Fe,Feo,Fe2o3,Fe3o4,cu,cuso4,cuo,cu(oh)2分别是什么颜色
 poouqfagdlz2022-10-04 11:39:541条回答
poouqfagdlz2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 zhenzm 共回答了21个问题
zhenzm 共回答了21个问题 |采纳率81%- 硫酸铜固体白色,液体蓝色,氧化铜黑色,氢氧化铜蓝色沉淀,铜是红色
- 1年前
相关推荐
- 能使反应:Cu+2H2O=Cu(OH)2+H2发生的是( )
能使反应:Cu+2H2O=Cu(OH)2+H2发生的是( )
A.铜片作阴、阳极,电解CuCl2
B.铁片作正极,Cu片作负极,CuCl2作电解质溶液的原电池
C.用铜片作阴、阳极,电解NaOH溶液
D.铜锌合金在潮湿空气中发生电化学腐蚀 杀1光支s那e猪t猡1年前1
杀1光支s那e猪t猡1年前1 -
 著名女mm 共回答了19个问题
著名女mm 共回答了19个问题 |采纳率89.5%解题思路:金属铜和水之间发生的反应是非自发的氧化还原反应,应设计成电解池,结合电解池的工作原理分析电极材料以及电解质溶液.金属铜和水之间发生的反应是非自发的氧化还原反应,应设计成电解池,在反应Cu+2H2O═Cu(OH)2↓+H2↑中,失电子的是金属铜,所以必须选择金属铜作阳极材料,其他导电的物质做阴极材料即可,在阴极上应该是水中的氢离子得电子的反应,可以选择硫酸钠等来做电解质.
A、用铜片作阴、阳电极,电解氯化铜溶液,阳极失电子生成铜离子,阴极铜离子得到电子析出铜,故A错误;
B、原电池原理不能实现该非自发的氧化还原反应,故B错误;
C、用铜片作阴、阳电极,电解氢氧化钠溶液,可以实现该反应的发生,故C正确;
D、铜锌合金在潮湿的空气中发生电化学腐蚀时,金属锌被腐蚀,铜被保护,故D错误;
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题是一道电解池工作原理知识的实验设计题,考查学生分析和解决问题的能力,难度中等.1年前查看全部
- Cu CuO CuCl2 Cu(OH)2 Cu(NO3)2的转化关系化学方程式?
 股海ee1年前0
股海ee1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 下列物质分类正确的是( )A.SO2能与碱反应生成盐和水,属于酸性氧化物B.Cu(OH)2难溶于水,属于非电解质C.N
下列物质分类正确的是( )
A.SO2能与碱反应生成盐和水,属于酸性氧化物
B.Cu(OH)2难溶于水,属于非电解质
C.NH4Cl组成中不含金属离子,不属于盐
D.HCl气体溶于水电离成H+和Cl-,属于离子化合物 lovewlq1231年前1
lovewlq1231年前1 -
 晓玉婵娟 共回答了17个问题
晓玉婵娟 共回答了17个问题 |采纳率88.2%解题思路:A、酸性氧化物是和碱反应生成盐和水的氧化物;
B、Cu(OH)2难溶于水,熔融状态能导电,属于电解质;
C、NH4Cl组成中不含金属离子,是铵根离子和氯离子构成的化合物属于盐;
D、氯化氢是共价化合物.A、酸性氧化物是和碱反应生成盐和水的氧化物,SO2能与碱反应生成盐和水,属于酸性氧化物,故A正确;
B、Cu(OH)2难溶于水,是碱,熔融状态能导电,属于电解质,故B错误;
C、NH4Cl组成中不含金属离子,是铵根离子和氯离子构成的化合物,符合盐的结构属于盐,故C错误;
D、氯化氢是共价化合物,HCl气体溶于水在水分子的作用下电离成H+和Cl-,故D错误;
故选A.点评:
本题考点: 酸、碱、盐、氧化物的概念及其相互联系.
考点点评: 本题考查了酸、碱、盐、氧化物概念的分析判断,主要是物质分类依据的掌握,掌握基础是关键,题目较简单.1年前查看全部
- 写出下列方程式NaOH→Cu(OH)2→CuSO4→CuCl2→MgCl2→Mg(NO3)2→KNO3按照剪头写!
 tianydream1年前1
tianydream1年前1 -
 书虫狂_aa 共回答了11个问题
书虫狂_aa 共回答了11个问题 |采纳率90.9%2NaOH+CuSO4→Cu(OH)2
Cu(OH)2+H2SO4→CuSO4
CuSO4+BaCl2→CuCl2
Mg+CuCl2→MgCl2
MgCl2+AgNO3→Mg(NO3)2
Mg(NO3)2+KOH→KNO3
除了第四个是置换反应外,其余都是复分解反应,请自己写出另一生成物并配平吧.相信你能作出来.1年前查看全部
- 乙酸与cu(oh)2反应
 紫鸽儿1年前1
紫鸽儿1年前1 -
 曰白諒湟 共回答了22个问题
曰白諒湟 共回答了22个问题 |采纳率100%生成醋酸铜和水1年前查看全部
- (2004•河南)现有Cu、Cu(OH)2、Fe2O3、BaCO3、AgNO3,溶液、盐酸,若各取少量两两混合,可以发生
(2004•河南)现有Cu、Cu(OH)2、Fe2O3、BaCO3、AgNO3,溶液、盐酸,若各取少量两两混合,可以发生的化学反应共有______个,其中有______个反应可以生成水,有______个反应属于置换反应.
 半_仙1年前1
半_仙1年前1 -
 花蕾04 共回答了20个问题
花蕾04 共回答了20个问题 |采纳率85%解题思路:根据金属和酸的化学性质,以及复分解反应的条件和金属活动性顺序及其应用等,结合题意采用从头连线的方法,即从Cu开始向后两两组合分析,能够发生反应的就将其连线,表示“牵手成功”,也就是能够反应的意思;然后,向后推移,依此类推;最后合计有几条线,就有几个反应.同时,还要关注能够化学反应的产物(是不是含有水)和反应类型等.根据金属和酸的化学性质,以及复分解反应的条件和金属活动性顺序及其应用等知识,常用连线的方法可得,从Cu开始向后两两组合分析,能够发生反应的(即连线的)有一个(即Cu与AgNO3溶液反应),且无水生成,但是属于...
点评:
本题考点: 书写化学方程式、文字表达式、电离方程式;金属活动性顺序及其应用;复分解反应的条件与实质;反应类型的判定.
考点点评: 本题主要考查了金属和酸的化学性质,以及复分解反应的条件和金属活动性顺序及其应用等知识.是一道比较难的综合题.解答时,常用这种连线的方法,根据所学的相关知识,进行分析推断和填写;并且一定要细心认真地进行分析和连线,切记不可丢三落四、顾此失彼.1年前查看全部
- 下列说法正确的是( )A. 醋酸纤维、橡胶、腈纶都属于合成高分子化合物B. 加新制的Cu(OH)2悬浊液并加热可检验尿
下列说法正确的是( )
A. 醋酸纤维、橡胶、腈纶都属于合成高分子化合物
B. 加新制的Cu(OH)2悬浊液并加热可检验尿液中的葡萄糖
C. 油脂在酸的催化作用下可发生水解,工业上利用该反应生产肥皂
D. 向蛋白质溶液中加入浓的Na2SO4或CuSO4溶液均可使蛋白质盐析而分离提纯 灵哲1年前1
灵哲1年前1 -
 vivian009900 共回答了20个问题
vivian009900 共回答了20个问题 |采纳率90%解题思路:A.橡胶有天然物质;
B.加入新制的Cu(OH)2悬浊液与尿液混合,加热后,若产生红色沉淀,说明含有醛基;
C.油脂在碱性条件下的水解是皂化反应;
D.硫酸铜是重金属盐.A.橡胶有天然物质,不是合成高分子化合物,故A错误;
B.加入新制的Cu(OH)2悬浊液与尿液混合,加热后,若产生红色沉淀,说明含有醛基,进而说明含有葡萄糖,故B正确;
C.油脂在碱性条件下的水解是皂化反应,酸性条件下水解生成高级脂肪酸,不是高级脂肪酸钠,故C错误;
D.硫酸铜是重金属盐,能使蛋白质发生变性,变性是不可逆过程,故D错误.
故选B.点评:
本题考点: 有机高分子化合物的结构和性质;油脂的性质、组成与结构;葡萄糖的性质和用途;氨基酸、蛋白质的结构和性质特点.
考点点评: 本题考查有机物的结构与性质,难度不大,注意把握葡萄糖的检验方法.1年前查看全部
- Cu2+ + 2H2O()Cu(OH)2 + 2H+ 这个方程式是等号还是可逆符号?
 lisa_zian1年前3
lisa_zian1年前3 -
 3366775 共回答了15个问题
3366775 共回答了15个问题 |采纳率93.3%可逆,是铜离子的水解,水解不是完全反应,是部分进行的.1年前查看全部
- 实验室中现有一种固体混合物,其中可能含有Cu(OH)2、NaOH、Na2CO3、Cu、BaCl2五种物质中的两种或多种.
实验室中现有一种固体混合物,其中可能含有Cu(OH)2、NaOH、Na2CO3、Cu、BaCl2五种物质中的两种或多种.按下图所示进行实验,出现的现象如图中所述.
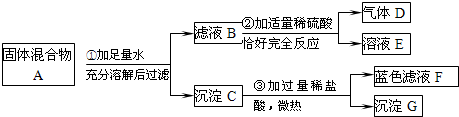
试根据实验过程和发生的现象判断:
(1)产生的气体D是(写化学式)______.
(2)混合物A中,一定不存在的物质是(写化学式)______.
(3)滤液F中一定存在的阳离子是(写化学式)______.
(4)写出过程②中发生的一个化学反应的化学方程式:______. 紫_砂1年前1
紫_砂1年前1 -
 清风无语男人 共回答了24个问题
清风无语男人 共回答了24个问题 |采纳率100%解题思路:固体混合物加入水后得到沉淀C,向C中加入稀盐酸后生成蓝色溶液,说明在沉淀中有氢氧化铜,但是仍有沉淀G,从所给的物质可以判断出该沉淀应该为铜;对于滤液B加入稀硫酸后生成了气体,说明存在着碳酸钠,同时可以排除氯化钡的存在,可以据此答题.(1)向滤液B中加入稀硫酸后生成了气体D,根据所给的物质能够和硫酸反应生成沉淀的只有碳酸钠,所以可以判断气体D是二氧化碳,故本题答案为:CO2
(2)向滤液C中加入过量的稀盐酸,得到但是蓝色溶液和不溶物,所以可以判断该沉淀不含碳酸钡,结合(1)的解答可以判断在混合物中不含氯化钡,故本题答案为:BaCl2
(3)蓝色溶液是铜盐的溶液,故在溶液中含有铜离子,同时由于加入的是过量的盐酸,所以在溶液中还存在着氢离子,故本题答案为:H+和Cu2+
(4)我们已经判断出在滤液B中存在着碳酸钠,所以过程②是硫酸和碳酸钠的反应,故本题答案为:Na2CO3+H2SO4═Na2SO4+CO2↑+H2O点评:
本题考点: 物质的鉴别、推断.
考点点评: 掌握物质的推断方法:在找准突破口的前提下根据图框顺藤摸瓜逐一推断,推测完后代入题目中验证并能够自圆其说即可;根据题目中的信息,正确书写化学方程式.1年前查看全部
- 已知:常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为
已知:常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol•L-1时就认为沉淀完全,已知某溶液中含有Fe3+、Cu2+和SO42-,设溶液中Cu2+的物质的量浓度为3.0mol•L-1,则Cu(OH)2开始沉淀时溶液的pH为______,完全沉淀时溶液的pH为______,通过计算确定pH=4时,Fe3+残存的浓度是:______.(请写出计算过程lg3=0.48)
 0119122221年前1
0119122221年前1 -
 hanxinchu 共回答了21个问题
hanxinchu 共回答了21个问题 |采纳率85.7%解题思路:依据氢氧化铜饱和溶液中溶度积常数计算氢氧化铜开始沉淀溶液中的氢离子浓度计算,依据完全沉淀得到c(Cu2+)1×10-5 mol•L-1,计算c(OH-),然后计算c(H+),再计算pH即可,依据此pH=4,计算氢氧根的浓度,利用Fe(OH)3的溶度积Ksp=8.0×10-38计算残留铁离子的浓度.Cu(OH)2的溶度积Ksp=3.0×10-20,溶液中CuSO4的浓度为3.0mol•L-1,c(Cu2+)=3.0mol•L-1;
依据溶度积常数c(Cu2+)×c2(OH-)=
3×10−20
3.0=3.0×10-20 ;c2(OH-)=
3×10−20
3.0=10-20;
得到c(OH-)=10-10mol/L,
依据水溶液中的离子积c(H+)×c(OH-)=10-14;c(H+)=10-4mol/L,溶液pH=4,
则Cu(OH)2开始沉淀时溶液的pH为4;
残留在溶液中的离子浓度小于1×10-5 mol•L-1时就认为沉淀完全,Cu(OH)2的溶度积Ksp=3.0×10-20,c(Cu2+)×c2(OH-)=3.0×10-20;c2(OH-)=
3×10−20
1×10−5=3.0×10-15;
求得c(OH-)=5.47×10-8mol/L;
水溶液中的离子积c(H+)×c(OH-)=10-14,c(H+)=1.83×10-7mol/L,
则pH=6.7;
常温下Fe(OH)3的溶度积Ksp=8.0×10-38,c(Fe3+)×c3(OH-)=8.0×10-38,c(Fe3+)=
8.0×10−38
(1×10−10)3mol/L=8×10-8mol/L,
故答案为:4;6.7;8×10-8mol/L.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题主要考查的是溶解沉淀的转化关系的分析应用以及pH的有关计算,题目难度中等.1年前查看全部
- (2013•青岛二模)已知:Cu(OH)2是二元弱碱;亚磷酸(H3PO3)是二元弱酸,与NaOH溶液反应,生成Na2HP
 (2013•青岛二模)已知:Cu(OH)2是二元弱碱;亚磷酸(H3PO3)是二元弱酸,与NaOH溶液反应,生成Na2HPO3.
(2013•青岛二模)已知:Cu(OH)2是二元弱碱;亚磷酸(H3PO3)是二元弱酸,与NaOH溶液反应,生成Na2HPO3.
(1)在铜盐溶液中Cu2+发生水解反应的离子方程式为______,该反应的平衡常数为______;(已知:25℃时,Ksp[Cu(OH)2]=2.0×10-20mol3•L-3)
(2)根据H3PO3的性质可推测Na2HPO3稀溶液的pH______7(填“>”“<”或“=”).常温下,向10mL0.01mol•L-1H3PO3溶液中滴加10ml 0.02mol•L-1NaOH溶液后,溶液中各种离子浓度由大到小的顺序是______;
(3)电解Na2HPO3溶液可得到亚磷酸,装置如图(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过)
①阳极的电极反应式为______.
②产品室中反应的离子方程式为______. qq宾1年前1
qq宾1年前1 -
 fangxm007 共回答了16个问题
fangxm007 共回答了16个问题 |采纳率93.8%解题思路:(1)铜离子水解生成氢氧化铜和氢离子,依据沉淀溶度积常数和溶液中离子积常数计算;
(2)根据H3PO3的酸性强弱确定Na2HPO3溶液的酸碱性;氢氧化钠滴入到磷酸反应按照1:2反应依据反应产物判断离子浓度大小;
(3)阳极上是氢氧根离子失电子发生氧化反应;
②产品室中HPO32-和氢离子结合 生成亚磷酸.(1)铜离子水解离子反应为Cu2++2H2O⇌Cu(OH)2+2H+,Ksp=c(Cu2+)×c2(OH-)=2.0×10-20mol3•L-3,则K=
c2(H+)
c(Cu2+)=
c2(H+)×c2(OH−)
c(Cu2+)×c2(OH−)=
Kw2
Ksp=
(10−14)2
2.0×10−20=5×10-9,
故答案为:Cu2++2H2O⇌Cu(OH)2+2H+;5×10-9;
(2)H3PO3是弱酸,Na2HPO3是强碱弱酸盐,所以其水溶液呈碱性,即pH>7,向10mL0.01mol•L-1H3PO3溶液中滴加10ml 0.02mol•L-1NaOH溶液后,反应生成Na2HPO3,溶液水解显碱性,溶液中离子浓度大小为:c(Na+)>c(HPO32-)>c(OH-)>c(H2PO3-)>c(H+),故答案为:>;c(Na+)>c(HPO32-)>c(OH-)>c(H2PO3-)>c(H+);
(3))①阳极上氢氧根离子失电子发生氧化反应,电极反应式为4OH--4e-=2H2O+O2↑,故答案为:4OH--4e-=2H2O+O2↑;
②产品室中HPO32-和氢离子结合生成亚磷酸,反应离子方程式为:HPO32-+2H+=H3PO3,故答案为:HPO32-+2H+=H3PO3.点评:
本题考点: 盐类水解的应用;化学电源新型电池;离子浓度大小的比较.
考点点评: 本题涉及水解反应、氧化还原反应、离子浓度大小比较,电极反应式的书写等知识点,电极反应式的书写、有关平衡常数的计算是高考热点,应重点掌握.1年前查看全部
- (2014•九江三模)已知常温下,Cu(OH)2的溶度积常数为Ksp=2×10-20.又知常温下某CuSO4溶液里Cu2
(2014•九江三模)已知常温下,Cu(OH)2的溶度积常数为Ksp=2×10-20.又知常温下某CuSO4溶液里Cu2+浓度为0.02mol•L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于______.
 常疯1年前1
常疯1年前1 -
 Vinica 共回答了16个问题
Vinica 共回答了16个问题 |采纳率75%解题思路:根据Ksp=c(Cu2+)•[c(OH-)]2=2×10-20,根据Cu2+离子的浓度计算OH-离子的浓度,根据水的离子积常数计算氢离子浓度,并以此计算溶液pH值.某CuSO4溶液里c(Cu2+)=0.02mol/L,如果生成Cu(OH)2沉淀,则应有c(OH-)≥
2×10−20
0.02mol/L=10-9mol/L,则c(H+)≤
1×10−14
10−9mol/L=10-5mol/L,所以pH≥-lg(10-5)=5,即应调整溶液pH大于5;
故答案为:5.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查了Ksp的有关计算、pH的计算,侧重于公式的应用的考查,题目难度不大,考查了学生解决问题的能力和计算能力.1年前查看全部
- (2011•南平二模)某温度下,将Fe(OH)3(s)、Cu(OH)2(s) 分别置于蒸馏水中达到沉淀溶解平衡
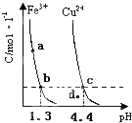 (2011•南平二模)某温度下,将Fe(OH)3(s)、Cu(OH)2(s) 分别置于蒸馏水中达到沉淀溶解平衡后,金属阳
(2011•南平二模)某温度下,将Fe(OH)3(s)、Cu(OH)2(s) 分别置于蒸馏水中达到沉淀溶解平衡后,金属阳
离子浓度随溶液pH的变化如图所示.下列判断正确的是( )
A.加适量浓NH3•H2O可使溶液由a点变到b点
B.c、d两点代表的溶液中c(H+)与c(OH-)乘积不相等
C.Cu(OH)2在c点比在d点代表的溶液中溶解程度小
D.该温度下,氢氧化铁的Ksp[Fe(OH)5大于氢氧化铜的Ksp[Cu(OH)2] 苦涩的小草1年前1
苦涩的小草1年前1 -
 kafeiggw9 共回答了21个问题
kafeiggw9 共回答了21个问题 |采纳率95.2%解题思路:A.由a点变到b点,pH增大;
B.Kw只与温度有关,与溶液的酸碱性无关;
C.注意分析处在曲线上的点与曲线外的点有什么区别;
D.根据图象找出可用来比较Fe(OH)3与Cu(OH)2溶度积常数点,可用b、c进行计算.A.向溶液中加入氨水,溶液的pH增大,则铁离子浓度降低,所以可以由a点变到b点,故A正确;
B.只要温度不发生改变,溶液中c(H+)与c(OH-)的乘积(即Kw)就不变.该题中温度条件不变,故c、d两点代表的溶液中c(H+)与c(OH-)的乘积相等,故B错误;
C.在C点表示饱和溶液,在d点表示不饱和溶液,所以Cu(OH)2在c点比在d点代表的溶液中溶解程度大,故C错误;
D.由b、c两点对应数据可比较出KSP[Fe(OH)3]与KSP[Cu(OH)2]的大小,KSP[Fe(OH)3]=c(Fe3+)•(OH-)3=c(Fe3+)•(10-12.7)3,KSP[Cu(OH)2]=c(Cu2+)•(OH-)2=c(Cu2+)•(10-9.6)2,因c(Fe3+)=c(Cu2+),故KSP[Fe(OH)3]<KSP[Cu(OH)2],故D错误;
故选A.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查沉淀溶解平衡、溶度积、pH、水的离子积等知识点,对图象中的数据进行定量或定性处理,找出数据(或坐标点)之间存在的相互关系;明确坐标点所表达的涵义;对溶度积和水的离子积有正确的理解.1年前查看全部
- 为什么CU离子是绿或蓝色?我见过的好象都只有生成蓝色的啊.比如CU(OH)2,CUSO4等.
 contr1231年前1
contr1231年前1 -
 公元20060606 共回答了27个问题
公元20060606 共回答了27个问题 |采纳率92.6%铜离子在水溶液中以四水合铜(IV)离子形式存在,铜离子电子构型是3d(9),四水合铜离子形成的是四配位正方形晶体场,电子跃迁后返回基态释放的光波长位于蓝光波段,所以显示蓝色
而在氯化铜溶液中,铜离子部分以四水合铜(IV)离子存在,部分以四氯合铜(IV)离子形式存在,由于氯离子是一个和水强度不同的配体,所以四氯合铜(IV)离子的中心铜离子d电子跃迁之后返回基态释放的光波长位于黄光波段,所以是黄色的.因此氯化铜显示的是蓝色和黄色的混合色绿色
如果将氯化铜溶于浓盐酸,就显示四氯合铜(IV)离子的黄色1年前查看全部
- 高一离子反应方程式①____+3H+=Fe3++____②Cu2++SO42-+____=Cu(OH)2↓+____③C
高一离子反应方程式
①____+3H+=Fe3++____
②Cu2++SO42-+____=Cu(OH)2↓+____
③CO2+____=CO32-+____
④HCO3-+____=CO32-+_____ 恶心的显示屏1年前2
恶心的显示屏1年前2 -
 cb_chanel 共回答了20个问题
cb_chanel 共回答了20个问题 |采纳率100%①Fe2O3+3H+ = Fe3+ +3H2O
②Cu2+ 2OH- + SO42- + Ba2+ =Cu(OH)2↓+BaSO4↓
此题正确答案如上,硫酸根和铜离子参加离子反应
必有沉淀生成
③CO2 +2OH-= CO32- + H2O
④HCO3- + OH- = CO32- + H2O1年前查看全部
- 铜及其重要化合物cu→cuo cuo→cuso4 cuso4→cu(OH)2 cu(OH)2→cuo cuso4→cu
铜及其重要化合物
cu→cuo cuo→cuso4 cuso4→cu(OH)2 cu(OH)2→cuo cuso4→cu 写出每个的反应方程式 hbswsik1年前3
hbswsik1年前3 -
 zhongliang0703 共回答了11个问题
zhongliang0703 共回答了11个问题 |采纳率81.8%2 Cu + O2 ==△== 2 CuO
CuO + H2SO4 = CuSO4 + H2O
CuSO4 + 2 NaOH = Cu(OH)2 + Na2SO4
Cu(OH)2 ==△== CuO + H2O
CuSO4 + Fe = Cu + FeSO4
注意条件!1年前查看全部
- 已知氢为+1价,氧为-2价,标出其它元素的化合价FeO、Fe2O3、CuO、Cu(OH)2、RO、XOH、H2SO4、H
已知氢为+1价,氧为-2价,标出其它元素的化合价FeO、Fe2O3、CuO、Cu(OH)2、RO、XOH、H2SO4、HClO4.
 阳山客1年前1
阳山客1年前1 -
 super虫 共回答了19个问题
super虫 共回答了19个问题 |采纳率84.2%解题思路:根据在化合物中正负化合价代数和为零计算指定元素化合价.
根据元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,进行解答.根据在化合物中正负化合价代数和为零,氢为+1价,氧为-2价可得:
FeO中Fe元素的化合价为+2;Fe2O3中Fe元素的化合价为+3;CuO中Cu元素的化合价为+2;Cu(OH)2中Cu元素的化合价为+2;RO中R元素的化合价为+2;XOH中X元素的化合价为+1;H2SO4 中S元素的化合价为+6;HClO4 中Cl元素的化合价为+7.
故答案为:
+2
FeO;
+3
Fe2O3;
+2
CuO;
+2
Cu(OH)2;
+2
RO;
+1
XOH; H2
+6
SO4 ;H
+7
ClO4 .点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题考查学生对计算化合价及元素化合价的表示方法的理解与掌握,并能在解题中灵活应用的能力.1年前查看全部
- 写出下列转化的化学方程式:CuCl2→Cu→CuO→CuSO4→Cu(OH)2→CuCl2①Fe+CuCl2=Cu+Fe
写出下列转化的化学方程式:CuCl2→Cu→CuO→CuSO4→Cu(OH)2→CuCl2①Fe+CuCl2=Cu+FeCl2;②2Cu+O2
2CuO;③CuO+H2SO4=CuSO4+H2O;④CuSO4+2NaOH=Cu(OH)2↓+Na2SO4;⑤Cu(OH)2+2HCl=CuCl2+2H2O△ .①Fe+CuCl2=Cu+FeCl2;②2Cu+O2.
2CuO;③CuO+H2SO4=CuSO4+H2O;④CuSO4+2NaOH=Cu(OH)2↓+Na2SO4;⑤Cu(OH)2+2HCl=CuCl2+2H2O△ . rui7512251年前1
rui7512251年前1 -
 雅舍林 共回答了16个问题
雅舍林 共回答了16个问题 |采纳率93.8%解题思路:根据CuCl2、Cu、CuO、CuSO4、Cu(OH)2、CuCl2的化学性质先判断物质转化利用的反应,再根据方程式的书写原则和方法写出相应的化学方程式.氯化铜是一种盐,要得到铜单质,可利用金属与盐的置换反应,如铁与氯化铜反应生成铜和氯化亚铁,方程式为Fe+CuCl2=Cu+FeCl2;铜能与氧气在加热的条件下反应生成氧化铜,方程式为2Cu+O2
△
.
2CuO;氧化铜是金属氧化物,如想得到盐类物质,得与酸反应,故反应为氧化铜和稀硫酸反应生成硫酸铜和水,方程式为CuO+H2SO4=CuSO4+H2O;硫酸铜要生成氢氧化铜必须与碱反应,盐与碱反应时,要求反应物都可溶,生成物中有沉淀或气体或水生成,故可让硫酸铜与氢氧化钠反应生成氢氧化铜沉淀和硫酸钠,方程式为CuSO4+2NaOH=Cu(OH)2↓+Na2SO4;由氢氧化铜得氯化铜,根据碱的性质,应和酸反应,可选择盐酸,氢氧化铜与稀盐酸反应生成氯化铜和水,方程式为Cu(OH)2+2HCl=CuCl2+2H2O.
故答案为:①Fe+CuCl2=Cu+FeCl2;②2Cu+O2
△
.
2CuO;③CuO+H2SO4=CuSO4+H2O;④CuSO4+2NaOH=Cu(OH)2↓+Na2SO4;⑤Cu(OH)2+2HCl=CuCl2+2H2O.点评:
本题考点: 常用盐的用途;金属的化学性质;物质的相互转化和制备;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查物质的性质及化学方程式的书写方法,掌握相关物质的性质,了解反应发生的条件,掌握方程式的书写方法,是解题的前提条件.1年前查看全部
- 师大附中某化学研究性学习小组为探究Cu(OH)2受热分解产物及产物性质,设计如下实验过程:
师大附中某化学研究性学习小组为探究Cu(OH)2受热分解产物及产物性质,设计如下实验过程:
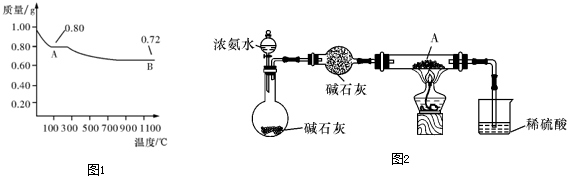
(1)取0.98gCu(OH)2固体加热,有铜的氧化物生成,其质量随温度变化如图1所示.产物A、B的化学式分别为______
和Cu2O;通过该实验可知,主温时______更稳定(用A或B的化学式表示)
(2)为探究产物A能否被NH3还原,设计如图2实验装置(夹持及尾气处理装置未画出),实验中观察到A变成红色物质,同时生成一种无污染的气体,该气体的化学式为______.小明认为应该在装A物质的试管与烧杯之间增加一个防倒吸装置,你认为是否有必要______(填“有”或“没有”),原因是______.
(3)取少量产物B加入足量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在,该反应的离子方程式为______. xzy13821年前1
xzy13821年前1 -
 秋月QT 共回答了15个问题
秋月QT 共回答了15个问题 |采纳率93.3%解题思路:(1)依据氢氧化铜质量换算物质的量0.01mol,结合图象分析判断生成的产物;
(2)氧化铜和氨气加热反应生成红色物质为铜,无污染气体为氮气;弱有剩余的氨气易引起倒吸;
(3)依据分析判断D为Cu2O在酸中 反应生成蓝色溶液为硫酸铜,红色固体为铜,依据元素化合价变化分析写出.(1)0.98gCu(OH)2固体物质的量为:0.01mol,依据分解图象分析判断,100°C时氢氧化铁分解产物为0.8g,高温1100°C得到B为0.72g,根据氢氧化铁分解生成氧化铜和水判断,Cu(OH)2=CuO+H2O;氧化铜摩尔质量为80g/mol,所以推断A为CuO,B为Cu2O,依据温度图象可知Cu2O比CuO稳定,
故答案为:CuO;Cu2O;
(2)探究产物ACuO能否被NH3还原,依据元素化合价可知,铜在最高价具有氧化性,氨气中氮元素化合价在最低价-3价具有还原性,能发生氧化还原反应,实验中观察到A变成红色物质判断为Cu,同时生成一种无污染的气体判断为N2,在装A物质的试管与烧杯之间增加一个防倒吸装置可以防止过量氨气通入水中引起倒吸,
故答案为:N2;有;氨气极易溶于水,氨气有剩余可以引起倒吸;
(3)产物B为Cu2O加入足量的稀硫酸,得到蓝色溶液推断为硫酸铜溶液,同时观察到容器中还有红色固体存在说明生成Cu,所以反应的离子方程式为Cu20+2H+=Cu2++Cu+H2O,
故答案为:Cu20+2H+=Cu2++Cu+H2O.点评:
本题考点: 性质实验方案的设计.
考点点评: 本题考查了物质性质验证的实验方法、现象分析、产物判断,物质元素化合价的变化是分析判断的关键,题目难度中等.1年前查看全部
- 设置原电池…追加~急急急……原电池总反应方程式:NaOH+Cu+AgNO3===Cu(OH)2+Ag+NaNO3应该如何
设置原电池…追加~
急急急……原电池总反应方程式:NaOH+Cu+AgNO3===Cu(OH)2+Ag+NaNO3
应该如何设置? ailulu08061年前1
ailulu08061年前1 -
 sony112233 共回答了18个问题
sony112233 共回答了18个问题 |采纳率83.3%负极Cu,正极碳棒.两个池,负极池里放NaOH,正极池放AgNO3,中间用NaNO3盐桥连起来1年前查看全部
- 已知难溶于水的碱受热易分解,如:Cu(OH)2 △ . CuO+H
已知难溶于水的碱受热易分解,如:Cu(OH)2
CuO+H2O.A、B、C、D、E 五种物质之间存在如图所示的转化关系:△ .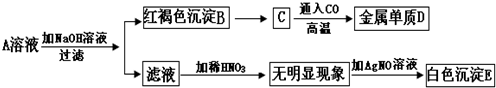
请填写下列空白:
(1)写出下列物质的化学式:A______;B______;E______.
(2)由A转化为B的化学方程式为______.
(3)有C转化为D的化学方程式为Fe2O3+3CO
2Fe+3CO2高温 .Fe2O3+3CO.
2Fe+3CO2高温 . yll8845891年前1
yll8845891年前1 -
 fallwind1113 共回答了24个问题
fallwind1113 共回答了24个问题 |采纳率75%解题思路:红褐色沉淀B为氢氧化铁,白色沉淀E为酸化后的溶液与硝酸银反应生成的沉淀,因此沉淀E为不溶于酸的沉淀,可推断为氯化银,结合反应框图可知,A溶液中含Cl-;而A与NaOH反应Fe(OH)3红褐色沉淀,所以A溶液中含有Fe3+;综上所述,物质A为氯化铁溶液;
据此,可根据反应框图完成对其它物质的推断.(1)根据不溶性碱可受热分解的性质,由物质C为不溶性碱氢氧化铁加热后的产生,可推断C为氧化铁;氧化铁与CO在高温条件下能生成金属单质铁和二氧化碳,则物质D为铁;因此,物质A为氯化铁,B为氢氧化铁,C为氧化铁,D为铁,E为氯化银;
故A、FeCl3;B、Fe(OH)3;AgCl;
(2)A→B的反应是氯化铁和氢氧化钠的反应产物是氢氧化铁和氯化钠,方程式为:FeCl3+3NaOH═Fe(OH)3↓+3NaCl;
(3)由C转化为D为高温下CO还原氧化铁,生成铁和二氧化碳,Fe2O3+3CO
高温
.
2Fe+3CO2.
故答案为(1)A、FeCl3;B、Fe(OH)3;E、AgCl;(2)FeCl3+3NaOH═Fe(OH)3↓+3NaCl;(3)Fe2O3+3CO
高温
.
2Fe+3CO2点评:
本题考点: 物质的鉴别、推断;化学式的书写及意义;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题属于物质的推断题,根据特殊的现象或特殊的反应或特殊的物质颜色,找到推断类题的解决突破口,是解决此类问题的主要手段.1年前查看全部
- 写出下列反应的化学反应式? NaOH 和CuSO4 溶液反应产生[Cu(OH)2]沉淀生成Na2SO4 白磷生
写出下列反应的化学反应式? NaOH 和CuSO4 溶液反应产生[Cu(OH)2]沉淀生成Na2SO4 白磷生
(P2O5)
白磷在空气中燃烧生成五氧化二磷 polarbear5011年前1
polarbear5011年前1 -
 wurui927 共回答了19个问题
wurui927 共回答了19个问题 |采纳率100%2NaOH + CuSO4 = Cu(OH)2 + Na2SO4
点燃
4P + 5O2 = 2P2O51年前查看全部
- 在课堂上,老师演示了金属Na与CuSO4溶液反应的实验,同学们观察到该反应中生成了蓝色的Cu(OH)2沉淀而没有发现Cu
在课堂上,老师演示了金属Na与CuSO4溶液反应的实验,同学们观察到该反应中生成了蓝色的Cu(OH)2沉淀而没有发现Cu单质生成.但某同学心中在想,会不会是因为生成的Cu较少而被蓝色沉淀所覆盖从而没有被发现呢?于是想课后到实验室继续研究,希望进一步用实验来验证自己的猜想是否正确.
假如该同学是你,请你写一份实验准备单交给老师,要求老师提供必需的用品.
(1)实验探究的目的:______.
(2)探究所依据的化学原理:______.
(3)实验必需的用品:小刀、玻璃片、滤纸、______和______;金属Na、______和______.
该同学在探究实验中意外地发现生成的蓝色的沉淀中混有少量的黑色沉淀,而所使用的药品均没有问题.你认为该黑色难溶物是______,生成该黑色难溶物的原因是______. 木_夕1年前1
木_夕1年前1 -
 astrohobo 共回答了23个问题
astrohobo 共回答了23个问题 |采纳率87%解题思路:(1)学生怀疑Na也与硫酸铜发生了置换反应生成铜单质,因而他探究的实验目的是验证钠与硫酸铜溶液反应是否生成铜;
(2)当钠不与硫酸铜发生置换反应时,沉淀只有氢氧化铜,当钠与硫酸铜发生置换反应时,沉淀中既有氢氧化铜液有铜,依据氢氧化铜可溶于盐酸而铜不溶,只是加入过量的盐酸观察沉淀是否全部溶解即可;
(3)实验需要首先完成Na与硫酸铜溶液反应,然后再进行沉淀与盐酸的反应,完成钠与硫酸铜溶液的反应,需要的试剂是钠和硫酸铜溶液,还需要的用品是镊子、烧杯;完成沉淀与盐酸的反应,需要试剂是稀盐酸或稀硫酸,不再需要其他用品;钠与水反应放出热量,氢氧化铜受热分解,所以实验中意外发现的黑色沉淀是氧化铜.(1)老师演示了金属Na与CuSO4溶液反应的实验,同学们观察到该反应中生成了蓝色的Cu(OH)2沉淀而没有发现Cu单质生成.但某同学心中在想,会不会是因为生成的Cu较少而被蓝色沉淀所覆盖从而没有被发现呢,学生怀疑Na也与硫酸铜发生了置换反应生成铜单质,因而他探究的实验目的是验证钠与硫酸铜溶液反应是否生成铜;
故答案为:验证钠与硫酸铜溶液反应是否有铜生成;
(2)探究所依据的化学原理是,当钠不与硫酸铜发生置换反应时,沉淀只有氢氧化铜,当钠与硫酸铜发生置换反应时,沉淀中既有氢氧化铜液有铜,氢氧化铜可溶于盐酸而铜不溶,加入过量的盐酸观察沉淀是否全部溶解,若全部溶解说明无铜生成,若仍有沉淀说明有铜生成;
故答案为:氢氧化铜可溶于盐酸而铜不溶;
(3)实验需要首先完成Na与硫酸铜溶液反应,然后再进行沉淀与盐酸的反应,完成钠与硫酸铜溶液的反应,需要的试剂是钠和硫酸铜溶液,需要的用品:小刀、玻璃片、滤纸,还需要的用品是镊子、烧杯;完成沉淀与盐酸的反应,需要试剂是稀盐酸或稀硫酸,不再需要其他用品;钠与水反应放出热量,氢氧化铜受热分解,所以实验中意外发现的黑色沉淀是氧化铜;
故答案为:镊子;烧杯;硫酸铜溶液;稀盐酸或稀硫酸;CuO;钠与水反应放出热量使氢氧化铜受热部分分解.点评:
本题考点: 碱金属及其化合物的性质实验.
考点点评: 本题考查了钠性质的分析,主要是钠和盐反应产物的分析判断和实验设计验证,掌握物质性质和实验探究式解题关键,题目难度中等.1年前查看全部
- 观察法:先金属后原子团(1)CuSO4+NaOH═Na2SO4+Cu(OH)2(2)Mg+HCl═MgCl2+H2↑(3
观察法:先金属后原子团(1)CuSO4+NaOH═Na2SO4+Cu(OH)2(2)Mg+HCl═MgCl2+H2↑(3)Fe2O3+H2SO4═Fe
观察法:先金属后原子团
(1)CuSO4+NaOH═Na2SO4+Cu(OH)2
(2)Mg+HCl═MgCl2+H2↑
(3)Fe2O3+H2SO4═Fe2(SO4)3+H2O
(4)Al+H2SO4═Al2(SO4)3+H2↑
(5)Fe(OH)3+H2SO4═Fe2(SO4)3+H2O
(6)Al2(SO4)3+NaOH═Na2SO4+Al(OH)3.
 今天下了小雨1年前1
今天下了小雨1年前1 -
 465171488 共回答了17个问题
465171488 共回答了17个问题 |采纳率100%配平化学方程式关键是保证等号两边各原子的数目相等,用最小公倍数法再结合观察法即可一一配平(观察法:先金属后原子团)
(1)本题可利用“定一法”进行配平,把Cu(OH)2的化学计量数定为1,则CuSO4、NaOH、Na2SO4前面的化学计量数分别为:1、2、1,故化学方程式为CuSO4+2NaOH═Na2SO4+Cu(OH)2;.
(2)利用观察法,则可配平化学方程式,Mg+2HCl═MgCl2+H2↑.
(3)此为复分解反应,利用其特点“内项结合,外项结合”,结合化合价书写化学式,利用观察法书写配平化学方程式Fe2O3+3H2SO4═Fe2(SO4)3+3H2O,;
(4)2Al+3H2SO4═Al2(SO4)3+3H2↑;等号前1个SO42-,一个Al,等号后有3个SO42-,2个Al,所以在Al 前配2,在H2SO4前配3,再观察可知H2前配3即可,故答案为:2Al+3H2SO4=Al2(SO4)+3H2↑
(5)此为复分解反应,利用其特点“内项结合,外项结合”,结合化合价书写化学式,利用观察法书写配平化学方程式2Fe(OH)3+3H2SO4═Fe2(SO4)3+6H2O,;
(6)此为复分解反应,利用其特点“内项结合,外项结合”,结合化合价书写化学式,利用观察法书写配平化学方程式Al2(SO4)3+6NaOH═3Na2SO4+2Al(OH)3.
故答案为:
(1)CuSO4+2NaOH═Na2SO4+Cu(OH)2;(2)Mg+2HCl═MgCl2+H2↑,
(3)Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;(4)2Al+3H2SO4═Al2(SO4)3+3H2↑;
(5)2Fe(OH)3+3H2SO4═Fe2(SO4)3+6H2O;
(6)Al2(SO4)3+6NaOH═3Na2SO4+2Al(OH)3.1年前查看全部
- 有下列物质:①Fe ②CO2 ③Na2O ④Cu(OH)2 ⑤MgCl2⑥NH4Cl ⑦H2SO4 ⑧C2H5OH(酒精
有下列物质:①Fe ②CO2 ③Na2O ④Cu(OH)2 ⑤MgCl2⑥NH4Cl ⑦H2SO4 ⑧C2H5OH(酒精)(用序号作答).
按组成进行分类,酸有______,碱有______,盐有______.上述八种物质中,其中属于电解质的有______,属于非电解质的有______. 若若心酸1年前1
若若心酸1年前1 -
 Qilum 共回答了22个问题
Qilum 共回答了22个问题 |采纳率90.9%解题思路:根据酸碱盐、电解质、非电解质的定义进行判断,酸是指电离出的阳离子全部是氢离子的化合物,碱是指电离出的阴离子全部是氢氧根离子的化合物,盐是指能电离出金属离子(或铵根离子)和酸根离子的化合物,在溶于水或熔融状态下能导电的化合物是电解质,在溶于水和熔融状态下都不能导电的化合物是非电解质.酸是指电离出的阳离子全部是氢离子的化合物,故⑦H2SO4符合;碱是指电离出的阴离子全部是氢氧根离子的化合物,故④Cu(OH)2符合;
盐是指能电离出金属离子(或铵根离子)和酸根离子的化合物,故⑤MgCl2⑥NH4Cl符合;在溶于水或熔融状态下能导电的化合物是电解质,③Na2O ④Cu(OH)2 ⑤MgCl2⑥NH4Cl ⑦H2SO4符合;在溶于水和熔融状态下都不能导电的化合物是非电解质,②CO2 ⑧C2H5OH(酒精)符合,
故答案为:⑦;④;⑤⑥; ③④⑤⑥⑦;②⑧.点评:
本题考点: 酸、碱、盐、氧化物的概念及其相互联系;电解质与非电解质.
考点点评: 本题考查了物质的分类问题,需根据酸、碱、盐、电解质、非电解质的定义及分类依据进行判断,难度不大.1年前查看全部
- 实验室里有H2O、O2、Mg、稀盐酸、Cu(OH)2五种物质,请你以它们为反应物,按要求各写出一个化学方程式.
实验室里有H2O、O2、Mg、稀盐酸、Cu(OH)2五种物质,请你以它们为反应物,按要求各写出一个化学方程式.
化合反应、分解反应、置换反应、中和反应 wakeup1年前1
wakeup1年前1 -
 pvoisadofipaosdi 共回答了22个问题
pvoisadofipaosdi 共回答了22个问题 |采纳率95.5%化合反应:2Mg+O2=点燃=2MgO
分解反应:2H2O=通电=2H2↑+O2↑
置换反应:Mg+2HCl=MgCl2+H2↑
中和反应:Cu(OH)2+2HCl=CaCl2+2H2O1年前查看全部
- 根据化学反应方程式:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4,请回答下列问题:
根据化学反应方程式:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4,请回答下列问题:
(1)该反应所属的基本反应类型是______;
(2)若上述两种溶液恰好完全反应,反应后的溶液中除水之外,还含有的物质是______;
(3)反应后溶液的总质量比反应前溶液的总质量______. 花烛1年前1
花烛1年前1 -
 songlill217 共回答了16个问题
songlill217 共回答了16个问题 |采纳率87.5%解题思路:(1)从基本反应的类型及特点分析;
(2)从化学方程式上判断;
(3)从化学方程式上判断.(1)从化学反应方程式:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4看,此反应是两种化合物相互交换成分生成另外两种化合物,是复分解反应.故答案为:复分解反应
(2)从化学反应方程式:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4看,反应后的溶液中除了原溶液中的水外,只有硫酸钠,因为氢氧化铜是沉淀,不是溶液的一部分.故答案为:硫酸钠
(3)从化学反应方程式:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4看,生成物氢氧化铜是沉淀,不是溶液的一部分,故反应后溶液的总质量比反应前溶液的总质量小.故答案为:小点评:
本题考点: 反应类型的判定;质量守恒定律及其应用.
考点点评: 本题考查化学反应的类型和化学方程式以及溶液的有关知识,难度较小,注意不溶物不是溶液的一部分.1年前查看全部
- 新制Cu(OH)2 悬浊液怎么鉴别 乙醇 乙醛 甲醛 乙酸
新制cu(oh)2 悬浊液怎么鉴别 乙醇 乙醛 甲醛 乙酸
***和碳酸钠反应吗
乙酸乙酯为什么不是既能被氧化又能被还原 455h1年前1
455h1年前1 -
 jincancan7 共回答了17个问题
jincancan7 共回答了17个问题 |采纳率88.2%与乙醇混溶,蓝色悬浊液
与乙醛反应生成砖红色沉淀
与甲醛反应生成砖红色沉淀和气体
与乙酸反应,悬浊液变澄清,蓝色溶液1年前查看全部
- 多羟基醇和新制Cu(OH)2反应,为什么配置Cu(OH)2是酸性的
 liulaotou1年前1
liulaotou1年前1 -
 enthusiasm999 共回答了21个问题
enthusiasm999 共回答了21个问题 |采纳率100%醛基和新制Cu(OH)2反应
多羟基醇如果没有醛基和新制Cu(OH)2不反应
配置Cu(OH)2应该是碱性的1年前查看全部
- 2、已知Cu(OH)2沉淀在一定条件下可以溶解在氨水中,有关反应的化学方程式为:Cu(OH)2+4NH3?H2O [Cu
2、已知Cu(OH)2沉淀在一定条件下可以溶解在氨水中,有关反应的化学方程式为:Cu(OH)2+4NH3?H2O [Cu(
 掉毛的狗1年前1
掉毛的狗1年前1 -
 wjygigi 共回答了13个问题
wjygigi 共回答了13个问题 |采纳率92.3%[Cu(NH3)4](OH)21年前查看全部
- 高中化学有机醛基和新制cu(oh)2反应的问题
高中化学有机醛基和新制cu(oh)2反应的问题
请问醛基和cu(oh)2反应后生成的cooh会不会和新制氢氧化铜中的naoh反应 我特意去翻了翻化学选修4的教材 教材中描述的新制氢氧化铜的配法是10%的naoh几ML 然后2%的cuso4几滴 这样显然naoh过量 也就是需要考虑新制氢氧化铜中的naoh 但是 我又做了很多资料的标答中 又没有考虑naoh 求权威= = 狂沙再现1年前1
狂沙再现1年前1 -
 里膨 共回答了17个问题
里膨 共回答了17个问题 |采纳率88.2%检验醛基的试剂通常是新制氢氧化铜或者是银氨溶液,在鉴别过程中一定要考虑到溶液本身是呈现的碱性,所以在与氢氧化铜悬浊液反应后得到的是羧酸钠而不是羧酸,在历年高考中出现过这种类型的题图,或者分两步写,在写一步得到的羧酸与氢氧化钠的反应,或者直接写成一个整体的化学反应方程式,在反应物中要有氢氧化钠参与到反应中.1年前查看全部
- 化学中醛和cu(oh)2反应是酒精灯加热 为什么生物中是水浴?
 左边是卧室1年前0
左边是卧室1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 油脂在什么条件下的水解产物能和新制Cu(oH)2悬浊液反应?
 apue1年前1
apue1年前1 -
 17118332 共回答了15个问题
17118332 共回答了15个问题 |采纳率80%碱性条件下1年前查看全部
- 官能团为醛基,可以发生那些反应?是不是可以和新制Cu(OH)2反应
 474544751年前2
474544751年前2 -
 XX-H 共回答了28个问题
XX-H 共回答了28个问题 |采纳率85.7%醛基可以发生银镜反应、氧化反应生产酸、还原反应生成醇、缩合反应生成缩醛、可以将新制的氢氧化铜还原为氢氧化亚铜、醛基氧化为羧基1年前查看全部
- 已知一定温度下的ksp:Cu(OH)2=2.2×10-20,Ksp[Fe(
已知一定温度下的ksp:Cu(OH)2=2.2×10-20,Ksp[Fe(
已知一定温度下的ksp:Cu(OH)2=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=1.9×10-13.现在阳离子浓度相等,加入氢氧化钾,发生沉淀的顺序?
不是说相同类型可以比较ksp不同就不可以吗?那么氢氧化铁和氢氧化铜为什么能比较出来沉淀顺序的啊?
感觉这里比较乱, chengyf198101年前1
chengyf198101年前1 -
 姜楠 共回答了13个问题
姜楠 共回答了13个问题 |采纳率84.6%很明显看出氢氧化铁先沉淀,接着是氢氧化铜,最后是氢氧化锰.可以通过计算来证明
设阳离子浓度为c铜和铁的氢氧根浓度分别为x1和x2
铜开始沉淀时c*x1*x1=2.2*10的-20次方,x1=√2.2*10的-20次方/c0.48*10的-5次方/√c
铁开始沉淀时,c*x2*x2*x2=4*10的-38次方,x2=³√4*10的-38次方/c=0.75*10的-13次方/³√c
比较x1.x2很明显,x2远远小于x1即铁离子先沉淀.1年前查看全部
- 为什么向CU(OH)2悬浊液中加入葡萄糖会有绛蓝色?还能证明葡萄糖中有羟基?
 ii发哥1年前3
ii发哥1年前3 -
 pray_ 共回答了18个问题
pray_ 共回答了18个问题 |采纳率100%生成
C-O
空格Cu
C-O
结构,O与Cu之间有化学键1年前查看全部
- 根据化学反应方程式:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4,请回答下列问题:
根据化学反应方程式:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4,请回答下列问题:
(1)该反应所属的基本反应类型是______;
(2)若上述两种溶液恰好完全反应,反应后的溶液中除水之外,还含有的物质是______;
(3)反应后溶液的总质量比反应前溶液的总质量______. 5535811351年前3
5535811351年前3 -
 hyb1978 共回答了20个问题
hyb1978 共回答了20个问题 |采纳率80%解题思路:(1)从基本反应的类型及特点分析;
(2)从化学方程式上判断;
(3)从化学方程式上判断.(1)从化学反应方程式:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4看,此反应是两种化合物相互交换成分生成另外两种化合物,是复分解反应.故答案为:复分解反应
(2)从化学反应方程式:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4看,反应后的溶液中除了原溶液中的水外,只有硫酸钠,因为氢氧化铜是沉淀,不是溶液的一部分.故答案为:硫酸钠
(3)从化学反应方程式:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4看,生成物氢氧化铜是沉淀,不是溶液的一部分,故反应后溶液的总质量比反应前溶液的总质量小.故答案为:小点评:
本题考点: 反应类型的判定;质量守恒定律及其应用.
考点点评: 本题考查化学反应的类型和化学方程式以及溶液的有关知识,难度较小,注意不溶物不是溶液的一部分.1年前查看全部
- 加热条件下,甲酸和新制CU(OH)2反应 化学方程式怎么写
 炒青椒1年前3
炒青椒1年前3 -
 flyingbabyface 共回答了22个问题
flyingbabyface 共回答了22个问题 |采纳率86.4%甲酸具有和醛类似的还原性.它能起银镜反应,会还原铜和将自身还原成水和二氧化碳
HCOOH+2Cu(OH)2=CO2(上升符号)+Cu2O+3H2O1年前查看全部
- 有机化学选择可以鉴别乙酸溶液,葡萄糖溶液,蔗糖溶液是试剂?A.银氨溶液 B.新制Cu(OH)2溶液 C.石蕊溶液 D.碳
有机化学选择
可以鉴别乙酸溶液,葡萄糖溶液,蔗糖溶液是试剂?
A.银氨溶液 B.新制Cu(OH)2溶液 C.石蕊溶液 D.碳酸钠溶液
说明理由, 粪土墙1年前2
粪土墙1年前2 -
 阅霏 共回答了14个问题
阅霏 共回答了14个问题 |采纳率100%选B.
乙酸溶液会溶解Cu(OH)2,生成蓝色溶液.
葡萄糖溶液会与Cu(OH)2反应生成砖红色Cu2O沉淀.
蔗糖溶液与Cu(OH)2不反应,Cu(OH)2会沉淀.1年前查看全部
- 乙醇(乙醛) 用新制Cu(OH)2悬浊液,加热至沸腾,过滤取溶液.除杂为何不可?
 雪儿20041年前2
雪儿20041年前2 -
 nigennn 共回答了13个问题
nigennn 共回答了13个问题 |采纳率84.6%因为乙醛氧化生成乙酸,乙醇和乙酸互溶,所以过滤不能分开.
CH3CHO + 2Cu(OH)2--加热--> CH3COOH + Cu2O(沉淀) + 2H2O1年前查看全部
- Cu(OH)2是什么意思(~在两化学式的中间,和CuO—Cu(OH)2中位置一样.)
 不爱我别烦我1年前5
不爱我别烦我1年前5 -
 山人等待妙计 共回答了14个问题
山人等待妙计 共回答了14个问题 |采纳率100%就是“转化”的意思,中间省略了步骤、条件、和部分反应物生成物.在这里面,波浪线省略的是,加盐酸或硫酸生成氯化铜或硫酸铜,再加氢氧化钠生成氢氧化铜沉淀1年前查看全部
- 化学--物质及其性质和变化规律HCl、CuO、(CaOH)2、NaCl、BaSO4、Fe、Cu(OH)2、CH4、SO2
化学--物质及其性质和变化规律
HCl、CuO、(CaOH)2、NaCl、BaSO4、Fe、Cu(OH)2、CH4、SO2、O2、HNO3、NaOH、MgO、K2CO3、Fe(OH)3
、CuSO4、NaNO3、H2SO4、C2H5OH、CO2、I2
以上物质属于单质的是:
属于酸的是:
属于碱的是:
属于盐的是:
属于有机化合物的是:
属于氧化物的是:
还能对上列物质进行怎样的分类?
属于 的是:
属于 的是: woailishi991年前5
woailishi991年前5 -
 yatou798128 共回答了14个问题
yatou798128 共回答了14个问题 |采纳率92.9%以上物质属于单质的是 Fe,O2,I2
属于酸的是:HCl、HNO3、H2SO4、
属于盐的是:NaCl,BaSO4,K2CO3、CuSO4、NaNO3、
属于有机化合物的是:CH4、C2H5OH、
属于氧化物的是:CuO、SO2、MgO、CO2、
属于电解质的是:HCl,CuO、、(CaOH)2,NaCl、BaSO4、Cu(OH)2、HNO3、NaOH、MgO、K2CO3、Fe(OH)3 ,CuSO4、NaNO3、H2SO4、
属于碱的是:、(CaOH)2,Cu(OH)2,NaOH1年前查看全部
- 为什么说CuCl2水解不能制取Cu(oh)2?
 shy151年前2
shy151年前2 -
 年年如花 共回答了29个问题
年年如花 共回答了29个问题 |采纳率96.6%如果水解会生成HCL是强酸,不能与Cu(OH)2共存.
当然也不是说完全不能,万事都不绝对,只是它水解平衡的平衡点非常接近CuCl2+H2O这一端1年前查看全部
- cuso4+2NaOH=Na2SO4+Cu(OH)2 为什么在Cu(OH)2后加下沉符号
 acacia011年前1
acacia011年前1 -
 晚睡的虫子 共回答了24个问题
晚睡的虫子 共回答了24个问题 |采纳率91.7%氢氧化铜是难溶物,因为该反应中其他物质均为溶液所以要打沉淀符号.
拓展、如果氢氧化铜是反应物,发生受热分解反应,此时不用加沉淀符号,因为只有生成物才能标沉淀符号.如果反应环境为溶液,是难溶物就要加沉淀符号,如果是固体反应,即使生成了难溶物也不用标的1年前查看全部
- Cu(OH)2为什么加括号Cu(OH)2为什么要加括号
 小彭0061年前2
小彭0061年前2 -
 tulv521tao 共回答了17个问题
tulv521tao 共回答了17个问题 |采纳率70.6%OH是一个化学键啊1年前查看全部
- 乙酸乙酯的水解1.乙酸乙酯在碱性环境下水解要加热吗?强碱、弱碱有区别吗?2.若题目中说“往乙酸乙酯中加入Cu(OH)2"
乙酸乙酯的水解
1.乙酸乙酯在碱性环境下水解要加热吗?强碱、弱碱有区别吗?
2.若题目中说“往乙酸乙酯中加入Cu(OH)2", 幼儿园猪猪1年前2
幼儿园猪猪1年前2 -
 风高夜下 共回答了24个问题
风高夜下 共回答了24个问题 |采纳率91.7%要加热,加热可以使反应速率提高,强碱弱碱反应速率不一样,其他的没区别
不考虑1年前查看全部
- 用Cu(OH)2胶体做电泳实验时,阴极附近蓝色加深,往此胶体中加入下列物质时,不发生凝聚的是( )
用Cu(OH)2胶体做电泳实验时,阴极附近蓝色加深,往此胶体中加入下列物质时,不发生凝聚的是( )
①硫酸镁溶液②硅酸胶体③氢氧化铁胶体④葡萄糖溶液.
A. ①②
B. ②③
C. ③④
D. ①④ 司马夏鱼1年前1
司马夏鱼1年前1 -
 ericjx 共回答了22个问题
ericjx 共回答了22个问题 |采纳率95.5%解题思路:电泳时阴极附近蓝色加深,说明Cu(OH)2胶粒带正电荷.使胶体凝聚的方法有:①加电解质;⑧加带相反电荷的胶体;③加热.①硫酸镁为电解质,能使Cu(OH)2胶体发生聚沉,故①错误;
②硅酸胶体带负电,能使Cu(OH)2胶体发生聚沉,故②错误;
③Fe(OH)3胶体带正电,不能使Cu(OH)2胶体发生聚沉,故③正确;
④葡萄糖溶液不带电荷不会使Cu(OH)2胶体聚沉,故④正确;
故选C.点评:
本题考点: 胶体的重要性质.
考点点评: 本题考查胶体的聚沉,难度不大,注意使胶体凝聚的方法有:①加电解质;⑧加带相反电荷的胶体;③加热.1年前查看全部
- (2013•丹徒区模拟)对于反应:X+2NaOH═2Y+Cu(OH)2↓,下列分析中正确的是( )
(2013•丹徒区模拟)对于反应:X+2NaOH═2Y+Cu(OH)2↓,下列分析中正确的是( )
A.Y 中一定含有钠元素
B.X 和Y 的相对分子质量之差为18
C.X 可能是CuSO4
D.Y 可能是Na2SO4 麦笀1年前1
麦笀1年前1 -
 class9yinjie 共回答了19个问题
class9yinjie 共回答了19个问题 |采纳率94.7%解题思路:根据复分解反应的发生规律并结合质量守恒的知识来分析解答.A、由质量守恒定律可知,反应前后元素的种类不变,Y中一定含有钠元素.故A正确;
B、依据质量守恒定律可知,反应前后各物质的相对分子质量之和相等可知,X比2个Y大18,并不能说明X和Y的相对分子质量相差18,故B错误;
C、如果X是CuSO4,带入,由复分解反应的发生规律可知,Y是Na2SO4.将化学方程式配平,Y前边的计量数应是1,故C错误;
D、如果Y是Na2SO4,带入,由复分解反应的发生规律可知,X是CuSO4.将化学方程式配平,Y前边的计量数应是1,故D错误.
故选A.点评:
本题考点: 复分解反应及其发生的条件.
考点点评: 在解此类题时,首先分析题中方程式发生的原理,然后结合具体的反应以及物质进验证即可.1年前查看全部
- 什么有机物可以和Cu(OH)2反应
 youbin8681年前1
youbin8681年前1 -
 誘o惑 共回答了25个问题
誘o惑 共回答了25个问题 |采纳率92%只要有醛基的有机物就可以与其在加热煮沸条件下发生氧化反应生成羧酸和氧化亚铜和水.例如甲酸,醛类,还原性糖(葡萄糖、麦芽糖等)1年前查看全部
大家在问
- 1高温燃烧后的聚苯乙烯有毒吗?
- 2我的魔方不能复原了,在最后一步本应该中间的颜色是相对的 但现在出现了和4阶一样的情况了
- 3为什么小米手机科学计算器算三角函数总是错的
- 4写英文邮件时,若收件人是副教授,那么称呼应该是Dear Prof.还是Dear associate professor?
- 5(2013•汕尾二模)下列的实验操作、现象和解释都正确的是( )
- 6(2009•来宾)奥斯特发现电流的周围存在着磁场,许多科学家进行了逆向思考,经过10年的探索,物理学家 ______发现
- 7为什么不能把废液直接放到水池中,为什么使用试管夹时手指不能按在短柄上
- 8否命题和命题的否定关系量词该怎么改变?
- 9周末上做了一种美食英语作文60_80字
- 10小明前五次数学测验的平均成绩是88分.为了使平均成绩达到92.5分,小明要连续考多少次满分
- 11一个长方行操场长180米,宽120米,需要在比例是1:100的图纸上,长和宽各应画多少?怎
- 12怎样计算完成年度计划的百分比
- 13如图中五7线为晨昏线.完成13~11题
- 14The year later he turned ____ doctor填什么 冠词
- 15【调节光圈和反光镜】与【调节细准焦螺旋】的顺序
