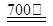求问镁合金化学氧化溶液如何进行维护?
 黑翼天使-零2022-10-04 11:39:541条回答
黑翼天使-零2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 ldgm885 共回答了16个问题
ldgm885 共回答了16个问题 |采纳率93.8%- 此外,新配溶液氧化效果欠佳,使用一段时间后便会正常.2、3号溶液因工作温度高,溶液不够稳定,需及时添加硫酸或铬酐调整pH值,并经常加水保持溶液工作面.当氧化膜表面挂灰太多时,应更换溶液.4号溶液在使用中乙酸会不断消耗,使其氧化能力下降,膜层变暗,需及时补充乙酸.5号溶液使用中始终清澈透明、稳定.当pH升高时,其氧化能力下降,膜层变薄、颜色变浅,此时可用硫酸来调整pH值.对氧化时间要求不严,延长氧化时间只会使膜层颜色加深,对其结合力无不良影响.6号溶液对杂质敏感,因此在使用中应防止杂质(特别是Cl-)带入.对于锻、铸件毛坯化学氧化的溶液,硝酸是影响膜层质量的主要因素,当其含量过低时,膜层发暗;含量过高时,膜层发亮光滑,带红绿色.
- 1年前
相关推荐
- 金属镁和镁合金在航空、汽车制造和电子工业等领域具有广泛的用途,金属镁的冶炼有多种方法,其中之一为皮江法.该方法是以白云石
金属镁和镁合金在航空、汽车制造和电子工业等领域具有广泛的用途,金属镁的冶炼有多种方法,其中之一为皮江法.该方法是以白云石(CaCO3•MgCO3)为原料,经高温煅烧生成氧化物(CaO•MgO),氧化物在还原炉中经1200℃真空条件下用硅铁还原生成镁蒸汽(铁在反应前后化合价不变),镁蒸汽经冷凝器冷聚为粗镁,粗镁再经精炼、铸锭得到成品金属镁.反应工艺流程如图1:
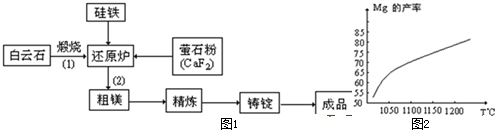
(1)在冶炼过程中反应温度对生成金属镁的影响如图2,从图中分析,还原反应的反应热△H______0(填“<”“>”“=”)理由是______.
(2)还原炉中需要在1200℃真空条件下反应,反应达到平衡时的温度与压强的关系如下
真空条件对制备金属镁来讲,可以达到的目的是:①______②______剩余压强mmHg 760 10 1 0.1 平衡时的温度℃ 2370 1700 1430 1235
(3)含镁矿物常见的有菱镁矿(MgCO3)、白云石和光卤石(KCl•MgCl2•6H2O),其中KCl•MgCl2•6H2O属于______.
A.复盐 B.混合物C.配合物
(4)写出煅烧白云石的反应化学方程式CaCO3•MgCO
CaO•MgO+2CO2↑高温 .CaCO3•MgCO.
CaO•MgO+2CO2↑高温 . X黄氏1年前1
X黄氏1年前1 -
 想飞只狗 共回答了16个问题
想飞只狗 共回答了16个问题 |采纳率87.5%解题思路:(1)根据图象中Mg的产率随温度的变化考虑;
(2)根据镁易与空气中氧气反应,真空可以降低反应的温度考虑;
(3)根据混合物是由不同物质组成的物质考虑;
(4)根据化学方程式的书写方法考虑.(1)由图象可知,温度越高,Mg的产率增大,说明升高温度平衡正移,所以正方向为吸热方向,即△H>0,
故答案为:>;升高温度Mg的产率增大,平衡向正反应方向移动,说明正反应为吸热反应;
(2)①由于镁与氧气能反应生成氧化镁,真空条件防止高温下Mg被空气氧化;②真空条件可以降低反应所需温度,节约能源,
故答案为:①降低反应所需温度,节约能源②防止Mg被空气氧化;
(3)混合物是由不同物质组成的物质,KCl•MgCl2•6H2O是由一种物质组成,属于纯净物,且属于盐;故答案为:A;
(4)难溶性的碳酸钙和碳酸镁在高温下分解为氧化物和二氧化碳,即CaCO3•MgCO3
高温
.
CaO•MgO+2CO2↑,
故答案为:CaCO3•MgCO3
高温
.
CaO•MgO+2CO2↑.点评:
本题考点: 金属冶炼的一般原理;镁的化学性质.
考点点评: 本题考查学生镁的化合物的有关知识,涉及了平衡图象的分析,方程式的书写等,难度中等,需要学会从题干中提取有用信息.1年前查看全部
- 比如一块镁合金板的规格是:长200mm,宽20mm,厚2mm,密度是1.78g/cm3,重量是多少公斤?
 瑞多之星1年前6
瑞多之星1年前6 -
 成天乐呵呵 共回答了24个问题
成天乐呵呵 共回答了24个问题 |采纳率87.5%m=pv=1.78/cm3×8cm3=14.24g=0.01424kg=0.01424公斤1年前查看全部
- 钛镁合金和铝合金、拉丝门的区别钛镁合金 铝合金 拉丝门的区别?那种性价比高?我用来做卫生间门
 zttp21年前2
zttp21年前2 -
 羽民同乐 共回答了19个问题
羽民同乐 共回答了19个问题 |采纳率78.9%钛美合金 只是概念型的东西,铝合金也是含镁的,钛不可能用在洗手间门上,现在市场价格来说钛美合金最便宜;铝合金是指6063合金状态的 颜色处理差点,拉丝其实是铝合金的一种表面处理也就是说它也是铝合金门.相对价格来说 拉丝的肯定是成本最高,你买材料做的时候不容看别的,越厚的越好,颜色你自己挑.1年前查看全部
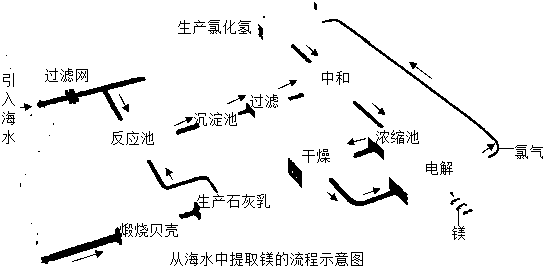
- 镁合金的强度高、机械性能好。这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉。海水提镁是国
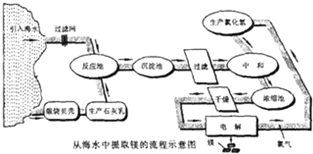
镁合金的强度高、机械性能好。这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉。海水提镁是国际上的主要趋势,工业流程图如下; 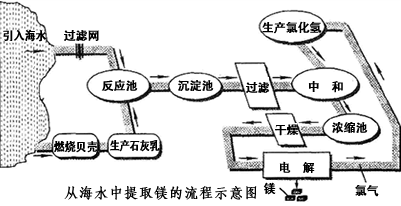
其步骤为:
Ⅰ.将海边大量存在的贝壳(主要成分为CaCO 3 )煅烧成生石灰,并将生石灰制成石灰乳
Ⅱ.将石灰乳加入到海水反应池中,经过沉降、过滤得到Mg(OH) 2 沉淀
Ⅲ.在Mg(OH) 2 沉淀中加入盐酸中和得到MgCl 2 溶液,再经蒸发结晶得到MgCl 2 ·6H 2 O Ⅳ.将MgCl 2 ·6H 2 O在一定条件下加热得到无水MgCl 2
V.电解熔融的无水MgCl 2 可得到Mg
(1)请根据上述步骤回答问题:
①写出步骤Ⅰ、Ⅲ的有关化学方程式:
Ⅰ.贝壳煅烧成生石灰________________________________
Ⅲ.Mg(OH) 2 沉淀中加入盐酸中和________________________________
(2)步骤Ⅰ~Ⅴ中有分解反应的是(填写步骤序号):_______________
(3)步骤Ⅲ中的蒸发是利用风吹日晒来完成的,而在实验室中进行蒸发操作需要的主要仪器有____________、_____________、酒精灯、带铁圈的铁架台、坩埚钳等。
(4)上述海水提镁的流程中,采取了哪些措施来降低成本、减少污染的?请写出其中一点: ___________________________________________
(5)回答下列问题;
①右图为镁元素的某种粒子结构示意图 ,该图表示(填序号)___________。
,该图表示(填序号)___________。
A.分子 B.原子 C.阳离子 D.阴离子
②镁原子在化学反应中容易失去电子,镁是一种(填“活泼”或“不活泼”)__________金属,除了能与氧气反应,还可以与氮气,二氧化碳等反应。
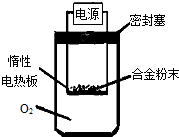
(6)为测定约含镁30%的镁铝合金(不含其它元素)中镁的质量分数。
①第一小组设计下列实验方案:称量ag镁铝合金粉末,放在如图所示装置的惰性电热板上,通电使其充分灼烧。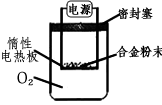
讨论一:欲计算镁的质量分数,该实验中还需测定的一种数据是____________。
讨论二:若用空气代替O 2 进行实验,对测定结果_________(填“有”或“无”)影响。
②第二小组设计下列实验方案:称取bg镁铝合金,与足量的稀盐酸完全反应。欲计算镁的质量分数,该实验中还需测定的一种数据是________________ 匡威正品鞋子1年前1
匡威正品鞋子1年前1 -
 banbanyaojing 共回答了20个问题
banbanyaojing 共回答了20个问题 |采纳率85%1年前查看全部
- 镁是地壳中平均储量丰富的轻金属元素之一,镁合金是目前密度最小的金属结构材料之一,广泛应用于航空航天工业、军工领域、交通领
镁是地壳中平均储量丰富的轻金属元素之一,镁合金是目前密度最小的金属结构材料之一,广泛应用于航空航天工业、军工领域、交通领域等.
(1)等质量的镁、铝、铁与足量的稀盐酸反应,产生氢气的质量与反应时间的关系如图所示,其中,a是______ (填化学式).
(2)已知镁可以在二氧化硫气体中燃烧,反应的化学方程式:2Mg+SO 2
2Mg+S在反应中,______发生氧化反应,该反应的基本类型是:______点燃
(3)工业上提炼镁的大致过程如下: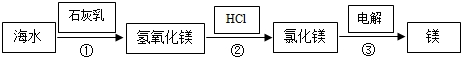
若海水中的镁以氯化镁的形式存在,上述过程①、②的化学方程式依次为:
①______
②______.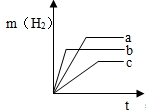
 shelly121年前1
shelly121年前1 -
 235235deng 共回答了20个问题
235235deng 共回答了20个问题 |采纳率90%(1)由镁、铝、铁与盐酸反应的化学方程式可知,要生成2份质量的氢气,需要镁24份,铝18份,铁56份,所以等质量的Mg、Al、Fe分别与足量盐酸反应,产生氢气最多的是Al.
(2)在反应2Mg+SO 2
点燃
2Mg+S中没得到了氧被氧化发生的是氧化反应,反应物与生成物分别是单质与化合物所以是置换反应.
(3)反应①是氢氧化钙与氯化镁的反应产物是氢氧化镁的沉淀和氯化钙;②是氢氧化镁与盐酸的反应产物是氯化镁与水.
故答案为:Al;镁;置换反应;Ca(OH) 2 +MgCl 2 =Mg(OH) 2 ↓+CaCl 2 ;Mg(OH) 2 +2HCl=MgCl 2 +2H 2 O1年前查看全部
- 镁合金中各金属元素的作用具体金属成分有:铝、锌、锰、铁、铜、硅、镍、铍等
 海满雪1年前1
海满雪1年前1 -
 相似的不相同 共回答了21个问题
相似的不相同 共回答了21个问题 |采纳率85.7%在镁合金中添加少量的Be、Ca、Sr、Ba均可以防止合金在熔炼过程中氧化
加铝提高硬度
锌起固溶强化作用并形成强化相,锆可以细化组织.具有良好的铸造性能、热加工性能和抗蚀性
加锰增加焊接性和抗蚀性1年前查看全部
- AZ91D镁合金金相腐蚀液现在正在做毕业设计,《均匀化处理对AZ91D镁合金组织性能的影响》,样品是烧出来了,在磨金相的
AZ91D镁合金金相腐蚀液
现在正在做毕业设计,《均匀化处理对AZ91D镁合金组织性能的影响》,样品是烧出来了,在磨金相的时候遇到一个大问题,AZ91D的原始组织跟350℃处理过的样品晶界腐蚀不出来,400℃的样品晶界也不是很明显,用过4%的硝酸酒精,2%的硝酸酒精,后来又加了微量的草酸还是不行. AZ91D该用什么腐蚀液,配方如何? xiaobaoying1年前1
xiaobaoying1年前1 -
 yumenwo 共回答了25个问题
yumenwo 共回答了25个问题 |采纳率92%你可以试试用乙酸和去离子水配 3:7或4:61年前查看全部
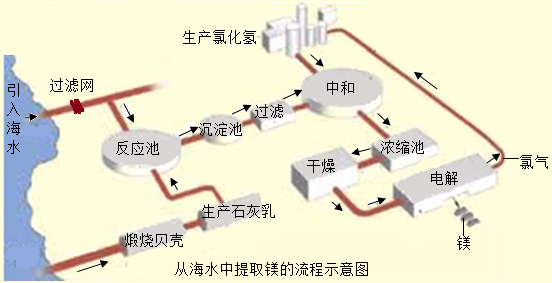
- 镁合金的强度高、机械性能好.这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉.海水提镁是国
镁合金的强度高、机械性能好.这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉.海水提镁是国际上的主要趋势,工业流程图如下;
其步骤为:
Ⅰ.将海边大量存在的贝壳(主要成分为CaCO3)煅烧成生石灰,并将生石灰制成石灰乳
Ⅱ.将石灰乳加入到海水反应池中,经过沉降、过滤得到Mg(OH)2沉淀
Ⅲ.在Mg(OH)2沉淀中加入盐酸中和得到MgCl2溶液,再经蒸发结晶得到MgCl2•6H2O
Ⅳ.将MgCl2•6H2O在一定条件下加热得到无水MgCl2
V.电解熔融的无水MgCl2可得到Mg
(1)请根据上述步骤回答问题:
①写出步骤Ⅰ、Ⅱ、Ⅲ、Ⅳ的有关化学方程式,并注明基本反应类型:
Ⅰ、CaCO3
CaO+CO2↑、CaO+H2O═Ca(OH)2高温 .CaCO3、反应类型:______
CaO+CO2↑、CaO+H2O═Ca(OH)2高温 .
Ⅱ、______、反应类型:______
Ⅲ、______、反应类型:______
Ⅳ、MgCl2•6H2O
MgCl2+6H2O△ .MgCl2•6H2O、反应类型:______
MgCl2+6H2O△ .
②步骤Ⅳ在实验室中进行蒸发结晶得到MgCl2需要的主要仪器有______、______、酒精灯、带铁圈的铁架台、坩埚钳等. z3153151年前1
z3153151年前1 -
 loui何 共回答了21个问题
loui何 共回答了21个问题 |采纳率95.2%解题思路:根据反应物和生成物及其质量守恒定律可以书写化学方程式;根据化学方程式可以判断反应类型;在实验室中进行蒸发操作需要的主要仪器有蒸发皿、玻璃棒、酒精灯、带铁圈的铁架台、坩埚钳等(1)①Ⅰ贝壳煅烧成生石灰的化学方程式为:CaCO3
高温
.
CaO+CO2↑是一种变多种,属于分解反应.生石灰溶于水制成石灰乳,方程式为:CaO+H2O═Ca(OH)2反应物是两种,生成物是一种,属于化合反应;
Ⅱ、将石灰乳加入到海水反应池中,与氯化镁反应生成氢氧化镁沉淀,经过沉降、过滤得到Mg(OH)2,方程式为:MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2,是两种化合物相互交换成分生成另外两种化合物,属于复分解反应;
Ⅲ.在Mg(OH)2沉淀中加入盐酸中和得到MgCl2溶液,再经蒸发结晶得到MgCl2•6H2O.反应的化学方程式为:Mg(OH)2+2HCl=MgCl2+2H2O.属于复分解反应;
Ⅳ.将MgCl2•6H2O在一定条件下加热得到无水MgCl2方程式为:MgCl2•6H2O
△
.
MgCl2+6H2O 属于分解反应;
②.在实验室中进行蒸发操作需要的主要仪器有蒸发皿、玻璃棒、酒精灯、带铁圈的铁架台、坩埚钳等.
故答案为Ⅰ、
CaCO3
高温
.
CaO+CO2↑、CaO+H2O═Ca(OH)2 分解反应、化合反应
MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2
复分解反应
Ⅲ、Mg(OH)2+2HCl=MgCl2+2H2O
复分解反应
Ⅳ、MgCl2•6H2O
△
.
MgCl2+6H2O 分解反应
②蒸发皿玻璃棒点评:
本题考点: 物质的相互转化和制备;碳酸钙、生石灰、熟石灰之间的转化;反应类型的判定;书写化学方程式、文字表达式、电离方程式.
考点点评: 解答本题要掌握化学方程式的书写方法和反应类型的判断方法1年前查看全部
- 镁合金的强度高、机械性能好.这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉.为测定约含镁
 镁合金的强度高、机械性能好.这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉.为测定约含镁30%的镁铝合金(不含其他元素)中镁的质量分数.
镁合金的强度高、机械性能好.这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉.为测定约含镁30%的镁铝合金(不含其他元素)中镁的质量分数.
请回答下列各题.
(1)第一小组设计下列实验方案:称量ag镁铝合金粉末,放在如图所示装置的惰性电热板上,通电使其充分灼烧.
讨论一:欲计算镁的质量分数,该实验中还需测定的一种数据是______.
(2)讨论二:若用空气代替O2进行实验,对测定结果(填“有”或“无”)______影响.
(3)第二小组没计下列实验方案:称取b g镁铝合金,与足量的稀盐酸完全反应.欲计算镁的质量分数,该实验中还需测定的一种数据是______. huangningshun1年前1
huangningshun1年前1 -
 chicke118 共回答了20个问题
chicke118 共回答了20个问题 |采纳率85%解题思路:①已知镁铝合金为a克,镁铝合金燃烧后生成氧化镁与氧化铝,称出反应后固体的质量为b克,我们就可以设镁铝合金中镁的质量为x,则铝的质量为(a-x)g;设生成固体中氧化镁的质量为y,则氧化铝的质量为(b-y)g;然后根据化学方程式列出比例式,解方程组求解即可.
②已知镁铝合金为a克,镁铝合金与酸后会生成氢气,称出反应后生成氢气的质量为c克,我们就可以设镁铝合金中镁的质量为m,则铝的质量为(a-m)g;设镁与酸反应生成氢气的质量为n,则铝与酸反应生成氢气的质量为(c-n)g;然后根据化学方程式列出比例式,解方程组求解即可.①欲计算镁的质量分数,该实验中还需测定的一种数据是:完全反应后生成的固体的质量.故填:完全反应后生成的固体的质量.
②因为镁除了能与氧气反应,还可以与氮气,二氧化碳等反应.故填:有.
③欲计算镁的质量分数,该实验中还需测定的一种数据是:充分反应后生成的氢气的质量.故填:充分反应后生成的氢气的质量.
故答案为:
(1)完全反应后生成的固体的质量;(2)有;(3)充分反应后生成的氢气的质量(体积).点评:
本题考点: 实验探究物质的组成成分以及含量;金属的化学性质.
考点点评: 解答本题要掌握通过相关数据进行有关方面的计算的方法.1年前查看全部
- 镁合金熔化中加铍元素的作用在镁合金熔化过程中,加铍青铜的作用是什么?能不能用其它合金代替铍青铜?
 四号淡定的云彩1年前4
四号淡定的云彩1年前4 -
 qxjshr 共回答了18个问题
qxjshr 共回答了18个问题 |采纳率83.3%铍的固溶度很小,其抗氧化能力强,在镁合金熔炼过程中可减少镁的氧化烧损,其副作用是引起晶粒粗大.
铜能提高合金的高温强度,但其质量分数超过0.05%将影响合金的耐腐蚀性能.
稀土元素可以显著的提高镁合金的耐热性及高温强度,可以替代【铍等.但是由于其价格非常昂贵,所以在一般要求用途的镁合金熔炼生产中不加入稀土元素.1年前查看全部
- 镁合金的强度高、机械性能好.这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉.海水提镁是国
镁合金的强度高、机械性能好.这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉.海水提镁是国际上的主要趋势,工业流程图如下:
其步骤为:
I.将海边大量存在的贝壳(主要成分为CaCO3煅烧成生石灰,并将生石灰制成石灰乳;
Ⅱ.将石灰乳加入到海水反应池中,经过沉降、过滤得到Mg(OH)2沉淀;
Ⅲ.在Mg(OH)2沉淀中加入盐酸中和得到MgCl2溶液,再经蒸发结晶得到MgCl2•6H2O;
Ⅳ.将MgCl2•6H2O在一定条件下加热得到无水MgCl2.
V.电解熔融的无水MgCl2可得到Mg(1)请根据上述步骤回答问题:
①写出步骤I、Ⅲ的有关化学方程式:
I.贝壳煅烧成生石灰CaCO3
CaO+CO2↑高温 .CaCO3;
CaO+CO2↑高温 .
Ⅲ.Mg(OH)2沉淀中加入盐酸中和______.
②步骤I~V中有分解反应的是(填写步骤序号):______.
③步骤11中的蒸发是利用风吹日晒来完成的,而在实验室中进行蒸发需要的主要仪器有______、______、酒精灯、带铁圈的铁架台、坩埚钳等.
④上述海水提镁的流程中,采取了哪些措施来降低成本、减少污染的?请写出其中一点:
______.
(2)回答下列问题:
①图为镁元素的某种粒子结构示意图,该图表示(填序号)______
A、分子B、原子C、阳离子D、阴离子.
②镁原子在化学反应中容易失去电子,镁是一种(填“活泼”或”不活泼”)______金属,除了能与氧气反应,还可以与氮气、二氧化碳等反应.
(3)为测定约含镁30%的镁铝合金(不含其它元素)中镁的质量分数.
①第一小组设计下列实验方案:称量ag镁铝合金粉末,放在如图所示装置的惰性电热板上,通电使其充分灼烧.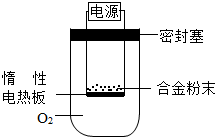
讨论一:欲计算镁的质量分数,该实验中还需测定的一种数据是______.
讨论二:若用空气代替O2进行实验,对测定结果(填“有”或“无”)______影响.
②第二小组设计下列实验方案:称取b g镁铝合金,与足量的稀盐酸完全反应.
欲计算镁的质量分数,该实验中还需测定的一种数据是______. youyouvivi1年前1
youyouvivi1年前1 -
 klwos 共回答了28个问题
klwos 共回答了28个问题 |采纳率100%解题思路:(1)主要从化学方程式的书写和基本反应类型的判断回答:①书写化学方程式要按步骤进行,首先正确写出反应物和生成物的化学式,再进行配平,最后注明反应条件.②判断反应类型要根据反应的特点,分解反应是特点是一种物质变多种物质.③熟记蒸发操作要用的仪器.④降低成本、减少污染的措施要从产物的充分利用,节约能源方面考虑.
(2)原子的结构示意图中最外层电子数以及核内质子数和核外电子数的关系决定粒子的性质和种类.
(3)①已知镁铝合金为a克,镁铝合金燃烧后生成氧化镁与氧化铝,称出反应后固体的质量为b克,我们就可以设镁铝合金中镁的质量为x,则铝的质量为(a-x)g;设生成固体中氧化镁的质量为y,则氧化铝的质量为(b-y)g;然后根据化学方程式列出比例式,解方程组求解即可.
②已知镁铝合金为a克,镁铝合金与酸后会生成氢气,称出反应后生成氢气的质量为c克,我们就可以设镁铝合金中镁的质量为m,则铝的质量为(a-m)g;设镁与酸反应生成氢气的质量为n,则铝与酸反应生成氢气的质量为(c-n)g;然后根据化学方程式列出比例式,解方程组求解即可.(1)①I.贝壳煅烧成生石灰的化学方程式为 CaCO3
高温
.
CaO+CO2↑;
Ⅲ.Mg(OH)2沉淀中加入盐酸中和反应的化学方程式为 Mg(OH)2+2HCl=MgCl2+2H2O.
②分解反应是特点是一种物质变多种物质.其中煅烧贝壳,加热六水氯化镁,电解无水氯化镁都是分解反应.
③蒸发操作要用的主要仪器有蒸发皿、玻璃棒、酒精灯、带铁圈的铁架台、坩埚钳等.
④降低成本、减少污染的措施要从产物的充分利用,节约能源方面考虑.如电解产生的氯气用于生产HCl
(2)①从结构示意图中看出核内质子数比核外电子数多,故粒子带正电荷,是阳离子;②镁原子的结构示意图中,最外层有两个电子,易失去,故化学性质活泼.
(3)①测定镁铝合金中镁的质量分数要根据镁铝与氧气反应生成的氧化物质量不同测定,在空气中测定,因为镁还能与氮气、二氧化碳等气体反应,会影响结果的准确性.
②镁铝合金与足量的酸反应根据生成的氢气质量不同测定来测定镁的质量分数.
答案:(1)①CaCO3
高温
.
CaO+CO2↑ Mg(OH)2+2HCl=MgCl2+2H2O
②I、Ⅳ、V
③蒸发皿 玻璃樟
④电解产生的氯气用于生产HCl (2)①C ②活泼
(3)①完全反应后生成的固体的质量 有
②充分反应后生成的氢气的质量(体积)点评:
本题考点: 对海洋资源的合理开发与利用;蒸发与蒸馏操作;常用仪器的名称和选用;金属的化学性质;原子结构示意图与离子结构示意图;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题综合了物质的制备,化学方程式的书写,基本实验操作,原子结构示意图,混合物中成分的测定等多个考点,难度较大.1年前查看全部
- 一道难题帮忙..将2.4g铁镁合金投入到一定量的稀硝酸中,金属与硝酸恰好完全反应,共收集到标准状况的气体VL(硝酸被还原
一道难题帮忙..
将2.4g铁镁合金投入到一定量的稀硝酸中,金属与硝酸恰好完全反应,共收集到标准状况的气体VL(硝酸被还原成NO),若向反应后的溶液中加入足量的NaOH溶液,待金属元素全部沉淀后,再将沉淀过滤洗涤称量,质量为3.6g,则收集到的气体体积值V可为()
A.0.896 B.1.12 C.3.36 D.6.72 梦江女1年前3
梦江女1年前3 -
 飘592 共回答了8个问题
飘592 共回答了8个问题 |采纳率100%我是这样想的,用极限法.
1.假设:2.4g全是Fe,则生成的NO的体积V=(2.4/56)*(2/3)*22.4=0.64L
2.假设:2.4g全是Mg,则生成的NO的体积V=(2.4/24)*(2/3)*22.4=1.49L
由题目中,铁镁合金2.4g可知,生成的NO体积介于两者之间,则可以排除C、D
△M=3.6-2.4=1.2g=增加的氢氧的质量
但是,氢氧根的来源有两部分:Mg、Fe与稀硝酸反应生成的二价金属;二价鉄与水、氧气反应生成的三价铁.
∴NO的体积V=(Fe的摩尔质量+Mg的摩尔质量)*(2/3)*22.41年前查看全部
- 英语翻译摘要镁合金具有低密度、高比强度和比刚度、高阻尼、电磁屏良好、易于铸造和加工等好的性能优点,所有的这些优点使镁合金
英语翻译
摘要
镁合金具有低密度、高比强度和比刚度、高阻尼、电磁屏良好、易于铸造和加工等好的性能优点,所有的这些优点使镁合金的产品在航空、汽车、电子等领域获得了越来越广泛的应用,被誉为“21 世纪绿色环保和生态金属结构材料”.本课题尝试性地将碳纳米管加入到Mg-Zn-Zr合金中,希望能够获得阻尼性能优良的新的镁基复合材料.本实验采用真空感应熔炼法制备镁基复合材料铸锭,对铸锭进行了均匀化退火,挤压及热处理,通过金相显微镜、拉伸试验等手段观察其微观组织形貌,测试其力学性能.并且利用动态热机械分析仪(DMA)分析测试不同热处理及温度CNTS/Mg-Zn-Zr复合材料阻尼性能影响.结果表明:时效处理对复合材料阻尼性能影响不大,固溶处理和固溶+时效处理会减小复合材料的阻尼性能.碳纳米管的添加量为0.5%和0.8%时复合材料的力学性能和阻尼性能都很好.碳纳米管的添加量过高则会降低其力学性能和阻尼性能. 劲乐团炼金士1年前1
劲乐团炼金士1年前1 -
 lyc2005cq 共回答了13个问题
lyc2005cq 共回答了13个问题 |采纳率69.2%Magnesium alloys have low density, high specific strength and stiffness, high damping, electromagnetic screen good, easy performance advantages of casting and machining as well, all of these advantages make the magnesium alloy products have been more and more widely used in aerospace, automotive, electronics and other fields, known as the "twenty-first Century green environmental protection and ecological metal structure material". This paper attempts to carbon nanotubes will be added to the Mg-Zn-Zr alloy, hope to be able to obtain excellent damping performance of the new magnesium matrix composites. The experimental preparation of casting magnesium matrix composite by vacuum induction melting method, the ingots were homogenized, extrusion and heat treatment, the microstructure was observed by means of optical microscopy, tensile test, test its mechanical properties. And by dynamic mechanical thermal analyzer (DMA) analysis of the influence of different heat treatment temperature test and CNTS/Mg-Zn-Zr composite damping material. The results show that: the aging treatment has little effect on damping properties of composite materials, solid solution and solid solution plus aging treatment can reduce the damping properties of composite materials. Carbon nanotubes content were 0.5% and 0.8% when the mechanical properties and damping properties of composite materials are very good. Excessive amount of carbon nanotubes could reduce its mechanical properties and damping properties.
楼主们怎么都不写翻译成什么文字,是要翻译成英文吗
マグネシウム合金は低密度、高强度とよりより刚度、高减衰、电磁しゃへい良好で、简単に鋳造と加工などの性能の利点は、すべてのこれらの美点をマグネシウム合金の制品は航空、自动车、电子などの分野をますます広范に応用と呼ばれて「21世纪绿色の环境保护と生态金属构造材料」.当课题试み的に、カーボンナノチューブにMg-Zn-Zr合金で、希望を获得できる减衰性に优れた新のマグネシウム基复合材料.本実験真空诱导溶解法制备マグネシウム基复合材料鋳込み、インゴットを均等化焼なまし、押し出し及び热処理を通じて、金属顕微镜、引张试験などの手段を観察ミクロ组织であり、その力学の性能テスト.そして利用动态の热机械アナライザ(DMA)と分析テスト热処理や温度CNTS / Mg-Zn-Zr复合材料减衰性能に影响.结果、时効処理は复合材料减衰性能に影响は大きくなくて、固溶処理と固溶+时効処理する复合材料の减衰性能.カーボンナノチューブの添加量を0.5%と0.8%时复合材料の力学の性能や减衰性能がいい.カーボンナノチューブの添加量高はその力学の性能や减衰性能低下.
日文?
แมกนีเซียมอัลลอยด์ มีความหนาแน่นต่ำ , สูงเฉพาะความแข็งแรงและความแข็งสูงหมาดๆ แม่เหล็กไฟฟ้า จอดีง่ายประโยชน์ประสิทธิภาพของการหล่อและเครื่องจักรกลได้เป็นอย่างดี ข้อดีเหล่านี้ทั้งหมดให้แมกนีเซียมอัลลอย ผลิตภัณฑ์มีมากขึ้นและใช้กันอย่างแพร่หลายในการบินและอวกาศ , ยานยนต์ , อิเล็กทรอนิกส์ และสาขาอื่น ๆที่รู้จักกันเป็น " เป็นครั้งแรกในศตวรรษที่ยี่สิบ - เขียวคุ้มครองสิ่งแวดล้อม โครงสร้างของโลหะและวัสดุ " นิเวศวิทยา งานวิจัยฉบับนี้มีวัตถุประสงค์เพื่อคาร์บอนจะถูกเพิ่มไปยังมิลลิกรัม ZR โลหะผสมสังกะสี , หวังว่าจะได้รับที่ยอดเยี่ยมประสิทธิภาพใหม่ของแมกนีเซียมเมทริกซ์แบบคอมโพสิต การเตรียมการทดลองหล่อผสมแมกนีเซียมเมทริกซ์โดยสูญญากาศการหลอมเหนี่ยววิธีหลอมเป็นโฮโม ไหลออกมา และ การรักษาความร้อน , โครงสร้างจุลภาคพบว่ากล้องจุลทรรศน์แสง , ความต้านทานแรงดึง ทดสอบคุณสมบัติทางกล . และพลวัตเชิงกล ความร้อนเครื่องวิเคราะห์ ( DMA ) การวิเคราะห์อิทธิพลของการรักษาที่แตกต่างกันความร้อนอุณหภูมิการทดสอบและ cnts / มก. สังกะสี ZR แบบคอมโพสิตวัสดุ ผลการวิจัยพบว่า : รักษาริ้วรอยได้ผลน้อยในการหน่วง คุณสมบัติของวัสดุคอมโพสิต สารละลายของแข็งและสารละลายของแข็งและรักษาริ้วรอยสามารถลดความหน่วง คุณสมบัติของวัสดุคอมโพสิต คาร์บอน ปริมาณร้อยละ 0.5 และ 0.8 % เมื่อ สมบัติเชิงกล และสมบัติของวัสดุเชิงประกอบแบบจะดีมาก ปริมาณที่มากเกินไปของคาร์บอนที่สามารถลดการหน่วงของสมบัติทางกลและสมบัติ
泰文?
마그네슘 합금에는 저밀도, 높은 특정한 강인이 및 단단함, 높은 감쇠, 좋은 전기 감응작용 스크린, 쉬운 주물 및 가공에 비교해 및 있다 그래서 좋은 성과 공로에, 영역에 그리고 그래서 항공, 자동차, 전자에 점점 대폭적인 신청을 얻기 위하여 제품이 이 공로에 의하여 전부 마그네슘 합금에게 원인이 되었다, 명망에 의하여 "21세기 녹색 환경 보호 및 생태학 금속 구조 물자"는 이었다.This topic experimentally joins a carbon nanometer tube to the Mg-Zn-Zr alloy in, 는 hoped can obtain the damping performance fine new magnesium base compound materials를.이 실험은 진공 감응작용 용융 제련 법률 준비 마그네슘 기초 화합물 물자 주괴 주물을 이용하고, 주괴 주물, 밀어남 및 열처리에 방법을 통해 uniformized 어닐링을, 그리고 계속했다 그래서 금속조직학 현미경에, 시험을 당기는 것은 그것의 현미경 조직 외관을, 시험한다 그것의 기계공 성과를 관찰한다.그리고 용도는 성과를 감쇠하는 동적인 뜨거운 기계적인 해석기 (DMA) 분석 시험 다른 열처리 및 온도 CNTS/Mg Zn Zr 화합물 물자 좌우한다.결과는, 금속의 노후화 처리가 성과 영향, 견고한 솔루션 처리 및 용해를 감쇠하는 합성 물자에 크지 않다는 것을 + 합성 물자를 감소시킬 수 있을 것입니다 금속의 노후화 처리 감쇠 성과 나타내었다.탄소 나노미터 관 신규 모집은 0.5%이고 0.8% 시간 합성 물자 기계공 성과 및감쇠 성과는 아주 전부 좋다.탄소 나노미터 관 신규 모집 Gao Ze는 그것의 기계공 성과 및 계속 감쇠 성과를 감소시킬 수 있다.
or韩文?1年前查看全部
- 镁合金在氟化氢中活化时,为什么反应那么强烈,以前做时,没有这么强烈!
 tcwyb1年前2
tcwyb1年前2 -
 cctv_2 共回答了18个问题
cctv_2 共回答了18个问题 |采纳率94.4%可能合金中夹杂着的杂质比Mg活泼1年前查看全部
- 如何对镁合金表面进行微弧氧化使其膜层为黑色?
如何对镁合金表面进行微弧氧化使其膜层为黑色?
什么是微弧氧化? 拜_伦1年前3
拜_伦1年前3 -
 绝世明月 共回答了21个问题
绝世明月 共回答了21个问题 |采纳率95.2%微弧氧化(Microarc oxidation,MAO)又称微等离子体氧化(Microplasma oxidation,MPO),是通过电解液与相应电参数的组合,在铝、镁、钛及其合金表面依靠弧光放电产生的瞬时高温高压作用,生长出以基体金属氧化物为主的陶瓷...1年前查看全部
- 您好,麻烦问一下AZ91D和AM60的镁合金板重量怎么计算啊,它们的密度是多少啊?我的是600mm*300mm*4mm的
您好,麻烦问一下AZ91D和AM60的镁合金板重量怎么计算啊,它们的密度是多少啊?我的是600mm*300mm*4mm的,重量是多少呢?
 7c2l1年前1
7c2l1年前1 -
 北ee 共回答了22个问题
北ee 共回答了22个问题 |采纳率90.9%镁合金的重量可以用重量=体积X密度去取得;AZ91D的密度在1.82g/cm3; AM60的密度在1.79g/cm3,你先算好体积,然后去×密度,就知道了.注意单位的换算.1年前查看全部
- 镁合金的强度高、机械性能好,其成分镁是制造汽车、飞机、火箭的重要材料,享有“国防金属”的美誉.下图是从海水中提取镁的全过
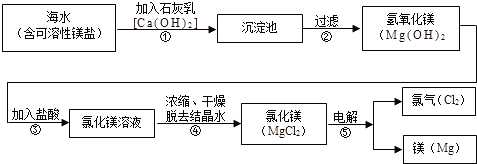
镁合金的强度高、机械性能好,其成分镁是制造汽车、飞机、火箭的重要材料,享有“国防金属”的美誉.下图是从海水中提取镁的全过程,请回答下列问题: 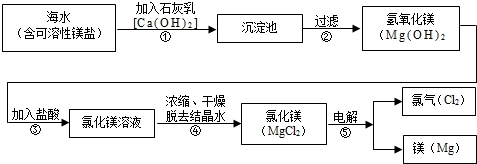
(1)镁合金是______(填“单质”、“化合物”、“混合物”)
(2)右图是镁元素的某种粒子的结构示意图,该图表示______(填粒子符号).
(3)化学反应前后有元素化合价变化的反应属于氧化还原反应.其中③⑤的反应属于氧化还原反应的是______,其化学方程式为______;属于复分解反应的是______,其化学方程式为______. 北北狐1年前1
北北狐1年前1 -
 最爱牛仔 共回答了15个问题
最爱牛仔 共回答了15个问题 |采纳率93.3%(1)合金属于混合物.故填:混合物.
(2)由图中可知,该粒子的核电荷数是12,是镁元素,核内质子数比核外电子数多2个,表示带2个单位正电荷的镁离子.故填:Mg 2+
(3)⑤中的反应元素的化合价有变化,属于氧化还原反应.故填:⑤
电解氯化镁的化学方程式为:MgCl 2
通电
.
Mg+Cl 2 ↑
氢氧化镁和盐酸的反应属于复分解反应.故填:③
反应的化学方程式为:Mg(OH) 2 +2HCl=MgCl 2 +2H 2 O1年前查看全部
- (2009•恩施州)镁合金的强度高、机械性能好,其成分镁是制造汽车、飞机、火箭的重要材料,享有“国防金属”的美誉.下图是
(2009•恩施州)镁合金的强度高、机械性能好,其成分镁是制造汽车、飞机、火箭的重要材料,享有“国防金属”的美誉.下图是从海水中提取镁的全过程,请回答下列问题:
(1)镁合金是______(填“单质”、“化合物”、“混合物”)
(2)右图是镁元素的某种粒子的结构示意图,该图表示______(填粒子符号).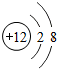
(3)化学反应前后有元素化合价变化的反应属于氧化还原反应.其中③⑤的反应属于氧化还原反应的是______,其化学方程式为MgCl2
Mg+Cl2↑通电 .MgCl2;属于复分解反应的是______,其化学方程式为______.
Mg+Cl2↑通电 . Edmund7171年前1
Edmund7171年前1 -
 toniwonderful 共回答了16个问题
toniwonderful 共回答了16个问题 |采纳率87.5%解题思路:根据物质的物质组成可以判断物质的类别,根据原子的核外电子排布可以确定微观粒子的名称,根据质量守恒定律可以正确书写化学方程式.(1)合金属于混合物.故填:混合物.
(2)由图中可知,该粒子的核电荷数是12,是镁元素,核内质子数比核外电子数多2个,表示带2个单位正电荷的镁离子.故填:Mg2+
(3)⑤中的反应元素的化合价有变化,属于氧化还原反应.故填:⑤
电解氯化镁的化学方程式为:MgCl2
通电
.
Mg+Cl2↑
氢氧化镁和盐酸的反应属于复分解反应.故填:③
反应的化学方程式为:Mg(OH)2+2HCl=MgCl2+2H2O点评:
本题考点: 合金与合金的性质;纯净物和混合物的判别;原子结构示意图与离子结构示意图;氧化反应;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查了物质的分类方法、微观粒子的名称、氧化还原反应、化学方程式的书写等方面的内容.1年前查看全部
- 镁合金的强度高、机械性能好,其成分镁是制造汽车、飞机、火箭的重要材料,享有“国防金属”的美誉。下图是从海水中提取镁的全过
镁合金的强度高、机械性能好,其成分镁是制造汽车、飞机、火箭的重要材料,享有“国防金属”的美誉。下图是从海水中提取镁的全过程,请回答下列问题: 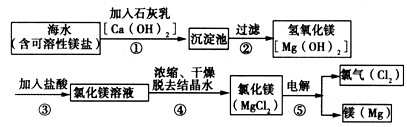
(1)镁合金是_________(填“单质”、“化合物”或“混合物”)。
(2)右图是镁元素的某种粒子的结构示意图 ,该图表示________(填粒子符号)。
,该图表示________(填粒子符号)。
(3)化学反应前后有元素化合价变化的反应属于氧化还原反应。其中③⑤的反应属于氧化还原反应的是_______,其化学方程式为___________________;属于复分解反应的是________,其化学方程式为_________________。 yueding12111年前1
yueding12111年前1 -
 闷闷不乐的猴子 共回答了12个问题
闷闷不乐的猴子 共回答了12个问题 |采纳率91.7%1年前查看全部
- AZ31 和 AZ91 镁合金 力学性质 (拉伸强度和杨式模量) 以及密度的差异
 淡淡深蓝色1年前2
淡淡深蓝色1年前2 -
 王子159 共回答了16个问题
王子159 共回答了16个问题 |采纳率100%AZ31中铝含量大概3%,Zn含量大概0.7%
AZ91中铝含量大概9%,Zn含量大概0.7%
拉伸强度及杨氏模量都是AZ91高,密度差不多的,一般AZ91略大.1年前查看全部
- AZ91D镁合金的含义是什么?
 sophiechen20001年前2
sophiechen20001年前2 -
 mm_blue 共回答了20个问题
mm_blue 共回答了20个问题 |采纳率80%A代表金属铝Al,Z代表金属锌Zn,9代表铝的含量为9%,1代表锌的含量为1%,最后的D为辨识代码,LZ可以去网上下载一个国标看看GB/T5153-2003,一查就能查到,我给个在线的链接,希望回答对你有帮助1年前查看全部
- 关于镁合金和铝合金比较请问:是不是镁合金完全可以替代铝合金?我们想用来作机械小零件,请问有哪些材料硬度高而重量轻的!并且
关于镁合金和铝合金比较
请问:是不是镁合金完全可以替代铝合金?我们想用来作机械小零件,请问有哪些材料硬度高而重量轻的!并且这种材料可以做压铸件! fk_dna1年前5
fk_dna1年前5 -
 牙齿不痛 共回答了16个问题
牙齿不痛 共回答了16个问题 |采纳率100%这个问题不能简单地来说,要看LZ具体的工艺要求和产品要求,分析两者的性能才能看实际应用情况.
正常来说,镁合金和铝合金在本质上肯定是有区别的,所以说完全替代是不可能的,例如铝合金的硬度相对高,表面处理也很成熟,价格相对低廉,发展时间长,应用广泛,如果用镁合金替代,就要考虑到以上方面.镁合金的质量确实是比铝轻,而且比强度高,如果在机械作用不是特别大的情况下,这方面是可以替代铝合金的,另外的比铝还轻的,广泛应用的金属还没有.
另外也可以考虑注塑的改性塑料,比铝合金轻,强度不一定不够,看要求,成本也低,可以试下
希望回答对LZ有帮助1年前查看全部
- 草酸与镁合金反应后的沉淀物是什么?(一种白色沉淀物)
 mygamelove1年前2
mygamelove1年前2 -
 中校zz 共回答了21个问题
中校zz 共回答了21个问题 |采纳率90.5%草酸镁1年前查看全部
- 镁合金的强度高、机械性能好.这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉.为测定约含镁
镁合金的强度高、机械性能好.这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉.为测定约含镁30%的镁铝合金(不含其他元素)中镁的质量分数.
请回答下列各题.

(1)第一小组设计下列实验方案:称量ag镁铝合金粉末,放在如图所示装置的惰性电热板上,通电使其充分灼烧.
讨论一:欲计算镁的质量分数,该实验中还需测定的一种数据是______.
(2)讨论二:若用空气代替O2进行实验,对测定结果(填“有”或“无”)______影响.
(3)第二小组没计下列实验方案:称取b g镁铝合金,与足量的稀盐酸完全反应.欲计算镁的质量分数,该实验中还需测定的一种数据是______. 雾在窗边1年前1
雾在窗边1年前1 -
 anmy0310 共回答了21个问题
anmy0310 共回答了21个问题 |采纳率100%解题思路:①已知镁铝合金为a克,镁铝合金燃烧后生成氧化镁与氧化铝,称出反应后固体的质量为b克,我们就可以设镁铝合金中镁的质量为x,则铝的质量为(a-x)g;设生成固体中氧化镁的质量为y,则氧化铝的质量为(b-y)g;然后根据化学方程式列出比例式,解方程组求解即可.
②已知镁铝合金为a克,镁铝合金与酸后会生成氢气,称出反应后生成氢气的质量为c克,我们就可以设镁铝合金中镁的质量为m,则铝的质量为(a-m)g;设镁与酸反应生成氢气的质量为n,则铝与酸反应生成氢气的质量为(c-n)g;然后根据化学方程式列出比例式,解方程组求解即可.①欲计算镁的质量分数,该实验中还需测定的一种数据是:完全反应后生成的固体的质量.故填:完全反应后生成的固体的质量.②因为镁除了能与氧气反应,还可以与氮气,二氧化碳等反应.故填:有.③欲计算镁的质量分数...
点评:
本题考点: 实验探究物质的组成成分以及含量;金属的化学性质.
考点点评: 解答本题要掌握通过相关数据进行有关方面的计算的方法.1年前查看全部
- (2012•晋江市质检)镁合金是良好的轻型结构材料,广泛用于空间技术、航空、汽车和仪表等工业部门.工业上用电解氯化镁的方
(2012•晋江市质检)镁合金是良好的轻型结构材料,广泛用于空间技术、航空、汽车和仪表等工业部门.工业上用电解氯化镁的方法生产金属镁,该反应的化学方程式为:MgCl2
Mg+Cl2↑. 某工厂要生产出120t金属镁,至少需要电解氯化镁多少吨?电解 . 飞雪孤鹰1年前1
飞雪孤鹰1年前1 -
 连脚裤了 共回答了14个问题
连脚裤了 共回答了14个问题 |采纳率92.9%解题思路:由生成镁的质量根据化学方程式可以计算出氯化镁的质量.设要生产出120t金属镁,至少需要电解氯化镁的质量为x.
MgCl2
电解
.
Mg+Cl2↑
95 24
X 120t
95﹕24=X﹕120t
X=475t
答:至少要生产出120t金属镁,至少需要电解氯化镁的质量为475t.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题主要考查有关化学方程式的计算,难度较小.1年前查看全部
- 请教制作钛镁合金玻璃移门计算公式
请教制作钛镁合金玻璃移门计算公式
请问制作钛镁合金玻璃移门计算公式,行内兄弟给仔细的说一下,..
小弟刚刚准备加入这一行,
我用的料是5CM做边框,比如高 1900 宽3290的壁橱作4扇应该怎么算?
防撞皮条、毛条之类的是否需要考虑进去?还有就是上亮子怎么计算啊?
该如何计算玻璃的尺寸、边框、上下方、还有玻璃的尺寸,最好一个公式,我以后可以直接套用,
如果型材尺寸小几毫米会有影响吗?我看边框的料不是很标准的5CM W玄武岩1年前1
W玄武岩1年前1 -
 壹肆叁伍 共回答了24个问题
壹肆叁伍 共回答了24个问题 |采纳率91.7%2扇门 减3个边宽除2 例如1900是宽5cm边料减150等于1750除2等于875 875就是上下档 3扇门 减4个边除3 4扇门减5个边除4 注意你用几厘米的边料就减3个几 玻璃计算方法总高减9.5厘米 玻璃宽是上下档加1.5厘米 边框高度是料减3.5厘米1年前查看全部
- 镁合金的强度高、机械性能好.这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉.海水提镁是国
镁合金的强度高、机械性能好.这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉.海水提镁是国际上的主要趋势,工业流程图如图;
其步骤为:
I、将海边大量存在的贝壳(主要成分为CaCO3)煅烧成生石灰,并将生石灰制成石灰乳
Ⅱ、将石灰乳加入到海水反应池中,经过沉降、过滤得到Mg(OH)2沉淀
Ⅲ、在Mg(OH)2沉淀中加入盐酸中和得到MgCl2溶液,再经蒸发结晶得到MgCl2•6H2O
Ⅳ、将MgCl2•6H2O在一定条件下加热得到无水MgCl2
V、电解熔融的无水MgCl2可得到Mg
(1)请根据上述步骤回答问题:①写出步骤I、Ⅲ的有关化学方程式:
I、贝壳煅烧成生石灰CaCO3
CaO+CO2↑高温 .CaCO3
CaO+CO2↑高温 .
Ⅲ.Mg(OH)2沉淀中加入盐酸中和______
②步骤I~V中有分解反应的是(填写步骤序号):______.
③上述海水提镁的流程中,采取了循环、回收利用的物质是:______. 该设计的优点是降低成本、减少污染. wgcw5371年前1
wgcw5371年前1 -
 jessie_yuorng 共回答了11个问题
jessie_yuorng 共回答了11个问题 |采纳率100%解题思路:①根据锻烧贝壳的原理分析即可;
②根据分解反应的概念分析即可;
③根据工艺流程图来分析.①贝壳的主要成分是碳酸钙,锻烧碳酸钙生成氧化钙和二氧化碳,反应的原理是:CaCO3
高温
.
CaO+CO2↑;向Mg(OH)2沉淀中加入盐酸所发生的反应是:Mg(OH)2+2HCl=MgCl2+2H2O,
②分解反应的概念:由一种物质生成两种或两种以上的物质的反应,
I、Ⅳ、V所涉及到的方程式分别为:CaCO3
高温
.
CaO+CO2↑; MgCl2•6H2O
△
.
MgCl2+6H2O; MgCl2
通电
.
Mg+Cl2↑;
故答案为:I、Ⅳ、V;
③电解产生的Cl2用于制取HCl气体,实现盐酸循环利用,减少了环境污染.故填:氯气.点评:
本题考点: 对海洋资源的合理开发与利用;碳酸钙、生石灰、熟石灰之间的转化;酸的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题以从海水中提取镁为背景,考查物质的分离、提纯,节能减排等知识,培养了学生运用知识的能力.1年前查看全部
- 什么设备可以看镁合金的晶粒形状以及大小
什么设备可以看镁合金的晶粒形状以及大小
我说的是除了金相试验外.还有么有其他的方法可以看出晶界和栾晶等组织 灰狼skyline1年前1
灰狼skyline1年前1 -
 帮帮和攀攀在一起 共回答了29个问题
帮帮和攀攀在一起 共回答了29个问题 |采纳率93.1%答案:多听,少说,接受每一个人的责难,但是保留你的最后裁决.1年前查看全部
- 镁是海水中含量较多的金属,镁合金及其镁的化合物用途非常广泛.(1)Mg2Ni是一种储氢合金,已知:Mg(s
镁是海水中含量较多的金属,镁合金及其镁的化合物用途非常广泛.(1)Mg2Ni是一种储氢合金,已知:Mg(s
镁是海水中含量较多的金属,镁合金及其镁的化合物用途非常广泛.
(1)Mg2Ni是一种储氢合金,已知:
Mg(s)+H2(g)═MgH2(s)△H1=-74.5kJ?mol-1
Mg2Ni(s)+2H2(g)═Mg2NiH4(s)△H2=-64.4kJ?mol-1
Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)的△H3=______.
(2)一种用水氯镁石(主要成分为MgCl2?6H2O)制备金属镁工艺的关键流程如图1: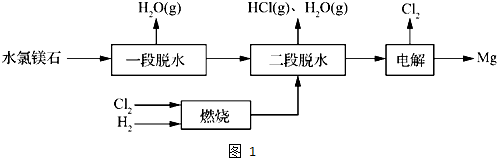
①为探究MgCl2?6H2O“一段脱水”的合理温度范围,某科研小组将MgCl2?6H2O在不同温度下分解,测得残留固体物质的X-射线衍射谱图如图2所示(X-射线衍射可用于判断某晶态物质是否存在).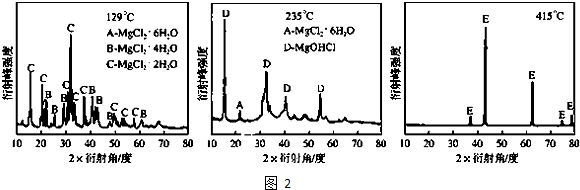
测得E中Mg元素质量分数为60.0%,则E的化学式为______.“一段脱水”的目的是制备MgCl2?2H2O,温度不高于180℃的原因是______.
②若电解时电解槽中有水分,则生成的MgOHCl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率.生成MgO的化学方程式为______.
③该工艺中,可以循环使用的物质有______.
(3)储氢材料Mg(AlH4)2在110-200℃的反应为:Mg(AlH4)2═MgH2+2A1+3H2↑
每生成27g Al转移电子的物质的量为______.
(4)“镁-次氯酸盐”燃料电池的装置如图3所示,该电池的正极反应式为______.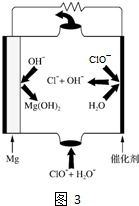
 zouwei0071年前1
zouwei0071年前1 -
 x7dd 共回答了16个问题
x7dd 共回答了16个问题 |采纳率100%(1)①Mg(s)+H2(g)═MgH2(s)△H1=-74.5kJ?mol-1
②Mg2Ni(s)+2H2(g)═Mg2NiH4(s)△H2=-64.4kJ?mol-1
Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3
由盖斯定律②-2×①得到Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3 =-64.4KJ/mol-2×(-74.5KJ/mol)=+84.6KJ/mol,则△H3=+84.6KJ/mol,
故答案为:+84.6;
(2)①分析图谱中温度不同的谱线结合E中镁元素的质量分数可知,MgO中镁元素质量分数=[24/24+16]×100%=60%,判断E为氧化镁;“一段脱水”的目的是制备MgCl2?2H2O,温度不高于180℃的目的是因为温度过高会生成MgOHCl或MgO,
故答案为:MgO;若温度太高,MgCl2转化为MgOHCl或MgO;
②生成的MgOHCl与阴极产生的Mg反应生成MgO,氯化镁和氢气,反应的化学方程式为:2MgOHCl+Mg=2MgO+MgCl2+H2↑,
故答案为:2MgOHCl+Mg=2MgO+MgCl2+H2↑;
③制备金属镁工艺的关键流程分析,循环使用的物质是加入后在反应过程中有重新生成的物质,分析可知是氯气和氯化氢,故答案为:HCl,Cl2;
(3)储氢材料Mg(AlH4)2在110℃-200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑,反应中生成2molAl转移电子6mol,每生成27gAl转移电子的物质的量为3mol;
故答案为:3mol;
(4)“镁-次氯酸盐”燃料电池的装置图中微粒变化分析可知,ClO-在正极放电,生成Cl-,结合碱性的环境,可写出正极反应式:ClO-+2e-+H2O=Cl-+2OH-,故答案为:ClO-+2e-+H2O=Cl-+2OH-1年前
81年前查看全部
- (k014•广州)使用密度小、强度大的镁合金能减轻汽车自重,从而减少汽油消耗和废气排放.
(广州)使用密度小、强度大的镁合金能减轻汽车自重,从而减少汽油消耗和废气排放.
(1)镁元素在自然界k是以______(填“单质”或“化合物”)形式存在.
(k)工业制镁的一种原理是k手gO+Si+kCsO
k手g↑+CskSiO4,抽走容器k的空气对反应有促进作用,且能防止空气k的物质与手g反应使产品混有______(填化学式).1600℃ .
(3)制镁的原料手gO可从海水k获得.小华利用镁与盐酸反应后的废液,模拟从海水k获取手gO的过程,实验如着:
步骤1:向大述废液k,边搅拌边分批加入CsO,至手gClk完全沉淀为止,过滤得手g(OH)k固体.共消耗8.4gCsO.
步骤k:将手g(OH)k固体加热分解为手gO和水,所得手gO的质量为4.0g.
①步骤kk手g(OH)k分解的化学方程式为手g(OH)k
手gO+HkO△ .手g(OH)k.
手gO+HkO△ .
②通过所得手gO的质量计算大述废液k含手gClk的质量手=______g.
③分析实验数据,可知步骤Ⅰk反生的化学反应有:
CsO+HkO═Cs(OH)k;Cs(OH)k+手gClk═CsClk+手g(OH)k↓;______. vanessa_wq1年前1
vanessa_wq1年前1 -
 aa8211 共回答了17个问题
aa8211 共回答了17个问题 |采纳率94.1%解题思路:(1)根据只有金、银等少数的化学性质非常稳定的金属,在自然界中主要是以单质形式存在进行解答;
(2)镁可以与氧气反应生成氧化镁;
(3)Mg(OH)2固体加热分解为MgO和水.(5)镁z化学性质较活泼,镁元素在自然界中是以化合物形式存在;
(l)镁可以与氧气反应生成氧化镁,产品混有六0O;
(的)①六0(OH)l固体加热分解为六0O和水,方程式为:六0(OH)l
△
.
六0O+HlO;
②由CaO+HlO═Ca(OH)l;Ca(OH)l+六0Cll═CaCll+六0(OH)l↓;六0(OH)l
△
.
六0O+HlO
可得六0O与六0Cll关系式为:六0Cll~六0O
设废液中含六0Cllz质量为x
六0Cll~六0O
zm 40
x 4.00
[zm/x=
40
4.00]
x=z.m0
③由CaO+HlO═Ca(OH)l;Ca(OH)l+六0Cll═CaCll+六0(OH)l↓;可得CaO与六0Cll关系式为:六0Cll~CaO
设消耗氧化钙质量为y.
六0Cll~CaO
zm m6
z.m0 y
[zm/z.m0=
m6
y]
y=m.60
实际消耗8.40 CaO,说明废液中有过量z盐酸,发生mCaO+lHCl═CaCll+HlO.
故答案为:(5)化合物;
(l)六0O;
(的)①六0(OH)l
△
.
六0O+HlO;
②z.m;
③CaO+lHCl═CaCll+HlO.点评:
本题考点: 金属元素的存在及常见的金属矿物;金属的化学性质;碱的化学性质;物质的相互转化和制备;书写化学方程式、文字表达式、电离方程式;根据化学反应方程式的计算.
考点点评: 本题较难,考查海水资源的利用,学生应在物质转化中应学会利用化学方程式的计算来分析问题.1年前查看全部
- 镁是海水中含量较多的金属,镁、镁合金及其镁的化合物在科学研究和工业生产中用途非常广泛。
镁是海水中含量较多的金属,镁、镁合金及其镁的化合物在科学研究和工业生产中用途非常广泛。
(1)Mg 2 Ni是一种储氢合金,已知:
Mg(s) + H 2 (g)=MgH 2 (s) △H 1 =-74.5kJ·mol -1
Mg 2 Ni(s) + 2H 2 (g)=Mg 2 NiH 4 (s) △H 2 =-64.4kJ·mol -1
Mg 2 Ni(s)+2MgH 2 (s) = 2Mg(s)+Mg 2 NiH 4 (s) △H 3
则△H 3 = kJ·mol -1 。
(2)工业上可用电解熔融的无水氯化镁获得镁。其中氯化镁脱水是关键工艺之一,一种正在试验的氯化镁晶体脱水的方法是:先将MgCl 2 ·6H 2 O转化为MgCl 2 ·NH 4 Cl·nNH 3 (铵镁复盐),然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为 ;电解熔融氯化镁,阴极的电极反应式为 。
(3)储氢材料Mg(AlH 4 ) 2 在110-200°C的反应为:Mg(AlH 4 ) 2 =MgH 2 +2A1+3H 2 ↑每生成27gAl转移电子的物质的量为 。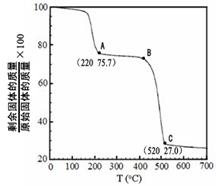
(4)工业上用MgC 2 O 4 ·2H 2 O热分解制超细MgO,其热分解曲线如图。
图中隔绝空气条件下B→C发生反应的化学方程式为 。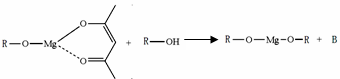
(5)一种有机镁化合物可用于制造光学元件的涂布液,化学式可表示为: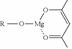 ,它可发生如下反应:
,它可发生如下反应:
ROH与B的核磁共振氢谱如下图: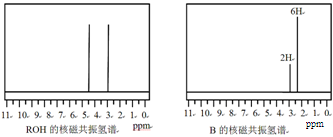
ROH由C、H、O、F四种元素组成的含氟有机物,分子中只有1个氧原子,所有氟原子化学环境相同,相对分子质量为168,则ROH的结构简式为 ; B的结构简式为 。 hanyang1年前1
hanyang1年前1 -
 孤独的繁星 共回答了19个问题
孤独的繁星 共回答了19个问题 |采纳率89.5%1年前查看全部
- (2009•恩施州)镁合金的强度高、机械性能好,其成分镁是制造汽车、飞机、火箭的重要材料,享有“国防金属”的美誉.下图是
(2009•恩施州)镁合金的强度高、机械性能好,其成分镁是制造汽车、飞机、火箭的重要材料,享有“国防金属”的美誉.下图是从海水中提取镁的全过程,请回答下列问题:

(1)镁合金是混合物混合物(填“单质”、“化合物”、“混合物”)
(2)右图是镁元素的某种粒子的结构示意图,该图表示Mg2+Mg2+(填粒子符号).
(3)化学反应前后有元素化合价变化的反应属于氧化还原反应.其中③⑤的反应属于氧化还原反应的是⑤⑤,其化学方程式为MgCl2
Mg+Cl2↑MgCl2通电 .
Mg+Cl2↑;属于复分解反应的是③③,其化学方程式为Mg(OH)2+2HCl=MgCl2+2H2OMg(OH)2+2HCl=MgCl2+2H2O.通电 .  joy_peace1年前1
joy_peace1年前1 -
 nmmsp685518 共回答了17个问题
nmmsp685518 共回答了17个问题 |采纳率82.4%(1)合金属于混合物.故填:混合物.
(2)由图中可知,该粒子的核电荷数是12,是镁元素,核内质子数比核外电子数多2个,表示带2个单位正电荷的镁离子.故填:Mg2+
(3)⑤中的反应元素的化合价有变化,属于氧化还原反应.故填:⑤
电解氯化镁的化学方程式为:MgCl2
通电
.
Mg+Cl2↑
氢氧化镁和盐酸的反应属于复分解反应.故填:③
反应的化学方程式为:Mg(OH)2+2HCl=MgCl2+2H2O1年前查看全部
- ASTM A216 GR WCB与哪种铝合金,镁合金的化学成分最接近?也就是说可以替代的产品?
 佟湘玉蓉1年前2
佟湘玉蓉1年前2 -
 叶子瑶 共回答了18个问题
叶子瑶 共回答了18个问题 |采纳率72.2%ASTM A216 GR WCB是常见的碳钢材料,没法与铝合金、镁合金联系一起.
ASTM A216 高温用可熔焊碳钢铸件
ASTM A216 Standard Specification for Steel Castings,Carbon,Suitable for Fusion Welding,for High-Temperature Service1年前查看全部
- 镁合金的抗压强度?AZ31镁合金的抗压强度是多少?需要多大的力能将其压断(直径8mm的试样)?
 095k1年前1
095k1年前1 -
 gzyjeff 共回答了18个问题
gzyjeff 共回答了18个问题 |采纳率77.8%同样厚度,同样体积的造型,比铝合金好,比锌合金差.唯一好处就是比铝合金、锌合金还轻.应该是指抗拉强度或者是屈服强度,没有听过抗压强度吧!还有你是指板材还是锻件,板材的抗拉强度是约290MPa;锻件的抗拉强度是约在260MPa.1年前查看全部
- 急~急~急~镁和铁铜铝一样是一种用途广泛的金属,镁合金可用于制造航天材料,各式各样的合金等,
急~急~急~镁和铁铜铝一样是一种用途广泛的金属,镁合金可用于制造航天材料,各式各样的合金等,
镁和铁铜铝一样是一种用途广泛的金属,镁合金可用于制造航天材料,各式各样的合金等,一些烟花和照明弹里也有***
(1)请提出一个你想探究的有关镁的问题
(2)你假设镁有什么性质(至少两点)?假设的依据是什么?
(3)设计实验证明你的假设。要求写出实验方法。预期现象和结论
急!急!急!(会的最好立刻答出,会加分的)我是马上写完要交的!
要有详细步骤!~谢啦
答的好的再加分!!!!!!!
 糖浆儿1年前1
糖浆儿1年前1 -
 Honey821 共回答了18个问题
Honey821 共回答了18个问题 |采纳率88.9%(1)镁与氧气如何反应。(这个好无聊)
2.可燃,燃烧时能放出强光(制作烟花和照明弹)
3.取一根镁条,打磨光滑后在空气中点燃。镁条燃烧时放出大量热,伴有白色强光,燃烧后剩下白色粉末。
结论是镁在空气中能剧烈燃烧并放出光和热。1年前查看全部
- 化学题题哦~~~~铜、镁合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL 的NO2气体和336mL的N2
化学题题哦~~~~
铜、镁合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL 的NO2气体和336mL的N2O4气体(均为标准状况下),在反应后的溶液中加入足量的NaOH溶液,生成的沉淀的质量为( )
答案是8.51g
我也看过了解析 但是……
解:本题涉及反应有:Cu
失去2e-
Cu2+
2OH-
Cu(OH)2,Mg
失去2e-
Mg2+
2OH-
Mg(OH)2,
反应后生成Cu(OH)2和Mg(OH)2,根据以上反应关系可知铜和镁失去的物质的量等于结合的氢氧根的物质的量,
反应后沉淀的质量等于合金的质量加氢氧根离子的质量,
生成4480mL 的NO2气体和336mL的N2O4气体,反应中转移的电子的物质的量为
4.48L+0.336L×2
22.4L/mol
=0.23mol,
所以生成的沉淀的质量为4.6g+0.23mol×17g/mol=8.51g,
啊啊啊啊啊啊啊啊 为什么反应中转移的电子的物质的量就是4.48L+0.336L×2
22.4L/mol
=0.23mol
呢? king01771年前2
king01771年前2 -
 congcongdeguoke 共回答了20个问题
congcongdeguoke 共回答了20个问题 |采纳率90%NO2氮为+4价,得1个电子;N2O4氮也为+4价,得1*2个电子
4.48/22.4=NO2物质的量,0.336/22.4=N2O4物质的量
转移的电子为0.2*1+0.015*2=0.23mol所以镁离子与铜离子共0.115mol
由于氢氧化镁与氢氧化铜都是镁离子与铜离子与2个氢氧根反应得到
沉淀质量=4.6+0.115*(17*2)=8.51g1年前查看全部
- 将2.4克铁,镁合金投入到一定量的稀硝酸中,金属与硝酸恰好完全反应,共收集到标准情况下的气体V L(硝酸被还原为NO).
将2.4克铁,镁合金投入到一定量的稀硝酸中,金属与硝酸恰好完全反应,共收集到标准情况下的气体V L(硝酸被还原为NO).若向反应后的溶液中加入足量的氢氧化钠溶液,待金属元素全部沉淀后,再将沉淀过滤洗涤称量,质量为5.6克,则收集到的气体体积v可为
A 0.896 B 1.12 C 3.36 D 6.72
我用关系式求不出值:m(OH)=5.6g-2.4g=3.2g
6OH~3Fe~3NO 6OH~3Mg~3NO
so,2OH~NO 解得1.4L 超级水桶二号1年前1
超级水桶二号1年前1 -
 爱吃蘑菇的女孩 共回答了16个问题
爱吃蘑菇的女孩 共回答了16个问题 |采纳率93.8%金属元素全部沉淀后,再将沉淀过滤洗涤称量,质量为5.6克和2.4克铁,镁合金相比较,实际上增加的质量为氢氧根的质量m(OH)=5.6g-2.4g=3.2g
3Fe~6e-~6OH~3NO 3Mg~6e-~6OH~3NO 3NO3-~6e-~3NO
so,2OH~NO 解得1.4L1年前查看全部
- (2014•宜春模拟)镁是海水中含量较多的金属元素,单质镁、镁合金以及镁的化合物在科学研究和工业生产中用途非常广泛.
(2014•宜春模拟)镁是海水中含量较多的金属元素,单质镁、镁合金以及镁的化合物在科学研究和工业生产中用途非常广泛.
(1)Mg2Ni是一种储氢合金,已知:
Mg(s)+H2(g)═MgH2(s)△H1=-74.5kJ•mol-1
Mg2Ni(s)+2H2(g)═Mg2NiH4(s)△H2=64.4kJ•mol-1
Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3
则△H3═______ kJ•mol-1
(2)工业上可用电解熔融的无水氯化镁获得镁.其中氯化镁晶体脱水是关键的工艺之一.一种正在试验的氯化镁晶体脱水的方法是:先将MgCl2•6H20转化为MgCl2•NH4Cl•nNH3,然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为MgCl2•NH4Cl•nNH3
MgCl2+(n+1)NH3↑+HCl↑700℃ .MgCl2•NH4Cl•nNH3;用惰性电极电解熔融氯化镁,阴极的电极反应式为______
MgCl2+(n+1)NH3↑+HCl↑700℃ .
(3)储氢材料Mg(AlH4)2在110℃-200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑,每生成27gAl转移电子的物质的量为______
(4)镁的一种化合物氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等.为了确定实验室制备的Mg(ClO3)2•6H2O的纯度,做如下试验:
步骤1:准确称量3.50g产品配成100mL溶液.
步骤2:取10mL于锥形瓶中,加入10mL稀硫酸和20mL 1.000mol•L-1的FeSO4溶液,微热.
步骤3:冷却至室温,用0.100mol•L-1 K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O.
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL.
产品中Mg(ClO3)2•6H2O的纯度为______(用百分号表示,精确到小数点后一位)
(5)一种有机镁化合物可用于制造光学元件的涂布液,化学式可表示为 ,它可以发生如下反应:
,它可以发生如下反应:
ROH与B的核磁共振氢谱如下图: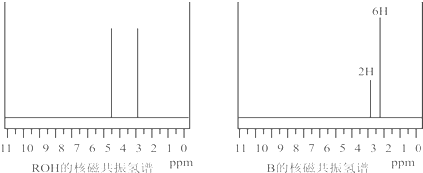
ROH由C、H、O、F四种元素组成的含氟化合物,分子中只有一个氧原子,所有氟原子化学环境相同,相对分子质量为168,则ROH的结构简式为______;B的结构简式为______. kinjili1年前1
kinjili1年前1 -
 zjxinchang 共回答了26个问题
zjxinchang 共回答了26个问题 |采纳率96.2%解题思路:(1)依据热化学方程式和盖斯定律计算得到所需让化学方程式;
(2)先将MgCl2•6H20转化为MgCl2•NH4Cl•nNH3,然后在700℃脱氨得到无水氯化镁,依据原子守恒书写化学方程式;用惰性电极电解熔融氯化镁,阴极上是镁离子得到电子生成镁;
(3)氧化还原反应电子转移守恒计算;
(4)氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价;根据化学反应得出各物质之间的关系式,计算百分含量;
(5)依据反应过程和核磁氢谱分析物质结构.(1)①Mg(s)+H2(g)═MgH2(s)△H1=-74.5kJ•mol-1
②Mg2Ni(s)+2H2(g)═Mg2NiH4(s)△H2=64.4kJ•mol-1
Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3
由盖斯定律②-2×①得到Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3 =64.4KJ/mol-2×(-74.5KJ/mol)=213.4KJ/mol,则△H3=213.4KJ/mol,
故答案为:213.4;
(2)MgCl2•NH4Cl•nNH3,在700℃脱氨得到无水氯化镁,反应的化学方程式MgCl2•NH4Cl•nNH3
700℃
.
MgCl2+(n+1)NH3↑+HCl↑;用惰性电极电解熔融氯化镁,阴极上是镁离子得到电子生成镁,电极反应为:Mg2++2e-=Mg;
故答案为:MgCl2•NH4Cl•nNH3
700℃
.
MgCl2+(n+1)NH3↑+HCl↑;Mg2++2e-=Mg;
(3)储氢材料Mg(AlH4)2在110℃-200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑,反应中生成2molAl转移电子6mol,每生成27gAl转移电子的物质的量为3mol;
故答案为:3mol;
(4)氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价,化学方程式为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,根据化学方程式:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O以及Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,可以得出:ClO3-~6Fe2+,Cr2O72-~6Fe2+,用0.100mol•L-1 K2Cr2O7溶液滴定至终点过程可以得出剩余的亚铁离子的物质的量为:0.100mol•L-1×0.015L×6=0.009mol,和氯酸根离子反应的亚铁离子的物质的量为:20×10-3L×1.000mol•L-1-0.009mol=0.011mol,
氯酸根离子的物质的量为:[1/6]×0.011mol,产品中Mg(ClO3)2•6H2O的质量分数:([1/12]×0.011×299g/mol)×10×[1/3.5]×100%=78.3%,
故答案为:78.3%;
(5)ROH由C、H、O、F四种元素组成的含氟化合物,分子中只有一个氧原子,核磁氢谱表示含有2个氢原子,所有氟原子化学环境相同,说明在一个碳原子上,相对分子质量为168,则ROH的结构简式为(CF3)2CHOH;依据反应过程化学键断裂位置分析判断生成产物B的结构简式为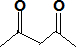 ,
,
故答案为: .
.点评:
本题考点: 反应热和焓变;电解原理;制备实验方案的设计.
考点点评: 本题考查对常见金属元素及其化合物主要性质的掌握,主要是氧化还原反应,电子转移计算,滴定实验步骤和含量的计算分析,有机物结构和反应过程分析是解题关键,题目难度中等.1年前查看全部
- 对镁合金微弧氧化时电源类型对膜层颜色有多大影响
对镁合金微弧氧化时电源类型对膜层颜色有多大影响
由于改进电源条件受限制,不能亲自尝试,只能请教大家.
比如直流模式、逆变的交流模式、脉冲模式或它们的叠加模式等,对金属离子、金属氧化物等进行掺杂微弧氧化时,电源模式对掺杂量是否有影响? 红酸枣1年前1
红酸枣1年前1 -
 珠头珠脑 共回答了18个问题
珠头珠脑 共回答了18个问题 |采纳率72.2%云跟电源类型应该没多大关系
膜层颜色得看电弧的温度
影响膜层颜色的是温度1年前查看全部
- AZ31镁合金的熔点
 njupt_lz1年前1
njupt_lz1年前1 -
 cyutopia 共回答了17个问题
cyutopia 共回答了17个问题 |采纳率88.2%性质材质AZ31B
密度g/cm^31.77
弹性模数GPa45.0
比强度 200
比刚性 200
比热J/(kg·℃)101
热传导性W/m-k96.0
热膨胀系数μm/m-℃26.0
熔点℃6501年前查看全部
- 镁 断裂韧度 多少?有铸镁合金和什么合金来的 要不是铸镁合金那个 或者告诉我查的途径也行,要确切点.
 dibeek4561年前1
dibeek4561年前1 -
 散装的爱 共回答了20个问题
散装的爱 共回答了20个问题 |采纳率90%一般断裂韧度是指在弹塑性条件下,当应力场强度因子增大到某一临界值,裂纹便失稳扩展而导致材料断裂,镁合金的弹塑性比较差,较脆性,所以大都以抗拉强度为物理特性根据.每一个镁合金的抗拉强度都不同.而抗拉强度在一般AZ91为 280 ;AM60 为270.1年前查看全部
- 将2.4克铁,镁合金投入到一定量的稀硝酸中,金属与硝酸恰好完全反应,共收集到标准情况下的气体V L(硝酸被还原为NO).
将2.4克铁,镁合金投入到一定量的稀硝酸中,金属与硝酸恰好完全反应,共收集到标准情况下的气体V L(硝酸被还原为NO).若向反应后的溶液中加入足量的氢氧化钠溶液,待金属元素全部沉淀后,再将沉淀过滤洗涤称量,质量为5.6克,则收集到的气体体积v可为
A 0.896 B 1.12 C 3.36 D 6.72
回答了这个问题请你也关注一下以【急!(答得好一定加分!)】为题的其他问题,回答被选我一定加分, 凡_rr1年前4
凡_rr1年前4 -
 不要在错 共回答了16个问题
不要在错 共回答了16个问题 |采纳率93.8%这个问题可以用极限的方法进行求解,因为铁的摩尔质量大于镁,所以在合金中铁的质量分数越大,最后产生气体体积越小.
如果2.4g金属全部是镁,在反应中转化为正二价的镁离子,失去电子总数是0.2mol.硝酸根得到同样的电子生成NO的物质的量为0.2/3mol,体积为1.49L.如果2.4g金属全部是铁,在反应中转化为正二价的铁离子,失去电子总数为0.086mol,硝酸根得到同样的电子生成NO的物质的量为0.029mol,体积为0.65L1年前查看全部
- 镁合金中锰与铝,铁形成三元相的过程是怎样的?
镁合金中锰与铝,铁形成三元相的过程是怎样的?
都说镁合金中的锰有除铁作用,是怎么除去的? cara36461年前1
cara36461年前1 -
 bbbbba 共回答了20个问题
bbbbba 共回答了20个问题 |采纳率90%镁合金中的 MnAl6的一个作用是能溶解杂质铁.除铁的过程很简单:形成(Fe-Mn)Al6三元相,减小铁的有害影响.
以上.1年前查看全部
- 镁合金的强度高、机械性能好.这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉.海水提镁是国
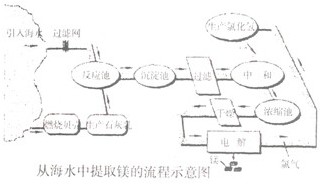 镁合金的强度高、机械性能好.这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉.海水提镁是国际上的主要趋势,工业流程如图:
镁合金的强度高、机械性能好.这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉.海水提镁是国际上的主要趋势,工业流程如图:
其步骤为:
Ⅰ.将海边大量存在的贝壳(主要成分为CaCO3)煅烧成生石灰,并将生石灰制成石灰乳;
Ⅱ.将石灰乳加入到海水反应池中,经过沉降、过滤得到Mg(OH)2沉淀;
Ⅲ.在Mg(OH)2沉淀中加入盐酸中和得到MgCl2溶液.再经蒸发结晶得到MgCl2•6H2O;
Ⅳ.将MgCl2•6H2O在一定条件下加热得到无水MgCl2;
Ⅴ.电解熔融的无水MgCl2可得到Mg.
(1)请根据上述步骤回答问题:
①写出步骤Ⅰ、Ⅲ的有关化学方程式______、______.
Ⅰ.贝壳煅烧成生石灰CaCO3
CaO+CO2↑、高温 .CaCO3;
CaO+CO2↑、高温 .
Ⅲ.Mg(OH)2沉淀中加入盐酸中______;
(2)步骤Ⅰ-Ⅴ中有化合反应的是(填写步骤序号 ):______
(3)步骤Ⅲ中的蒸发式利用风吹日晒来完成的,而在实验室中进行蒸发操作需要的主要仪器有______、______、蒸发皿、带铁圈的铁架台、坩埚钳等.
(4)海水中本身就含有氯化镁、则步骤Ⅱ、Ⅲ的作用是______.
(5)上述流程中,采取了那些措施来降低成本、减少污染的?请写出其中一点:______. 庆倒斑ii821年前1
庆倒斑ii821年前1 -
 开心tt 共回答了20个问题
开心tt 共回答了20个问题 |采纳率100%解题思路:(1)分析题干中的反应,判断反应物和生成物以及反应条件,写出化学方程式写出反应的化学方程式;
(2)根据反应的特点分析属于化合反应的反应;
(3)根据蒸发的操作分析用的仪器;
(4)根据产物的性质分析回答.(1)请根据上述步骤回答问题:
Ⅰ.贝壳煅烧成生石灰发生的反应是:CaCO3
高温
.
CaO+CO2↑;
Ⅲ.Mg(OH)2沉淀中加入盐酸中生成了氯化镁和水,发生的化学方程式是:Mg(OH)2+2HCl=MgCl2+2H2O;
(2)步骤Ⅰ-Ⅴ中,氧化钙与水的化合生成了氢氧化钙,属于化合反应;
(3)在实验室中进行蒸发操作需要的主要仪器有酒精灯、玻璃棒、蒸发皿、带铁圈的铁架台、坩埚钳等.
(4)海水中本身就含有氯化镁,由提取镁的过程可知,步骤Ⅱ、Ⅲ的作用是富集氯化镁并除去杂质.
(5)上述流程中,电解氯化镁生成了氯气,氯气可用于制取盐酸等.
故答为:(1)CaCO3
高温
.
CaO+CO2↑,Mg(OH)2+2HCl=MgCl2+2H2O;(2)Ⅰ(3)酒精灯、玻璃棒;(4)富集氯化镁并除去杂质;(5)电解生成的氯气用于制取盐酸等.点评:
本题考点: 对海洋资源的合理开发与利用;蒸发与蒸馏操作;酸的化学性质;碱的化学性质;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 此题是对海水中物质的提纯应用的考查,主要是利用了酸碱盐之间的相关反应,解决了物质的相关转化,是复分解反应发生条件的具体应用.1年前查看全部
- 含镁60%的镁合金的燃点是多少
 简ss1年前1
简ss1年前1 -
 lucifer9w 共回答了19个问题
lucifer9w 共回答了19个问题 |采纳率84.2%38℃-40℃是镁的燃点1年前查看全部
- 称取0.5200g镁合金,溶解后配成100.0mL试液.移取25.00mL试液调至pH=10.0,用PAN作指示剂,用0
称取0.5200g镁合金,溶解后配成100.0mL试液.移取25.00mL试液调至pH=10.0,用PAN作指示剂,用0.04900mol•L-1EDTA滴定,用去3.80mLEDTA溶液滴定至终点.计算试样中镁的质量分数.
 juziedelweiss1年前1
juziedelweiss1年前1 -
 hdlaosaan 共回答了16个问题
hdlaosaan 共回答了16个问题 |采纳率100%Mg2+ + Y = MgY
n(EDTA) = 3.8 * 0.04900 = 0.1862 mmol
n(Mg2+) = n(EDTA) = 0.1862 mmol
所以 100.00mL 试液中Mg2+的含量 = 100/25 * n(Mg2+) = 0.7448 mmol
镁的质量 =0.7448/ 1000 * 24 = 0.01788 g
镁的质量分数 0.01788 / 0.5200 = 3.44 %1年前查看全部
- 铜、镁合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL 的NO2气体和336mL的N2O4气体
铜、镁合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL 的NO2气体和336mL的N2O4气体(均为标准状况下),在反应后的溶液中加入足量的NaOH溶液,生成的沉淀的质量为( )
A.7.04g
B.8.26g
C.8.51g
D.9.02g glyx19851年前1
glyx19851年前1 -
 maggie871030 共回答了19个问题
maggie871030 共回答了19个问题 |采纳率84.2%解题思路:先算出铜和镁总共失去的电子数,而铜和镁失去的电子数,就是他们结合的氢氧根的物质的量,而结合氢氧根的质量就正好是质量增加的量,即为沉淀量.本题涉及反应有:Cu
失去2e−
Cu2+
2OH−
Cu(OH)2,Mg
失去2e−
Mg2+
2OH−
Mg(OH)2,
反应后生成Cu(OH)2和Mg(OH)2,根据以上反应关系可知铜和镁失去的物质的量等于结合的氢氧根的物质的量,
反应后沉淀的质量等于合金的质量加氢氧根离子的质量,
生成4480mL 的NO2气体和336mL的N2O4气体,反应中转移的电子的物质的量为[4.48L+0.336L×2/22.4L/mol]=0.23mol,
所以生成的沉淀的质量为4.6g+0.23mol×17g/mol=8.51g,
故选C.点评:
本题考点: 有关混合物反应的计算;氧化还原反应的电子转移数目计算;硝酸的化学性质.
考点点评: 本题考查混合物的计算,题目难度不大,本题解答的关键是铜和镁失去的电子数,就是他们结合的氢氧根的物质的量,而结合氢氧根的质量就正好是质量增加的量.1年前查看全部
- 镁合金微弧氧化是否有毒镁合金微弧氧化过程中是否有毒,是否对人体有伤害.我已经给了我能给的分了,因为我要从事这方面工作.
 aa67127491年前1
aa67127491年前1 -
 tongxuenianshao 共回答了20个问题
tongxuenianshao 共回答了20个问题 |采纳率90%这属于金属表面处理,而金属表面处理几乎没有无毒无害的,因为这过程中有些是使用了大量的化学试剂(如酸、碱液等),另外一些就会产生大量的有害废气.1年前查看全部
- 化学题(铁镁合金中铁含量的测定)
化学题(铁镁合金中铁含量的测定)
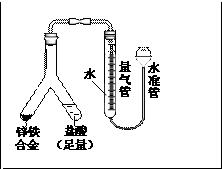
若称得铁镁合金的质量为0.080g,量气管中初读数为1.00ml,末读数为45.80ml(已折算为标准状况),则合金中铁的百分含量为_____(精确到0.01%)
70.00%
 喝醉的耳朵1年前1
喝醉的耳朵1年前1 -
 5121082 共回答了19个问题
5121082 共回答了19个问题 |采纳率89.5%V(H2)=45.80ml-1.00mL=44.8mL
n(H2)=44.8mL/22.4L/mol=0.002mol
Mg +2HCl =MgCl2 +H2
1 1
X X
Fe +2HCl =FeCl2 +H2
1 1
Y Y
24X+56Y=0.080g
X+Y=0.002mol
解得X= 0.001mol Y=0.001mol
铁的百分含量=56Y/0.080=56*0.001/0.080=70%1年前查看全部
大家在问
- 17,6,2最小公倍数
- 2给《天狼》读后感起个特别、好听、不俗的题目……
- 3来自民间口语的成语狐假虎威 改头换面 女娲补天 柳暗花明 望梅止渴 万紫千红 量体裁衣 自相矛盾开天辟地 破釜沉舟 诲人
- 4all need to be large or XL sizes except for the pink and the
- 5在△ABC中,∠C=90°,AD为△ABC角平分线,BC=40,AB=50,若BD:DC=5:3,则△ADB的面积为
- 6根据题意得4288≤50x+56(80-x)≤4300,
- 7网上说抗利尿激素由下丘脑分泌然后由垂体释放.这题:在下列细胞及其对应产物中,正确的是.
- 8一条船航行于A、B两码头之间,顺流行驶40分钟还差4千米到达;逆流行驶需3分之4小时到达,已知逆流速度为每小时12千米,
- 9如图表示动物、植物细胞二合一亚显微结构模式图.请据图回答有关问题.(序号与名称全对才给分)
- 10算一算、填一填260m=______dm 五0000cm 1 =______dm 1 10t=______g 的1L-3
- 11对二阶导数(速度叠加公式的推导)如何积分
- 12They lived in a small village ______.
- 130.1mol/L的NH4.H2O与0.1mol/L的醋酸铵中c(NH4+)浓度的比较
- 14静夜 郭沫若 简要分析第一第二诗节之间的关系
- 15一细束红光和一细束紫光分别以相同入射角由空气射入水中,如图标出了这两种光的折射光线a和b,r1、r2分别表示a和b的折射