草酸钠与硫酸钙反应化学式
 ann511392022-10-04 11:39:543条回答
ann511392022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 pingergirl77 共回答了19个问题
pingergirl77 共回答了19个问题 |采纳率84.2%- Na2C2O4+CaSO4=CaC2O4(下箭头)+Na2SO4
- 1年前
 xiaoyesai 共回答了197个问题
xiaoyesai 共回答了197个问题 |采纳率- 草酸钠与硫酸钙反应化学方程式:
Na2C2O4+CaSO4=CaC2O4↓+Na2SO4 - 1年前
 差12点一刻 共回答了91个问题
差12点一刻 共回答了91个问题 |采纳率- Na2C2O4 + CaSO4= CaC2O4↓+Na2SO4
- 1年前
相关推荐
- 用草酸钠基准物质标定0.002mol/L的高锰酸钾标准溶液,请计算需要基准物质的称量范.
 DYPYY1年前1
DYPYY1年前1 -
 cheng4235 共回答了18个问题
cheng4235 共回答了18个问题 |采纳率88.9%没有给定基本单元,假设C(KMnO4)=0.002mol/L,滴定分析要求消耗标准溶液体积在20—40毫升范围内,滴定反应:
5Na2C2O4 + 2KMnO4 + 16H+ =2Mn^2+ + 10CO2 + 8H2O
5 2
m/134.00 0.002*20/1000
m=0.0134g 同理可算出当V=40ml时,m=0.0268g
当消耗标准溶液体积在20—40毫升范围内时,称样范围是0.0134—0.0268克.1年前查看全部
- 加热草酸钠制取一氧化碳,同时生成碳酸钠.
加热草酸钠制取一氧化碳,同时生成碳酸钠.
加热草酸钠制取一氧化碳,同时生成碳酸钠写出该反应的化学方程式 ngsdfa1年前4
ngsdfa1年前4 -
 非凡莹 共回答了19个问题
非凡莹 共回答了19个问题 |采纳率89.5%Na2C2O4=Na2CO3+CO↑(加热)1年前查看全部
- 0.01N的草酸钠怎么配制0.01N的高锰酸钾怎么配制
 lxzs20051年前1
lxzs20051年前1 -
 fence119 共回答了22个问题
fence119 共回答了22个问题 |采纳率95.5%检验水质实验报告
实验名称:水中化学耗氧量(COD)测定
实验目的:1、巩固滴定操作成果
2、了解水体及水体污染的初步知识
3、通过对水中化学耗氧量的测定,了解不同水体受污染的程度,从而激发和增强环保意识
实验原理:利用氧化还原反应的原理,测算水中的化学耗氧量(COD).当DO≤4时,鱼类即无法生存.
实验仪器:铁架台、酒精灯、石棉网、移液管、洗耳球、10ml量筒、100ml量筒、烧杯、锥形瓶、胶头滴管、酸式滴定管、碱式滴定管、100ml酸式容量瓶、100ml 碱式容量瓶、玻璃棒
实验药品:高锰酸钾溶液、稀硫酸、草酸钠溶液、蒸馏水、河水水样
水样来源:杭州西溪河
实验操作:1、分别用浓度为0.1N的KMnO4溶液与Na2C2O4溶液配制为0.01N的溶液,置于100ml的容量瓶中;
2、将配制好的溶液倒入滴定管中,并调零(KMnO4溶液置于酸式滴定管中,Na2C2O4溶液置于碱式滴定管中);
3、取充分摇匀的废水样100ml置于250ml锥形瓶中,并向瓶中加入5 ml以1∶3配制的H2SO4溶液,使其均匀混合;
4、自滴定管中加入体积为V0的KMnO4溶液,摇匀,并立即放入沸水浴中加热(沸水浴液面要高于瓶内溶液液面)在此过程中,溶液必须保持淡红色,否则应向瓶中再加入KMnO4溶液;
5、 30分钟后,取出锥形瓶,并趁热向其中滴加10ml0.01N的Na2C2O4 标准溶液,摇匀后,立即用0.01N的KMnO4溶液滴定至溶液呈粉红色并半分钟不褪色,记录滴定所耗0.01N的KMnO4溶液的体积,记作V1;
6、再向溶液中滴加10ml0.01N的Na2C2O4标准溶液,并用0.01N的KMnO4溶液滴定至溶液呈粉红色,记录滴定所耗KMnO4溶液的体积,记作V2,以此测定KMnO4溶液的校正系数K=10.00/ V2;
7、计算DO指数:DO=[(V0+ V1)K-10.00]*0.01*8*1000/100;(K值应略小于1);
8、进行三到四次平行操作.
三次平行实验所测数据
V0 V1 V2 K DO
第一次 37.96 17.19 12.68 0.789 26.81
第二次 38.77 15.79 12.26 0.816 27.62
第三次 33.28 16.51 10.55 0.948 29.76
平均值 28.071年前查看全部
- (2011•龙岩模拟)实验室中,通常以草酸钠(Na2C2O4)为标准液,通过氧化还原滴定来测定高锰酸钾溶液的浓度,其反应
(2011•龙岩模拟)实验室中,通常以草酸钠(Na2C2O4)为标准液,通过氧化还原滴定来测定高锰酸钾溶液的浓度,其反应的化学方程式为:C2O42-+MnO4-+H+-Mn2++CO2↑+H2O(未配平)下列有关草酸钠滴定高锰酸钾实验的叙述,正确的是( )
A.滴定过程中,高锰酸钾被氧化,草酸钠被还原
B.温度需超过100℃,草酸钠与高锰酸钾才会反应
C.反应中,消耗的草酸钠与高锰酸钾的物质的量之比为5:2
D.为便于滴定终点的判断,滴定时必须往体系中加入指示剂 风神3211年前1
风神3211年前1 -
 sherlockqi 共回答了16个问题
sherlockqi 共回答了16个问题 |采纳率93.8%解题思路:A、高锰酸钾具有强氧化性,能将草酸钠氧化;
B、草酸钠滴定高锰酸钾常温下就可以反应,实验必须在室温下进行;
C、化学反应中的是电子的数目必须相等;
D、进行滴定实验时,指示剂的加入必须是根据反应物的特点来选择的.A、高锰酸钾具有强氧化性,草酸具有还原性,高锰酸钾能将草酸钠氧化,高锰酸钾被还原,草酸钠被氧化,故A错误;
B、滴定实验必须在常温条件下发生,草酸钠与高锰酸钾的反应常温下即可发生,故B错误;
C、高锰酸钾中的锰离子由+7价降为+2价,共得到5mol电子,草酸钠中碳元素的化合价由+3价升为+4价,共失去2mol电子,要使得失电子守恒,消耗的草酸钠与高锰酸钾的物质的量之比应为5:2,故C正确;
D、高锰酸钾本身为紫红色,以草酸钠(Na2C2O4)为标准液进行滴定时,滴定终点的判断依据是紫红色消失,不需要加指示剂,故D错误.
故选C.点评:
本题考点: 氧化还原反应;中和滴定.
考点点评: 本题是一道有关氧化还原反应知识的题目,反应的考查结合了滴定实验,要求学生具有分析和解决问题的能力.1年前查看全部
- 草酸钠与硫酸钙化学反应方程式?
 daerm1年前1
daerm1年前1 -
 鲤鱼007 共回答了23个问题
鲤鱼007 共回答了23个问题 |采纳率82.6%Na2C2O4+CaSO4=CaC2O4+Na2SO4
这里反应生成更难溶的CaC2O4,不用加沉淀号1年前查看全部
- 请问在过氧化氢酶活性的测定中,标定0.1mol/l的高锰酸钾标准溶液时,需要大概消耗多少毫升草酸钠?
 anan661年前2
anan661年前2 -
 ch5k1 共回答了20个问题
ch5k1 共回答了20个问题 |采纳率100%称取经110℃烘干2小时,并于干燥器中冷却至室温的保证试剂草酸钠0.1340克(即相当20毫克当量)置于250ml锥形瓶中,加水30ml和硫酸(1:4)10ml溶解,加热至70~80℃,用欲标定的高锰酸钾滴定至溶液呈微玫瑰红色能保持30秒即为终点.同时做空白.1年前查看全部
- 草酸钠测定高锰酸钾含量最后,为什么只要半分钟内不退色就行了
 ownname1年前2
ownname1年前2 -
 有278把洋伞 共回答了19个问题
有278把洋伞 共回答了19个问题 |采纳率94.7%高锰酸钾是氧化性物质,空气里含有很多还原性气体如二氧化碳,一般都是以30秒为基准1年前查看全部
- 向硫酸酸化的高锰酸钾溶液中加入草酸钠溶液的现象
 门前白兔儿1年前1
门前白兔儿1年前1 -
 清烟漫漫水溶溶 共回答了16个问题
清烟漫漫水溶溶 共回答了16个问题 |采纳率106.3%溶液褪色并产生气泡(CO2).1年前查看全部
- 在硫酸介质中,基准物质草酸钠201.0mg,用KMnO4溶液滴定至终点,消耘其体积30.00mL,
在硫酸介质中,基准物质草酸钠201.0mg,用KMnO4溶液滴定至终点,消耘其体积30.00mL,
,计算KMnO4标准溶液的浓度(单位:mol/L). 爱心笔记本1年前2
爱心笔记本1年前2 -
 -听竹- 共回答了9个问题
-听竹- 共回答了9个问题 |采纳率100%2KMnO4 + 5Na2C2O4 +8H2SO4====K2SO4+2MnSO4+5Na2SO4+10CO2+8H2O
2 5
CV 0.2010/134=0.0015mol
c=0.02mol/L1年前查看全部
- 已知酸性高锰酸钾溶液可以和草酸钠、二氧化硫等物质发生氧化还原反应。
已知酸性高锰酸钾溶液可以和草酸钠、二氧化硫等物质发生氧化还原反应。
(1)酸性高锰酸钾溶液和草酸钠反应的离子反应式为:MnO 4 - +C 2 O 4 2- +H + →CO 2 ↑+Mn 2+ +H 2 O(未配平) 现称取草酸钠(Na 2 C 2 O 4 )样品,1. 34g溶于稀硫酸中,然后用0.20 mol/L的高锰酸钾溶液滴定(其中的杂质不跟高锰酸钾和稀硫酸反应),达到终点时消耗 了15.00 mL的高锰酸钾溶液。
①判断滴定达到终点时的现象是_________________; ②样品中草酸钠的质量分数为___________。
(2)请写出酸性高锰酸钾和二氧化硫反应的离子反应方程式,并标出电子转移的方向和数目:
_____________________。 heluliang1年前0
heluliang1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 用高锰酸钾滴定草酸钠时,为什么温度要保持在75~85左右?
 好想多爱你一点1年前1
好想多爱你一点1年前1 -
 碰碰 共回答了16个问题
碰碰 共回答了16个问题 |采纳率100%加热的目的主要是加快反应速度,但温度不易过高,否则草酸钠在酸性环境下自身发生氧化-还原分解1年前查看全部
- 为什么不能用草酸钠标定盐酸
 ic0olcbf1年前2
ic0olcbf1年前2 -
 duanhaixiang 共回答了26个问题
duanhaixiang 共回答了26个问题 |采纳率92.3%标定盐酸需要用稳定的碱性的化合物
草酸钠不与盐酸反应
草酸钠用来标定氧化剂 因为草酸跟会被定量氧化为CO2 盐酸无氧化性1年前查看全部
- 测定草酸钠中是否含氯离子的方法有?
 mark8714551年前1
mark8714551年前1 -
 haoini 共回答了19个问题
haoini 共回答了19个问题 |采纳率89.5%取一点点样品,加入适量水,再向制成的溶液中滴加“硝酸酸化的硝酸银溶液”,会产生白色沉淀,一段时间后,滴加盐酸,沉淀溶解,说明有氯离子1年前查看全部
- 实验室中,通常以草酸钠(Na 2 C 2 O 4 )为标准液,通过氧化还原滴定来测定高锰酸钾溶液的浓度,其反应的化程程为
实验室中,通常以草酸钠(Na 2 C 2 O 4 )为标准液,通过氧化还原滴定来测定高锰酸钾溶液的浓度,其反应的化程程为:C 2 O 4 2— +MnO 4 — +H + —Mn 2+ +CO 2 ↑+H 2 O(未配平)下列有关草酸钠滴定高锰酸钾实验的叙述,正确的是
A.配制草酸钠标准液时,直接将Na 2 C 2 O 4 固体溶于容量瓶的水中即可 B.滴定过程中,高锰酸钾被氧化,草酸钠被还原 C.该反应中,消耗的草酸钠与高锰酸钾物质的量之比为5:2 D.为便于滴定终点的判断,滴定时必须往体系中加入指示剂  611281年前1
611281年前1 -
 sallylbx 共回答了17个问题
sallylbx 共回答了17个问题 |采纳率88.2%C
分析:A、高锰酸钾具有强氧化性,能将草酸钠氧化;
B、草酸钠滴定高锰酸钾常温下就可以反应,实验必须在室温下进行;
C、化学反应中的是电子的数目必须相等;
D、进行滴定实验时,指示剂的加入必须是根据反应物的特点来选择的.
A、高锰酸钾具有强氧化性,草酸具有还原性,高锰酸钾能将草酸钠氧化,高锰酸钾被还原,草酸钠被氧化,故A错误;
B、滴定实验必须在常温条件下发生,草酸钠与高锰酸钾的反应常温下即可发生,故B错误;
C、高锰酸钾中的锰离子由+7价降为+2价,共得到5mol电子,草酸钠中碳元素的化合价由+3价升为+4价,共失去2mol电子,要使得失电子守恒,消耗的草酸钠与高锰酸钾的物质的量之比应为5:2,故C正确;
D、高锰酸钾本身为紫红色,以草酸钠(Na 2 C 2 O 4 )为标准液进行滴定时,滴定终点的判断依据是紫红色消失,不需要加指示剂,故D错误.
故选C.1年前查看全部
- l硫酸钙分别与草酸和草酸钠反应的化学方程式
 伊豆pp1年前2
伊豆pp1年前2 -
 81年男生 共回答了30个问题
81年男生 共回答了30个问题 |采纳率93.3%H2C2O4十CaSO4== CaC2O4↓十H2SO4
2COONa+CaSO4===(COO)2Ca↓ +Na2SO4
草酸钙溶解度更低,这个反应可以进行!1年前查看全部
- 锰法测定COD加入10.0ml草酸钠溶液,若溶液颜色呈红色则需要再加入10.0ml草酸钠溶液,是何原因?空白值作何
 vivid9151年前1
vivid9151年前1 -
 沂蒙心 共回答了21个问题
沂蒙心 共回答了21个问题 |采纳率85.7%高锰酸钾法测定废水COD
一、实验目的
1.掌握高锰酸钾法滴定原理及操作.
2.学习高锰酸钾法测定废水中COD的方法.
二、实验原理
高锰酸钾指数是指在一定条件下,以高锰酸钾为氧化剂,处理水样时所消耗的氧量,以氧的mg/L来表示.水中部分有机物及还原性无机物均可消耗高锰酸钾.因此,高锰酸钾指数常作为水体受有机物污染程度的综合指标.
水样加入硫酸使呈酸性后,加入一定量的高锰酸钾溶液,并在沸水浴中加热反应一定的时间.剩余的高锰酸钾加入过量草酸钠溶液还原,再用高锰酸钾溶液回滴过量的草酸钠,通过计算求出高锰酸盐指数.
三、仪器
1.水浴装置
2.250mL锥形瓶
3.50mL酸式滴定管
四、试剂
1.高锰酸钾溶液(C(1/5 KMnO4)=0.1mol/L):称取3.2g高锰酸钾溶于1.2L水中,加热煮沸,使体积减少到约1L,放置过夜,用G-3玻璃砂芯漏斗过滤后,滤液储于棕色瓶中保存.
2.高锰酸钾溶液(C(1/5 KMnO4)=0.01mol/L):吸取25mL上述高锰酸钾溶液,用水稀释至250mL,储于棕色瓶中.使用前进行标定,并调节至0.01mol/L准确浓度.
3.1+3硫酸
4.草酸钠标准溶液(C(1/2Na2C2O4)=0.1000mol/L):称取0.6705g在105-110℃烘干一小时并冷却的草酸钠溶于水,移于100mL容量瓶中,用水稀释至标线.
5.草酸钠标准溶液(C(1/2Na2C2O4)=0.0100mol/L):吸取10.00mL上述草酸钠溶液移入100mL容量瓶中,用水稀释至标线.
五、实验步骤
1.取100mL混匀水样(如高锰酸盐指数高于5mg/L,则酌量少取,并用水稀释至100mL)于250mL锥形瓶中.
2.加入5mL(1+3)硫酸,摇匀.
3.加入10.00mL0.01mol/L高锰酸钾溶液,摇匀,立即放入沸水浴中加热30分钟(从水浴重新沸腾起计时).沸水浴液面要高于反应溶液的液面.
4.取下锥形瓶,趁热加入10.00mL0.0100mol/L草酸钠标准溶液,摇匀,立即用0.01mol/L高锰酸钾溶液滴定至显微红色,记录高锰酸钾溶液消耗量.
5.高锰酸钾溶液浓度的标定:将上述已滴定完毕的溶液加热至70℃,准确加入10.00mL草酸钠标准溶液(0.0100mol/L)再用0.01mol/L高锰酸钾溶液滴定至显微红色.记录高锰酸钾溶液的消耗量,按照下式求得高锰酸钾溶液的校正系数(K):
K=
式中:V—高锰酸钾溶液消耗量(mL).若水样经稀释时,应同时另取100mL水,同水样操作步骤进行空白实验.
注意事项:
1.在水浴加热完毕后,溶液仍应保持淡红色,如变浅或全部褪去,说明高锰酸钾的用量不够.此时,应将水样稀释倍数加大后再测定.
2.在酸性条件下,草酸钠和高锰酸钾的反应温度应保持在60-80℃,所以滴定操作必须趁热进行,若溶液温度过低,需适当加热.
六、计算
1.水样不经稀释
高锰酸钾指数(O2,mg/L)=
式中:V1—滴定水样时高锰酸钾溶液的消耗量(mL);
K—校正系数;
M—高锰酸钾溶液浓度(mol/L);
8—氧(1/2 O2)摩尔质量.
2.水样经稀释
高锰酸钾指数(O2,mg/L)=
式中,V0—空白实验中高锰酸钾溶液消耗量(mL);
V2—水样量(mL);
C—稀释的水样中含水的比值,例如:10.00mL水样用90mL水稀释至100mL,则C=0.90.1年前查看全部
- 草酸钠(Na2C2O4)溶液和硫酸钙发生复分解反应的化学方程式
 transtent1年前2
transtent1年前2 -
 zlpwater 共回答了18个问题
zlpwater 共回答了18个问题 |采纳率88.9%Na2C2O4+CaSO4=CaC2O4↓+Na2SO41年前查看全部
- 用草酸钠标定高锰酸钾中硫酸加太多或太少会怎么样
 心如止水一连1年前2
心如止水一连1年前2 -
 我也很忙 共回答了15个问题
我也很忙 共回答了15个问题 |采纳率86.7%反应的离子式为:5C2O42- + 2MnO4- + 16H+ = 2Mn2+ + 10CO2 + 8H2O
根据反应式可知,高锰酸根在酸性条件下才具有较强的氧化性,且H+参与反应.若硫酸加入太少,H+作为反应物浓度太低,反应速率慢,甚至不够量,且高锰酸根的氧化性减弱.若硫酸加入太多,草酸根会生成草酸氢根和草酸,使溶液中草酸根离子浓度降低,也会减慢反应速率.1年前查看全部
- Ⅰ.实验室称取0.867g草酸钠(Na2C2O4,式量为134),溶解于水,加入一定量硫酸,用未知浓度的KMnO4溶液滴
Ⅰ.实验室称取0.867g草酸钠(Na2C2O4,式量为134),溶解于水,加入一定量硫酸,用未知浓度的KMnO4溶液滴定,用去KMnO4溶液22.50mL,反应式如下(未配平):MnO4-+C2O42-+H+→Mn2++CO2+H2O.则装KMnO4的滴定管是______(填“酸式”或“碱式”); KMnO4溶液的浓度是______mol/L.
Ⅱ.某温度下在容积固定的密闭容器中,下列反应达到平衡:M(g)+H2O(g)⇌N(g)+H2(g)
①该反应的平衡常数为______.该温度下,向容器中充入1molM、3mol H2O、2mol N、1.5molH2,则起始时该反应速率V正______V逆(填“>”、“<”或“=”)起始n(M):n(H2O) M转化率 H2O转化率 1:1 0.5 0.5 1:2 0.67 0.33 1:3 0.75 0.25
②结合表中数据,判断下列说法中正确的是______.
A.增加H2O(g)的量,M的转化率升高而H2O(g)的转化率降低
B.若M与H2O(g)的转化率相同时,二者的初始投入量一定相同
C.M和H2O(g)初始物质的量之比等于二者转化率之比
D.当M与H2O(g)物质的量之比为1:4时,M的转化率为0.85
③该温度下,向容器中充入2molM、2mol H2O,当达平衡时放出a KJ热量,则该反应的△H=______. 儋州歌调1年前1
儋州歌调1年前1 -
 摇曳透明 共回答了20个问题
摇曳透明 共回答了20个问题 |采纳率95%解题思路:Ⅰ.酸性高锰酸钾可腐蚀橡胶管,由电子守恒可知2MnO4-~5C2O42-,以此计算;
Ⅱ.①利用1:1时转化率为0.5,可知平衡时各物质浓度相同,K=
;再利用Qc、K的关系判断反应方向;c(N)c(H2) c(M)c(H2O)
②初始量之比等于化学计量数之比时转化率相同,增大某反应物的量,必定增大另一反应物的转化率,以此解答;
③2molM、2mol H2O,当达平衡时放出a KJ热量,即转化率为0.5,反应1molM放出akJ的热量.Ⅰ.酸性高锰酸钾可腐蚀橡胶管,则应盛放在酸式滴定管中,由电子守恒可知2MnO4-~5C2O42-,n(Na2C2O4)=[0.867g/134g/mol]=0.0065mol,KMnO4溶液的浓度是
0.0065×
2
5mol
0.0225L=0.115(或0.12)mol/L,故答案为:酸式;0.115(或0.12);
Ⅱ.①由1:1时转化率为0.5,可知起始量相同,平衡时各物质浓度相同,K=
c(N)c(H2)
c(M)c(H2O)=1;由Qc=[2×1.5/1×3]=1=K,则平衡不移动,即V正=V逆,
故答案为:1;=;
②A.增加H2O(g)的量,促进M的转化,则M的转化率升高而H2O(g)的总物质的量增大,其转化率降低,故A正确;
B.若M与H2O(g)的转化率相同时,化学计量数相同,所以二者的初始投入量一定相同,故B正确;
C.由表格中后两组数据可知,M和H2O(g)初始物质的量之比不一定等于二者转化率之比,故C错误;
D.当M与H2O(g)物质的量之比为1:4时,
M(g)+H2O(g)⇌N(g)+H2(g)
开始 n 4n 0 0
转化x x x x
平衡n-x n-x xx
x×x
(n−x)×(4n−x)=1,解得x=0.8n,M的转化率为0.8,故D错误,
故答案为:AB;
③2molM、2mol H2O,当达平衡时放出a KJ热量,即转化率为0.5,反应1molM放出akJ的热量,即该反应的△H=-akJ/mol,故答案为:-aKJ/mol.点评:
本题考点: 氧化还原反应的计算;反应热和焓变;化学平衡常数的含义;化学平衡的影响因素.
考点点评: 本题考查氧化还原反应的计算及化学平衡的计算,为高频考点,侧重学生分析能力和计算能力的考查,注意电子守恒及化学平衡常数K的计算与应用,题目难度中等.1年前查看全部
- 已知酸性高锰酸钾溶液可以和草酸钠、二氧化硫等物质发生氧化还原反应.
已知酸性高锰酸钾溶液可以和草酸钠、二氧化硫等物质发生氧化还原反应.
(1)酸性高锰酸钾溶液和草酸钠反应的离子方程式为:MnO
+C2O−4
+H+-→CO2↑+Mn2++H2O(未配平)2−4
现称取草酸钠(Na2C2O4)样品1.34g溶于稀硫酸中,然后用0.20mol•L-1的高锰酸钾溶液滴定(其中的杂质不跟高锰酸钾和稀硫酸反应),达到终点时消耗了15.00mL的高锰酸钾溶液.
①判断滴定达到终点时的现象是______;
②样品中草酸钠的质量分数为______.
(2)请写出酸性高锰酸钾溶液和二氧化硫反应的离子方程式,并标出电子转移的方向和数目______. 忘了赵敏1年前1
忘了赵敏1年前1 -
 jinglixin112 共回答了21个问题
jinglixin112 共回答了21个问题 |采纳率85.7%解题思路:(1)①滴定终点时,溶液由无色变为紫红色,且在半分钟内不褪色;
②先根据高锰酸钾和草酸钠之间的关系式计算草酸钠的物质的量,再根据质量分数公式计算;
(2)酸性高锰酸钾具有强氧化性,能氧化二氧化硫生成硫酸,同时自身被还原生成锰离子.(1)①滴定终点时,溶液由无色变为紫红色,且在半分钟内不褪色,故答案为:溶液由无色变为紫红色,且在半分钟内不褪色;
②根据转移电子相等、原子守恒得该反应方程式为2MnO4-+5C2O4 2-+16H+=10CO2↑+2Mn2++8H2O,
根据草酸钠和高锰酸钾之间的关系式得草酸钠的质量=
0.2mol/L×0.015L
2×5×134g/mol=1.005g,
质量分数=
1.005g
1.34g×100%=75%,故答案为:75%;
(2)酸性高锰酸钾具有强氧化性,能氧化二氧化硫生成硫酸,同时自身被还原生成锰离子,硫元素化合价由+4价变为+6价,锰元素由+7价变为+2价,所以化合价变化的最小公倍数是10,所以转移电子数是10,
再结合原子守恒得,该反应离子方程式为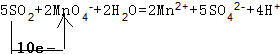 ,
,
故答案为: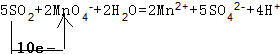 .
.点评:
本题考点: 氧化还原反应;氧化还原反应的电子转移数目计算.
考点点评: 本题考查了氧化还原反应,明确元素化合价变化是解本题关键,难点是标出电子转移的方向和数目,难度中等.1年前查看全部
- 环境监测 COD 高锰酸钾指数测定中为什么要再用高锰酸钾溶液回滴过量的草酸钠?
 zzzzzii1年前1
zzzzzii1年前1 -
 adas1301 共回答了19个问题
adas1301 共回答了19个问题 |采纳率84.2%反应剩余高锰酸钾,用草酸钠溶液还原并加入过量,再用高锰酸钾溶液回滴过量的草酸钠,通过计算求出高锰酸盐指数.简单的一句话:反滴定法.其原理在分析化学一般基本教材里有详细的介绍.1年前查看全部
- 酸性高锰酸钾溶液和草酸钠反应的离子方程式是
 小猪精神1年前2
小猪精神1年前2 -
 coco_chen82 共回答了16个问题
coco_chen82 共回答了16个问题 |采纳率100%5C2O4(2-)+2MnO4(-)+16H(+)=10CO2↑+2Mn(2+)+8H2O1年前查看全部
- 做高锰酸盐指数时,加草酸钠为什么不褪色?
做高锰酸盐指数时,加草酸钠为什么不褪色?
水浴加热后,加10ML0.01mol/L草酸钠,为什么有的水样不褪色呢? ewqewq3211年前1
ewqewq3211年前1 -
 闲庭信步100 共回答了25个问题
闲庭信步100 共回答了25个问题 |采纳率96%酸性不够.1年前查看全部
- 高锰酸盐指数的测定,如何用0.1mol/L草酸钠溶液标定高锰酸钾储备液的浓度.有具体实验步骤和计算方法吗?
 melodymann1年前1
melodymann1年前1 -
 野山花 共回答了14个问题
野山花 共回答了14个问题 |采纳率92.9%按照方程式计算呀:
2KMnO4 + 5Na2C2O4 + 8H2SO4 ---> K2SO4 + 2MnSO4 + 10CO2 + 8H2O + 5Na2SO41年前查看全部
- 如何用草酸钠溶液测定高锰酸钾溶液的浓度
 ﹎想1年前2
﹎想1年前2 -
 汗王 共回答了16个问题
汗王 共回答了16个问题 |采纳率93.8%草酸钠溶液具有还原性,可以使高锰酸钾溶液褪色
已经标定浓度的草酸钠溶液去滴定已知体积未知浓度的高锰酸钾溶液
不需指示剂,高锰酸钾溶液褪色时,就可以得到消耗草酸钠溶液体积
根据 5 C2O4(2-)对应2MnO4-
可以很轻松算出高锰酸钾溶液的浓度1年前查看全部
- 什么东西可以标定高锰酸钾,草酸钠?
什么东西可以标定高锰酸钾,草酸钠?
PH在4~8.7变色的指示剂是什么?
也就是说没有这种指示剂的? 程纸音1年前2
程纸音1年前2 -
 波波粉丝3号 共回答了16个问题
波波粉丝3号 共回答了16个问题 |采纳率81.3%草酸钠,草酸(2结晶水),As2O3,硫酸亚铁铵
常用草酸钠,As2O3 不需要指示剂
甲基橙 3.1-4.4
溴酚蓝 3.0-4.6
溴甲酚绿 3.8-5.4
甲基红 4.4-6.2
溴百里酚蓝 6.0-7.6
中性红 6.8-9.0
酚红 6.4-8.2
百里酚蓝 8.0-9.6
酚酞 8.0-9.6
指示剂并不需要和突跃范围完全重合,只要等当点在指示剂变色范围内就可以了
我列出的都可以作为你的指示剂1年前查看全部
- 用草酸的稀溶液或草酸钠的酸性溶液可以洗涤粘在皮肤上的高锰酸钾,其离子方程式为(未配平):MnO 4 - +C 2 O 4
用草酸的稀溶液或草酸钠的酸性溶液可以洗涤粘在皮肤上的高锰酸钾,其离子方程式为(未配平):MnO 4 - +C 2 O 4 2 - +H + →CO 2 ↑+Mn 2+ +□。关于此反应的叙述正确的是
A.该反应右边方框内的产物是OH - B.配平该反应后,H + 的化学计量数是8 C.该反应中氧化产物是CO 2 D.该反应电子转移总数是5e -  zhudongqin1年前1
zhudongqin1年前1 -
 mzj14 共回答了19个问题
mzj14 共回答了19个问题 |采纳率84.2%C
考查离子反应及氧化还原反应相关知识点
根据化合价的升降守恒可得:2MnO 4 - +5C 2 O 4 2 - +H + →10CO 2 ↑+2Mn 2+ +□
由电荷守恒可知:2MnO 4 - +5C 2 O 4 2 - +16H + →10CO 2 ↑+2Mn 2+ +□
由原子守恒可知:2MnO 4 - +5C 2 O 4 2 - +16H + →10CO 2 ↑+2Mn 2+ +8H 2 O
从而可知,氧化产物为CO 2 ,电子转移总数为10e -
答案为C1年前查看全部
- 用草酸的稀溶液或草酸钠的酸性溶液可以洗涤粘在皮肤上的高锰酸钾,其离子方程式为(未配平):MnO4(-)+C2O4(2-)
用草酸的稀溶液或草酸钠的酸性溶液可以洗涤粘在皮肤上的高锰酸钾,其离子方程式为(未配平):MnO4(-)+C2O4(2-)+H(+)----CO2+Mn(2+)+_____ 关于此反应的叙述正确的是( )
A.该反应右边方框内的产物是OH-
B.配平该反应后,H+化学计量数是6 C.该反应电子转移总数是5e-
D.该反应中氧化产物是CO2(注:括号里的是右上角的电荷数,下划线是要填的未知生成物)为什么下划线里要填水?生成氢气不行吗? 变成花的傻瓜1年前4
变成花的傻瓜1年前4 -
 cara3202 共回答了17个问题
cara3202 共回答了17个问题 |采纳率88.2%为什么下划线里要填水?生成氢气不行吗?
MnO4(-)+C2O4(2-)+H(+)----CO2+Mn(2+)+ H2O
MnO4(-) →Mn化合价 +7价→+2价 → Mn(2+)
C2O4(2-) →C化合价 +3价→+4价 → CO2
上面是化合价的变化,方便你理解,与下面推断没什么联系
我们看产物,如果生成H2,产物C元素与O元素物质的量之比为1比2(看CO2)
再看反应物C2O4(2-)中C元素与O元素物质的量之比为1比2,但是!还有MnO4-,这里还有O元素,所以产物中O元素少了,这是为什么呢?因为产物H2应该是H2O,少的O来自于H2O
这个是最简单判断产物是H2O的办法,根据产物是H2O,配平就很简单了,根据化合价升降相等和元素守恒
就这么多吧,亲!有什么不懂得追问我就好!1年前查看全部
- (2012•佛山)豆腐不可与菠菜一起煮,原因是菠菜中含有丰富的草酸、草酸钠,豆腐中含有较多的硫酸钙等钙盐,相互反应生成草
(2012•佛山)豆腐不可与菠菜一起煮,原因是菠菜中含有丰富的草酸、草酸钠,豆腐中含有较多的硫酸钙等钙盐,相互反应生成草酸钙沉淀等物质.其中发生的反应属于( )
A.化合反应
B.分解反应
C.置换反应
D.复分解反应 萧爱天空1年前1
萧爱天空1年前1 -
 leegenli 共回答了13个问题
leegenli 共回答了13个问题 |采纳率100%解题思路:复分解反应是两种化合物互相交换成分生成另外两种化合物的反应,草酸钠和硫酸钙反应生成草酸钙白色沉淀和硫酸钠,属于复分解反应.A、化合反应是多变一,故选项错误;
B、分解反应是一变多,故选项错误;
C、置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的化学反应,故选项错误;
D、草酸钠和硫酸钙反应生成草酸钙白色沉淀和硫酸钠,属于复分解反应;故选项正确;
故选D点评:
本题考点: 反应类型的判定.
考点点评: 本考点考查了基本反应类型的判断,要牢记四个基本反应类型的概念,并会理解应用.本考点基础性比较强,主要出现在选择题和填空题中.1年前查看全部
- 0.1mol/L高锰酸钾溶液如何用0.1mol/L的草酸钠溶液标定
0.1mol/L高锰酸钾溶液如何用0.1mol/L的草酸钠溶液标定
如何计算? 昕寅1年前1
昕寅1年前1 -
 Hypnos1122 共回答了17个问题
Hypnos1122 共回答了17个问题 |采纳率94.1%摩尔比为2:51年前查看全部
- 如何提高草酸钠在水中的溶解度(常温)
如何提高草酸钠在水中的溶解度(常温)
如何提高草酸钠在水中的溶解度(常温水中) zhangxi241年前1
zhangxi241年前1 -
 随身听 共回答了21个问题
随身听 共回答了21个问题 |采纳率85.7%不改变条件是没法提高的.
提高溶解度的方法有:
(1)升温
(2)加入一点酸,影响草酸的水解平衡,使得草酸根在水中的浓度增大.
(3)对草酸钠进行修饰,比如对其进行多羟基修饰,增加其亲水性.1年前查看全部
- 草酸钠中碳元素多少价?
 肥果1年前7
肥果1年前7 -
 spear2007 共回答了18个问题
spear2007 共回答了18个问题 |采纳率94.4%草酸是COOH-COOH,所以碳原子是+3价.1年前查看全部
- 高猛酸钾和草酸钠的化学方程式怎么写,
 狗狗会刷呀了1年前1
狗狗会刷呀了1年前1 -
 chenweioo 共回答了24个问题
chenweioo 共回答了24个问题 |采纳率87.5%是反应吗
2MnO4- + 5C2O4- +16H+ ==2Mn2+ +8H2O +10CO2↑1年前查看全部
- 草酸与草酸钠混合液中各成分含量测定
 xjdai12201年前1
xjdai12201年前1 -
 biologyangel 共回答了8个问题
biologyangel 共回答了8个问题 |采纳率100%首先加几滴酚酞 用氢氧化钠滴定至粉红为终点 可得到草酸的含量A
然后用K2Cr2O7标准溶液标定粉色的溶液至绿
可算出草酸根含量B
最后 B-A即草酸钠含量1年前查看全部
- 草酸钠与氯酸钠反应的化学方程式
 若水无尢1年前1
若水无尢1年前1 -
 宁可不长草 共回答了10个问题
宁可不长草 共回答了10个问题 |采纳率100%Na2C2O4+2NaClO3+2H2SO4→Na2SO4+2CO2↑+2ClO2↑+2H2O1年前查看全部
- 草酸、草酸钠和硫酸钙反应的复分解化学方程式
草酸、草酸钠和硫酸钙反应的复分解化学方程式
要一起的、不要分开的谢谢XD 3876594111年前2
3876594111年前2 -
 一亩西瓜地 共回答了27个问题
一亩西瓜地 共回答了27个问题 |采纳率88.9%H2C2O4+Na2C2O4+CaSO4=2CaC2O4(↓)+H2SO4+Na2SO41年前查看全部
- 草酸钠与硫酸钙的反应讲清白一点,注意配平
 bobo_zhang1年前1
bobo_zhang1年前1 -
 累了睡了哭了 共回答了18个问题
累了睡了哭了 共回答了18个问题 |采纳率83.3%2NaAc+CaSO4==Ca(Ac)2↓+Na2SO41年前查看全部
- 谁知道草酸钠硫酸钙反应生成什么?
谁知道草酸钠硫酸钙反应生成什么?
关于化学的, jingweiju1101年前2
jingweiju1101年前2 -
 nnnet 共回答了20个问题
nnnet 共回答了20个问题 |采纳率85%生成硫酸钠和草酸钙,因硫酸钙微溶于水,而草酸钙几乎不溶于水,所以这个复分解反应可以进行,但需要大量的水先把硫酸钙完全溶解方能顺利反应.
Na2C2O4 + CaSO4 = Na2SO4 + CaC2O4(沉淀)
20摄氏度时
CaSO4·2H2O溶解度0.255g/100ml水
CaC2O4溶解度6.7×10∧-4g/100ml水1年前查看全部
- 草酸钠成酸性,电离大于水解,怎么判断
 为了爱而活着1年前1
为了爱而活着1年前1 -
 刘凯文 共回答了11个问题
刘凯文 共回答了11个问题 |采纳率81.8%HOOCCOONa既可以电离,又可以水解,而溶液的酸碱性可以判断电离和水解程度的相对大小.同样告诉水解电离相对大小也可以确定溶液的酸碱性.1年前查看全部
- 二氧化锰氧化草酸钠的离子方程式(酸性条件下)
二氧化锰氧化草酸钠的离子方程式(酸性条件下)
如题 斑斓雪1年前2
斑斓雪1年前2 -
 蒂落涕 共回答了18个问题
蒂落涕 共回答了18个问题 |采纳率94.4%2C2O4 (2-) + MnO2 = Mn + 2CO2↑ + 2CO3 (2-)1年前查看全部
- 草酸钠成酸性,电离大于水解,怎么判断
 liulangdeliulang1年前1
liulangdeliulang1年前1 -
 sheep2 共回答了20个问题
sheep2 共回答了20个问题 |采纳率85%HOOCCOONa既可以电离,又可以水解,而溶液的酸碱性可以判断电离和水解程度的相对大小.同样告诉水解电离相对大小也可以确定溶液的酸碱性.1年前查看全部
- 为什么用来调节滴定基准物 草酸钠 的酸度的要用硫酸?用一元酸或其它多元酸会怎样?
 朝天门的水1年前1
朝天门的水1年前1 -
 eerr 共回答了20个问题
eerr 共回答了20个问题 |采纳率95%用盐酸貌似都可以1年前查看全部
- 草酸钠可否作为酸碱滴定的基准物质
草酸钠可否作为酸碱滴定的基准物质
为什么? 924141年前2
924141年前2 -
 zzzz2004zzzz 共回答了21个问题
zzzz2004zzzz 共回答了21个问题 |采纳率95.2%不可以
草酸就是乙二酸
首先它是弱酸 PH到7的话 需要的草酸量>NAOH的
还有就是乙二酸会腐蚀玻璃的 所以就更不能了1年前查看全部
- 在氯化钡溶液中滴加草酸钠溶液在BaCl2溶液中滴加Na2C2O4(草酸钠)溶液,产生白色沉淀,在白色沉淀中加入盐酸,沉淀
在氯化钡溶液中滴加草酸钠溶液
在BaCl2溶液中滴加Na2C2O4(草酸钠)溶液,产生白色沉淀,在白色沉淀中加入盐酸,沉淀溶解.
1、试用离子方程式和有关平衡知识解释.
2、根据上述判断,可得出盐跟酸反应的一种规律是? 2474241年前1
2474241年前1 -
 涩橄榄的爱 共回答了16个问题
涩橄榄的爱 共回答了16个问题 |采纳率87.5%Ba2+ +C2O42-==BaC2O4
BaC2O4+2H+==Ba2+ +H2C2O4
草酸钡与盐酸反应生成弱电解质草酸使反应能够完成,同时破坏草酸钡溶解平衡,使其不断溶解,不断反应.符合强酸制弱酸规律.1年前查看全部
- 在滴定草酸钠时为什么高锰酸钾开始褪色慢之后比较快
 士比1年前1
士比1年前1 -
 窝头咸菜 共回答了18个问题
窝头咸菜 共回答了18个问题 |采纳率88.9%草酸钠与KMnO4的反应是一个自催化反应.
5 Na2C2O4 + 2 KMnO4 + 8 H2SO4 = K2SO4 + 2 MnSO4 + 5 Na2SO4 + 10 CO2↑ + 8 H2O
反应生成的Mn2+会催化反应进行.
刚开始的时候,Mn2+浓度很低,缺少催化剂,反应慢.
随着反应进行,Mn2+浓度逐渐增大,催化作用显著.反应速率明显加快1年前查看全部
- 高锰酸钾滴定草酸钠的实验误差
 为七七1年前1
为七七1年前1 -
 liuzimingy 共回答了17个问题
liuzimingy 共回答了17个问题 |采纳率94.1%其实也都是滴定中的误差,比如实验中,仰视俯视等,主要是抓住各个量的增大还是减小,就知道偏高还是偏低.1年前查看全部
- 关于求质量分数的一个问题某研究小组为测定某软锰矿中MnO2的质量分数,准确称取1.20g软锰矿样品,加入2.68g草酸钠
关于求质量分数的一个问题
某研究小组为测定某软锰矿中MnO2的质量分数,准确称取1.20g软锰矿样品,加入2.68g草酸钠晶体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应之后冷却、滤去杂质,将所得溶液转移到容量瓶中定容;从中取出25.00mL待测液置于锥形瓶中,再用0.0200mol·L-1 KMnO4标准溶液进行滴定,当滴入20.00mL KMnO4溶液时恰好完全反应.
试回答下列问题:
(1)配平:____MnO4-+____C2O42-+____H+ =____Mn2++____CO2↑+____H2O
(2)0.0200mol·L-1 KMnO4标准溶液应置于______(选填“酸式”或“碱式”)滴定管中;如何判断滴定终点?__________________________________________________________.
(3)你能否帮助该研究小组求得软锰矿中MnO2的质量分数?______(选填“能”或“否”).若回答“能”,请给出计算结果;若回答“否”,试说明原因________________________.
(4)若在实验过程中存在下列操作,其中会使所测MnO2的质量分数偏小的是________.
A.溶液转移至容量瓶中,未将烧杯、玻棒洗涤
B.滴定前尖嘴部分有气泡,滴定终点时消失
C.定容时,俯视刻度线
D.滴定前仰视读数,滴定后俯视读数
E.锥形瓶用水洗之后未用待测液润洗
希望能解释一下怎么求MnO2,以及(1)中的式子是哪一步 第五帅1年前1
第五帅1年前1 -
 wang320132 共回答了16个问题
wang320132 共回答了16个问题 |采纳率93.8%(1)配平:__2__MnO4-+__5__C2O42-+__16__H+ =__2__Mn2++__10__CO2↑+_8___H2O
(2)0.0200mol·L-1 KMnO4标准溶液应置于__酸____(选填“酸式”或“碱式”)滴定管中;如何判断滴定终点?
__溶液由无色变为淡紫色___________.
3)你能否帮助该研究小组求得软锰矿中MnO2的质量分数?___否___(选填“能”或“否”).若回答“能”,请给出计算结果;若回答“否”,试说明原因___不知道反应后总溶液量____________.
求二氧化锰结果:
(A)草酸残余量:
用(1)式方程计算,2 :5 = 0.02 *20ml :N1 *25ml ,解得N1=0.016 mol/L
也即是反应后,草酸钠的浓度为0.016
(B)参与反应的草酸钠为:m = 2.68g - 0.016 * V (v为反应后容易体积)
二氧化锰与草酸反应:MnO2 + C2O42- + 4 H+ =Mn2+ 2CO2 +2H2O
通过上式可计算,MnO2 的反应量:A :B = x :m (x为二氧化锰质量,m为草酸钠质量,A B 分别是二氧化锰和草酸钠分子量)
求得 x = A/B *m =A/B *( 2.68-0.016* v)
(C)则二氧化锰的含量为 1.20 / x = ** = 1.2*B / (A*(2.68-0.016V))
由此可见,需要知道反应后溶液量!
回答你的问题:
怎么求MnO2———如上
以及(1)中的式子是哪一步——反应掉多余的草酸!1年前查看全部
- 1.焰火的主要原料是黑火药,还有草酸钠、碳酸铜(发出绿色的光)等发色剂和氯酸钾、镁铝合金粉等添加剂.下列说法正确的是
1.焰火的主要原料是黑火药,还有草酸钠、碳酸铜(发出绿色的光)等发色剂和氯酸钾、镁铝合金粉等添加剂.下列说法正确的是
A.碳酸铜因为受热分解才发出绿色的光 B.氯酸钾的主要用途是产生紫色的焰火
C.镁铝合金粉在焰火中发出耀眼的白光 D.黑火药的主要成分是木炭、硫磺
答案选什么,为什么.O(∩_∩)O谢谢 an00111年前1
an00111年前1 -
 小余子 共回答了11个问题
小余子 共回答了11个问题 |采纳率90.9%4D,焰火发光原理为焰色反应,氯酸钾能放氧气,镁铝能提供高温1年前查看全部
- 基准草酸钠滴定高锰酸钾滴定液所加入的10ml硫酸的浓度是多少
 广顺1年前1
广顺1年前1 -
 wang__hong 共回答了11个问题
wang__hong 共回答了11个问题 |采纳率100%10ml浓度为6mol/L的1/2硫酸溶液
相当于10ml浓度为3mol/L的硫酸溶液1年前查看全部
大家在问
- 1书山有路勤为径的下一句
- 2若全集为实数R,集合A:log1/2(2x-1)>0,则A的补集为
- 3下面每个小正方形的面积是1平方厘米,在方格中画一个三角形的面积等于15平方厘米,三角形怎么画
- 4化学反应中的产率是什么?怎么计算?
- 5你英语很厉害 我佩服 用英语怎么说
- 6本人姓赵,名婉婷,求教各位大侠们起个有水平的英语名吧 .还有想要有像陈、chan .李 LEE 这种的
- 75个5用加减乘除使答案是24
- 8草酸、草酸钠和硫酸钙反应的复分解化学方程式
- 9亲爱的,其实你不懂我的心,英文翻译是什么?
- 10书山有路勤为径下一句是什么?
- 11书山有路勤为径的下一句是什么
- 12“书山有路勤为径”,的下一句是什么?
- 13书山有路勤为径,下一句是…?
- 14氧化铁(Fe2O3)如何一步转变成四氧化三铁(Fe3O4)?
- 15五个五加减乘除只能用一次,如何等于24
