滴定法测量维c含量时,为什么不用高锰酸钾?
 wzqsi2022-10-04 11:39:544条回答
wzqsi2022-10-04 11:39:544条回答
已提交,审核后显示!提交回复
共4条回复
 东方睡仙 共回答了13个问题
东方睡仙 共回答了13个问题 |采纳率100%- 当且仅当物料中全部被测物都算作是VC时才可以用高锰酸钾法,因为一滴定下来其它物质也被氧化,和VC混在了一起,就只能全算到VC里了
- 1年前
 danshuiyu000 共回答了21个问题
danshuiyu000 共回答了21个问题 |采纳率- 因为高锰酸钾的氧化性更强,可能会将待滴定物中其他能与高锰酸钾反应的物质当作是维生素C,使待滴定物中维生素C的含量偏高。
- 1年前
 Nabarro 共回答了2个问题
Nabarro 共回答了2个问题 |采纳率- 因为高锰酸钾有强氧化性,维C有还原性,会被破坏
- 1年前
 daisy741031 共回答了1345个问题
daisy741031 共回答了1345个问题 |采纳率- VC结构中的连二烯醇基具有级强的还原性,易被氧化,所以用较弱的氧化剂,如碘来滴定。
- 1年前
相关推荐
- 用直接滴定法测定食品中的还原糖是如何进行定量的
 会游泳的cat1年前1
会游泳的cat1年前1 -
 sun188 共回答了17个问题
sun188 共回答了17个问题 |采纳率82.4%通过利用标准葡萄糖溶液对所用酒石酸铜溶液进行标定,计算出还原糖系数,再用公式
X=[m1/(m2*V*1000)/250]*100
计算出试样中还原糖的含量.其中
m1
就是还原糖系数.
用标准葡萄糖溶液标定的原因是因为葡萄糖本身就是还原糖,
且其他糖类物质最后还是
疏解为最简单的葡萄糖参与各种反应1年前查看全部
- 用滴定法将HCl和NAOH混合后有关指示剂的问题
用滴定法将HCl和NAOH混合后有关指示剂的问题
根据题目计算,pH从4.30到9.70变化最快,指示剂应该在pH=7的时候改变颜色.但如果用酚酞(Pka=9.1) 作指示剂仍能得到较好的结果.
是因为9.1还在4.30-9.70的范围里吗?如果是的话如何完整回答? qq8880001年前1
qq8880001年前1 -
 网虫小强 共回答了18个问题
网虫小强 共回答了18个问题 |采纳率88.9%指示剂应该在pH=7的时候改变颜色,这个是计量点,但是事实上,所有指示剂都不可能刚好在这个点变色的,所以选择指示剂的时候,选在PH变化的这个范围内就好了.选酚酞是因为几点,第一,酚酞的变色点在4.30-9.70的范围里,第二...1年前查看全部
- (2007•广州一模)某草酸亚铁样品中含有少量硫酸亚铁.现用滴定法测定该样品中FeC2O4的含量.滴定反应是:
(2007•广州一模)某草酸亚铁样品中含有少量硫酸亚铁.现用滴定法测定该样品中FeC2O4的含量.滴定反应是:
5Fe2++5C2O42-+3MnO4-+24H+═5Fe3++10CO2↑+3Mn2++12H2O.
实验方案设计为:
①将准确称量的a g草酸亚铁样品置于250mL锥形瓶内,加入适量2mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为b ml.
②向上述滴定混合液中加入适量的Zn粉和过量的2mol/L的H2SO4溶液,煮沸5-8min,经检验溶液合格后(不含Fe3+),继续用0.02000mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为c ml.
③______.
④数据处理.
请回答下列问题:
(1)上述实验方案中的步骤③是______.
(2)洁净的滴定管在滴定前必须进行的操作是:
Ⅰ.______;
Ⅱ.用高锰酸钾标准溶液润洗滴定管;
Ⅲ.加入高锰酸钾标准溶液,赶走尖嘴部位的气泡;
Ⅳ.______.
(3)步骤②中检验溶液是否合格的操作是:取1滴煮沸后的溶液滴入装有______溶液的试管中,如______,则说明溶液合格.
(4)某实验探究小组的一次测定数据记录如下:
根据数据计算0.1582g 样品中:n(Fe2+)=______; n(C2O42-)=______;FeC2O4(FeC2O4 的摩尔质量为144g/mol)的质量分数为______.(精确到0.1%)a/g 起始读数/mL b/mL c/mL 0.1582 0.00 29.90 40.90 0.1582 0.00 30.10 41.10 0.1582 0.00 32.10 43.10  羊羊的幸福生活1年前1
羊羊的幸福生活1年前1 -
 漪ss 共回答了24个问题
漪ss 共回答了24个问题 |采纳率91.7%解题思路:(1)为了减小误差,需要重新操作实验;
(2)Ⅰ滴定管使用前必须进行查漏;
Ⅳ根据滴定管的构造,0刻度在上方,盛装的溶液不能超过0刻度;
(3)可以根据检验三价铁离子的方法完成;
(4)根据表中数据,舍弃无效数据,然后计算出消耗高锰酸钾溶液的平均体积,根据关系式计算出亚铁离子、草酸根离子的浓度,再根据亚铁离子、草酸根离子的物质的量计算出草酸铁的质量分数.(1)为了使实验数据更加准确,需要重复1-2次实验,
故答案为:重复以上实验1-2次;
(2)Ⅰ滴定管在使用前需要进行检查是否漏液,
故答案为:检验活塞是否漏液;
Ⅳ由于滴定管的0刻度在上方,盛装的溶液不能超过0刻度,所以需要调节液面至“0”刻度以下,
故答案为:调节液面至“0”刻度以下;
(3)要证明溶液中没有三价铁离子,可以向溶液中加入硫氰化钾溶液,溶液中没有出现血红色,证明溶液中没有三价铁离子,
故答案为:KSCN;溶液中没有出现血红色(或红色);
(4)由于第三次试验的数据误差较大,舍弃掉,
样品配制溶液中亚铁离子、草酸根离子消耗的高锰酸钾溶液的平均体积为:[40.90+41.10/2]mL=41.00ml,高锰酸钾的物质的量为:0.041L×0.02000mol/L=8.2×10-4mol,
亚铁离子消耗的高锰酸钾溶液的平均体积为:41.00mL-[29.90+30.10/2]mL=11.00mL,高锰酸钾的物质的量为:0.011L×0.02000mol/L=2.2×10-4mol,
草酸根离子消耗的高锰酸钾溶液的体积为:30.00mL-11.00mL=19.00mL,高锰酸钾的物质的量为:0.019×0.02000mol/L=3.8×10-4mol
根据化合价升降相等找出关系式:5Fe2+~MnO4-,5C2O42-~2MnO4-,
n(Fe2+)=5×2.2×10-4mol=0.001100mol,
n(C2O42-)=2.5×3.8×10-4mol=0.00095mol,
根据草酸根离子物质的量可知草酸铁的物质的量为:0.00095mol,质量为:0.00095mol×144=0.1368g,
草酸铁的质量分数为:[0.1368g/0.1582g]×100%≈86.5%,
故答案为:0.001100mol;n(C2O42-)=0.001000mol;86.50%;点评:
本题考点: 探究物质的组成或测量物质的含量.
考点点评: 本题考查了用滴定法测定该样品中FeC2O4的含量,涉及了实验方案设计、滴定管的使用、质量分数的计算等知识,可以根据所学知识完成,难度中等.1年前查看全部
- 什么是盐析法?什么是滴定法?
 wcmxz1年前3
wcmxz1年前3 -
 孤城落晖 共回答了25个问题
孤城落晖 共回答了25个问题 |采纳率92%盐析
1.盐析一般是指溶液中加入无机盐类而使某种物质溶解度降低而析出的过程.如:加浓(NH4)2SO4使蛋白质凝聚的过程;在乙酸的酯化反应中加入饱和碳酸钠溶液,降低乙酸乙酯溶解度,使其分层现象更明显的过程.
2.向某些蛋白质溶液中加入某些无机盐溶液后,可以使蛋白质凝聚而从溶液中析出,这种作用叫作盐析.
2.(2)向某些蛋白质溶液中加入某些重金属盐,可以使蛋白质凝聚而从溶液中析出,这种作用叫作盐析.
3.把动物脂肪或植物油与氢氧化钠按一定比例放在皂化锅内搅拌加热,反应后形成的高级脂肪酸钠、甘油、水形成混合物.往锅内加入食盐颗粒,搅拌、静置,使高级脂肪酸钠与甘油、水分离,浮在液面.(该反应用以制肥皂)
滴定
滴定是一种化学实验操作也是一种定量分析的手段.它通过两种溶液的定量反应来确定某种溶质的含量.滴定最基本的公式为:
c1 V1 / ν1 = c2 V2 / ν2
其中c为溶液浓度,V为溶液体积,ν为反应方程序中的系数.
原理
滴定过程需要一个定量进行的反应,此反应必须能完全进行,且速率要快,也就是平衡常数、速率常数都要较大.而且反应还不能有干扰测量的副产物,副反应更是不容许的.
在两种溶液的滴定中,未知浓度的溶液装在滴定管里,已知浓度的溶液装在下方的锥形瓶里.通常把已知浓度的溶液叫做标准溶液,它的浓度是与不易变质的固体基准试剂滴定而测得的.
反应停止时,读出用去滴定管中溶液的体积,即可用公式算出浓度.
根据反应类型的不同,滴定分为以下种类:
酸碱中和滴定(利用中和反应)
氧化还原滴定(利用氧化还原反应)
沉淀滴定(利用生成沉淀的反应)
络合滴定(利用络合反应)
指示剂
滴定反应需要灵敏的指示剂来指示反应的完成.指示剂在反应完成时,会迅速变成另一种颜色.这样实验者就可以根据指示剂的变色来确定反应的终止.
中和滴定的指示剂是有机弱酸或弱碱,它们的变色范围在等电点附近.如弱酸的变色(以HIn代表):
HIn (酸色形) = H+ + In-(碱色形)
指示剂一般有两种形态,两种形态呈现不同的颜色.指示剂在变色范围内呈现过渡色.有的指示剂有三种不同颜色的形态.
由于在变色范围时会发生“突跃”现象,颜色会变得很迅速,只要1滴溶液就可以让指示剂完全变色,因此选择指示剂时,只需让反应完成时的pH值落在突跃范围内即可,不必苛求准确.
其他种类滴定的指示剂一般是与某种反应物有灵敏反应的物质.当反应物消耗完毕时,指示剂就会变色.甚至有些反应物也可以作为指示剂,如高锰酸钾1年前查看全部
- 滴定法是化学定量分析的一种重要而普遍的方法.
滴定法是化学定量分析的一种重要而普遍的方法.
I:如图是常温下用0.1000mol•L -1 NaOH溶液滴定20.00mL0.1000mol•L -1 某一元酸HX溶液所得滴定曲线.
请回答下列问题:
(1)若学生分组实验需用约400mL0.1000mol•L -1 NaOH溶液,配制所需溶液时必需的定量玻璃仪器是______.
(2)判断HX是______(填“强酸”或“弱酸”),理由是______
(3)点①所示溶液中,各离子浓度由大到小的顺序是______.
II:某校化学探究小组用高锰酸钾滴定法测定市场上某品牌钙补品中钙的含量.测定的步骤如下:
①取10.00mL样品,加入适量盐酸酸化,再加入足量的沉淀剂草酸铵[(NH 4 ) 2 C 2 O 4 ]溶液,然后慢慢滴加氨水,并调节溶液pH至3.5~4.5之间,产生草酸钙沉淀;
②将沉淀放置过夜或加热半小时使沉淀陈化,过滤、洗涤;
③将洗净的沉淀溶解于适量稀硫酸中,加热至75℃~85℃,用0.1000mol•L -1 高锰酸钾溶液滴定至终点,记录消耗的高锰酸钾溶液体积;
④重复上述①~③操作,有关数据记录如表.
(1)判断滴定终点的现象是______.实验 样品体积/mL 高锰酸钾溶液体积/mL 1 10.00 8.98 2 10.00 8.58 3 10.00 9.02 4 10.00 9.00
(2)写出滴定时所发生反应的离子方程式______.
(3)计算样品中钙的含量______g/L.
(4)下列操作会使测量结果偏低的是______.
a.滴定前俯视读数,滴定后仰视读数
b.滴定过程中,不慎将锥形瓶中少量待测液体摇出瓶外
c.滴定前酸式滴定管尖嘴部分有气泡,滴定后尖嘴部分充满溶液
d.沉淀溶解于稀硫酸时,滤纸上仍残留少量固体.
 浪子DN1年前1
浪子DN1年前1 -
 3122611 共回答了23个问题
3122611 共回答了23个问题 |采纳率95.7%Ⅰ:(1)配制溶液时一定用到容量瓶,实验需用约400mL,应用500mL容量瓶,故答案为:500mL容量瓶;
(2)酸的浓度为0.1000 mol•L -1 ,由图象可以看出0.1000mol•L -1 一元酸HX溶液的PH>1,当NaOH溶液滴加至20mL时,溶液pH大于7,或滴加至溶液pH等于7时,需要的NaOH溶液体积小于20mL,都可以说明HX为弱酸,
故答案为:弱酸;当NaOH溶液滴加至20mL时,溶液pH大于7,或滴加至溶液pH等于7时,需要的NaOH溶液体积小于20mL,或从图中可看出0.1000 mol•L -1 HX的pH大于1;
(3)点①所示溶液中,酸过量,溶液呈酸性,则溶液中存在c(H + )>c(OH - ),
根据溶液电中性:c(H + )+c(Na + )=c(X - )+c(OH - ),则c(X - )>c(Na + ),且c(Na + )>c(H + ),
故有c(X - )>c(Na + )>c(H + )>c(OH - ),
故答案为:c(X - )>c(Na + )>c(H + )>c(OH - );
Ⅱ:(1)滴定终点,溶液颜色变化,且半分钟内颜色不变,该反应中当最后一滴KMnO 4 溶液滴入后,溶液由无色变为红色,
故答案为:当最后一滴KMnO 4 溶液滴入后,溶液由无色变为红色,且半分钟不褪色;
(2)高锰酸钾与草酸发生氧化还原反应,反应的离子方程式为5H 2 C 2 O 4 +2MnO 4 - +6H + =2Mn 2+ +10CO 2 ↑+8H 2 O,
故答案为:5H 2 C 2 O 4 +2MnO 4 - +6H + =2Mn 2+ +10CO 2 ↑+8H 2 O;
(3)第2组数据误差较大,舍去,根据其它三组数据计算,高锰酸钾溶液的平均体积为:
8.98+9.02+9.00
3 mL=9.00mL,
5CaC 2 O 4 ~5H 2 C 2 O 4 ~2MnO 4 -
5mol5mol 2mol
n 0.1mol/L×9×10 -3 L
n=2.25×10 -3 mol,
则m(Ca 2+ )=2.25×10 -3 mol×40g/mol=0.09g,
所以1L样品中含有0.09g×
1000mL
10mL =9.00g,
故答案为:9.00;
(4)a.滴定前俯视读数,滴定后仰视读数,会导致体积偏大,测量结果偏大,故a错误;
b.滴定过程中,不慎将锥形瓶中少量待测液体摇出瓶外,会导致所需标准液偏小,故b正确;
c.滴定前酸式滴定管尖嘴部分有气泡,滴定后尖嘴部分充满溶液,会导致体积读数偏大,测量结果偏大,故c错误;
d.沉淀溶解于稀硫酸时,滤纸上仍残留少量固体,会导致所需标准液偏小,故d正确.
故答案为:b、d.1年前查看全部
- 镉含量化学法怎么测定不是原子吸收分光光度法也不用双硫腙.那太毒了.有没有滴定法测定镉含量的.
 xjwz1年前1
xjwz1年前1 -
 欢迎使用 共回答了20个问题
欢迎使用 共回答了20个问题 |采纳率100%可以使用硫化物沉淀法.
在偏酸性溶液中将镉全部以CdS形式沉淀下来,过滤,充分洗涤沉淀.
沉淀溶于NH4Cl-NH3溶液中:CdS +4 NH3===【Cd(NH3)4】S
用I2标准溶液滴定,淀粉为指示剂,滴定至溶液变深蓝:S2- + I2 = S + 2 I-1年前查看全部
- 怎样用滴定法测定硼酸溶液的浓度?
 koko_1031年前1
koko_1031年前1 -
 若嫣 共回答了25个问题
若嫣 共回答了25个问题 |采纳率80%硼酸是极弱酸,不能用直接滴定法滴定.可用甘露醇或甘油等多元醇处理硼酸溶液,使其转化为弱酸,转换比例1:1,再用NaOH标液滴定.1年前查看全部
- 废水中测定无机氨所用的是滴定法,现实蒸馏,以硼酸为吸收剂,拿出之后加入两滴甲基红-次甲基蓝,颜色应该呈绿色,但是为什么我
废水中测定无机氨所用的是滴定法,现实蒸馏,以硼酸为吸收剂,拿出之后加入两滴甲基红-次甲基蓝,颜色应该呈绿色,但是为什么我做的时候呈红色?我已经做之前将ph调至7.0了
 bioncle171年前1
bioncle171年前1 -
 sczdw 共回答了17个问题
sczdw 共回答了17个问题 |采纳率88.2%硼酸吸收液的PH值与理论上的滴定终点(指化学计量点)的PH值是有差异的.前者的PH值由硼酸决定(还与浓度有关),而滴定到化学计量点时的PH值由硼酸+铵盐混合液决定,要考虑体积的变化(浓度变化),这时的PH值在5.2-5.3,选择甲基红+亚甲蓝混合指示剂时,正是考虑了这个终点的PH要求.
而指示剂的变化总是从酸色滴定到碱色,或碱色滴定到酸色(滴定硼酸吸收液是由碱色变酸色),是根据颜色的突变来定终点的,该混合指示剂的碱色为5.6,呈暗绿,酸色为5.2,呈紫红.这个PH值刚好接近终点产物的PH值,故以此为终点.1年前查看全部
- 滴定法 我有一瓶硫酸和硝酸 怎么用滴定法测试他们的浓度 测试完后怎么计算出来需要些什么
 liyong09031年前5
liyong09031年前5 -
 红水银 共回答了14个问题
红水银 共回答了14个问题 |采纳率92.9%先找来酸式滴定管、胶头滴管烧杯等各类仪器,然后还需氢氧化钠溶液(已知浓度的).称取一定量的氢氧化钠和酸溶液(硫酸或硝酸)如50毫升,然后先将烧碱加入滴定管中,记下其上刻度,将酸放入烧杯中,加入酚酞,用滴定管慢慢将烧碱滴入烧杯中直到烧杯刚好变为红色,记下滴定管刻度,两刻度数相减算出所用氢氧化钠体积,1年前查看全部
- 请问怎样用滴定法测定铁离子的浓度
请问怎样用滴定法测定铁离子的浓度
用哪种标准溶液和指示剂 nancy12771年前2
nancy12771年前2 -
 海之虎 共回答了16个问题
海之虎 共回答了16个问题 |采纳率87.5%重铬酸钾法分析
(1)实验原理
① 还原:
标准液K2Cr2O7是一个氧化剂,它在滴定过程中不断氧化Fe2+,和Fe2+等当量作用.因此,当测定试样中的全铁含量或试样中Fe3+含量时,就必须使溶液中的Fe3+全部还原成Fe2+,在根据K2Cr2O7的克当量数=Fe的克当量数.
还原Fe3+一般加入SnCl2,其反应为:Fe3++Sn2+=Fe2++Sn4+(热溶液).为使Fe3+全部还原成Fe2+,所以SnCl2的用量必须过量1~2滴.
② 加入HgCl2,除去过剩SnCl2.
SnCl2+2HgCl2=Hg2Cl2(白色絮状沉淀)+Sn4++4Cl-
③ 滴定:
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
副反应:加入SnCl2过量太多,且HgCl2又不足时,会引起下列反应:
SnCl2+Hg2Cl2=SnCl4+Hg(灰色粒状沉淀)
反应中产生的全部Hg能进一步与标准液K2Cr2O7起反应,从而引起结果偏高.所以,在操作过程中应特别小心,加SnCl2应过量1~2滴,但不能过量太多,但由于SnCl2与Fe3+反应较慢,所以应在热溶液中进行.
(2)全铁分析方法
① 取5.00ml还原后液于400ml烧杯中,加5ml浓HCl;
② 加热,趁热加热SnCl2溶液至FeCl3-6黄色恰好退掉,再过量1~2滴;
③ 冷却,加入10ml HgCl2,放置片刻至Hg2Cl2沉淀出现,加入水200ml;
④ 再加20ml硫、磷混合酸,二苯胺磺酸钠指示剂4~5滴;
⑤ 用K2Cr2O7标准液滴定至溶液由绿色至红紫色,为终点.
记下步骤⑤所消耗的K2Cr2O7标准液体积,计算全铁含量:
M(全Fe)=TV*1000 (g/L)
式中:V—滴定消耗K2Cr2O7的量,ml;
T—K2Cr2O7标准液滴定度,mg/ml;
(3)Fe2+分析方法
① 取5.00ml试液,于400ml烧杯中,加水200ml;
② 再加20ml硫-磷混合酸,二苯胺磺酸钠指示剂4~5滴;
③ 用K2Cr2O7标准液滴定至溶液由绿色至红紫色,为终点
记下步骤③所消耗的K2Cr2O7标准液体积,计算Fe2+含量:
M(Fe2+)=TV*1000 (g/L)
式中:V—滴定消耗K2Cr2O7的量,ml;
T—K2Cr2O7标准液滴定度,mg/ml;
注:若试液中Fe2+含量低,用0.01000N K2Cr2O7标准液滴定;若含量高则用0.1000N K2Cr2O7标准液滴定.
(4)Fe3+分析方法
M(Fe3+)= M(全Fe)- M(Fe2+) (g/L)
(5)试剂
① 10%SnCl2溶液:称取10g SnCl2溶于40ml 1:1的HCl中,用水稀释至100ml;
② HCl:比重为1.19;
③ 0.5%二苯胺磺酸钠指示剂:称取0.25g二苯胺磺酸钠溶于50ml水中,加2~3滴浓H2SO4,溶液澄清后使用;
④ 硫-磷混合酸(硫酸+磷酸+蒸馏水=15+15+70):将150ml的浓H2SO4在不断搅拌下慢慢地加入到700ml的蒸馏水中,冷却加入150ml浓H3PO4混合均匀;1年前查看全部
- 第四问要解题过程某草酸亚铁样品(FeC2O4•xH2O)中含有少量硫酸亚铁.现用滴定法测定该样品中FeC2O
第四问要解题过程
某草酸亚铁样品(FeC2O4•xH2O)中含有少量硫酸亚铁.现用滴定法测定该样品中FeC2O4的含量.滴定反应是:5 Fe2+ +5C2O42—+3MnO4—+24H+==5 Fe3+ +10CO2↑+3Mn2++12H2O
实验方案设计为:
①将准确称量的a g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为b mL
②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5—8min,经检验溶液合格后,继续用0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为c mL
③ .
④数据处理.
请回答下列问题:
(1)上述实验方案中的步骤③是 .
(2)洁净的滴定管在滴定前必须进行的操作是:
Ⅰ.检验活塞是否漏水.
Ⅱ..
Ⅲ.加入高锰酸钾标准溶液,赶走尖嘴部位的气泡,调节起始读数.
(3)步骤②中检验溶液是否合格的操作是:取1滴煮沸后的溶液滴入装有 溶液的试管中,如 ,则说明溶液合格.
(4)某小组的一次测定数据记录如下:
a/g 起始读数/mL b/mL c/mL
0.1970 0.00 31.30 42.40
根据数据计算0.1970g 样品中:n(Fe2+)== ; n(C2O42—)== ;
FeC2O4 的质量分数为 (精确到0.01%) robertonana1年前1
robertonana1年前1 -
 jestion 共回答了18个问题
jestion 共回答了18个问题 |采纳率88.9%第一次滴定所需高锰酸钾b mL为滴定Fe2+和C2O42—的总用量,第二次滴定所需高锰酸钾C mL为滴定Fe2+的用量.
所以根据5 Fe2+ ——MnO4—可以求得:
n(Fe2+)=0.02000 mol/L *c/mL =5* 0.02000 *(42.40-31.30)=0.00111mol
再根据5C2O42—2MnO4-可以求得
n(C2O42—)==52*0.02000 *[31.30-(42.40-31.30)]=0.00101mol1年前查看全部
- 分光光度法测钼酸钠含量如题,分光光度法,不是滴定法。而且楼下的回答已经有人验证不行的。那是测钼酸铵的
 empty991年前1
empty991年前1 -
 gjy2006214 共回答了14个问题
gjy2006214 共回答了14个问题 |采纳率92.9%称取试样样0.3g精确至0.0001g.溶于水中加4g六次甲基四胺加热至60℃,加2~4滴吡啶偶氮间苯二酚钠盐指示液,用0.05mol/L硝酸铅标准滴定溶液,滴定至溶液由橙色明显变为粉红色.1年前查看全部
- 测定铁矿石中的全铁量时,一般采用K2Cr2O7滴定法而不用KMnO4滴定法,原因是
 zhang06241年前1
zhang06241年前1 -
 woshishui66666 共回答了11个问题
woshishui66666 共回答了11个问题 |采纳率100%重铬酸钾的氧化能力不如高锰酸钾强,因此重铬酸钾可以测定的物质不如高锰酸钾广泛,但与高锰酸钾法相比:
(1)K2Cr2O7易提纯,可以制成基准物质,在140~150℃干燥2h后,可直接称量,配制标准溶液.K2Cr2O7标准溶液相当稳定,保存在密闭容器中,浓度可长期保持不变.
(2)室温下,当HCl溶液浓度低于3mol/L时,Cr2O72-不会诱导氧化Cl-,因此K2Cr2O7法可在盐酸介质中进行滴定.Cr2O72-的滴定还原产物是Cr3+,呈绿色,滴定时须用指示剂指示滴定终点.常用的指示剂为二苯胺磺酸钠.
(3)由于KMnO4氧化能力强,因此方法的选择性欠佳,而且KMnO4与还原性物质的反应历程比较复杂,易发生副反应.
(4)KMnO4标准溶液不能直接配制,且标准溶液不够稳定,不能久置,需经常标定.1年前查看全部
- 什么情况下可以用直接滴定法测定阿司匹林的含量?区分两步滴定法.
 守鹤一族1年前1
守鹤一族1年前1 -
 餐桌上的蚂蚁 共回答了15个问题
餐桌上的蚂蚁 共回答了15个问题 |采纳率86.7%阿司匹林中的杂质(如水杨酸)含量很少,在杂质限量一下,对中和滴定的影响很小的时候可以进行直接滴定.当水杨酸、枸橼酸的含量多时,因为会消耗用于滴定的NaOH,导致结果偏高,此时要使用两步滴定法.1年前查看全部
- (2014•浦东新区二模)某工业废水中含有少量Ag+,现欲通过滴定法测定其浓度.
(2014•浦东新区二模)某工业废水中含有少量Ag+,现欲通过滴定法测定其浓度.
已知:①K2CrO4(铬酸钾)是一种可溶性盐;②Ag2CrO4是一种呈砖红色的难溶性盐,但它的溶解度略高于AgCl(即AgCl比Ag2CrO4更难溶);③废水中的其它金属离子不与CrO42-、Cl-发生反应.
实验室提供的试剂有:(a)标准AgNO3溶液、(b)标准NaCl溶液、(c)5% K2CrO4溶液.提供的定量仪器只有滴定管.
请将下列实验步骤填写完全:
(1)量取一定体积的含银废水置于______瓶中.
(2)在废水样品中加入过量的______,并振荡摇匀.
(3)再滴入少量c作为滴定终点指示剂.
(4)用______溶液滴定,直至______色出现即刻停止.
(5)重复以上实验,根据记录的数据计算测定结果.
(6)以上必须使用滴定管的步骤是______(填编号). 移动灌水xx1年前1
移动灌水xx1年前1 -
 zq_yang 共回答了15个问题
zq_yang 共回答了15个问题 |采纳率100%解题思路:本题运用沉淀滴定法来进行的定量实验,其原理和中和滴定非常相似.在一定量的少量Ag+的工业废水中,加一定量(过量)的标准NaCl溶液,再用标准AgNO3溶液把与废水中的银离子反应后剩余的氯离子滴定出来,这样就可以计算出废水中银离子的浓度.依据的反应是Ag++Cl-=AgCl↓,在这个沉淀滴定中运用铬酸钾做指示剂.(1)由于废水里要先加过量的标准NaCl溶液,充分反就后再滴定所以必须将待测液置于锥形瓶中,因为滴定管有能作为反应容器,故答案为:锥形瓶;
(2)在废水先加入过量的已知体积的标准NaCl溶液,使银离子完全沉淀,再用标准AgNO3溶液把剩余的氯离子滴定出来,这样就可以计算出废水中银离子的浓度,故答案为:标准NaCl溶液(或选b);
(4)在废水先加入过量的已知体积的标准NaCl溶液,使银离子完全沉淀,剩余的氯离子需要用标准AgNO3溶液把它滴定出来,由于Ag2CrO4是一种呈砖红色的难溶性盐且AgCl比Ag2CrO4更难溶,所以可以选5% K2CrO4溶液为指示剂.故答案为:标准AgNO3溶液(或选a);砖红;
(6)在整个实验过程中含银废水、过量的标准NaCl溶液、标准AgNO3溶液都要精确量取体积,然后才能计算出废水中含Ag+的浓度,在重复实验的时候也需要这样做,故答案为:(1)(2)(4)((5)).点评:
本题考点: 中和滴定;探究物质的组成或测量物质的含量.
考点点评: 本题考查了学生的中和滴定原理的理解,在此基础上根据题目的信息设计出沉淀滴定的实验步骤,有一定的综合性,对学生从题中获取信息并运用信息结合基础知识分析解、决问题有较高的要求,所以本题目有一定的难度.1年前查看全部
- 用沉淀滴定法测定Ag+下列那个方法为宜?A莫尔直接滴定法B莫尔间接滴定法C福尔哈德直接法D福尔哈德间接法
 歇锄1年前1
歇锄1年前1 -
 流星_划过 共回答了13个问题
流星_划过 共回答了13个问题 |采纳率92.3%c1年前查看全部
- 用滴定法测硬度,EDTA是4克放在1L水中配成0.01摩尔每升吗?水取样是取100还是50毫升水样?
 ggshmily1年前1
ggshmily1年前1 -
 阿蜡 共回答了23个问题
阿蜡 共回答了23个问题 |采纳率87%edta不是国标里的基准物质.所以edta 不可能直接配置已知浓度的.只能是通过大致计算,配置在已知浓度左右的水样,然后通过标定来具体得到它的浓度.1年前查看全部
- 有关化学滴定法.在滴定法中,对于不同的酸和碱,对酸碱指示剂有不同的要求吗?
 啪啦啦1年前2
啪啦啦1年前2 -
 鼠标甲 共回答了17个问题
鼠标甲 共回答了17个问题 |采纳率94.1%要求当然不一样喽,但是最基本的是要求颜色是由浅变深,不能由深变浅,因为人的眼睛对深色有体内风流时间,比如红的到粉红色就很难看出来,但是无色到红色就很容易看出来啦~还有啊,根据指示剂变色范围和滴定曲线的突跃范围来确定用何种指示剂啊~我也学分析的,要多下功夫了~1年前查看全部
- 某工厂的废水中只含氯化镁和少量盐酸,欲测定废水中各组分的浓度,某兴趣小组采用滴定法按以下步骤进行操作:
 某工厂的废水中只含氯化镁和少量盐酸,欲测定废水中各组分的浓度,某兴趣小组采用滴定法按以下步骤进行操作:
某工厂的废水中只含氯化镁和少量盐酸,欲测定废水中各组分的浓度,某兴趣小组采用滴定法按以下步骤进行操作:
①取25.00mL工厂废水放入锥形瓶中,加入2~3滴甲基橙指示剂,用 0.2020mol•L-1氢氧化钠溶液滴至终点,滴定前后滴定管中示数如右图.
②再取25.00mL工厂废水放入锥形瓶中,加入 0.2020mol•L-1NaOH溶液V1 mL(过量),振荡.然后加入2~3滴甲基橙试液,用0.1012mol•L-1的盐酸滴定过量的氢氧化钠溶液至终点,消耗盐酸V2mL.
③略.
(1)步骤①取25.00mL废水所用的仪器______,滴定时左手______,眼睛注视______.计算c(HCl)=______mol•L-1.
(2)步骤②滴定至终点观察到的实验现象______.步骤②测出氯化镁的浓度明显不合理,实验设计存在问题,请提出一种改进的方法______.若改进后步骤②消耗盐酸的体积为V3mL.请列出计算c(MgCl2)的表达式0.2020mol/L×V1×10−3L−0.2020mol/L×0.0125L−0.1012mol/LV×3×10−3L 0.025L×2 .0.2020mol/L×V1×10−3L−0.2020mol/L×0.0125L−0.1012mol/LV×3×10−3L 0.025L×2
(3)请设计另外一种测定该工业废水各组分浓度的实验方案并简述实验步骤. 爱你等于爱大腿1年前1
爱你等于爱大腿1年前1 -
 海上明珠- 共回答了21个问题
海上明珠- 共回答了21个问题 |采纳率85.7%解题思路:(1)根据酸式滴定管盛放酸性溶液;根据滴定操作的方法;根据读数求出氢氧化钠的体积,然后根据氢氧化钠与盐酸反应的关系式NaOH~HCl求出盐酸的物质的量浓度;
(2)废水中加入过量NaOH溶液,溶液中含有氢氧化镁沉淀、NaOH,根据用甲基橙试液作指示剂,碱滴定酸时到终点时溶液的颜色由黄色橙色变成橙色,沉淀溶解;根据废水放入NaOH溶液会产生氢氧化镁沉淀,再加盐酸,盐酸与氢氧化镁、氢氧化钠都能反应,在测定过量的氢氧化钠时,应除去氢氧化镁沉淀;根据步骤①用氢氧化钠溶液滴至终点,滴定前后滴定管中示数如右图求出与氯化镁反应的氢氧化钠的物质的量;根据步骤②用盐酸滴定过量的氢氧化钠溶液至终点,消耗盐酸的体积求出过量的氢氧化钠的物质的量,最后用总的氢氧化钠的物质的量-与氯化镁反应的氢氧化钠的物质的量-过量的氢氧化钠的物质的量=与盐酸反应的氢氧化钠的物质的量,最后求出盐酸的物质的量浓度;
(3)根据在一定量的废水放入烧杯中,加入过量的氢氧化钠溶液溶液,过滤、洗涤沉淀、烘干、称重.计算出氯化镁的浓度.在一定量废水放入烧杯中,加入过量的硝酸银溶液,过滤、洗涤沉淀、烘干、称重,计算出盐酸的浓度.(1)根据废水呈酸性,所以取25.00mL废水所用的仪器为25.00mL酸式滴定管;
滴定时左手挤压玻璃球,眼睛注视锥形瓶溶液颜色变化;
消耗氢氧化钠的体积为13.90mL-1.40 mL=12.50mL
氢氧化钠与盐酸反应的关系式 NaOH~HCl
11
0.2020mol•L-1×12.50mLC(HCl)×25.00mL
C(HCl)=0.1010mol/L
故答案为:酸式滴定管;挤压玻璃球,锥形瓶溶液颜色变化;0.1010;
(2)废水中加入过量NaOH溶液,溶液中含有氢氧化镁沉淀、NaOH溶液,所以终点时溶液的颜色由黄色橙色变成橙色,沉淀溶解;废水放入NaOH溶液会产生氢氧化镁沉淀,再加盐酸,盐酸与氢氧化镁、氢氧化钠都能反应,在测定过量的氢氧化钠时,应除去氢氧化镁沉淀,所以过滤并洗涤沉淀,然后对滤液进行滴定,与氯化镁反应的氢氧化钠的物质的量为:0.2020mol•L-1×0.0125L,总的氢氧化钠的物质的量为:0.2020mol•L-1×V1×10-3L,过量的氢氧化钠的物质的量为:0.1012mol•L-1×V3×10-3L,
则氯化镁的物质的量浓度为
0.2020mol/L×V1×10−3L−0.2020mol/L×0.0125L−0.1012mol/LV×3×10−3L
0.025L×2,
故答案为:溶液的颜色由黄色橙色变成橙色,沉淀溶解;过滤并洗涤沉淀,然后对滤液进行滴定;
0.2020mol/L×V1×10−3L−0.2020mol/L×0.0125L−0.1012mol/LV×3×10−3L
0.025L×2;
(3)取25.00mL工厂废水放入烧杯中,加入过量的氢氧化钠溶液溶液,过滤、洗涤沉淀、烘干、称重.计算出氯化镁的浓度;取25.00mL工厂废水放入烧杯中,加入过量的硝酸银溶液,过滤、洗涤沉淀、烘干、称重,计算出盐酸的浓度,
答:取25.00mL工厂废水放入烧杯中,加入过量的氢氧化钠溶液溶液,过滤、洗涤沉淀、烘干、称重.计算出氯化镁的浓度;取25.00mL工厂废水放入烧杯中,加入过量的硝酸银溶液,过滤、洗涤沉淀、烘干、称重.计算出盐酸的浓度.点评:
本题考点: 中和滴定.
考点点评: 本题主要考查了物质成分的测定,难度不大,注意氢氧化钠与各物质之间的关系.1年前查看全部
- 点位滴定法确定终点 与指示剂法相比 有什么优缺点?
 caoyasweet1年前1
caoyasweet1年前1 -
 童年小路 共回答了16个问题
童年小路 共回答了16个问题 |采纳率81.3%电位滴定法相比指示剂法最大的优点就是完全避免待滴定溶液本身自带颜色对读数的干扰,还有一点就是电位滴定法可以做到完全自动化滴定,效率极高.电位滴定法的缺点就是对仪器的精度要求很高,否则很难得到如指示剂法那样精准的读数,精度不高的话,对检出限有一定的限制,对于某些微量滴定来说,电位滴定法显得有些力不从心.1年前查看全部
- 滴定分析常用的滴定方式:1.直接滴定法 2.返滴定法 3.置换滴定法 4.间接滴定法 ,请说出个自己的适用范围
 怪鸟1年前1
怪鸟1年前1 -
 Jeniya 共回答了24个问题
Jeniya 共回答了24个问题 |采纳率79.2%1.直接滴定法:符合滴定条件的物质(反应定量完全、反应速度快、有适宜的指示剂)盐酸滴定氢氧化钠等.
2.返滴定法:至少有一条不符合上述条件.如:配位滴定中铝的滴定,先过量(已知浓度和体积)EDTA,加热,铝与EDTA充分反应,...,然后用锌标准滴定过量EDTA.计算出铝.
3.置换滴定法 :至少有一条不符合上述条件.续上:如:配位滴定中铝的滴定,先过量EDTA,加热,铝与EDTA充分反应,...,然后用锌标准滴定过量EDTA.然后加入氟化物,加热,铝中EDTA被氟定量置换,再用锌标准溶液滴定,此次锌量与铝量对用相同(指mol).
4.间接滴定法:应用很少.例:测定磷酸根,先将其定量沉淀为磷酸铵镁,过滤洗涤后,用盐酸溶解,加入已知过量EDTA,在pH=10,用Mg标准溶液滴定EDTA过量部分,二者之差为磷酸铵镁中镁的量,也是磷酸根的量.1年前查看全部
- 怎样用“滴定法”测定硫酸亚铁铵晶体中Fe2+的含量?
 curtismeng1年前1
curtismeng1年前1 -
 xiatiandeyu 共回答了16个问题
xiatiandeyu 共回答了16个问题 |采纳率93.8%先将溶液酸化,用高锰酸钾滴定,出现紫色滴定结束
5Fe(2+)+MnO4(-)+8H(+)===5Fe(3+)+Mn(2+)+4H2O1年前查看全部
- 高氯酸滴定法的优缺点
 当爱已走开1年前1
当爱已走开1年前1 -
 同甘共苦是非功过 共回答了25个问题
同甘共苦是非功过 共回答了25个问题 |采纳率84%优点是快速,作为含量测定来说,化学法肯定要比液相之类的要快.但是缺点也很多,因为它是非水滴定,所以环境要求较高,湿度不能大,温度一定要是标定温度,使用的器皿一定要干燥,而且不能边滴定边溶解(这点最讨厌!)1年前查看全部
- 何时用用直接滴定法
 蓝色的喜欢1年前2
蓝色的喜欢1年前2 -
 kenko_weijin 共回答了18个问题
kenko_weijin 共回答了18个问题 |采纳率100%1.按一定的反应式进行,具有确定的化学计量关系
比如碘量法
2.反应定量进行(转化率大于99.9%),无副反应,平衡常数大
3.反应速度快
4.要有合适的确定滴定终点的方法,有合适的指示剂1年前查看全部
- 计算柠檬酸的纯度:用滴定法测定,氢氧化钠的密度为40/dm3,体积为8cm3,柠檬酸的质量为4g,柠檬酸溶液的体积为25
计算柠檬酸的纯度:用滴定法测定,氢氧化钠的密度为40/dm3,体积为8cm3,柠檬酸的质量为4g,柠檬酸溶液的体积为25cm3
然后书上说有一个这样的公式:酸的密度=3X(氢氧化钠的质量/柠檬酸的体积) 我看到这里就完全不明白了 书上的结果是38.4g/dm3
根据这个算出酸的密度之后,乘以体积得到酸的质量为0.96,所以融在100cm3的水中的酸的质量为3.84g 我不明白为什么既然前面明明体积是25cm3,后面又要转到100cm3来算
最后就是(3.84/4)X100=96%
这道题原先是英文的,译成中文可能会有错漏,如果大家有问题的话尽管问我啊.
英文原文:
interpreting titration results
Calculate the purity of citric acid used when...
-concentration of sodium hydroxide=40g/dm3
-volume of sodium hydroxide=8cm3
-mass of citric acid=4g
-volume of citric acid solution=25cm3
first,using the formula below,calculate the concentration of citric acid by substituting the values.
concentration of acid=3 X (volume X conc.NaOH/volume citric acid)
(这里又附注道:1 molecule of citric acid reacts with 3 molecules of sodium hydroxide.
you have to work in dm3 when doing the calculations)
Then,work out the actual mass of citric acid in the sample:answer is 0.96g
If the mass of citric acid dissolved in 25cm3 is 0.96g,the mass of citric acid dissolved in 100cm3 of water will be 4g X 0.96=3.84g
% of purity=(calculated mass/mass weighed ot at start)X100=96%
那我还想问一下,那个“酸的密度=(氢氧化钠的质量/酸的体积)”又是怎么得出来的? lotusmilan1年前4
lotusmilan1年前4 -
 茱3 共回答了15个问题
茱3 共回答了15个问题 |采纳率93.3%concentration of acid=3 X (volume X conc.NaOH/volume citric acid)
这句话的意思其实就是
酸的体积*酸的浓度=3*碱的体积*碱的浓度
因为有柠檬酸和NaOH是1:3反应的,所以上式右边要*3
不过这里有个问题是,两者的式量是不同的,按照道理来说不能简单的以浓度*体积来算,这样得出的结果是不正确的,而按照物质的量浓度*体积来算才对(concentration在这里的exact的意思是什么能提示下么?这里我只能理解为NaOH在该溶液中的浓度为40g/dm3,也就是1mol/L).
还有就是按照题目的意思,If the mass of citric acid dissolved in 25cm3 is 0.96g,the mass of citric acid dissolved in 100cm3 of water will be 4g X 0.96=3.84g
也就是说滴定的是25ml,而最初4g柠檬酸是溶解成为100ml溶液的,因此这里需要*4,但是不是你写的4g*0.96,而是4*0.96g.1年前查看全部
- 直接滴定法测定还原糖,滴定时为什么要控制滴定的速度?进行浓度预测过高或过低怎么办?
 szszpeng1年前1
szszpeng1年前1 -
 风四哥 共回答了23个问题
风四哥 共回答了23个问题 |采纳率87%因为滴定速度对实验结果影响较大,滴定速度过快,消耗还原糖量多,反之,则消耗还原糖量少.预测浓度过大或过小应加以调整,使预测时消耗样液量在10ml左右.1年前查看全部
- Ni-P镀液中镍离子含量的测定,最好是用滴定法,
Ni-P镀液中镍离子含量的测定,最好是用滴定法,
最好使用滴定的方法, hnbingo1年前1
hnbingo1年前1 -
 yrgang 共回答了19个问题
yrgang 共回答了19个问题 |采纳率84.2%简要介绍:取样液稀释,吸液管吸液至角瓶中,水稀释,加pH=10 氨-氯化铵缓冲溶液,紫尿酸铵为指示剂,0.05M EDTA 滴定至稳定的玫瑰红色出现.1年前查看全部
- 怎么测定溴离子跟氯离子的浓度?除了滴定法之外
 遂安小rr1年前3
遂安小rr1年前3 -
 静水流深123 共回答了21个问题
静水流深123 共回答了21个问题 |采纳率85.7%用硝酸银呀,向溶液中加过量硝酸银,根据沉淀质量算出对应离子的质量.1年前查看全部
- 如何测氨水中氨的含量我知道用滴定法,谁能说下具体步骤,化学我是门外汉,请尽量说得通俗易懂点,还有都需要什么药剂,药剂的配
如何测氨水中氨的含量
我知道用滴定法,谁能说下具体步骤,化学我是门外汉,请尽量说得通俗易懂点,还有都需要什么药剂,药剂的配置方法, 王猩零1年前1
王猩零1年前1 -
 hiphoper628 共回答了16个问题
hiphoper628 共回答了16个问题 |采纳率93.8%滴定法也分精测和粗测.要求不高的话就用0.5mol/L的稀硫酸做酸碱中和滴定,方法:
把0.5mol/L的稀硫酸注入事先已用该硫酸溶液润洗过的酸式滴定管,至刻度“ 0”以上,把滴定管固定在滴定管夹上.轻轻转动下面的活塞,使管的尖嘴部分充满溶液且无气泡.然后调整管内液面,使其保持在“0”或“0”以下的某一刻度,并记下准确读数;把待测浓度的氨水注入事先已用该溶液润洗过的酸式滴定管(氨水会腐蚀碱式滴定管的橡胶),也把它固定在滴定管夹上.轻轻挤压钢球,使管的尖嘴部分充满溶液且无气泡,然后调整管内液面,使其保持在“ 0”或“ 0”以下某一刻度,并记下准确读数.
在管下放一洁净的锥形瓶,从碱式滴定管放出25.00 mL 氨水,注入锥形瓶,加入 2滴甲基橙试液,溶液立即呈黄色.然后,把锥形瓶移到酸式滴定管下,左手调活塞逐滴加入已知物质的量浓度的硫酸,同时右手顺时针不断摇动锥形瓶,使溶液充分混合.随着硫酸逐滴加入,锥形瓶里OH-浓度逐渐减小.最后,当看到加入1滴酸时,溶液变成橙红色.停止滴定,准确记下滴定管溶液液面的刻度,并准确求得滴定用去酸的体积.为保证测定的准确性,上述滴定操作应重复二至三次,并求出滴定用去酸体积的平均值.然后根据有关计量关系,计算出待测的氨水的物质的量浓度.具体计量关系为C(A)*V(A)=C(B)*V(B),其中A(Acid)为酸,B(Base)为碱.
如果要求精确的话就用草酸氢钾做中和滴定,如果在精确的话就用硝酸银做滴定.1年前查看全部
- 如何用分析滴定法测定水的酸碱性?
 msmsmfdsa1年前2
msmsmfdsa1年前2 -
 黑骨精 共回答了18个问题
黑骨精 共回答了18个问题 |采纳率88.9%如果你的水是酸性的,你就用氢氧化钠标准溶液滴定,如果你的水是碱性的,你就用盐酸或者硫酸标准溶液滴定.指示剂你会选取的了.1年前查看全部
- 用滴定法测量水中氯离子要用什么试剂?
 分-寸1年前1
分-寸1年前1 -
 淡蓝风清 共回答了15个问题
淡蓝风清 共回答了15个问题 |采纳率93.3%如果测量水中游离氯离子的含量,用一种叫“甲土立丁”的试剂就可以测定了,比如象游泳池的水处理、自来水的水处理等,大多都是使用这种试剂的.1年前查看全部
- 还原糖直接滴定法样品经除去蛋白质后,在加热条件下,以次甲基蓝作指示剂,滴定标定过的碱性酒石酸铜溶液(用还原糖标准溶液标定
还原糖直接滴定法
样品经除去蛋白质后,在加热条件下,以次甲基蓝作指示剂,滴定标定过的碱性酒石酸铜溶液(用还原糖标准溶液标定碱性酒石酸铜溶液),根据样品液消耗体积计算还原糖量.
怎么根据样品消耗体积计算还原糖量啊?不懂这个原理 平凡a1年前1
平凡a1年前1 -
 真爱就不顾一切 共回答了23个问题
真爱就不顾一切 共回答了23个问题 |采纳率91.3%假设共有还原糖100毫升,滴定用去25毫升,则根据比例25比100算出总量.1年前查看全部
- 如何溶解环氧化纤维素纤维,这个纤维是用粘胶纤维和环氧氯丙烷合成.我要溶解后,用滴定法策略环氧基团含
 uuuuww1年前1
uuuuww1年前1 -
 mm骑士2000 共回答了18个问题
mm骑士2000 共回答了18个问题 |采纳率88.9%可以采用3-烯丙基-3-甲基氯代咪唑离子液体作为溶剂,在其中纤维素溶解度可以达到14%(质量百分比).这也是近年来发展迅速的新溶剂法制取再生纤维的优质 溶剂.1年前查看全部
- 用滴定法测量水中氯离子要用什么试剂?
 QQ精1年前1
QQ精1年前1 -
 geminiwlj 共回答了19个问题
geminiwlj 共回答了19个问题 |采纳率89.5%如果测量水中游离氯离子的含量,用一种叫“甲土立丁”的试剂就可以测定了,比如象游泳池的水处理、自来水的水处理等,大多都是使用这种试剂的.1年前查看全部
- 测定溶液中铜离子含量的可行性方法,滴定法,分光光度计法?
 百姓zhang1年前1
百姓zhang1年前1 -
 Gary_xie 共回答了19个问题
Gary_xie 共回答了19个问题 |采纳率84.2%常用分光光度法.1年前查看全部
- 设计实验:试样中含有镁离子和铵根离子.用滴定法测出它们的浓度
设计实验:试样中含有镁离子和铵根离子.用滴定法测出它们的浓度
实验原理.计算公式 圆裤花1年前1
圆裤花1年前1 -
 jarry20 共回答了15个问题
jarry20 共回答了15个问题 |采纳率80%镁离子用EDTA,铵根用酸碱滴定1年前查看全部
- 滴定法测次氯酸钠溶液中次氯酸钠的量,用什么滴定剂?反应结束的现象是怎样?
 yy34wusu1年前3
yy34wusu1年前3 -
 mayaking 共回答了24个问题
mayaking 共回答了24个问题 |采纳率83.3%又是将军大人?
用次氯酸钠滴定标准亚硫酸钠溶液,标准液中加入标准液体积1%的淀粉碘化钾做指示剂.
终点为溶液变蓝.1年前查看全部
- 在用滴定法测过氧化氢酶的活性时,其中在标顶滴液硫代硫酸钠时,其浓度根据什么计算,如何计算
 kentai1231年前1
kentai1231年前1 -
 魍魉天使 共回答了24个问题
魍魉天使 共回答了24个问题 |采纳率91.7%用基准重铬酸钾标定
硫代硫酸钠的浓度公式C=1000m/M(V2-V1)
其中m是基准重铬酸钾的质量,精确到万分之一克,单位是克
V1是滴空白样消耗的硫代硫酸钠体积,单位是mL(不做空白试验则此项为0)
V2是标定使用的硫代硫酸钠体积,单位是mL
M是1/6的重铬酸钾摩尔质量(根据反应的比率),一般取M=49.031g/mol1年前查看全部
- 测试硫酸浓度具体步骤如题,滴定法测试的步骤
 音无夜1年前1
音无夜1年前1 -
 xzm0525 共回答了21个问题
xzm0525 共回答了21个问题 |采纳率95.2%称取amL的待测硫酸溶液置于锥形瓶中,加入2-3滴酚酞指示剂
用已知浓度的氢氧化钠标准溶液润洗碱式滴定管,然后向滴定管中加入该氢氧化钠溶液至零刻度或以下
用碱式滴定管向锥形瓶中滴加氢氧化钠溶液,同时震荡锥形瓶并观察锥形瓶中溶液颜色变化
当加入一滴氢氧化钠溶液发现溶液变为粉红色且半分钟内不退色时停止滴定
读出所用氢氧化钠溶液的体积进行计算即可1年前查看全部
- 水果中总酸度的测定 要用滴定法测
 xuxiangcho1年前1
xuxiangcho1年前1 -
 子-弹 共回答了11个问题
子-弹 共回答了11个问题 |采纳率90.9%(1).称取实验室制备试样10克(精确至0.0001克),移入250ml容量瓶中,加水稀至150ml,盖上瓶盖,放入旋转振荡器内振荡30分钟,取出,用水稀释至刻度,摇匀.干过滤.(2)精确移取过滤液25.0ml于300ml三角瓶中,加入水50ml,加入3滴甲基红指示剂,摇匀,用0.1000.moL的氢氧化钠标液滴定至黄色为终点.记下滴定体积ml.(3)计算:略!1年前查看全部
- 如何用滴定法滴定溶液的pH值?我这里用的是草酸溶液滴定,但是忘记了 怎么换算,有没有公式?溶液一般是碱性的多些~
 temp123456781年前2
temp123456781年前2 -
 wanmeisj 共回答了8个问题
wanmeisj 共回答了8个问题 |采纳率100%没明白楼主的意思呢?你要求pH?是测定PH值的方法?分析测试百科网乐意为你解答实验中碰到的各种问题,祝你实验顺利,有问题可找我,百度上搜下就有.
酸碱中和PH至7么?最后是氢离子与氢氧根离子总量相等吧
测定PH没听说过用滴定法的.楼主的意思表达错误了.1年前查看全部
- 蒸馏-滴定法做氨氮馏出液为什么不变色
 46不懂1年前1
46不懂1年前1 -
 猪的妄想 共回答了14个问题
猪的妄想 共回答了14个问题 |采纳率85.7%1.确保样品中的氮是以氨氮形式存在的,若是有机氮需要消解后蒸馏; 2.蒸馏前需要采用NaOH调整pH至10以上,最好是12以上,且加入NaOH后应立即密封; 3.1年前查看全部
- 如何用滴定法测试氢氧化钠溶液浓度?
如何用滴定法测试氢氧化钠溶液浓度?
我想知道用含量为百分之一的氢氧化钠溶液进行镀铝产品的检验后,在此溶液反复使用过程中浓度发生了变化如何用滴定发检测出其使用后的浓度?能不能介绍一下步骤和实验所用的仪器?另外如果浓度在使用后发生了变化如何能调整至规定的浓度比例?(百分之一)谢谢了! polo_zhou1年前2
polo_zhou1年前2 -
 艾晚绿 共回答了16个问题
艾晚绿 共回答了16个问题 |采纳率81.3%可以用草酸滴定
草酸(带两个结晶水,分析纯)化学式是H2C2O4.2H2O
配制成溶液后,可以知道草酸的浓度
然后用酸碱滴定装置滴定氢氧化钠即可,用酚酞试剂做指示剂,起初酚酞滴到氢氧化钠里是红的,滴到恰好成粉红色且30秒内不变色,就是终点了,计算一下就知道了
仪器:酸碱滴定管
或者如楼上所说的酸碱滴定计来计算
测出浓度后就好办了
计算一下,浓的加水,稀了加氢氧化钠固体,加完后还得再滴定浓度1年前查看全部
- 如何用滴定法测试硫酸浓度?用0.5mol/L的氢氧化钠滴定怎么计算?
 jane20031年前1
jane20031年前1 -
 shelley_f 共回答了16个问题
shelley_f 共回答了16个问题 |采纳率87.5%1.取一定量的浓硫酸
2.加入紫色酚酞试液
3.用胶头滴管取0.5mol/L的氢氧化钠溶液滴定,待溶液恢复成紫色,停止滴定
4.通过消耗掉的氢氧化钠计算反应消耗的硫酸物质的量
5.用反应掉的硫酸除以硫酸的体积就是硫酸浓度1年前查看全部
- (2013•江苏三模)用氯化铁浸出重铬酸钾(K2Cr2O7)滴定法测定钛精粉试样中单质铁的质量分数[ω(Fe)%],实验
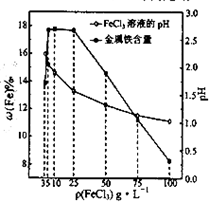 (2013•江苏三模)用氯化铁浸出重铬酸钾(K2Cr2O7)滴定法测定钛精粉试样中单质铁的质量分数[ω(Fe)%],实验步骤如下:
(2013•江苏三模)用氯化铁浸出重铬酸钾(K2Cr2O7)滴定法测定钛精粉试样中单质铁的质量分数[ω(Fe)%],实验步骤如下:
步骤1:称取试样0.100g于250mL洗净的锥形瓶中.
步骤2:加入FeCl3溶液100mL,迅速塞上胶塞,用电磁搅拌器30min.
步骤3:过滤,用水洗涤锥形瓶和滤渣各3~4次,洗液全部并入滤液中.
步骤4:将滤液稀释至500mL,再移去100mL稀释液于锥形瓶中,加入20mL硫酸和磷酸的混合酸,加0.5%二苯胺磺酸钠指示剂4滴.
步骤5:以K2Cr2O7标准溶液滴定至出现明显紫色为终点.发生的反应为:Cr2O72-+6Fe2++14H+=2Cr3++Fe3++7H2O.
步骤6:重复测定两次.
步骤7:数据处理.
(1)步骤2中加入FeCl3溶液后锥形瓶中发生反应的离子方程式为______,迅速塞上胶塞的原因是______.
(2)步骤3中判断滤纸上残渣已洗净的方法是______.
(3)实验中需用到100mL浓度为0.01mol•L-1K2Cr2O7标准溶液,配置时用到的玻璃仪器有______.称量K2Cr2O7固体前应先将其烘干至恒重,若未烘干,对测定结果的影响是______(填“偏高”、“偏低”、或“无影响”):滴定时,K2Cr2O7溶液应置于______(填仪器名称)中.
(4)科研人员确定FeCl3溶液的最佳浓度,选用100mL不同浓度的FeCl3溶液(FeCl3溶液均过量)溶解同一钛精粉试样,其余条件控制相同,得到测定结果如图所示.则FeCl3溶液的浓度[用ρ(FeCl3)表示]范围应为______g•L-1,浓度过低或过高时测定结果偏低的原因分别是______. yxy_qzkz1年前1
yxy_qzkz1年前1 -
 sonic0320 共回答了20个问题
sonic0320 共回答了20个问题 |采纳率90%解题思路:(1)钛精粉试样中含单质铁,加入氯化铁溶液反应生成氯化亚铁,迅速塞上胶塞防止生成的亚铁离子被氧气氧化;
(2)依据检验氯化铁溶液中的氯离子的存在分析判断是否洗涤干净;
(3)依据溶液配制的实验过程中的操作步骤分析选择所需仪器;若未烘干会增大标准液的体积,造成测定结果偏高,K2Cr2O7溶液是强氧化剂,能腐蚀橡胶管,应盛在酸式滴定管中;
(4)依据图象变化曲线分析,FeCl3溶液的浓度在5-25g/L时铁的质量分数最大,浓度低溶解速率慢,浓度高溶液酸性强和铁发生反应;(1)钛精粉试样中含单质铁,加入氯化铁溶液反应生成氯化亚铁,反应的离子方程式为:2Fe3++Fe=3Fe2+,迅速塞上胶塞防止生成的亚铁离子被氧气氧化;
故答案为:2Fe3++Fe=3Fe2+,防止Fe2+被空气中的氧气氧化;
(2)依据检验氯化铁溶液中的氯离子的存在分析判断是否洗涤干净,实验设计方案为:取最后一次洗涤滤出液,滴加硝酸银溶液,若无白色沉淀证明已洗净;
故答案为:取最后一次洗涤滤出液,滴加硝酸银溶液,若无白色沉淀证明已洗净;
(3)溶液配制的实验过程中的操作步骤为计算,称量、溶解、转移、洗涤定容,选择所需玻璃仪器为烧杯、玻璃棒、100ml容量瓶、胶头滴管;若未烘干会增大标准液的体积,造成测定结果偏高,K2Cr2O7溶液是强氧化剂,能腐蚀橡胶管,应盛在酸式滴定管中;
故答案为:100ml容量瓶,烧杯,玻璃棒,胶头滴管,偏高,酸式滴定管;
(4)依据图象变化曲线分析,FeCl3溶液的浓度在5g/L-25g/L时铁的质量分数最大,测定误差小,浓度低时溶解速率慢,单质铁未全部反应,浓度高溶液酸性强和铁发生反应;
故答案为:5-25,浓度过低时溶解速率过慢,单质铁未完全反应;浓度过高时溶液酸性强,溶液中H+与单质铁反应;点评:
本题考点: 探究物质的组成或测量物质的含量.
考点点评: 本题考查了物质含量的实验分析验证,物质性质和实验基本操作是解题关键,题目难度中等.1年前查看全部
- 下列说法正确的是 A.只有酸碱中和反应才可使用滴定法测物质浓度 B.只要是酸碱中和反应,无论使用酚酞还是甲基橙,误差都非
下列说法正确的是
A.只有酸碱中和反应才可使用滴定法测物质浓度 B.只要是酸碱中和反应,无论使用酚酞还是甲基橙,误差都非常小,但不能使用变色不明显的石蕊作指示剂 C.通过酸碱滴定曲线的绘制可知,酸溶液pH的增加与加入NaOH溶液的体积成正比 D.分光光度计可用于某些无色物质的比色测定  婚后的女人1年前1
婚后的女人1年前1 -
 x_164 共回答了15个问题
x_164 共回答了15个问题 |采纳率93.3%D
分光光度计可以检测到近紫外、近红外光区的信号,可以检测在此范围内有特征吸收光谱的无色物质。1年前查看全部
- 直接滴定法测定食品的还原糖是,菲林试剂是什么的硫酸铜的碱性溶液?
 忍无可忍8881年前1
忍无可忍8881年前1 -
 jerkson 共回答了15个问题
jerkson 共回答了15个问题 |采纳率66.7%还原糖:葡萄糖,果糖,麦芽糖
菲林试剂是氢氧化钠硫酸铜的碱性溶液
菲林试剂与可溶性的还原性糖在加热的条件下生成砖红色的氧化亚铜沉淀,从而鉴定可溶性的还原性糖是否存在.1年前查看全部
- 我周六要参加关于滴定法应用具体内容是用已知浓度NaOH 检测未知的HCl 还有应该怎样减小结果的误差 等我回了国一定重谢
我周六要参加关于滴定法应用
具体内容是用已知浓度NaOH 检测未知的HCl 还有应该怎样减小结果的误差 等我回了国一定重谢! vistaqq1年前1
vistaqq1年前1 -
 鬼酷狼好 共回答了27个问题
鬼酷狼好 共回答了27个问题 |采纳率92.6%1、一般取三份被检测物;2、用同一吸液管吸取,用同种方法处理,如用试纸擦拭吸液管外壁等;3、滴定管最大刻度25ml,则滴定液消耗量约在20ml左右,不可以一管滴完再加一管那样做,实在不行就换用50ml甚至更高的大管,此时...1年前查看全部
- (化学)为什么 滴定法测氢氧化钙Ksp
(化学)为什么 滴定法测氢氧化钙Ksp
为什么可以用HCL滴定ca(oh)2 来测 氢氧化钙Ksp 当氢离子 和 氢氧化钙 离解出来 的氢氧根 反应时 离解反应会因为 氢氧根被消耗 而向右移动 从而理解出更多的氢氧根 江海一舟1年前1
江海一舟1年前1 -
 郁姨 共回答了17个问题
郁姨 共回答了17个问题 |采纳率88.2%应该是测饱和石灰水的浓度c
Ksp=s*(2s)^2=c*(2c)^21年前查看全部
大家在问
- 1英语翻译1、being afraid to go too far near the edge2、as they hid
- 2物理量的单位均可以互相导出 这句话是正确的吗
- 3如果说生命是一杯咖啡,那么时间则是一块方糖,调味人生;如果说生命是一扇大门,那么时间则是一把钥匙,开启人生;如果说生命是
- 4KYN是什么电器
- 5小流域治理工程分几部分
- 6能不能用电桥偏离平衡位置的不同程度来测量未知电阻?如何测?
- 7我是初中生,以o结尾的单词什么时候加S 什么时候加es?
- 8用名词的适当形式填空(5题)急!
- 9读书破万卷,下笔如有神之类的句子是写什么的?
- 10边长为0.1M,质量为0.6KG的正方体木块放在容器中,给容器中注水一段时间后,木块浮起.
- 11people usually spend time with their relatives d ring the sp
- 12八年级水平用take sb place造句速度啊
- 13观察下列等式:9-1=8,16-4=12,25-9=16,36-16=20,…设n表示正整数,下面符合上述规律的等式是(
- 14市面上出售的“水壶一次净”能较好地除去水壶中的水垢,为确定它的成分和使用范围,某同学通过以下实验进行探究:
- 15help with translation
