催熟剂与膨大剂短文中:用简洁的语言概括两者之间的区别
 福泡泡2022-10-04 11:39:541条回答
福泡泡2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 天使338 共回答了14个问题
天使338 共回答了14个问题 |采纳率85.7%- 催熟是增加水果内的乙烯起到加速成熟的效果,膨大剂只能让水果的体型增大.
- 1年前
相关推荐
- 水果催熟剂用低压水银灯照射水果,引起光化学反应,使催熟剂转化为没有催熟作用的有机物.主要反应的化学方程式是?
 Pappel1年前1
Pappel1年前1 -
 obeistern 共回答了17个问题
obeistern 共回答了17个问题 |采纳率88.2%CH2=CH2 + H2O ---光--- CH3CH3OH1年前查看全部
- 乙烯不是催熟剂吗?为什么成熟的果实会比不成熟的果实还多?
 jdsws19771年前1
jdsws19771年前1 -
 青鸟2005 共回答了20个问题
青鸟2005 共回答了20个问题 |采纳率90%原本乙烯就是成熟的果实中含有的,因为把它放靠近不成熟的果实会加速果实的
成熟所以也叫催化剂!1年前查看全部
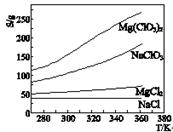
- 1.Mg(ClO3)2在农业上常用作脱叶剂、催熟剂,可由MgCl2和NaClO3反应制得.已知四种化合物的溶
1.Mg(ClO3)2在农业上常用作脱叶剂、催熟剂,可由MgCl2和NaClO3反应制得.已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示.下列选项不正确的是
A.四种化合物的溶解度随温度变化最大的 是Mg(ClO3)2
B.300K时,MgCl2的溶解度约为55 g
C.300K时,NaClO3饱和溶液温度升高至 340K,溶质的质量分数变大(不考虑水蒸发)
D.该反应为复分解反应,反应中有沉淀生 成,生成的沉淀是NaCl
2.Fe3O4固体和一定量的盐酸恰好完全反应,测得反应后溶液中Fe3+和Cl-的个数比为
1 :4,则Fe2+和Cl-个数比为
A.1 :1 B.1 :2 C.1 :3 D.1 :8
3.
有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加稀盐酸,沉淀的质量与加入盐酸体积的关系如右图所示.由此推断白色固体中
A.肯定只存在BaCl2 B.可能存在NaOH
C.可能存在Na2SO4 D.肯定不存在Na2CO3

 nichoi1年前1
nichoi1年前1 -
 独自墨非 共回答了12个问题
独自墨非 共回答了12个问题 |采纳率100%第一题选C,因为NaClO3是反应物,所以就算溶解度升高,但是量是减少的.
第二题选D,因为溶液一定是中性的,所以正负电荷一定相等.计算一下就好
第三题选C,因为溶于水有沉淀,切加盐酸有不容物.所以Na2SO4、Na2CO3、BaCl2都有
曲线是直直向下,所以没有NAOH
望采纳,谢谢1年前查看全部
- 下列说法不正确的是( )A.乙烯是一种植物生长调节剂,可用作果实催熟剂B.聚乙烯薄膜不可用作食品包装C.油脂在碱性条件
下列说法不正确的是( )
A.乙烯是一种植物生长调节剂,可用作果实催熟剂
B.聚乙烯薄膜不可用作食品包装
C.油脂在碱性条件下的水解反应称为皂化反应,工业生产中常用此反应来制取肥皂
D.蛋白质在人体胃蛋白酶和胰蛋白酶的催化作用下,经过水解最终生成氨基酸 moonlei20001年前1
moonlei20001年前1 -
 taolue01 共回答了16个问题
taolue01 共回答了16个问题 |采纳率87.5%解题思路:A.乙烯是一种植物生长调节剂;
B.聚乙烯无臭,无毒,手感似蜡,具有优良的耐低温性能(最低使用温度可达-70~-100℃),化学稳定性好;
C.油脂在碱性条件下能水解;
D.蛋白质水解最终生成氨基酸.A.乙烯是一种植物生长调节剂,可用作果实催熟剂,故A正确;
B.聚乙烯薄膜无毒可用作食品包装,故B错误;
C.油脂在碱性条件下的水解反应称为皂化反应,工业生产中常用此反应来制取肥皂,故C正确;
D.蛋白质在人体胃蛋白酶和胰蛋白酶的催化作用下,经过水解最终生成氨基酸,故D正确.
故选B.点评:
本题考点: 乙烯的用途;油脂的性质、组成与结构;氨基酸、蛋白质的结构和性质特点.
考点点评: 本题考查乙烯聚乙烯,油脂蛋白质的性质,难度不大,平时注意知识的积累.1年前查看全部
- Mg(ClO 3 ) 2 在农业上常用作脱叶剂、催熟剂,可采用复分解反应制备:MgCl 2 +2NaClO 3
Mg(ClO 3 ) 2 在农业上常用作脱叶剂、催熟剂,可采用复分解反应制备:MgCl 2 +2NaClO 3 =Mg(ClO 3 ) 2 +2NaCl。已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示。下列叙述正常的是
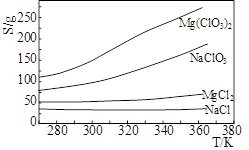
A.四种化合物的溶解度随温度变化最小的是Mg(ClO 3 ) 2 B.300K时,MgCl 2 的溶解度约为55g C.300K时,100gNaCl饱和溶液中约含有NaCl 36g D.该反应能够进行的条件是生成沉淀,该沉淀是Mg(ClO 3 ) 2  yisihan1年前1
yisihan1年前1 -
 oohehe 共回答了15个问题
oohehe 共回答了15个问题 |采纳率86.7%B
1年前查看全部
- 用简洁的语言概括催熟剂与膨大剂之间的区别
 wojiushiwo1231年前1
wojiushiwo1231年前1 -
 cd515 共回答了19个问题
cd515 共回答了19个问题 |采纳率84.2%催熟剂是使农作物加速成熟,某些水果成熟后也会自然产生一些催熟剂;如把弥猴桃和苹果放在一起,利于弥猴桃变得更可口.
膨大剂是属激素类化学物质,主要功能是使蔬菜瓜果变大.1年前查看全部
- 在那能买到乙烯控释剂(香蕉催熟剂)
 晓人事知天命1年前1
晓人事知天命1年前1 -
 winorc 共回答了19个问题
winorc 共回答了19个问题 |采纳率94.7%生香蕉催熟的话,简单的话其实大可不必利用化学药品.乙烯而已,熟透的苹果会散发大量乙烯,装一个袋子里密封即可.1年前查看全部
- 化学与生活密切相关。下列说法不正确的是 A.乙烯可作水果的催熟剂 B.硅胶可作袋装食品的干燥剂 C.福尔马林可作食品的保
化学与生活密切相关。下列说法不正确的是
A.乙烯可作水果的催熟剂 B.硅胶可作袋装食品的干燥剂 C.福尔马林可作食品的保鲜剂 D.氢氧化铝可作胃酸的中和剂  亚洲非洲1年前1
亚洲非洲1年前1 -
 临风飘雪 共回答了12个问题
临风飘雪 共回答了12个问题 |采纳率100%C
1年前查看全部
- 关于乙稀用途下列不正确的是 A制塑料B生产有机溶剂C作果实催熟剂D作燃料
 cctv971年前1
cctv971年前1 -
 sxsfphz 共回答了19个问题
sxsfphz 共回答了19个问题 |采纳率89.5%B1年前查看全部
- 下列说法不正确的是( )A.乙烯可作水果的催熟剂B.硅胶可作袋装食品的干燥剂C.福尔马林可作食品的保鲜剂D.小苏打可作
下列说法不正确的是( )
A.乙烯可作水果的催熟剂
B.硅胶可作袋装食品的干燥剂
C.福尔马林可作食品的保鲜剂
D.小苏打可作胃酸的中和剂 bznjkly1年前1
bznjkly1年前1 -
 rr山妞 共回答了18个问题
rr山妞 共回答了18个问题 |采纳率88.9%解题思路:A.乙烯是植物当中天然存在的生长激素,能调节植物的成熟和衰老;
B.硅胶的表面积比较大,有微孔,吸水效果好;
C.福尔马林有毒,不能用作食品的保鲜剂;
D.小苏打为碳酸氢钠,能够中和胃酸中的盐酸.A.由于乙烯是植物当中天然存在的生长激素,能调节植物的成熟和衰老,所以乙烯可作水果的催熟剂,故A正确;
B.由于硅胶具有很好的吸附性,且无毒,可以用作袋装食品的干燥剂,故B正确;
C.福尔马林有毒,可以用于浸泡标本,但不能作食品的保鲜剂,故C错误;
D.小苏打能够与胃酸中的盐酸反应,能够作胃酸的中和剂,故D正确;
故选C.点评:
本题考点: 乙烯的用途;钠的重要化合物;甲醛.
考点点评: 本题考查了生活中常见物质的性质及用途,题目难度不大,注意明确常见物质的组成、结构与性质,熟练掌握基础知识是解答本题的关键.1年前查看全部
- 已知有机物A能发生以下转化,并且A可以作为水果的催熟剂,在一定条件下,
已知有机物A能发生以下转化,并且A可以作为水果的催熟剂,在一定条件下,
A可以发生自身加成反应,形成高分子化合物E.
请回答下列问题:
(1)写出下列化合物的结构简式:B______;D______;
(2)写出反应①、②的化学方程式,并注明反应类型:
①CH2=CH2+H2O
CH3CH2OH一定条件下 CH2=CH2+H2O反应类型______;
CH3CH2OH一定条件下
②2CH3CH2OH+O2
2CH3CHO+2H2OCu △ 2CH3CH2OH+O2反应类型______.
2CH3CHO+2H2OCu △  longxiaodongfang1年前1
longxiaodongfang1年前1 -
 tti123 共回答了20个问题
tti123 共回答了20个问题 |采纳率95%解题思路:A可以作为水果的催熟剂,则A是CH2=CH2,A和水发生加成反应生成B,B的结构简式为CH3CH2OH,在Cu作催化剂、加热条件下,B被氧气氧化生成C,C的结构简式为CH3CHO,B和D在浓硫酸作催化剂、加热条件下发生酯化反应生成乙酸乙酯,则D的结构简式为CH3COOH,一定条件下,A可以发生自身加成反应,形成高分子化合物E,E的结构简式为: ,再结合物质的性质分析解答.
,再结合物质的性质分析解答.
可以作为水果的催熟剂,则A是CH2=CH2,A和水发生加成反应生成B,B的结构简式为CH3CH2OH,在Cu作催化剂、加热条件下,B被氧气氧化生成C,C的结构简式为CH3CHO,B和D在浓硫酸作催化剂、加热条件下发生酯化反应生成乙酸乙酯,则D的结构简式为CH3COOH,一定条件下,A可以发生自身加成反应,形成高分子化合物E,E的结构简式为:
 ,
,
(1)通过以上分析知,B的结构简式为CH3CH2OH,D的结构简式为CH3COOH,故答案为:CH3CH2OH;CH3COOH;
(2)①在一定条件下,乙烯和水发生加成反应生成乙醇,反应方程式为:CH2=CH2+H2O
一定条件下
CH3CH2OH,该反应属于加成反应,
故答案为:CH2=CH2+H2O
一定条件下
CH3CH2OH;加成反应;
②在Cu作催化剂、加热条件下,B被氧气氧化生成CH3CHO,反应方程式为:2CH3CH2OH+O2
Cu
△2CH3CHO+2H2O,该反应属于氧化反应,故答案为:2CH3CH2OH+O2
Cu
△2CH3CHO+2H2O;氧化反应.点评:
本题考点: 有机物的推断.
考点点评: 本题考查了有机物的推断,以乙烯为载体考查了乙烯和其它物质之间的转化,乙烯中含有碳碳双键导致乙烯能发生加成反应,再结合醇的性质分析解答,熟悉以乙烯为代表的烯烃的性质,题目难度不大.1年前查看全部
- (2014•闵行区一模)氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2•6H2O的
(2014•闵行区一模)氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2•6H2O的流程如图1:

已知:
①卤块主要成分为MgCl2•6H2O,含有MgSO4、FeCl2等杂质;
②几种化合物的溶解度(S)随温度(T)变化曲线如图2.
(1)加MgO后过滤所得滤渣的主要成分为______.
(2)加入BaCl2的目的是除去SO42-,如何检验SO42-已沉淀完全______.
(3)加入NaClO3饱和溶液会发生如下反应:MgCl2+2NaClO3→Mg(ClO3)2+2NaCl↓,请利用该反应,结合图1,制取Mg(ClO3)2•6H2O的实验步骤依次为:
①取样,加入NaClO3饱和溶液充分反应;
②______;
③______;
④______;
⑤过滤、洗涤,获得Mg(ClO3)2•6H2O晶体.
产品中Mg(ClO3)2•6H2O含量的测定:
步骤1:准确称量3.50g产品溶解定容成100mL溶液.
步骤2:取10mL于锥形瓶中,加入10mL稀硫酸和20mL 1.000mol/L的FeSO4溶液,微热.
步骤3:冷却至室温,用0.100mol/L K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+→2Cr3++6Fe3++7H2O.
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL.
(4)上述产品测定中需要检查是否漏液的仪器有______.步骤3中若滴定前不用标准液润洗滴定管,会导致最终结果偏______.(填“大”或“小”).
(5)产品中Mg(ClO3)2•6H2O的质量分数为______.(计算结果保留两位小数) JFOLIA1年前1
JFOLIA1年前1 -
 wht9533124 共回答了12个问题
wht9533124 共回答了12个问题 |采纳率83.3%解题思路:卤块的成分有MgCl2•6H2O、MgSO4、FeCl2,加入双氧水之后,亚铁离子可以被氧化为三价铁离子,再向混合物中加入氯化钡溶液,可以将硫酸根离子转化为硫酸钡沉淀,加入氧化镁,调节pH=4,可以促进铁离子的水解,将铁离子转化为氢氧化铁而除去,过滤,得到的滤液是氯化镁,可以根据溶解度受温度的影响情况来获得要制取的物质.
(1)根据加氧化镁后溶液的pH为4,可以沉淀的离子来回答;
(2)根据钡离子可以和硫酸根离子之间反应生成白色不溶于硝酸的白色沉淀来回答;
(3)根据物质的溶解度大小,溶液获得晶体的方法:蒸发结晶、过滤、冷却结晶;
(4)带有旋塞、活塞等部件的仪器使用之前必须查漏,滴定前要用标准液润洗滴定管,否则会将标准液稀释;
(5)氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价;根据化学反应得出各物质之间的关系式,计算百分含量.卤块的成分有MgCl2•6H2O、MgSO4、FeCl2,加入双氧水之后,亚铁离子可以被氧化为三价铁离子,再向混合物中加入氯化钡溶液,可以将硫酸根离子转化为硫酸钡沉淀,加入氧化镁,调节pH=4,可以促进铁离子的水解,将铁离子转化为氢氧化铁而除去,过滤,得到的滤液是氯化镁,可以根据溶解度受温度的影响情况来获得要制取的物质.
(1))调节溶液的pH为4,此时铁离子形成了沉淀氢氧化铁,钡离子已经和硫酸根离子只碱反应生成了硫酸钡沉淀,故答案为:BaSO4和Fe(OH)3;
(2)检验硫酸根离子是否除净的方法:静置,取上层清液加入BaCl2,若无白色沉淀,则SO42-沉淀完全,故答案为:静置,取上层清液加入BaCl2,若无白色沉淀,则SO42-沉淀完全;
(3)根据物质的溶解度大小,溶液获得晶体的方法:蒸发结晶、过滤、冷却结晶,故答案为:蒸发结晶;趁热过滤;冷却结晶;
(4)带有旋塞、活塞等部件的仪器容量瓶、滴定管使用之前必须查漏,并且滴定前要用标准液润洗滴定管,否则会将标准液稀释,实验计算的剩余亚铁离子的物质的量结果会偏高,则反应掉的会偏小,Mg(ClO3)2•6H2O的含量测定结果偏小,故答案为:容量瓶、滴定管;小;
(5)氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价,化学方程式为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,根据化学方程式:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O以及Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,可以得出:
ClO3-~6Fe2+,Cr2O72-~6Fe2+,用0.100mol•L-1 K2Cr2O7溶液滴定至终点过程可以得出剩余的亚铁离子的物质的量为:0.100mol•L-1×0.015L×6=0.009mol,和氯酸根离子反应的亚铁离子的物质的量为:20×10-3L×1.000mol•L-1-0.009mol=0.011mol,
氯酸根离子的物质的量为:[1/6]×0.011mol,产品中Mg(ClO3)2•6H2O的质量分数:([1/12]×0.011×299g/mol)×10×[1/3.5]×100%=78.31%.
故答案为:78.31%.点评:
本题考点: 制备实验方案的设计;镁、铝的重要化合物.
考点点评: 本题考查对常见金属元素及其化合物主要性质的掌握,以及对离子反应实质的认识;同时考查应用基础知识解决简单化学问题的能力以及对图表的观察、分析能力,物质溶解度概念的应用,晶体析出的方法,杂质离子的除杂原则和试剂选择,题目难度中等.1年前查看全部
- 用低压水银灯照射水果,引起光化学反应,使催熟剂转化为没有催熟作用的有机物.反应物为何有水参加
 ll方向盘1年前1
ll方向盘1年前1 -
 suoluosi888 共回答了10个问题
suoluosi888 共回答了10个问题 |采纳率100%催熟剂是乙烯,和水发生加成反应生成了乙醇.1年前查看全部
- 乙烯作果实催熟剂是化学变化吗?
 wldjf1年前3
wldjf1年前3 -
 纯正的天蓝 共回答了22个问题
纯正的天蓝 共回答了22个问题 |采纳率100%其实这个过程涉及到生物学,具体细胞里面涉及很多化学反应1年前查看全部
- 下列物质能作为水果的催熟剂,使生水果尽快成熟的是( )
下列物质能作为水果的催熟剂,使生水果尽快成熟的是( )
A.乙烷
B.乙烯
C.乙醇
D.乙酸 mimiki_ash1年前1
mimiki_ash1年前1 -
 广州紫狼 共回答了19个问题
广州紫狼 共回答了19个问题 |采纳率78.9%解题思路:根据常见气体的性质和用途进行分析,乙烯是植物生产调节剂.乙烯(化学式为C2H4)是植物生长的调节剂,可以催熟水果,
故选:B.点评:
本题考点: 乙烯的用途.
考点点评: 本题考查乙烯的用途,难度不大,掌握各种气体的性质和用途是解题的关键.1年前查看全部
- (2013•徐州模拟)氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2•6H2O的流
(2013•徐州模拟)氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2•6H2O的流程如下:
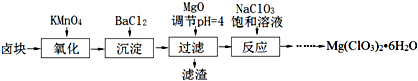
已知:①卤块主要成分为MgCl2•6H2O,含有MgSO4、FeCl2等杂质.
②四种化合物的溶解度(S)随温度(T)变化曲线如下图所示.
(1)过滤所需要的主要玻璃仪器有______,加MgO后过滤所得滤渣的主要成分为______.
(2)加入BaCl2的目的是除去SO42-,如何检验SO42-已沉淀完全?答:______.
(3)加入NaClO3饱和溶液发生反应为:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl↓再进一步制取Mg(ClO3)2•6H2O的实验步骤依次
为:①______;②______;③______;④过滤、洗涤.
(4)产品中Mg(ClO3)2•6H2O含量的测定:
步骤1:准确称量3.50g产品配成100mL溶液.
步骤2:取10mL于锥形瓶中,加入10mL稀硫酸和20mL 1.000mol•L-1的FeSO4溶液,微热.
步骤3:冷却至室温,用0.100mol•L-1 K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O.
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL.
①写出步骤2中发生反应的离子方程式:______
②产品中Mg(ClO3)2•6H2O的质量分数为______. 伊猪猪1年前1
伊猪猪1年前1 -
 aarenclub 共回答了21个问题
aarenclub 共回答了21个问题 |采纳率90.5%解题思路:(1)过滤实验用到的仪器:漏斗、玻璃棒、烧杯、滤纸、铁架台等,根据加氧化镁后溶液的pH为4,可以沉淀的离子来回答;
(2)根据钡离子可以和硫酸根离子之间反应生成白色不溶于硝酸的白色沉淀来回答;
(3)根据物质的溶解度大小,溶液获得晶体的方法:蒸发结晶、过滤、冷却结晶;
(4)氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价;根据化学反应得出各个质物之间的关系式,计算百分含量.(1))过滤实验用到的仪器:漏斗、玻璃棒、烧杯、滤纸、铁架台等,其中玻璃仪器有:漏斗、玻璃棒、烧杯,加入氧化镁,调节溶液的pH为4,此时铁离子形成了沉淀氢氧化铁,钡离子已经和硫酸根离子只碱反应生成了硫酸钡沉淀,故答案为:漏斗、玻璃棒、烧杯;BaSO4和Fe(OH)3;
(2)检验硫酸根离子是否除净的方法:静置,取上层清液加入BaCl2,若无白色沉淀,则SO42-沉淀完全,故答案为:静置,取上层清液加入BaCl2,若无白色沉淀,则SO42-沉淀完全;
(3)根据物质的溶解度大小,溶液获得晶体的方法:蒸发结晶、过滤、冷却结晶;故答案为:蒸发结晶;趁热过滤;冷却结晶;
(4)①氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价,化学方程式为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,故答案为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O;
②根据化学方程式:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O以及Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,可以得出:
ClO3-~6Fe2+,Cr2O72-~6Fe2+,用0.100mol•L-1 K2Cr2O7溶液滴定至终点过程可以得出剩余的亚铁离子的物质的量为:0.100mol•L-1×0.015L×6=0.009mol,和氯酸根离子反应的亚铁离子的物质的量为:20×10-3L×1.000mol•L-1-0.009mol=0.011mol,
氯酸根离子的物质的量为:[1/6]×0.011mol,产品中Mg(ClO3)2•6H2O的质量分数:([1/2×
1
6]×0.011×299g/mol)×10×[1/3.5]×100%=78.3%.
故答案为:78.3%.点评:
本题考点: 镁、铝的重要化合物;物质分离和提纯的方法和基本操作综合应用;制备实验方案的设计.
考点点评: 本题考查对常见金属元素及其化合物主要性质的掌握,以及对离子反应实质的认识;同时考查应用基础知识解决简单化学问题的能力以及对图表的观察、分析能力,物质溶解度概念的应用,晶体析出的方法,杂质离子的除杂原则和试剂选择,题目难度中等.1年前查看全部
大家在问
- 1检查是否有语病 When I found your are more and more important in my
- 2圆台侧面积不用减去挖去的圆就是35派?
- 3若ab互为相反数cb互为倒数求2a+b²c+b
- 4_________(ðæt)is my piant.it is talland strong.的音标是什么单词?
- 5四边形 几何题 初三18.如图,在矩形ABCD中,∠BAD的平分线交BC于点E,点O为对角线的交点,且∠CAE=15°,
- 6他们在人群中失散了.用英语怎么说
- 7高中化学:饱和的烧碱溶液中加钠如上.问,烧碱的浓度变化,质量分数变化,质量变化,及为什么这样变化?
- 8线性代数公开课//24:50分钟解x=0 y=0 z=1如何求出的?
- 9四边形如图,正方形ABCD,菱形BDEF.点C F E 共线,求角E度数
- 10四边形如图,正方形ABCD,菱形BDEF,点C F E 在同一直线上,求角E度数
- 111/x+1/(x+10)=1/12
- 12证明:直角三角形中,30°的角所对的边等于斜边的一半.
- 13如图,三个村庄A、B、C之间的距离分别为AB=5km,BC=12km,AC=13km,村庄D在CA的延长线上,且AD=6
- 14改非限制性定语从句1.They will fly to Kunming.They plan to stay there
- 15酸性最强的最高价氧化物的水化物
