由短周期元素组成的单质A、B、C和甲乙丙丁戊五种化合物有如图所示的转化关系,其中甲是工业上制取A的主要原料.写出各种物质
 wuliaonjlt2022-10-04 11:39:541条回答
wuliaonjlt2022-10-04 11:39:541条回答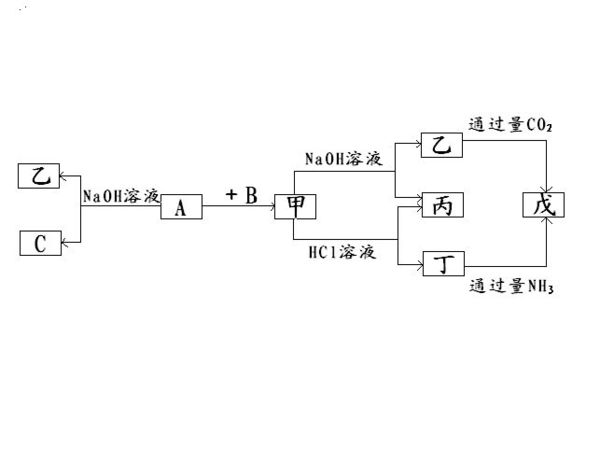

已提交,审核后显示!提交回复
共1条回复
 wugg17 共回答了19个问题
wugg17 共回答了19个问题 |采纳率94.7%- 通过通入CO2和NH3可以产生Al(OH)3,可以知道戊是Al(oH)3,然后可以推出其他物质.
甲:Al2O3
乙:NaAlO2
丙:H2O
丁:AlCl3
戊:Al(OH)3
A:Al
B:O2
C:H2 - 1年前
相关推荐
- (2013•哈尔滨模拟)X、Y为短周期元素,X位于 I A族,X与Y可形成化合物X2Y,下列说法正确的是(
(2013•哈尔滨模拟)X、Y为短周期元素,X位于 I A族,X与Y可形成化合物X2Y,下列说法正确的是( )
A.X的原子半径一定大于Y的原子半径
B.X2Y可能是离子化合物,也可能是共价化合物
C.两元素形成的化合物中,原子个数比不可能为1:1
D.X与Y的简单离子不可能具有相同的电子层结构 cjh823756421年前1
cjh823756421年前1 -
 我喜欢着急 共回答了19个问题
我喜欢着急 共回答了19个问题 |采纳率73.7%解题思路:X、Y为短周期元素,X位于IA族,则X可能为H、Li、Na元素,X与Y可形成化合物X2Y,则Y为第ⅥA族元素,Y可能为O、S元素,以此进行解答.X、Y为短周期元素,X位于IA族,则X可能为H、Li、Na元素,X与Y可形成化合物X2Y,则Y为第ⅥA族元素,Y可能为O、S元素,
A.当X为H元素,Y为O、S元素时,X的原子半径小于Y的原子半径,故A错误;
B.化学式为X2Y的有H2O或Na2O或Na2S或H2S等,可能是离子化合物,也可能是共价化合物,故B正确;
C.两元素形成的化合物中,原子个数为1:1的有H2O2或Na2O2,故C错误;
D.X为Na时,其对应离子为Na+,离子有10个电子,Y为O元素时,其对应的离子为O2-,离子有10个电子,二者具有相同的电子层结构,故D错误;
故选B.点评:
本题考点: 位置结构性质的相互关系应用.
考点点评: 本题考查位置结构性质的相互关系及应用,题目难度不大,注意元素周期表中各主族元素的主要性质的相似性和递变性的应用.1年前查看全部
- 现有10种元素的性质、数据如下表所列,它们均为短周期元素.
现有10种元素的性质、数据如下表所列,它们均为短周期元素.
回答下列问题:A B C D E F G H I J 原子半径(10 -10 m) 0.74 1.60 1.52 1.10 0.99 1.86 0.75 0.82 0.102 0.037 最高或最低
化合价+2 +1 +5 +7 +1 +5 +3 +6 +1 -2 -3 -1 -3 -2
(1)D的元素名称是______,H的元素符号是______.
B在元素周期表中的位置是(周期、族)______
(2)在以上元素形成的最高价氧化物的水化物中,酸性最强的化合物的分子式是______.
化合物F 2 A 2 的电子式是:______,构成该物质的化学键类型为______
(3)用电子式表示A的简单氢化物的形成过程如下:______;G的氢化物的结构式为______.
(4)一定条件下,IA 2 气体与足量的A单质充分反应生成20g气态化合物,放出24.6kJ热量,写出其热化学方程式______.
(5)用J元素的单质与A元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的惰性电极甲和乙浸入KOH溶液,在甲极通入J的单质,乙极通入A的单质,则甲极的电极反应式为:______. lilijing20051年前0
lilijing20051年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- A与B为同周期相邻.B与C为同主族相邻的短周期元素,三者的最外层电子数之和为17则A()B()C()(写出所有可能)
 吴性坚1年前3
吴性坚1年前3 -
 石城清风 共回答了18个问题
石城清风 共回答了18个问题 |采纳率88.9%因为三个元素的相邻关系,所以设B的最外层电子数为y,则有2y+(y-1)=17,解得y=6.
短周期为前三周期.
只有一组答案:A(氮)B(氧)C(硫)1年前查看全部
- 短周期元素中 原子M层有一个未成对的P电子 除了可以是Al Cl 外 可以是P吗 为什么
 朋克夫子1年前1
朋克夫子1年前1 -
 小豬yuan 共回答了11个问题
小豬yuan 共回答了11个问题 |采纳率100%不能,P的三个p电子分占三个p轨道,满足能量最低原则.
上述仅考虑基态,不考虑激发态.1年前查看全部
- (2009•松江区二模)Q、R、X、Y、Z是原子序数依次增大的五种短周期元素,在短周期的所有元素中Q的原子半径与Z的原子
(2009•松江区二模)Q、R、X、Y、Z是原子序数依次增大的五种短周期元素,在短周期的所有元素中Q的原子半径与Z的原子半径之比最小(不包括稀有气体),R、X、Y三种元素的原子核外电子层数相同,同一周期中R的一种单质的熔点最高,Y与Q、R、X、Z均能形成多种常见化合物.
(1)X在周期表中的位置:______,其原子核外有______种不同形状的电子云.这五种元素中,最外层有两个未成对电子的元素是______(用元素符号表示).
(2)ZYQ的电子式是______.
(3)Q分别与X.Y形成的最简单化合物的稳定性______>______(用分子式表示)
(4)Q与R两元素组成的分子构型可能是______(填写序号).
a.直线型b.平面形c.三角锥形d.正四面体
(5)常温下液态化合物甲只含上述元素中的两种,分子中原子个数比1:1,请你仅用一个化学方程式表示甲既有氧化性又有还原性2H2O2
2H2O+O2↑MnO2 .2H2O2.
2H2O+O2↑MnO2 . meihuating1年前1
meihuating1年前1 -
 aquarius_zy 共回答了26个问题
aquarius_zy 共回答了26个问题 |采纳率88.5%解题思路:Q、R、X、Y、Z是原子序数依次增大的五种短周期元素,在短周期的所有元素中Q的原子半径与Z的原子半径之比最小,则Q的原子半径最小,应为H元素,Z的原子半径最大,应为Na元素,R、X、Y三种元素的原子核外电子层数相同,应为同一周期元素,为第而周期元素,第二周期中R的一种单质的熔点最高,则R为C元素,熔点最高的单质为金刚石,Y与Q、R、X、Z均能形成多种常见化合物,则Y为O元素,与其它物质反应形成多种氧化物,根据Q、R、X、Y、Z是原子序数依次增大的五种短周期元素,可知X为N元素,以此解答题中各小问.Q、R、X、Y、Z是原子序数依次增大的五种短周期元素,在短周期的所有元素中Q的原子半径与Z的原子半径之比最小,则Q的原子半径最小,应为H元素,Z的原子半径最大,应为
Na元素,R、X、Y三种元素的原子核外电子层数相同,应为同一周期元素,为第而周期元素,第二周期中R的一种单质的熔点最高,则R为C元素,熔点最高的单质为金刚石,Y与Q、R、X、Z均能形成多种常见化合物,则Y为O元素,与其它物质反应形成多种氧化物,根据Q、R、X、Y、Z是原子序数依次增大的五种短周期元素,可知X为N元素,
(1)X为N元素,位于第二周期第VA族,核外电子排布为1S22S22P3,有S和P两种不同形状的电子云,最外层有两个未成对电子,则最外层的电子排布可能为nP2或nP4,只有C、O两种元素符合,
故答案为:第二周期第VA族;2;C、O;
(2)ZYQ组成的化合物为NaOH,为离子化合物,其电离子式为 ,故答案为:
,故答案为: ;
;
(3)Q分别与X、Y形成的最简单化合物分别为NH3和H2O,元素的非金属性越强,则对应的氢化物的稳定性越强,O元素的非金属性大于N元素的非金属性,则有H2O>NH3,
故答案为:H2O>NH3;
(4)Q与R两元素组成的分子为烃类物质,其中甲烷为正四面体结构,乙烯为平面结构,乙炔为直线形结构,
故答案为:abd;
(5)常温下液态化合物有H2O2和H2O,H2O2分子中原子个数比1:1,在二氧化锰做催化剂条件下发生分解反应生成氧气和水,反应的方程式为2H2O2
MnO2
.
2H2O+O2↑,
故答案为:2H2O2
MnO2
.
2H2O+O2↑.点评:
本题考点: 原子结构与元素周期律的关系;原子核外电子排布.
考点点评: 本题考查原子结构与元素周期律的关系,题目难度不大,正确推断元素的种类是解答本题的关键,要正确把握元素周期律的递变规律.1年前查看全部
- (10分)W、X、Y、Z四种短周期元素在元素周期表中的位置如图所示,其中Z位于ⅦA族。请回答下列问题。
(10分)W、X、Y、Z四种短周期元素在元素周期表中的位置如图所示,其中Z位于ⅦA族。请回答下列问题。
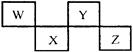
(1)请写出各对应的元素符号:W、 X、 Y、 Z 。
(2)W、Y和氢3种元素所形成的一种化合物,其75%(体积分数)的溶液常用于医疗消毒,该化合物的化学式为
(3)电解NaZ水溶液时,总反应化学方程式为 。工业上,以上述反应的阳极产物和Ca(OH) 2 为原料,制备漂白粉反应的化学方程式为 。
(4)已知:元素钠与元素Y可组成原子个数比为1:1的化合物。请写出该化合物与含W的最高价氧化物发生反应的化学方程式为 。 kcaslv1年前1
kcaslv1年前1 -
 onlyou0203 共回答了15个问题
onlyou0203 共回答了15个问题 |采纳率86.7%(10分)(1)C P O Cl各1分
(2)CH 3 CH 2 OH(1分)
(3)2NaCl+2H 2 O 2NaOH+H 2 ↑+Cl 2 ↑
2NaOH+H 2 ↑+Cl 2 ↑
2Cl 2 +2Ca(OH) 2 =CaCl 2 +Ca(ClO) 2 +2H 2 O(2分)
(4)2Na 2 O 2 +2CO 2 =2Na 2 CO 3 +O 2 (2分)
(1)考查元素周期表的结构及元素周期律的应用。根据元素在周期表中的位置
可知,W、X、Y、Z四种短周期元素分别是C、P、O、Cl。
(2)75%(体积分数)的酒精溶液常用于医疗消毒,所以该化合物的化学式为CH 3 CH 2 OH。
(3)惰性电极电解氯化钠溶液,阳极是氯离子放电生成氯气,阴极是氢离子放电生成氢
气,所以总的反应方程式是2NaCl+2H 2 O 2NaOH+H 2 ↑+Cl 2 ↑;氯气被石灰乳吸收,
2NaOH+H 2 ↑+Cl 2 ↑;氯气被石灰乳吸收,
即生成漂白粉,方程式是2Cl 2 +2Ca(OH) 2 =CaCl 2 +Ca(ClO) 2 +2H 2 O。
(4)该化合物是过氧化钠,能吸收CO 2 生成碳酸钠和氧气,反应的方程式是2Na 2 O 2 +
2CO 2 =2Na 2 CO 3 +O 2 。1年前查看全部
- 甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,戊的负一价阴离子与丙的阳离
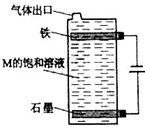 甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,戊的负一价阴离子与丙的阳离子差8个电子.甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1mol/L的Y溶液pH>1;丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐L也能与Z的水溶液反应生成盐;丙、戊可组成化合物M.请回答下列问题:
甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,戊的负一价阴离子与丙的阳离子差8个电子.甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1mol/L的Y溶液pH>1;丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐L也能与Z的水溶液反应生成盐;丙、戊可组成化合物M.请回答下列问题:
(1)戊离子的结构示意图为______.
(2)写出由甲乙两元素形成的化合物中,既含有极性键又含有非极性键的物质的结构式______;该物质与空气在碱性条件下可构成燃料电池,该电池放电时,负极的反应式为______.
(3)戊的单质与X反应生成的Y和Z的物质的量之比为2:4,反应中被氧化的物质与被还原的物质的物质的量之比为______.
(4)写出少量Z的稀溶液滴入过量L的稀溶液中发生反应的离子方程式:______.
(5)按如图电解M的饱和溶液,写出该电解池中发生反应的总反应方程式:NaCl+H2O
NaClO+H2↑电解 .NaCl+H2O.将充分电解后所得溶液逐滴加入到酚酞试液中,观察到得现象是______.
NaClO+H2↑电解 . longyan1111年前1
longyan1111年前1 -
 zxcdxj 共回答了13个问题
zxcdxj 共回答了13个问题 |采纳率92.3%甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝,则X为NH3,甲为H,乙为N;甲、丙处于同一主族,结合原子序数可知,丙为Na;戊的负一价阴离子与丙的阳离子差8个电子,戊的负一价阴离子核外电子数为18,则戊为Cl;氯气与氨气反应生成氮气,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1mol/L的Y溶液pH>1,则Y为NH4Cl、Z为HCl;丁的单质既能与丙(Na)元素最高价氧化物的水化物的溶液反应生成盐L,也能与Z(HCl)的水溶液反应生成盐N,丁为两性金属,则丁为Al元素,故L为NaAlO2;丙、戊组成化合物M为NaCl,用石墨作阳极、铁作阴极,电解氯化钠水溶液,生成氢气、氯气与氢氧化钠,氯气与氢氧化钠反应生成氯化钠与次氯酸钠,
(1)Cl-的结构示意图为: ,故答案为:
,故答案为: ;
;
(2)H、N两元素形成的化合物中,既含有极性键又含有非极性键的物质为N2H4,其结构式为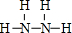 ,负极反应氧化反应,N2H4在负极失去电子,碱性条件下生成氮气与水,负极电极反应式为N2H4+4OH--4e-=N2↑+2H2O,
,负极反应氧化反应,N2H4在负极失去电子,碱性条件下生成氮气与水,负极电极反应式为N2H4+4OH--4e-=N2↑+2H2O,
故答案为: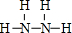 ;N2H4+4OH--4e-=N2↑+2H2O;
;N2H4+4OH--4e-=N2↑+2H2O;
(3)氯气与氨气反应生成的NH4Cl和HCl的物质的量之比为2:4,则NH3与Cl2反应的化学方程式:4NH3+3Cl2═N2+2NH4Cl+4HCl,在反应中氨气做还原剂,氯气做氧化剂,被氧化的物质氨气只占反应掉的一半,被氧化的物质氨气与被还原的物质氯气物质的量之比=2:3,
故答案为:2:3;
(4)将少量的盐酸滴入过量NaAlO2溶液中发生反应的离子方程式为AlO2-+H++H2O═Al(OH)3↓,
故答案为:AlO2-+H++H2O═Al(OH)3↓;
(5)电解饱和氯化钠溶液,反应的方程式为:2NaCl+2H2O
电解
.
2NaOH+Cl2↑+H2↑,同时发生反应Cl2+2NaOH=NaCl+NaClO+H2O,故该电解池中发生反应的总反应方程式为:NaCl+H2O
电解
.
NaClO+H2↑,电解后得到NaClO溶液,显碱性,且具有强氧化性,滴入酚酞溶液中,观察到溶液变红后褪色,
故答案为:NaCl+H2O
电解
.
NaClO+H2↑;溶液变红后褪色.1年前查看全部
- 甲乙丙短周期元素电子总数相等.甲乙为双分子原子,丙为原子乙在高温时作还原剂,用化学方程式表示它在工业
甲乙丙短周期元素电子总数相等.甲乙为双分子原子,丙为原子乙在高温时作还原剂,用化学方程式表示它在工业
上的用途 磐石2891年前1
磐石2891年前1 -
 daqingwa01 共回答了14个问题
daqingwa01 共回答了14个问题 |采纳率100%打半天不小心关了,懒的再打了
甲:CO 乙:N2 丙:Si
甲主要用其还原性和可燃性,冶金
乙用其惰性,保护气
丙单晶硅作半导体,集成电路需要.光纤.有机硅塑料.1年前查看全部
- X、Y、Z为短周期元素,这些元素原子的最外层电子数分别是1、4、6.则由这三种元素组成的化合物的化学式不可能是( )
X、Y、Z为短周期元素,这些元素原子的最外层电子数分别是1、4、6.则由这三种元素组成的化合物的化学式不可能是( )
A. XYZ
B. X2YZ
C. X2YZ2
D. X2YZ3 annie_zycn241年前1
annie_zycn241年前1 -
 xingye1117 共回答了14个问题
xingye1117 共回答了14个问题 |采纳率85.7%解题思路:X、Y、Z为短周期元素,这些元素原子的最外层电子数分别是1、4、6,则X、Y、Z在化合物中的化合价分别为为+1价、+4价(或+2等)、-2价,Y可能为碳元素,化合物中正负化合价的代数和为0,以此来解答.X、Y、Z为短周期元素,这些元素原子的最外层电子数分别是1、4、6,则X、Y、Z在化合物中的化合价分别为为+1价、+4价(或+2等)、-2价,
A.若为XYZ,不存在HCO物质,且(+1)+(+4)+(-2)≠0,故A错误;
B.若为X2YZ,则可能为HCHO,故B正确;
C.若为X2YZ2,则可能为HCOOH,故C正确;
D.若为X2YZ3,则可能为H2CO3,故D正确;
故选A.点评:
本题考点: 原子结构与元素周期律的关系.
考点点评: 本题考查最外层电子数与元素的化合价的变化,明确最外层电子数为4的可能为C是解答本题的关键,也是解答的难点,注意在有机物中碳元素存在多种化合价,为易错点.1年前查看全部
- (2012•浙江模拟)X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的
(2012•浙江模拟)X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质.已知:甲+乙=丁+己,甲+丙=戊+己; 0.1mol•L-1丁溶液的pH为13(25℃).下列说法正确的是( )
A.原子半径:W>Z>Y>X
B.Y元素在周期表中的位置为第三周期第ⅣA族
C.1mol甲与足量的乙完全反应共转移了1mol电子
D.1.0L0.1mol•L-1戊溶液中阴离子总的物质的量小于0.1mol L-Noonriver1年前1
L-Noonriver1年前1 -
 vilyting1 共回答了12个问题
vilyting1 共回答了12个问题 |采纳率100%解题思路:首先应该从突破口找出X、Y、Z、W四种元素,“0.1 mol•L-1丁溶液的pH为13(25℃).”是重要突破口,丁是一元强碱且其中的金属元素在短周期,甲+乙=丁+己,甲+丙=戊+己;这两个方程式不难看出“己”是氧气,“丁”是氢氧化钠,那么甲是Na2O2、乙是水,丙是二氧化碳,戊是碳酸钠,因此X为氢、Y为碳、Z为氧、W为钠元素.
根据它们在元素周期表中的位置和其它性质就不难判断各选项了.由0.1 mol•L-1丁溶液的pH为13(25℃),丁是一元强碱且其中的金属元素在短周期,甲+乙=丁+己,甲+丙=戊+己;则“己”是氧气,“丁”是氢氧化钠,那么甲是Na2O2、乙是水,丙是二氧化碳,戊是碳酸钠,因此X为氢、Y为碳、Z为氧、W为钠元素;
A、由以上分析可知:X为氢、Y为碳、Z为氧、W为钠元素,则原子半径大小顺序为:Na>C>O>H,即:W>Y>Z>X,故A错误;
B、Y为碳,在周期表中的位置为:第二周期第ⅣA族,故B错误;
C、甲与足量的乙完全反应的方程式为:2Na2O2+2H2O═4NaOH+O2↑,1molNa2O2反应转移的电子为1mol,故C正确;
D、戊是碳酸钠,在碳酸钠溶液中,CO32-离子水解生成HCO3-离子和OH-离子,溶液中阴离子总的物质的量大于0.1mol,故D错误.
故选C.点评:
本题考点: 无机物的推断;位置结构性质的相互关系应用.
考点点评: 本题为推断题,做题时注意找出题目的突破口是做该题的关键,结合元素化合物知识解答,注意盐类的水解问题.1年前查看全部
- 氢能源是一种重要的清洁能源.现有两种可产生H2的化合物甲和乙.将6.00g甲加热至完全分解,只得到一种短周期元素的金属单
氢能源是一种重要的清洁能源.现有两种可产生H2的化合物甲和乙.将6.00g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72L的H2(已折算成标准状况).甲与水反应也能放出H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液.化合物乙的式量为19,乙与水反应也能产生氢气;化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状况下的密度为1.25g•L-1.请回答下列问题:
(1)甲与水反应的化学方程式是______.
(2)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式2NH4H+5CuO
5Cu+N2↑+5H2O△ .2NH4H+5CuO.有人提出生成的产物Cu中可能还混有Cu2O,请设计实验方案验证之.(已知:Cu2O+2H+=Cu+Cu2++H2O)______.
5Cu+N2↑+5H2O△ . sa_tsui1年前1
sa_tsui1年前1 -
 相约07 共回答了12个问题
相约07 共回答了12个问题 |采纳率83.3%解题思路:甲加热至完全分解,只得到一种短周期元素的金属单质和6.72L H2,则甲中含有H元素,甲与水反应能产生H2,同时产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液,应为Al(OH)3,综上可知,甲中含有Al和H两种元素,n(H2)=[6.72L/22.4L/mol]=0.3mol,则m(H)=0.3mol×2×1g/mol=0.6g,则6.00g甲中含有m(Al)=6.00g-0.6g=5.4g,n(Al)=[5.4g/27g/mol]=0.2mol,所以n(Al):n(H)=0.2mol:0.6mol=1:3,则甲的化学式为AlH3;
乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状况下的密度为1.25g/L,则丙的相对原子质量为1.25×22.4=28,应为N2,化合物乙的式量为19,分子中只能有1个N原子,故含有H原子数目=[19−14/1]=5,分子式为NH5,乙与水反应也能产生氢气,应为NH4H,据此解答.甲加热至完全分解,只得到一种短周期元素的金属单质和6.72L H2,则甲中含有H元素,甲与水反应能产生H2,同时产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液,应为Al(OH)3,综上可知,甲中含有Al和H两种元素,n(H2)=[6.72L/22.4L/mol]=0.3mol,则m(H)=0.3mol×2×1g/mol=0.6g,则6.00g甲中含有m(Al)=6.00g-0.6g=5.4g,n(Al)=[5.4g/27g/mol]=0.2mol,所以n(Al):n(H)=0.2mol:0.6mol=1:3,则甲的化学式为AlH3;
乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状况下的密度为1.25g/L,则丙的相对原子质量为1.25×22.4=28,应为N2,化合物乙的式量为19,分子中只能有1个N原子,故含有H原子数目=[19−14/1]=5,分子式为NH5,乙与水反应也能产生氢气,应为NH4H,
(1)由上述分析可知,甲的化学式是AlH3,AlH3与水发生水解反应,反应的方程式为:AlH3+3H2O=Al(OH)3↓+3H2↑,
故答案为:AlH3+3H2O=Al(OH)3↓+3H2↑;
(2)乙的化学式是NH4H,NH4H在加热条件下与CuO反应可生成Cu、氮气和水,该反应的化学方程式为:2NH4H+5CuO
△
.
5Cu+N2↑+5H2O,要判断产物中是否含有Cu2O,可加入稀硫酸检验溶液是否变蓝,方法是:取样后加H2SO4,如果溶液变蓝,说明产物中含有Cu2O,反之则无Cu2O,
故答案为:2NH4H+5CuO
△
.
5Cu+N2↑+5H2O;取样后加H2SO4,如果溶液变蓝,说明产物中含有Cu2O,反之则无Cu2O.点评:
本题考点: 无机物的推断.
考点点评: 本题考查无机物的推断,属于计算型推断,注意根据反应的现象以及数据判断甲乙两种物质,侧重考查学生对知识的迁移应用,题目难度中等.1年前查看全部
- (8分)现有A、B、C、D、E五种元素,都是短周期元素,其中A、B、C原子序数依次递增并都相差1。B的阳离子的电子层结构
(8分)现有A、B、C、D、E五种元素,都是短周期元素,其中A、B、C原子序数依次递增并都相差1。B的阳离子的电子层结构与Ne原子相同,2gB的氧化物与100ml 0.5mol/L的
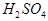 恰好完全反应。B单质与D单质反应后可形成离子化合物
恰好完全反应。B单质与D单质反应后可形成离子化合物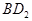 ;B单质与E单质可形成化合物BE。D的阴离子比B的阳离子多一个电子层,而E阴离子与B的阳离子电子层结构相同。
;B单质与E单质可形成化合物BE。D的阴离子比B的阳离子多一个电子层,而E阴离子与B的阳离子电子层结构相同。
(1)五种元素的名称是B________;D ;E________.
(2) 形成化合物 的化学键类型是: .
的化学键类型是: .
(3)用电子式表示化合物BD 2 的形成过程。 .
(4) A的氢氧化物的水溶液和C单质发生反应的离子方程式: . snsn261年前1
snsn261年前1 -
 害虫头头 共回答了17个问题
害虫头头 共回答了17个问题 |采纳率88.2%(1) B_镁;D氯;E 氧。 (每空1分)
(2)离子键、(极性)共价键。(1分,只填一种键不给分)
(3) (2分)
(2分)
(4)2OH - +2Al +2H 2 O=2AlO 2 - +3 H 2 ↑。(2分)
根据B单质与D单质反应后可形成离子化合物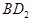 ,说明B是第ⅡA,D是第 Ⅶ A 。2gB的氧化物与100ml 0.5mol/L的
,说明B是第ⅡA,D是第 Ⅶ A 。2gB的氧化物与100ml 0.5mol/L的 恰好完全反应,所以B的氧化物的相对分子质量是40,因此B是镁,则A是Na,C是Al,D是Cl,E是O。
恰好完全反应,所以B的氧化物的相对分子质量是40,因此B是镁,则A是Na,C是Al,D是Cl,E是O。
(2)过氧化钠中含有离子键和非极性键。
(3)氯化镁是离子化合物,其形成过程为 。
。
(4)铝和氢氧化钠反应的方程式为2OH - +2Al +2H 2 O=2AlO 2 - +3 H 2 ↑。1年前查看全部
- (14分)有5 种短周期元素的原子序数按E、D、B、A、C的顺序依次增大;A、C同周期,B、C同主族;A与B可形成离子化
(14分)有5 种短周期元素的原子序数按E、D、B、A、C的顺序依次增大;A、C同周期,B、C同主族;A与B可形成离子化合物A 2 B,A 2 B中所有粒子的电子数相同,且电子总数为30;D和E可形成4核10电子的分子。试回答下列问题:
(1)写出五种元素的名称:A B C D 。
(2)用电子式表示离子化合物A 2 B的形成过程:
(3)写出下列物质的电子式:
D元素形成的单质 ;B与E形成的化合物 ;
A、B、E形成的化合物 ;D、E形成的化合物 。 enjoyit1年前0
enjoyit1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2014•滨州模拟)X、Y、Z均是由两种短周期元素组成的无机物,它们的每个分子中均含有l8个电子,相关信息如下表所示(
 (2014•滨州模拟)X、Y、Z均是由两种短周期元素组成的无机物,它们的每个分子中均含有l8个电子,相关信息如下表所示(“/”表示相应的信息略去):
(2014•滨州模拟)X、Y、Z均是由两种短周期元素组成的无机物,它们的每个分子中均含有l8个电子,相关信息如下表所示(“/”表示相应的信息略去):
回答下列问题:化合物 X Y Z 分子中含有的原子个数 / 4 / 摩尔质量/g•mol-l 32 34 /
(1)X常用作火箭推进剂,其分子的球棍模型为 ,则X的化学式为______.
,则X的化学式为______.
(2)Y的化学性质描述正确的是______.
a.不稳定性b.弱碱性c.氧化性 d.还原性
(3)Z的化学式可用H2A表示.将一定量的H2A气体通入0.05mol•L-1 CuSO4溶液中,二者恰好完全反应.已知Ksp(CuA)=6.0×10-36.若不考虑溶液体积的变化,则:
①反应后溶液的pH=______.
②若反应后溶液中c(A2-)=2.0×10-30mol•L-1,则溶液中c(Cu2+)=______mol•L-1.
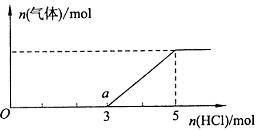
(4)将一定量的Z气体通人NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发).
①O点溶液中所含溶质的化学式为______.
②已知a点溶液呈碱性,该溶液中离子的物质的量浓度由大到小的顺序是______. 地下的泪水1年前1
地下的泪水1年前1 -
 德好5 共回答了17个问题
德好5 共回答了17个问题 |采纳率88.2%解题思路:(1)X、Y、Z均是由两种短周期元素组成的无机物,它们的每个分子中均含有l8个电子,X常用作火箭推进剂,其分子的球棍模型为,X的摩尔质量是32g/mol,则X是N2H4;(2)Y是由两种短周期元素组成的无机物,它的每个分子中含有l8个电子,Y分子中含有4个原子且其摩尔质量是34g/mol,则Y是H2O2;(3)①Z的化学式可用H2A表示,且含有18个电子,能和硫酸铜反应生成沉淀,则Z为H2S,根据硫酸根离子守恒计算氢离子的浓度,再根据氢离子浓度计算溶液的pH;②根据溶度积常数计算;(4)Na2S+HCl=NaCl+NaHS、NaHS+HCl=NaCl+H2S↑,根据图象知,不生成气体需要酸的物质的量大于生成气体时需要酸的物质的量,说明溶液中还存在NaOH;a点是溶液中的溶质是NaCl、NaHS,根据物料守恒、溶液酸碱性结合电荷守恒判断离子浓度大小.(1)X、Y、Z均是由两种短周期元素组成的无机物,它们的每个分子中均含有l8个电子,X常用作火箭推进剂,其分子的球棍模型为
 ,X的摩尔质量是32g/mol,该分子中含有两种元素原子个数之比为1:2,且能形成一个共用电子对的原子是H原子、形成3个共用电子对的原子是N原子,则X是N2H4,
,X的摩尔质量是32g/mol,该分子中含有两种元素原子个数之比为1:2,且能形成一个共用电子对的原子是H原子、形成3个共用电子对的原子是N原子,则X是N2H4,
故答案为:N2H4;
(2)Y是由两种短周期元素组成的无机物,它的每个分子中含有l8个电子,Y分子中含有4个原子且其摩尔质量是34g/mol,则Y是H2O2;
a.双氧水不稳定,易分解生成氧气,故正确;
b.双氧水能电离出氢离子而使溶液呈弱酸性,故错误;
c.双氧水具有氧化性,能氧化某些还原性的物质,正确;
d.双氧水能被强氧化剂氧化生成氧气,所以双氧水具有还原性,故正确;
故选acd;
(3)①Z的化学式可用H2A表示,且含有18个电子,能和硫酸铜反应生成沉淀,则Z为H2S,根据硫酸根离子守恒得c(H+)=2c(SO42-)=0.1mol/L,所以溶液的pH=1,故答案为:1;
②溶液中c(Cu2+)=
6.0×10−36
2.0×10−30mol/L=3×10-6mol/L,故答案为:3×10-6;
(4)①Na2S+HCl=NaCl+NaHS、NaHS+HCl=NaCl+H2S↑,根据图象知,不生成气体需要酸的物质的量大于生成气体时需要酸的物质的量,说明溶液中除了含有Na2S外还存在NaOH;
故答案为:Na2S和NaOH;
②a点是溶液中的溶质是NaCl、NaHS,根据需要n(HCl)知,O点溶液中n(NaOH)=1mol、n(Na2S)=2mol,发生反应后a点n(NaCl)=3mol、n(NaHS)=2mol,HS-水解程度大于电离程度导致溶液呈碱性,则c(OH-)>c(H+),水和HS-都电离出氢离子,所以c(H+)>c(S 2-),根据物料守恒得c(Na+)>c(Cl-),弱离子的水解程度较小,所以溶液中离子浓度大小顺序是:c(Na+)>c(Cl-)>c(HS-)>c(OH-)>c(H+)>c(S 2-),
故答案为:c(Na+)>c(Cl-)>c(HS-)>c(OH-)>c(H+)>c(S 2-).点评:
本题考点: 位置结构性质的相互关系应用.
考点点评: 本题考查了物质的推断,涉及离子浓度大小比较、难溶物的溶解平衡等知识点,根据溶度积常数、溶质的性质等知识点来分析解答,难点是离子浓度大小比较,题目难度中等.1年前查看全部
- 已知短周期元素ABCD四种元素的核电核数依次递增,AC在同一主族,BD也在同一主族,AB不同周期.XY均是由ABCD四种
已知短周期元素ABCD四种元素的核电核数依次递增,AC在同一主族,BD也在同一主族,AB不同周期.XY均是由ABCD四种元素组成的类型相同的盐,能互相作用,产生有毒气体Z.X与Y作用的离子方程式是
 alibutterfly1年前1
alibutterfly1年前1 -
 卡门的欣赏者 共回答了14个问题
卡门的欣赏者 共回答了14个问题 |采纳率85.7%ABCD顺序是:H,O,S,钠
XY:亚硫酸氢钠,
硫酸氢钠离子方程式:2(H)+(SO 3)2 - = H2O + SO2 ↑1年前查看全部
- (2012•漳州一模)如图为元素周期表的一部分.X、Y、Z、W均为短周期元素,若W原子的最外层电子数是其次外层电子数的[
(2012•漳州一模)如图为元素周期表的一部分.X、Y、Z、W均为短周期元素,若W原子的最外层电子数是其次外层电子数的[7/8],则下列说法中正确的是( )
X Y Z W
A.气态氢化物的稳定性强弱为Y>Z
B.单质的氧化性强弱为X>Y
C.最高价氧化物的水化物酸性强弱为Z>W
D.原子半径由大到小的排列顺序是Z>Y>X 格格楚1年前1
格格楚1年前1 -
 虎尾巴张 共回答了18个问题
虎尾巴张 共回答了18个问题 |采纳率88.9%解题思路:X、Y、Z、W均为短周期元素,W原子的最外层电子数是其次外层电子数的[7/8],则次外层外层为8个电子,最外层电子数为7,故W为Cl元素,由元素在周期表中的位置可知,X为氮元素、Y为氧元素、Z为硫元素,据此解答.X、Y、Z、W均为短周期元素,W原子的最外层电子数是其次外层电子数的[7/8],则次外层外层为8个电子,最外层电子数为7,故W为Cl元素,由元素在周期表中的位置可知,X为氮元素、Y为氧元素、Z为硫元素,
A.非金属性O>S,故氢化物稳定性H2O>H2S,故A正确;
B.氮气分子中含有N≡N三键,化学性质稳定,氧化性比氧气弱,故B错误;
C.非金属性Cl>S,故酸性HClO4>H2SO4,故C错误;
D.同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径S>N>O,故D错误;
故选:A.点评:
本题考点: 位置结构性质的相互关系应用.
考点点评: 本题考查结构性质位置关系、元素周期律等,难度不大,推断元素是解题关键,注意整体把握元素周期律表的结构,注意氮气结构与化学性质.1年前查看全部
- 短周期元素X、Y、Z和W的原子序数依次递增,且均为同周期,四元素原子的最外层电子数之和为18,X和Y的原子序数比为6:7
短周期元素X、Y、Z和W的原子序数依次递增,且均为同周期,四元素原子的最外层电子数之和为18,X和Y的原子序数比为6:7,X的最高正价是W的最低负价绝对值的2倍.下列说法不正确的是( )
A.Y的单质可能为原子晶体
B.X和W可组成离子化合物
C.Z和W的单质发生化学反应可生成两种共价化合物
D.Z和W的最高价氧化物对应的水化物都是强酸 可乐ss1年前1
可乐ss1年前1 -
 honlang197 共回答了20个问题
honlang197 共回答了20个问题 |采纳率85%解题思路:短周期元素X、Y、Z和W的原子序数依次递增,且在同一周期,X和Y元素原子的原子序数比为6:7,如果X的原子序数为6,则Y的原子序数为7,则X、Y、Z和W的最外层电子数只能为4、5、6、7,四种元素原子的最外层电子数之和为22,而且X的最高正价是W的最低负价的绝对值的4倍,不符合题意;
如果X的原子序数为12,X和Y元素原子的原子序数比为6:7,Y的原子序数应为14,由于X的最高正价是W的最低负价的绝对值的2倍,则W的原子序数为17,四种元素原子的最外层电子数之和为18,则Z原子最外层电子数为18-2-7-4=5,Z只能是15号元素,所以X、Y、Z和W以此为Mg、Si、P、Cl元素,根据元素所在周期表的位置结合元素周期律的递变规律推断元素、单质及化合物所具有的性质.短周期元素X、Y、Z和W的原子序数依次递增,且在同一周期,X和Y元素原子的原子序数比为6:7,如果X的原子序数为6,则Y的原子序数为7,则X、Y、Z和W的最外层电子数只能为4、5、6、7,四种元素原子的最外层电子数之和为22,而且X的最高正价是W的最低负价的绝对值的4倍,不符合题意;
如果X的原子序数为12,X和Y元素原子的原子序数比为6:7,Y的原子序数应为14,由于X的最高正价是W的最低负价的绝对值的2倍,则W的原子序数为17,四种元素原子的最外层电子数之和为18,则Z原子最外层电子数为18-2-7-4=5,Z只能是15号元素,所以X、Y、Z和W以此为Mg、Si、P、Cl元素,
A.Y为Si元素,其单质晶体硅属于原子晶体,故A正确;
B.氯化镁由镁离子与氯离子构成,属于离子化合物,故B正确;
C.磷与氯气反应可以生成三氯化磷、五氯化磷,故C正确;
D.高氯酸属于强酸,磷酸属于中强酸,故D错误,
故选D.点评:
本题考点: 原子结构与元素的性质.
考点点评: 本题考查原子结构和元素周期律的关系,题目难度较大,正确推断元素的种类为解答该题的关键.1年前查看全部
- X、Y、Z为短周期元素,形成的简单离子为Xn+、Ym+、Zn-,已知带有电荷的数值m>n,且X、Y、Z三种原子的M电子层
X、Y、Z为短周期元素,形成的简单离子为Xn+、Ym+、Zn-,已知带有电荷的数值m>n,且X、Y、Z三种原子的M电子层中的电子数均为奇数.若按X、Y、Z为顺序的下列说法中,正确的是( )
A.原子半径依次增大
B.常温常压下单质的密度依次减少
C.它们的最高价氧化物对应水化物两两之间均能反应
D.X单质能将Y从其盐的水溶液中置换出来 应该没有人叫这个1年前1
应该没有人叫这个1年前1 -
 蓝雨泡沫 共回答了18个问题
蓝雨泡沫 共回答了18个问题 |采纳率100%解题思路:X、Y、Z为短周期元素,且X、Y、Z三种原子的M电子层中的电子数均为奇数,则X、Y、Z 一定是在第3周期,能简单离子为Xn+、Ym+、Zn-,且数值m>n,所以X为钠元素,Y为铝元素,Z为氯元素.
A、同周期原子半径随原子序数的增加而减小;
B、铝的密度比钠的大;
C、Al(OH)3是两性氢氧化物,能与NaOH和HClO4反应,NaOH与HClO4,发生酸碱中和反应;
D、钠先与水反应,不能从Y的盐水溶液中置换出Y.X、Y、Z为短周期元素,且X、Y、Z三种原子的M电子层中的电子数均为奇数,则X、Y、Z 一定是在第3周期,能简单离子为Xn+、Ym+、Zn-,且数值m>n,所以X为钠元素,Y为铝元素,Z为氯元素.
A、同周期原子半径随原子序数的增加而减小,X、Y、Z半径依次减小,故A错误;
B、铝的密度比钠的大,故B错误;
C、X、Y、Z的最高价氧化物对应水化物分别为NaOH、Al(OH)3、HClO4,Al(OH)3是两性氢氧化物,能与NaOH和HClO4反应,NaOH与HClO4,发生酸碱中和反应,故C正确;
D、钠先与水反应,不能从Y的盐水溶液中置换出Y,故D错误.
故选C.点评:
本题考点: 原子结构与元素周期律的关系.
考点点评: 本题以结构推断元素为载体,考查原子半径比较、元素化合物知识等,难度不大,关键根据结构推断出X、Y、Z元素.1年前查看全部
- 由两种短周期元素组成的化合物,其中一种元素的质量分数为75%(甲烷除...
由两种短周期元素组成的化合物,其中一种元素的质量分数为75%(甲烷除...
由两种短周期元素组成的化合物,其中一种元素的质量分数为75%(甲烷除外),此化合物可能是什么? eddywo1年前1
eddywo1年前1 -
 轻风小朱 共回答了22个问题
轻风小朱 共回答了22个问题 |采纳率95.5%铝的相对原子质量是27
碳的相对原子质量是32
碳化铝 又叫三碳化四铝 Al4C3 中铝的质量分数是75%
另注碳化铝的性质:
黄色或绿灰色结晶块或粉末,有吸湿性 沸 点 2200℃(分解) 熔 点 2100℃ 较稳定
遇湿易燃,燃烧(分解)产物:氧化铝、一氧化碳、二氧化碳,用作甲烷发生剂、催化剂、干燥剂等1年前查看全部
- (2012•许昌一模)几种短周期元素的原子半径及主要化合价见下表:下列说法正确的是( )
(2012•许昌一模)几种短周期元素的原子半径及主要化合价见下表:下列说法正确的是( )
元素代号 a b c d e 原子半径/nm 0.089 0.074 0.160 0.143 0.102 主要化合价 +2 -2 +2 +3 +6,-2
A.b和e所形成的化合物一定能使酸性高锰酸钾溶液褪色
B.a的单质与稀硫酸反应的速率比c快
C.d的氢氧化物为两性氢氧化物
D.这些元素应位于周期表中的同一周期 Lorain_Liu1年前1
Lorain_Liu1年前1 -
 dibaka 共回答了25个问题
dibaka 共回答了25个问题 |采纳率92%解题思路:a、c最高化合价都为+2价,应位于周期表第ⅡA族,由原子半径大小可知a为Be,c为Mg,b、e元素最低化合价为-2价,为O元素,e最高正价为+6价,应为S元素,d 的最高正价为+3价,结合与c的原子半径关系可知应为Al元素,结合对应单质、化合物的性质解答该题.a、c最高化合价都为+2价,应位于周期表第ⅡA族,由原子半径大小可知a为Be,c为Mg,b、e元素最低化合价为-2价,为O元素,e最高正价为+6价,应为S元素,d 的最高正价为+3价,结合与c的原子半径关系可知应为Al元素,
A.b和e所形成的化合物如为二氧化硫,可使酸性高锰酸钾溶液褪色,如为三氧化硫,则不褪色,故A错误;
B.金属性Be<Mg,Mg与稀硫酸反应较快,故B错误;
C.d为Al,对应的氧化物既可与酸反应,也可与碱反应,为两性氧化物,故C正确;
D.这些元素应位于周期表中第二、第三周期,故D错误.
故选C.点评:
本题考点: 原子结构与元素周期律的关系.
考点点评: 本题考查元素位置结构和性质的关系及应用,题目难度中等,从原子半径的变化和元素的最高正价和最低负价入手寻求突破,正确把握元素化合价、原子半径与元素性质的关系是解答该题的关键注意物质的性质与元素周期律的关系.1年前查看全部
- 【化学】X、Y、Z三种短周期元素分别处于不同周期.
【化学】X、Y、Z三种短周期元素分别处于不同周期.
X、Y、Z三种短周期元素分别处于不同周期.已知X原子和Y原子最外层电子数相同,Z原子次外层只有两个电子,X和Z可以形成离子化合物X2Z,Y和Z可以形成共价化合物Y2Z.
X、Y、Z的元素符号? 秋千上的猪1年前1
秋千上的猪1年前1 -
 心生呼啸露飞 共回答了12个问题
心生呼啸露飞 共回答了12个问题 |采纳率91.7%X为Na
Y为H
Z为O1年前查看全部
- 短周期元素A、B、C、D、E在元素周期表中的位置如图所示:
短周期元素A、B、C、D、E在元素周期表中的位置如图所示:

(1)A、C、D元素简单离子的半径由大到小为(填微粒符号)______.
(2)E的氢化物与其最高价氧化物的水合物的钾盐共热能发生反应,生成气体单质E反应的化学方程式为8HCl+KClO4
KCl+4Cl2↑+4H2O△ .8HCl+KClO4.
KCl+4Cl2↑+4H2O△ .
(3)C可形成单质C2,C2分子中σ键和π键的个数比为______.
(4)F与D同主族且相邻,请说明D的氢化物比F的氢化物稳定的根本原因:______.
用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种具有较强的氧化性的阳离子,试写出阳离子的电子式:______.写出该阳离子与F氢化物的水溶液反应的离子方程式:______. 凝子1年前1
凝子1年前1 -
 wolingmeng 共回答了19个问题
wolingmeng 共回答了19个问题 |采纳率94.7%解题思路:周期表中ⅡA、ⅢA不相邻,图中为相邻的5个主族,只能为ⅢA~ⅦA元素,由短周期主族元素A、B、C、D、E在元素周期表中的位置,可知A为Al,B为C,C为N,D为O,E为Cl.
(1)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
(2)E的氢化物为HCl,其最高价氧化物对应水化物的钾盐为KClO4,二者发生氧化还原反应生成氯气、水、KCl;
(3)N2分子结构式为N≡N,三键中含有1个σ键、2个π键;
(4)F与D同主族且相邻,则F为S元素,非金属性越强,氢化物越稳定;
用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,应为H2O+,该阳离子与H2S水溶液反应生成为S,由电荷守恒可知还生成H+,同时生成水.周期表中ⅡA、ⅢA不相邻,图中为相邻的5个主族,只能为ⅢA~ⅦA元素,由短周期主族元素A、B、C、D、E在元素周期表中的位置,可知A为Al,B为C,C为N,D为O,E为Cl.
(1)N3-、O2-、Al3+具有的核外电子排布,核电荷数越大,离子半径越小,则离子半径N3->O2->Al3+,故答案为:N3->O2->Al3+;
(2)E的氢化物为HCl,其最高价氧化物对应水化物的钾盐为KClO4,二者发生氧化还原反应生成氯气、水、KCl,反应的方程式为8HCl+KClO4
△
.
KCl+4Cl2↑+4H2O,
故答案为:8HCl+KClO4
△
.
KCl+4Cl2↑+4H2O;
(3)N2分子结构式为N≡N,三键中含有1个σ键、2个π键,N2分子中σ键和π键的个数比为1:2,
故答案为:1:2;
(4)F与D同主族且相邻,则F为S元素,非金属性O>S,故水比硫化氢稳定,
用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,应为H2O+,电子式为: ,该阳离子与H2S水溶液反应生成为S,由电荷守恒可知还生成H+,同时生成水,反应离子方程式为:2H2O++H2S=S↓+2H2O+2H+,
,该阳离子与H2S水溶液反应生成为S,由电荷守恒可知还生成H+,同时生成水,反应离子方程式为:2H2O++H2S=S↓+2H2O+2H+,
故答案为:氧的非金属性比硫强; ;2H2O++H2S=S↓+2H2O+2H+.
;2H2O++H2S=S↓+2H2O+2H+.点评:
本题考点: 元素周期律和元素周期表的综合应用;转化率随温度、压强的变化曲线.
考点点评: 本题考查结构、性质、位置关系应用,根据元素的位置推断元素是解题的关键,涉及微粒半径比较、化学键、电子式、化学方程式等知识点,难度中等.1年前查看全部
- 短周期元素中共价键最多的气体分子是什么?
 号码1111年前1
号码1111年前1 -
 奢华的叛逆 共回答了25个问题
奢华的叛逆 共回答了25个问题 |采纳率96%在有机物里面找,四个碳的烷烃,正丁烷或异丁烷.高于四个碳,就是液体或固体了.无机物中共价键是比较少的.1年前查看全部
- 四种短周期元素在周期表中的相对位置如图所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.
四种短周期元素在周期表中的相对位置如图所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.
请回答下列问题:X Y Z W
(1)元素Z位于周期表中第______周期,______族;
(2)这些元素的氢化物中,水溶液碱性最强的是______(写化学式);
(3)XW2的电子式为______;
(4)Y的最高价氧化物的化学式为______. chaoge12031年前0
chaoge12031年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 短周期元素X、Y、Z在周期表中的位置如图所示.下列说法正确的是( )
短周期元素X、Y、Z在周期表中的位置如图所示.下列说法正确的是( )
 A. 若它们均为金属元素,则x与氧元素组成的物质中一定只含离子键
A. 若它们均为金属元素,则x与氧元素组成的物质中一定只含离子键
B. 若它们的原子最外层屯子数之和为11,则它们均为非金属元素
C. 它们的原子最外层电子数的大小顺序一定是Z=Y>X
D. Z元素的最高化合价不一定大于X元素的 sobraniepink1年前2
sobraniepink1年前2 -
 废都上空的鹰 共回答了18个问题
废都上空的鹰 共回答了18个问题 |采纳率88.9%解题思路:A.短周期元素,若均为金属元素,由X、Y、Z在周期表中的位置关系可知,X为Na、Y为Mg、Z为Be;
B.若Z、Y处于零族,不符合最外层电子数为11,故都是主族元素,令X的最外层电子数为a,则a+a+1+a+1=11,解得a=3,则X为Al、Y为Si、Z为C;
C.若Z、Y处于零族,Z为He、Y为Ne,最外层电子数不相等;
D.Z为氧或F是不表现正化合价.A.短周期元素,若均为金属元素,由X、Y、Z在周期表中的位置关系可知,X为Na、Y为Mg、Z为Be,过氧化钠中含有离子键、共价键,故A错误;
B.若Z、Y处于零族,不符合最外层电子数为11,故都是主族元素,令X的最外层电子数为a,则a+a+1+a+1=11,解得a=3,则X为Al、Y为Si、Z为C,Al为金属性元素,故B错误;
C.若Z、Y处于零族,Z为He、Y为Ne,最外层电子数Y>X>Z,故C错误;
D.Z为氧或F是不表现正化合价,Z元素的最高化合价不一定大于X元素的,故D正确;
故选D.点评:
本题考点: 位置结构性质的相互关系应用.
考点点评: 本题考查结构性质位置关系,难度中等,掌握元素周期表的结构是关键,注意利用列举法进行的解答.1年前查看全部
- A,B,C,D为原子序数依次增大的短周期元素,化合物AB对水的电离有抑制作用,化合物C2D对水电离有促进作用,则C
 sun196505011年前1
sun196505011年前1 -
 elacy 共回答了7个问题
elacy 共回答了7个问题 |采纳率85.7%A氢 B氟 C钠 D硫1年前查看全部
- 现有a、b、c、d、e五种短周期元素,原子序数依次增大,其中a对应的单质是第IA族中沸点最低的物质
现有a、b、c、d、e五种短周期元素,原子序数依次增大,其中a对应的单质是第IA族中沸点最低的物质
e的单质能和冷水剧烈反应生成a的单质.它们中的一种或几种元素可以组成中学常见的物质,这些物质见的转化关系如图所示
A能生成B和C和D B与E反应生成C和F D和E反应能生成F和G 则abcde与ABCDEFG分别为? yangruilin1年前2
yangruilin1年前2 -
 Vinkinson 共回答了19个问题
Vinkinson 共回答了19个问题 |采纳率68.4%a:H
e:Na
还有C、O(具体是bcd哪种,确定不了)
A是NaHCO3
B是CO2
C是Na2CO3
D是H2O
E是Na2O2
F是O2
G是NaOH1年前查看全部
- a,b,c,d,e是短周期元素,周期表中a与b,b与c相邻,c与e同主族,a与c的最外层电子数之比为2:3,b的最外层电
a,b,c,d,e是短周期元素,周期表中a与b,b与c相邻,c与e同主族,a与c的最外层电子数之比为2:3,b的最外层电子数比c的最外层电子数少一个,常见化合物d2c2与水反应生成c的单质,且溶液使酚酞溶液变红.
1.e的元素符号是:
2.a,b,c的氢化物稳定性顺序为:
b的氢化物和b的最高价氧化物的水化物反应生成z,则z中的化学键类型为:
z的化合物类型为:(填共价化合物或离子化合物)
3.写出d2c2与ac2反应的化学方程式:
d2c2与水反应生成c的单质的离子方程式: 重庆英语9221年前2
重庆英语9221年前2 -
 另类情感 共回答了21个问题
另类情感 共回答了21个问题 |采纳率90.5%a:C,b:N,c:O,d:Na,e,S,z:NH4NO3
1.e的元素符号是:S
2.a,b,c的氢化物稳定性顺序为:H2O>NH3>CH4
b的氢化物和b的最高价氧化物的水化物反应生成z,则z中的化学键类型为:共价键和离子键
z的化合物类型为:离子化合物 (填共价化合物或离子化合物)
3.写出d2c2与ac2反应的化学方程式:2Na2O2+2CO2=2Na2CO3+O2↑
d2c2与水反应生成c的单质的离子方程式:2Na2O2+2H2O=4NaOH+O2↑1年前查看全部
- 现有A、B、C、D、E、F六种短周期元素,原子序数依次增大。已知A与D、C与E分别同主族,D、E、F同周期;A、B的最外
现有A、B、C、D、E、F六种短周期元素,原子序数依次增大。已知A与D、C与E分别同主族,D、E、F同周期;A、B的最外层电子数之和与C的最外层电子数相等,A与C形成的化合物常温下均为液态,A分别与E、F形成的气体分子电子总数相等。请回答下列问题:
(1) 元素B在周期表中的位置______________。
(2) A 2 C比A 2 E沸点高的原因是____________________________。
(3)写出同时含A、B、C、E四种元素的三种盐的化学式 、 、 。
(4)A 2 C的电子式为 ,C和D形成的一种化合物与A 2 C发生氧化还原反应,该反应的离子方程式为
(5)B元素的最高价氧化物的水化物与其氢化物反应的离子方程式
(6)在一定条件下,A、C的单质和A、C、D形成的离子化合物的水溶液可构成电池,该电池在放电过程中,电解质溶液的pH将________(填“增大”、“减小”或“不变”)。 kmrqc1年前0
kmrqc1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 元素推断(高中)5.R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数)A.若
元素推断(高中)
5.R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数)
A.若R (OH)n为强碱,则W (OH)n+1也为强碱
B.若HnXOm为强酸,则Y是活泼非金属元素
C.若Y的最低化合价为-2,则Z的最高正化合价为+6
D.若X的最高正化合价为+5,则五种元素都是非金属元素
题目中的“依次递增”是这个意思吗?比如说X是钠 那Y就是镁吗?
稀有气体不属于非金属元素是吗? 玲愤怒ing1年前3
玲愤怒ing1年前3 -
 chenli 共回答了15个问题
chenli 共回答了15个问题 |采纳率93.3%依次递增,并不是代表相邻,只是代表后面的大于前面的而已
若R是Na的话,W是Mg A就错了
若Y是O的话,Z只能是F或He,由于F没有正价,He只显0价,所以C错
若X是N的话五种元素不一定都是非金属元素,所以D错
只能选B
元素分成三份,金属元素,非金属元素和稀有元素1年前查看全部
- 短周期元素A、B、C、D、E在元素周期表中的位置如下图所示,其中B元素形成的化合物在自然界中的种类最多.请回答下列问题
 短周期元素A、B、C、D、E在元素周期表中的位置如下图所示,其中B元素形成的化合物在自然界中的种类最多.请回答下列问题
短周期元素A、B、C、D、E在元素周期表中的位置如下图所示,其中B元素形成的化合物在自然界中的种类最多.请回答下列问题
(1)描述D在元素周期表中的位置:______
(2)比较A、C、D元素简单离子半径的大小:______>______>______(填微粒符号)
(3)F与D同主族且相邻,请说出D的氢化物比F的氢化物稳定的根本原因:______
(4)C的氢化物与其最高价氧化物对应的水化物反应,产物溶于水呈______性,用离子方程式解释原因______.
(5)D原子与氢原子可形成10电子阳离子,写出该阳离子的电子式______
(6)E的最高价氧化物的水化物的化学式为______.E的氢化物与其最高价氧化物的水化物的钾盐共热能发生反应,生成一种气体单质,该反应的化学反应方程式为8HCl+KClO4
KCl+4Cl2↑+4H2O△ .8HCl+KClO4.
KCl+4Cl2↑+4H2O△ . 老妖刀1年前1
老妖刀1年前1 -
 chenlei519 共回答了22个问题
chenlei519 共回答了22个问题 |采纳率95.5%解题思路:短周期元素A、B、C、D、E,B元素形成的化合物在自然界中的种类最多,则B为C元素,由元素在周期表中的位置依次推出C为N,D为O,A为Al,E为Cl,然后利用元素及其单质、化合物的性质来解答.短周期元素A、B、C、D、E,B元素形成的化合物在自然界中的种类最多,则B为C元素,由元素在周期表中的位置依次推出C为N,D为O,A为Al,E为Cl,
(1)O元素在周期表中第二周期第ⅥA族,故答案为:第二周期第ⅥA族;
(2)A、C、D元素简单离子具有相同的电子排布,则原子序数大的离子半径小,所以离子半径为N3->O2->Al3+,故答案为:N3-;O2-;Al3+;
(3)F与D同主族且相邻,则F为S,因非金属性O>S,则O的氢化物比S的氢化物稳定,故答案为:N的非金属性比S强;
(4)C的氢化物为氨气,与其最高价氧化物对应的水化物硝酸,二者反应生成硝酸铵,因铵根离子水解使溶液显酸性,水解离子反应为NH4++H2O⇌NH3.H2O+H+,
故答案为:酸;NH4++H2O⇌NH3.H2O+H+;
(5)D原子与氢原子可形成10电子阳离子为H3O+,其电子式为 ,故答案为:
,故答案为: ;
;
(6)E的最高价为+7价,则最高价氧化物的水化物的化学式为HClO4,E的氢化物为HCl,其最高价氧化物的水化物的钾盐为KClO4,二者共热能发生反应生成一种气体单质为Cl2,由质量守恒定律可知还生成KCl和水,
化学反应为8HCl+KClO4
△
.
KCl+4Cl2↑+4H2O,故答案为:HClO4;8HCl+KClO4
△
.
KCl+4Cl2↑+4H2O.点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题考查元素周期表和元素周期律,元素的推断是解答的关键,并熟悉非金属的比较、半径的比较、水解、电子式、化学反应等知识点来解答,难度不大.1年前查看全部
- 下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是( )
下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是( )
元素代号 L M Q R T 原子半径/nm 0.160 0.143 0.089 0.102 0.074 主要化合价 +2 +3 +2 +6、-2 -2
A.L2+与R2-的核外电子数相等
B.M与T形成的化合物具有两性
C.氢化物的稳定性为H2T<H2R
D.单质与浓度相等的稀盐酸反应的速率为Q<L Mela1年前1
Mela1年前1 -
 airroy 共回答了17个问题
airroy 共回答了17个问题 |采纳率100%解题思路:L和Q的化合价都为+2价,应为周期表第ⅡA族,根据半径关系可知Q为Be,L为Mg;R和T的化合价都有-2价,应为周期表第ⅥA族元素,R的最高价为+6价,应为S元素,T无正价,应为O元素;M的化合价为+3价,应为周期表第ⅢA族元素,根据M原子半径大于R小于L可知应和L同周期,为Al元素,结合元素周期律知识解答该题.L和Q的化合价都为+2价,应为周期表第ⅡA族,根据半径关系可知Q为Be,L为Mg;R和T的化合价都有-2价,应为周期表第ⅥA族元素,R的最高价为+6价,应为S元素,T无正价,应为O元素;M的化合价为+3价,应为周期表第ⅢA族元素,根据M原子半径大于R小于L可知应和L同周期,为Al元素.
A.Mg2+核外有10个电子,S2-核外有18个电子,二者核外电子数不同,故A错误;
B.M与T形成的化合物是氧化铝,氧化铝是两性氧化物,溶于强酸、强碱,故B正确;
C.非金属性O>S,非金属性越强,氢化物越稳定,所以氢化物的稳定性为H2O>H2S,故C错误;
D.金属性Mg>Be,则Mg与酸反应越剧烈,则相同条件下单质与稀盐酸反应速率为Q<L,故D正确.
故选:BD.点评:
本题考点: 原子结构与元素周期律的关系.
考点点评: 本题考查元素位置结构和性质的关系及应用,题目难度中等,正确把握元素化合价、原子半径与元素性质的关系是解答该题的关键,注意元素周期律的递变规律的应用.1年前查看全部
- A B C D E F为原子序数一次增大的五种短周期元素,其中仅含一种金属元素.A和D最外层电子数相同,B C和E 在周
A B C D E F为原子序数一次增大的五种短周期元素,其中仅含一种金属元素.A和D最外层电子数相同,B C和E 在周期表中相邻,且C E同主族,B元素的氢化物与其最高价氧化物水化物化合生成一种盐,B C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的化合物甲和乙(相对分子质量甲小于乙) ABCDEF分别是什么元素?
 只抽三五烟1年前1
只抽三五烟1年前1 -
 妖怪尼尼 共回答了21个问题
妖怪尼尼 共回答了21个问题 |采纳率90.5%abcde分别是氢氮氧纳氯1年前查看全部
- 下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是( )
下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是( )
元素代号 L M Q R T 原子半径/nm 0.160 0.134 0.089 0.102 0.074 主要化合价 +2 +3 +2 +6、-2 -2
A.L2+与R2-的核外电子数相等
B.L与T形成的化合物具有两性
C.氢化物的稳定性为H2T<H2R
D.单质与浓度相等的稀盐酸反应的速率为Q<L 在爱情中迷失1年前1
在爱情中迷失1年前1 -
 流浪天空下 共回答了20个问题
流浪天空下 共回答了20个问题 |采纳率80%解题思路:元素的最高正价=最外层电子数,最高正价和最低负价绝对值的和为8,R、T两元素最外层电子数为6,故为第ⅥA元素,而R的半径大于T,T为O,R为S,M元素最外层电子数为3,为B或Al,但是半径比氧和硫均大,应为Al,L的半径比铝大,最外层电子数为2,应为Mg,Q的半径最小,最外层两个电子,故为Be,结合对应单质、化合物的性质解答该题.元素的最高正价=最外层电子数,最高正价和最低负价绝对值的和为8,R、T两元素最外层电子数为6,故为第ⅥA元素,而R的半径大于T,T为O,R为S,M元素最外层电子数为3,为B或Al,但是半径比氧和硫均大,应为Al,L的半径比铝大,最外层电子数为2,应为Mg,Q的半径最小,最外层两个电子,故为Be,
A.L2+是镁离子,R2-是硫离子,它们的核外电子数分别是10和18,核外电子数不相等,故A错误;
B.L与T形成的化合物是氧化镁,属于碱性氧化物,不是两性氧化物,故B错误;
C.同主族,从上到下氢化物的稳定性逐渐减小,所以稳定性:H2S<H2O,即H2T>H2R,故C错误;
D.同主族,从上到下原子得失电子能力逐渐增强,所以失电子能力Mg>Be,元素的金属性越强,与盐酸反应越剧烈,故D正确.
故选D.点评:
本题考点: 原子结构与元素周期律的关系.
考点点评: 本题主要考查了学生有关元素周期表的应用知识,题目难度不大,本题关键是能够把握元素的原子半径和化合价的关系,要熟记元素周期表中的递变规律,学以致用.1年前查看全部
- X、Y、Z、W四种短周期元素,若X的阳离子与Y的阴离子具有相同的电子层结构,W的阳离子氧化性强于等电荷的X阳离子的氧化性
X、Y、Z、W四种短周期元素,若X的阳离子与Y的阴离子具有相同的电子层结构,W的阳离子氧化性强于等电荷的X阳离子的氧化性,Z的阴离子半径大于等电荷的Y的阴离子半径,且Z离子所带电荷数的绝对值是W离子的两倍,W离子与Z离子的电子层相差两层.试推断这四种元素X_______,Y_________,Z_________,W_______.
 dy6141年前4
dy6141年前4 -
 dol3k 共回答了22个问题
dol3k 共回答了22个问题 |采纳率86.4%X、Y、Z、W四种短周期元素,Z离子所带电荷数的绝对值是W离子的两倍,一般可得z离子和y离子带两个单位的负电荷,又因为Z的阴离子半径大于等电荷的Y的阴离子半径,所以z为硫元素、y为氧元素.同时说明w离子带一个单位的正电...1年前查看全部
- 无机推断题X、Y均为短周期元素,X原子核外各电子层的电子数之比为1∶4∶1,X比Y原子多3个电子.下列叙述中正确的是 (
无机推断题
X、Y均为短周期元素,X原子核外各电子层的电子数之比为1∶4∶1,X比Y原子多3个电子.下列叙述中正确的是 ( )
A.X元素的最高氧化物对应的水化物是强碱
B.Y元素的最高氧化物对应的水化物的分子式可表示为HYO4
C.电解Y的钠盐溶液可制备Y的单质?
D.Y的单质与H2O反应在同类元素中最剧烈
我觉得选B,为什么? 资深书棍1年前1
资深书棍1年前1 -
 trtrtrtrtr 共回答了21个问题
trtrtrtrtr 共回答了21个问题 |采纳率85.7%由题目可知,X为Mg,Y为F.
选择答案D.
A:元素的最高氧化物对应的水化物是中强碱(或者是弱碱)
B:的氧化性比O还强,不可能形成HFO4
C:能由NaF制备单质F2
D:F能从水中迅速发生不可逆置换出氧气,而其他的则是发生可逆的歧化反应1年前查看全部
- 下表是元素周期表的一部分,表中的每个字母表示一种短周期元素,回答下列问题:(1)画出A的原子结构示意
下表是元素周期表的一部分,表中的每个字母表示一种短周期元素,回答下列问题:(1)画出A的原子结构示意
下表是元素周期表的一部分,表中的每个字母表示一种短周期元素,回答下列问题:
(1)画出A的原子结构示意图______.
(2)A、B、E、F、G五种元素所形成的气态氢化物最不稳定的是______(填化学式).
(3)D在元素周期表中的位置是第3周期第______族.
(4)E、F元素的最高价氧化物对应水化物的酸性较强的是______(填化学式).
(5)写出C和F形成的化合物的电子式______.
(6)A、C、D 的离子半径大小关系是______ (用离子符号表示)
 星宇20071年前1
星宇20071年前1 -
 xiepei 共回答了17个问题
xiepei 共回答了17个问题 |采纳率88.2%根据元素在周期表中的分布知识,可以知道A是O,B是F,C是Na,D是Al,E是P,F是S,G是Cl.
(1)根据原子结构示意图的画法,氧原子结构示意图为: ,故答案为:
,故答案为: ;
;
(2)同主族元素的原子从上到下,氢化物的稳定性逐渐减弱;同周期元素的原子从左到右,氢化物的稳定性逐渐增强,所以O、F、P、S、Cl五种元素所形成的气态氢化物最不稳定的是
PH3,故答案为:PH3;
(3)根据元素周期表中周期和族的划分可以确定Al元素在周期表中的第三周期第ⅢA族,故答案为:第三周期第ⅢA族;
(4)P、S是周期表中同一周期元素,从左到右元素最高价氧化物对应水化物的酸的酸性逐渐增强,所以酸性:H2SO4>H3PO4,故答案为:H2SO4;
(5)C和F形成的化合物是硫化钠,硫化钠是钠离子和硫离子之间通过离子键形成的离子化合物.电子式为: ,故答案为:
,故答案为: ;
;
(6)微粒电子层越多半径越大,S2->O2-、Na+,核外电子排布一样,核电荷数越多半径越小,即O2->Na+,故答案为:S2->O2->Na+.1年前查看全部
- (2010•福建模拟)化合物A由两种不同短周期元素X、Y组成,具有良好电绝缘性
(2010•福建模拟)化合物A由两种不同短周期元素X、Y组成,具有良好电绝缘性
(1)X的单质既可与盐酸反应,又可与NaOH溶液反应,X的原子结构示意图为______.
(2)0.1mol/LX的硫酸盐溶液与0.1mol/LNaOH溶液等体积混合,反应的离子方程式为______.
(3)Y的单质在放电条件下能与氧气反应.写出化学方程式:N2+O2
2NO放电 .N2+O2.
2NO放电 .
(4)化合物A能与水缓慢反应生成含Y的化合物Z,Z分子中含有10个电子.写出该反应的化学方程式:______. zhangyu18421年前0
zhangyu18421年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- ABCD四种短周期元素的原子序数依次增大,AD同主族,BC同周期,AB组合成的化合物甲为气态.
 yan-he1年前1
yan-he1年前1 -
 penghuall 共回答了21个问题
penghuall 共回答了21个问题 |采纳率90.5%问题不够清楚,不过先给你个大概的可能吧,你再把题看看做相应的处理;常温下为气体的,NH3、CO、CO2、HF、CH4、H2S、HCl;再根据ABCD的顺序,A很可能就是H,而B可能就是C、N、F、S、Cl、中的一个;我们的常识D也很可能就是K,Na,极为可能就是Na吧!1年前查看全部
- A、B、C三种短周期元素,A是地壳中含量最多的元素,B的单质是最轻的气体,C的单质通常情况下是一种黄绿色的气体,该气体常
A、B、C三种短周期元素,A是地壳中含量最多的元素,B的单质是最轻的气体,C的单质通常情况下是一种黄绿色的气体,该气体常用于自来水的杀菌消毒.请按要求填空:
(1)A的原子结构示意图为:______.
(2)B的同位素中常用于制造氢弹的是:______.
(3)用电子式表示B2A的形成过程______.
(4)写出实验室制取C的单质的化学方程式:MnO2+4HCl
MnCl2+Cl2↑+2H2O△ .MnO2+4HCl.
MnCl2+Cl2↑+2H2O△ .
(5)A,B,C组成一种有强氧化性,且有漂白性的一种物质是:______. 卡伦耶申科1年前0
卡伦耶申科1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是(
 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
A.Y的氢化物沸点较高是因为其相对分子质量比较大
B.W的最高价氧化物对应水化物的酸性比Z的强
C.Z的非金属性比Y的强
D.X与Y形成的化合物中既有离子键又有共价键 沉浮小白1年前1
沉浮小白1年前1 -
 yan000000 共回答了11个问题
yan000000 共回答了11个问题 |采纳率100%解题思路:X、Y、Z、W均为短周期元素,由元素的位置可知,X、Y处于第二周期,Z、W处于第三周期,Y原子的最外层电子数是内层电子数的3倍,Y原子最外层电子数为6,所以Y为O元素,可推知X为N元素,Z为S元素,W为Cl元素,
A.水分子之间存在氢键,沸点高于硫化氢;
B.同周期随原子序数增大,元素非金属性增强,非金属性越强,最高价含氧酸的酸性越强;
C.同主族自上而下非金属性减弱;
D.X与Y形成的常见化合物属于共价化合物.X、Y、Z、W均为短周期元素,由元素的位置可知,X、Y处于第二周期,Z、W处于第三周期,Y原子的最外层电子数是内层电子数的3倍,Y原子最外层电子数为6,所以Y为O元素,可推知X为N元素,Z为S元素,W为Cl元素,
A.水分子之间存在氢键,沸点高于硫化氢,故A错误;
B.非金属性W>Z,故最高价氧化物对应水化物的酸性W>Z,故B正确;
C.同主族自上而下非金属性减弱,非金属性Y>Z,故C错误;
D.X与Y形成的常见化合物属于共价化合物,不含离子键,故D错误,
故选B.点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题考查结构性质位置关系应用,侧重对元素周期表与元素周期律的考查,难度不大,注意掌握元素周期律,理解同主族、同周期元素性质的递变规律.1年前查看全部
- (2009•宝安区模拟)现有下列短周期元素性质的数据:下列说法正确的是( )
(2009•宝安区模拟)现有下列短周期元素性质的数据:下列说法正确的是( )
元素编号
元素性质① ② ③ ④ ⑤ ⑥ ⑦ ⑧ 原子半径 0.74 1.60 1.52 1.10 0.99 1.86 0.75 0.82 最高或
最低化合价+2 +1 +5 +7 +1 +5 +3 -2 -3 -1 -3
A.元素④的原子序数小于元素⑦的原子序数
B.②、③处于同一周期
C.⑧号元素原子结构示意图为:
D.上述八种元素最高价氧化物对应的水化物,⑤号酸性最强 小灶王1年前1
小灶王1年前1 -
 失落天使2008 共回答了22个问题
失落天使2008 共回答了22个问题 |采纳率86.4%解题思路:①只有最低价-2价,则①为O;⑤有+7、-1价,处于ⅦA族,为Cl元素;④⑦有+5、-3价,处于ⅤA族,且④原子半径较大,则④为P、⑦为N;③⑥只有最高正价+1价,处于ⅠA族,且⑥的原子半径较大,③原子半径不是最小,则③为Li、⑥为Na;②最高价+2价,处于ⅡA族,原子半径大于P,则②为Mg;⑧最高价为+3价,处于ⅢA族,原子半径小于P元素,则⑧为B元素,据此解答.①只有最低价-2价,则①为O;⑤有+7、-1价,处于ⅦA族,为Cl元素;④⑦有+5、-3价,处于ⅤA族,且④原子半径较大,则④为P、⑦为N;③⑥只有最高正价+1价,处于ⅠA族,且⑥的原子半径较大,③原子半径不是最小,则③为Li、⑥为Na;②最高价+2价,处于ⅡA族,原子半径大于P,则②为Mg;⑧最高价为+3价,处于ⅢA族,原子半径小于P元素,则⑧为B元素,
A.④为P、⑦为N,④的原子序数较大,故A错误;
B.②为Mg,处于第三周期,③为Li,处于第二周期,二者不处于同一周期,故B错误;
C.⑧为B元素,原子结构示意图为 ,故C错误;
,故C错误;
D.⑤Cl元素,其元素最高价氧化物对应的水化物为HClO4,是最强的无机含氧酸,故D正确,
故选D.点评:
本题考点: 位置结构性质的相互关系应用.
考点点评: 本题考查性质结构位置关系应用,根据化合价与原子半径推断元素是解题的关键,注意掌握元素周期律,难度中等.1年前查看全部
- 若短周期元素中的两种元素能形成原子个数为2:3的化合物,这样的原子序数不可能是多少
若短周期元素中的两种元素能形成原子个数为2:3的化合物,这样的原子序数不可能是多少
A.1
B.3
C.5
D.6希望能够各举出几个例子,再说一下怎么样解这样的题目最快
谢谢了 sunnycjy1年前3
sunnycjy1年前3 -
 liutaoxhs 共回答了7个问题
liutaoxhs 共回答了7个问题 |采纳率71.4%B.3.
原子序数为1、3、5、6的元素分别是H 、Li 、B 、C.短周期元素中的两种元素形成原子个数为2:3的可以是B2O3 、C4H6.所以排除了ACD.这类题目根据比值关键要考虑元素的化合价,以及要注意有机化合物.1年前查看全部
- 水做反应物的复分解反应与水反应的物质是短周期元素组成的
 一个想法_1年前1
一个想法_1年前1 -
 jsgxya 共回答了13个问题
jsgxya 共回答了13个问题 |采纳率92.3%2KAl(SO4)2+6H2O=2Al(OH)3+K2SO4+2H2SO4
应该只能考虑水解了吧- -|1年前查看全部
- 两种短周期元素组成的化合物中,原子个数比为1:2,两元素原子序数为p,q,p+q能等于15么?
 414933481年前2
414933481年前2 -
 艾城故事 共回答了26个问题
艾城故事 共回答了26个问题 |采纳率100%可以的,如NO2或N2O.1年前查看全部
- 一道化学题,帮一帮.x,y,z均为短周期元素.若:x元素原子的最外层电子数为一:y元素原子的M层上有7个电子;z元素的原
一道化学题,帮一帮.
x,y,z均为短周期元素.若:x元素原子的最外层电子数为一:y元素原子的M层上有7个电子;z元素的原子最外层电子数是次外层电子数的3倍.
则由x,y,z组成的化合物的化学式不可能是
A XYZ2 (2为脚标) B XYZ4 (4为脚标) C XYZ D X2YZ4(2,4为脚标)
请讲解,谢谢 绝kou1年前7
绝kou1年前7 -
 hi5y76114 共回答了13个问题
hi5y76114 共回答了13个问题 |采纳率92.3%X可以是H,Li,Na Y必是Cl Z必定是O,
A 可以为HClO2,为亚氯酸,Cl化合价为+3
B可以为HClO4,高氯酸 Cl化合价为+7
C为HClO,也可以NaClO等,化合价为+1
其实就是告诉你 Y最外层电子数为7个,那么Y元素的最高化合价为+7,也就是考Cl的可能的化合价 Cl一般有-1.0.+1,+3.+5 +7 就是没有正6 所以D错1年前查看全部
- 有两短周期元素X和Y,可组成化合物XY3,当Y为-2价时,X的原子序数为( ) A13 B5 C8 D16
 娃哈哈1ra1年前1
娃哈哈1ra1年前1 -
 的重要 共回答了25个问题
的重要 共回答了25个问题 |采纳率96%SO3:选D1年前查看全部
- 已知A,B为短周期元素,它们可组成BA4的化合物,若A原子序数为m,则B的原子序数不可能是? A m-3 B m+5 C
已知A,B为短周期元素,它们可组成BA4的化合物,若A原子序数为m,则B的原子序数不可能是? A m-3 B m+5 C m+15
 sjg520ly1年前1
sjg520ly1年前1 -
 time_well 共回答了20个问题
time_well 共回答了20个问题 |采纳率95%其实这种题,可以随便取一些元素套一下.
BA4,那么A应该是+1或者-1价的物质,+1可以选H,那么B选项中,就是C,然后甲烷CH4成立,-1就可以考虑第七主族的元素,A选项的m-3就是第四主族的元素,可以写出几种,都合题意.只有C选项,因为是短周期元素,m只能是1,2,3,对应16,17,18,不管哪个都不能满足要求.
所以应该是C1年前查看全部
- 短周期元素X,Y,Z,W的原子序数增大其原子的最外层电子数不少于最内层电子数.其中X是形成化合物种类最多的元素,①X的最
短周期元素X,Y,Z,W的原子序数增大其原子的最外层电子数不少于最内层电子数.其中X是形成化合物种类最多的元素,①X的最高价氧化物的电子式是?
在一定条件下,上述四种元素的单质均能与氧气反应,其中Z的氧化物既能溶于稀硫酸,又能溶于NaOH溶液,②Z元素在元素周期表中位于第几周期,第几主族.
Y固体单质与盐酸反应,再向反应后的溶液中加入过量烧碱溶液,最终溶液中有白色沉淀生成,③写出生成白色沉淀的反应方程式
向上述四种元素的单质的混合物中加入足量烧碱,固体部分溶解,过滤,向滤液中加入过量的盐酸溶液,最终溶液中有白色沉淀,④产生白色沉淀的离子方程式
X,Y,Z,W四种元素的原子半径由大到小顺序为(用元素符号表示) wenwen19811年前2
wenwen19811年前2 -
 yanggao198118 共回答了19个问题
yanggao198118 共回答了19个问题 |采纳率94.7%X、Y、Z、W分别为碳、镁、铝、硅1年前查看全部
大家在问
- 1The Internet makes our life nicer,e__and more colourful than
- 2亲们,leave后面加什么介词?to还是for???
- 3下面一段文字后的四个选项中,最能准确概括文字内容的一项是( )(3分)
- 4如图在三角形ABC中AC大于AB,角ABC=3倍角ACB,AD平分角BAC,BM垂直AD垂足为点M求证:BM=二分之一(
- 5成语,( )( )不展;( )苦( )乐;( )己( )人
- 6一项工程,甲.乙两队合作完成需6天,如果两队合作3天后,剩下的由甲队又单独做了5天才能完成,
- 7如图: (1)买两件毛衣,付100元应找回多少钱?(2)小刚只带60元,可以买那些服装?
- 8请问英语中的nice to see you和nice to meet you有什么不同?如何使用和区分?
- 9洗衣服英文怎么写
- 10生物圈为生物提供的基本生存条件不包括( )
- 11简要介绍自己在体育活动方面的爱好.(不得少于5句话) 要有翻译
- 12英语翻译中文名言简短一点的的名言哦,快一点要是初二学生能懂的哦
- 13英语阅读We have h____ about the Friends of the Earth.Friends of
- 14函数y=x|x-2|的单调递增区间是 ______.
- 15成年人说话时的声音大小的范围是多少?成年人能听到的声音大概是多少?(物理单位)
