“复盐”是指含多种简单阳离子和一种酸根离子组成的盐,如KAl(SO4)2.而一种金属离子与多种酸根离子构成的盐则称为“混
 cf_chdh2022-10-04 11:39:541条回答
cf_chdh2022-10-04 11:39:541条回答A.Ca2O2Cl4
B.KCl•MgCl2•6H2O
C.KMnO4
D.Cu2(OH)2CO3

已提交,审核后显示!提交回复
共1条回复
 mengfeiyu1 共回答了9个问题
mengfeiyu1 共回答了9个问题 |采纳率88.9%- 解题思路:盐是由金属阳离子(铵根离子)和酸根阴离子组成的化合物,一种金属离子与多种酸根离子构成的盐则称为“混盐”,结合题中信息和盐的定义进行分析判断.
A、Ca2O2Cl4的化学式可以写成Ca2(ClO)2Cl2,所以该物质是由一种金属阳离子和两种酸根离子构成的,因此属于混盐,故A正确.
B、KCl•MgCl2•6H2O含有两种阳离子和一种酸根阴离子,是复盐,不符合混盐的组成,所以不是混盐,故B错误.
C、KMnO4,是一种阳离子和一种阴离子构成,属于正盐,故C错误.
D、Cu2(OH)2CO3 含有一种阳离子、一种酸根阴离子和氢氧根离子的盐,属于碱式盐,故D错误.
故选:A.点评:
本题考点: 酸、碱、盐、氧化物的概念及其相互联系.
考点点评: 本题是信息给予题,注意根据盐的概念和题目中信息分析解答,考查学生提练加工信息的能力,题目难度中等. - 1年前
相关推荐
- 10、某复盐的化学式为AxB(ED4)y·zH2O,已知x、y、z均为正整数,且x+y+z=10,用该晶体完成下列实验:
10、某复盐的化学式为AxB(ED4)y·zH2O,已知x、y、z均为正整数,且x+y+z=10,用该晶体完成下列实验:
①称取该晶体40.20g,在坩锅中加热至质量不再改变,固体质量减少了10.8g. ②将剩余固体溶于水配成200mL溶液,20mL,向其中加入过量的Ba(OH)2溶液,ED4离子和B离子全部沉淀,经过过滤、洗涤、干燥、冷却,称得固体质量为5.24g. ③往上述固体中加入过量盐酸,固体又减少了0.58g.试确定A、B是何种元素及该晶体的化学式. wanglili1982781年前1
wanglili1982781年前1 -
 风之子2008 共回答了22个问题
风之子2008 共回答了22个问题 |采纳率77.3%结晶水的物质的量为:10.8g÷18g/mol=0.600mol
初步确认的SO42-的物质的量为:{(5.24g-0.580g)÷233g/mol}×200mL/20mL=0.200mol
这样,该复盐中y:z=0.200:0.600=1:3
这就找到了解决问题的突破口,因为有了y:z=1:3,加之题给x+y+z=10,就创造了利用数学手段,结合化学意义进行讨论进而确认的机会.讨论:
当y=1时,z=3,则x=6,依该结论,则该复盐的化学式当初步确定为A6B(ED4)·3H2O,这显然与化合价法则相矛盾.原假设不能成立.
当y=2时,z=6,则x=2,依该结论,则该复盐的化学式当初步确定为A2B(ED4)2·6H2O,且可能成立的情况必然为A为+1价,则B必为+2价.依上述推论推得的40.2g中含结晶水0.600mol,则含A为0.200mol、B为0.100mol,可知生成金属B的氢氧化物的化学式为B(OH)2,且其摩尔质量为:
(0.58g×200mL/20mL)/0.100mol=58.0g/mol
易得金属B的相对原子质量为58.0-17.0×2=24.0,显然B元素为Mg.40.2g复盐中A元素的质量为:
40.2g-10.8g-96g/mol×0.2mol-2.4g=7.80g
金属A的摩尔质量为:7.80g÷0.2mol=39.0g/mol,所以A元素为K元素.
这样复盐的化学式是K2Mg(SO4)2·6H2O.1年前查看全部
- 钙沸石、正长石、高岭石的主要组成成分是否属于复盐
 fruits1年前1
fruits1年前1 -
 lwlly 共回答了27个问题
lwlly 共回答了27个问题 |采纳率92.6%钙沸石是沸石族矿物之一,它与钠沸石相似并有着密切的关系.
化学式:na2al2si3o10·3h2o,是复盐
正长石的化学组成是KAlSi3O8,是复盐]
高岭石属于粘土矿物,其化学组成为Al4[Si4O10]·(OH)8,应该是碱式盐1年前查看全部
- 摩尔盐的能抗氧化,是因为它是复盐?复盐为什么能抗氧化?
 budaocun1年前2
budaocun1年前2 -
 狂人舅舅 共回答了17个问题
狂人舅舅 共回答了17个问题 |采纳率94.1%硫酸亚铁铵的固体中,原子之间的空隙很小,氧分子不能进入,仅氧化掉表面后反应即停止.类似于钝化.1年前查看全部
- Caocl2是属于混盐,复盐还是络盐?
Caocl2是属于混盐,复盐还是络盐?
请说明理由 雪海神1年前4
雪海神1年前4 -
 下午6点 共回答了13个问题
下午6点 共回答了13个问题 |采纳率76.9%络盐:由两种不同的盐结合而成的一种盐,这种盐在溶液中电离,产生出来不是原来盐所具有的离子.如K3Fe(CN)6在溶液中电离时,产生Fe(CN)6 3-离子,而不产生Fe 3+及CN -离子
混盐:二元或多元酸分子中的氢原子被不同金属原子所置换,或两种或两种以上的酸分子中的氢原子被同一金属原子所置换而成的盐,由一种金属阳离子(包括NH4+)和两种酸根阴离子所组成.例如氯化硝酸钙,氯化次氯酸钙CaOCl2 等.1年前查看全部
- 在无色溶液中下列离子能大量共存,加入了一种复盐--(NH4)2Fe(SO4)2•6H2O晶体后,仍能大量共存的是( )
在无色溶液中下列离子能大量共存,加入了一种复盐--(NH4)2Fe(SO4)2•6H2O晶体后,仍能大量共存的是( )
A.Na+、H+、Cl-、NO− 3
B.K+、Ba2+、OH-、I-
C.Cu2+、Na+、Br-、Cl-
D.Na+、K+、Cl-、SO2− 4  flameex1年前1
flameex1年前1 -
 我就想掘一小桶金 共回答了19个问题
我就想掘一小桶金 共回答了19个问题 |采纳率89.5%解题思路:根据离子之间不能结合生成水、气体、沉淀,则能大量共存,加入(NH4)2Fe(SO4)2•6H2O晶体后,与铵根离子、亚铁离子、硫酸根离子也不反应的离子组可大量共存,以此来解答.A.该组离子之间不反应,能共存,但加入(NH4)2Fe(SO4)2•6H2O晶体后,Fe2+、H+、NO3-发生氧化还原反应,不能大量共存,故A错误;
B.该组离子之间不反应,能共存,但加入(NH4)2Fe(SO4)2•6H2O晶体后,NH4+、OH-结合生成弱电解质,Ba2+、SO42-结合生成沉淀,不能共存,故B错误;
C.该组离子之间不反应,不能大量共存,但Cu2+为蓝色,与无色溶液不符,故C错误;
D.该组离子之间不反应,能大量共存,且离子均为无色,加入(NH4)2Fe(SO4)2•6H2O晶体后,仍不反应,能大量共存,故D正确;
故选D.点评:
本题考点: 离子共存问题.
考点点评: 本题考查离子的共存问题,为高考常见的题型,侧重氧化还原反应及复分解反应的考查,把握离子的性质、离子的颜色等即可解答,题目难度不大.1年前查看全部
- 什么是复盐“由两种或两种以上的简单盐类组成的同晶型化合物,叫做复盐”同晶型化合物是什么意思最好有举例
 春土1年前1
春土1年前1 -
 路客茶 共回答了24个问题
路客茶 共回答了24个问题 |采纳率83.3%就是同样属于盐而两种盐的方程式不相同..1年前查看全部
- 复盐 由两种金属离子(或铵根离子)和一种酸根离子构成的盐.能用氨根离子的举个例子吗?
 ADWS更漂亮1年前1
ADWS更漂亮1年前1 -
 hongping_li 共回答了11个问题
hongping_li 共回答了11个问题 |采纳率90.9%硫酸铝铵1年前查看全部
- (2012•奉贤区二模)铵明矾[NH4Al(SO4)2•12H2O]是一种复盐,向其溶液中逐滴加入Ba(OH)2溶液,可
(2012•奉贤区二模)铵明矾[NH4Al(SO4)2•12H2O]是一种复盐,向其溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是( )
A.NH4++Al3++5OH-→NH3•H2O+AlO2-+2H2O
B.NH4++Al3++2SO42-+2Ba2++5OH-→2BaSO4↓+NH3•H2O+AlO2-+2H2O
C.5NH4++5Al3++10SO42-+10Ba2++22OH-→10BaSO4↓+5NH3•H2O+2AlO2-+3Al(OH)3↓+4H2O
D.3NH4++4Al3++8SO42-+8Ba2++16OH-→8BaSO4↓+3NH3•H2O+3Al(OH)3↓+AlO2-+2H2O jinhai1年前1
jinhai1年前1 -
 dlq346734145 共回答了17个问题
dlq346734145 共回答了17个问题 |采纳率94.1%解题思路:铵明矾[NH4Al(SO4)2•12H2O]是一种复盐,向其溶液中逐滴加入Ba(OH)2溶液,硫酸根沉淀钡离子,同时氢氧根离子沉淀铝离子,随滴入的氢氧化钡增多,硫酸根离子全部沉淀,同时铝离子沉淀完全,过量的氢氧根离子和铵根离子结合生成一水合氨,氢氧化铝不能溶解在氨水中,继续滴入氢氧化钡,氢氧化铝沉淀溶解,依据离子反应顺序书写离子方程式判断;A、反应中氢氧化钡低显生成硫酸钡沉淀和氢氧化铝沉淀;故A错误;
B、NH4Al(SO4)2•12H2O和Ba(OH)2 按照1:2恰好反应生成硫酸钡沉淀、氢氧化铝沉淀、一水合氨,继续加入氢氧化钡0.5mol,氢氧化铝沉淀完全溶解,反应的离子方程式为:NH4++Al3++2SO42-+2Ba2++5OH-→2BaSO4↓+NH3•H2O+AlO2-+2H2O,故B正确;
C、NH4Al(SO4)2•12H2O和Ba(OH)2 按照5:10恰好反应生成硫酸钡沉淀、氢氧化铝沉淀、一水合氨,继续加入1molBa(OH)2,溶解2mol氢氧化铝沉淀,剩余氢氧化铝沉淀3mol,反应的离子方程式为:5NH4++5Al3++10SO42-+10Ba2++22OH-→10BaSO4↓+5NH3•H2O+2AlO2-+3Al(OH)3↓+4H2O;故C正确;
D、NH4Al(SO4)2•12H2O和Ba(OH)2 按照4:8恰好反应生成硫酸钡沉淀、氢氧化铝沉淀、一水合氨,无氢氧化铝沉淀溶解,故D错误;
故选BC.点评:
本题考点: 离子方程式的书写;镁、铝的重要化合物.
考点点评: 本题考查了离子方程式的书写方法和注意问题,离子反应顺序是解题关键,题目难度较大.1年前查看全部
- 什么叫正盐,酸式盐,碱式盐,复盐,混盐,请举例说明
 ss移动老总ss1年前2
ss移动老总ss1年前2 -
 a9458 共回答了18个问题
a9458 共回答了18个问题 |采纳率83.3%盐可电离出金属根离子和酸根离子
正盐呈中性 如NaCl
酸式盐呈酸性,可以电离H+ ,如NaHSO4
碱式盐呈碱性,可以电离出OH-,如Cu(OH)2CO3
复盐,由两种或两种以上的简单盐类组成的同晶型化合物,叫做复盐.复盐又叫重盐.复盐中含有大小相近、适合相同晶格的一些离子,如
明矾(硫酸铝钾)KAl(SO4)2·12H2O
混盐:是指一种金属离子与多种酸根离子所构成的盐.如氯化硝酸钙 Ca(NO3)Cl1年前查看全部
- 什么是“复盐”?举例
 伊苒1年前4
伊苒1年前4 -
 win0632 共回答了15个问题
win0632 共回答了15个问题 |采纳率86.7%由两种或两种以上的简单盐类组成的同晶型化合物,叫做复盐.
例如,明矾(硫酸铝钾)是KAl(SO4)2·12H2O,莫尔盐(硫酸亚铁铵)是(NH4)2Fe(SO4)2·6H2O,铁钾矾(硫酸铁钾)是KFe(SO4)2·12H2O.1年前查看全部
- 单盐的定义 合盐的定义 正盐的定义 酸式盐的定义 碱式盐的定义 复盐的定义 络盐的定义
单盐的定义 合盐的定义 正盐的定义 酸式盐的定义 碱式盐的定义 复盐的定义 络盐的定义
好的额外重赏! 搭错火车1年前1
搭错火车1年前1 -
 freeknight 共回答了21个问题
freeknight 共回答了21个问题 |采纳率95.2%单盐分为正盐、酸式盐、碱式盐,合盐分为复盐和络盐 酸式盐除含有金属离子与酸根离子外还含有氢离子,碱式盐除含有金属离子与酸根离子外还含有氢氧根离子,复盐溶于水时,可生成与原盐相同离子的合盐了,络盐溶于水时,可生成与原盐不相同的复杂离子的合盐-络合物 正盐:单由金属离子(包括铵根离子)和非金属离子构成. 酸式盐:由金属离子(包括铵根离子)、氢离子 酸根离子和非金属离子构成 碱式盐:由金属离子(包括铵根离子)、氢氧根离子 酸根离子和非金属离子构成 复盐:由不同金属离子(包括铵根离子)和酸根离子构成 络盐是由两种不同的盐结合而成的一种盐,这种盐在溶液中电离,产生出来不是原来盐所具有的离子.1年前查看全部
- 已知a是一种由两种阳离子和一种酸根离子组成的含结晶水的复盐,现有以下实验.用热的铂丝蘸取a的晶体在酒精灯的火焰上灼烧,火
已知a是一种由两种阳离子和一种酸根离子组成的含结晶水的复盐,现有以下实验.用热的铂丝蘸取a的晶体在酒精灯的火焰上灼烧,火焰呈紫色:向a的水溶液中滴加稀盐酸,没有现象,在滴加氯化钡溶液有白色沉淀b产生,向a的水溶液中加入过量氨水,产生白色沉淀c,将c加热得到d,d即可溶于naoh,又溶于硫酸,电解熔融的d可得到人们生产和生活中广泛使用的金属,求bcd及所有化学方程式,离子方程式.
万分 qq夏天1年前1
qq夏天1年前1 -
 mollify 共回答了16个问题
mollify 共回答了16个问题 |采纳率93.8%a就是硫酸铝钾,K2SO4·Al2(SO4)3·24H2O ,b是BaSO4,c是Al(OH)3,d是Al2O3.
BaCl2 + K2SO4 = BaSO4↓ + 2KCl
Ba2+ + SO42- = BaSO4↓
Al2(SO4)3 + 6NH3-H2O= 2Al(OH)3↓ + 3(NH4)2SO4
Al3+ + 3NH3-H2O = Al(OH)3↓ + 3 NH4+
2Al(OH)3 = AL2O3 + 3H20
无离子方程式
AL2O3 + 2NaOH = 2NaAlO2 + H20
AL2O3 + 2OH- = 2AlO2- + H2O
AL2O3 + 3H2SO4 = AL2(SO4)3 + 3H20
AL2O3 + 6H+ = 2AL3+ + 3H2O
2AL2O3 = 4AL + 3O2↑1年前查看全部
- k3Fe(CN)6 是配合物还是复盐
 fumeili121年前1
fumeili121年前1 -
 用筷子吃kk 共回答了24个问题
用筷子吃kk 共回答了24个问题 |采纳率87.5%k3Fe(CN)6是标准的配合物,非盐.1年前查看全部
- 复盐溶液(如Kal(SO4)2·12H2O (NH4)2SO4·CuSO4·6H2O)中的溶质是什么
 寻找aa1年前1
寻找aa1年前1 -
 baifengqi632 共回答了18个问题
baifengqi632 共回答了18个问题 |采纳率88.9%这里溶质就是复盐
也就是硫酸铝钾KAl(SO4)2和硫酸铜铵(NH4)2Cu(SO4)21年前查看全部
- 在复盐NH4Al(SO4)2溶液中逐滴Ba(oH)2 离子方程式可能有哪些 为什么?
 cc儒1年前1
cc儒1年前1 -
 犹如鹿切慕溪水 共回答了24个问题
犹如鹿切慕溪水 共回答了24个问题 |采纳率95.8%这个题目可以这么理解:
因为离子型化合物一旦溶解到水里以后,就会变成水合离子,简单的说就是离子,这个时候表现的就是离子的性质,而不再是原来的化合物,比如那个复盐溶于水之后,就变成了NH4+,Al3+,硫酸根这三种离子,跟硫酸铵和硫酸铝这两种化合物溶于水的性质是一样的.你肯定做过类似于"下面那些离子不可以在溶液中共存"的题目,所以这道题就变成了:
在水溶液中,NH4+,Al3+,Ba2+,硫酸根,氢氧根这几种离子都可以有那些反应,离子反应式无非就是阴阳离子互相反应,所以你拿一个阳离子出来跟两种阴离子结合看看能不能反应就行了,逐个排查.
最后说一点,有些时候可能还需要考虑水溶液里面本身就有H+,和OH-,也就是考虑一些离子的水解反应.反应式就不写了,你自己总结吧.1年前查看全部
- 酸酐、氧化物、复盐、混盐是怎样分类?定义各是什么?
 wasami1年前1
wasami1年前1 -
 luyunonline 共回答了22个问题
luyunonline 共回答了22个问题 |采纳率90.9%两分子酸脱去一份子水就成了酸酐,如乙酸酐;氧化物是只有氧元素和另一种元素构成的化合物,如氧化铁;复盐:1.由两种或两种以上的简单盐类组成的同晶型化合物,叫做复盐.复盐又叫重盐.复盐中含有大小相近、适合相同晶...1年前查看全部
- 在化工试剂生产中,要除去某种杂质离子,往往采用一定条件下使之生成MXAy(DE4)Z(OH)12浅黄色复盐晶体析出.化学
在化工试剂生产中,要除去某种杂质离子,往往采用一定条件下使之生成MXAy(DE4)Z(OH)12浅黄色复盐晶体析出.化学式中OH为氢氧根,而M、A、D、E代表四种未知元素.已知⑴X+Y+Z=12(x、Y、Z为正整数).⑵取9.7g该化合物溶于含有稀硝酸的水中,滴加硝酸钡溶液,使D、E元素完全转变为白色沉淀,过滤干燥后称量为9.32g.⑶滤液中A、M以阳离子形式存在,用胶头滴管滴滤液2—3滴在白色点滴板(或玻璃片)上,再滴加1—2滴硫氰化钾溶液,溶液呈血红色.⑷往滤液中通入足量的硫化氢气体,使A离子全部被还原后,产生黄色沉淀物,过滤干燥后,称量为0.96g.⑸化合物中A元素的百分含量为34.64%.
试通过计算推理判断:
⑴ 确定D和E:
D是 ,E是 (写元素符号).
⑵ 确定x、y、z和A:
x== y== z== A是 .
⑶ M代表的元素是 ;化合物的化学式为 lijoulin1年前1
lijoulin1年前1 -
 乔乔笑 共回答了19个问题
乔乔笑 共回答了19个问题 |采纳率89.5%D和E怎么着也是S和O啊,从钡离子试验中也看得出
硫酸根0.04mol
第二个反应说明有铁离子,且为0.06mol
接下来要讨论 若在化学式中 y是6 z是4 则x是2 且9.7g该物质中含M0.02mol
由化合价代数和为零,得M为正一价离子
又根据质量推算得其相对分子质量为23 所以是钠
若在化学式中 y是3 z是2 则x是7 同样根据化合价得M是一价的
这样算出来M的相对分子质量是负的,显然不可能
综上所述 答案如下
D是S E是O
x=2 y=4 z=6 A是Fe
M代表Na 化学式为Na2Fe6(SO4)4(OH)121年前查看全部
- 正盐和复盐有什么区别
 素衣紫痕1年前1
素衣紫痕1年前1 -
 chilun 共回答了19个问题
chilun 共回答了19个问题 |采纳率84.2%我们首先来看,复盐:由两种或两种以上阳离子和一种酸根组成的盐.
而正盐的概念是:只有金属阳离子和酸根组成的盐.
综上所述,复盐应该是属于正盐范畴.
即正盐中金属离子的数目可以是一个或者一个以上.1年前查看全部
- 在无色溶液中下列离子能大量共存,加入了一种复盐:(NH 4 ) 2 Fe(SO 4 ) 2 ·6H 2 O晶体后,仍能大
在无色溶液中下列离子能大量共存,加入了一种复盐:(NH 4 ) 2 Fe(SO 4 ) 2 ·6H 2 O晶体后,仍能大量共存的是( )
A.Na + 、H + 、Cl - 、 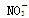
B.K + 、Ba 2 + 、OH - 、I - C.Cu 2 + 、Na + 、Br - 、Cl - D.Na + 、K + 、Cl - 、 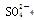
 souhumao30001年前1
souhumao30001年前1 -
 折断翅膀的小鸟 共回答了22个问题
折断翅膀的小鸟 共回答了22个问题 |采纳率86.4%D
1年前查看全部
- 什么叫复盐?复盐与形成它的简单盐相比有什么特点?
 zhongguolaji1年前1
zhongguolaji1年前1 -
 siba 共回答了18个问题
siba 共回答了18个问题 |采纳率83.3%盐:是指在水中发生电离时,能电离出金属阳离子(或铵根离子)和酸根阴离子的化合物.如Na2SO4
复盐:是指在水中发生电离时,能电离两种(或两种以上)金属阳离子和酸根阴离子的化合物.如K2Al(SO4)2.12H2O
复盐跟简单盐的区别就是有两种或两种以上的金属阳离子.1年前查看全部
- 复盐的概念什么是复盐?它的具体概念是怎样的,最行帮忙具体的举个例子.绝对正确的告诉我,前面也有人提同样问题,但是有两个不
复盐的概念
什么是复盐?它的具体概念是怎样的,最行帮忙具体的举个例子.绝对正确的告诉我,前面也有人提同样问题,但是有两个不同答案,我也分8清楚 xingzhoushi1年前1
xingzhoushi1年前1 -
 崔罗什二世 共回答了25个问题
崔罗什二世 共回答了25个问题 |采纳率84%由两种不同的金属离子和一种酸根离子组成的盐.例如硫酸铝钾[KAl(SO4)2],十二水合硫酸铝钾〔KAl(SO4)2·12H2O]俗称明矾.明矾是无色晶体,溶于水完全电离产生三种离子,Al3+水解形成Al(OH)3胶体,水溶液呈酸性.
Al(OH)3有很强的吸附能力,它吸附水中悬浮的杂质形成沉淀.因此,明矾可作净水剂,还可作收敛剂和媒染剂.
氯化镁钾[KMgCl3]也是复盐.自然界的KCl·MgCl2·6H2O,俗称光卤石,易溶于水.从光卤石可提取KCl和MgCl2.复盐和复盐的水合物都属于纯净物.1年前查看全部
- 什么是复盐?复盐与形成它的简单盐相比有什么特点?
 上下一统1年前2
上下一统1年前2 -
 setfeqwfsdfsd 共回答了22个问题
setfeqwfsdfsd 共回答了22个问题 |采纳率90.9%复盐:由两种或两种以上阳离子和一种阴离子组成的盐.它的性质除了有酸根离子决定之外,还有多种金属阳离子决定1年前查看全部
- 配合物和复盐的主要区别是什么?
 P飄逝的絕唱1年前1
P飄逝的絕唱1年前1 -
 awey00001 共回答了22个问题
awey00001 共回答了22个问题 |采纳率95.5%配合物:配位化合物的简称,也叫络合物,是由一定数量的配位体(有孤电子或电子对的负离子或分子)通过配位键(由成键一方单独提供电子而形成的共价键)结合于中心离子(或中心原子)的周围而形成的一个复杂离子(或分子),并与原来各组分的性质不同.配合物在晶体和溶液中能稳定的存在,有些稳定的配合离子在溶液中很少离解.配合物都具有一定的空间构型,有特定的理、化性质.实验室中用于元素的分离、提纯,在工业中用于催化、电镀等.
复盐:由两种或两种以上的简单盐类组成的同晶型化合物,叫做复盐.复盐又叫重盐.复盐中含有大小相近、适合相同晶格的一些离子.例如,明矾(硫酸铝钾)是KAl(SO4)2·12H2O,莫尔盐(硫酸亚铁铵)是(NH4)2Fe(SO4)2·6H2O,铁钾矾(硫酸铁钾)是KFe(SO4)2·12H2O.复盐溶于水时,电离出的离子,跟组成它的简单盐电离出的离子相同.使两种简单盐的混合饱和溶液结晶,可以制得复盐.例如,使CuSO4和(NH4)2SO4的溶液混合结晶,能制得硫酸铜铵[(NH4)2SO4·CUSO4·6H2O].1年前查看全部
- 复盐的定义
 半文钱1年前1
半文钱1年前1 -
 yweiuy 共回答了18个问题
yweiuy 共回答了18个问题 |采纳率77.8%由两种或两种以上的简单盐类组成的同晶型化合物,叫做复盐.复盐又叫重盐.复盐中含有大小相近、适合相同晶格的一些离子
您的问题已经被解答~(>^ω^1年前查看全部
- 含硫酸根的复盐有哪些含有10电子的粒子
 流星能滑多久1年前1
流星能滑多久1年前1 -
 kkkkdddd132 共回答了16个问题
kkkkdddd132 共回答了16个问题 |采纳率75%硫酸亚铁铵里的铵根离子1年前查看全部
- 为什么盐分三种 那复盐为什么不属于 从定义上看 酸式盐与复盐好像是酸式盐属于复盐呀 、
 jtghghf1年前1
jtghghf1年前1 -
 爱上小白 共回答了14个问题
爱上小白 共回答了14个问题 |采纳率92.9%复盐是指有固定组成可形成特定构型晶体的几种盐类的混合物,如硫酸钾铝.酸式盐或碱式盐符合了这个要求的话也可以算.1年前查看全部
- 正盐.酸式盐.碱式盐.复盐.络盐水溶液的酸碱性判断
 unreined1年前1
unreined1年前1 -
 辽沙 共回答了18个问题
辽沙 共回答了18个问题 |采纳率100%NACL NAHSO4 CU2(OH)2CO3 KAL(SO4)21年前查看全部
- 常见的复盐,酸式盐,络合物和不溶性物质有哪些?
 ufo8003291年前1
ufo8003291年前1 -
 7093373 共回答了13个问题
7093373 共回答了13个问题 |采纳率92.3%由两种或两种以上的简单盐类组成的同晶型化合物,叫做复盐.例如,明矾(硫酸铝钾)是KAl (SO4)2·12H2O,莫尔盐(硫酸亚铁铵)是(NH4)2Fe(SO4)2·6H2O,铁钾矾(硫酸铁钾)是KFe(SO4)2·12H2O.
酸式盐如CaCO3,Ca(HCO3)2,Ca(H2PO4)2,CaHPO4,Ca3(PO4)2,NaHCO3、NaHS、Na2HPO4
络合物通常指含有络离子的化合物,例如络盐[Ag(NH3)2]Cl、络酸H2[PtCl6]、络碱[Cu(NH3)4](OH)2等;也指不带电荷的络合分子,例如[Fe(SCN)3]、[Co(NH3)3Cl3]等.
不溶性物质例如GaCO3,SiO2等难溶于水的物质1年前查看全部
- 关于土壤地理学问题请问什么是重碳酸盐,什么是复盐过程,什么是发小而不发老苗
 rrrr123cd1年前1
rrrr123cd1年前1 -
 zjqq 共回答了20个问题
zjqq 共回答了20个问题 |采纳率90%在百度搜搜看吧
含有两个碳酸根的盐类
标定方法:
用标准盐酸溶液滴定水样时,若以酚酞作指示剂,滴定到等当点时,pH为8.4,此时消耗的酸量仅相当于碳酸盐含量的一半,当再向溶液中加入甲基橙指示剂,继续滴定到等当点时,溶液的ph值为4.4,这时所滴定的是由碳酸盐所转变的重碳酸盐和水样中原有的重碳酸盐的总和,根据酚酞和甲基橙指示的两次终点时所消耗的盐酸标准溶液的体积,即可分别计算碳酸盐和重碳酸盐的含量.
有相同的 阴离子的盐,阳离子可以多种,一般有固定组成,只要将两种盐溶解于水,蒸干水,就会有复盐生成
有相同的 阴离子的盐,阳离子可以多种,一般有固定组成,只要将两种盐溶解于水,蒸干水,就会有复盐生成
另一个我也不知道.1年前查看全部
- 有两种以上的阴离子和一种阳离子组成的物质吗?总称是什么?(和复盐相对应)
 unten1年前1
unten1年前1 -
 夏雨枫 共回答了20个问题
夏雨枫 共回答了20个问题 |采纳率95%好像没有两种以上的阴离子和一种阳离子组成的物质耶,要有的话也应该是很不稳定的.1年前查看全部
- 英语翻译请帮忙翻译:两种或两种以上简单盐类组成的晶态化合物称为复盐,但当它们溶于水时,其溶液的性质与组成它的简单盐的混合
英语翻译
请帮忙翻译:两种或两种以上简单盐类组成的晶态化合物称为复盐,但当它们溶于水时,其溶液的性质与组成它的简单盐的混合溶液没有区别.
thank you~ 613175241年前1
613175241年前1 -
 鸟四 共回答了19个问题
鸟四 共回答了19个问题 |采纳率94.7%Simple salts of two or more crystalline compounds consist of the known double salt, but when they are soluble in water, its nature and composition of the solution of a simple mixture of salt has no differences1年前查看全部
- 酸式盐.碱式盐.复盐.络盐水溶液的酸碱性判断
 大山里头1年前1
大山里头1年前1 -
 sdzwan88 共回答了19个问题
sdzwan88 共回答了19个问题 |采纳率94.7%强酸弱碱盐——酸性
强碱弱酸盐——碱性
强酸标志:Cl- NO3- SO421年前查看全部
- 锌单质与强碱反应的化学方程式?如果生成复盐,请写出名称
 lsopener1年前3
lsopener1年前3 -
 nnnvvv888 共回答了20个问题
nnnvvv888 共回答了20个问题 |采纳率75%Zn+2NaOH+2H2O====Na2[Zn(OH)4]+H2↑
其中Na2[Zn(OH)4]四羟基锌酸钠,是络合物.锌和铝反应是不同的1年前查看全部
- 碱式碳酸铜是复盐吗?
 roche_gin1年前3
roche_gin1年前3 -
 QQ386398474 共回答了16个问题
QQ386398474 共回答了16个问题 |采纳率93.8%由两种或两种以上的简单盐类组成的同晶型化合物,叫做复盐.
碱式碳酸铜Cu2(OH)2CO3不是复盐,是碱式盐.1年前查看全部
- 多介绍室温下不容的碱金属盐不管是复盐,还是混盐,多介绍一些,
 无志rr1年前3
无志rr1年前3 -
 板板487 共回答了17个问题
板板487 共回答了17个问题 |采纳率94.1%(下面是微溶或不溶的碱金属盐)锂的难溶盐有:
LiF 氟化锂
Li2CO3 碳酸锂
Li3PO4·5H2O 磷酸锂
LiKFeIO6 高碘酸铁钾锂
钠的难溶盐有:
Na[Sb(OH)6] 六羟基锑酸钠
NaZn(UO2)3(CH3COO)9·6H2O 醋酸铀酰锌钠
钾、铷、铯的难溶盐有:
M3[Co(NO2)6] 钴亚硝酸盐
MB(C6H5)4 四苯硼化物
MClO4 高氯酸盐
M2PtCl6 氯铂酸盐
其中铷和铯的盐比相应的钾盐还要难溶.
铵盐
NH4MgPO4 0.052
NH4)2PtCl6 0.499
NH4VO3 0.480
(单位:g,均20℃)
以上均微溶.1年前查看全部
- 硅酸铜钡是什么?它是复盐还是混合物?[CaMg(CO3)2]呢?
 lian二少1年前1
lian二少1年前1 -
 神奇狂 共回答了12个问题
神奇狂 共回答了12个问题 |采纳率100%硅酸铜钡是一种罕见的紫色颜料,它曾经在秦兵马俑彩绘中被分析出来,秦俑也是它最早的使用实物.硅酸铜钡易溶于水,是当今利用最新科学技术才能合成的一种物质(也有天然存在),属于混合物.硅酸铜钡的化学式是[BaCuSi2O6...1年前查看全部
- 两种以上的阴离子和一种阳离子有两种以上的阴离子和一种阳离子组成的物质吗?总称是什么?(和复盐相对应) 比如铜锈Cu(OH
两种以上的阴离子和一种阳离子
有两种以上的阴离子和一种阳离子组成的物质吗?总称是什么?(和复盐相对应)
比如铜锈Cu(OH)2CO3 湘湘辉辉1年前1
湘湘辉辉1年前1 -
 chao841025 共回答了12个问题
chao841025 共回答了12个问题 |采纳率100%叫混盐,混盐是指一种金属离子与多种酸根离子所构成的盐.(但是要注意阴离子要是酸根离子)1年前查看全部
- 金属离子与高锰酸根的组合物是复盐还是混盐
 零在这里1年前1
零在这里1年前1 -
 我为大家 共回答了15个问题
我为大家 共回答了15个问题 |采纳率93.3%复盐
复盐是指多种金属离子和一种酸根形成的盐;
混盐是指多种酸根和一种金属离子形成的盐.1年前查看全部
- 什么是复盐可以说成是多种金属阳离子和一种酸根离子组成的化合物吗
 vipvic2111年前2
vipvic2111年前2 -
 jessicajiajia 共回答了24个问题
jessicajiajia 共回答了24个问题 |采纳率83.3%比如说明矾,十二水硫酸铝价就是一种复盐,多种金属阳离子就是铝离子和钾离子,一种酸根离子就是硫酸根.
这么说你明白么?1年前查看全部
- 化学中是不是有两种阳离子或以上就可以称为复盐啊?
 mimi9876541年前2
mimi9876541年前2 -
 阿泓 共回答了20个问题
阿泓 共回答了20个问题 |采纳率80%两种阳离子但不能有氢离子,一种氢离子一种阳离子的那不叫复盐,如碳酸氢钠就不是复盐,叫酸式盐.复盐是两种正盐复合得到的.所以需具有两种阳离子且两种都不是氢离子.1年前查看全部
- 你回答的复盐晶体AxB(ED4)y.zH2O,已知x+y+z=10那题,为什么只有B(OH)2,而没有A(OH)沉淀啊?
 Gracecool1年前1
Gracecool1年前1 -
 你再胡说 共回答了12个问题
你再胡说 共回答了12个问题 |采纳率100%AOH不沉淀呀1年前查看全部
- 金属离子结合反应请问在一硫酸溶液里,有多种金属离子,例如铁,铝,镍,锌等等,加入另一硫酸盐类使其生成复盐,那先生成哪种金
金属离子结合反应
请问在一硫酸溶液里,有多种金属离子,例如铁,铝,镍,锌等等,加入另一硫酸盐类使其生成复盐,那先生成哪种金属复盐,是根据什么来算的,.. fzp660351年前1
fzp660351年前1 -
 sxhzlzy 共回答了14个问题
sxhzlzy 共回答了14个问题 |采纳率100%根据的是金属离子的活泼性和能够氧化还原性来判断.金属铝和锌都可以还原铁,说明铁离子的还原性大于铝和锌,这样算的.不好意思,不能完全解出,丢了化学几年了.1年前查看全部
- 什么样的反应生成复盐 如KAl(SO4)2
什么样的反应生成复盐 如KAl(SO4)2
我要生成硫酸铝钾的方程.反应物简单一点.
能介绍
复盐生成的反应
的基本特点并举例更好.
请勿乱答.黄帮学勿答 demon04051年前1
demon04051年前1 -
 naughtykid 共回答了21个问题
naughtykid 共回答了21个问题 |采纳率95.2%楼上回答得已经比较全面
需要注意的是,溶液中不存在固定比例的复盐对应的离子
要生成复盐,需要先生成其对应的溶液离子,然后通过结晶形成
所以不存在所谓在溶液中“生成KAl(SO4)2”的反应方程
是溶液中的K+、Al3+、SO4 2-及H2O结晶形成KAl(SO4)2·12H2O晶体1年前查看全部
- 在复盐NH 4 Al(SO 4 ) 2 溶液中逐滴加入Ba(OH) 2 溶液,可能发生的反应的离子方程式是 A.NH 4
在复盐NH 4 Al(SO 4 ) 2 溶液中逐滴加入Ba(OH) 2 溶液,可能发生的反应的离子方程式是
A.NH 4 + +SO 4 2 - +Ba 2+ +OH - → BaSO 4 ↓+ NH 3 ·H 2 O B.Al 3+ + 2SO 4 2 - + 2Ba 2+ + 4OH - → 2BaSO 4 ↓+ AlO 2 - + 2H 2 O C.2 Al 3+ + 3SO 4 2 - + 3Ba 2+ +6OH - → 3BaSO 4 ↓+ 2 Al (OH) 3 ↓ D.NH 4 + + Al 3+ +2SO 4 2 - + 2Ba 2+ + 4OH - → 2BaSO 4 ↓+ Al (OH) 3 ↓+NH 3 ·H 2 O  喝杯清茶1年前1
喝杯清茶1年前1 -
 见鸿 共回答了18个问题
见鸿 共回答了18个问题 |采纳率88.9%CD
Al (OH) 3 为典型的两性氢氧化物,不溶于很弱的酸(如H 2 CO 3 等),也不溶于弱碱(如NH 3 ·H 2 O)。在复盐NH 4 Al(SO 4 ) 2 溶液中逐滴加入Ba(OH) 2 溶液,先生成Al (OH) 3 沉淀,可能的离子方程式为C,如若滴加的Ba(OH) 2 溶液过量,则继续生成NH 3 ·H 2 O,D正确。1年前查看全部
- A、B、C、D、E是中学所学的无机试剂。B、C、D、E都是可溶性正盐(不包括复盐);且组成它们的阴、阳离子均不相同。现进
A、B、C、D、E是中学所学的无机试剂。B、C、D、E都是可溶性正盐(不包括复盐);且组成它们的阴、阳离子均不相同。现进行如下实验:
①常温下,0.05 mol/LA溶液的pH=13;C溶液显中性,D、E的溶液显酸性;
②A与B的浓溶液混合时有刺激性气味的气体产生,同时有白色沉淀生成;
③A与D的溶液混合时有白色沉淀生成,当A过量时沉淀部分溶解;
④E溶液与B、C、D的浓溶液反应均有白色沉淀生成。
根据上述实验信息,请回答下列问题。
(1)写出A和D的化学式:A________,D________,A中阴离子的电子式是________。
(2)E溶液的实验室保存方法是________________________。
(3)实验测得B的溶液显碱性,则B电离产生的阳离子与阴离子的物质的量浓度的比值____2(填“大于”“小于”或 “等于”)。
(4)1 mol D与A反应生成沉淀的最大质量为_______________。
(5)为进一步确定C的组成,还需要进行的实验操作是________(填名称)。 froghui1年前0
froghui1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 复盐与形成它的简单盐相比有什么特点
 cntommy1年前1
cntommy1年前1 -
 zhangping02 共回答了15个问题
zhangping02 共回答了15个问题 |采纳率93.3%从性质上看一般溶解性有差异,通常是因为相对于溶剂溶解性下降而析出.
从结构上看,不同的分子和离子以复盐的规则堆积,而不是原来简单盐的堆积方式.1年前查看全部
- 在某化工厂生产中,要用到一种无色、可溶于水的晶体铝铵矾.该晶体是一种复盐,其主要化学成分为十二水合硫酸铝铵.向该复盐的浓
在某化工厂生产中,要用到一种无色、可溶于水的晶体铝铵矾.该晶体是一种复盐,其主要化学成分为十二水合硫酸铝铵.向该复盐的浓溶液中逐滴加入浓氢氧化钠溶液.将发生一系列变化.已知,NH4+与AlO2-在水溶液中不能大量共存,会发生如下反应:NH4++A102-+H2O=Al(0H)3↓+NH3↑试回答:
(1)硫酸铝铵在水溶液中的电离方程式为______;
(2)在逐滴加入浓氢氧化钠溶液的过程中,产生的现象有:①溶液中出现白色沉淀;②有刺激性气体逸出;③白色沉淀量逐渐增多;④白色沉淀完全消失;⑤白色沉淀逐渐减少.请回答各种现象由先到后出现的顺序是(用序号回答):______;
(3)写出滴入氢氧化钠溶液的过程中,有关反应的离子方程式:
①______;
②______;
③______. aqzl9111年前1
aqzl9111年前1 -
 地球人爱地球 共回答了20个问题
地球人爱地球 共回答了20个问题 |采纳率85%解题思路:(1)硫酸铝铵在水溶液中完全电离出铝离子、铵根离子、硫酸根离子;
(2)铵根和铝离子在溶液中共存时,铝离子先和氢氧根离子生成沉淀,然后是铵根离子和碱的反应,接下来是氢氧化铝和氢氧根离子的反应,根据铵根离子、铝离子、偏铝酸根和氢氧根之间的反应的离子方程式确定离子的量的多少;
(3)根据物质的性质以及离子方程式的书写进行解答.(1)硫酸铝铵为类似于明矾的复盐,在水溶液中完全电离出NH4+、A13+、SO42-,电离方程式为:NH4Al(SO4)2=NH4++Al3++2SO42-,
故答案为:NH4Al(SO4)2=NH4++Al3++2SO42-;
(2)加入NaOH溶液,OH-能与NH4+和A13+作用,但由于 A13++3NH3•H2O=A1(OH)3↓+3NH4+,
即碱性NaOH>NH3•H2O>Al(OH)3,则先发生反应的是Al3+与OH-,最后 Al(OH)3逐渐溶解生成A1O2-故反应的顺序是:①③②⑤④,
故答案为:①③②⑤④;
(3)先发生反应的是Al3+与OH-,然后是NH4+、OH-之间的反应,最后 Al(OH)3逐渐溶解生成A1O2-,
即①Al3++3OH-=Al(OH)3↓②NH4++OH-=NH3↑+H2O③Al(OH)3+OH-=A1O2-+2H2O,
故答案为:①Al3++3OH-=Al(OH)3↓;②NH4++OH-=NH3↑+H2O;③Al(OH)3+OH-=A1O2-+2H2O.点评:
本题考点: 离子方程式的书写;镁、铝的重要化合物.
考点点评: 本题考查了铝的重要化合物性质、电离方程式、离子方程式的书写,题目难度中等,注意掌握常见元素单质及其化合物性质,明确离子方程式、电离方程式的书写原则.1年前查看全部
- 上述五种元素可形成一种常见复盐三种离子个数比2:1:2
 iq5nddhd1年前1
iq5nddhd1年前1 -
 静静的听海 共回答了8个问题
静静的听海 共回答了8个问题 |采纳率100%硫酸亚铁铵 (NH4)2Fe(SO4)2
题目不完整,只能猜测.硫酸亚铁铵,浅蓝绿色结晶或粉末1年前查看全部
- 在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是( )
在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是( )
A. Fe2++SO42-+Ba2++2OH-═BaSO4↓+Fe(OH)2↓
B. NH4++Fe3++SO42-+Ba2++4OH-═BaSO4↓+Fe(OH)3↓+NH3•H2O
C. 2Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Fe(OH)3↓
D. 3NH4++Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+Fe(OH)3↓+3NH3•H2O 猴子吴1年前3
猴子吴1年前3 -
 蓝色战车 共回答了22个问题
蓝色战车 共回答了22个问题 |采纳率95.5%解题思路:在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,NH4+与OH-离子反应生成NH3•H2O,Fe3+与OH-离子反应生成Fe(OH)3,Ba2+与SO42-离子反应生成BaSO4,根据参加反应的物质的量判断可能发生的反应以及反应物的物质的量的关系.本题考查的离子方程式与加入反应物的量有关.本题加入的Ba(OH)2溶液由少到多,所以要分两种情况一种是Ba(OH)2不足,另一种情况是Ba(OH)2过量.A、复盐NH4Fe(SO4)2中Fe的化合价是+3价,故A错误;
B、在复盐NH4Fe(SO4)2溶液中,n(NH4+):n(Fe3+):n(SO42-)=1:1:2,1mol复盐完全反应时需要2molBa(OH)2,反应的离子方程式为NH4++Fe3++2SO42-+2Ba2++4OH-=2BaSO4↓+Fe(OH)3↓+NH3•H2O,故B错误;
C、当Ba(OH)2不足时,生成Fe(OH)3和BaSO4,该依据原子守恒配平书写的离子方程式为2Fe3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Fe(OH)3↓,故C正确;
D、当加入3molBa(OH)2时,反应的n(Fe3+):n(SO42-)=1:2,离子方程式不符合反应实际,故D错误.
故选:C.点评:
本题考点: 离子方程式的书写.
考点点评: 本题考查离子方程式的正误判断,题目难度较大,注意参加反应的物质的量判断可能发生的反应以及反应物的物质的量的关系.1年前查看全部
大家在问
- 1家长写孩子在家怎样读书情况怎么写
- 2英语翻译 在那个时候你在干什麼?
- 3太阳与行星间的引力根据F引=mv²/r可知,太阳对行星的引力F引与太阳到行星的距离r成反比这句话错哪了?
- 4山中访友课后题从哪些描写中可以看出“我”和山里的“朋友”有着深厚的感情?你是否有过类似的体验?
- 5第Ⅱ卷(共35分)第一节:短文改错(共10题,每题1分,共10分)此题要求改正以下短文中的错误:此行多一词:把多余的词用
- 6会计电算化的定义
- 7急求一篇英语作文,给未来妻子的一封信,120-140词左右。
- 8照样子,写句子。例:人类的能力太强了,能呼风唤雨!1.电脑太神奇了,__________________________
- 9下列各式计算正确的是( ) A. x 6 x 3 = x 2 B. -2 2x-2 = 1 1-x C. m 2 -9
- 10如果a,b,c为实数,且满足a+b+|√(c-1)-1|=4√(a-2)+2√(b+1)-4.试求a+2b+3c的值.
- 11描写景、物的诗句1、描写秋天的诗句 2、描写山水景色的诗句 3、和动物有关的诗句 4、带有“桃”的诗句 5、和名山大山有
- 12一捆电线用去了全长的5分之2,剩下的比用去的多28米 这捆电线长多少米 告诉我吧 求求你们 7点之前告诉我吧
- 13《五柳先生传》选自___________,作者_______________,__________(朝代)著名的田园诗人
- 14(2014•无锡二模)现有一种固体粉末样品,已知该样品由氧化铜和铁组成.取样品少许,加入一定量的稀硫酸,待反应停止后过滤
- 15关于勇气和成功的名言
