有若干克某金属,其各原子核内共有1.6*10^23个中子,同质量的该金属和稀硫酸反应生成6.02*10^22个阳离子,这
 夏至彼岸2022-10-04 11:39:543条回答
夏至彼岸2022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 朝纲2008 共回答了14个问题
朝纲2008 共回答了14个问题 |采纳率92.9%- 应该是:原子核内共有1.6*6.02*10^23个中子.
阳离子物质的量=6.02*10^22/6.02*10^23=0.1mol,中子物质的量=1.6mol,质子物质的量=1.3mol,所以该金属原子质子数为13,中子数为16,摩尔质量=29g/mol. - 1年前
 农夫山园 共回答了1个问题
农夫山园 共回答了1个问题 |采纳率- 核外电子书等于核电荷数
- 1年前
 痛随快乐着 共回答了13个问题
痛随快乐着 共回答了13个问题 |采纳率- 阳离子物质的量=6.02*10^22/6.02*10^23=0.1mol,中子数为1.4*6.02^23个,即物质的量=1.4mol,质子物质的量=1.3mol,所以该金属原子质子数为13,中子数为14,摩尔质量=27g/mol。
- 1年前
相关推荐
- X.Y是三种物质各10克组成的混合物,加热使其充分反应,反应后的物质中有16克Z .8克W和若干克X 则X Y的质量比?
 c33451年前1
c33451年前1 -
 fantiban 共回答了16个问题
fantiban 共回答了16个问题 |采纳率100%X+Y=Z + W
16 8
X剩余,则Y=10于是可以知道X=16+8-10=14
X:Y=7:51年前查看全部
- 甲容器中有浓度为4%的盐水150克,乙容器中有某种浓度的盐水若干克,如果从乙中取出450克盐水放入甲中混合成浓度为8.2
甲容器中有浓度为4%的盐水150克,乙容器中有某种浓度的盐水若干克,如果从乙中取出450克盐水放入甲中混合成浓度为8.2%的盐水,求乙中原来盐水的浓度是______.
 无泪鬼鬼1年前2
无泪鬼鬼1年前2 -
 贝劳 共回答了23个问题
贝劳 共回答了23个问题 |采纳率87%解题思路:根据甲容器中有浓度为4%的盐水150克,可求出原来甲容器中盐的重量150×4%=6克,再根据如果从乙中取出450克盐水放入甲中混合成浓度为8.2%的盐水,可求出混合后的甲容器中盐的重量(150+450)×8.2%=49.2克,再用混合后的甲容器中盐的重量减去原来甲容器中盐的重量就可求出乙容器中450克盐水中盐的重量,再用乙容器中盐的重量除以盐水的重量乘以100%,即可求出.混合后的甲容器中盐的质量:(150+450)×8.2%=49.2(克),
原来甲容器中盐的质量:150×4%=6((克),
那么乙容器中盐的质量:49.2-6=43.2(克),
则乙容器的盐水的浓度:43.2÷450×100%=9.6%,
答:乙中原来盐水的浓度是9.6%.点评:
本题考点: 浓度问题.
考点点评: 此题先跟据甲容器中原来及混合后的盐的重量,即可求出乙中盐的重量,再根据乙容器中盐的重量除以盐水的重量乘以100%,即可求出.1年前查看全部
- 已知有盐水若干克,第一次加入一定量的水后,盐水浓度为3%,第二次又加入同样多的水后,盐水的浓度变为2%,求:
已知有盐水若干克,第一次加入一定量的水后,盐水浓度为3%,第二次又加入同样多的水后,盐水的浓度变为2%,求:
(1)第一次加水之前盐水的浓度是多少?
(2)第三次加入同样多的水后,盐水的浓度是多少?
注:请不要用比例解答.
额···请不要用太高级的解法···接受不了啊··· 落叶yymm1年前4
落叶yymm1年前4 -
 a-feifei 共回答了22个问题
a-feifei 共回答了22个问题 |采纳率90.9%我这样给你解答,不知你能不能看懂.
假设第一次加水之后盐是3克,盐水是100克,那么浓度就是3%.又加了一次水,浓度变成了2%,由于盐是3克,列示计算盐水是3除以2%等于150,那么第二次加水后盐水就是150克,加入的水就是50克,那么第一次加了多少水呢,也是50克,那么原来的水就是100-50=50克,原来的浓度就是3除以50等于6%.第三次加水后,盐水变成了150+50=200克,盐是3克,3除以200等于1.5%.再给你列一个清单,把下面的表填了吧.
盐水 盐 浓度 加水量
原来的盐水 3
第一次加水100克 3 3%
第二次加水 3 2%
第三次加水 31年前查看全部
- 急需一道化学题目有若干克Fe Fe2O3混合物在73gHCL中恰好完全溶解,所得溶液中不含FeCl3,现将等质量该混合物
急需一道化学题目
有若干克Fe Fe2O3混合物在73gHCL中恰好完全溶解,所得溶液中不含FeCl3,现将等质量该混合物在高温下与CO,可得固体质量_______克.
若有一定质量Fe Fe2O3 CuO混合物,也能在73gHCL中完全溶解,所得的溶液中不含FeCl3,则等质量该混合物在高温下与CO完全反映后,所得固体质量取值范围是______.(要求解题过程)
已知Fe+2FeCl3===3FeCl2 Cu+2FeCl3===2FeCl2+CuCl2
(本人才初中.所以麻烦各位用简单点的方法.3Q.) 无影xiey1年前1
无影xiey1年前1 -
 潴儿小乖 共回答了19个问题
潴儿小乖 共回答了19个问题 |采纳率89.5%不含FE三价,而FE单质有不存在 说明都是FE2价离子
根据阴阳离子守恒 CI离子数为 2MOL 所以 FE2价离子有1MOL
还原后就有1MOL FE 就是 56克
是溶液 说明 生成的都是FE2价和CU2价
用极端法.1中情况就是 生成物中都是CU2价 2就是生成物都是FE2价
CI离子有2MOL 所以 还原后生成1MOL CU 或 1MOL FE
64 和56 2个都是开区间
只要是有关范围的,都用极端法,无论是高中 还是初中.
溶液中存在FeCl2 CuCl2
还原后的固体是FE和CU
73克HCL中有 CL 71克
假如都是FeCl2 那么铁有56*71/71=56
.CuCl2 ,那么CU有 64克
但事实上,溶液中FE和CU都存在,所以 得到的固体质量应 小于64大于561年前查看全部
- 某固态混合物中含有m克KNO3和若干克不溶于水的杂质,将此混合物加入n克水时观察,充分溶解后的结果如下:
某固态混合物中含有m克KNO3和若干克不溶于水的杂质,将此混合物加入n克水时观察,充分溶解后的结果如下:
通过计算回答:温度(℃) 10 40 75 未溶固体(克) 261 175 82
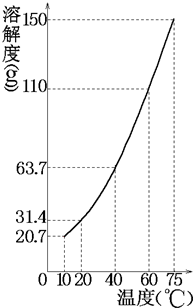
(1)m、n的值各为多少?
(2)75℃时所得溶液是否饱和?
(3)若要在n克水中恰好溶解m克硝酸钾即饱和,则温度应控制在多少度? 吸血鬼莱斯特1年前1
吸血鬼莱斯特1年前1 -
 lz2003cc 共回答了10个问题
lz2003cc 共回答了10个问题 |采纳率70%解题思路:(1)对比温度从10℃升至40℃再升温至75℃时,硝酸钾溶解度的改变及实验中未溶固体质量的改变,由二者的在10℃和40℃的溶解度关系可得出m、n的值;
(2)判断实验中75℃时还有82g未溶解固体的成分,可判断此时所得KNO3溶液是否饱和;
(3)若要在n g水中恰好溶解m g 硝酸钾即饱和,由m、n的值计算出饱和时硝酸钾的溶解度,然后要曲线上查出对应温度(1)根据硝酸钾溶解度曲线,温度从10℃升高至40℃时,硝酸钾的溶解度从20.7g增大到63.7g,溶解度增加了63.7g-20.7g=43g,而实验中溶解硝酸的质量增加了
261g-175g=86g,因此可得知实验中所用水n为200g;
200g水在10℃最多溶解硝酸钾20.7g×2=41.4g,则原固体混合物质量为41.4g+261g=302.4g;
温度从40℃升高75℃时,硝酸钾的溶解度增加了150g-63.7g=86.3g,则200g水从40℃升温至75℃时可以多溶解硝酸钾的质量为86.3g×2=172.6g,而实验中固体质量只减少了175g-82g=93g,说明所剩余82g固体不含硝酸钾,全部为不溶于水的杂质,则所取硝酸钾的质量=302.4g-82g=220.4g;
(2)根据以上分析,由溶解度曲线可知200g水从40℃升温至75℃时,需要溶解硝酸钾的质量为86.3g×2=172.6g溶液才能继续饱和,但由表中数据可知只有93g硝酸钾继续溶解,因此此时的硝酸钾溶液为不饱和溶液;
(3)n g水中恰好溶解m g 硝酸钾,此时硝酸钾的溶解度=[220.4g/200g]×100g=110.2g,根据溶解度曲线可查得,此时温度约为60℃;
故答案为:(1)m=220.4g,n=200g;(2)75℃时所得KNO3溶液不饱和;(3)若要在n g水中恰好溶解m g 硝酸钾即饱和,则温度应控制在60℃.点评:
本题考点: 固体溶解度曲线及其作用;饱和溶液和不饱和溶液.
考点点评: 此题是对溶解度计算的考查题,解题的关键是对图象及表格中数据的分析与应用,题目难度较大,应属竞赛题的类别.1年前查看全部
- 将15.5g氯化钙和碳酸钙的混合物加入26.8g水中,然后向其中加入若干克10%的稀盐酸,恰好完全反应,生成了4.4g二
将15.5g氯化钙和碳酸钙的混合物加入26.8g水中,然后向其中加入若干克10%的稀盐酸,恰好完全反应,生成了4.4g二氧化碳气体.求:
(1)原混合物中碳酸钙的质量.
(2)加入稀盐酸的质量.
(3)反应后所得溶液中溶质的质量分数. manunitedfc1年前1
manunitedfc1年前1 -
 laoou 共回答了16个问题
laoou 共回答了16个问题 |采纳率93.8%分析题意得
(1)CaCO3+2HCl=CaCl2+H2O+CO2
100 73 111 44
x y z 4.4g
CaCO3的质量x=10g(用十字交叉法)
(2)HCl的质量y=73*4.4/44g=7.3g(十字交叉法)
稀盐酸的质量m=7.3/10%=73g
(3)原来的混合物中CaCl2质量为15.5g-10g=5.5g
反应生成的CaCl2的质量z=11.1g(十字交叉法)
最后溶液中CaCl2的质量m=5.5g+11.1g=16.6g
溶液的总质量M=15.5+26.8+73-4.4=110.9g
溶质的质量分数=m/M=(16.6/110.9)*100%=14.97%
希望可以早日帮你解决你的疑惑~1年前查看全部
- 甲容器有浓度为2%的盐水180克,乙容器中有浓度为9%盐水若干克,从乙中取出240克盐水倒入甲,再往乙倒入水,两个容器中
甲容器有浓度为2%的盐水180克,乙容器中有浓度为9%盐水若干克,从乙中取出240克盐水倒入甲,再往乙倒入水,两个容器中恰好有一样多同样浓度的盐水.此时两容器的盐水浓度为______%.
 我是河南人20061年前1
我是河南人20061年前1 -
 小雪米 共回答了13个问题
小雪米 共回答了13个问题 |采纳率100%解题思路:由“甲容器有浓度为2%的盐水180克,乙容器中有浓度为9%盐水若干克,从乙中取出240克盐水倒入甲”可求出此时甲容器含盐量为180×2%+240×9%=25.2(克),盐水的质量为180+240=420(克),此时甲容器的浓度为25.2÷420=6%,.因为此时两容器浓度相同,因此此时两容器的盐水浓度为6%.(180×2%+240×9%)÷(180+240),
=(3.6+21.6)÷420,
=25.2÷420,
=6%.
答:此时两容器的盐水浓度为6%.
故答案为:6.点评:
本题考点: 浓度问题.
考点点评: 求出交换后甲容器的盐和盐水的质量,是解题的关键.1年前查看全部
- 用15g氢氧化钠固体、50g10%的氢氧化钠溶液、50g20%的氢氧化钠溶液、若干克蒸馏水四种物质来配置100g15%的
用15g氢氧化钠固体、50g10%的氢氧化钠溶液、50g20%的氢氧化钠溶液、若干克蒸馏水四种物质来配置100g15%的氢氧化钠溶液,请你设计相关的配置方案
(有三种就行了) tz小李探花1年前1
tz小李探花1年前1 -
 ofw_30 共回答了27个问题
ofw_30 共回答了27个问题 |采纳率96.3%1.在85g蒸馏水里加热溶解15g氢氧化钠固体即可得到100g15%的氢氧化钠溶液;
2.在50g10%的氢氧化钠溶液里加10g氢氧化钠固体,再加40g蒸馏水,加热溶解即可得到;
3.在50g20%的氢氧化钠溶液里加5g氢氧化钠固体,再加45g蒸馏水,加热溶解即可得到;
4.把两种氢氧化钠溶液混合摇匀即可.1年前查看全部
- 初一科学选择题,较难把充分干燥的若干克土壤放在细密的铁丝网上加热燃烧,结果发现燃烧过的土壤变轻了,这主要是由于土壤中什么
初一科学选择题,较难
把充分干燥的若干克土壤放在细密的铁丝网上加热燃烧,结果发现燃烧过的土壤变轻了,这主要是由于土壤中什么物质含量减少所造成的:
A水分
B矿物质
C有机物
D空气
A不可能,因为是充分干燥的,D也不可能,答案是什么,为什么是呢?难道矿物质或有机物能燃烧,燃烧后变什么了
 Tracywa1年前2
Tracywa1年前2 -
 aadd168 共回答了12个问题
aadd168 共回答了12个问题 |采纳率83.3%C有机物 有机物燃烧后成二氧化碳和水变成气体跑掉了1年前查看全部
- 含盐百分之二十的盐水若干克,加清水30千克后,含盐量变成百分之五,原有盐水多少千克
 dolphin_ming1年前6
dolphin_ming1年前6 -
 yjy886 共回答了21个问题
yjy886 共回答了21个问题 |采纳率90.5%设原有盐水xkg
0.2x=0.05(x+30)
x=101年前查看全部
- 有若干克某金属,其各原子核内共有3.5乘6.02乘十的二十三次方个中子,同质量的该金属和稀硫酸反应共有0.2mol电子发
有若干克某金属,其各原子核内共有3.5乘6.02乘十的二十三次方个中子,同质量的该金属和稀硫酸反应共有0.2mol电子发生转移,生成6.02乘十的二十二次方个阳离子,这些阳离子共有3乘6.02乘十的二十三次方个质子,则该金属摩尔质量为____,
原子核内有____个质子,____个中子,
其核组成符号为____. 男人的样子1年前1
男人的样子1年前1 -
 我爱QQ秀 共回答了10个问题
我爱QQ秀 共回答了10个问题 |采纳率90%6.02乘十的二十三次方个即为1mol,所以该块金属含3.5mol中子,失去0.2mol电子,生成0.1mol阳离子,有3mol质子.
综上,该块金属为0.1mol,原子核内有30个质子,35个中子,摩尔质量为65g/mol,其核组成符号为Zn,左上角为65,左下角为30.1年前查看全部
- 若干克锌投入200克稀硫酸中恰好完全反应,溶液质量为210克,则原稀硫酸溶液的质量分数约为
 it68871年前1
it68871年前1 -
 yefengzhou 共回答了15个问题
yefengzhou 共回答了15个问题 |采纳率93.3%根据质量守恒 反应后Zn完全与酸反应等于溶解在溶液中,总质量为210,再加上溢出溶液的氢气质量.因为溢出的氢气质量相对很小 ,忽略,那反应前Zn的质量为10克
Zn+H2SO4=ZnSO4+H2气体
65 98
10 x
65/10=98/x=2/y
x=15.077克
稀硫酸质量分数约为15/200=7.5%
实际要大一点点.1年前查看全部
- 称取一定质量锌粉与质量分数为20%的稀硫酸若干克混合,恰好完全反应,生成氢气0.1g
称取一定质量锌粉与质量分数为20%的稀硫酸若干克混合,恰好完全反应,生成氢气0.1g
1,称取锌粉的质量为 g
2,反应后溶液的总质量是多少 kokoii1年前1
kokoii1年前1 -
 wwb2788 共回答了19个问题
wwb2788 共回答了19个问题 |采纳率89.5%Zn+H2SO4=ZnSO4+H2
65 98 2
x y 0.1g
65/x=98/y=2/0.1g
x=3.25g y=4.9g
1,称取锌粉的质量为 3.25g
2,反应后溶液的总质量是
3.25g+4.9g/20%-0.1g=27.65g1年前查看全部
- (2011•怀柔区一模)将一定质量的碳酸钠粉末溶于400克水中配制成溶液,取一半该溶液,向其中加入20%的盐酸若干克,恰
(2011•怀柔区一模)将一定质量的碳酸钠粉末溶于400克水中配制成溶液,取一半该溶液,向其中加入20%的盐酸若干克,恰好反应完全,放出气体的质量为22克.试计算:
(1)碳酸钠溶液的总质量;
(2)反应后所得溶液中溶质的质量分数. 叨叨1年前1
叨叨1年前1 -
 威罗_gg 共回答了22个问题
威罗_gg 共回答了22个问题 |采纳率100%解题思路:根据溶液的均一性,取一半该溶液,即由生成的22g二氧化碳所计算得到的碳酸钠仅为原粉末质量的一半;
恰好完全反应,所以,反应后所得溶液为氯化钠溶液,计算出反应生成氯化钠的质量与溶液质量比.设生成22g二氧化碳消耗碳酸钠的质量为x,消耗盐酸的质量为y,生成氯化钠的质量为z
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 11744
x y z 22g
[106/x=
73
y=
117
z=
44
22g]
解之得 x=53g
y=36.5g
z=58.5g
碳酸钠溶液的总质量=53g×2+400g=506g
反应消耗稀盐酸的质量=[36.5g/20%]=182.5g
反应后所得溶液中溶质的质量分数=[58.5g/200g+53g+182.5g−22g]×100%≈14.1%
答:(1)Na2CO3溶液的总质量为506克;
(2)反应后所得溶液中溶质的质量分数为14.1%点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 因为取一半的溶液,即有200g水,53gNa2CO3,182.5g稀盐酸溶液,生成22g二氧化碳逸出,故根据质量守恒定律,反应物物溶液的质量=200g+53g+182.5g-22g=413.5g.1年前查看全部
- 甲容器中有浓度2%的盐水180克,乙容器中有浓度为9%的盐水若干克,从乙中取出24克盐水倒入甲,这时,
甲容器中有浓度2%的盐水180克,乙容器中有浓度为9%的盐水若干克,从乙中取出24克盐水倒入甲,这时,
甲乙两个容器内的食盐量相等,乙容器原有盐水多少克?
速求 wh6766353441年前2
wh6766353441年前2 -
 ThronesX 共回答了26个问题
ThronesX 共回答了26个问题 |采纳率96.2%180*2%+24*9%=X*9%-24*9%,解出X即可1年前查看全部
- 一道溶液浓度题,有浓度为4%的盐水若干克,蒸发了一些水分后浓度变成l0%,再加入300克4%的盐水后,变为浓度6.4%的
一道溶液浓度题,
有浓度为4%的盐水若干克,蒸发了一些水分后浓度变成l0%,再加入300克4%的盐水后,变为浓度6.4%的盐水,则最初的盐水是多少克,越详细越好. azhongying1年前1
azhongying1年前1 -
 amyb1 共回答了15个问题
amyb1 共回答了15个问题 |采纳率93.3%设最初的盐水x克,蒸发了y克水
4%x=10%(x-y)
4%(x+300)=6.4%(x-y+300)
解得x=500,y=3001年前查看全部
- 有FeO、Fe2O3的混合物若干克,在CO气流中加热充分反应,冷却后称剩余固体比原混合物质量减轻0.8g,若将同质量的混
有FeO、Fe2O3的混合物若干克,在CO气流中加热充分反应,冷却后称剩余固体比原混合物质量减轻0.8g,若将同质量的混合物与盐酸反应,欲使其完全溶解需1mol/L 的盐酸的体积为( )
A. 200mL
B. 100mL
C. 50mL
D. 无法计算 挖你家墙脚1年前2
挖你家墙脚1年前2 -
 ivnana47 共回答了19个问题
ivnana47 共回答了19个问题 |采纳率94.7%解题思路:在CO气流中加热充分反应,冷却后称剩余固体比原混合物质量减轻0.8g,减少的质量为O元素的质量,将FeO、Fe2O3的混合物与盐酸反应生成FeCl2、FeCl3的混合物,相当于其中的O被Cl代替,根据化合价守恒计算盐酸的体积,1个O被2个Cl代替.FeO、Fe2O3的混合物若干克,在CO气流中加热充分反应,生成Fe,冷却后称剩余固体比原混合物质量减轻0.8g,则减少的质量为O元素的质量,将FeO、Fe2O3的混合物与盐酸反应生成FeCl2、FeCl3的混合物,相当于其中的O被Cl代...
点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物反应的计算,题目难度中等,本题计算时可从化合物组成的角度分析,从化合价守恒的角度解答,可以省去过程的繁琐.1年前查看全部
- 若干克含盐4%的盐水蒸去一些水分后变成了含盐为10%的盐水,再加进300克含盐4%的盐水,混合后变成了含盐6.4%的盐水
若干克含盐4%的盐水蒸去一些水分后变成了含盐为10%的盐水,再加进300克含盐4%的盐水,混合后变成了含盐6.4%的盐水,则最初有4%的盐水______克.
 静寅1年前2
静寅1年前2 -
 lanye66 共回答了21个问题
lanye66 共回答了21个问题 |采纳率85.7%解题思路:设最初有4%的盐水x克,蒸发掉y克水,则原先含起盐量为4%x,蒸发不后盐量不变可列出一方程;再根据加进300克含盐4%的盐水,混合后变成了含盐6.4%的盐水可列出第二个方程,求方程组的解即可.设最初有4%的盐水x克,蒸发掉y克水,
根据题意得:
4%x=(x−y)10%
(x−y)10%+300×4%
x−y+300=6.4%,
解得:x=500(克).
故答案为:500.点评:
本题考点: 二元一次方程组的应用.
考点点评: 本题考查了二元一次方程组的应用,解题关键是弄清题意,设出相关未知数并找到合适的等量关系,列出方程组.1年前查看全部
- 有浓度为10%的盐水溶液若干克,加入800克水后浓度变为6%.原来盐水有多少?
 tchctchc1年前1
tchctchc1年前1 -
 大雨倾盆 共回答了15个问题
大雨倾盆 共回答了15个问题 |采纳率93.3%设原来盐水有x千克,则原来盐水里面含有盐为x*10%=0.1x,所以现有浓度的盐水配置为0.1x/(x+0.8)=0.06,解得x=1.2,原来盐水有1.2千克1年前查看全部
- 浓度问题急求请帮帮忙吧1.有浓度为25%的盐水若干克,现将20克盐加入到该溶液中,溶解后盐水的浓度增加到25%,求原有2
浓度问题急求请帮帮忙吧
1.有浓度为25%的盐水若干克,现将20克盐加入到该溶液中,溶解后盐水的浓度增加到25%,求原有20%的盐水多少克?
2,从装满100克浓度为60%的糖水中倒出20克糖水,再倒入清水将杯装满,搅拌均匀后再倒出20克糖水,然后倒入清水将杯装满.反复三次后,杯中的浓度是多少?
真的急 梦想富有1年前1
梦想富有1年前1 -
 WOLFSE4 共回答了8个问题
WOLFSE4 共回答了8个问题 |采纳率75%1、配比学过吗?把20%的盐水看为低浓度,把25%的盐水看为高浓度,20克的盐就是100%的盐水,求出它们的差比为(25%-20%):(100%-25%)=1:15,那么差比和量比成反比,量比为15:1,20克的盐对应的是1份,那么原有20%的盐水20*15=300克.1年前查看全部
- 有若干克某金属,其各原子核内共有1.4*6.02*10的23次方个中子,同质量的该金属和稀硫酸反应生成6.02*10的2
有若干克某金属,其各原子核内共有1.4*6.02*10的23次方个中子,同质量的该金属和稀硫酸反应生成6.02*10的22次方个阳离子,这些阳离子共有1.3*6.02*10的23次方个质子,则该金属的摩尔质量为 ,单个原子核内有 个质子,个中子,其核素组成符号为
 iloveyoubest1年前1
iloveyoubest1年前1 -
 永不言弃ds 共回答了19个问题
永不言弃ds 共回答了19个问题 |采纳率94.7%质子数:1.3*6.02*10的23次方/6.02*10的22次方=13 中子数:1.4*6.02*10的23次方/6.02*10的22次方=14
则该金属为Al 摩尔质量为27 有13个质子 14个中子 核素符号为Al1年前查看全部
- 已知盐水若干克,第一次加入一定量的水后,盐水浓度变成3%,第二次加入相同的水,盐水浓度变成2%.求第三次加入同样多的水后
已知盐水若干克,第一次加入一定量的水后,盐水浓度变成3%,第二次加入相同的水,盐水浓度变成2%.求第三次加入同样多的水后盐水的浓度.(最好用十字交叉法,不准用方程,
 天与地011年前1
天与地011年前1 -
 chrisbobo 共回答了15个问题
chrisbobo 共回答了15个问题 |采纳率86.7%设原来盐有1
第一次后的体积是 1÷3%=100/3
第二次后的体积是 1÷2%=50
每次加水 50-100/3=50/3
后来的浓度 1÷(50+50/3)=1.5%1年前查看全部
- 有浓度为25%的盐水若干克,加入一勺盐变为浓度为40%的盐水,如果再加入这样的盐5勺浓度为多少
有浓度为25%的盐水若干克,加入一勺盐变为浓度为40%的盐水,如果再加入这样的盐5勺浓度为多少
快 凌么儿1年前2
凌么儿1年前2 -
 jmtommi 共回答了15个问题
jmtommi 共回答了15个问题 |采纳率93.3%设有25%的盐水1000克,一勺盐有x克
则m(溶质)=250克
则(x+250)/(x+1000)=40%
所以x=250克
浓度=(6×250+250)/(1000+6×250)=0.71年前查看全部
- 由A、B、C三种物质各5克组成的混合物,加热使其充分反应.反应后的混合物中有8克C、4克新物质D和若干克A...
由A、B、C三种物质各5克组成的混合物,加热使其充分反应.反应后的混合物中有8克C、4克新物质D和若干克A...
由A、B、C三种物质各5克组成的混合物,加热使其充分反应.反应后的混合物中有8克C、4克新物质D和若干克A.参加反应的A和B的质量比是多少 求详解 70583381年前1
70583381年前1 -
 stella0711 共回答了27个问题
stella0711 共回答了27个问题 |采纳率88.9%B全部参与反应
反应前混合物质量=5+5+5=15g
反应后C和D质量之和=8+4=12g
根据质量守恒,剩余A的质量=15-12=3g
所以参加反应的A和B的质量比是3:51年前查看全部
- 有浓度为4%的盐水若干克,蒸发了一些水以后,变成了浓度为10%的盐水,在加进300克浓度为4%的盐水,混合后,变成为6.
有浓度为4%的盐水若干克,蒸发了一些水以后,变成了浓度为10%的盐水,在加进300克浓度为4%的盐水,混合后,变成为6.4%的盐水.问最初的盐水有多少克?
 i257271年前2
i257271年前2 -
 想要gg1 共回答了18个问题
想要gg1 共回答了18个问题 |采纳率94.4%设最初有x克,(0.04x+300*0.04)/(0.04x/0.1+300)=0.0641年前查看全部
- 由XYZ三种物质各10g组成的混合物,加热使其充分反应,反应后的物质中有16gZ,8g新物质W和若干克X,则参加反应的X
由XYZ三种物质各10g组成的混合物,加热使其充分反应,反应后的物质中有16gZ,8g新物质W和若干克X,则参加反应的X和Y的质量比为?
请说明理由 epWER1年前1
epWER1年前1 -
 洒落柔情片片非 共回答了25个问题
洒落柔情片片非 共回答了25个问题 |采纳率92%由于是加热,因此没有其他物质参加反应,所以剩下的x为6克,即反应了4克,由于剩余物中没有y,故y全部反应,所以比例为x:y=4:10=2:5
建议多问老师问题,他们的回答会更好
我得答案不知是否正确1年前查看全部
- 质量比的某固体混合物内含ABC三种物质各10克,加热充分反应后,剩余固体中含C物质16克,D物质8克,还有A物质若干克.
质量比的
某固体混合物内含ABC三种物质各10克,加热充分反应后,剩余固体中含C物质16克,D物质8克,还有A物质若干克.则参加反应的A和B的质量比为
A2:1 B1;2 C2:5 D3:5 aiaiwoa1年前1
aiaiwoa1年前1 -
 笑的快乐 共回答了20个问题
笑的快乐 共回答了20个问题 |采纳率95%还剩余A物质30-16-8=6克(总质量是不会变的)
所以A反应了10-6=4克
B完全反应了,所以反应了10克
反应的质量比是4:10=2:5
选C1年前查看全部
- 应用题:一.130g盐水与含盐9%的盐水若干克混合,配成含盐6.4%的盐水.这样配成的6.4%的盐水有多少克?
应用题:一.130g盐水与含盐9%的盐水若干克混合,配成含盐6.4%的盐水.这样配成的6.4%的盐水有多少克?
二.小明去买苹果和橘子,苹果的售价是1元一斤,橘子的售价是1.2元一斤.批发的话苹果打九折,橘子打八折.小明批发了苹果10斤,橘子若干斤,付的钱省了15%,问他买了多少斤橘子?
三.甲乙两种商品,成本共2200元,甲商品按20%的利润定价,乙商品按15%的利润定价.后来都按定价的90%打折出售,结果仍获利131元.求甲种商品的成本是多少元?
四.某同学读一本科幻小说,第一天读了全书的一本多30页,第二天读了余下的一半多16页,还剩下64页没有读.求这本科幻小说一共有多少页?
五.假定一对***子每一个月可以生产已对小兔子(两只),而小兔子出生一个月后长成***子.问从一对小兔子开始,一年后能繁殖成多少对兔子? 小小蛇1年前1
小小蛇1年前1 -
 BATISTUTA和狗 共回答了18个问题
BATISTUTA和狗 共回答了18个问题 |采纳率94.4%四:设共X页
第一天读了0.5X+30
第二天读了0.5(X-X/2-30)+16
则X=0.5X+30+0.5(X-X/2-30)+16+64
解得X=3801年前查看全部
- 已知5g A与2g B恰好完全反应生成3g C和若干克D.若制取8g D,则需______g A.
已知5g A与2g B恰好完全反应生成3g C和若干克D.若制取8g D,则需______g A.
 Erenda1年前2
Erenda1年前2 -
 wsm1985sh 共回答了22个问题
wsm1985sh 共回答了22个问题 |采纳率90.9%解题思路:由反应A+B═C+D中,由5g A与2g B恰好完全反应生成3g C,根据质量守恒定律,可计算生成D物质的质量,判断反应中A、D物质质量关系,由反应有8g D生成可计算物质A的质量.根据质量守恒定律,反应A+B═C+D中,5g A与2g B恰好完全反应生成3g C时,生成D物质质量=5g+2g-3g=4g,则反应中物质A、D的质量比=5g:4g=5:4;
则当反应有8g D生成时,参加反应的A质量=8g×[5/4]=10g.
故答案为:10.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 对于此类无具体反应化学方程式类根据化学方程式的计算,首先由反应中各物质的质量确定反应中物质的质量比,是解决问题的基本思路.1年前查看全部
- 有盐水若干克,第一次加入一定量的水后,盐水浓度为3%,第二次加入同样多的水后,盐水浓度为2%.
有盐水若干克,第一次加入一定量的水后,盐水浓度为3%,第二次加入同样多的水后,盐水浓度为2%.
问第三次加入同样多的水后,盐水浓度是多少? duanecho87661年前1
duanecho87661年前1 -
 han0 共回答了24个问题
han0 共回答了24个问题 |采纳率91.7%设原盐水浓度X%;每次加水Y
则有X/(100+Y)=3/100:
X/(100+2Y)=2/100;解之得:X=6; Y=100;
所以第三次加水后:6/(100+300)=1.5/100=1.5%.1年前查看全部
- 有若干克浓度为4%的盐水,蒸发了一些水分后变成了10%的盐水,再加入300克40%的盐水混合后变为6.4%的盐水
有若干克浓度为4%的盐水,蒸发了一些水分后变成了10%的盐水,再加入300克40%的盐水混合后变为6.4%的盐水
问最初的盐水多少克 lgag1年前3
lgag1年前3 -
 wscyoo 共回答了24个问题
wscyoo 共回答了24个问题 |采纳率87.5%有若干克浓度为4%的盐水,蒸发了一些水分后变成了10%的盐水,再加入300克4%的盐水混合后变为6.4%的盐水
设蒸发后的盐水有x千克
10%x+30*4%=6.4%(x+30)
10x+120=6.4x+192
3.6x=72
x=20
再设最初的盐水有y千克
4%y=20*10%
y=50
所以初的盐水是50千克1年前查看全部
- 公务员数学运算题 十字相乘有浓度为的盐水若干克,蒸发了一些水分后浓度变成,再加入300克的盐水后.浓度变为6.4%的盐水
公务员数学运算题 十字相乘
有浓度为的盐水若干克,蒸发了一些水分后浓度变成,再加入300克的盐水后.浓度变为6.4%的盐水,问最初的盐水多少克?( )
A.200B.300C.400D.500
用的十字相乘法,十字相乘法真的不会了已经. lilyairain1年前1
lilyairain1年前1 -
 it06 共回答了26个问题
it06 共回答了26个问题 |采纳率92.3%题目不完整吧!1年前查看全部
- 某金属若干克其原子核外共有2mol电子
某金属若干克其原子核外共有2mol电子
某金属若干克,其原子核外共有2MOL电子,核内共有1.204X10^24个中子,同质量的该金属跟足量稀盐酸反应,有0.2MOL电子发生转移,生成6.02X10^22个阳离子,试回答:
1.该金属元素的原子符号为____,摩尔质量_____.
2.原子核的组成中,中子有___个,质子___个. 娃哈哈qai1年前1
娃哈哈qai1年前1 -
 WYJ789 共回答了21个问题
WYJ789 共回答了21个问题 |采纳率95.2%中子 1.204X10^24/(6.02X10^23)=2mol
也就是说核外电子和核内中子数目相同
0.2mol电子转移,生成0.1mol阳离子,说明是二价的,并且可以和稀盐酸反应
那就是Mg啦,摩尔质量为24g/mol
中子12个,质子12个1年前查看全部
- 在两份质量相等,溶质质量分数相同的盐酸中,分别加入56 g铁和若干克碳酸钙,都恰好完全反应,所得溶液质量相等,
在两份质量相等,溶质质量分数相同的盐酸中,分别加入56 g铁和若干克碳酸钙,都恰好完全反应,所得溶液质量相等,则所加碳酸钙的质量为( )
A. 56g
B. 54g
C. 96.4g
D. 100g fjzyz6605301年前1
fjzyz6605301年前1 -
 zahc9999 共回答了16个问题
zahc9999 共回答了16个问题 |采纳率81.3%解题思路:要想使反应后溶液质量相等,则两烧杯中的溶液反应前后物质质量的增加值应该相等,利用此分析结合差量法解决此题.要使天平两端质量再次相等,则两烧杯中的溶液反应前后物质的质量增加值应该相等,利用差量法解决此题.
设放入铁后溶液质量增加的质量是x,放入的碳酸钙质量是y
Fe+2HCl=FeCl2 +H2↑ 溶液质量增大
56 2 56-2=54
56g X
[56/56g][54/x] X=54g
CaCO3+2HCl=CaCl2+H2O+CO2↑ 溶液质量增大
100 44 100-44=56
Y 54g
[100/y]=[56/54g] Y=96.4g
故选C点评:
本题考点: 酸的化学性质;称量器-托盘天平.
考点点评: 此题是一道综合计算题,解题的关键是分析出两溶液质量相等就是反应前后溶液的质量增加值,属于一道综合性较强的题目.1年前查看全部
- 有浓度为百分之25的糖水若干克,再加入16克糖后,糖水的浓度为百分之35,问现在的糖水有多少克?
 gr54gawewe1年前2
gr54gawewe1年前2 -
 keaidexiaosi6 共回答了28个问题
keaidexiaosi6 共回答了28个问题 |采纳率85.7%设原来糖水有x克
则
35%=x·25%+16/x+16
解得
x=104
则现在糖水有120克1年前查看全部
- 有浓度为4%的盐水若干克,蒸发了一些水后,变成浓度为10%的盐水,若加进300克浓度4%的盐水混合后变成浓度为6.4%的
有浓度为4%的盐水若干克,蒸发了一些水后,变成浓度为10%的盐水,若加进300克浓度4%的盐水混合后变成浓度为6.4%的盐水,问最初的盐水有多少克?
求过程以及关系式. 没钱买空调1年前3
没钱买空调1年前3 -
 夏季冰女孩 共回答了22个问题
夏季冰女孩 共回答了22个问题 |采纳率95.5%设原有x g,蒸发掉y g.
4%x=10%(x-y)
4%(x+300)=6.4%(x-y+300)
解得x=5001年前查看全部
- 有浓度为30%的盐水若干克,加入一些水后浓度变为10%,再加入同样多的水后,浓度变为百分之几
 zqhx1年前3
zqhx1年前3 -
 hotnrg6 共回答了18个问题
hotnrg6 共回答了18个问题 |采纳率83.3%设原溶液为a加水的质量为b
a*30%=(a+b)*10%
b=2a
再加入同样多的水后,浓度变为 (a*30%)/(a+2b)*100%=0.3a/5a*100%=6%1年前查看全部
- 现有硫酸铁和硫酸亚铁的混合物若干克,已知在混合物中硫元素的质量分数为16%,求在混合物中铁元素的质量分
现有硫酸铁和硫酸亚铁的混合物若干克,已知在混合物中硫元素的质量分数为16%,求在混合物中铁元素的质量分
要过程 最好把为什么得出结论也写出来
 jonny_swww1年前1
jonny_swww1年前1 -
 004160 共回答了15个问题
004160 共回答了15个问题 |采纳率93.3%Fe2(SO4)3
FeSO4
其中S都是在硫酸根中
S占SO42-的质量分数是
32/(32+16*4)=1/3
则混合物中硫酸根的质量分数是0.16/(1/3)=0.48
即剩下的都是Fe
Fe占1-0.48=52%1年前查看全部
- ,用含酒精36%的酒精若干克,加入一定量雪碧后稀释为30%的溶液,如果欲再稀释到18%,还需要加入的雪碧是上次
,用含酒精36%的酒精若干克,加入一定量雪碧后稀释为30%的溶液,如果欲再稀释到18%,还需要加入的雪碧是上次
所加入的几倍? gghaker1年前2
gghaker1年前2 -
 奶溪 共回答了13个问题
奶溪 共回答了13个问题 |采纳率76.9%36*a=30*(a+b)=18*(a+b+c) 是4倍1年前查看全部
- 甲容器有浓度为2%的盐水180克,乙容器中有浓度为9%盐水若干克,从乙中取出240克盐水倒入甲,再往乙倒入水,两个容器中
甲容器有浓度为2%的盐水180克,乙容器中有浓度为9%盐水若干克,从乙中取出240克盐水倒入甲,再往乙倒入水,两个容器中恰好有一样多同样浓度的盐水.此时两容器的盐水浓度为______%.
 coke_nilk1年前1
coke_nilk1年前1 -
 qa0079 共回答了14个问题
qa0079 共回答了14个问题 |采纳率85.7%解题思路:由“甲容器有浓度为2%的盐水180克,乙容器中有浓度为9%盐水若干克,从乙中取出240克盐水倒入甲”可求出此时甲容器含盐量为180×2%+240×9%=25.2(克),盐水的质量为180+240=420(克),此时甲容器的浓度为25.2÷420=6%,.因为此时两容器浓度相同,因此此时两容器的盐水浓度为6%.(180×2%+240×9%)÷(180+240),
=(3.6+21.6)÷420,
=25.2÷420,
=6%.
答:此时两容器的盐水浓度为6%.
故答案为:6.点评:
本题考点: 浓度问题.
考点点评: 求出交换后甲容器的盐和盐水的质量,是解题的关键.1年前查看全部
- 现有10gNaOH固体,50g,10%的NaOH溶液,还有50g,30%的HaOH溶液和若干克水,配置50g,30%的N
现有10gNaOH固体,50g,10%的NaOH溶液,还有50g,30%的HaOH溶液和若干克水,配置50g,30%的NaOH溶液.5种
 hruj51年前1
hruj51年前1 -
 kudos 共回答了20个问题
kudos 共回答了20个问题 |采纳率100%"还有50g,30%的HaOH溶液和若干克水"是否写错了?“HaOH”貌似没有这种东西,是NaOH吗?
1、直接取30%的NaOH溶液50g
2、取10g10%的NaOH溶液,30g30%NaOH,5gNaOH,5g水
3、取10g10%的NaOH溶液,20g30%NaOH,8gNaOH,12g水
4、取10g10%的NaOH溶液,15g30%NaOH,9.5gNaOH,15.5g水
5、取20g10%的NaOH溶液,10g30%NaOH,10gNaOH,10g水1年前查看全部
- 有若干克糖水糖占糖水的50%加入糖10克水10克糖还占水的50%.
有若干克糖水糖占糖水的50%加入糖10克水10克糖还占水的50%.
判断题,要详细解答! dhyandjlh1年前4
dhyandjlh1年前4 -
 大肥123 共回答了21个问题
大肥123 共回答了21个问题 |采纳率90.5%设原来糖水的质量为2a克,糖和水各a克,
加完糖和水后,糖水的质量变为2a+20克,糖的质量变为a+10克,糖占糖水的(a+10)/(2a+20)=50%,是对的1年前查看全部
- 用方程(组)解决实际问题:有含酒精30%的酒精溶液若干克,加入一定量水后稀释为24%的溶液,再加入同样多的水后,浓度是多
用方程(组)解决实际问题:
有含酒精30%的酒精溶液若干克,加入一定量水后稀释为24%的溶液,再加入同样多的水后,浓度是多少? 落沫7181年前1
落沫7181年前1 -
 蓝绿生烟 共回答了17个问题
蓝绿生烟 共回答了17个问题 |采纳率88.2%有含酒精30%的酒精溶液x克,加入一定量水y后稀释为24%的溶液,
再加入同样多的水=x+y
30%x=24%(x+y),x=4y
浓度是30%x/[(x+y)*2]=12%1年前查看全部
- 将亚硫酸钠与硫化钠的混合物若干克配成50克溶液,
将亚硫酸钠与硫化钠的混合物若干克配成50克溶液,
加入50克一定浓度足量的盐酸,放出气体0.448L(标况)混合液96.9克.求混合物中亚硫酸钠和硫化钠的物质的量各为? 集体去wwww1年前1
集体去wwww1年前1 -
 故事里的人007 共回答了22个问题
故事里的人007 共回答了22个问题 |采纳率81.8%因为Na2SO3+2HCl=2NaCl+SO2↑+H2O ① ,
Na2S+2HCl=2NaCl+H2S↑②,
SO2+2H2S=3S↓+2H2O ,
因此,放出的气体是SO2或H2S.
根据质量守恒定律可知,m(S)+m(气体)=(50g+50g)-96.9g=3.1g,
(1)当放出的气体是SO2时,n1(SO2)=0.448L/(22.4L/mol)=0.02mol,
则m1(SO2)=0.02mol*64g/mol=1.28g,
所以m(S)=3.1g-1.28g=1.82g,
SO2 + 2H2S = 3S↓ + 2H2O
1mol~2mol~3*32g
n2(SO2)~n(H2S)~1.82g
列比例式解得:n2(SO2)=0.019mol,n(H2S)=0.038mol
故n(SO2)=n1(SO2)+n2(SO2)=0.039mol
根据化学方程式①知,n(Na2SO3)=n(SO2)=0.039mol,
根据化学方程式②知,n(Na2S)=n(H2S)=0.038mol.
(2)当放出的气体是H2S时,n1(H2S)=0.448L/(22.4L/mol)=0.02mol,
则m1(H2S)=0.02mol*34g/mol=0.68g,
所以m(S)=3.1g-0.68g=2.42g,
SO2 + 2H2S = 3S↓ + 2H2O
1mol~2mol~3*32g
n(SO2)~n2(H2S)~2.42g
列比例式解得:n(SO2)=0.0252mol,n2(H2S)=0.0504mol
故n(H2S)=n1(H2S)+n2(H2S)=0.0704mol
根据化学方程式①知,n(Na2SO3)=n(SO2)=0.0252mol,
根据化学方程式②知,n(Na2S)=n(H2S)=0.0704mol.
答:混合物中亚硫酸钠与硫化钠的物质的量为0.039mol、0.038mol,或混合物中亚硫酸钠与硫化钠的物质的量为0.0252mol、0.0704mol.1年前查看全部
- 有浓度为10%的盐水溶液若干克,加入800克水后浓度变为6%,原来溶液有多少克?
有浓度为10%的盐水溶液若干克,加入800克水后浓度变为6%,原来溶液有多少克?
不用方程 莫口1年前6
莫口1年前6 -
 我爱吴孟达 共回答了21个问题
我爱吴孟达 共回答了21个问题 |采纳率90.5%盐的重量没变,用盐作为单位1
1-10%=9/10
9/10÷10%=9
得到水占盐的9倍
1-6%=94%
94%÷6%=47/3
得到现在水占盐的47/3
则800÷(47/3-9)=120克 这是原来盐的重量
120÷10%=1200克
答:原来溶液1200克.1年前查看全部
- 今有酒精溶液若干克,若加水10克,则酒精浓度变为25%,若在加酒精40克,浓度又变为35%.原来酒精浓度是多少
今有酒精溶液若干克,若加水10克,则酒精浓度变为25%,若在加酒精40克,浓度又变为35%.原来酒精浓度是多少
算数、方程都可以,方程的话只可以有一个未知数.方程要有两个未知数的话,六年级要看得懂.要有每一步的解释,方程要一步步下来不要只有一个开始一个结束.
要求比较多啊, kqnybas1年前3
kqnybas1年前3 -
 妖蕊 共回答了19个问题
妖蕊 共回答了19个问题 |采纳率84.2%利用一元二次方程组来求解.
设原酒精溶液z克,含酒精x克.
则原来酒精浓度为:x/z *100%
由题意,可列出以下方程:
(1)x/(z+10)=25%
(2)(x+40)/(z+40)=35%
由(1)得:z=4x-10
代入(2)中求解得:x=73.75
则z=4x-10=285
所以,原来酒精浓度为:
x/z *100%=73.75/285 *100%=25.88%1年前查看全部
- 六年级奥数题已知盐水若干克,第1加入一定量的水后,盐水浓度是3%,第2次又加入同样多的水,盐水的浓度变为2%,若第3次还
六年级奥数题
已知盐水若干克,第1加入一定量的水后,盐水浓度是3%,第2次又加入同样多的水,盐水的浓度变为2%,若第3次还加入相同多的谁,盐水的浓度会变为多少?
要过程!!!!!!!!!!! 夜葬南山1年前2
夜葬南山1年前2 -
 ttll 共回答了19个问题
ttll 共回答了19个问题 |采纳率94.7%设原来的盐有X 原来的盐水为m
第一次加入a千克水...这时的浓度为X/(m+a)=3%
第二次加入a千克水...这时的浓度为X/(m+2a)=2%
由这两个方程解得m=a
将m=a带入上面任意一个方程解得x=0.06a
第三次加入a千克后浓度为X/(m+3a)
所以这时的浓度为0.06a/4a=1.5%1年前查看全部
- 问一道化学计算(有过程)将亚硫酸钠和硫化钠的混合物若干克配置成50g溶液,加入50克一定浓度,足量的盐酸,放出气体0.4
问一道化学计算(有过程)
将亚硫酸钠和硫化钠的混合物若干克配置成50g溶液,加入50克一定浓度,足量的盐酸,放出气体0.448L(标况),混合液为96.9克,求混合物中亚硫酸钠和硫化钠的物质的量 大家聚聚1年前1
大家聚聚1年前1 -
 clarkchung 共回答了19个问题
clarkchung 共回答了19个问题 |采纳率89.5%因为Na2SO3+2HCl=2NaCl+SO2↑+H2O ① ,
Na2S+2HCl=2NaCl+H2S↑②,
SO2+2H2S=3S↓+2H2O ,
因此,放出的气体是SO2或H2S.
根据质量守恒定律可知,m(S)+m(气体)=(50g+50g)-96.9g=3.1g,
(1)当放出的气体是SO2时,n1(SO2)=0.448L/(22.4L/mol)=0.02mol,
则m1(SO2)=0.02mol*64g/mol=1.28g,
所以m(S)=3.1g-1.28g=1.82g,
SO2 + 2H2S = 3S↓ + 2H2O
1mol~2mol~3*32g
n2(SO2)~n(H2S)~1.82g
列比例式解得:n2(SO2)=0.019mol,n(H2S)=0.038mol
故n(SO2)=n1(SO2)+n2(SO2)=0.039mol
根据化学方程式①知,n(Na2SO3)=n(SO2)=0.039mol,
根据化学方程式②知,n(Na2S)=n(H2S)=0.038mol.
(2)当放出的气体是H2S时,n1(H2S)=0.448L/(22.4L/mol)=0.02mol,
则m1(H2S)=0.02mol*34g/mol=0.68g,
所以m(S)=3.1g-0.68g=2.42g,
SO2 + 2H2S = 3S↓ + 2H2O
1mol~2mol~3*32g
n(SO2)~n2(H2S)~2.42g
列比例式解得:n(SO2)=0.0252mol,n2(H2S)=0.0504mol
故n(H2S)=n1(H2S)+n2(H2S)=0.0704mol
根据化学方程式①知,n(Na2SO3)=n(SO2)=0.0252mol,
根据化学方程式②知,n(Na2S)=n(H2S)=0.0704mol.
答:混合物中亚硫酸钠与硫化钠的物质的量为0.039mol、0.038mol,或混合物中亚硫酸钠与硫化钠的物质的量为0.0252mol、0.0704mol.1年前查看全部
- 现有100克浓度为22%的盐水中,先加入80克盐,再加入多少克浓度为15%的盐水,就能得到若干克浓度为40%的
现有100克浓度为22%的盐水中,先加入80克盐,再加入多少克浓度为15%的盐水,就能得到若干克浓度为40%的
盐水溶液? 钱家少爷1年前5
钱家少爷1年前5 -
 活着的刀 共回答了17个问题
活着的刀 共回答了17个问题 |采纳率82.4%设再加入X克浓度为15%的盐水,由题可得:
100×22%+80+15%X=(100+x+80)×40%
102+15%X=72+40%X
-25%X=-30
X=120
答:再加入120克浓度为15%的盐水,就能得到若干克浓度为40%的盐水溶液1年前查看全部
大家在问
- 1下列说法正确的是( )A.在氢氧化铁胶体中,加入足量的AgNO3溶液,以除去胶体中的Cl-B.镁铝合金被碱液腐蚀时,负
- 2小明和小芳在一个直径是80m的圆周上的同一地点向相反方向走31.8m,小芳每分钟走31m,两人几分钟后相遇?
- 3甲乙两地相距4500米(注意:是米!),一列火车从甲地开往乙地,每小时行90千米(注意:是千米!),行多久能达到乙地?
- 4客车以20m/s的速度行驶,突然发现同轨道的前方120m处有一列货车正以6m/s的速度同向行驶,于是客车紧急刹车
- 5五位裁判给一位体操运动员评分,去掉一个最高分和一个最低分,平均得分9.70分;如果
- 6王阿姨把1000元人民币存入银行,月利率为0.14%,定期三年,到期应付20%的利息税,王阿姨到期实际可那几元
- 7this is tom red bike .判断正误,并改错
- 8第三部分:阅读理解(共20小题;每小题2分,满分40分)阅读下列短文,从每题所给的四个选项(A、B、C和D)中,选出最佳
- 90.82 0.15的二进制数是多少啊,小数部分乘2取整的时候循环怎么办
- 10(2008•徐汇区二模)某学生配制溶质质量分数为12%的NaCl溶液100g(水的密度为1g/cm3),实验操作示意图如
- 11(2012•珠海)下表对部分化学知识的归纳完全正确的一组是:( )
- 12约分2x-4分之x²-4x+4
- 131.有若干苹果(个数在100以内),3个3个数余1个;4个4个数余1个.5个5个数余1个、这筐苹果有多少个?
- 14方程有二个负根X平方=+mx+1=0有二个不相等的负根?怎么求X让求X。
- 15梯形ABCD中AD//BC,AB=AD+BC,(1)取DC的中点E,(2)连接AE并延长到F,使EF=AE,1.
