KAl(SO4)2 和氨水作用的化学方程式怎么写
 优优2232022-10-04 11:39:542条回答
优优2232022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 你真贪玩 共回答了19个问题
你真贪玩 共回答了19个问题 |采纳率84.2%- 2KAl(SO4)2 + 6NH3•H2O === 2Al(OH)3↓ + 3(NH4)2SO4 + K2SO4
- 1年前
 潮汐的阳台 共回答了2个问题
潮汐的阳台 共回答了2个问题 |采纳率- 2KAl(SO4)2+6NH3.H2O=2AL(OH)3!+3(NH4)2SO4+K2SO4
- 1年前
相关推荐
- 〔KAl(SO4)2·12H2O〕中的中间那个点和12表示什么?
 王玲林1年前3
王玲林1年前3 -
 king天 共回答了18个问题
king天 共回答了18个问题 |采纳率83.3%结合水的个数1年前查看全部
- 把Ba(OH)2溶液滴入KAl(SO4)2溶液中,使SO42-恰好全部转化成BaSO4沉淀,此时铝元素的主要存在形式是(
把Ba(OH)2溶液滴入KAl(SO4)2溶液中,使SO42-恰好全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( )
A.Al3+
B.Al(OH)3
C.[Al(OH)4]-
D.Al3+和Al(OH)3 南之端1年前1
南之端1年前1 -
 xdbvfy 共回答了13个问题
xdbvfy 共回答了13个问题 |采纳率84.6%解题思路:设明矾KAl(SO4)2•12H2O为1mol,则溶液中含有1molK+、1molAl3+、2molSO42-,根据反应:SO42-+Ba2+═BaSO4↓,当溶液中的SO42-完全沉淀时,需要2molBa2+,即2molBa(OH)2,2molBa(OH)2中含有4molOH-,1molAl3+和4molOH-发生反应:Al3++4OH-═AlO2-+2H2O;铝元素的存在形式为:AlO2-.设明矾KAl(SO4)2•12H2O为1mol,则溶液中含有1molK+、1molAl3+、2molSO42-,根据反应:SO42-+Ba2+═BaSO4↓,当溶液中的SO42-完全沉淀时,需要2molBa2+,即2molBa(OH)2,2molBa(OH)2中含有4molOH-,1molAl3+和...
点评:
本题考点: 镁、铝的重要化合物.
考点点评: 本题考查溶液中离子的共存,注意判断使SO42-全部转化成BaSO4沉淀需要Ba(OH)2的物质的量,根据Al3+和OH-物质的量的关系判断反应产物,题目难度中等.1年前查看全部
- “复盐”是指由多种简单阳离子和一种酸根离子组成的盐,如KAl(SO4)2;而由一种金属离子与多种酸根离子构成的盐则称为“
“复盐”是指由多种简单阳离子和一种酸根离子组成的盐,如KAl(SO4)2;而由一种金属离子与多种酸根离子构成的盐则称为“混盐”,如氯化硝酸钙[Ca(NO3)Cl].下列化合物属于混盐的是( )
A.CaOCl2
B.(NH4)2Fe(SO4)2
C.BiONO3
D.K3[Fe(CN)6] 05565336601年前1
05565336601年前1 -
 sleepyeyes 共回答了20个问题
sleepyeyes 共回答了20个问题 |采纳率90%解题思路:盐是由金属阳离子(铵根离子)和酸根阴离子组成的化合物,一种金属离子与多种酸根离子构成的盐则称为“混盐”,结合题中信息和盐的定义进行分析判断.A、CaOCl2的化学式可以写成Ca(ClO)Cl,所以该物质是由一种金属阳离子和两种酸根离子构成的,因此属于混盐,故A正确;
B、(NH4)2Fe(SO4)2含有两种阳离子和一种酸根阴离子,是复盐,不符合混盐的组成,所以不是混盐,故B错误;
C、BiONO3,没有金属离子或铵根离子,不属于盐,故C错误;
D、K3[Fe(CN)6]含有一种阳离子和一种酸根阴离子的盐,故D错误.
故选:A.点评:
本题考点: 酸、碱、盐、氧化物的概念及其相互联系.
考点点评: 本题是信息给予题,注意根据盐的概念和题目中信息分析解答,考查学生提练加工信息的能力,题目难度不大.1年前查看全部
- KAl(SO4)2和三氧化二铝和三氧化二铁哪一个加水生成沉淀?
 bdordb1年前2
bdordb1年前2 -
 feather812 共回答了14个问题
feather812 共回答了14个问题 |采纳率92.9%三氧化二铝和三氧化二铁虽不溶于水,但不与水反应,不能说生成沉淀
明矾在水中可以电离出两种金属离子:
2KAl(SO4)2 = K+ + Al3+ + 2SO4 2-
而Al3+很容易水解,生成胶状的氢氧化铝Al(OH)3:
Al3+ + 3H2O = Al(OH)3(胶体)+ 3H+
所以2KAl(SO4)2溶于水生成沉淀1年前查看全部
- Ⅰ有一包白色粉末,由K2CO3、KOH、CuSO4、BaCl2、KAl(SO4)2、KCl、KNO3中的一种或几种组成,
Ⅰ有一包白色粉末,由K2CO3、KOH、CuSO4、BaCl2、KAl(SO4)2、KCl、KNO3中的一种或几种组成,为确定其组成进行下列相关实验和探究.取样溶解得无色透明水溶液,并进行下列操作:
1、取适量溶液于试管,滴加2-3滴酚酞试液,酚酞变红;
2、另取少量溶液滴加到FeCl3浓溶液中,产生红褐色沉淀,并产生少量无色气体;
3、取适量的原溶液浓缩,加适量的浓硫酸和铜片微热,产生无色气体,气体遇空气为红棕色.回答问题:
(1)白色粉末可能含有(填化学式)______;
(2)白色粉末一定含有(填化学式)______;
这其中能导致溶液呈碱性的是(填化学式)______,用方程式表示溶液呈碱性的原因______.在回答问题(1)可能存在的物质中,还有______也可能导致溶液呈碱性.
Ⅱ为了探究导致白色粉末溶液呈碱性的物质是否惟一,
提出假设:
假设1:导致溶液呈碱性的只有已确定______;
假设2:导致溶液呈碱性的既有已确定______又有______. 进行如下实验:
供选仪器:试管及胶头滴管若干;
供选试剂:样品溶液、2.0mol/LBa(OH)2溶液、1mol/L盐酸、2.0mol/LBaCl2溶液、酚酞试液;填写下表:操作步骤 预期的现象和结论 , 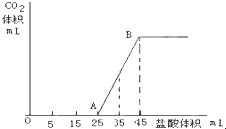
Ⅲ定量分析取样品适量加水溶解得一定体积的溶液,向溶液中滴加1mol/L盐酸,绘制出随盐酸体积的变化,溶液中产生气体体积变化曲线如图,请回答:由该曲线能否确定样品中导致溶液呈碱性物质成分______,若能,该成分化学式是______(若不能,则该空不填) jeff19886111年前1
jeff19886111年前1 -
 春天的雨0322 共回答了22个问题
春天的雨0322 共回答了22个问题 |采纳率86.4%解题思路:I.取样溶解得无色透明水溶液,一定不含CuSO4;取适量溶液于试管,滴加2-3滴酚酞试液,酚酞变红,则溶液显碱性,含K2CO3、KOH中的至少一种,则不含KAl(SO4)2,另取少量溶液滴加到FeCl3浓溶液中,产生红褐色沉淀,并产生少量无色气体,则沉淀为氢氧化铁、气体为二氧化碳,则一定含K2CO3;取适量的原溶液浓缩,加适量的浓硫酸和铜片微热,产生无色气体,气体遇空气为红棕色,无色气体为NO,则原混合物中一定含KNO3;
II.K2CO3水解显碱性,KOH为强碱,碳酸钾与盐酸反应生成气体,碳酸钾与氯化钡反应后溶液为中性;
Ⅲ.由图象可知,没有气体生成消耗盐酸大于生成气体消耗的盐酸,则发生OH-+H+═H2O、CO32-+H+═HCO3-、HCO3-+H+=CO2↑+H2O,以此来解答.I.取样溶解得无色透明水溶液,一定不含CuSO4;取适量溶液于试管,滴加2-3滴酚酞试液,酚酞变红,则溶液显碱性,含K2CO3、KOH中的至少一种,则不含KAl(SO4)2,另取少量溶液滴加到FeCl3浓溶液中,产生红褐色沉淀,并产生少量无色气体,则沉淀为氢氧化铁、气体为二氧化碳,则一定含K2CO3,不含BaCl2;取适量的原溶液浓缩,加适量的浓硫酸和铜片微热,产生无色气体,气体遇空气为红棕色,无色气体为NO,则原混合物中一定含KNO3;
(1)由上述分析可知,可能含有KOH、KCl,故答案为:KOH、KCl;
(2)白色粉末一定含有K2CO3、KNO3,能导致溶液呈碱性的是K2CO3,水解显碱性,水解离子反应为CO32-+H2O⇌HCO3-+OH-,在回答问题(1)可能存在的物质中,还有KOH也可能导致溶液呈碱性,
故答案为:K2CO3、KNO3;K2CO3;CO32-+H2O⇌HCO3-+OH-;KOH;
II.由上述分析可知,溶液显碱性,假设1为导致溶液呈碱性的只有已确定的K2CO3,
假设2为KOH为导致溶液呈碱性的既有已确定的K2CO3,又有KOH,
取溶液少许加盐酸,观察到气体生成,则假设1成立;
取溶液少许加足量氯化钡后,过滤,向滤液中加酚酞,若变红,则假设2成立,反之不成立,
故答案为:K2CO3;K2CO3;KOH;
操作步骤预期的现象和结论
取溶液少许加盐酸;
取溶液少许加足量氯化钡后,过滤,向滤液中加酚酞,观察到气体生成,则假设1成立;
若变红,则假设2成立,反之不成立;
Ⅲ.若只有碳酸钠,由CO32-+H+═HCO3-、HCO3-+H+=CO2↑+H2O可知,生成气体与不生成气体消耗盐酸相同,由图象可知,没有气体生成时消耗盐酸大于生成气体消耗的盐酸,则发生OH-+H+═H2O、CO32-+H+═HCO3-、HCO3-+H+=CO2↑+H2O,则溶质为K2CO3、KOH,故答案为:能;K2CO3、KOH.点评:
本题考点: 无机物的推断;探究物质的组成或测量物质的含量.
考点点评: 本题考查无机物的推断及物质组成的实验测定,为高频考点,把握盐类水解、离子之间的反应推断物质及实验设计为解答的关键,侧重分析与推断能力的综合考查,注意物质成分的实验设计及图象分析,题目难度中等.1年前查看全部
- 明矾的化学式为KAL(SO4)2.12H2O
明矾的化学式为KAL(SO4)2.12H2O
它是一种常见得净化剂,在制作某些传统食品时也用到它,营养学家指出铝元素的安全摄入量为每千克体重0.7mg(1)KAL(SO4)2.12H2O的相对分子质量是----?(2)传统食品加工过程中,一般在1Kg面粉中加入1g明矾,小峰的体重为50Kg,一天食用该种食品150g,试求:1小题:1g明矾中含铝元素的质量为多少mg?2小题:150g该食品中含铝元素的质量为多少mg?3小题:小峰摄入的铝元素的量是否超过安全摄入量?(写出过程) xxyyz001年前1
xxyyz001年前1 -
 舞雾迷 共回答了20个问题
舞雾迷 共回答了20个问题 |采纳率95%(1)KAL(SO4)2.12H2O的相对分子质量是474
(2)1小题:1g明矾中含铝元素的质量为多少mg?
1000 * 27/474 = 57 mg
2小题:150g该食品中含铝元素的质量为多少mg?
150 * 57/1000 = 8.5 mg
3小题:小峰摄入的铝元素的量是否超过安全摄入量?
0.7 * 50 = 35 mg > 8.5 mg 没超过1年前查看全部
- Ba(OH)2与KAl(SO4)2.12H2O反应
 幸福da瞬间1年前1
幸福da瞬间1年前1 -
 siver678 共回答了22个问题
siver678 共回答了22个问题 |采纳率90.9%如果是氢氧化钡过量:KAl(SO4)2+2Ba(OH)2==2BaSO4(沉淀) +KAlO2,
如果是KAl(SO4)2过量:6KAl(SO4)2+3Ba(OH)2==3BaSO4(沉淀)+3K2SO4+2Al2(SO4)3+2Al(OH)3(沉淀)1年前查看全部
- Ba(OH)2溶液滴入KAl(SO4)2溶液中,使SO42-全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( )
Ba(OH)2溶液滴入KAl(SO4)2溶液中,使SO42-全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( )
A. Al3+
B. Al(OH)3
C. AlO2-
D. Al3+和Al(OH)3 埃杜拉尔多1年前2
埃杜拉尔多1年前2 -
 ychoo 共回答了25个问题
ychoo 共回答了25个问题 |采纳率92%解题思路:设明矾KAl(SO4)2•12H2O为1mol,则溶液中含有1molK+、1molAl3+、2molSO42-,根据反应:SO42-+Ba2+═BaSO4↓,当溶液中的SO42-完全沉淀时,需要2molBa2+,即2molBa(OH)2,2molBa(OH)2中含有4molOH-,1molAl3+和4molOH-发生反应:Al3++4OH-═AlO2-+2H2O;铝元素的存在形式为:AlO2-.设明矾KAl(SO4)2•12H2O为1mol,则溶液中含有1molK+、1molAl3+、2molSO42-,根据反应:SO42-+Ba2+═BaSO4↓,当溶液中的SO42-完全沉淀时,需要2molBa2+,即2molBa(OH)2,2molBa(OH)2中含有4molOH-,1molAl3+和4molOH-发生反应:Al3++4OH-═AlO2-+2H2O;
铝元素的存在形式为:AlO2-,也可以写为[Al(OH)4]-形式.
故选C.点评:
本题考点: 镁、铝的重要化合物.
考点点评: 本题考查溶液中离子的共存,注意判断使SO42-全部转化成BaSO4沉淀需要Ba(OH)2的物质的量,根据Al3+和OH-物质的量的关系判断反应产物,题目难度中等.1年前查看全部
- 有什么化学俗语比如KAl(SO4)2.H2O俗称明矾之类的,越全越好哈~>_
 无名英杰1年前5
无名英杰1年前5 -
 mslboy 共回答了23个问题
mslboy 共回答了23个问题 |采纳率87%化学小常识
一、硫酸盐类:
1.皓 矾:ZnSO4?7H2O
2.钡餐,重 晶 石:BaSO4
3.绿矾,皂矾,青矾:FeSO4?7H2O
4.芒硝,朴硝,皮硝:Na2SO4?10H2O
5.明 矾:KAl(SO4)2?12H2O
6.生 石 膏:CaSO4?2H2O
熟 石 膏:2CaSO4?H2O
7.胆 矾、蓝 矾:CuSO4?5H2O
8.莫 尔 盐:(NH4)2SO4?FeSO4?6H2O
二、矿石类:
1.莹 石:CaF2
2.光 卤 石:KCl.MgCl2?6H2O
3.黄 铜 矿:CuFeS2
4.矾 土:Al2O3?H2O、Al2O3?3H2O和少量Fe2O3 、SiO2
5.磁 铁 矿 石:Fe3O4
6.赤 铁 矿 石:Fe2O3
7.褐 铁 矿 石:2Fe2O3?3H2O
8.菱 铁 矿 石:Fe2CO3
9.镁 铁 矿 石:Mg2SiO4
10.苏 口 铁:碳以片状石墨形式存在
11.白 口 铁:碳以FeC3形式存在
12.高 岭 石:Al2(Si2O5)(OH)4 或(Al2O3?2SiO2?2H2O)
13.正 长 石:KAlSi3O8
14.石 英:SiO2
15.硼 砂:Na2B4O7?10H2O
16.脉 石:SiO2
17.刚玉(蓝宝石.红宝石):天然产的无色氧化铝晶体
18.黄 铁 矿(愚人金):FeS2
19.炉 甘 石:ZnCO3
20.智 利 硝 石:NaNO3
21.滑 石:3MgO?4SiO2?H2O
22.大理石(方解石、石灰石):CaCO3
23.孔 雀 石:CuCO3?Cu(OH)2
24.白 云 石:MgCO3?CaCO3
25.冰 晶 石:Na3AlF6
26.高 岭 土:Al2O3?2SiO2?2H2O
27.锡 石:SnO2
28.辉 铜 矿:Cu2S
三、气体类:
1.高 炉 煤 气:CO,CO2等混合气体
2.水 煤 气:CO,H2
3.天 然 气(沼气):CH4
4.液 化 石 油 气:C3H8,C4H10为主
5.焦 炉 气:CH4,CO,H2,C2H4为主
6.裂 解 气:C2H4为主
7.爆 鸣 气:H2和O2
8.笑 气:N2O
9.裂 化 气:C1~C4的烷烃、烯烃
10.电 石 气:C2H2(通常含H2S、PH3等)
四、有机类:
1.福 马 林(蚁醛):HCHO
2.蚁 酸:HCOOH
3.尿 素:(NH4CNO)或 CO(NH2)2
4.氯 仿:CCl4
5.木精(工业酒精):CH3OH
6.甘 油:CH2OH-CHOH- CH2OH
7.硬 脂 酸:C17H35COOH
8.软 脂 酸:C15H31COOH
9.油 酸:C17H33OH
10.肥 皂:C17H35COONa
11.银 氨 溶 液:[Ag(NH3)2]+
12.乳 酸:CH3-CHOH-COOH
13.葡 萄 糖:C6H12O6
14.蔗 糖:C12H22O11
15.核 糖:CH2OH-(CHOH)3CHO
16.脱 氧 核 糖:CH2OH-(CHOH)2CH2-CH3
17.淀 粉:(C6H10O5)n
18.火 棉,胶 棉:主要成份都是[(C6H7O2)-(ONO2)3]n 只是前者含N量高
19.尿 素:CO(NH2)2 、NH4CNO为氰酸铵.(互为同分异构体)
20.氯 仿:CHCl3
21.油 酸:C17H33COOH
22.银 氨 溶 液:[Ag(NH3)2]OH
23.脱 氧 核 糖:CH2OH-(CHOH)2CH2-CHO
五、其他类:
1.白 垩:CaCO3
2.石 灰 乳:Ca(OH)2
3.熟 石 灰:Ca(OH)2
4.足 球 烯:C60
5.铜 绿:Cu2(OH)2CO3
6.纯 碱 (碱 面):Na2CO3
7.王 水:HCl,HNO3 (3:1)
8.水玻璃(泡火碱) :Na2SiO3
9.小 苏 打:NaHCO3
10.苏 打:Na2CO3
11.大 苏打(海波):Na2S2O3
12.盐 卤:MgCl2?6H2O
13.雌 黄:As2S3
14.雄 黄:As4S4
15.朱 砂:HgS
16.石 棉:CaO?3MgO?4SiO2
17.砒 霜:As2O3
18.泻 盐:MgSO4?7H2O
19.波 尔 多 液:CuSO4+Ca(OH)2
20.钛 白 粉:TiO21年前查看全部
- 明矾石经处理后得到明矾[KAl(SO4)2?12H2O].从明矾制备Al、K2SO4、和H2SO4的工艺过程如图所示:焙
明矾石经处理后得到明矾[KAl(SO4)2?12H2O].从明矾制备Al、K2SO4、和H2SO4的工艺过程如图所示:焙烧明
明矾石经处理后得到明矾[KAl(SO4)2?12H2O].从明矾制备Al、K2SO4、和H2SO4的工艺过程如图所示:
焙烧明矾的化学方程式为:4KAl(SO4)2?12H2O+3S═2K2SO4+2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,氧化剂是______,氧化剂与还原剂的物质的量之比为______.
(2)从水浸后的滤液中得到K2S04晶体的方法是______.产物K2SO4中K元素的鉴定操作方法是______.
(3)向明矾溶液中逐滴加入Ba(OH)2溶液至SO2-4恰好沉淀完全的离子反应方程式为______.
(4)焙烧产生的SO2可用于制硫酸.已知25℃、l0lkPa时:
2SO2(g)+O2(g)?2SO3(g)△H1=-197kJ/mol;
H2O(g)?H2O(l)△H2=-44kJ/mol;
2SO2(g)+O2(g)+2H2O(g)═2H2SO4△H3=-545kJ/mol.
则SO3(g)与H2O(1)反应的热化学方程式是______.
(5)假设整个过程中没有物质损失,理论上三种最终产物K2SO4,Al和H2SO4的物质的量之比为______.
 ljn22061年前1
ljn22061年前1 -
 hswic 共回答了21个问题
hswic 共回答了21个问题 |采纳率95.2%(1)4KAl(SO4)2?12H2O+3S═2K2SO4+2Al2O3+9SO2+48H2O反应硫单质中硫元素化合价升高为+4价.硫酸根离子中硫元素化合价从+6价变化为+4价,复印纸还原剂是硫单质,氧化剂与还原剂的物质的量之比为6:3=2:1,故答案为:KAl(SO4)2?12H2O;2:1;
(2)从水浸后的滤液中得到K2SO4晶体的方法是利用硫酸钾溶解度随温度变化不大,可以利用蒸发溶剂方法结晶析出晶体;钾离子焰色反应呈紫色,需要透过蓝色钴玻璃观察,故答案为:蒸发结晶;用盐酸洗过铂丝后,用火烧干后用铂丝蘸取待测溶液,到酒精灯火焰上灼烧,透过蓝色钴玻璃观察颜色,观察到紫色即证明有钾离子;
(3)假设SO42-的物质的量为2mol,则明矾溶液中含有2mol SO42-,1molAl3+,向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-刚好沉淀完全时,需要2molBa(OH)2,即加入的Ba2+为2mol,OH-为4mol,生成2molBaSO4,1molAl3+与4molOH-反应生成1molAlO2-,反应的离子方程式为Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O,
故答案为:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O;
(4)2SO2(g)+O2(g)?2SO3(g)△H1=-197kJ/mol;Ⅰ
H2O(g)?H2O(l)△H2=-44kJ/mol;Ⅱ
2SO2(g)+O2(g)+2H2O(g)═2H2SO4(l)△H3=-545kJ/mol.Ⅲ
依据盖斯定律Ⅲ-Ⅰ-2×Ⅱ得到:2SO3(g)+2H2O(l)=2H2SO4(l)△H=-260KJ/mol;
即反应的热化学方程式为:SO3(g)+H2O(l)=H2SO4(l)△H=-130KJ/mol;
故答案为:SO3(g)+H2O(l)=H2SO4(l)△H=-130KJ/mol;
(5)根据方程式4KAl(SO4)2?12H2O+3S═2K2SO4+2Al2O3+9SO2+48H2O,Al2O3电解得到铝单质,二氧化硫氧化后全部反应得到硫酸.可知最终产物K2SO4,Al和H2SO4的物质的量之比为2:4:9,故答案为:2:4:9.1年前查看全部
- “复盐”是指由多种简单阳离子和一种酸根离子组成的盐,如KAl(SO4)2;而由一种金属离子与多种酸根离子构成的盐则称为“
“复盐”是指由多种简单阳离子和一种酸根离子组成的盐,如KAl(SO4)2;而由一种金属离子与多种酸根离子构成的盐则称为“混盐”,如氯化硝酸钙[Ca(NO3)Cl].下列化合物属于混盐的是( )
A. CaOCl2
B. (NH4)2Fe(SO4)2
C. BiONO3
D. K3[Fe(CN)6] 胡翘楚1年前1
胡翘楚1年前1 -
 zhang5919 共回答了16个问题
zhang5919 共回答了16个问题 |采纳率87.5%解题思路:盐是由金属阳离子(铵根离子)和酸根阴离子组成的化合物,一种金属离子与多种酸根离子构成的盐则称为“混盐”,结合题中信息和盐的定义进行分析判断.A、CaOCl2的化学式可以写成Ca(ClO)Cl,所以该物质是由一种金属阳离子和两种酸根离子构成的,因此属于混盐,故A正确;
B、(NH4)2Fe(SO4)2含有两种阳离子和一种酸根阴离子,是复盐,不符合混盐的组成,所以不是混盐,故B错误;
C、BiONO3,没有金属离子或铵根离子,不属于盐,故C错误;
D、K3[Fe(CN)6]含有一种阳离子和一种酸根阴离子的盐,故D错误.
故选:A.点评:
本题考点: 酸、碱、盐、氧化物的概念及其相互联系.
考点点评: 本题是信息给予题,注意根据盐的概念和题目中信息分析解答,考查学生提练加工信息的能力,题目难度不大.1年前查看全部
- Ba(OH)2溶液滴入KAl(SO4)2溶液中,使SO42-全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( )
Ba(OH)2溶液滴入KAl(SO4)2溶液中,使SO42-全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( )
A. Al3+
B. Al(OH)3
C. AlO2-
D. Al3+和Al(OH)3 851261年前1
851261年前1 -
 木三儿 共回答了16个问题
木三儿 共回答了16个问题 |采纳率93.8%解题思路:设明矾KAl(SO4)2•12H2O为1mol,则溶液中含有1molK+、1molAl3+、2molSO42-,根据反应:SO42-+Ba2+═BaSO4↓,当溶液中的SO42-完全沉淀时,需要2molBa2+,即2molBa(OH)2,2molBa(OH)2中含有4molOH-,1molAl3+和4molOH-发生反应:Al3++4OH-═AlO2-+2H2O;铝元素的存在形式为:AlO2-.设明矾KAl(SO4)2•12H2O为1mol,则溶液中含有1molK+、1molAl3+、2molSO42-,根据反应:SO42-+Ba2+═BaSO4↓,当溶液中的SO42-完全沉淀时,需要2molBa2+,即2molBa(OH)2,2molBa(OH)2中含有4molOH-,1molAl3+和4molOH-发生反应:Al3++4OH-═AlO2-+2H2O;
铝元素的存在形式为:AlO2-,也可以写为[Al(OH)4]-形式.
故选C.点评:
本题考点: 镁、铝的重要化合物.
考点点评: 本题考查溶液中离子的共存,注意判断使SO42-全部转化成BaSO4沉淀需要Ba(OH)2的物质的量,根据Al3+和OH-物质的量的关系判断反应产物,题目难度中等.1年前查看全部
- Ba(OH)2与KAl(SO4)2.12H2O反应
 echojocy19820zz1年前1
echojocy19820zz1年前1 -
 辣手不摧花 共回答了255个问题
辣手不摧花 共回答了255个问题 |采纳率63.9%如果是氢氧化钡过量:KAl(SO4)2+2Ba(OH)2==2BaSO4(沉淀) +KAlO2, 如果是KAl(SO4)2过量:6KAl(SO4)2+3Ba(OH)2==3BaSO4(沉淀)+3K2SO4+2Al2(SO4)3+2Al(OH)3(沉淀) 满意请采纳哦,谢谢,祝学习进步!1年前查看全部
- (1)现有以下四种物质:A.新制的氢氧化铜[Cu(OH)2]悬浊液B.碳铵(NH4HCO3)C.明矾[KAl(SO4)2
(1)现有以下四种物质:
a.新制的氢氧化铜[cu(oh)2]悬浊液
b.碳铵(nh4hco3)
c.明矾[kal(so4)2•12h2o]
d.熟石灰[ca(oh)2]
请你根据题意,选择恰当的选项用字母代号填空:
①检验尿液中是否含有葡萄糖,可使用______;
②要使含泥沙的洪水变澄清,可使用______;
③要中和钢铁厂、电镀厂产生的酸性废水,可使用______;
④给农作物施用氮肥,可使用______.
(2)2013年1月,***多个省市出现严重的雾霾天气.导致雾霾形成的主要污染物是______(填字母).
a.so2 b.no2 c.pm2.5. YGJ6241年前1
YGJ6241年前1 -
 笑傲江湖传奇 共回答了20个问题
笑傲江湖传奇 共回答了20个问题 |采纳率95%解题思路:(1)①根据葡萄糖中含醛基,可与新制的氢氧化铜[Cu(OH)2]悬浊液反应产生砖红色沉淀;
②明矾电离出的铝离子可水解生成氢氧化铝胶体,具有吸附性,可净水;
③熟石灰显碱性,能与酸发生中和反应,且微溶于水,能指示是否足量,过量后碱性也不很强;
④碳铵可作氮肥,是因为能电离出铵根离子被植物吸收;
(2)形成雾霾的主要污染物是PM2.5”,指大气层中直径≥2.5μm的颗粒物,能被肺吸收并进入血液,对人体危害很大.(1)①葡萄糖中含醛基,故可使用新制的氢氧化铜[Cu(OH)2]悬浊液,检验尿液中是否含有葡萄糖,故答案为A;
②明矾[KAl(SO4)2•12H2O]电离出的铝离子可水解生成氢氧化铝胶体,具有吸附性;故可使含泥沙的洪水变澄清,故答案为C;
③熟石灰显碱性,能与酸发生中和反应,故可中和钢铁厂、电镀厂产生的酸性废水,故答案为D;
④碳铵是铵盐,能电离出铵根离子被植物吸收,故可作氮肥,故答案为B;
(2)PM2.5”是指大气层中直径≥2.5μm的颗粒物,能被肺吸收并进入血液,对人体危害很大,是形成雾霾的主要污染物,故答案为:c.点评:
本题考点: 常见的生活环境的污染及治理;葡萄糖的银镜反应.
考点点评: 本题考查了生产生活中的一些常见问题,较简单.1年前查看全部
- 用等体积的0.1mol/L的BaCl2溶液,可使相同体积的Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液的
用等体积的0.1mol/L的BaCl2溶液,可使相同体积的Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液的SO42-完全沉淀,则三种硫酸盐的物质的量浓度之比为( )
A. 3:2:3
B. 3:1:2
C. 2:6:3
D. 1:1:1 jin天1年前1
jin天1年前1 -
 qq先锋 共回答了17个问题
qq先锋 共回答了17个问题 |采纳率76.5%解题思路:等体积的0.1mol/L的BaCl2溶液,可使相同体积的Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液的SO42-完全沉淀,则Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液中n(SO42-)相同,根据硫酸根守恒可知,n[Fe2(SO4)3]=[1/3]n(SO42-),n(Na2SO4)=n(SO42-),n[KAl(SO4)2]=[1/2]n(SO42-),三种溶液的体积相同,物质的量浓度之比等于溶质物质的量之比,据此计算.等体积的0.1mol/L的BaCl2溶液,可使相同体积的Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液的SO42-完全沉淀,则Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液中n(SO42-)相同,根据硫酸根守恒可知,n[Fe2(SO4)3]=[1/3]n(SO42-),n(Na2SO4)=n(SO42-),n[KAl(SO4)2]=[1/2]n(SO42-),三种溶液的体积相同,物质的量浓度之比等于溶质物质的量之比,所以三种硫酸盐的物质的量浓度之比为c[Fe2(SO4)3]:c(Na2SO4):c[KAl(SO4)2]=[1/3]n(SO42-):n(SO42-):[1/2]n(SO42-)=2:6:3.
故选:C.点评:
本题考点: 物质的量浓度的相关计算;离子方程式的有关计算.
考点点评: 考查物质的量浓度的计算、反应方程式的计算等,难度不大,根据化学式推断溶质的物质的量与硫酸根关系是解题关键.1年前查看全部
- 在Al2(SO4)3、K2SO4和KAl(SO4)2的混合溶液中,如果SO42-的物质的量浓度为0.2mol•L-1,当
在Al2(SO4)3、K2SO4和KAl(SO4)2的混合溶液中,如果SO42-的物质的量浓度为0.2mol•L-1,当加等体积的0.2mol•L-1的KOH溶液时,生成的沉淀恰好溶解,则原混合物中K+的物质的量浓度是( )
A.0.2 mol•L-1
B.0.25 mol•L-1
C.0.45 mol•L-1
D.0.225 mol•L-1 lansp1年前1
lansp1年前1 -
 心观自在428 共回答了23个问题
心观自在428 共回答了23个问题 |采纳率82.6%解题思路:Al2(SO4)3、K2SO4和明矾的混和溶液中,加入等体积的0.2mol/L的KOH溶液时,生成的沉淀恰好溶解,发生反应Al3++4OH-=AlO2-+2H2O,可知原溶液中c(Al3+)=[1/4]×0.2mol/L=0.05mol/L,由电荷守恒可知溶液中c(K+)+3c(Al3+)=2c(SO42-),据此计算.Al2(SO4)3、K2SO4和明矾的混和溶液中,加入等体积的0.2mol/L的KOH溶液时,生成的沉淀恰好溶解,发生反应Al3++4OH-=AlO2-+2H2O,
可知原溶液中c(Al3+)=[1/4]×0.2mol/L=0.05mol/L,根据电荷守恒可知,原溶液中c(K+)+3c(Al3+)=2c(SO42-),
即c(K+)=2c(SO42-)-3c(Al3+)=2×0.2mol/L-0.05mol/L×3=0.25mol/L,
故选:B.点评:
本题考点: 离子方程式的有关计算.
考点点评: 本题考查有关混合物的计算,题目浓度不大,注意根据电荷守恒的角度解答.1年前查看全部
- Ba(OH)2溶液滴入KAl(SO4)2溶液中,使SO42-全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( )
Ba(OH)2溶液滴入KAl(SO4)2溶液中,使SO42-全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( )
A. Al3+
B. Al(OH)3
C. AlO2-
D. Al3+和Al(OH)3 名之如花1年前2
名之如花1年前2 -
 ynsnjs 共回答了19个问题
ynsnjs 共回答了19个问题 |采纳率84.2%解题思路:设明矾KAl(SO4)2•12H2O为1mol,则溶液中含有1molK+、1molAl3+、2molSO42-,根据反应:SO42-+Ba2+═BaSO4↓,当溶液中的SO42-完全沉淀时,需要2molBa2+,即2molBa(OH)2,2molBa(OH)2中含有4molOH-,1molAl3+和4molOH-发生反应:Al3++4OH-═AlO2-+2H2O;铝元素的存在形式为:AlO2-.设明矾KAl(SO4)2•12H2O为1mol,则溶液中含有1molK+、1molAl3+、2molSO42-,根据反应:SO42-+Ba2+═BaSO4↓,当溶液中的SO42-完全沉淀时,需要2molBa2+,即2molBa(OH)2,2molBa(OH)2中含有4molOH-,1molAl3+和4molOH-发生反应:Al3++4OH-═AlO2-+2H2O;
铝元素的存在形式为:AlO2-,也可以写为[Al(OH)4]-形式.
故选C.点评:
本题考点: 镁、铝的重要化合物.
考点点评: 本题考查溶液中离子的共存,注意判断使SO42-全部转化成BaSO4沉淀需要Ba(OH)2的物质的量,根据Al3+和OH-物质的量的关系判断反应产物,题目难度中等.1年前查看全部
- 用等体积的1mol/L的BaCl2溶液,可使相同体积的Na2SO4、Fe2(SO4)3、KAl(SO4)2
用等体积的1mol/L的BaCl2溶液,可使相同体积的Na2SO4、Fe2(SO4)3、KAl(SO4)2
三种溶液中的SO42-完全沉淀,则三种硫酸盐的物质的量浓度之比为?
2:3.特别是硫酸铝钾 cbc7ql01年前1
cbc7ql01年前1 -
 雨叶百合 共回答了14个问题
雨叶百合 共回答了14个问题 |采纳率100%假设氯化钡就只用了1L,所以氯化钡物质的量为1mol,只能结合1mol硫酸根,同样因为三者体积相同所以姑且假设也是1L那么需要硫酸根的浓度就是1mol/L,硫酸钠浓度就是c(Na2SO4)=c(SO42-)=1mol/1L=1mol/L,c(SO42-)=1/3c(Fe2(SO4)3)=1mol/1L=1mol/L,所以c(Fe2(SO4)3)=1/3mol/L,c(SO42-)=1/2c(KAl(SO4)2)=1mol/L,c(KAl(SO4)2=0.5mol/L,所以比例1:1/3:1/2=6:2:31年前查看全部
- 怎么写KAL(SO4)2与其他物质的反应方程式?如Ba(oh)2,氨水
 最后一根火柴1年前2
最后一根火柴1年前2 -
 牵熊花 共回答了24个问题
牵熊花 共回答了24个问题 |采纳率91.7%原则上来讲是可以像楼上这样的,但是对于实际问题又有不同的情况
比如楼主举例的Ba(OH)2,这里面会发生多个反应(若写离子方程式比较直观):
(Ba 2+)+(SO4 2-)=BaSO4↓
(Al 3+)+3(OH-)=Al(OH)3↓
而且由于氢氧化钡是强碱,因此可能发生2Al(OH)3+Ba(OH)2=Ba(AlO2)2+4H2O
所以综合起来需要考虑过量或少量的问题.
(一)若要耗尽SO4 2-:
KAl(SO4)2+2Ba(OH)2=2BaSO4↓+KAlO2
【方法:先写出KAl(SO4)2,若要耗尽其中的SO4 2-,就需要两个Ba 2+,因此Ba(OH)2前配2,生成2个BaSO4;而此时Al 3+与OH -比例1:4,碱已过量,因此变为偏铝酸根离子,加上K +变为KAlO2.可以看出,这里Al 3+恰好全部变为AlO2 -,因此若要使Al 3+全部变为AlO2 -,也是这个反应】
(二)若要全部沉淀Al 3+:
2KAl(SO4)2+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓+K2SO4
【方法:类似前面,先配好Al 3+与OH-的1:3比例,再顺次配好其他物质】
相应的,与氨水的反应也类似且更简单,因为没有硫酸钡沉淀的情况,且氨水是弱碱,所以不必考虑氢氧根过量的问题1年前查看全部
- 用等体积的0.1mol/L的BaCl2溶液,可使相同体积的Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液的
用等体积的0.1mol/L的BaCl2溶液,可使相同体积的Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液的SO42-完全沉淀,则三种硫酸盐的物质的量浓度之比为( )
A. 3:2:3
B. 3:1:2
C. 2:6:3
D. 1:1:1 ghost11351年前1
ghost11351年前1 -
 msnr 共回答了11个问题
msnr 共回答了11个问题 |采纳率100%解题思路:等体积的0.1mol/L的BaCl2溶液,可使相同体积的Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液的SO42-完全沉淀,则Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液中n(SO42-)相同,根据硫酸根守恒可知,n[Fe2(SO4)3]=[1/3]n(SO42-),n(Na2SO4)=n(SO42-),n[KAl(SO4)2]=[1/2]n(SO42-),三种溶液的体积相同,物质的量浓度之比等于溶质物质的量之比,据此计算.等体积的0.1mol/L的BaCl2溶液,可使相同体积的Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液的SO42-完全沉淀,则Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液中n(SO42-)相同,根据硫酸根守恒可知,n[Fe2(SO4)3]=[1/3]n(SO42-),n(Na2SO4)=n(SO42-),n[KAl(SO4)2]=[1/2]n(SO42-),三种溶液的体积相同,物质的量浓度之比等于溶质物质的量之比,所以三种硫酸盐的物质的量浓度之比为c[Fe2(SO4)3]:c(Na2SO4):c[KAl(SO4)2]=[1/3]n(SO42-):n(SO42-):[1/2]n(SO42-)=2:6:3.
故选:C.点评:
本题考点: 物质的量浓度的相关计算;离子方程式的有关计算.
考点点评: 考查物质的量浓度的计算、反应方程式的计算等,难度不大,根据化学式推断溶质的物质的量与硫酸根关系是解题关键.1年前查看全部
- 100mL Al2(SO4)3、K2SO4、KAl(SO4)2的混合液中,如果SO42-的浓度等于0.4mol/L,当加
100mL Al2(SO4)3、K2SO4、KAl(SO4)2的混合液中,如果SO42-的浓度等于0.4mol/L,当加入2mol/L的KOH溶液50mL时,生成沉淀恰好溶解,则原混合物中K+的物质的量浓度是( )
A.0.2mol•L-1
B.0.05mol•L-1
C.0.45mol•L-1
D.0.225mol•L-1 6940232011年前1
6940232011年前1 -
 weijiyi 共回答了29个问题
weijiyi 共回答了29个问题 |采纳率93.1%解题思路:当加入2mol/L的KOH溶液50mL时,生成沉淀恰好溶解,发生反应Al3++4OH-=AlO2-+2H2O,此时溶液中溶质为硫酸钾、偏铝酸钾,原溶液中n(Al3+)=[1/4]×2mol/L×0.05L=0.025mol,根据原溶液中电荷守恒可知溶液中c(K+)+3c(Al3+)=2c(SO42-),以此计算.当加入2mol/L的KOH溶液50mL时,生成沉淀恰好溶解,发生反应Al3++4OH-=AlO2-+2H2O,此时溶液中溶质为硫酸钾、偏铝酸钾,原溶液中n(Al3+)=[1/4]×2mol/L×0.05L=0.025mol,则c(Al3+)=0.25mol/L,
原溶液中电荷守恒可知溶液中c(K+)+3c(Al3+)=2c(SO42-),c(K+)=2×0.4mol/L-0.25mol/L×3=0.05mol/L,
故选B.点评:
本题考点: 离子方程式的有关计算;镁、铝的重要化合物.
考点点评: 本题考查有关混合物的计算,为高频考点,注意铝离子物质的量的计算和电荷守恒的角度解答是解题的关键,题目难度不大.1年前查看全部
- 测得某KAl(SO4)2、NaCl、Na2SO4组成的混合溶液中c(K+)=0.1mol•L-1,c(Na+)=0.2m
测得某KAl(SO4)2、NaCl、Na2SO4组成的混合溶液中c(K+)=0.1mol•L-1,c(Na+)=0.2mol•L-1,c(Cl-)=0.15mol•L-1,则该溶液中c(SO42-)是( )
A. 0.1mol•L-1
B. 0.125mol•L-1
C. 0.2mol•L-1
D. 0.225mol•L-1 张ZY1年前1
张ZY1年前1 -
 ruby_guoguo 共回答了18个问题
ruby_guoguo 共回答了18个问题 |采纳率100%解题思路:根据溶液不显电性,则阳离子的电荷总数等于阴离子的电荷总数,即c(K+)+c(Na+)+3c(Al3+)=c(Cl-)+2c(SO42-),溶液中c(K+)=c(Al3+),以此来计算c(SO42-).溶液中c(Al3+)=c(K+)=0.1mol/L,
根据溶液呈电中性,则c(K+)+c(Na+)+3c(Al3+)=c(Cl-)+2c(SO42-),
故0.1mol/L+0.2mol/L+3×0.1mol/L=0.15mol/L+2c(SO42-),
解得c(SO42-)=0.225mol/L,
故选:D.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查溶液物质的量浓度的计算,难度不大,注意电解质混合溶液中离子浓度计算常利用电荷守恒计算.1年前查看全部
- 下列说法不正确的是( )A.分散质粒子的直径在10-9~10-7m之间的分散系叫做胶体B.KAl(SO4)2在水溶液中
下列说法不正确的是( )
A.分散质粒子的直径在10-9~10-7m之间的分散系叫做胶体
B.KAl(SO4)2在水溶液中电离方程式为KAl(SO4)2═K++Al3++SO42-
C.利用丁达尔效应可以鉴别CuSO4溶液和氢氧化铁胶体
D.氯气可用于自来水的消毒 悦儿771年前1
悦儿771年前1 -
 wjsdzyw 共回答了13个问题
wjsdzyw 共回答了13个问题 |采纳率84.6%解题思路:A.分散质粒子的直径介于1-100nm,1nm=10-9m;
B.原子个数、电荷均不守恒;
C.丁达尔效应是胶体的特性,可以用来鉴别胶体和溶液;
D.氯气与水反应生成具有强氧化性的次氯酸,可以使蛋白质变性.A.分散质粒子的直径介于1-100nm,1nm=10-9m,1-100nm即10-9~10-7m,故A正确;
B.KAl(SO4)2在水溶液中电离方程式为:KAl(SO4)2═K++Al3++2SO42-,故B错误;
C.丁达尔效应是胶体的特性,可以用来鉴别胶体和溶液,故C正确;
D.氯气与水反应生成具有强氧化性的次氯酸,可以使蛋白质变性,所以氯气可用于自来水的消毒,故D正确;
故选:B.点评:
本题考点: 分散系、胶体与溶液的概念及关系;电离方程式的书写;胶体的重要性质.
考点点评: 本题考查了胶体的本质特征和性质、氯气的性质、电离方程式的书写,属于对课本基础知识的考查,题目难度不大,注意书写电离方程式时应遵循原子个数、电荷数守恒.1年前查看全部
- (2013•达州模拟)NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.
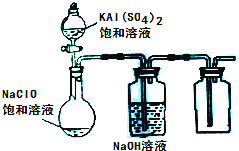 (2013•达州模拟)NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.
(2013•达州模拟)NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.
(1)工业上可用氯化钠为原料,通过电解的方法制得NaClO,工业上制取NaClO的离子反应方程式为Cl-+H2O
ClO-+H2↑通电 .Cl-+H2O电解后的溶液PH______ 7(填大于、小于、等于);其原因是______ (用离子方程式表示)
ClO-+H2↑通电 .
(2)KAl(SO4)2溶液中质子守恒等式为______
(3)某小组同学用下图所示装置探究饱和NaClO和KAl(SO4)2溶液混合反应的实验.
①打开活塞向烧瓶中加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀.此时反应的离子方程式为______.②将烧瓶中的混合液在阳光照射下,不久烧瓶中有黄绿色气体产生,充分反应后集气瓶中收集到一种无色无味的气体.写出在光照射下混合液中反应的化学方程式是4HClO
2H2O+2Cl2↑+O2↑光照 .4HClO.
2H2O+2Cl2↑+O2↑光照 .
(4)若将分液漏斗中的KAl(SO4)2溶液换成硫酸亚铁铵(一种复盐:(NH4)2SO4•FeSO4)溶液,其他不变.打开分液漏斗活塞向烧瓶中滴入足量的硫酸亚铁铵溶液.观察到烧瓶中有红褐色沉淀产生,但是没有观察到黄绿色气体产生.此时烧瓶中发生的氧化还原反应的离子方程式为______.
(5)取100mL 0.1mol/L Ba(OH)2溶液,向其中逐滴加入同浓度的KHSO4溶液至Ba2+恰好完全沉淀,此时溶液的PH值为______ (忽略两溶液混合时的体积变化,混合后溶液的温度为100℃,100℃时Kw=1x10-12) 蛇妖ku1年前1
蛇妖ku1年前1 -
 江湖路人 共回答了18个问题
江湖路人 共回答了18个问题 |采纳率94.4%解题思路:(1)电解饱和食盐水得到氯气、氢气、氢氧化钠溶液,氯气和氢氧化钠溶液反应生成次氯酸钠和氯化钠溶液;氯气全部和氢氧化钠反应生成次氯酸钠溶液和氢气;次氯酸钠溶液水解显碱性;
(2)依据溶液中铝离子水解生成氢氧化铝和氢离子,质子守恒是水电离出的氢离子和氢氧根离子守恒;
(3)①烧瓶中加入饱和KAl(SO4)2溶液,次氯酸根离子水解显碱性,铝离子水解显酸性,混合后水解相互促进,产生大量的白色胶状沉淀和次氯酸;
②依据现象分析是次氯酸分解生成氯气、氧气和水的反应;
(4)亚铁离子具有还原性,次氯酸根离子教育氧化性在溶液中发生氧化还原反应,依据原子守恒和电子守恒计算书写离子方程式;
(5)Ba(OH)2溶液与KHSO4溶液至Ba2+恰好完全沉淀,反应物质的量之比为1:1,依据剩余溶液中氢氧根离子计算浓度结合Kw计算氢离子浓度计算溶液PH;(1)电解饱和食盐水得到氯气、氢气、氢氧化钠溶液,氯气和氢氧化钠溶液反应生成次氯酸钠和氯化钠溶液;氯气全部和氢氧化钠反应生成次氯酸钠溶液和氢气;反应的离子方程式为:Cl-+H2O
通电
.
ClO-+H2↑;次氯酸钠溶液水解显碱性;ClO-+H2O⇌HClO+OH-;故答案为:Cl-+H2O
通电
.
ClO-+H2↑;大于;ClO-+H2O⇌HClO+OH-;
(2)液中铝离子水解生成氢氧化铝和氢离子,质子守恒是水电离出的氢离子和氢氧根离子守恒,c(H+)=c(OH-)+3c(Al(OH)3);故答案为:c(H+)=c(OH-)+3c(Al(OH)3);
(3)①烧瓶中加入饱和KAl(SO4)2溶液,次氯酸根离子水解显碱性,铝离子水解显酸性,混合后水解相互促进,产生大量的白色胶状沉淀和次氯酸,反应的离子方程式为:
3ClO-+Al3++3H2O=3HClO+Al(OH)3↓;故答案为:3ClO-+Al3++3H2O=3HClO+Al(OH)3↓;
②将烧瓶中的混合液在阳光照射下,不久烧瓶中有黄绿色气体产生为氯气,充分反应后集气瓶中收集到一种无色无味的气体为氧气.依据氧化还原反应电子守恒写出化学方程式配平得到:4HClO
光照
.
2H2O+2Cl2↑+O2↑;
故答案为:4HClO
光照
.
2H2O+2Cl2↑+O2↑;
(4)若将分液漏斗中的KAl(SO4)2溶液换成硫酸亚铁铵(一种复盐:(NH4)2SO4•FeSO4)溶液,其他不变.打开分液漏斗活塞向烧瓶中滴入足量的硫酸亚铁铵溶液.观察到烧瓶中有红褐色沉淀产生,但是没有观察到黄绿色气体产生,亚铁离子具有还原性,次氯酸根离子教育氧化性在溶液中发生氧化还原反应,
反应的离子方程式为:3ClO-+6Fe2++3H2O=2Fe(OH)3↓+4Fe3++3Cl-;
故答案为:3ClO-+6Fe2++3H2O=2Fe(OH)3↓+4Fe3++3Cl-;
(5)取100mL 0.1mol/L Ba(OH)2溶液,向其中逐滴加入同浓度的KHSO4溶液至Ba2+恰好完全沉淀,Ba(OH)2溶液与KHSO4溶液至Ba2+恰好完全沉淀,需要同浓度溶液体积为100ml,反应物质的量之比为1:1,剩余氢氧根离子物质的量为0.01mol,浓度c(OH-)=[0.01mol/0.2L]=0.05mol/L;100℃时Kw=1x10-12,c(H+)=
10−12
0.05=2×10-11mol/L;PH=-lg2×10-11mol/L=10.7,故答案为:10.7;点评:
本题考点: 盐类水解的应用;氧化还原反应;pH的简单计算;电解原理.
考点点评: 本题考查了电解原理的应用,反应产物判断,盐类水解的应用,氧化还原反应的分析判断,溶液PH计算应用,题目难度中等.1年前查看全部
- 明矾水溶液的导电性怎么样?KAl(SO4)2·12H2O,明矾溶于水后全部电离出K+,Al 3+,SO4 2-,问:明矾
明矾水溶液的导电性怎么样?
KAl(SO4)2·12H2O,明矾溶于水后全部电离出K+,Al 3+,SO4 2-,
问:明矾水溶液的导电性____(填“良”“好”“差”) xuexue1年前1
xuexue1年前1 -
 灰辰 共回答了12个问题
灰辰 共回答了12个问题 |采纳率83.3%良 明矾属于盐类 你们化学初中的时候讲没讲过 盐类除了 难溶的导电性都很强1年前查看全部
- Ba(OH)2溶液滴入KAl(SO4)2溶液中,使SO42-全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( )
Ba(OH)2溶液滴入KAl(SO4)2溶液中,使SO42-全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( )
A. Al3+
B. Al(OH)3
C. AlO2-
D. Al3+和Al(OH)3 我遨游1年前1
我遨游1年前1 -
 飞鱼88 共回答了11个问题
飞鱼88 共回答了11个问题 |采纳率90.9%解题思路:设明矾KAl(SO4)2•12H2O为1mol,则溶液中含有1molK+、1molAl3+、2molSO42-,根据反应:SO42-+Ba2+═BaSO4↓,当溶液中的SO42-完全沉淀时,需要2molBa2+,即2molBa(OH)2,2molBa(OH)2中含有4molOH-,1molAl3+和4molOH-发生反应:Al3++4OH-═AlO2-+2H2O;铝元素的存在形式为:AlO2-.设明矾KAl(SO4)2•12H2O为1mol,则溶液中含有1molK+、1molAl3+、2molSO42-,根据反应:SO42-+Ba2+═BaSO4↓,当溶液中的SO42-完全沉淀时,需要2molBa2+,即2molBa(OH)2,2molBa(OH)2中含有4molOH-,1molAl3+和4molOH-发生反应:Al3++4OH-═AlO2-+2H2O;
铝元素的存在形式为:AlO2-,也可以写为[Al(OH)4]-形式.
故选C.点评:
本题考点: 镁、铝的重要化合物.
考点点评: 本题考查溶液中离子的共存,注意判断使SO42-全部转化成BaSO4沉淀需要Ba(OH)2的物质的量,根据Al3+和OH-物质的量的关系判断反应产物,题目难度中等.1年前查看全部
- 用等体积的0.1mol/L的BaCl2溶液,可使相同体积的Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液的
用等体积的0.1mol/L的BaCl2溶液,可使相同体积的Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液的SO42-完全沉淀,则三种硫酸盐的物质的量浓度之比为( )
A. 3:2:3
B. 3:1:2
C. 2:6:3
D. 1:1:1 空语句卡1年前2
空语句卡1年前2 -
 魔波巡 共回答了13个问题
魔波巡 共回答了13个问题 |采纳率92.3%解题思路:等体积的0.1mol/L的BaCl2溶液,可使相同体积的Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液的SO42-完全沉淀,则Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液中n(SO42-)相同,根据硫酸根守恒可知,n[Fe2(SO4)3]=[1/3]n(SO42-),n(Na2SO4)=n(SO42-),n[KAl(SO4)2]=[1/2]n(SO42-),三种溶液的体积相同,物质的量浓度之比等于溶质物质的量之比,据此计算.等体积的0.1mol/L的BaCl2溶液,可使相同体积的Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液的SO42-完全沉淀,则Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液中n(SO42-)相同,根据硫酸根守恒可知,n[Fe2(SO4)3]=[1/3]n(SO42-),n(Na2SO4)=n(SO42-),n[KAl(SO4)2]=[1/2]n(SO42-),三种溶液的体积相同,物质的量浓度之比等于溶质物质的量之比,所以三种硫酸盐的物质的量浓度之比为c[Fe2(SO4)3]:c(Na2SO4):c[KAl(SO4)2]=[1/3]n(SO42-):n(SO42-):[1/2]n(SO42-)=2:6:3.
故选:C.点评:
本题考点: 物质的量浓度的相关计算;离子方程式的有关计算.
考点点评: 考查物质的量浓度的计算、反应方程式的计算等,难度不大,根据化学式推断溶质的物质的量与硫酸根关系是解题关键.1年前查看全部
- Al2(SO4)3、K2SO4、KAl(SO4)2的混合溶液100mL中,如果SO42-的浓度为0.8mol/L,当加入
Al2(SO4)3、K2SO4、KAl(SO4)2的混合溶液100mL中,如果SO42-的浓度为0.8mol/L,当加入2mol/L的KOH溶液100mL时,生成沉淀恰好溶解,则原混合物中K+的物质的量浓度是( )
A. 0.2mol/L
B. 0.1mol/L
C. 0.45mol/L
D. 0.225mol/L 有风就有飞的理由1年前1
有风就有飞的理由1年前1 -
 phoenixflies 共回答了17个问题
phoenixflies 共回答了17个问题 |采纳率82.4%解题思路:当加入2mol/L的KOH溶液100mL时,生成沉淀恰好溶解,发生反应Al3++4OH-=AlO2-+2H2O,此时溶液中溶质为硫酸钾、偏铝酸钾,原溶液中n(Al3+)=[1/4]×2mol/L×0.1L=0.05mol,根据原溶液中电荷守恒可知溶液中c(K+)+3c(Al3+)=2c(SO42-),以此进行小计算原混合物中K+的物质的量浓度.加入2mol/L的KOH溶液100mL时,生成沉淀恰好溶解,发生反应为:Al3++4OH-=AlO2-+2H2O,此时溶液中溶质为硫酸钾、偏铝酸钾,原溶液中铝离子的物质的量为:n(Al3+)=[1/4]×2mol/L×0.1L=0.05mol,
则原溶液中铝离子的浓度为:c(Al3+)=[0.05mol/0.1L]=0.5mol/L,
根据原溶液中电荷守恒可知:c(K+)+3c(Al3+)=2c(SO42-),
则c(K+)=2×0.8mol/L-0.5mol/L×3=0.1mol/L,
故选B.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查有关混合物的计算,为高频考点,题目难度中等,注意明确铝离子与氢氧根离子的物质的量关系及溶液中的电荷守恒为解题的关键.1年前查看全部
- (2012•长宁区二模)在KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生反应的离子方程式是( )
(2012•长宁区二模)在KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生反应的离子方程式是( )
A.4Al3++7SO42-+7Ba2++14OH-→7BaSO4↓+2AlO3-+4H2O+2Al(OH)3↓
B.Al3++3SO42-+3Ba2++3OH-→3BaSO4↓+Al(OH)3↓
C.Al3++3AlO2-+6H2O→4Al(OH)3↓
D.2Al3++3SO42-+3Ba2++6OH-→3BaSO4↓+2 Al(OH)3↓ i且听风声1年前1
i且听风声1年前1 -
 mumian326 共回答了17个问题
mumian326 共回答了17个问题 |采纳率82.4%解题思路:在KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液,发生的反应为KAl(SO4)2和Ba(OH)2按照2:3反应,铝离子恰好沉淀,反应的离子方程式为:2Al3++3SO42-+3Ba2++6OH-→3BaSO4↓+2 Al(OH)3↓;KAl(SO4)2和Ba(OH)2按照1:2反应铝离子恰好变为偏铝酸根离子,Al3++2SO42-+2Ba2++4OH-→2BaSO4↓+2H2O+AlO2-.A、选项中的反应4molKAl(SO4)2和7molBa(OH)2的反应,4molAl3+完全沉淀需要12molOH-,7molBa(OH)2的提供14molOH-,溶解了2molAl(OH)3,反应的离子方程式为:4Al3++7SO42-+7Ba2++14OH-→7BaSO4↓+2AlO3-+4H2O+2Al(OH)3↓,故A正确;
B、但按照选项滴入3molBa(OH)2,需要测定2molAl3+生成2molAl(OH)3沉淀,故B错误;
C、滴入氢氧化钡溶液只能出现沉淀生成氢氧化铝,继续加入氢氧化铝溶解的反应,反应过程中无此反应,故C错误;
D、选项中是2molKAl(SO4)2和3molBa(OH)2的反应,2molAl3+完全沉淀需要6molOH-,生成2mol氢氧化铝沉淀,故D正确;
故选AD.点评:
本题考点: 离子方程式的书写.
考点点评: 本题考查了离子反应的定量分析判断,氢氧化铝是两性氢氧化物溶于强酸强碱,离子性质的应用和定量反应是解题关键,题目难度较大.1年前查看全部
- 明矾化学式为KAl(SO4)2·12H2O,请写出实验步骤实验现象与结论证明明矾中有钾离子,氯离子,硫离子.
 mrsbiaoge1年前3
mrsbiaoge1年前3 -
 ltled 共回答了19个问题
ltled 共回答了19个问题 |采纳率94.7%钾离子:用沾过盐酸的铂丝在酒精灯上灼烧后沾取少量溶液,透过蓝色钴玻璃观察火焰呈紫色则证明有钾离子.
氯离子:取样少许,向其中加入氢氧化钠溶液,有白色沉淀产生,继续加入氢氧化钠溶液,若沉淀溶解,则有氯离子,否则无.
硫离子:取样少许,向其中加入BaCl2溶液,有白色沉淀生成,继续加入,沉淀不溶解,证明有硫酸根离子.
(KAl(SO4)2·12H2O 电离后应该是钾离子,氯离子,硫酸根离子啊)1年前查看全部
- 明矾和小苏打的化学反应方程式nahco3和kal(so4)2.12h2o的化学反应方程式
 lomila1年前2
lomila1年前2 -
 willing2005 共回答了27个问题
willing2005 共回答了27个问题 |采纳率88.9%3HCO3- + Al3+ == Al(OH)3 (沉淀) + 3CO2 (气体)
6NaHCO3 + 2KAl(SO4)2.12H2O = 2Al(OH)3 (沉淀) + 6CO2 (气体) + K2SO4 + 3Na2SO4 + 24H2O1年前查看全部
- KAl(SO4)2转化成Al(OH)3
 jimtan1881年前4
jimtan1881年前4 -
 hh人98 共回答了21个问题
hh人98 共回答了21个问题 |采纳率81%加入强碱容易过量使得氢氧化铝变成偏铝酸盐
一般用氨水可以控制在氢氧化铝这一步
2KAl(SO4)2+6NH3.H2O=2Al(OH)3+K2SO4+3(NH4)2SO41年前查看全部
- Ba(OH)2溶液滴入KAl(SO4)2溶液中,使SO42-全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( )
Ba(OH)2溶液滴入KAl(SO4)2溶液中,使SO42-全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( )
A. Al3+
B. Al(OH)3
C. AlO2-
D. Al3+和Al(OH)3 xixixi1231年前1
xixixi1231年前1 -
 qu860v 共回答了21个问题
qu860v 共回答了21个问题 |采纳率95.2%解题思路:设明矾KAl(SO4)2•12H2O为1mol,则溶液中含有1molK+、1molAl3+、2molSO42-,根据反应:SO42-+Ba2+═BaSO4↓,当溶液中的SO42-完全沉淀时,需要2molBa2+,即2molBa(OH)2,2molBa(OH)2中含有4molOH-,1molAl3+和4molOH-发生反应:Al3++4OH-═AlO2-+2H2O;铝元素的存在形式为:AlO2-.设明矾KAl(SO4)2•12H2O为1mol,则溶液中含有1molK+、1molAl3+、2molSO42-,根据反应:SO42-+Ba2+═BaSO4↓,当溶液中的SO42-完全沉淀时,需要2molBa2+,即2molBa(OH)2,2molBa(OH)2中含有4molOH-,1molAl3+和4molOH-发生反应:Al3++4OH-═AlO2-+2H2O;
铝元素的存在形式为:AlO2-,也可以写为[Al(OH)4]-形式.
故选C.点评:
本题考点: 镁、铝的重要化合物.
考点点评: 本题考查溶液中离子的共存,注意判断使SO42-全部转化成BaSO4沉淀需要Ba(OH)2的物质的量,根据Al3+和OH-物质的量的关系判断反应产物,题目难度中等.1年前查看全部
- KAL(SO4)2和少量naoh反应与和过量naoh反应的化学方程式是什么
 haishanghai1年前0
haishanghai1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- Al2(SO4)3、K2SO4、KAl(SO4)2的混合溶液100mL中,如果SO42-的浓度为0.8mol/L,当加入
Al2(SO4)3、K2SO4、KAl(SO4)2的混合溶液100mL中,如果SO42-的浓度为0.8mol/L,当加入2mol/L的KOH溶液100mL时,生成沉淀恰好溶解,则原混合物中K+的物质的量浓度是( )
A. 0.2mol/L
B. 0.1mol/L
C. 0.45mol/L
D. 0.225mol/L 小小茉1年前1
小小茉1年前1 -
 蟑螂王 共回答了20个问题
蟑螂王 共回答了20个问题 |采纳率90%解题思路:当加入2mol/L的KOH溶液100mL时,生成沉淀恰好溶解,发生反应Al3++4OH-=AlO2-+2H2O,此时溶液中溶质为硫酸钾、偏铝酸钾,原溶液中n(Al3+)=[1/4]×2mol/L×0.1L=0.05mol,根据原溶液中电荷守恒可知溶液中c(K+)+3c(Al3+)=2c(SO42-),以此进行小计算原混合物中K+的物质的量浓度.加入2mol/L的KOH溶液100mL时,生成沉淀恰好溶解,发生反应为:Al3++4OH-=AlO2-+2H2O,此时溶液中溶质为硫酸钾、偏铝酸钾,原溶液中铝离子的物质的量为:n(Al3+)=[1/4]×2mol/L×0.1L=0.05mol,
则原溶液中铝离子的浓度为:c(Al3+)=[0.05mol/0.1L]=0.5mol/L,
根据原溶液中电荷守恒可知:c(K+)+3c(Al3+)=2c(SO42-),
则c(K+)=2×0.8mol/L-0.5mol/L×3=0.1mol/L,
故选B.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查有关混合物的计算,为高频考点,题目难度中等,注意明确铝离子与氢氧根离子的物质的量关系及溶液中的电荷守恒为解题的关键.1年前查看全部
- “复盐”是指含多种简单阳离子和一种酸根离子组成的盐,如KAl(SO4)2.而一种金属离子与多种酸根离子构成的盐则称为“混
“复盐”是指含多种简单阳离子和一种酸根离子组成的盐,如KAl(SO4)2.而一种金属离子与多种酸根离子构成的盐则称为“混盐”,如氯化硝酸钙[Ca(NO3)2Cl].下列化合物属于混盐的是( )
A.Ca2O2Cl4
B.KCl•MgCl2•6H2O
C.KMnO4
D.Cu2(OH)2CO3 cf_chdh1年前1
cf_chdh1年前1 -
 mengfeiyu1 共回答了9个问题
mengfeiyu1 共回答了9个问题 |采纳率88.9%解题思路:盐是由金属阳离子(铵根离子)和酸根阴离子组成的化合物,一种金属离子与多种酸根离子构成的盐则称为“混盐”,结合题中信息和盐的定义进行分析判断.A、Ca2O2Cl4的化学式可以写成Ca2(ClO)2Cl2,所以该物质是由一种金属阳离子和两种酸根离子构成的,因此属于混盐,故A正确.
B、KCl•MgCl2•6H2O含有两种阳离子和一种酸根阴离子,是复盐,不符合混盐的组成,所以不是混盐,故B错误.
C、KMnO4,是一种阳离子和一种阴离子构成,属于正盐,故C错误.
D、Cu2(OH)2CO3 含有一种阳离子、一种酸根阴离子和氢氧根离子的盐,属于碱式盐,故D错误.
故选:A.点评:
本题考点: 酸、碱、盐、氧化物的概念及其相互联系.
考点点评: 本题是信息给予题,注意根据盐的概念和题目中信息分析解答,考查学生提练加工信息的能力,题目难度中等.1年前查看全部
- KAL(SO4)2 的电离方程BA(OH)2的电离方程
 天妒紅顏1年前1
天妒紅顏1年前1 -
 猪肉搜 共回答了15个问题
猪肉搜 共回答了15个问题 |采纳率100%KAl(SO4)2 → K+ + Al3+ + SO42-
Ba(OH)2 → Ba2+ + 2OH-1年前查看全部
- Ba(OH)2溶液滴入KAl(SO4)2溶液中,使SO42-全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( )
Ba(OH)2溶液滴入KAl(SO4)2溶液中,使SO42-全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( )
A.Al3+
B.Al(OH)3
C.AlO2-
D.Al3+和Al(OH)3 竹林斜影1年前1
竹林斜影1年前1 -
 阿会暔 共回答了15个问题
阿会暔 共回答了15个问题 |采纳率93.3%解题思路:设明矾KAl(SO4)2•12H2O为1mol,则溶液中含有1molK+、1molAl3+、2molSO42-,根据反应:SO42-+Ba2+═BaSO4↓,当溶液中的SO42-完全沉淀时,需要2molBa2+,即2molBa(OH)2,2molBa(OH)2中含有4molOH-,1molAl3+和4molOH-发生反应:Al3++4OH-═AlO2-+2H2O;铝元素的存在形式为:AlO2-.设明矾KAl(SO4)2•12H2O为1mol,则溶液中含有1molK+、1molAl3+、2molSO42-,根据反应:SO42-+Ba2+═BaSO4↓,当溶液中的SO42-完全沉淀时,需要2molBa2+,即2molBa(OH)2,2molBa(OH)2中含有4molOH-,1molAl3+和4molOH-发生反应:Al3++4OH-═AlO2-+2H2O;
铝元素的存在形式为:AlO2-,也可以写为[Al(OH)4]-形式.
故选C.点评:
本题考点: 镁、铝的重要化合物.
考点点评: 本题考查溶液中离子的共存,注意判断使SO42-全部转化成BaSO4沉淀需要Ba(OH)2的物质的量,根据Al3+和OH-物质的量的关系判断反应产物,题目难度中等.1年前查看全部
- 明矾与偏铝酸钠反映的离子方程式、、明矾是KAl(SO4)2啊
 wwwewew1年前1
wwwewew1年前1 -
 韵儿lh 共回答了17个问题
韵儿lh 共回答了17个问题 |采纳率88.2%明矾是KAl(SO4)2·12H2O,十二水合硫酸铝钾.
这个的离子方程式原理就是铝离子和偏铝酸根反应生成氢氧化铝沉淀,
Al^3+ +3AlO2- + 6H2O == 4Al(OH)3 (沉淀符号)
希望我的回答能够对你有所帮助1年前查看全部
- kal(so4)2+过量ba(oh)2方程式
 ailiyusuyin1年前2
ailiyusuyin1年前2 -
 fbcvl6 共回答了17个问题
fbcvl6 共回答了17个问题 |采纳率100%将BA(OH)2逐滴加入到KAL(SO4)2溶液中,初始时的离子反应方程式
3Ba2++6OH-+2Al3++3SO4 2-=3BaSO4+2Al(OH)3
继续滴加Ba(OH)2,在Al3+完全沉淀之后
2Al(OH)3+2OH-+Ba2++SO4 2-=2AlO2-+BaSO4+4H2O
所以
过量Ba(OH)2:Al3++(SO4)2-+Ba2++4OH-==BaSO4↓+AlO2-+2H2O
KAl(SO4)2+2Ba(OH)2=2BaSO4↓+KAlO2+2H2O1年前查看全部
- 向20ml 2mol/L的KAl(SO4)2溶液中加入30ml氢氧化钠溶液,充分反应后得到0.78g沉淀.则氢氧化钠溶液
向20ml 2mol/L的KAl(SO4)2溶液中加入30ml氢氧化钠溶液,充分反应后得到0.78g沉淀.则氢氧化钠溶液的物质的量浓度是?
 心向老仑1年前6
心向老仑1年前6 -
 yoovie 共回答了11个问题
yoovie 共回答了11个问题 |采纳率90.9%两种情况;1,OH-不足 2,OH-过量
若过量:Al3+ +3OH-=Al(OH)3
有0.04Mol的Al3+,如果全生成Al(OH)3,沉淀质量为0.04X78=3.12g,
所以存在下步反应:
Al(OH)3 +OH- = AlO2- + 2H20
最终只有0.78g沉淀,说明只有0.01Mol的Al(OH)3,还有0.03被二步反应,
则OH-一共存在0.04X3+0.03=0.15Mol,氢氧化钠溶液的物质的量浓度是0.15/0.03=5Mol/L
若不足:则只有第一步反应,即只有0.03MOL的OH-
氢氧化钠溶液的物质的量浓度是0.03/0.03=1Mol/L1年前查看全部
大家在问
- 1colour在什么情况下加Sshe has eight ( ).选择填空:1.colour 2 colours 3 a
- 2我市某校生物兴趣小组的同学做探究影响种子萌发的环境条件实验时,选取四个干净的锥形瓶,编号为甲、乙、丙、丁,分别放入20粒
- 3下列关于碳和碳的氧化物,说法正确的是( )
- 4根据语境填成语时间过得真快啊,六年的小学生活就要结束了。回想愉快的时光,我们可用成语( )、( )、 ( )来形容同学们
- 5,在△ABC中,BC = 8 cm,AB的垂直平分线交 AB于点D,交边AC于点E,△BCE的周长等于18 cm,则AC
- 6一个最简分数,若分子加上1,约分后得4分之3,若分子减1,约分后得2分之1,这个最简分数是多少、
- 7现在进行时,一般现在时,将来时,过去时的相同点和不同点
- 8(how to choose you love?)的翻译是什么
- 9Which newspaper do you think _____ young people in Australia
- 10帮我把这几句话,翻成英文你这人真是奇怪,不是说我死了吗,那么怎么又被货车撞死,真是神经.还有我不是说了,我当了天使了吗?
- 11已知ABCD是同一球面上的四点,且每两点间距离都等于2,则其外接球的面积是多少
- 12know-how和expertise的区别?
- 13关于台阶的话题能写什么样的作文啊
- 14下列有关物质的俗名正确的是( ) A.Na 2 CO 3 →小苏打 B.CuSO 4 ·5H 2 O →绿矾 C.
- 15加工一批零件,甲单独做20天完成,乙单独做每天完成这批零件的[1/25].现在两人合作完成这批零件的加工任务,甲中途休息
