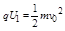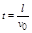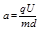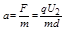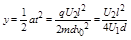向一价金属碘化物中加AgNO3溶液,到沉淀完全,生成硝酸盐质量是原碘化物质量,求原硝酸银质量分数
 oo下2022-10-04 11:39:541条回答
oo下2022-10-04 11:39:541条回答向一价金属的碘化物中逐滴滴加硝酸银溶液,直到沉淀完全为止,已知生成的硝酸盐溶液质量等于原碘化物溶液的质量,求原硝酸银溶液的质量分数?

已提交,审核后显示!提交回复
共1条回复
 嗅-嗅 共回答了15个问题
嗅-嗅 共回答了15个问题 |采纳率93.3%- 设未知金属为X
化学式为:XI+AgNO3=AgI(沉淀)+XNO3
则:XI溶液+AgNO3溶液-AgI=XNO3溶液
因为XI溶液=XNO3溶液,所以推出AgNO3溶液=AgI
所以AgNO3溶液中AgNO3的质量分数为:
170除以235=72.3% - 1年前
相关推荐
- 怎样确定共价化合物中元素化合价过氧化氢中一个氧原子形成了两对共用电子对,为什么是负一价?不应该是负二价吗
 Smaller-Dog1年前3
Smaller-Dog1年前3 -
 sundaniel 共回答了19个问题
sundaniel 共回答了19个问题 |采纳率94.7%O与O之间没有化合价,所以是-1价.我高中生,老师就这么解释的.1年前查看全部
- 正二价镁离子半径与负一价氯离子半径比较
 说心事1年前3
说心事1年前3 -
 断翅v笨鸟 共回答了14个问题
断翅v笨鸟 共回答了14个问题 |采纳率85.7%原子半径:Mg > Cl
镁原子失去2个电子,变成镁离子,电子层比氯离子,少了一个,离子半径变小
离子半径:Mg 2+< Cl-1年前查看全部
- 丁硼烷结构我不明白的地方:丁烷是C4H10,硼比碳少一价,怎么还是B4H10?描述清楚一些啊,谢
 b1nm1年前1
b1nm1年前1 -
 东方抽水 共回答了19个问题
东方抽水 共回答了19个问题 |采纳率94.7%这可是大学无机化学的内容了.那么就我以B4H10(乙硼烷)的结构为例:,H,H,H,|,H,H,,⌒B⌒,/,B,|,B,,/,∪B∪,,H,H,|,H,H,H其分子中桥键如:第四排的B与第三B相连中间还夹着一个H第四排和第五排都存在桥键所以所以使...1年前查看全部
- 您好?我想问的是,写氯化钠的化学式时为什么只选氯元素的负一价?氯元素有几个化合价呀!
 elei11年前3
elei11年前3 -
 lw1q2w3e4r5t 共回答了18个问题
lw1q2w3e4r5t 共回答了18个问题 |采纳率100%因为钠只有+1价,所以在氯化钠中,氯为-1价.氯还可以为+5价1年前查看全部
- LI-AL/FES电池是一种正在开发的车在电池,该电池正极的电极反应式为2LI(正一价)+FES+2e(负一价)===L
LI-AL/FES电池是一种正在开发的车在电池,该电池正极的电极反应式为2LI(正一价)+FES+2e(负一价)===LI2S+FE 正确的是..( )
A.LI-AL在电池中作为负极材料,该材料中LI里的化合价为正一价
B.该电池总反应式为2LI+FES===LI2S+FE
C.负极的电极反应式为AL—3e(负一价)===AL(正三价)
D.FES在正极发生氧化反应
求 ...全 rl19341年前2
rl19341年前2 -
 阿英_2007 共回答了18个问题
阿英_2007 共回答了18个问题 |采纳率88.9%1、化学变化:生成了其它物质的变化
2、物理变化:没有生成其它物质的变化
3、物理性质:不需要发生化学变化就表现出来的性质
(如:颜色、状态、密度、气味、熔点、沸点、硬度、水溶性等)
4、化学性质:物质在化学变化中表现出来的性质
(如:可燃性、助燃性、氧化性、还原性、酸碱性、稳定性等)
5、纯净物:由一种物质组成
6、混合物:由两种或两种以上纯净物组成,各物质都保持原来的性质
7、元素:具有相同核电荷数(即质子数)的一类原子的总称
8、原子:是在化学变化中的最小粒子,在化学变化中不可再分
9、分子:是保持物质化学性质的最小粒子,在化学变化中可以再分
10、单质:由同种元素组成的纯净物
11、化合物:由不同种元素组成的纯净物
12、氧化物:由两种元素组成的化合物中,其中有一种元素是氧元素
13、化学式:用元素符号来表示物质组成的式子
14、相对原子质量:以一种碳原子的质量的1/12作为标准,其它原子的质量跟它比较所得的值
某原子的相对原子质量=
相对原子质量 ≈ 质子数 + 中子数 (因为原子的质量主要集中在原子核)
15、相对分子质量:化学式中各原子的相对原子质量的总和
16、离子:带有电荷的原子或原子团
17、原子的结构:
原子、离子的关系:
注:在离子里,核电荷数 = 质子数 ≠ 核外电子数
18、四种化学反应基本类型:
①化合反应: 由两种或两种以上物质生成一种物质的反应
如:A + B = AB
②分解反应:由一种物质生成两种或两种以上其它物质的反应
如:AB = A + B
③置换反应:由一种单质和一种化合物起反应,生成另一种单质和另一种化合物的反应
如:A + BC = AC + B
④复分解反应:由两种化合物相互交换成分,生成另外两种化合物的反应
如:AB + CD = AD + CB
19、还原反应:在反应中,含氧化合物的氧被夺去的反应(不属于化学的基本反应类型)
氧化反应:物质跟氧发生的化学反应(不属于化学的基本反应类型)
缓慢氧化:进行得很慢的,甚至不容易察觉的氧化反应
自燃:由缓慢氧化而引起的自发燃烧
20、催化剂:在化学变化里能改变其它物质的化学反应速率,而本身的质量和化学性在化学变化前后都没有变化的物质(注:2H2O2 === 2H2O + O2 ↑ 此反应MnO2是催化剂)
21、质量守恒定律:参加化学反应的各物质的质量总和,等于反应后生成物质的质量总和.
(反应的前后,原子的数目、种类、质量都不变;元素的种类也不变)
22、溶液:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物
溶液的组成:溶剂和溶质.(溶质可以是固体、液体或气体;固、气溶于液体时,固、气是溶质,液体是溶剂;两种液体互相溶解时,量多的一种是溶剂,量少的是溶质;当溶液中有水存在时,不论水的量有多少,我们习惯上都把水当成溶剂,其它为溶质.)
23、固体溶解度:在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量,就叫做这种物质在这种溶剂里的溶解度
24、酸:电离时生成的阳离子全部都是氢离子的化合物
如:HCl==H+ + Cl -
HNO3==H+ + NO3-
H2SO4==2H+ + SO42-
碱:电离时生成的阴离子全部都是氢氧根离子的化合物
如:KOH==K+ + OH -
NaOH==Na+ + OH -
Ba(OH)2==Ba2+ + 2OH -
盐:电离时生成金属离子和酸根离子的化合物
如:KNO3==K+ + NO3-
Na2SO4==2Na+ + SO42-
BaCl2==Ba2+ + 2Cl -
25、酸性氧化物(属于非金属氧化物):凡能跟碱起反应,生成盐和水的氧化物
碱性氧化物(属于金属氧化物):凡能跟酸起反应,生成盐和水的氧化物
26、结晶水合物:含有结晶水的物质(如:Na2CO3 .10H2O、CuSO4 . 5H2O)
27、潮某物质能吸收空气里的水分而变潮的现象
风化:结晶水合物在常温下放在干燥的空气里,
能逐渐失去结晶水而成为粉末的现象
28、燃烧:可燃物跟氧气发生的一种发光发热的剧烈的氧化反应
燃烧的条件:①可燃物;②氧气(或空气);③可燃物的温度要达到着火点.
基本知识、理论:
1、空气的成分:氮气占78%, 氧气占21%, 稀有气体占0.94%,
二氧化碳占0.03%,其它气体与杂质占0.03%
2、主要的空气污染物:NO2 、CO、SO2、H2S、NO等物质
3、其它常见气体的化学式:NH3(氨气)、CO(一氧化碳)、CO2(二氧化碳)、CH4(甲烷)、
SO2(二氧化硫)、SO3(三氧化硫)、NO(一氧化氮)、
NO2(二氧化氮)、H2S(硫化氢)、HCl(氯化氢)
4、常见的酸根或离子:SO42-(硫酸根)、NO3-(硝酸根)、CO32-(碳酸根)、ClO3-(氯酸)、
MnO4-(高锰酸根)、MnO42-(锰酸根)、PO43-(磷酸根)、Cl-(氯离子)、
HCO3-(碳酸氢根)、HSO4-(硫酸氢根)、HPO42-(磷酸氢根)、
H2PO4-(磷酸二氢根)、OH-(氢氧根)、HS-(硫氢根)、S2-(硫离子)、
NH4+(铵根或铵离子)、K+(钾离子)、Ca2+(钙离子)、Na+(钠离子)、
Mg2+(镁离子)、Al3+(铝离子)、Zn2+(锌离子)、Fe2+(亚铁离子)、
Fe3+(铁离子)、Cu2+(铜离子)、Ag+(银离子)、Ba2+(钡离子)
各元素或原子团的化合价与上面离子的电荷数相对应:课本P80
一价钾钠氢和银,二价钙镁钡和锌;
一二铜汞二三铁,三价铝来四价硅.(氧-2,氯化物中的氯为 -1,氟-1,溴为-1)
(单质中,元素的化合价为0 ;在化合物里,各元素的化合价的代数和为0)
5、化学式和化合价:
(1)化学式的意义:①宏观意义:a.表示一种物质;
b.表示该物质的元素组成;
②微观意义:a.表示该物质的一个分子;
b.表示该物质的分子构成;
③量的意义:a.表示物质的一个分子中各原子个数比;
b.表示组成物质的各元素质量比.
(2)单质化学式的读写
①直接用元素符号表示的:a.金属单质.如:钾K 铜Cu 银Ag 等;
b.固态非金属.如:碳C 硫S 磷P 等
c.稀有气体.如:氦(气)He 氖(气)Ne 氩(气)Ar等
②多原子构成分子的单质:其分子由几个同种原子构成的就在元素符号右下角写几.
如:每个氧气分子是由2个氧原子构成,则氧气的化学式为O2
双原子分子单质化学式:O2(氧气)、N2(氮气) 、H2(氢气)
F2(氟气)、Cl2(氯气)、Br2(液态溴)
多原子分子单质化学式:臭氧O3等
(3)化合物化学式的读写:先读的后写,后写的先读
①两种元素组成的化合物:读成“某化某”,如:MgO(氧化镁)、NaCl(氯化钠)
②酸根与金属元素组成的化合物:读成“某酸某”,如:KMnO4(高锰酸钾)、K2MnO4(锰酸钾)
MgSO4(硫酸镁)、CaCO3(碳酸钙)
(4)根据化学式判断元素化合价,根据元素化合价写出化合物的化学式:
①判断元素化合价的依据是:化合物中正负化合价代数和为零.
②根据元素化合价写化学式的步骤:
a.按元素化合价正左负右写出元素符号并标出化合价;
b.看元素化合价是否有约数,并约成最简比;
c.交叉对调把已约成最简比的化合价写在元素符号的右下角.
6、课本P73. 要记住这27种元素及符号和名称.
核外电子排布:1-20号元素(要记住元素的名称及原子结构示意图)
排布规律:①每层最多排2n2个电子(n表示层数)
②最外层电子数不超过8个(最外层为第一层不超过2个)
③先排满内层再排外层
注:元素的化学性质取决于最外层电子数
金属元素 原子的最外层电子数< 4,易失电子,化学性质活泼.
非金属元素 原子的最外层电子数≥ 4,易得电子,化学性质活泼.
稀有气体元素 原子的最外层有8个电子(He有2个),结构稳定,性质稳定.
7、书写化学方程式的原则:①以客观事实为依据; ②遵循质量守恒定律
书写化学方程式的步骤:“写”、“配”、“注”“等”.
8、酸碱度的表示方法——PH值
说明:(1)PH值=7,溶液呈中性;PH值7,溶液呈碱性.
(2)PH值越接近0,酸性越强;PH值越接近14,碱性越强;PH值越接近7,溶液的酸、碱性就越弱,越接近中性.
9、金属活动性顺序表:
(钾、钙、钠、镁、铝、锌、铁、锡、铅、氢、铜、汞、银、铂、金)
说明:(1)越左金属活动性就越强,左边的金属可以从右边金属的盐溶液中置换出该金属出来
(2)排在氢左边的金属,可以从酸中置换出氢气;排在氢右边的则不能.
(3)钾、钙、钠三种金属比较活泼,它们直接跟溶液中的水发生反应置换出氢气1年前查看全部
- 核外有10个电子的二价阳离子是什么?核外有18个电子的负一价阴离子.
 xiao55201年前1
xiao55201年前1 -
 泥泞留痕2 共回答了23个问题
泥泞留痕2 共回答了23个问题 |采纳率82.6%即失去2个电子还有10个,则原核外有10+2个电子,所以是镁.得到一个电子核外变成18个电子,则原核外有18-1个电子,是氯1年前查看全部
- 一秒钟内共有n个二价正离子和m个一价负离子通过面积为0.1平方米的某面积,求这个截面的电流强度?(求详解
 lao6tou1年前1
lao6tou1年前1 -
 76149174 共回答了14个问题
76149174 共回答了14个问题 |采纳率92.9%如果同向,电流是:[(2n-m)/0.1]/6.25*10^18=(2n-m)*1.6*10^(-18)
如果反向,同理可得电流是:
(2n+m)*1.6*10^(-18)1年前查看全部
- 3个硫酸根离子恰好将2个(XO4)负一价离子还原,则X元素在还原产物中的化合价是多少?
3个硫酸根离子恰好将2个(XO4)负一价离子还原,则X元素在还原产物中的化合价是多少?
如题. PS:“(XO4)负一价”里面4是下标. 题目简略过程高一的我能看懂. 鞠躬,谢谢.
 yuwenyao_20001年前1
yuwenyao_20001年前1 -
 lanjiaguang2008 共回答了16个问题
lanjiaguang2008 共回答了16个问题 |采纳率87.5%根据得失电子守恒可得出+2价1年前查看全部
- 氢元素为什么只显一价有时显正一价,有时显负一价,是跟电子数有关吗?
 41000181年前3
41000181年前3 -
 ryan_zyw 共回答了18个问题
ryan_zyw 共回答了18个问题 |采纳率94.4%因为它最外层(只有一层电子)电子只有一个,失去就显正一价,而最内层电子最多为2个,所以得到电子是只得1个就显负一价了.1年前查看全部
- (2010•天津模拟)如图所示,真空中有一个固定的点电荷,电荷量为+Q,虚线表示该点电荷电场中的等势面.两个一价离子M、
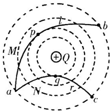 (2010•天津模拟)如图所示,真空中有一个固定的点电荷,电荷量为+Q,虚线表示该点电荷电场中的等势面.两个一价离子M、N(不计重力和它们之间的电场力)先后从a点以相同的速率v0射入该电场,运动轨迹分别为曲线a→b和a→c,其中b、c两点在同一等势面上,p、q分别是它们离固定点电荷最近的位置.下列说法中正确的是( )
(2010•天津模拟)如图所示,真空中有一个固定的点电荷,电荷量为+Q,虚线表示该点电荷电场中的等势面.两个一价离子M、N(不计重力和它们之间的电场力)先后从a点以相同的速率v0射入该电场,运动轨迹分别为曲线a→b和a→c,其中b、c两点在同一等势面上,p、q分别是它们离固定点电荷最近的位置.下列说法中正确的是( )
A.M、N都是正离子
B.M在p点的速率小于N在q点的速率
C.M从a→b的电势能先减小后增大
D.M从p→b过程电场力做的功等于N从a→q过程电场力做的功 yjy01111年前1
yjy01111年前1 -
 转基因人类 共回答了13个问题
转基因人类 共回答了13个问题 |采纳率76.9%解题思路:根据轨迹判定电荷N受到中心电荷的斥力,而电荷M受到中心电荷的引力,可知两粒子在从a向b、c运动过程中电场力做功情况.根据abc三点在同一等势面上,可判定从a到b和从a到c过程中电场力所做的总功为零.A、由图可知电荷N受到中心电荷+Q的斥力,而电荷M受到中心电荷+Q的引力,故两粒子的电性一定不同.由于中心电荷为正电,则M一定是负离子,N一定是正离子,故A错误;
B、由图可判定M电荷在运动过程中,电场力做正功,导致动能增加;而N电荷在运动过程中,电场力做负功,导致动能减小.所以在p点的速率一定大于N在q点的速率,故B错误;
C、电场力对M离子先做正功后做负功,则M从a→b的电势能先减小后增大.故C正确.
D、由图可知:p、b间电势差小于a、q间电势差,根据电场力做功W=Uq知,M从p→b过程电场力做的功小于N从a→q过程电场力做的功.故D错误.
故选C点评:
本题考点: 电势能;物体做曲线运动的条件;动能定理的应用.
考点点评: 根据轨迹判定“电荷N受到中心电荷的斥力,而电荷M受到中心电荷的引力”是解决本题的突破口.1年前查看全部
- 某电解池,如果在1s内共有5×1018个二价正离子和1×1019个一价负离子通过面积为0.1m2的某截面,那么通过这个截
某电解池,如果在1s内共有5×1018个二价正离子和1×1019个一价负离子通过面积为0.1m2的某截面,那么通过这个截面的电流是( )
A. 0
B. 0.8A
C. 1.6A
D. 3.2A shww0428851年前2
shww0428851年前2 -
 我来深圳干吗 共回答了25个问题
我来深圳干吗 共回答了25个问题 |采纳率88%解题思路:由题计算出1s内通过截面正离子与负离子电量绝对值之和,根据电流的定义式求解电流.一价离子所带电量大小为e=1.6×10-19C.由题,1s内通过截面正离子的电量为q1=2n1e,负离子的电量绝对值为q2=n2e,则电流为I=
q1+q2
t=
(2n1+n2)e
t,将n1=5×1018个,n2=1×1019个,e=1.6×10-19C代入解得,I=3.2A
故选D点评:
本题考点: 电流、电压概念.
考点点评: 本题是电流定义式的应用,关键确定通过导体截面的电量,当电流由正负离子向相反方向定向移动形成时,电量等于正离子与负离子电量绝对值之和.1年前查看全部
- 老师说过氧化钠是钠离子和过氧根离子组成的 过氧根离子是负一价为什么还需要两个钠离子 这样子的话电子数就没办法为零啦
 xiaoqin19921年前1
xiaoqin19921年前1 -
 sun198385 共回答了18个问题
sun198385 共回答了18个问题 |采纳率94.4%1年前查看全部
- 如图所示,真空中有一个固定的点电荷,电荷量为+Q.图中的虚线表示该点电荷形成的电场中的等势面.有两个一价离子M、N(不计
如图所示,真空中有一个固定的点电荷,电荷量为+Q.图中的虚线表示该点电荷形成的电场中的等势面.有两个一价离子M、N(不计重力,也不计它们之间的电场力)先后从a点以相同的速率v0射入该电场,运动轨迹分别为曲线apb和aqc,其中p、q分别是它们离固定点电荷最近的位置.以下说法正确的是( )
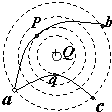 A. M是负离子,N是正离子
A. M是负离子,N是正离子
B. a→p→b过程中电场力先做负功再做正功
C. M在b点的速率大于N在c的速率
D. M从p→b过程中电势能的增量小于N从a→q电势能的增量 hyb6661年前2
hyb6661年前2 -
 5203000 共回答了18个问题
5203000 共回答了18个问题 |采纳率83.3%解题思路:根据轨迹判定电荷N受到中心电荷的斥力,而电荷M受到中心电荷的引力,可知两粒子在从a向b、c运动过程中电场力做功情况.根据abc三点在同一等势面上,可判定从a到b和从a到c过程中电场力所做的总功为零.A、由图可知电荷N受到中心电荷的斥力,而电荷M受到中心电荷的引力,故两粒子的电性一定不同.由于中心电荷为正电,则M一定是负离子,N一定是正离子,故A正确;
B、由图可判定M电荷在a→p→b运动过程中,先是动力,后是阻力,则电场力先做正功,后做负功,故B错误;
C、由于abc三点在同一等势面上,故粒子M在从a向b运动过程中电场力所做的总功为0,N粒子在从a向c运动过程中电场力所做的总功为0.由于两粒子以相同的速率从a点飞入电场故两粒子的分别经过b、c两点时的速率一定相等.故C错误.
D、由图可知q点离正电荷更近一些,N粒子在从a向q运动过程中电场力做负功的值大于粒子M在从p向b运动过程中电场力做负功的值,故M从p→b过程电势能的增量一定小于N从a→q电势能的增量.故D正确.
故选:AD.点评:
本题考点: 等势面;电势能.
考点点评: 根据轨迹判定“电荷N受到中心电荷的斥力,而电荷M受到中心电荷的引力”是解决本题的突破口.1年前查看全部
- H O S 三种元素可形成甲、乙两种粒子,它们均为负一价双原子阴离子且甲有18个电子,乙有10个电子,则%
H O S 三种元素可形成甲、乙两种粒子,它们均为负一价双原子阴离子且甲有18个电子,乙有10个电子,则%
RT
RT:H O S 三种元素可形成甲、乙两种粒子,它们均为负一价双原子阴离子且甲有18个电子,乙有10个电子,则甲和乙反应的离子方程式 abcdefg9871年前4
abcdefg9871年前4 -
 aoeitlaetjo 共回答了17个问题
aoeitlaetjo 共回答了17个问题 |采纳率94.1%知道了是负一价阴离子,且为双原子,就可知,这甲、乙两种粒子分别是HS根和OH根.
为什么这么说?负一价,说明两个粒子都是多一个电子,除去这个多余的电子,那甲、乙两种粒子就成为不带电的双原子组合,一种组合的双原子带17个电子,另一个组合带9个电子,至此,这更象一道数学题了!
H 带一个电子,S带16个电子,O带8个电子
显然这两个组合是HS和OH组合,再加上一个负一价符号,就出来了!
方程式:HS- + OH- =H20 +S 2-1年前查看全部
- 钾钠银氢正一价,钙镁钡锌正二价;铝是正三氧负二,氯负一价最常见;硫有负二正四六,
钾钠银氢正一价,钙镁钡锌正二价;铝是正三氧负二,氯负一价最常见;硫有负二正四六,
正二正三铁可变;正一二铜二四碳,单质零价永不变;
其它元素有变价,先死后活来计算.
只解释最后一句就行了:其它元素有变价,先死后活来计算。 missph1年前3
missph1年前3 -
 danielcai303 共回答了17个问题
danielcai303 共回答了17个问题 |采纳率82.4%这个公式用来解释化合价常见价态,用于确定某一个物质中元素的比例,确定相应的化学式1年前查看全部
- 疑难解答——羟基羟基是中性的吗?如果是,那为什么又说是一价原子团?(我才刚念完初中,麻烦解释得清楚些,不甚感激!)
 fsdaf54d4d541年前5
fsdaf54d4d541年前5 -
 wxdwxd2006 共回答了17个问题
wxdwxd2006 共回答了17个问题 |采纳率100%羟基和氢氧根离子的概念是不同的.
氢氧根离子写作OH-,带有1个单元负电荷.氢氧根离子核外总电子数为10.
羟基写作-OH,其中“-”表示半个共价键,他的意思是,一个羟基能够和另一个原子生成一个共价键,所以称为一价原子团.羟基中,氢原子和氧原子形成一个共价键,氧原子还有未成对电子.羟基不带电,核外总电子数为9.1年前查看全部
- 把下列离子方程式改写为化学方程式SO2+2OH负一价====SO3负二价+H2O
 sukaling1年前1
sukaling1年前1 -
 yan13784787913 共回答了22个问题
yan13784787913 共回答了22个问题 |采纳率68.2%2MOH+SO2(少量)=M2SO3+H2O
M代表碱金属离子,如Na+,K+等1年前查看全部
- 谁来帮我解一道物理题?急用!某电解池,如果在1S内共有5乘以10的18次方个二价正离子和1乘以10的19次方个一价负离子
谁来帮我解一道物理题?急用!
某电解池,如果在1S内共有5乘以10的18次方个二价正离子和1乘以10的19次方个一价负离子通过某截面,那么通过这截面的电流是?
用什么知识解决?什么公式?这是高中题不要用大学知识解决!) 爱你没一天1年前1
爱你没一天1年前1 -
 武猪脸cc 共回答了14个问题
武猪脸cc 共回答了14个问题 |采纳率85.7%I=Q/t=(Q正-Q负)/t=(N正*e-N负*(-e))/t=((N正+N负)*e/t=((5*10^18*2+1*10^19)*1.6*10^-19/1)A=3.2A
N是离子个数,e是电子/质子电量.大小是1.6*10^-191年前查看全部
- 工业盐酸中因含有正3价Fe而呈黄色.若某工业盐酸中一价H、负一价Cl的个数比为91:94
工业盐酸中因含有正3价Fe而呈黄色.若某工业盐酸中一价H、负一价Cl的个数比为91:94
工业盐酸中因含有正3价Fe而呈黄色.若某工业盐酸中一价H、负一价Cl的个数比为91:94,则该盐酸中三价Fe和负一价Cl的个数比为? 桃子呼呼1年前1
桃子呼呼1年前1 -
 cbowroad 共回答了13个问题
cbowroad 共回答了13个问题 |采纳率92.3%∵一价H、负一价Cl的个数比为91:94
设有91x个H+和94x个Cl-,则91个H+带有91个单位的正电荷;94个Cl-带有94个单位的负电荷;由于溶液呈电中性,所以剩下的94-91=3个单位的正电荷由Fe3+承担,由于铁+3价,所以只需一个,
因此可得三价Fe和负一价Cl的个数比1:941年前查看全部
- )A、B、C、D、E五种短周期元素的原子序数依次增大.元素A的负一价离子具有和稀有气体He一样的结构,元素B的最外层电子
)A、B、C、D、E五种短周期元素的原子序数依次增大.元素A的负一价离子具有和稀有气体He一样的结构,元素B的最外层电子数是内层电子总数的2倍,元素C是短周期元素中原子半径最大的主族元素,元素D在地壳中的含量位于第二位,元素E的单质是黄绿色气体.请回答下列问题:
(1)在周期表中,元素B位于第 周期第族;A与C形成的离子化合物的化学式为;
A与C形成的离子化合物与水反应的化学方程式为.
(2)C形成的简单离子的离子结构示意图为.
(3)D、E元素形成的化合物可与水反应生成一种沉淀和一种气体,试写出该反应的化学方程式:.
(4)B的单质能与NaOH溶液反应,写出反应的离子方程式:. 大kk袍1年前0
大kk袍1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 如图所示,一价氢离子和二价氦离子(不考虑二者间的相互作用),从静止开始经过同一加速电场加速,垂直打入偏转电场中,则它们(
如图所示,一价氢离子和二价氦离子(不考虑二者间的相互作用),从静止开始经过同一加速电场加速,垂直打入偏转电场中,则它们( ) A.同时离开偏转电场,但出射点的位置不同 B.同时离开偏转电场,出射点的位置相同 C.先后离开偏转电场,但出射点的位置相同 D.先后离开偏转电场,且出射点的位置不同 
 轮子上的人1年前1
轮子上的人1年前1 -
 江南_万事 共回答了16个问题
江南_万事 共回答了16个问题 |采纳率87.5%设加速电压为U 1 ,偏转电压为U 2 ,偏转极板的长度为L,板间距离为d.
在加速电场中,由动能定理得:qU 1 =
1
2 m v 0 2 得,加速获得的速度为v 0 =
2q U 1
m ,两种粒子在偏转电场中,水平方向做速度为v 0 的匀速直线运动,由于两种粒子的比荷不同,则v 0 不同,所以两粒子在偏转电场中运动的时间不同.两种粒子在加速电场中的加速度不同,位移相同,则运动的时间也不同,所以两粒子是先后离开偏转电场.
在偏转电场中的偏转位移y=
1
2 a t 2 =
1
2 ?
q U 2
md
L 2
v 0 2 =
U 2 L 2
4d U 1 ,与电荷的电量和质量无关.知出射点的位置相同.故C正确,A、B、D错误.
故选C.1年前查看全部
- 电解质溶液中电解质溶液中有n个一价正离子
电解质溶液中电解质溶液中有n个一价正离子
若电解质溶液中有n个一价正离子和n个一价负离子反向移动,则负价离子也为电流的形成作出了贡献,则在t秒内电解质中的电流为2ne/t.
但是若题目说:在t秒内,有n个一价正离子回到负极,则电解质溶液中的电流是多少?
(答案说是ne/t)
若是某探测器因射线照射其内部气体电离,t秒内有n个二价正离子到阴极,2n个电子到阳极,则此探测器中电流为?(答案说是4ne/t) tianfangke1年前2
tianfangke1年前2 -
 kimiko0519 共回答了22个问题
kimiko0519 共回答了22个问题 |采纳率100%可以用转化法,把负电看为不带电,相应的,正电荷的量要增加.比如说,n个一价正离子和n个一价负离子反向移动,相当于没有负电,而2n个正电在移动.但是要注意方向,负电和正电的方向相反才能增加,相同就减少了.1年前查看全部
- 有四种物质的量浓度相等、且都由一价阳离子A+和B+及一价阴离子X-和Y-组成的盐溶液.据测定常温下AX和BY溶液的pH=
有四种物质的量浓度相等、且都由一价阳离子A+和B+及一价阴离子X-和Y-组成的盐溶液.据测定常温下AX和BY溶液的pH=7,AY溶液的pH>7,BX溶液的pH<7,由此判断不水解的盐是( )
A.BX
B.AX
C.AY
D.BY feiyunsong1年前1
feiyunsong1年前1 -
 阿_萌 共回答了28个问题
阿_萌 共回答了28个问题 |采纳率92.9%解题思路:AY溶液的PH>7,显碱性,说明A相对于Y为强碱性物质,Y相对于A来说属弱酸性物质;同理BX溶液的pH<7,X为强酸性物质,B为弱碱性物质;不能水解,意味着是由强酸和强碱组成的物质,组成只有一种,即AX;AY溶液的PH>7,显碱性,说明A相对于Y为强碱性物质,Y相对于A来说属弱酸性物质;同理BX溶液的pH<7,X为强酸性物质,B为弱碱性物质;据测定常温下AX和BY溶液的pH=7,说明BY是弱离子写成的弱酸弱碱盐且水解程度相同,溶液呈中性,AX为强酸强碱盐不能水解,由强酸和强碱组成的物质,组成只有一种,即AX;
故选B.点评:
本题考点: 盐类水解的原理.
考点点评: 本题考查盐类水解的规律应用,溶液酸碱性的判断能水解离子的分析是解题关键,题目难度中等.1年前查看全部
- 一道高中化学概念理解题.为什么碳化钙里碳的化合价为负一价?
 2708191年前1
2708191年前1 -
 smartbaby1113 共回答了17个问题
smartbaby1113 共回答了17个问题 |采纳率94.1%钙的金属性很强,只能是正2价的1年前查看全部
- 氢氧根化学键的问题.氢氧根不是通过共价键而生成的吗?怎么会显负一价?它是离子化合物还是共价化合物?
 永远抹不去的伤痕1年前3
永远抹不去的伤痕1年前3 -
 yy与无双 共回答了11个问题
yy与无双 共回答了11个问题 |采纳率72.7%氢氧根是通过共价键结合在一起的,氧的最外层电子数为6,氢的最外层电子数为1,它们通过共用电子对结合在一起,但还缺少一个电子,氧要达到8电子结构,所以从外界得到一个电子,整个离子团就带一个单位的负电荷.1年前查看全部
- 一价烷烃基结构简式是什么啊 什么叫一价烷烃基
 renzhankk1年前2
renzhankk1年前2 -
 christoph_sun 共回答了9个问题
christoph_sun 共回答了9个问题 |采纳率77.8%-CH3就是一价烷烃基1年前查看全部
- 如图所示,一价氢离子和二价氦离子(不考虑二者间的相互作用),从静止开始经过同一加速电场加速,垂直打入偏转电场中,则它们(
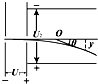 如图所示,一价氢离子和二价氦离子(不考虑二者间的相互作用),从静止开始经过同一加速电场加速,垂直打入偏转电场中,则它们( )
如图所示,一价氢离子和二价氦离子(不考虑二者间的相互作用),从静止开始经过同一加速电场加速,垂直打入偏转电场中,则它们( )
A.同时离开偏转电场,但出射点的位置不同
B.同时离开偏转电场,出射点的位置相同
C.先后离开偏转电场,但出射点的位置相同
D.先后离开偏转电场,且出射点的位置不同 junlong5211年前1
junlong5211年前1 -
 梦幻现在 共回答了20个问题
梦幻现在 共回答了20个问题 |采纳率85%设加速电压为U1,偏转电压为U2,偏转极板的长度为L,板间距离为d.
在加速电场中,由动能定理得:qU1=
1
2mv02得,加速获得的速度为v0=
2qU1
m,两种粒子在偏转电场中,水平方向做速度为v0的匀速直线运动,由于两种粒子的比荷不同,则v0不同,所以两粒子在偏转电场中运动的时间不同.两种粒子在加速电场中的加速度不同,位移相同,则运动的时间也不同,所以两粒子是先后离开偏转电场.
在偏转电场中的偏转位移y=
1
2at2=
1
2•
qU2
md
L2
v02=
U2L2
4dU1,与电荷的电量和质量无关.知出射点的位置相同.故C正确,A、B、D错误.
故选C.1年前查看全部
- Y和Z两种元素可以形成4核42个电子的负一价阴离子.
 再见蓝鸟1年前1
再见蓝鸟1年前1 -
 冰-雪-儿 共回答了23个问题
冰-雪-儿 共回答了23个问题 |采纳率73.9%4个原子1年前查看全部
- sihcl3的化合价问题SiHCl3中硅是几价的?氢是几价的?如果氢是负一价是否是因为硅的金属性太强?
 传说中的尤太人1年前2
传说中的尤太人1年前2 -
 chen0324 共回答了15个问题
chen0324 共回答了15个问题 |采纳率93.3%氢只有和碱金属化合时是-1价,这里是+1价,而Cl是-1价,硅是+2价.
化合价是高中问题,在大学化学中是只谈氧化数而不谈化合价的.1年前查看全部
- 钾离子和氯离子(负一价)哪个半径大?为什么?
 solgen1年前1
solgen1年前1 -
 秋林就是迷人 共回答了17个问题
秋林就是迷人 共回答了17个问题 |采纳率94.1%氯离子大,核外电子数相同,钾离子质子数多,对核外电子的引力大,所以半径比氯离子小1年前查看全部
- 为什么氢元素可以形成一价氢离子不是要核外2个电子才能稳定吗.
 wpym5d8rc65061年前2
wpym5d8rc65061年前2 -
 易水萧 共回答了15个问题
易水萧 共回答了15个问题 |采纳率86.7%你理解错了,不只是2e- 8e-结构才稳定,还有0 ,6 ,10等电子也是稳定结构,如H- (NaH)是0e-稳定结构,BF3中B就是6e-稳定结构,PCl5中P是10e-稳定结构.
氢元素中的氢原子最外层有一个电子,它可以得一个电子或共用一对电子达到2e-稳定结构;也可以失去一个电子达到0e-稳定结构,所以氢离子有:H- 和H+.1年前查看全部
- 向一价金属的碘化物向一价金属碘化物中加AgNO3溶液,到沉淀完全,生成硝酸盐质量是原碘化物质量,求原硝酸银质量分数 为什
向一价金属的碘化物
向一价金属碘化物中加AgNO3溶液,到沉淀完全,生成硝酸盐质量是原碘化物质量,求原硝酸银质量分数 为什么是两分子量之比?、 yutaiyuan1年前1
yutaiyuan1年前1 -
 舞青云 共回答了18个问题
舞青云 共回答了18个问题 |采纳率100%溶液质量就是:108+127(沉淀的质量)
溶质质量就是:108+62(产生沉淀需要的溶质)1年前查看全部
- 某电解池,如果在1s内共有5×1018个二价正离子和1×1019个一价负离子通过面积为0.1m2的某截面,那么通过这个截
某电解池,如果在1s内共有5×1018个二价正离子和1×1019个一价负离子通过面积为0.1m2的某截面,那么通过这个截面的电流是
请详细分析具体原因
即电解池为何这样算的具体原因 xhanz1年前1
xhanz1年前1 -
 带刺的蚂蚁 共回答了15个问题
带刺的蚂蚁 共回答了15个问题 |采纳率93.3%解析:根据公式I=Q/t,可以运算
Q=(5×10^18+1×10^19)*1.6×10^-19=2.4库
t=1s,所以I=2.4安1年前查看全部
- 请教负一价碘离子是什么颜色?
 易寅1年前1
易寅1年前1 -
 言弈 共回答了16个问题
言弈 共回答了16个问题 |采纳率93.8%无色.加碘食盐中加有KI,你看看不是没颜色么!有时KI会被氧化生成碘单质,使食盐发黄.1年前查看全部
- 银氨的化学式有问题啊银氨的化学式是 Ag(NH3)2OH那如果银是+1价, NH3是+1价 OH是负一价那总的化合价是+
银氨的化学式有问题啊
银氨的化学式是 Ag(NH3)2OH
那如果银是+1价, NH3是+1价 OH是负一价
那总的化合价是+2不对了啊 怎么回事?
 lchy8881年前1
lchy8881年前1 -
 蜻蜓咬尾巴 共回答了17个问题
蜻蜓咬尾巴 共回答了17个问题 |采纳率94.1%NH3 是化合物,不显价态的.为01年前查看全部
- 双氧水中为什么氧元素显负一价?
 维嘉思U21年前2
维嘉思U21年前2 -
 angeryhuang 共回答了10个问题
angeryhuang 共回答了10个问题 |采纳率100%首先,LZ的问题表述有点问题,双氧水是过氧化氢(H2O2)的水溶液,是混合物.
H2O2分子结构式:H-O-O-H(实际是空间折线形分子).
H和O元素结合,共价键中电子对偏向O,因此H+1价,O-1价.
过氧键O-O是非极性键,电子对不偏向任何一方,对化合价的贡献是0.
2个H都为+1价,2个O都为-1价.因此总体来看,平均价态H为+1价,O为-1价.
====
[原创回答团]1年前查看全部
- 过氧化氢中的氧元素为何显示负一价?
过氧化氢中的氧元素为何显示负一价?
我们都知道,在学习化学变化时,要用到化学方程式和化学式.
一般我们所写的化学式中氧元素通常显示负二价,
但为什么在过氧化氢中氧元素显示的是负一价? 海外游客之傲视1年前1
海外游客之傲视1年前1 -
 zxp633696 共回答了17个问题
zxp633696 共回答了17个问题 |采纳率94.1%过氧根是一个整体 他们一起显负二价 一般不拆开看的...1年前查看全部
- 为什么双氧中氧元素是负一价?
 埃芬1年前4
埃芬1年前4 -
 seatlenight 共回答了20个问题
seatlenight 共回答了20个问题 |采纳率85%不是氧元素为-1价,而是过氧离子为-2价(O2^2-),两个氧原子呈共价态,对外显-2价.还有超氧离子是-1价(O2^-),你能说氧元素呈-0.5价吗?1年前查看全部
- 1mol FeCl3能电离生成3价铁离子物质的量为多少?负一价Cl离子物质的量为多少?
 失魂的公主1年前4
失魂的公主1年前4 -
 ji168 共回答了15个问题
ji168 共回答了15个问题 |采纳率93.3%1mol FeCl3能电离生成3价铁离子物质的量为1mol?负一价Cl离子物质的量为3mol?1年前查看全部
- 如右图所示,一价氢离子和二价氦离子(不考虑二者间的相互作用),从静止开始经过同一加速电场加速,垂直打入偏转电场中,则它们
如右图所示,一价氢离子和二价氦离子(不考虑二者间的相互作用),从静止开始经过同一加速电场加速,垂直打入偏转电场中,则它们()

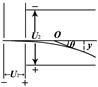
A.同时离开偏转电场,但出射点的位置不同 B.同时离开偏转电场,出射点的位置相同 C.先后离开偏转电场,但出射点的位置相同 D.先后离开偏转电场,且出射点的位置不同  stonegyy1年前1
stonegyy1年前1 -
 冰随风飘 共回答了14个问题
冰随风飘 共回答了14个问题 |采纳率85.7%1年前查看全部
- NH4HCO3 NaHCO3 Na2CO3三种溶液中负一价阴离子的浓度由大到小的顺序为?
NH4HCO3 NaHCO3 Na2CO3三种溶液中负一价阴离子的浓度由大到小的顺序为?
氢氧根除外. duckweed9151年前1
duckweed9151年前1 -
 makeliuma 共回答了21个问题
makeliuma 共回答了21个问题 |采纳率95.2%碳酸氢根 NaHCO3>NH4HCO3>Na2CO3
首先前两种物质HCO3-是主要的,Na2CO3主要含CO3 2-
NH4+ 会促进HCO3-水解
所以
碳酸氢根 NaHCO3>NH4HCO3>Na2CO31年前查看全部
- 在S(负二价) Fe(正三价 )Fe(正二价) Mg (正二价)S CL(负一价) H(正一价) SO2 Fe HCL
在S(负二价) Fe(正三价 )Fe(正二价) Mg (正二价)S CL(负一价) H(正一价) SO2 Fe HCL
在S(负二价) Fe(正三价 )Fe(正二价) Mg (正二价) S CL(负一价) H(正一价) SO2 Fe HCL 十个粒子中只有氧化性的是 只有还原性的是?既有氧化性又有还原性的是? 兰色知更鸟1年前1
兰色知更鸟1年前1 -
 缺点很多 共回答了23个问题
缺点很多 共回答了23个问题 |采纳率100%失电子的显示还原性,的电子的显示氧化性.
只有氧化性就是说不能再失去电子,只有还原性就是说不能再得到电子,呈现最高价态.既有氧化性又有还原性就是既能再得到电子,也还能再失去电子,呈现最低价态.
所以答案是:
只有氧化性的:Fe(正三价 )Mg (正二价)H(正一价)
只有还原性的:S(负二价) CL(负一价)
既有氧化性又有还原性的是:Fe(正二价 S SO2 Fe HCL1年前查看全部
- 某一电解池,如果在1秒内共有5×10^18个二价正离子和1×10^19个一价负离子通过某一横截面,则通过这个截面的电流强
某一电解池,如果在1秒内共有5×10^18个二价正离子和1×10^19个一价负离子通过某一横截面,则通过这个截面的电流强度是( )
 tiki为乐1年前2
tiki为乐1年前2 -
 tq0bv95 共回答了23个问题
tq0bv95 共回答了23个问题 |采纳率82.6%I=Q/T,其中Q=【5×10^18×2+1×10^19】×e,《e是每个电子的电量,我忘了》.
一楼的,两种电荷的方向当然是相反,因是电解池.1年前查看全部
- 化学价的口诀,请看看有没有错?正一价:K Na Ag H NH-负一价:F Cl Br OH- NO-正二价:Ga Mg
化学价的口诀,请看看有没有错?
正一价:K Na Ag H NH-
负一价:F Cl Br OH- NO-
正二价:Ga Mg Ba Zn
负二价:O S SO- CO-
3Al 4Si 5N P 1、2Cu 2、3Fe 2、4碳 我几乎背这个口诀背了三年了,可是今天突然被指有错误,帮我纠正一下. 一缕相思谁能懂1年前3
一缕相思谁能懂1年前3 -
 korla99l 共回答了18个问题
korla99l 共回答了18个问题 |采纳率94.4%ms没有错啊,当然,肯定是有遗漏的
比如说S,也是+4.+6.-2
别听别人胡说,这个是对的,而且很多中学不要求掌握的告诉你了也会混
那个人也不知道Fe也可以是+6价吧,况且你知道了也没用
以后会学到的,就等以后再记,现在学这些绝对够了1年前查看全部
- 如图所示,真空中有一个固定的点电荷,电荷量为+Q,虚线表示该点电荷电场中的等势面.两个一价离子M、N(不计重力和它们之间
如图所示,真空中有一个固定的点电荷,电荷量为+Q,虚线表示该点电荷电场中的等势面.两个一价离子M、N(不计重力和它们之间的电场力)先后从a点以相同的速率v 0 射入该电场,运动轨迹分别为曲线a→b和a→c,其中b、c两点在同一等势面上,p、q分别是它们离固定点电荷最近的位置.下列说法中正确的是( ) A.M、N都是正离子 B.M在p点的速率小于N在q点的速率 C.M从a→b的电势能先减小后增大 D.M从p→b过程电场力做的功等于N从a→q过程电场力做的功 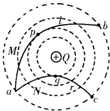
 爱在生vv边缘1年前1
爱在生vv边缘1年前1 -
 只要rr不要快乐 共回答了24个问题
只要rr不要快乐 共回答了24个问题 |采纳率95.8%A、由图可知电荷N受到中心电荷+Q的斥力,而电荷M受到中心电荷+Q的引力,故两粒子的电性一定不同.由于中心电荷为正电,则M一定是负离子,N一定是正离子,故A错误;
B、由图可判定M电荷在运动过程中,电场力做正功,导致动能增加;而N电荷在运动过程中,电场力做负功,导致动能减小.所以在p点的速率一定大于N在q点的速率,故B错误;
C、电场力对M离子先做正功后做负功,则M从a→b的电势能先减小后增大.故C正确.
D、由图可知:p、b间电势差小于a、q间电势差,根据电场力做功W=Uq知,M从p→b过程电场力做的功小于N从a→q过程电场力做的功.故D错误.
故选C1年前查看全部
- 甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,戊的负一价阴离子与丙的阳离
 甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,戊的负一价阴离子与丙的阳离子差8个电子.甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1mol/L的Y溶液pH>1;丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐L也能与Z的水溶液反应生成盐;丙、戊可组成化合物M.请回答下列问题:
甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,戊的负一价阴离子与丙的阳离子差8个电子.甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1mol/L的Y溶液pH>1;丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐L也能与Z的水溶液反应生成盐;丙、戊可组成化合物M.请回答下列问题:
(1)戊离子的结构示意图为______.
(2)写出由甲乙两元素形成的化合物中,既含有极性键又含有非极性键的物质的结构式______;该物质与空气在碱性条件下可构成燃料电池,该电池放电时,负极的反应式为______.
(3)戊的单质与X反应生成的Y和Z的物质的量之比为2:4,反应中被氧化的物质与被还原的物质的物质的量之比为______.
(4)写出少量Z的稀溶液滴入过量L的稀溶液中发生反应的离子方程式:______.
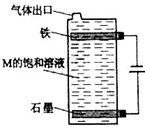
(5)按如图电解M的饱和溶液,写出该电解池中发生反应的总反应方程式:NaCl+H2O
NaClO+H2↑电解 .NaCl+H2O.将充分电解后所得溶液逐滴加入到酚酞试液中,观察到得现象是______.
NaClO+H2↑电解 . longyan1111年前1
longyan1111年前1 -
 zxcdxj 共回答了13个问题
zxcdxj 共回答了13个问题 |采纳率92.3%甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝,则X为NH3,甲为H,乙为N;甲、丙处于同一主族,结合原子序数可知,丙为Na;戊的负一价阴离子与丙的阳离子差8个电子,戊的负一价阴离子核外电子数为18,则戊为Cl;氯气与氨气反应生成氮气,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1mol/L的Y溶液pH>1,则Y为NH4Cl、Z为HCl;丁的单质既能与丙(Na)元素最高价氧化物的水化物的溶液反应生成盐L,也能与Z(HCl)的水溶液反应生成盐N,丁为两性金属,则丁为Al元素,故L为NaAlO2;丙、戊组成化合物M为NaCl,用石墨作阳极、铁作阴极,电解氯化钠水溶液,生成氢气、氯气与氢氧化钠,氯气与氢氧化钠反应生成氯化钠与次氯酸钠,
(1)Cl-的结构示意图为: ,故答案为:
,故答案为: ;
;
(2)H、N两元素形成的化合物中,既含有极性键又含有非极性键的物质为N2H4,其结构式为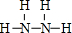 ,负极反应氧化反应,N2H4在负极失去电子,碱性条件下生成氮气与水,负极电极反应式为N2H4+4OH--4e-=N2↑+2H2O,
,负极反应氧化反应,N2H4在负极失去电子,碱性条件下生成氮气与水,负极电极反应式为N2H4+4OH--4e-=N2↑+2H2O,
故答案为: ;N2H4+4OH--4e-=N2↑+2H2O;
;N2H4+4OH--4e-=N2↑+2H2O;
(3)氯气与氨气反应生成的NH4Cl和HCl的物质的量之比为2:4,则NH3与Cl2反应的化学方程式:4NH3+3Cl2═N2+2NH4Cl+4HCl,在反应中氨气做还原剂,氯气做氧化剂,被氧化的物质氨气只占反应掉的一半,被氧化的物质氨气与被还原的物质氯气物质的量之比=2:3,
故答案为:2:3;
(4)将少量的盐酸滴入过量NaAlO2溶液中发生反应的离子方程式为AlO2-+H++H2O═Al(OH)3↓,
故答案为:AlO2-+H++H2O═Al(OH)3↓;
(5)电解饱和氯化钠溶液,反应的方程式为:2NaCl+2H2O
电解
.
2NaOH+Cl2↑+H2↑,同时发生反应Cl2+2NaOH=NaCl+NaClO+H2O,故该电解池中发生反应的总反应方程式为:NaCl+H2O
电解
.
NaClO+H2↑,电解后得到NaClO溶液,显碱性,且具有强氧化性,滴入酚酞溶液中,观察到溶液变红后褪色,
故答案为:NaCl+H2O
电解
.
NaClO+H2↑;溶液变红后褪色.1年前查看全部
- 请看图中第7题,着重分析一下负一价(OCN)的电子式,电子偏向问题,
 4919633171年前2
4919633171年前2 -
 hhqidi 共回答了22个问题
hhqidi 共回答了22个问题 |采纳率86.4%-O-C≡N异氰酸根.CNO 周期表顺序,因此,非金属性 O>N>C 氮显负价,文中说都满足8电子稳定结构,所以C成4个键,氮3个,氧2个(包括一个电子),所以有,C+4价,N-3价,氧-2价.
一分子反应物中,N失3个电子,氯气整体得2个电子.因此,6×2÷3=4 C正解1年前查看全部
- 如图所示,一束具有各种速率的两种一价铜离子,质量数分别为63和65,水平地经小孔S进入有匀强电场E和匀强磁场D的区域.电
如图所示,一束具有各种速率的两种一价铜离子,质量数分别为63和65,水平地经小孔S进入有匀强电场E和匀强磁场D的区域.电场的方向向下,磁场的方向垂直于纸面向里.只有些轨迹不发生偏折的离子才能通过另一小孔S'.为了把从S'射出的两种铜离子分开,再让它们进入另一方向垂直纸面向外的匀强磁场B'中,使两种离子分别沿不同半径的圆形轨道运动.试分别求出两种离子的轨道半径.题中各已知量如下: E=1.00×10^5V/m, B=0.4T, B'=0.5T, 质量数为63的铜离子质量m1=63×1.66×10^-27kg, 质量数为65的铜离子质量m2=65×1.66×10^-27kg

 可乐与茶1年前1
可乐与茶1年前1 -
 fengling722 共回答了24个问题
fengling722 共回答了24个问题 |采纳率91.7%(1)设铜离子的电量为e,以速度v进入小孔S后,受到的力有电场力F1=Ee,方向向下洛仑兹力F2=evB,方向向上重力可忽略不计,只有当F1=F2时,铜离子才能匀速无偏折地穿出小孔S'.因此,从小孔S'穿出的铜离子必须满足的条件是e...1年前查看全部
- 分别为一价和两价的静止铜离子,经过同一电场加速后,在垂直经过同一偏转电场,然后落到一光屏上.图略,离子重力不计.A 离子
分别为一价和两价的静止铜离子,经过同一电场加速后,在垂直经过同一偏转电场,然后落到一光屏上.图略,离子重力不计.A 离子经加速电场时,二价铜离子受到电场力的冲量大.B 在偏转电场中电场力对两种离子做功一样多.C 两种铜离子打在屏上速度一样大.D 两种铜离子打在屏上的两个不同点.选择?理由?
 oqbydxm1年前1
oqbydxm1年前1 -
 88212853 共回答了15个问题
88212853 共回答了15个问题 |采纳率93.3%A对 .二价离子受力大,距离相同,FS大,做功大,动能大,速度大,MV大,由冲量定理,冲量大
D要看情况.可以计算(字数限制不能细说)电场中偏转距离相同.所以,如屏紧挨偏转电场边沿,D不对,否则对
楼上想当然1年前查看全部
大家在问
- 1求函数fx=2^x+x-2在区间(0,1)内零点的个数
- 22.刘鹏设计了一个运动场的示意图.运动场有8条跑道,在图纸上每条跑道宽0.125cm,最里侧半圆跑道的直径为3.6cm,
- 3(简便运算) ②(5/6+7/8-5/12)÷1/24 =
- 4有志之人立长志的长是什么意思
- 5如图为四种粒子的结构示意图,完成以下填空:
- 6将盛有12gCuO的试管,通入一会儿氢气后加热,当试管内残渣为10g时,这10g残渣中铜元素的质量分数为( )
- 7若a的两个平方根分别是m+8与2m+1,求a+2的立方根是多少?
- 8初中物理 密度 题白酒的度数通常表示酒精的体积含量,如"45度"表示100ml白酒中含有45ml酒精,现有一瓶酒的规格为
- 9一张课桌比一条凳子贵75元,一张课桌的价格是一条凳子的4倍,一张课桌和一条凳
- 10simon身体很弱,很容易感冒 simon is quite weak.it's ___for him____ ____
- 11农业科技成果名词解释请解释“农业科技成果”这一名词的具体含义
- 12一、水平放置运行的传送带3:水平传送带被广泛地应用于机场和火车站,
- 13ab两地相距126km,甲每小时进行20km,乙每小时进行16km,甲乙同时由A向B出发,甲到b后立即返回,几小时后,
- 14十万火急!万分感激!计算 积分∫(0到π/2)∫(0到π)(cosθ)的平方(sinφ)的立方dθdφ
- 15青城小学五年级、六年级一共有6个班级,每两个班级之间进行一场篮球比赛.一共要进行______场比赛.