Al有非金属性应该怎么理解
 king36212022-10-04 11:39:541条回答
king36212022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 kid0228 共回答了18个问题
kid0228 共回答了18个问题 |采纳率100%- 金属性:2Al + 6H+ == 2Al3+ + 3H2↑非金属性:2Al + 2OH- + 2H2O == 2AlO2- + 3H2↑ 2Al+6H+ ===2Al3+ 3H2↑ 2Al+2OH- +2H2O
- 1年前
相关推荐
- 为什么I2的还原性比Br2强不能说明说明碘的非金属性强于溴?
 萧萧落19871年前4
萧萧落19871年前4 -
 yuezhoufeng 共回答了14个问题
yuezhoufeng 共回答了14个问题 |采纳率92.9%非金属性强,只能说明氧化性更强.
这里I的还原性强,所以非金属性是弱于Br的1年前查看全部
- 能否系统详细的教我如何比较金属性强弱与非金属性强弱?
能否系统详细的教我如何比较金属性强弱与非金属性强弱?
有关它的知识也希望能详细告诉我!
请帮我``仔细``分析一下下面的说法
在相同条件下,NaX溶液的PH比NaY溶液的大,说明元素X比元素Y的非金属性强(这种说法是正确的)
还有,在相同温度下,BaSO4比MgSO4难溶于水,说明Ba的金属性比Mg的金属性弱(这种说法是错误的)
我希望您能仔细系统的告诉我!!!
还有,为什么?
在相同条件下,NaX溶液的PH比NaY溶液的大,说明元素X比元素Y的非金属性强(这种说法是正确的)
从这道题引申出来的!!!
结合H+的能力越强,非金属性越强??? 陆游问1年前1
陆游问1年前1 -
 a1234_2004 共回答了19个问题
a1234_2004 共回答了19个问题 |采纳率100%非金属性是和金属性相对应的,一般形容非金属得电子能力的强弱.
可以用金属(或氢)和不同元素(单质)反应,根据发生反应的难易和生成物的稳定性强弱来判断(非金属性越强,越易与金属发生反应,生成物的稳定性越好)(想一下对应的结果,看是不是正确).
还可以比较相应含氧酸的酸性(最高价态),一般酸性越强,其对应非金属性越强.1年前查看全部
- 1.硫的非金属性弱于氯的主要事实是()
1.硫的非金属性弱于氯的主要事实是()
A.与Fe反应,硫还原为负二价,而氯还原为负一价
B.铁与硫反应生成硫化亚铁,铁的氯气反应生成氯化铁
2.将0.2mol铁与4.8g硫粉混合加热后的混合物再加足量的盐酸,收集到气体的体积在标准状况下为()
A.1.12L
B.3.36L
C.4.48L
D.7.84L tsib1年前5
tsib1年前5 -
 童-话 共回答了25个问题
童-话 共回答了25个问题 |采纳率96%1.B
氧化性的强弱与得失电子的多少是没有关系的.
2.C
首先是4.8g的S与Fe反应生成0.15Mol的FeS.与盐酸反应生成0.15Mol的硫化氢
然后剩余的0.05Mol的Fe与盐酸反应生成0.05Mol的氢气
这样总共是0.2Mol即4.48L1年前查看全部
- 元素的金属性是指元素的原子失电子的能力;元素的非金属性是指元素的原子得电子的能力.那么,碱金属对应的阳离子有没有金属性这
元素的金属性是指元素的原子失电子的能力;元素的非金属性是指元素的原子得电子的能力.那么,碱金属对应的阳离子有没有金属性这一说法,谢谢各位高手解答
 企鹅在人间1年前2
企鹅在人间1年前2 -
 福建李菁14 共回答了20个问题
福建李菁14 共回答了20个问题 |采纳率80%金属性非金属性是针对元素而言的,不能说离子,钠钾等离子不能说金属性,金属性是说元素单质与水或者酸反应置换出氢的难易程度和最高价氧化物对应水化物的碱性强弱,不是的是电子能力1年前查看全部
- 卤素中的氟 是非金属性强还是电负性强还是电离能大
 高新区招商局1年前1
高新区招商局1年前1 -
 80149086 共回答了20个问题
80149086 共回答了20个问题 |采纳率90%非金属性和电负性都强.电离能大.1年前查看全部
- 为什么I的非金属性比Cl弱
 ling79091年前1
ling79091年前1 -
 故人往事 共回答了14个问题
故人往事 共回答了14个问题 |采纳率100%随着原子半径的增大,还原性越来越强,金属性也越来越强,因此,非金属性越来越弱1年前查看全部
- 用方程式表示氯元素的非金属性比硫元素强
用方程式表示氯元素的非金属性比硫元素强
如题:越多越好 沈倒得1年前2
沈倒得1年前2 -
 坏怀淮 共回答了20个问题
坏怀淮 共回答了20个问题 |采纳率95%氯气+硫化氢=氯化氢+硫1年前查看全部
- 为什么同主族非金属元素的非金属性越强,其气态氢化物水溶液的酸性越弱?
为什么同主族非金属元素的非金属性越强,其气态氢化物水溶液的酸性越弱?
而同周期非金属元素的非金属性越强,其气态氢化物水溶液一般酸性越强; 蠢就一个字1年前3
蠢就一个字1年前3 -
 bigger_369852 共回答了14个问题
bigger_369852 共回答了14个问题 |采纳率92.9%主要考虑和氢元素结合的能力,非金属性越强,和氢结合的越紧密,不容易电离出氢离子
这种表现以卤族元素最为典型
氟非金属性最强,氟化氢水溶液(氢氟酸)中电解出的氢离子少,其余是以氟化氢分子存在,所以是弱酸
氯的非金属性较氟弱的多,氯化氢水溶液中,基本没有氯化氢分子,几乎全部是氢离子和氯离子,所以它是强酸
类推到碘,碘的非金属性最差,和氢结合的松散,受热,光照均会分解,所以其水溶液中氢离子最多,酸性也最强.
不同主族,不符合此规律1年前查看全部
- 下列说法中正确的是 A.元素的非金属性越强,其单质的活泼性一定越强 B.原子晶体中原子以共价键结合,具有键能大、熔点高、
下列说法中正确的是
A.元素的非金属性越强,其单质的活泼性一定越强 B.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性 C.分子晶体的熔沸点低,常温下均呈液态或气态 D.含有金属阳离子的晶体一定是离子晶体  乞力马扎罗的雪人1年前1
乞力马扎罗的雪人1年前1 -
 生命过客xl 共回答了14个问题
生命过客xl 共回答了14个问题 |采纳率71.4%B
A错,元素的非金属性越强,其单质的活泼性不一定越强,如N与P,N的非金属性比P强,但是N 2 的活泼性比P弱;B正确;C错,分子晶体的熔沸点低,但常温下不一定均呈液态或气态;D错,如金属晶体;1年前查看全部
- 为说明氯比硫的非金属性强,下列事实可作依据的是( ) A.HCl的溶解性强于H 2 S B.氯的最高价为+7价 C.H
为说明氯比硫的非金属性强,下列事实可作依据的是()
A.HCl的溶解性强于H 2 S B.氯的最高价为+7价 C.H 2 S中的S 2- 能被Cl 2 氧化 D.HClO的氧化性强于H 2 SO 4  bfafaf1年前1
bfafaf1年前1 -
 shuishi661 共回答了19个问题
shuishi661 共回答了19个问题 |采纳率94.7%C
1年前查看全部
- 为验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
为验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
(1)实验室制氯气的反应原理为______,盛有饱和食盐水的洗气瓶的作用是______.
(2)装置B中盛放的试剂是______(填选项),实验现象为______.
A.Na 2 S溶液B.Na 2 SO 3 溶液C.Na 2 SO 4 溶液
(3)装置C中盛放烧碱稀溶液,目的是______,写出反应的离子方程式______.
(4)能证明氯元素比硫元素非金属性强的依据为______. (填序号)
①氯原子比硫原子更容易获得电子形成离子;
②次氯酸的氧化性比稀硫酸强;③S 2- 比Cl - 还原性强;
④HCl比H 2 S稳定.
 ldkjzx1年前1
ldkjzx1年前1 -
 顿怀 共回答了18个问题
顿怀 共回答了18个问题 |采纳率83.3%(1)实验室用二氧化锰和浓盐酸来制取氯气,其原理为:MnO 2 +4HCl(浓) △ . MnCl 2 +Cl 2 ↑+2H 2 O;由于浓盐酸易挥发,所以制备的Cl 2 中混有HCl,...1年前查看全部
- 单质与氢气化合的难易程度,越易化合,非金属性越强 这句话对吗?
单质与氢气化合的难易程度,越易化合,非金属性越强 这句话对吗?
可是例如:C与H2 只需 点燃
N2与H2 要 高温高压催化剂 那这怎么解释呢? X9151年前2
X9151年前2 -
 小卷蕾蕾 共回答了18个问题
小卷蕾蕾 共回答了18个问题 |采纳率72.2%这是因为N2含有三键导致分子非常稳定,不易反应.另外C和H2不能通过点燃得到甲烷,同样需要催化剂.1年前查看全部
- 非金属元素的非金属性强弱如何判断
 巴cc直人1年前5
巴cc直人1年前5 -
 ErP123654 共回答了19个问题
ErP123654 共回答了19个问题 |采纳率89.5%同一周期的从左到右逐渐增强,同一主族从上到下依次减弱.1年前查看全部
- 元素的非金属性强,则它的单质的活泼型一定强为什么是错的,请举例!
 天下有无贼1年前1
天下有无贼1年前1 -
 让我们荡起又又桨 共回答了17个问题
让我们荡起又又桨 共回答了17个问题 |采纳率88.2%碳元素比钠元素非金属性强,石墨就比单质钠稳定多了.1年前查看全部
- NH3的稳定性比PH3的强为什么可以说氮的非金属性更强?
 方斯1年前2
方斯1年前2 -
 秋之爱 共回答了12个问题
秋之爱 共回答了12个问题 |采纳率100%NH3PH3是分子化合物,N和P就是靠其吸电子性(非金属性)把H牢牢吸住,成键 而形成的化合物,所以吸的越紧越稳定,也就是非金属性越强越稳定1年前查看全部
- Cl与Br与I怎么比较非金属性强弱
 啤酒剑客1年前4
啤酒剑客1年前4 -
 彩aa 共回答了14个问题
彩aa 共回答了14个问题 |采纳率85.7%周期表中越往右越往上的元素非金属性越强
所以非金属性Cl>Br>I1年前查看全部
- 元素周期律的记忆问题怎么准确记忆元素周期律 什么从左到右金属性变弱 非金属性增强 所有的等等不要告诉我多做题就记住了
 sir1731年前3
sir1731年前3 -
 黑色新tt 共回答了14个问题
黑色新tt 共回答了14个问题 |采纳率78.6%记经典的!
例第二周期:左为Na,右为Cl,金属变非金属,金属性明显减弱!
由此得:从左到右金属性变弱, 非金属性增强1年前查看全部
- 元素的非金属性强弱可以从其最高价氧化物的酸性来判断,请举例 元素的非金属性强弱可以从其?
 zlzry1年前3
zlzry1年前3 -
 slioner 共回答了18个问题
slioner 共回答了18个问题 |采纳率94.4%应该是水化物
成的含氧酸
如硫酸H2SO4和硒酸 H2SEO4
这是同主族
还有同周期的 高氯酸强于硫酸
通过”强制弱”的反应可以判断出来
另外可直接看其在元素周期表的相对位置
要注意 一定要是 最高价氧化物 ,特别在选择题中出现1年前查看全部
- 如何用实验证明硫,碳,硅非金属性强弱?
 幸福是种唯心论1年前2
幸福是种唯心论1年前2 -
 约定的幸福 共回答了28个问题
约定的幸福 共回答了28个问题 |采纳率100%用稀硫酸跟碳酸钠固体反应,生成的二氧化碳通入NaSiO3溶液中;
解析:因为元素的非金属性越强,其相应最高价含氧酸的酸性越强,强酸能制取弱酸,硫酸是强酸能和碳酸钠反应生成碳酸,碳酸不稳定分解生成二氧化碳和水,二氧化碳、水和硅酸钠反应生成不溶于水的硅酸和碳酸钠,硫酸的酸性大于碳酸的酸性,碳酸的酸性大于硅酸的酸性,就可以证明非金属性:硫>碳>硅.1年前查看全部
- 非金属性指的是什么?非金属性的强弱怎么知道?歧化反应是?为什么强氧+强还→弱氧+弱还?这是原本就这样规定的么?怎么知道氧
非金属性指的是什么?非金属性的强弱怎么知道?歧化反应是?为什么强氧+强还→弱氧+弱还?这是原本就这样规定的么?怎么知道氧化剂还原剂的强弱性?一些反应中除了加反应物还要加HNO3,是为了防止干扰对吧,这个这个干扰怎么说?
 mcysprite1年前1
mcysprite1年前1 -
 o81809295 共回答了14个问题
o81809295 共回答了14个问题 |采纳率92.9%非金属性就是指元素的氧化性.对元素说非金属性,对物质说氧化性.看元素周期表的主族部分,右边的元素比左边的高,上边的比下边的高.
岐化反应就是一个元素反应了之后变成了两个物质,一个化合价比原来的高,另一个比原来的低
在一个反应中,氧化剂的氧化性强与氧化产物,还原剂的还原性强与还原产物.
氧化剂还原剂的强弱有许多判断方法.除了上面说的这个,还有根据原电池的正负极判断(高中阶段好像就没别的了)
最后一个问题没想起来,最好追问里给我说个例子1年前查看全部
- 下列实验能说明氮元素的非金属性较活泼的事实是( )
下列实验能说明氮元素的非金属性较活泼的事实是( )
A.常温下氮气很稳定
B.氨气极易溶于水且易液化
C.硝酸易挥发
D.硝酸是强酸 shxshx1年前1
shxshx1年前1 -
 冰陨 共回答了19个问题
冰陨 共回答了19个问题 |采纳率84.2%解题思路:判断非金属强弱的方法很多,非金属的最高价氧化物的水化物的酸性强弱,能证明非金属强弱;非金属氢化物的稳定性,能说明非金属性强弱;非金属与氢气化合的难易程度,能说明非金属性的强弱.A、常温下氮气很稳定,说明氮气化学性质不活泼,不能说明氮元素的非金属性强弱,故A错误;
B、氨气极易溶于水且易液化,说明氨气的溶解度大、沸点低,不能说明氮元素的非金属性强弱,故B错误;
C、硝酸易挥发说明硝酸沸点低、挥发性强,不能说明氮元素的非金属性强弱,故C错误;
D、氮的最高价氧化物的水化物是强酸,说明氮的非金属性较活泼,故D正确;
故选D.点评:
本题考点: 非金属在元素周期表中的位置及其性质递变的规律.
考点点评: 本题考查判断非金属性强弱的方法.最高价氧化物的水化物是强酸,能说明该非金属性较活泼.1年前查看全部
- CH4和H2S谁更稳定?说法一:S的非金属性比碳强,所以H2S比CH4稳定说法二:C的半径更小,键长短,化学键更强,所以
CH4和H2S谁更稳定?
说法一:S的非金属性比碳强,所以H2S比CH4稳定
说法二:C的半径更小,键长短,化学键更强,所以CH4比H2S稳定
到底哪个说法是正确的?
课本上说“非金属性越强,对应的气态氢化物就越稳定”,S的非金属性比C强,应该是H2S更稳定吧? gold_8881年前1
gold_8881年前1 -
 skdmh 共回答了26个问题
skdmh 共回答了26个问题 |采纳率84.6%CH4比H2S稳定.
说法二正确.
化学理论还是半经验的,应该以实验事实为依据.我们知道甲烷在隔绝空气时加热到1000℃以上才分解,而H2S在300℃左右即分解.
另:极性不能用来解释该问题.H2O比CH4稳定,用分子极性如何解释?1年前查看全部
- 为什么碳酸根可以水解而硫酸根不能水解可以说明c的非金属性弱于s
为什么碳酸根可以水解而硫酸根不能水解可以说明c的非金属性弱于s
为什么碳酸根可以水解而硫酸根不能水解可以说明c的非金属性弱于s! Ctrl_CV1年前4
Ctrl_CV1年前4 -
 chengls2007 共回答了23个问题
chengls2007 共回答了23个问题 |采纳率91.3%非金属性可以理解为氧化性,氧化性越强,其稳定性越差,稳定性越差所形成的稳定状态越稳定.物质的自发反应都是熵增的趋于稳定状态,所以,碳酸根需要通过水解来达到其稳定,而硫酸根不需要水解,所以硫酸根的稳定性更高,硫的稳定性就相对更低,所以硫比碳更活泼,所以硫的非金属性强1年前查看全部
- 高中化学元素周期律和金属性非金属性怎么学好一点
 若一0061年前1
若一0061年前1 -
 hjm865 共回答了12个问题
hjm865 共回答了12个问题 |采纳率100%我也老记不住,只能多做题巩固,还有弄清本质,非金属性金属性就是指氧化性和还原性,和金属,非金属不同!注意从左右上下推金属性,应用等,特别注意s!那么你地化学就会有质的飞跃.1年前查看全部
- 氯元素的非金属性比氮元素强,用化学方程式表示
 zhangjunyi1年前1
zhangjunyi1年前1 -
 侍祠甘泉瞻羽车 共回答了22个问题
侍祠甘泉瞻羽车 共回答了22个问题 |采纳率81.8%3Cl2+2NH3--->N2+6HCl1年前查看全部
- 验证氯的非金属性比硫强的化学反应方程式
 斑比的嘎子婆1年前3
斑比的嘎子婆1年前3 -
 小贝啊 共回答了20个问题
小贝啊 共回答了20个问题 |采纳率90%Cl2+H2S==2HCl+S沉淀1年前查看全部
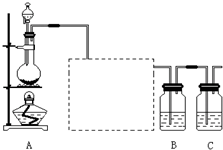
- 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
(1)装置A的分液漏斗中盛装的试剂是______,烧瓶中加入的试剂是______.
(2)画出虚线框内的实验装置图,并注明所加试剂,______说明装置的作用______.
(3)装置B中盛放的试剂是______(选填下列所给试剂的代码),实验现象为______,化学反应方程式是______,该反应属于四种基本反应类型中的______反应.
A.Na 2 S溶液B.Na 2 SO 3 溶液C.Na 2 SO 4 溶液
(4)从原子结构的角度简要分析氯元素的非金属性比硫元素的非金属性强的原因.
______
(5)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强(试举一例).
______
(6)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气.在该反应中,Cl元素的化合价既有升高又有降低,即在反应中Cl元素的原子既能获得电子也能失去电子,能否说氯元素既具有金属性又具有非金属性?简述你的理由.
______
______.
 jiangcheng7171年前1
jiangcheng7171年前1 -
 eent123 共回答了21个问题
eent123 共回答了21个问题 |采纳率90.5%(1)为验证氯元素的非金属性比硫元素的非金属性强,需要用氯气置换出硫,则必须用装置A制备氯气,实验室通常用浓盐酸与二氧化锰反应制取氯气,则A装置中A的分液漏斗中盛装的试剂是浓盐酸,烧瓶中加入的试剂是MnO 2 .故答案为:浓盐酸;MnO 2 ;
(2)由于用浓盐酸制取氯气,且需要加热,即实验过程中要挥发出HCl气体,因此虚线框部分应是除去HCl气体的装置,可以使用洗气瓶,瓶内盛装饱和食盐水,既除去HCl,又降低氯气在水中的溶解度.所用装置为:
.故答案为:
;除去Cl 2 中的HCl气体;
(3)要在B中发生氯气置换出硫的反应,在给定试剂中只能选取Na 2 S溶液,发生的是置换反应,化学方程式为:Na 2 S+Cl 2 =2NaCl+S↓.
故答案为:A;有淡黄色沉淀生成;Na 2 S+Cl 2 =2NaCl+S↓;置换;
(4)从氯原子和硫原子的核外电子排布可知:Cl与S分别为第三周期元素的VIIA和VIA,原子半径:S>Cl,因为Cl的核电荷数大于S,Cl的原子核对最外层电子的吸引能力比S强,即Cl的电子能力比S强,非金属性Cl比S强.答案为:Cl原子、S原子的电子层数相同,但最外层电子数Cl原子是7,S原子是6,且原子半径Cl<S,因此,在反应中Cl原子比S原子更容易获得电子达稳定结构,故氯元素的非金属性比硫元素的非金属性强.
故答案为:Cl原子、S原子的电子层数相同,但最外层电子数Cl原子是7,S原子是6,且原子半径Cl<S,因此,在反应中Cl原子比S原子更容易获得电子达稳定结构,故氯元素的非金属性比硫元素的非金属性强;
(5)我们可从最高价氧化物对应水化物的酸性强弱、与氢气反应的难以程度、气态氢化物的稳定性等来判断元素非金属性的强弱,对Cl和S来说,可具体为:HCl的稳定性比H 2 S的稳定性强或者HClO 4 的酸性比H 2 SO 4 的酸性强.
故答案为:HCl的稳定性比H 2 S的稳定性强或者HClO 4 的酸性比H 2 SO 4 的酸性强.(其他合理答案均可);
(6)判断元素金属性强弱的依据有:最高价氧化物对应水化物的碱性强弱、单质与水或酸反应置换出氢气的剧烈程度、金属之间的置换反应等,而判断元素具有金属的依据与之不同,如(5)所述.因此,Cl元素的化合价既有升高又有降低,不能说明氯元素既具有金属性又具有非金属性.本题答案为:金属性强弱的判断以元素的单质与水(或酸)反应置换氢的难易程度,以及它的最高价氧化物的水化物的碱性强弱为依据.非金属性的强弱以它与氢气生成氢化物的稳定性或它的最高价氧化物的水化物的酸性强弱来判断.
故答案为:不能;金属性强弱的判断以元素的单质与水(或酸)反应置换氢的难易程度,以及它的最高价氧化物的水化物的碱性强弱为依据.非金属性的强弱以它与氢气生成氢化物的稳定性或它的最高价氧化物的水化物的酸性强弱来判断.(其他合理答案均可)1年前查看全部
- 请问:原子的__越大,金属性越弱,非金属性越强.
 af1341年前5
af1341年前5 -
 痞子电磁波 共回答了16个问题
痞子电磁波 共回答了16个问题 |采纳率81.3%前面说的都不错 除了
电负性越大,金属性越弱,非金属性越强,的确,这是直接原因;
阴离子半径越大,才是根本原因 电负性强弱是阴离子半径的体现
个人喜欢答“阴离子半径”,但若是考试或做题还是“电负性”把1年前查看全部
- 请设计一个简单的实验方案以比较碳和氯的非金属性强弱,写出简要的实验方法,结论,及相关化学方程式
 我的牙很疼1年前2
我的牙很疼1年前2 -
 gloryofaa 共回答了17个问题
gloryofaa 共回答了17个问题 |采纳率94.1%和氢气反应
方法:一个瓶子充满H2,加入Cl2进去燃烧,苍白色火焰
令一个瓶子充满H2,夹住C进去燃烧,反应不明显
结论:Cl2的非金属性强,即氯的非金属性强
方程式:Cl2+H2==2HCl1年前查看全部
- 碳,氮和氧的非金属性强弱?是根据最外层电子数判断的吗?
 friendlll1年前3
friendlll1年前3 -
 胭脂红唇 共回答了27个问题
胭脂红唇 共回答了27个问题 |采纳率92.6%非金属性有一种简单的判断方法 就是看元素在元素周期表中的位置 一般越向又和向上非金属性越强(稀有气体除外) 如果学的多还可以根据电负性和电离能电子亲和能等判断
像碳,氮和氧在周期表为从左到右 根据我上面的规则 非金属性强弱就是O>N>C
不是根据最外层电子数判断的1年前查看全部
- 关于酸碱性的强弱比对问题从元素周期表中我们可以发现Cl的非金属性强于S的所以对应的氧化水化物高氯酸酸性强于硫酸.但从离子
关于酸碱性的强弱比对问题
从元素周期表中我们可以发现Cl的非金属性强于S的所以对应的氧化水化物高氯酸酸性强于硫酸.
但从离子浓度上来讲硫酸对应的是两份氢,而高氯酸只对应一分
而且都是完全电离难道不矛盾么 1文冠木1年前1
1文冠木1年前1 -
 sunhaoai 共回答了14个问题
sunhaoai 共回答了14个问题 |采纳率85.7%这牵扯到大学知识----“拉平效应”,也称校平效应(leveling effect)”.通过溶剂的作用,使不同强度的酸或碱显示同等强度的效应.根据酸碱质子理论,一种物质在某种溶液中表现出的酸或碱的强度,不仅与酸碱的本质有关,也与溶剂的性质的有关.如HClO4在水中是一种强酸,趋近于完全离解,但在冰醋酸中却不能完全离解.高氯酸和硫酸是强酸在水中都能完全电离,没法区分强弱,得选择其他合适的溶剂才能区分开.
你可以百度“拉平效应”来看看,以获得更多相关知识.1年前查看全部
- 非金属性强的原子半径小于非金属性弱的原子半径
非金属性强的原子半径小于非金属性弱的原子半径
元素A的非金属性比元素B的非金属性强,那么A的原子半径一定比B小?
请说明理由并举例 零点天使1年前2
零点天使1年前2 -
 sanse1 共回答了20个问题
sanse1 共回答了20个问题 |采纳率90%为方便理解 可以分情况讨论:
1. A元素与B元素在同一周期上:我们知道同周期元素非金属性由左往右递增,即越往右非金属性越强. 又知道同周期元素原子半径由左往右递减(原因是原子核对核外电子的吸引力越来越强)
因为A非金属性强于B ,故A原子半径比B小.如C和F, 非金属性F>C 半径F<C
2. A与B在同一主族上:同理由上往下 非金属性递减 而原子半径递增(原因是电子层数增多) 故A原子半径小于B 如Cl和I
3. A与B既不同周期,又不同主族:这种情况需要找中间一种过渡的元素
如Mg和N 直接比较不容易说明 但可以发现Mg与Be同一主族 而Be与N又在同一周期 根据1、2两种情况 递推可以得出非金属性N>Mg 半径N<Mg
其实如果只要大概在思维上理解可以这样记 :在周期表中,非金属性是越往右上越强,而原子半径则是越往左下越大 可以粗略知道非金属性越强的原子半径会比较小
恩,楼下的讲法更严谨,反例是存在的,还有的就是某些稀有气体元素(如Ne)的非金属性很弱 但半径却比很多元素的小(如I). 当然副族元素也有不少反例 ,但按照元素周期律来讲 这样的说法还算正确.1年前查看全部
- 为什么非金属原子结合相同数量的电子行成稳定结构,放出能量多的,元素非金属性强
 红绳绿幽灵1年前1
红绳绿幽灵1年前1 -
 langren7hao 共回答了21个问题
langren7hao 共回答了21个问题 |采纳率66.7%因为非金属外层电子书较多(一般都多余最外层电子可能数量的一半).因此核力比较强,容易吸引多余的电子,达到最外层电子饱和的相对稳定状态.宇宙中所有的物质都有能量最低原理,当非金属捕获外层电子时,放出能量,导致自身能量状态降低,达到相对跟稳定的状态.放出能量多的元素,其捕获电子的能力也强,因此其非金属性也强1年前查看全部
- 怎么证明CI的非金属性大于S举出5个例子
 a7u1hhe1年前2
a7u1hhe1年前2 -
 3633872 共回答了17个问题
3633872 共回答了17个问题 |采纳率94.1%一、向硫化钠溶液中通入氯气,产生硫沉淀.二、高氯酸(HClO4)的酸性比硫酸强.三、氯化氢比硫化氢更稳定.1年前查看全部
- 氯气和氧气的非金属性哪个更强
 白玛才仁1年前1
白玛才仁1年前1 -
 zhyz_1973 共回答了11个问题
zhyz_1973 共回答了11个问题 |采纳率90.9%氧,因为两者化合的话氯显正价,氧负价1年前查看全部
- 请问辨别金属性和非金属性强弱有哪些方法?
 彭泽人1年前1
彭泽人1年前1 -
 windmeteor 共回答了18个问题
windmeteor 共回答了18个问题 |采纳率94.4%看电负性,氟是4,就是非金属性最强的1年前查看全部
- 利用周期表判断N和Cl的非金属性强弱
利用周期表判断N和Cl的非金属性强弱
Cl的上一周期同主族元素是F,F原子序数比N大,F非金属性〉N
且F〉Cl.
然后该怎么判断啊?. wuyzhang1年前1
wuyzhang1年前1 -
 孙oo兵 共回答了17个问题
孙oo兵 共回答了17个问题 |采纳率82.4%原子半径等数据判断1年前查看全部
- 非金属性排列求一些常见元素及酸根离子的废金属性强弱顺序
 YYvstong1年前1
YYvstong1年前1 -
 李克勤天下 共回答了25个问题
李克勤天下 共回答了25个问题 |采纳率92%非金属性通常表示元素获得电子的倾向.非金属性表现在很多方面,如元素的电负性(吸电子能力)、单质的氧化性,最高价氧化物之水化物的酸性,氢化物的稳定性等等.正因为非金属性定义的模糊性,衡量标准的多样性,要笼统地比较元素的非金属性顺序,很难说.
总的来讲:
氟>氯>氧>溴>碘>硫>磷>碳>硅>氢.
氯、氧差不多,先后有争议;
硫、碘差不多,先后有争议;
氮的争议最大,根本没法排进去.有人认为应该放在溴的前面,有人认为应该和硫差不多.
非金属性是针对元素的,酸根负离子的还原性是单质氧化性的另一个方面,其顺序与单质氧化性相反,即酸根负离子还原性越强,非金属性越弱.常见的酸根负离子还原性顺序:
S2- > I- > Br- > Cl- > F-
像氧、氮的负离子无法在溶液中稳定存在(氢氧根和氨根不算),所以一般题目不会出的.1年前查看全部
- 能说明氮的非金属性比氧弱的实验是什么
 悠悠曙光1年前3
悠悠曙光1年前3 -
 liushijun73 共回答了18个问题
liushijun73 共回答了18个问题 |采纳率100%N2+O2=放电=2NO1年前查看全部
- 化学:硫的非金属性强是什么意思?详细!
 ffhh1年前4
ffhh1年前4 -
 hszhangxiaoxu 共回答了24个问题
hszhangxiaoxu 共回答了24个问题 |采纳率95.8%你可以简单的理解,非金属性就是氧化性,金属性就是还原性.说硫的非金属性强就是说硫的氧化性强.1年前查看全部
- 一种非金属单质x能把另一种非金属单质y从什么种置换出来,说明非金属性越强
 0o莫莫o01年前2
0o莫莫o01年前2 -
 81711651 共回答了14个问题
81711651 共回答了14个问题 |采纳率100%2F2+2H2O=4HF+O2 氟强于氧
Cl2+2KBr=2KCl+Br2 氯强于溴
Cl2+H2S=S+2HCl 氯强于硫
从盐溶液或酸都可以.1年前查看全部
- 【紧急,强酸制弱酸问题.】.最底下实验装置.请问分液漏斗加入HNO3或者H2SO4怎么验证非金属性大小.为什么前者N>C
【紧急,强酸制弱酸问题.】.最底下实验装置.请问分液漏斗加入HNO3或者H2SO4怎么验证非金属性大小.为什么前者N>C>Si不对?后者H2SO4验证S>C>Si.

 风在发鬓1年前1
风在发鬓1年前1 -
 lsw211211 共回答了10个问题
lsw211211 共回答了10个问题 |采纳率100%因为硝酸易挥发,前者只能说明N>C,N>SI1年前查看全部
- 铁丝在氯气中点燃和铁丝与硫反应两个实验能否比较氯硫的非金属性强弱
 soso13161年前2
soso13161年前2 -
 ziqpiz 共回答了13个问题
ziqpiz 共回答了13个问题 |采纳率100%铁丝在氯气中点燃和铁丝与硫反应两个实验能比较氯硫的非金属性强弱.1年前查看全部
- S和N;O和CL非金属性哪个大就已S,N为例,如果N大的化,那么最高价水化物硝酸的酸性将比硫酸的大,但事实是这样吗?
 嗔恋1年前3
嗔恋1年前3 -
 djgh 共回答了21个问题
djgh 共回答了21个问题 |采纳率95.2%这么说不确切 而且实际酸性硝酸确实大于硫酸的一级电离(二级电离只有10%)
这个不准确说法的来源应该是
首先 最高价态氧化性越高 其最高价含氧酸酸性越强 而 有的时候 价态越高 氧化性越强
这两点被压缩误读成了你的说法
实质原因是 含氧酸也就是最高价水化物提供酸性的H都连氧上
氧化性越强吸引电子的能力越强 连在上面O对连在这个O上的氢原子束缚力就越小 也就是这个H越容易失去电子 也就是H越容易脱离 成为H+
也就是酸性强1年前查看全部
- 已知溴(Br)是元素周期表中第四周期ⅦA族元素,关于溴的性质判断肯定不正确的是( ) A.溴的非金属性比氯强 B.溴的
已知溴(Br)是元素周期表中第四周期ⅦA族元素,关于溴的性质判断肯定不正确的是( ) A.溴的非金属性比氯强 B.溴的含氢化合物以HBr形式存在 C.溴的氢化物的稳定性比氯化氢差 D.溴的最高价氧化物对应水化物的化学式是HBrO 4  ynzybaxz1年前1
ynzybaxz1年前1 -
 zangjuan 共回答了23个问题
zangjuan 共回答了23个问题 |采纳率91.3%A、同主族元素从上到下,元素的非金属性逐渐减弱,所以溴的非金属性比氯弱,故A错误;
B、溴的含氢化合物有多种,可以是含氧酸,也可以是溴化氢,以HBr形式存在,故B正确;
C、元素的非金属性越强,对应的氢化物的稳定性就越强,因非金属性Cl>Br,则溴的氢化物的稳定性比氯化氢差,故C正确;
D、溴的最外层电子数为7,最高价为+7价,所对应的最高价氧化物对应水化物的化学式是HBrO 4 ,故D正确.
故选A.1年前查看全部
- 怎样判断一种物质是酸性或碱性,金属性或非金属性?
 oalpdw17BTcn1年前1
oalpdw17BTcn1年前1 -
 mackere20 共回答了23个问题
mackere20 共回答了23个问题 |采纳率78.3%酸是在水溶液中解离产生的阳离子全部是氢离子这类物质具有酸性.
碱性(alkaline )是指一种物质在溶剂中能向其它物质提供未共用电子对的能力.碱性物质:做面包用的小苏打、家用清洁剂……柿子和肥皂里含有碱性物质.
1、由单质的氧化性判断,一般情况下,氧化性越强,对应非金属性越强.
2、由单质和酸或者和水的反应程度来看,反应越剧烈,非金属性越强.(比如F2 Cl2 Br2 和H2O的反应剧烈程度依次减弱 非金属依次减弱)
3、由对应氢化物的稳定性判断.氢化物越稳定,非金属性越强,
4、由和氢气化合的难易程度判断.化合反应越容易,非金属性越强.
5、由最高价氧化物对应水化物的酸性来判断,酸性越强,非金属越强;
6、由对应最低价阴离子的还原性判断,还原性越强,对应非金属性越弱;
7、由置换反应判断!非金属强的强制弱!1年前查看全部
- 非金属性:F>Cl>S
 cciceblue1年前2
cciceblue1年前2 -
 翠玺 共回答了28个问题
翠玺 共回答了28个问题 |采纳率89.3%对 元素周期表中越往右上非金属性越强
F
S CL 由位置可知 F大于CL大于S1年前查看全部
- 下列实验结论正确的是A.一定条件下,2C+SiO2==高温==Si+2CO,说明碳非金属性强于硅B.过量CO2通入苯酚钠
下列实验结论正确的是
A.一定条件下,2C+SiO2==高温==Si+2CO,说明碳非金属性强于硅
B.过量CO2通入苯酚钠溶液中溶液浑浊,说明苯酚的酸性比HCO3-强
D.25摄氏度,与同浓度的稀硫酸反应,锌粒的速率可能比铁屑慢
无C选项,请解析ABD 挑衅者1年前3
挑衅者1年前3 -
 leijun125400 共回答了22个问题
leijun125400 共回答了22个问题 |采纳率100%A.一定条件下,2C+SiO2==高温==Si+2CO,说明碳非金属性强于硅
A错.一定条件下,2C+SiO2==高温==Si+2CO,说明碳还原性强于硅
B.过量CO2通入苯酚钠溶液中溶液浑浊,说明苯酚的酸性比HCO3-强
B错.过量CO2通入苯酚钠溶液中溶液浑浊,说明碳酸的酸性比苯酚强
D.25摄氏度,与同浓度的稀硫酸反应,锌粒的速率可能比铁屑慢
D错.25摄氏度,与同浓度的稀硫酸反应,锌粒的速率比铁屑快,因为锌的活泼性比铁强1年前查看全部
- 我想要知道 A元素比B元素的非金属性弱的时候,AHx BHx(或者是A的化合物与B的化合物?不太会表达)的稳定性,失电子
我想要知道 A元素比B元素的非金属性弱的时候,AHx BHx(或者是A的化合物与B的化合物?不太会表达)的稳定性,失电子能力,酸性,碱性这些的对比 要全部的 A比B非金属性强的时候又咋样 上课没听到课 做题的时候完全不会 只要能背下这些玩意就好办多了
 逍遥蓝麦田SKY1年前4
逍遥蓝麦田SKY1年前4 -
 llittlewolf 共回答了19个问题
llittlewolf 共回答了19个问题 |采纳率84.2%氢化物稳定性B大于A
失电子能力B小于A
氢化物酸性B大于A
氢氧化物碱性B小于A
A比B强时情况正好相反1年前查看全部
大家在问
- 1妈妈买回5千克橘子和4千克苹果共35.6元,每千克苹果比每千克橘子贵2.6元.苹果橘子各多少元?
- 2明月出天山,下—句是什么?
- 3(2012•白下区一模)下列实验操作正确的是( )
- 4帮把这句话翻译成英文 :“我买了很多觉得你可能爱吃的东西 ”
- 5一道关于磁场的物理题...一根电缆藏在一堵南北走向的墙里,在墙的西侧,当放一指南针时,其指向刚好比原来旋转180°,由此
- 6梦想永远在路上 文章为什么要用梦想在路上为题?
- 7(2013•连云港)图1是甲、乙两种固体物质的溶解度曲线,图2是盛水的烧杯中放着t2℃下甲、乙两种物质和溶液的试管(不考
- 8语文是滋润甘醇的美酒,让人回味无穷.仿写句子
- 9第二十二章《一元二次方程》测试题?
- 10已知A=25平方米 B=15平方米 h=4米 现在要把A地的土运到B 使AB两地同样高 这样B可升多少米
- 11已知,a加b加c等于6,a的平方加b的平方加c的平方等于14,a的立方加b的立方加c的立方等于36求abc的值
- 12英语中的人称 主语 宾格 形容词性物主代词的分类
- 132x²-3x-5=0用配方法
- 14一道大学线性代数题求详解设3阶实对称矩阵A的各行元素之和均为3,向量α1=[-1,2,-1]T和α2=[0,-1,1]T
- 15已知点A(2,3).B(1,1)和直线l1:3x-4y 8=0,求经过点B,且与直线l1平行的方程
