19. 纯锌与稀硫酸反应速率较慢,为了加快锌的溶解和放出H2的速率,并且使产生氢气的量不变,当锌过量时,可向其中加少量(
 shiya822022-10-04 11:39:544条回答
shiya822022-10-04 11:39:544条回答A.CuSO4溶液
B.ZnSO4溶液
C.铜粉
D.镁条
20.取碘水四份于试管中,编号为Ⅰ、Ⅱ、Ⅲ、Ⅳ,分别加入汽油、CCl4、酒精、NaCl溶液,
振荡后静置,现象正确的是( )
A.Ⅰ中溶液分层,下层呈紫红色
B.Ⅱ中溶液分层,下层呈紫红色
C.Ⅲ中溶液分层,下层呈棕黄色
D.Ⅳ中溶液不分层,溶液由棕黄色变成淡黄绿色
21.下列各组物质中,都是共价化合物的是( )
A.H2S和Na2O2
B.H2O2和CaF2
C.NH3和N2
D.HNO3和HClO4
24. A、B、C都是金属:B中混有C时,只有C能被盐酸溶解;A与B组成原电池时,A为电池的正极.A、B、C三种金属的活动性顺序为( )
A.A>B>C
B.A>C>B
C.C>B>A
D.B>C>A

已提交,审核后显示!提交回复
共4条回复
 115630943 共回答了22个问题
115630943 共回答了22个问题 |采纳率90.9%- 1.A 加入CuSO4后,锌与其发生置换反应,置换出的铜附着在锌表面,构成原电池,加快了反应速率.
2.B 汽油酒精与水互溶,不分层,排除AC,碘的非金属性弱于氯,加入NaCl溶液无现象,排除D,碘在CCl4中呈紫红色.
3.CD A中Na2O2是离子化合物,B中CaF2 是离子化合物.
4.C 由B中混有C时,只有C能被盐酸溶解可知,C可于酸反应而B不能,C>B;原电池中负极活动性一般强于正极(课本上有),由A与B组成原电池时,A为电池的正极可知,B>A,综上,活动性顺序为C>B>A - 1年前
 遵eeee药 共回答了637个问题
遵eeee药 共回答了637个问题 |采纳率- 19
锌过量的话AC
否则选C
20B
21D
22C - 1年前
 A逸凡 共回答了40个问题
A逸凡 共回答了40个问题 |采纳率- A,B,D,C
- 1年前
 忧愁的cc 共回答了64个问题
忧愁的cc 共回答了64个问题 |采纳率- C.铜粉
A.Ⅰ中溶液分层,下层呈紫红色
C.NH3和N2
C.C>B>A - 1年前
相关推荐
- 常温下,铁和稀硫酸反应会生成H2?
 你在哪啊1年前1
你在哪啊1年前1 -
 tanwei87 共回答了17个问题
tanwei87 共回答了17个问题 |采纳率70.6%对 反应较慢 因为铁的金属性质不是特别活泼 硫酸根对反应速率没有促进作用1年前查看全部
- 氧化钠和稀硫酸反应吗,如果反应,化学式是什么
 lookdi1年前5
lookdi1年前5 -
 张来兮 共回答了13个问题
张来兮 共回答了13个问题 |采纳率92.3%浓硫酸可以和氯化钠固体反应,反应如下:
2NaCl + (浓)H2SO4 ==== Na2SO4 + 2HCl(气体)
稀硫酸和氯化钠,浓硫酸和氯化钠稀溶液等,均不能反应.
是氧化钠哦.不好意思~看错了.
氧化钠可以和硫酸反应:
Na2O + H2SO4 ====Na2SO4 + H2O
氧化钠是碱性氧化物,和酸反应,生成盐和水~1年前查看全部
- “酸中碱歧”,为何氧化亚铜与稀硫酸反应歧化?
 cc_hh1年前1
cc_hh1年前1 -
 迷途的饿狼 共回答了18个问题
迷途的饿狼 共回答了18个问题 |采纳率94.4%歧化反应和归中反应都是同种元素间的氧化还原反应,归中的大前提是体系里至少有某一元素的两种价态存在,歧化的大前提是体系中某一元素处于中间价态.这里的铜只有+1价,因为不稳定被酸溶解后发生歧化···
话说高中化学有各种奇怪口诀,都是有适用范围的,而且不能作为绝对判断依据,以字面意义去当作标准是错误的.(嘛,实际上那东西也没什么用处···)1年前查看全部
- 实验室常用金属锌和稀硫酸反应制取氢气.现用26g锌与足量的稀硫酸反应,可制得氢气多少克
实验室常用金属锌和稀硫酸反应制取氢气.现用26g锌与足量的稀硫酸反应,可制得氢气多少克
实验室常用金属锌和稀硫酸反应制取氢气.现用26g锌与足量的稀硫酸反应,可制得氢气多少克? zhg6311年前1
zhg6311年前1 -
 hentuiwubai 共回答了12个问题
hentuiwubai 共回答了12个问题 |采纳率75%1年前查看全部
- 6.5g含杂质的锌粉和足量的稀硫酸反应,生成0.21g氢气,则锌粉中含有的杂质可能是( )
6.5g含杂质的锌粉和足量的稀硫酸反应,生成0.21g氢气,则锌粉中含有的杂质可能是( )
A.Ag
B.Cu
C.Mg
D.Zn skyjaysky1年前1
skyjaysky1年前1 -
 前街女孩 共回答了11个问题
前街女孩 共回答了11个问题 |采纳率100%解题思路:铜、银在金属活动性顺序中,排在氢的后面,不能和稀硫酸反应;根据化学方程式计算,可以判断混合物的组成.采用极值法,假设全是锌计算产生的氢气的质量,和不纯的锌与稀硫酸反应生成的氢气的质量比较再结合题中的金属分析判断.金属的化学性质有:金属与氧气反应、金属与酸反应、金属与盐溶液反应;本题考查的是金属与酸反应:Zn+H2SO4=ZnSO4+H2↑;Mg+H2SO4=MgSO4+H2↑;Cu、Ag不与稀H2SO4反应.可以看到65gZn反应得到2gH2,24gMg反应得到2gH2;现在6.5g含杂质的锌粉和足量的稀硫酸反应,得到0.21gH2,那么金属混合物6.5g反应得到H2的质量大于2.1g,只有镁产生的氢气大于锌的,因此一定含有Mg.
故选:C.点评:
本题考点: 金属的化学性质;根据化学反应方程式的计算.
考点点评: 本考点中既有金属性质的应用,又有化学方程式的书写和有关的计算,考查的比较全面,只要认真分析,问题就不难解决.本考点主要出现在选择题和实验题中.1年前查看全部
- 锌和稀硫酸反应前后,溶液中的溶剂(水),质量会变么
 凝绿琥珀1年前2
凝绿琥珀1年前2 -
 贾孟德 共回答了12个问题
贾孟德 共回答了12个问题 |采纳率100%会的,溶剂会增加.发生反应的锌和硫酸并不包括水,而却生成了水,所以溶剂的质量会增加.1年前查看全部
- 锌与稀硫酸反应为什么生成氢气
 闲人甲甲1年前3
闲人甲甲1年前3 -
 青园 共回答了18个问题
青园 共回答了18个问题 |采纳率88.9%与稀硫酸反应,稀硫酸只体现酸性和弱的氧化性,产物自然是H2
和浓硫酸反应,浓硫酸会体现强氧化性,产物为SO2
Zn + 2H2SO4==ZnSO4 + SO2 + 2H2O1年前查看全部
- 三氧化二铁和稀硫酸反应算是氧化还原反应吗
三氧化二铁和稀硫酸反应算是氧化还原反应吗
氧化二铁和稀硫酸反应算是氧化还原反应吗 铁是三价没变就是没有电子得失吗? kfei1年前2
kfei1年前2 -
 水妖zyy 共回答了11个问题
水妖zyy 共回答了11个问题 |采纳率81.8%对化合价不变就不是氧化还原,它是复分解反应,所有复分解化合价都不变,都不是氧化还原1年前查看全部
- 元素及其化合物在生产、生活中具有广泛的用途。Ⅰ.铬化学丰富多彩.(1)在常温下,铬能缓慢与稀硫酸反应
元素及其化合物在生产、生活中具有广泛的用途。Ⅰ.铬化学丰富多彩.(1)在常温下,铬能缓慢与稀硫酸反应元素及其化合物在生产、生活中具有广泛的用途。
Ⅰ.铬化学丰富多彩.
(1)在常温下,铬能缓慢与稀硫酸反应,生成蓝色溶液。 与铜相比,其金属活泼性 ( 填“强”或“弱”);
⑵Cr( OH) 3 和Al( OH) 3 类似,也是两性氢氧化物,在水中存在酸式和碱式电离平衡,其酸式电离方程式是 ;
⑶工业上净化处理铬污染方法之一是:将含K 2 Cr 2 O 7 酸性废水放人电解槽内,加入适量的NaCl,以Fe和石墨为电极进行电解。经过一段时间后,生成Cr(OH) 3 和Fe(OH) 3 沉淀除去(已知K sP [ Fe(OH) 3 ]=4.0×10 -38 ,K sP [Cr(OH) 3 ]=6.0×l0 -31 )。已知电解后的溶液中c( Fe 3+ )为2.0×10 -13 mol/L,则溶液中c(Cr 3+ )为 mol/L。
Ⅱ.物质A~H有如图所示转化关系(部分生成物未列出)。A、E、F、G均为气体,D为金属单质。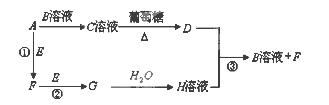
请回答下列问题:
(1)A的电子式为 D的化学式 ,C溶液的名称是 。
(2)反应①的化学方程式为 ;
反应③的离子方程式为 。
 fifaedd1年前1
fifaedd1年前1 -
 游手好闲者 共回答了18个问题
游手好闲者 共回答了18个问题 |采纳率94.4%Ⅰ(1)强(1分) (2)Cr(OH) 3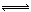 H + +CrO 2 - +H 2 O (2分)
H + +CrO 2 - +H 2 O (2分)
(3)3.0×10 -6 mol?L? 1
Ⅱ(1)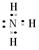 ;Ag(1分);银氨溶液(2分)
;Ag(1分);银氨溶液(2分)
(2)4NH 3 +5O 2 4NO+5H 2 O (2分);3Ag + 4H + +NO 3 ?=3Ag + +2H 2 O+NO↑(2分)
4NO+5H 2 O (2分);3Ag + 4H + +NO 3 ?=3Ag + +2H 2 O+NO↑(2分)
试题分析:Ⅰ(1)在常温下,铬能缓慢与稀硫酸反应,生成蓝色溶液,说明铬的活泼性大于氢,所以铬的活泼性强于铜。
(2)酸式电离生成H + ,所以电离方程式为:Cr(OH) 3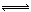 H + +CrO 2 - +H 2 O
H + +CrO 2 - +H 2 O
(3)[c(OH?)] 3 = K sP [ Fe(OH) 3 ]÷c(Fe 3+ )=4.0×10 -38 ÷2.0×10 -13 =2.0×10 -25 ,c(Cr 3+ )= K sP [Cr(OH) 3 ]÷[c(OH?)] 3 =6.0×l0 -31 ÷2.0×10 -25 =3.0×10 -6 mol?L? 1
Ⅱ(1)C溶液与葡萄糖反应生成金属D,则C溶液为银氨溶液,D为Ag,根据框图可知:A为NH 3 ,B为AgNO 3 ,E为O 2 ,F为NO,G为NO 2 ,H为HNO 3 。NH 3 的电子式为: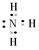
(2)反应①为氨的催化氧化,化学方程式为:4NH 3 +5O 2 4NO+5H 2 O;反应③为Ag与稀硝酸的反应,离子方程式为:3Ag + 4H + +NO 3 ?=3Ag + +2H 2 O+NO↑。 sP 的计算、物质的推断。
1年前查看全部
4NO+5H 2 O;反应③为Ag与稀硝酸的反应,离子方程式为:3Ag + 4H + +NO 3 ?=3Ag + +2H 2 O+NO↑。 sP 的计算、物质的推断。
1年前查看全部
- 过氧化氢俗称双氧水,可用过氧化钡(BaO 2 )与稀硫酸反应来制备。过氧化氢与过氧化钡都是过氧化物,过氧化物一般可用作氧
过氧化氢俗称双氧水,可用过氧化钡(BaO 2 )与稀硫酸反应来制备。过氧化氢与过氧化钡都是过氧化物,过氧化物一般可用作氧化剂、漂白剂、供氧剂等。阅读下文并回答有关问题:
(1)实验室可用过氧化氢溶液制取氧气,其反应的化学方程式是 。
(2)过氧化钠(Na 2 O 2 )也是一种过氧化物,潜水艇常用过氧化钠作供氧剂,同时维持艇内空气成分的稳定,写出这一反应的化学方程式 。 anniemaymay1年前0
anniemaymay1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 为了测定某铜锌合金(即Cu、Zn混合物)中锌的质量分数,某同学利用该合金与稀硫酸反应,进行了三次实验,所得相关数据记录
为了测定某铜锌合金(即Cu、Zn混合物)中锌的质量分数,某同学利用该合金与稀硫酸反应,进行了三次实验,所得相关数据记录
(1)从上表数据分析,当所取合金与所用稀硫酸的质量比为______时.表示合金中的锌与稀硫酸中的硫酸恰好完全反应.第一次 第二次 第三次 所取合金质量/g 25 25 50 所用稀硫酸质量/g 100 160 100 生成氢气质量1g 0.4 0.4 0.4
(2)试计算铜锌合金中铜的质量分数. 遇时1年前1
遇时1年前1 -
 锦衣卫的干活 共回答了20个问题
锦衣卫的干活 共回答了20个问题 |采纳率85%解题思路:(1)铜、锌合金中铜和稀硫酸不反应只有锌和稀硫酸反应,第二次和第一次所取的合金质量相同,第二次所用的稀硫酸比第一次多,而两次生成的气体质量相同,说明两次所取的合金中的锌都完全反应了,由此可以知道25g合金只能生成0.4g氢气;第三次和第一次比较可知100g稀硫酸完全反应只能产生0.4g气体,从而可以判断出稀硫酸和合金恰好完全反应的质量比;
(2)根据氢气的质量结合反应的化学方程式可以计算出锌的质量,进而求出铜的质量分数即可.(1)铜、锌合金中铜和稀硫酸不反应只有锌和稀硫酸反应,第二次和第一次所取的合金质量相同,第二次所用的稀硫酸比第一次多,而两次生成的气体质量相同,说明两次所取的合金中的锌都完全反应了,由此可以知道25g合金只能生成0.4g氢气;第三次和第一次比较可知100g稀硫酸完全反应只能产生0.4g气体,综上可以知道:25g合金中的锌和100g稀硫酸可恰好完全反应,即合金和稀硫酸的质量比为25g:100g=1:4;
(2)设25g铜锌合金中含有锌的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.4g
[65/x=
2
0.4g],
x=13g
铜合金中铜的质量分数为:
25g−13g
25g×100%=48%;
答:铜合金中铜的质量分数为48%.
故答案为:(1)1:4;
(2)48%.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 此题考查的是根据化学方程式的有关计算,学会运用控制变量法来正确的分析处理表中的数据是解答此题的关键.1年前查看全部
- 为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,进行了三次实验,所得相关的实验数据记录如下:
为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,进行了三次实验,所得相关的实验数据记录如下:
(1)写出有关反应的化学方程式;第一次 第二次 第三次 所取合金的质量/g 10 10 20 所用稀硫酸的质量/g 50 80 50 生成氢气的质量/g 0.2 0.2 0.2
(2)从上表数据分析,当所取合金与所用稀硫酸的质量比为______时,表明合金中的锌与稀硫酸恰好完全反应.(提示:铜与稀硫酸不反应)
(3)试计算该铜锌合金中锌的质量分数.
(4)计算当所用合金与稀硫酸恰好完全反应时,所得溶液中溶质的质量分数. celine_chen1年前1
celine_chen1年前1 -
 _raojc0bso5a8_0_ 共回答了20个问题
_raojc0bso5a8_0_ 共回答了20个问题 |采纳率90%解题思路:(1)由于铜与稀硫酸不反应,故铜锌合金与稀硫酸的反应,为锌与稀硫酸的反应,可直接写出反应方程式;
(2)从三次实验数据可知,第一、第二次反应中稀硫酸过量,第三次反应中锌过量,又因为第三次反应中硫酸产生的氢气恰好为0.2g,所以第一次反应中合金中的锌与稀硫酸恰好完全反应,从而得出它们的质量比.
(3)根据第一次实验产生氢气的质量和其所取用的稀硫酸与合金样品的质量,可求出合金中锌的质量;
(4)根据(3)中化学方程式的比例关系,求出溶质的质量,及溶液的总量,代入公式可以求出恰好完全反应后所得溶液中溶质的质量分数.(1)Zn+H2SO4→ZnSO4+H2↑;
(2)由于合金中的锌与稀硫酸恰好完全反应所取合金与所用稀硫酸分别为10g,50g,故其质量比为1:5;
故答案为:1:5.
(3)设合金中锌的质量为x,生成硫酸锌质量为y.
Zn+H2SO4→ZnSO4+H2↑
65 161 2
xy 0.2g
∴x:65=0.2g:2,
解之得:x=6.5g,
该铜锌合金中锌的质量分数为:[6.5/10]×100%=65%;
(4)y:161=0.2g:2,
解之得:y=16.1g,
所得溶液中ZnSO4的质量分数:[16.1g/6.5g+50g−0.2g]×100%=28.6%.
答:(3)该铜锌合金中锌的质量分数为65%;
(4)所得溶液中ZnSO4的质量分数为28.6%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算;酸的化学性质.
考点点评: 本题是借助于数学模型,利用图表的方式来分析和解决化学计算中的有关问题,要求学生有较强的识图能力和数据分析能力.1年前查看全部
- (2005•武汉)在通常状况下,氢气是一种无色、无味的气体,难溶于水,密度比空气小.实验室常用锌粒和稀硫酸反应制取氢气:
 (2005•武汉)在通常状况下,氢气是一种无色、无味的气体,难溶于水,密度比空气小.实验室常用锌粒和稀硫酸反应制取氢气:Zn+H2SO4═ZnSO4+H2↑.为了得到0.20s氢气,某请回答下列问题:
(2005•武汉)在通常状况下,氢气是一种无色、无味的气体,难溶于水,密度比空气小.实验室常用锌粒和稀硫酸反应制取氢气:Zn+H2SO4═ZnSO4+H2↑.为了得到0.20s氢气,某请回答下列问题:
(1)该同学可以用排水(或向下排空气)排水(或向下排空气)法收集氢气(填一种);
(2)实际产生氢气的质量是多少?(精确到0.01g) 大大笨女人1年前1
大大笨女人1年前1 -
 书夫 共回答了11个问题
书夫 共回答了11个问题 |采纳率100%解题思路:(1)根据氢气的性质结合收集气体的方法考虑;
(2)由图示可知,完全反应后,剩余杂质的质量为0.20g,据此计算出锌的质量;然后利用锌与稀硫酸反应的化学方程式和参与反应的锌的质量,就可计算出实际产生氢气的质量.(1)由题意可知,氢气难溶于水,故可用排水法收集;氢气密度比空气小,故可用向下排空气法收集;故答案为:排水(或向下排空气)
(2)设实际生成氢气的质量为x,
依题意可知,锌粒中杂质的质量为0.20g,那么锌的质量为8.00g-0.20g═7.80g.
Zn+H2SO4=ZnSO4+H2↑
652
7.8g x
∴
65
2=
7.8g
x,
解之得:x=0.24g.
答:实际产生氢气的质量是0.24g.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题主要考查学生利用化学方程进行计算的能力.学生要正确识图和分析数量关系,从图中找出有效数据进行计算,不要被其它数据干扰思维.1年前查看全部
- 铝和稀硫酸反应吗
 Pioneer_poa1年前7
Pioneer_poa1年前7 -
 chenjuexiao 共回答了11个问题
chenjuexiao 共回答了11个问题 |采纳率100%能反应,在金属活动顺序表中,铝排在H前面,能置换出稀硫酸中的氢离子,生成氢气和硫酸铝.1年前查看全部
- (2002•东城区)甲、乙、丙三位同学分别取铁粉和铜粉的均匀混合物与某稀硫酸反应,所得数据如下: 甲 乙 丙 取用金属混
(2002•东城区)甲、乙、丙三位同学分别取铁粉和铜粉的均匀混合物与某稀硫酸反应,所得数据如下:
计算:甲 乙 丙 取用金属混合物的质量(/g) 10 10 20 取用稀硫酸的质量(/g) 100 120 100 反应后过滤得到干燥固体的质量(/g) 2 2 12
(1)金属混合物铁的质量分数;
(2)甲制得硫酸亚铁的质量;
(3)该稀硫酸的质量分数. oria_wing1年前1
oria_wing1年前1 -
 kmmeiying 共回答了19个问题
kmmeiying 共回答了19个问题 |采纳率94.7%解题思路:根据铁和铜与酸的反应进行分析,铁能与稀硫酸反应生成氢气,铜不与稀硫酸反应生成氢气,取10g混合物,与100g硫酸和120g硫酸反应都剩余2g固体,则可以判断10g混合物中含有铜的质量为2g,含铁的质量为8g,取20g混合物,与100g硫酸反应剩余12g固体,则说明与8g铁反应需要硫酸的质量为100g,然后根据反应的化学方程式求硫酸亚铁和稀硫酸的质量.(1)取10g混合物,与100g硫酸和120g硫酸反应都剩余2g固体,说明混合物中的铁全部参加反应,可以判断10g混合物中含有铜的质量为2g,含铁的质量为8g,所以混合物中铁的质量分数为:[8g/10g]×100%=80%;
(2)取20g混合物,与100g硫酸反应剩余12g固体,则说明与8g铁反应需要硫酸的质量为100g,所以甲同学取的金属混合物与硫酸恰好完全反应,设生成硫酸亚铁的质量为x
Fe+H2SO4═FeSO4+H2↑
56152
8gx
[56/8g]=[152/x],x=21.71g
(3)设与8g铁反应需要硫酸的质量为y
Fe+H2SO4═FeSO4+H2↑
5698
8g y
[56/8g]=[98/y],y=14g
稀硫酸的质量分数为:[14g/100g]×100%=14%
答:(1)金属混合物中铁的质量分数为80%,
(2)甲制得硫酸亚铁的质量为21.71g,
(3)该稀硫酸的质量分数为14%.点评:
本题考点: 金属活动性顺序及其应用;酸的化学性质;根据化学反应方程式的计算.
考点点评: 本题考查了根据实验数据求混合金属中金属的含量以及所用酸的质量分数和生成物的质量,完成此题,首先要能够根据实验数据确定参加反应的物质的量,然后进行计算.1年前查看全部
- 下列物质中,既能与稀硫酸反应,又能与烧碱溶液反应的是
下列物质中,既能与稀硫酸反应,又能与烧碱溶液反应的是
a NH4Cl
B NH4HS
C Na2CO3
D FeS
C是不可以和NaOH反应的.
A B D里怎么选呢?
A B D怎么选啊
为什么D不对?
A好象也没错饿..
B呢?
FeS为什么不能和碱反应? 红色-tt1年前3
红色-tt1年前3 -
 漫步的傻X 共回答了18个问题
漫步的傻X 共回答了18个问题 |采纳率100%啊,典型的酸式盐,都可以反应
比如和HCL生成氯化氨和H2S气体
和NaOH生成H2O和硫化氨加硫化钠1年前查看全部
- 硫化钠和浓硫酸、稀硫酸反应的方程式分别怎么写
 枉自称侠若许年1年前1
枉自称侠若许年1年前1 -
 大海中的一滴水0 共回答了14个问题
大海中的一滴水0 共回答了14个问题 |采纳率85.7%Na2S + 5 H2SO4(浓)H2S(气体) + Na2SO41年前查看全部
- 硫酸亚铁和稀硫酸反应,化学方程式、
 mz20071年前4
mz20071年前4 -
 小玩家xxn 共回答了17个问题
小玩家xxn 共回答了17个问题 |采纳率82.4%不能反应的.看化合价.硫酸亚铁中硫的化合价和硫酸中的是一样的不能反应的1年前查看全部
- 50g镁、锌、铁的混合物与足量的稀硫酸反应,将混合溶液蒸干后可得不含结晶水的固体146g,则反应生成氢气的质量为( )
50g镁、锌、铁的混合物与足量的稀硫酸反应,将混合溶液蒸干后可得不含结晶水的固体146g,则反应生成氢气的质量为( )
A. 1 g
B. 2 g
C. 3 g
D. 4 g guobicheng1年前1
guobicheng1年前1 -
 sean_sn 共回答了21个问题
sean_sn 共回答了21个问题 |采纳率81%解题思路:由三种金属与硫酸的反应可知:Mg→MgSO4; Zn→ZnSO4; Fe→FeSO4.这个变化中蒸干所得固体比金属增加的质量是硫酸根的质量146g-50g=96g,而后根据H2SO4中氢元素与硫酸根的质量比为2:96计算氢气的质量即可.50g金属全部与SO42-结合,生成盐,质量增重146g-50g=96g. 此增重值即为硫酸根的质量;
设生成氢气的质量为x,
由于该反应生成的氢气质量等于硫酸中氢元素的质量,而依据硫酸的化学式可知氢元素与硫酸根的质量比为2:96;
则[2/96=
x
96g]
x=2g;
故选B点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 运用化学反应中的质量关系,了解物质反应前后有什么不同,从中找出规律,确定计算思路是解决此题的关键.1年前查看全部
- 查阅资料:在金属活动性顺序里,位于氢后面的金属Cu,在常温下虽然不能与稀盐酸、稀硫酸反应,但在加热条件下可以与浓硫酸反应
 查阅资料:在金属活动性顺序里,位于氢后面的金属Cu,在常温下虽然不能与稀盐酸、稀硫酸反应,但在加热条件下可以与浓硫酸反应,其化学方程式为:
查阅资料:在金属活动性顺序里,位于氢后面的金属Cu,在常温下虽然不能与稀盐酸、稀硫酸反应,但在加热条件下可以与浓硫酸反应,其化学方程式为:
Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O
反应生成的SO2是密度比空气大、易溶于水,有刺激性气味的有毒气体
现以铜、浓硫酸为原料,在加热条件下制取二氧化硫,用如图所示实验装置进行实验,发生装置为______,考虑到二氧化硫有毒,收集装置用C,二氧化硫气体应从______(填长或短)导管进入,另一端通入氢氧化钠溶液中加以吸收. fan_lily_12161年前1
fan_lily_12161年前1 -
 zd6jbh9 共回答了21个问题
zd6jbh9 共回答了21个问题 |采纳率95.2%解题思路:制取装置包括加热和不需加热两种,以铜、浓硫酸为原料,在加热条件下制取二氧化硫,用如图所示实验装置进行实验,发生装置为B;考虑到二氧化硫有毒,收集装置用C,二氧化硫气体应从长管进入,因为二氧化硫的密度比空气的密度大.以铜、浓硫酸为原料,在加热条件下制取二氧化硫,用如图所示实验装置进行实验,发生装置为B;考虑到二氧化硫有毒,收集装置用C,二氧化硫气体应从长管进入,因为二氧化硫的密度比空气的密度大,故答案为:B、长;
点评:
本题考点: 常用气体的发生装置和收集装置与选取方法.
考点点评: 本考点主要考查了气体的制取装置和收集装置的选择,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.1年前查看全部
- 铁和稀硫酸反应的化学方程式
 haha7811011年前3
haha7811011年前3 -
 TONGTTT 共回答了20个问题
TONGTTT 共回答了20个问题 |采纳率90%Fe+H2SO4=FeSO4+H2(气体符号)1年前查看全部
- 铜和稀硫酸反应生成NO,再与氧气产生NO2,一个反应,先用铜和稀硫酸反应生成NO,再与氧气产生NO2
铜和稀硫酸反应生成NO,再与氧气产生NO2,一个反应,先用铜和稀硫酸反应生成NO,再与氧气产生NO2
他说不断的加入O2,直到3.2g铜全部溶解共消耗的氧气在标准状况下的体积为多少,
前面的别看,多复制了一个,汗..
一个反应,先用铜和稀硫酸反应生成NO,再与氧气产生NO2
他说不断的加入O2,直到3.2g铜全部溶解共消耗的氧气在标准状况下的体积为多少, mmdd1年前2
mmdd1年前2 -
 pingan1314 共回答了15个问题
pingan1314 共回答了15个问题 |采纳率80%我用手机打,不太方便(是稀硝酸吧?)3铜和8稀硝酸反应生成3硝酸铜和2NO 4H2O(数字是配平系数,为方便理解你可以写出来).2NO O2=2NO2(这反应是可逆的,按题意视为不可逆)(3.2/64)除3乘2(得生成一氧化氮的物质的量)再除2乘22.4得到用去氧的体积.手机上打不方便,你把方程式写出来更好理解1年前查看全部
- 镁铝两种金属分别跟相同体积、相同浓度的稀硫酸反应,同温同压下生成相同体积的氢气,则下列正确的是()
镁铝两种金属分别跟相同体积、相同浓度的稀硫酸反应,同温同压下生成相同体积的氢气,则下列正确的是()
A.两个反应转移的电子数目相等。
B.加入镁铝的质量比为4:3。
C.溶解的金属的的物质的量相等。
D.加入的两种金属的质量不等。
谢谢
请写清各个选项对错的原因谢谢! 情愿开心1年前1
情愿开心1年前1 -
 薛凯琪 共回答了11个问题
薛凯琪 共回答了11个问题 |采纳率100%A对 可以根据“生成氢气的体积相同”判断出产生氢气的物质的量相同,由于氢元素的化合价均是由+1价降低到0价,所以两个反应中转移的电子数相同.
B错.Mg→Mg2+失去2mol电子,Al→Al3+ 失去3mol电子.因为要转移相同的电子数,所以二者物质的量比为3:2,质量比则为 24*3 : 27*2 == 4:3 但加入的镁和铝的质量之比不能确定,B不正确
C错 反应的金属物质的量比为3:2,不相等.
D错 根据B中分析可知,无法计算加入的金属质量,D不正确1年前查看全部
- 质量相同的下列金属分别和足量的稀硫酸反应,放出气体最多的是 A铁 B铝 C锌 D镁
 ff矮寇1年前1
ff矮寇1年前1 -
 ngomes 共回答了18个问题
ngomes 共回答了18个问题 |采纳率94.4%铝
摩尔质量最小1年前查看全部
- 求过硫化钠与稀硫酸反应的方程式
 fanggezi1年前3
fanggezi1年前3 -
 zhangbeishi 共回答了17个问题
zhangbeishi 共回答了17个问题 |采纳率100%Na2S2+H2SO4==Na2SO4+H2S+S应该和过氧化钠的相似1年前查看全部
- 了测定某铜锌合金中锌的质量分数,某同学利用该合金与稀硫酸反应,进行了三次试验,所得相关实验数据如下表(实验中误差不计)
了测定某铜锌合金中锌的质量分数,某同学利用该合金与稀硫酸反应,进行了三次试验,所得相关实验数据如下表(实验中误差不计)
第一次 第二次 第三次
所取合金的质量/g 25 25 50
所用稀硫酸的质量/g 125 160 100
生成氢气的质量/g 0.4 0.4 0.4
(1)计算该铜锌合金中锌的质量分数.
(2)从上表数据分析,当所取合金与所用的稀硫酸的质量比为————时,表示合金中的锌与稀硫酸中的硫酸恰好完全反应, 气不扬1年前1
气不扬1年前1 -
 氤氲郁 共回答了16个问题
氤氲郁 共回答了16个问题 |采纳率75%(1)由第一次、第二次所产生的氢气质量相同可知两次反应皆为完全反应.由题意得:
设铜锌合金中锌的质量为Xg
H2SO4+Zn===H2+ZnSO4
65 2
X 0.4g
0.4g/2=X/65
x/65=0.2g
x=13g
铜锌合金中锌的质量分数=13g/25g=52%
由题意得出
M铜锌合金/稀硫酸=25g/100g
M铜锌合金/M稀硫酸=1/4
M铜锌合金:M稀硫酸=1:4
答:铜锌合金中锌的质量分数为52%,当所取合金与所用的稀硫酸的质量比为1:4时,表示合金中的锌与稀硫酸中的硫酸恰好完全反应.1年前查看全部
- 实验室可用锌与稀硫酸反应制取氢气:Zn+H 2 SO 4 ═ZnSO 4 +H 2 ↑.现在实验室需要氢气2.24L(标
实验室可用锌与稀硫酸反应制取氢气:Zn+H 2 SO 4 ═ZnSO 4 +H 2 ↑.现在实验室需要氢气2.24L(标准状况下,氢气的密度为0.089g/L).
(1)求参加反应的锌的质量.
(2)某兴趣小组用的是从废旧电池中得到的含杂质10%的锌皮制取氢气.现有这种废锌皮15g,与足量的稀硫酸反应,最多得到氢气多少克? 北极淡水鱼1年前1
北极淡水鱼1年前1 -
 dianzi605 共回答了23个问题
dianzi605 共回答了23个问题 |采纳率87%(1)2.24 L氢气的质量为:2.24 L×0.089 g/L≈0.2 g设参加反应的锌的质量为xZn+H 2 SO 4 ═ZnSO 4 +H 2 ↑65&n...1年前查看全部
- 氢氧化钡与稀硫酸反应的化学方程式
 鬼魅浓烈1年前10
鬼魅浓烈1年前10 -
 翡翠落红尘 共回答了23个问题
翡翠落红尘 共回答了23个问题 |采纳率91.3%Ba(OH)2+H2SO4=BaSO4↓+2H2O
BaSO4为白色沉淀.1年前查看全部
- 6克铁与某金属的混合物跟足量的稀硫酸反应,放出0.2克氢气,则铁中混有的金属是什么
6克铁与某金属的混合物跟足量的稀硫酸反应,放出0.2克氢气,则铁中混有的金属是什么
有4个选项
A Mg
B Zn
C Ca
D Na 冷锋991年前3
冷锋991年前3 -
 zhshkhyy 共回答了18个问题
zhshkhyy 共回答了18个问题 |采纳率83.3%Fe+H2SO4==FeSO4+H2
56g 2g
5.6g 0.2g
如果只有铁与稀硫酸反应,生成0.2克H2,则只需要铁56克
而混合物质量是6克,5.61年前查看全部
- Na与稀硫酸反应的化学方程式Na与稀硫酸分几步反应?请写出各步的化学方程式1molNa与稀硫酸反应会生成多少mol的H2
Na与稀硫酸反应的化学方程式
Na与稀硫酸分几步反应?请写出各步的化学方程式
1molNa与稀硫酸反应会生成多少mol的H2? 秋天11111年前1
秋天11111年前1 -
 dally66360 共回答了20个问题
dally66360 共回答了20个问题 |采纳率85%就一步
2Na+H2SO4===Na2SO4+H2
钠与水反应实质就是钠和水电离出来的氢离子反应
硫酸是强酸,钠就先和他反应了1年前查看全部
- 将56克不纯的铁粉与足量的稀硫酸反应,仍能生成2克氢气,是因为( )
将56克不纯的铁粉与足量的稀硫酸反应,仍能生成2克氢气,是因为( )
A. 铁中含有碳和锌
B. 铁表面有铁锈
C. 铁中含有碳和铝
D. 铁中含有碳 bgg5881年前3
bgg5881年前3 -
 空心草 共回答了16个问题
空心草 共回答了16个问题 |采纳率100%解题思路:加入是纯铁时正好生成2g氢气,混入杂质中一定要有含有能生成氢气的物质,且含有的物质中一定含有同质量时比铁生成的氢气多与少的两种物质,采用极端假设法进行分析探讨即可.正常情况下当有56g纯铁粉时可以生成2g氢气
Fe+H2SO4=FeSO4+H2↑
56 2
56g2g
现在由于铁粉不纯生成的氢气同样是2g,这时一定有其他的物质与酸反应生成氢气
先看选项,选项中,除了Fe之外的物质有碳(C),锌(Zn),铁锈(Fe2O3),铝(Al)
碳不与稀硫酸反应;锌与酸反应:65gZn才能生成2g氢气.(如下)
Zn+H2SO4=ZnSO4+H2↑
652
65g2g
铝与酸反应是18g铝生成2g氢气
2Al+3H2SO4=Al2(SO4)3+3H2↑
2x273x2
18g 2g
然后再依据选项组合一下,假如不纯的铁粉中除了铁粉外的物质是碳或是铁锈,而碳和铁锈发生的反应都不生成氢气,所以B和D是错的.
再看A选项,当全部是铁时产生的H2范围是2g,而铁粉不纯(同质量的锌与酸反应生成的氢气要比铁要少),所以A选项产生的氢气一定少于2g
C选项的氢气极限量为(0g-6.2222g)综上,所以选C
故选C点评:
本题考点: 酸的化学性质;根据化学反应方程式的计算.
考点点评: 此题是金属与酸反应制氢气的综合计算,题解题的关键是采用极端假设法对混入的金属进行分析找到可能的组合,属于综合性较强的题目.1年前查看全部
- 下列叙述中正确的是( )①锌跟稀硫酸反应的制取氢气,加入少量硫酸铜溶液能加快反应速率;②镀层破损后,白铁(镀锌的铁)比
下列叙述中正确的是( )
①锌跟稀硫酸反应的制取氢气,加入少量硫酸铜溶液能加快反应速率;②镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)铁更易被腐蚀;③电镀时,应把待镀件置于电解槽的阴极;④用电解法精炼精铜时,粗铜作阳极,纯铜作阴极;⑤钢铁吸氧腐蚀时的正极反应式为2H2O+O2-4e-=4OH-.
A.①②④
B.①③④
C.①③④⑤
D.②④⑤ 自家的田地1年前1
自家的田地1年前1 -
 huazhong99 共回答了25个问题
huazhong99 共回答了25个问题 |采纳率100%解题思路:①根据原电池能加速负极金属和电极质的反应速率来回答;
②在原电池中,活泼金属做负极,负极金属更易腐蚀,正极金属被保护;
③根据电镀原理中,镀件和电镀液的选择原则来回答;
④用电解法精炼精铜时,粗铜作阳极,纯铜作阴极;
⑤钢铁吸氧腐蚀时的正极发生氧气得电子的反应.①锌跟稀硫酸反应的制取氢气,加入少量硫酸铜溶液后,金属锌可以置换金属铜,形成原电池,原电池能加速负极金属和电极质的反应速率,故①正确;
②白铁(镀锌的铁)中,镀层破损后,Zn为负极,被腐蚀的是Zn,Fe被保护,马口铁(镀锡的铁)中,Fe为负极,被腐蚀的是Fe,Zn被保护,所以镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)铁更耐腐蚀,故②错误;
③根据电镀原理中,镀件作阳极,待镀件置于电解槽的阴极,故③正确;
④用电解法精炼精铜时,粗铜作阳极,纯铜作阴极,故④正确;
⑤钢铁吸氧腐蚀时的正极发生氧气得电子的反应,即2H2O+O2+4e-=4OH-,故⑤正确.
故选B.点评:
本题考点: 原电池和电解池的工作原理;金属的电化学腐蚀与防护.
考点点评: 本题是一道综合知识题目,考查学生对原电池原理的应用知识,可以根据所学知识进行回答,难度不大.1年前查看全部
- 写出下列的化学方程式:镁和稀盐酸反应 铁和稀硫酸反应 铁锈和稀硫酸反应 氧化钙和稀硫酸反应
写出下列的化学方程式:镁和稀盐酸反应 铁和稀硫酸反应 铁锈和稀硫酸反应 氧化钙和稀硫酸反应
如题 迪米特里1年前2
迪米特里1年前2 -
 w5uv 共回答了17个问题
w5uv 共回答了17个问题 |采纳率88.2%Mg+2HCl=MgCl2+H2↑
Fe+H2SO4=FeSO4+H2↑
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
CaO+H2SO4=CaSO4+H2↑1年前查看全部
- 用32.5克锌和足量的稀硫酸反应,可制得氢气多少克
用32.5克锌和足量的稀硫酸反应,可制得氢气多少克
[请写出具体计算过程] 轻疯王通1年前2
轻疯王通1年前2 -
 sulonglong 共回答了23个问题
sulonglong 共回答了23个问题 |采纳率82.6%设H2为X克
65/32.5=2/X
X=1
H2为1克1年前查看全部
- 实验室制取氢气通常是用锌与20%的稀硫酸反应.若要制取0.4g氢气,至少需要多少克锌与足量的稀硫酸反应?
 henly1年前2
henly1年前2 -
 fanjici 共回答了16个问题
fanjici 共回答了16个问题 |采纳率93.8%锌+2价,每生成1个分子的氢气 也就是H2,需要一分子的锌 Zn.化学公式如下
Zn+H2SO4=H2+ZnSO4
H2的分子量是2 Zn是65
可得需要Zn=0.4*65/2=13g1年前查看全部
- 某金属粉末由铁、锌、铝、组成与足量的稀硫酸反应生成氢气在标准状况下为3.36L,则该金属混合物的物质的量可能是( ).A
某金属粉末由铁、锌、铝、组成
与足量的稀硫酸反应生成氢气在标准状况下为3.36L,则该金属混合物的物质的量可能是( ).
A.0.15mol B.0.1mol C.0.12mol D.0.14mol 玫瑰香水rose1年前1
玫瑰香水rose1年前1 -
 RLinux 共回答了17个问题
RLinux 共回答了17个问题 |采纳率100%1 mol Fe 和1mol Zn 都是 产生 1 mol H2
而1 mol Al 产生 1.5 mol H2
3.36 L 氢气是 3.36/22.4==0.15 mol
若全部是Al ,则金属物质的量最小,是 0.15/1.5==0.1 mol
若没有Al,则金属物质的量最大,是 0.15/1==0.15 mol
则 0.1< 金属物质的量1年前查看全部
- 一道奥林匹克化学题50克镁、锌、铁的混合物与足量的稀硫酸反应得到的混合溶液,蒸发后得218克固体(已换算成无水硫酸盐).
一道奥林匹克化学题
50克镁、锌、铁的混合物与足量的稀硫酸反应得到的混合溶液,蒸发后得218克固体(已换算成无水硫酸盐).反应设生成氢气的质量___________. 池光不受月1年前2
池光不受月1年前2 -
 lily86752601 共回答了19个问题
lily86752601 共回答了19个问题 |采纳率84.2%Mg+H2SO4=MgSO4+H2 即Mg变成MgSO4 同理Zn变成ZnSO4
Fe变成FeSO4增加的是硫酸根的质量
即50克变成218克增加的是SO4的质量为218-50=168克
在H2SO4中氢和硫酸根的质量比为H2 S O 4
2:96
设生成氢气的质量为x x:168=2:96
x=3.5克1年前查看全部
- 亚硝酸钠和稀硫酸反应亚硝酸钠和20%的稀硫酸反应现象及生成物
 自愚1年前1
自愚1年前1 -
 yuluo359 共回答了20个问题
yuluo359 共回答了20个问题 |采纳率90%生成一氧化氮和二氧化氮,现象是产生棕色气体.1年前查看全部
- 木炭还原氧化铜中黑色固体和稀硫酸反应生成蓝色溶液,黑色固体是什么?
 kssq1年前6
kssq1年前6 -
 mghelei 共回答了19个问题
mghelei 共回答了19个问题 |采纳率89.5%C+2CuO=高温=2Cu+CO2
反应物中黑色粉末是碳和氧化铜,反应一段时间后黑色粉末有三种可能:加入硫酸后1、全部溶解变成蓝色溶液,黑色固体是氧化铜;2、全部不溶,黑色固体是碳;3、黑固部分溶解、溶液变蓝,此时黑色固体既有氧化铜,也有碳.1年前查看全部
- 在实验课上,同学们用锌和稀硫酸反应制取氢气.小明取反应后的溶液164.7g,滴入碳酸钠溶液,先后有气体和白色沉淀生成.加
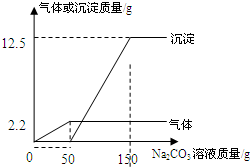 在实验课上,同学们用锌和稀硫酸反应制取氢气.小明取反应后的溶液164.7g,滴入碳酸钠溶液,先后有气体和白色沉淀生成.加入碳酸钠溶液与生成沉淀或气体的质量关系如图.
在实验课上,同学们用锌和稀硫酸反应制取氢气.小明取反应后的溶液164.7g,滴入碳酸钠溶液,先后有气体和白色沉淀生成.加入碳酸钠溶液与生成沉淀或气体的质量关系如图.
(1)滴入碳酸钠溶液后,生成的气体是______;
沉淀是______(填化学式);
(2)碳酸钠溶液中碳酸钠的质量分数为______;
(3)当加入150g碳酸钠溶液时,所得溶液中溶质的
质量分数为多少?(写出计算过程) yinliang1年前1
yinliang1年前1 -
 fenny6 共回答了18个问题
fenny6 共回答了18个问题 |采纳率88.9%解题思路:(1)根据碳酸钠分别与硫酸反应生成二氧化碳、与硫酸锌反应生成碳酸锌沉淀分析;
(2)分别利用氢气的质量和沉淀的质量根据化学方程式计算出参加反应的碳酸钠的质量,再求和,进而求质量分数;
(3)分别利用氢气的质量和沉淀的质量根据化学方程式计算出生成的硫酸钠的质量,再求质量分数(1)发生的反应有:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑,Na2CO3+ZnSO4=ZnCO3↓+Na2SO4,则生成的气体是二氧化碳,沉淀为碳酸锌;
故答案为:CO2; ZnCO3
设硫酸反应消耗碳酸钠的质量为x,生成硫酸钠的质量为y;硫酸锌反应消耗碳酸钠的质量为m,生成硫酸钠的质量为n
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 142 44
x y 2.2g
[106/x=
142
y=
44
2.2g]
x=5.3g,y=7.1g
Na2CO3+ZnSO4=ZnCO3↓+Na2SO4
106125 142
m 12.5g n
[106/m=
125
12.5g=
142
n]
m=10.6g,n=14.2g
(2)碳酸钠溶液中碳酸钠的质量分数为:[5.3g+10.6g/150g×100%=10.6%
答:碳酸钠溶液中碳酸钠的质量分数为10.6%;
(3)反应后溶液的质量:164.7g+150g-2.2g-12.5g=300g
硫酸钠的质量分数:
7.1g+14.2g
300g]×100%=7.1%
答:所得溶液中硫酸钠的质量分数为7.1%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 要明确该题中发生反应的过程,理清思路是解决该题的关键,有一定难度.1年前查看全部
- 氢氧化铝和稀硫酸反应的化学方程式是什么
 gylgdx1年前3
gylgdx1年前3 -
 xudongfl 共回答了20个问题
xudongfl 共回答了20个问题 |采纳率95%2 Al(OH)3 + 3 H2SO4 = Al2(SO4)3 + 3 H2O1年前查看全部
- 下列制取和收集气体的方法正确认识( ) A.用铜和稀硫酸反应制取氢气 B.用向上排空气法收集氢气 C.用KClO 3
下列制取和收集气体的方法正确认识( ) A.用铜和稀硫酸反应制取氢气 B.用向上排空气法收集氢气 C.用KClO 3 和MnO 2 共热制取O 2 D.用向下排空气法收集氧气  很帅的小伙子1年前1
很帅的小伙子1年前1 -
 BOBO_七 共回答了17个问题
BOBO_七 共回答了17个问题 |采纳率94.1%A、铜排在氢的前面,不和稀硫酸反应,故A错误;
B、因为氢气的密度小于空气的密度,应用向下排空气法收集,故B错误;
C、根据制取氧气的原理,在二氧化锰做催化剂下氯酸钾加热可以制取氧气,故C正确;
D、因为氧气的密度大于空气,不易用向下排空气法收集,应用向上排空气法收集,故D错误.
故选C.1年前查看全部
- 下列物质中既能与稀硫酸反应又能与氢氧化钠溶液作用生成红褐色沉淀的是
下列物质中既能与稀硫酸反应又能与氢氧化钠溶液作用生成红褐色沉淀的是
A.氯化铁 B.CO2 C.硝酸铜 D.盐酸 lilysy1年前3
lilysy1年前3 -
 lllxlll01 共回答了20个问题
lllxlll01 共回答了20个问题 |采纳率85%A
2FeCl3+3H2SO4=Fe2(SO4)3+6HCl 不过这条好像不行,不符合复分解反应的条件,没有生成水,气体或沉淀
FeCl3+3NaOH=Fe(OH)3下箭头+3NaCl
其中氢氧化铁为红褐色沉淀
在初中阶段,只要一看到是红褐色沉淀的碱就应该想到氢氧化铁,所以就应该先考虑有铁离子的化合物1年前查看全部
- 含杂质的铁20g与足量的100g稀硫酸反应
含杂质的铁20g与足量的100g稀硫酸反应
充分反应后称得溶液质量119.4g,杂质不反应,则铁的纯度是多少?
请给出完整步骤 应素1年前2
应素1年前2 -
 slayer19771017 共回答了22个问题
slayer19771017 共回答了22个问题 |采纳率90.9%逸出氢气0.6g.
则参与反应的铁的质量为16.8g.
其质量分数为16.8/20=84%1年前查看全部
- 氧化铝和稀硫酸反应的化学方程式为?氧化钙和稀硫酸反应的化学方程式为?
氧化铝和稀硫酸反应的化学方程式为?氧化钙和稀硫酸反应的化学方程式为?
1.氧化铝和稀盐酸反应的化学方程式为?
2.氧化钙和稀盐酸反应的化学方程式为?
3.氧化镁和稀硫酸反应的化学方程式为?
4.氧化铝和稀硫酸反应的化学方程式为? jelly_jun1年前5
jelly_jun1年前5 -
 eazic 共回答了15个问题
eazic 共回答了15个问题 |采纳率80%Al2O3+6HCl=2AlCl3+3H2O
CaO+2HCl=CaCl2+H2O
MgO+H2SO4=MgSO4+H2O
Al2O3+3H2SO4=Al2(SO4)3+3H2O1年前查看全部
- 铝和稀硫酸反应:2Al + 3H2SO4 === Al2(SO4)3 + 3H2↑
铝和稀硫酸反应:2Al + 3H2SO4 === Al2(SO4)3 + 3H2↑
氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O
生成物中,为什么 SO4 括号外面还要有个3呢 fjk1681681681年前6
fjk1681681681年前6 -
 无的放矢乱弓长弓 共回答了16个问题
无的放矢乱弓长弓 共回答了16个问题 |采纳率100%物质的化合价总和要为0楼主知道不,Al的化合价是+3,SO4的化合价是-2,(+3)*2+(-2)*3=0,而铁的化合价也是+3,跟上面一样的式子(+3)*2+(-2)*3=0,楼主明白不1年前查看全部
- CU和稀硫酸反应H2SO4后面要不要一个【(稀)】?
CU和稀硫酸反应H2SO4后面要不要一个【(稀)】?
速度 秒采纳
 QOOOQ1年前1
QOOOQ1年前1 -
 lzmlpp 共回答了19个问题
lzmlpp 共回答了19个问题 |采纳率89.5%不需要.只有浓的时候需要标记1年前查看全部
- 硝酸钡与稀硫酸反应的问题ba{no3}2+h2SO4(稀)=2HNO3+BASO4 其中硝酸根具有强氧化性 为什么HNO
硝酸钡与稀硫酸反应的问题
ba{no3}2+h2SO4(稀)=2HNO3+BASO4 其中硝酸根具有强氧化性 为什么HNO3 没有生成水和硝酸气体 在离子反应中他们不是不能共存吗 yy58461年前5
yy58461年前5 -
 188s8 共回答了19个问题
188s8 共回答了19个问题 |采纳率100%硝酸在浓度较高时表现出强氧化性,而在浓度较低时,主要表现为酸性.一般只有浓硝酸才会发生分解反应,生成NO2,NO,H2O.没有硝酸气体一说.在该反应中,浓度不高,又没有强还原剂,所以不会发生氧化还原反应,生成的是BaSO4沉淀,H+和NO3-,离子方程式为Ba(2+)+SO4(2-)→BaSO4↓1年前查看全部
- 氧化铁与稀硫酸反应生成?还有Fe(OH)3与盐酸反应生成?Fe在氧气中燃烧生成?最好写一下方程式!
 gmwhran1年前3
gmwhran1年前3 -
 sokrates 共回答了17个问题
sokrates 共回答了17个问题 |采纳率88.2%Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
Fe(OH)3+3HCl=FeCl3+3H2O
3Fe+2O2=Fe3O41年前查看全部
大家在问
- 1如图所示,光滑的水平面上有两块相同的长木板A和B,长度均为0.5m,在 B的中间位置有一个可以看作质点的小铁块
- 2材料:近些年来由于环保措施得到有效的执行,南极洲上空的臭氧空洞正在不断缩小,预计到2050年之前,这个“臭名昭著”的巨大
- 3保护生态平衡 作文
- 4证明:方阵A与B相似的充要条件是,存在方阵P,Q使A=PQ,B=QP,且P,Q中至少有一个是可逆矩阵
- 5这两句英语有没有问题?如果有的话请帮忙修改.1.Self-esteem,which is like a catalyst
- 6The bridge was named___the hero who gave his life for the ca
- 7比较a方除以b加b方除以a和a加b的大小
- 8假定你是李华,计划今年寒假和家人一起去泰国旅游。你已经预定了去泰国的机票,但是当你登陆泰国铁路订
- 9正方体ABCD-A1B1C1D1中,E、F、G、H、K、L分别是DC、DD1、A1D1、A1B1、BB1、BC的中点,O
- 10Boys and girls, do you have any trouble
- 11x平方-10x+25≥0
- 12my bag have got four wheels哪错了
- 13做8件上衣和7条裤子共用布19米,2件上衣用的布相当于3条裤子用的布.每件上衣和每件裤子各用布多少米?
- 14若α,β∈(0,π/4),tan(α/2)/1-tan(α/2)=1/4.且3sinβ=sin(2α+β)
- 15()北()腰()死()悲()吞()咽()心()肺()立()群()朋()友(写动物的词语)
