14工业制硝酸(以氨气为原料)?方程式是啥啊?
 hongjean5202022-10-04 11:39:541条回答
hongjean5202022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 帅帅西 共回答了26个问题
帅帅西 共回答了26个问题 |采纳率88.5%- (1)工业制法——氨的催化氧化法
主要原料:NH3、空气、水
生产原理:4NH3+5O2 4NO+6H2O
2NO+O2=2NO2
3NO2+H2O=2HNO3+NO
尾气吸收:2NO2+2NaOH=NaNO3+NaNO2+H2O
NO+NO2+2NaOH=2NaNO2+H2O
HNO3的浓缩:用Mg(NO3)2或浓H2SO4作吸水剂,蒸馏所得的HNO3可得发烟硝酸.
注:①由2NO+O2=2NO2、3NO2+H2O=2HNO3+NO可得总反应:
4NO2+O2+2H2O=4HNO3 、4NO+3O2+2H2O=4HNO3
②工业制硝酸过程中,由于有循环氧化吸收作用,故理论上1 mol NH3可制得1 mol HNO3 - 1年前
相关推荐
- (1)一氧化氮是工业制硝酸的中间产物,生成一氧化氮的化学方程式:4X+5O2 催化剂 .
(1)一氧化氮是工业制硝酸的中间产物,生成一氧化氮的化学方程式:4X+5O2
4NO+6H2O,根据质量守恒定律可以推断出X的化学式:______.催化剂 .
(2)尾气中含一氧化氮、一氧化碳等有毒气体,处理方法是在汽车尾气管上装一个催化转化器,在催化作用下,一氧化氮与一氧化碳生成二氧化碳和氮气,该反应的方程式为:2CO+2NO
2CO2+N2催化剂 .2CO+2NO.
2CO2+N2催化剂 . 忘年情缘1年前1
忘年情缘1年前1 -
 裁决者 共回答了20个问题
裁决者 共回答了20个问题 |采纳率90%解题思路:(1)根据质量守恒定律,化学反应前后元素种类及原子个数不变,分别统计出反应前后原子种类及个数,比较分析可得所求物质的化学式.(2)根据反应物,生成物,反应条件正确写出方程式.(1)根据质量守恒定律,化学反应前后元素种类及原子个数不变,由方程式可知,生成物中各元素及原子个数为:N,4;O,10;H,12; 已知反应物中各元素及原子个数为:O,10; 比较可知X中含有N和H元素,原子个数分别为1和3,故化学式为 NH3,故答案为NH3
(2)根据反应物是一氧化氮与一氧化碳,生成物是二氧化碳和氮气,反应条件是催化剂,写出方程式为2CO+2NO
催化剂
.
2CO2+N2;故答案为2CO+2NO
催化剂
.
2CO2+N2
故答案为:(1)NH3 (2)2CO+2NO
催化剂
.
2CO2+N2点评:
本题考点: 有关化学式的计算和推断;书写化学方程式、文字表达式、电离方程式.
考点点评: 解此类题需认真仔细,逐一分析,要会根据反应物,生成物及反应条件正确书写方程式,这是学习化学的重要内容.1年前查看全部
- (2014•嘉定区二模)硝酸是一种重要的化工原料,工业制硝酸时产生的废气(主要成分NO2和NO)可以用NaOH溶液来吸收
(2014•嘉定区二模)硝酸是一种重要的化工原料,工业制硝酸时产生的废气(主要成分NO2和NO)可以用NaOH溶液来吸收,以除去这些废气.其主要反应为:2NO2+2NaOH→NaNO2+NaNO3+H2ONO+NO2+2NaOH→2NaNO2+H2O.
(1)1mol NO和1.4mol NO2混合气体通入NaOH溶液被完全吸收时,消耗NaOH物质的量为______mol;生成的NaNO3是______mol.
(2)NO和NO2的混合气体的组成可表示为NOX,该混合气体通入NaOH溶液被完全吸收时,x的值不可能为______(填编号).
a.1.3b.1.5c.1.6d.1.9
硝酸的盐也是重要化工原料,易溶于水,高温时具有强氧化性、易分解等性质.
取11.28g Cu(NO3)2无水晶体,强热使其完全分解,得到NO2、O2和4.64固体氧化物.将气体用水充分吸收后,还有气体剩余,同时得到100mL溶液.
请通过计算确定:(要求写出计算过程)
(3)所得溶液的物质的量浓度.
(4)残留固体的成分和质量分别是多少克? 清晨去看海1年前1
清晨去看海1年前1 -
 hanyedc 共回答了13个问题
hanyedc 共回答了13个问题 |采纳率100%解题思路:(1)NO和NO2混合气体通入NaOH溶液被完全吸收,生成物为NaNO2和NaNO3,根据反应的方程式计算;
(2)混合气体通入NaOH溶液被完全吸收时,应满足n(NO2)≥n(NO);
(3)(4)发生2Cu(NO3)2→2CuO+4NO2+O2、4NO2+O2+2H2O→4HNO3,以此计算.(1)1molNO和1.4molNO2混合气体通入NaOH溶液被完全吸收,
NO+NO2+2NaOH→2NaNO2+H2O
1mol 1mol2mol2mol
反应后剩余0.4molNO2,
2NO2+2NaOH→NaNO2+NaNO3+H2O
2mol2mol 1mol
0.4mol0.4mol 0.2mol
则消耗NaOH为2mol+0.4mol=2.4mol,生成的NaNO3物质的量为0.2mol,
故答案为:2.4;0.2;
(2)由方程式可知混合气体通入NaOH溶液被完全吸收时,应满足n(NO2)≥n(NO),即x≥1.5,故答案为:a;
(3)发生2Cu(NO3)2→2CuO+4NO2+O2、4NO2+O2+2H2O→4HNO3,由于还有气体剩余,故只可能是O2,此部分O2由CuO 受热分解生成Cu2O所得,
故反应前N 元素全部转换成之后的HNO3溶液中的HNO3,故所得溶液的物质的量浓度为
11.28g
188g/mol×2
0.1L=1.2mol/L,
答:所得溶液的物质的量浓度为1.2mol/L;
(4)设生成CuO的物质的量为x mol,Cu2O的物质的量为 y mol
x+2y=[11.28/188]=0.06
80x+144y=4.64
解得 x=0.04,y=0.01,
质量分别为0.04mol×80g/mol=3.2g,144g/mol×0.01mol=1.44g,
答:CuO的质量为3.2g,Cu2O的质量为1.44g.点评:
本题考点: 化学方程式的有关计算;有关混合物反应的计算.
考点点评: 本题考查化学方程式的计算,题目难度不大,本题关键是能够把握反应的特点,根据方程式计算相关物理量,易错点为(3),注意把握题给信息.1年前查看全部
- 工业制硝酸流程 只要化学方程式。求好心人指教 谢谢!
 wangxl0011年前1
wangxl0011年前1 -
 乖乖猫oo 共回答了15个问题
乖乖猫oo 共回答了15个问题 |采纳率60%4NH3+5O2==(催化剂,加热)4NO+6H2O 2NO+O2==2NO2 3NO2+H2O==2HNO3+NO 总反应:12NH3+21O2==8HNO3+14H2O+4NO1年前查看全部
- 工业制硝酸的主要反应是4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H=-akJ/mol(a>0)
工业制硝酸的主要反应是4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H=-akJ/mol(a>0)
(1)如图将4molNH3和5molO2放入容器中,达到平衡时,放出热量0.8a kJ,则反应时转移的电子数为______mol.
(2)若其他条件不变,下列关系图中错误的是______(选填序号)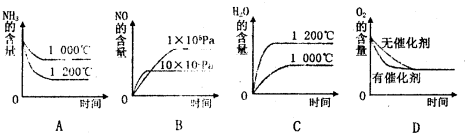
(3)t℃时,在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表
①反应在第2min到第4min时,反应速率v(O2)=______.浓度
时间c(NH3) c(O2) c(NO) c(H2O) 起始 4.0 5.4 0 0 第2min 3.2 1 0.8 1.2 第4min 2.0 3.0 2.0 3.0 第6min 2.0 3.0 2.0 3.0
②第2min时改变了条件,改变的条件可能是______.
A.升高温度B.使用了催化剂C.减小压强D.增加了生成物
③在相同的温度下,起始向容器中加入NH、O2、NO和H2O(g)的浓度都为1mol/L,则该反应将向______方向进行(填“正反应”、“逆反应”、“不移动”).
(4)工业上用水吸收二氧化氮生产硝酸,生成的气体经过多次氧化、吸收的循环操作使其充分转化为硝酸(假定上述过程中无其他损失),现有一定量的NO2经过______次循环操作后,才能使95%以上的NO2转化为HNO3.
(5)成品硝酸的浓度为60%~70%,为了制浓硝酸,常用Mg(NO3)2作吸水剂,然后进行蒸馏,不用CaCl或MgCl2作吸水剂的原因是______. ANGEL_文1年前1
ANGEL_文1年前1 -
 goldmuscle 共回答了23个问题
goldmuscle 共回答了23个问题 |采纳率78.3%解题思路:(1)根据转移电子和放出热量之间的关系式计算;
(2)A.升高温度,正逆反应速率都增大,反应达到平衡的时间缩短,平衡向吸热反应方向移动;
B.增大压强,正逆反应速率都增大,反应达到平衡的时间缩短,平衡向气体体积减小的方向移动;
C.升高温度,正逆反应速率都增大,反应达到平衡的时间缩短,平衡向吸热反应方向移动;
D.使用催化剂加快反应速率,缩短反应到达平衡的时间,但平衡不移动;
(3)①先根据v=[△C/△t]计算一氧化氮的反应速率,再根据同一可逆反应中,同一时间段内,各元素的反应速率之比等于其计量数之比确定氧气的反应速率;
②先分析图表,再根据外界对化学平衡的影响分析;
③根据浓度商与化学平衡常数的相对大小判断移动方向;
(4)根据等比数列计算前n项和,再根据其转化率公式计算;
(5)盐酸易挥发导致硝酸中含有氯化氢.(1)将4molNH3和5molO2放入容器中,达到平衡时,放出热量0.8akJ,根据氧气和放出热量的关系式知,参加反应的氧气的物质的量=[0.8kJ×5mol/1kJ]=4mol,根据氧气和转移电子之间的关系式得,转移电子的物质的量=[4mol×20mol/5mol]=16mol,故答案为:16;
(2)A.升高温度,正逆反应速率都增大,反应达到平衡的时间缩短,平衡向吸热反应方向移动,氨气的含增大,故A错误;
B.增大压强,正逆反应速率都增大,反应达到平衡的时间缩短,平衡向气体体积逆反应方向移动,则一氧化氮的含量减少,故B正确;
C.升高温度,正逆反应速率都增大,反应达到平衡的时间缩短,平衡向逆反应方向移动,则水的含量减少,故C错误;
D.使用催化剂加快反应速率,缩短反应到达平衡的时间,但平衡不移动,则氧气的含量不变,故D正确;
故选AC;
(3)①反应在第2min到第4min时,反应速率v(NO)=[2.0−0.8/2mol/(L.min)=0.6mol/(L.min),同一可逆反应中,同一时间段内,各元素的反应速率之比等于其计量数之比确定氧气的反应速率,则v(O2)=
0.6×5
4]mol/(L.min)=0.75mol/(L.min),故答案为:0.75mol/(L.min);
②根据生成物第2min及第4min时物质的量浓度的变化量知,第2min到第4min时反应速率增大,且平衡向正反应方向移动,则第2min时改变了条件,升高温度或使用催化剂,故选AB;
③第6min时,各种物质的浓度不变,说明该反应达到平衡状态,化学平衡常数K=
(2.0)4.(3.0)6
(2.0)4.(3.0)5=3.0,
Q=
14.16
14.15=1<3,则平衡向正反应方向移动,故答案为:正反应;
(4)设起始时NO2物质的量为1 mol,经过n次循环后生成HNO3的物质的量为:Sn=[2/3]+[2/3]×[1/3]+[2/3×(
1
3)2+・・・・・・+
2
3]×([1/3])n-1,经等比数列求和得Sn=
2
3[1−(
1
3)n]
1−
1
3=1-([1/3])n,因此,NO2→HNO3转化率为
1−(
1
3)n
1×100%,
1−(
1
3)n
1×100%=95%,因此,n=2.6≈3,要经过3次循环操作才能使95%的NO2转化为HNO3,
故答案为:3;
(5)防止生成易挥发的HCl混入硝酸中,导致得到的硝酸不纯,故答案为:防止生成易挥发的HCl混入硝酸中.点评:
本题考点: 体积百分含量随温度、压强变化曲线;氧化还原反应;化学平衡的影响因素.
考点点评: 本题考查了化学平衡的影响因素、氧化还原反应等知识点,涉及等比数列的运用,结合数学知识来分析解答,难点是计算循环次数及反应方向的判断,难度中等.1年前查看全部
- (2013•嘉定区一模)一氧化氮是大气的主要污染物之一.它是工业制硝酸的中间产物,生成一氧化氮的化学方程式为:4X+5O
(2013•嘉定区一模)一氧化氮是大气的主要污染物之一.它是工业制硝酸的中间产物,生成一氧化氮的化学方程式为:4X+5O2
4NO+6H2O,根据质量守恒定律,可以推断出X的化学式为( )催化剂
A.NH3
B.NO2
C.HNO3
D.CO pkyo1年前1
pkyo1年前1 -
 飞行111 共回答了27个问题
飞行111 共回答了27个问题 |采纳率88.9%解题思路:根据化学变化前后原子的种类、个数不变,由反应的化学方程式4x+5O2
4NO+6H2O,可推断反应物X的分子构成,确定反应物X的化学式;催化剂 .△ 由反应的化学方程式4x+5O2
催化剂
.
△4NO+6H2O,根据化学变化前后原子的种类、个数不变,可判断物质x的4个分子中含有4个氮原子、12个氢原子,则物质x的分子由1个氮原子、3个氢原子所构成,因此物质x的化学式为NH3;
故选A点评:
本题考点: 质量守恒定律及其应用.
考点点评: 通过书写化学方程式及利用化学方程式推断物质的化学式,本题对化学方程式的书写及意义进行基础考查.1年前查看全部
- 工业制硝酸的尾气因为含有NO、NO2等有害物质而不能直接排放,工业上普遍采用催化还原法将NOx转化成N2和H2O而除去.
工业制硝酸的尾气因为含有NO、NO2等有害物质而不能直接排放,工业上普遍采用催化还原法将NOx转化成N2和H2O而除去.下列式子是相应物质间的关系式(未配平):CH4+NO+NO2→N2+CO2+H2O有关说法不正确的是( )
A.物质的量之比可能是:CH4:NO:NO2=1:2:1
B.氧化性比较:NO2>NO>CO2
C.NO2既有氧化性又有还原性,在该反应中只有氧化性
D.将反应后的气体通过石灰水可得到纯净的氮气 wnlxyyy1年前1
wnlxyyy1年前1 -
 tgyjh 共回答了16个问题
tgyjh 共回答了16个问题 |采纳率81.3%解题思路:A.根据氧化还原反应中得失电子数相等判断;
B.同一化学反应中氧化剂的氧化性大于氧化产物的氧化性;
C.处于最高价态的元素只有氧化性,处于最低价态的元素只有还原性,处于中间价态的元素既有氧化性又有还原性,再结合反应方程式判断二氧化氮的性质;
D.氮气中含有水蒸气.A.如果物质的量之比是:CH4:NO:NO2=1:2:1,则氧化剂得到的电子数=2(2-0)+1(4-0)=8,还原剂失去的电子数=[4-(-4)]=8,所以得失电子数相等,故A正确;
B.反应3NO2+H2O=2HNO3+NO中,氧化性NO2>NO,CH4+NO+NO2→N2+CO2+H2O中,氧化性NO>CO2,所以氧化性NO2>NO>CO2,故B正确;
C.NO2中N元素处于中间价态,所以NO2既有氧化性又有还原性,但在该反应中得电子作氧化剂,所以只有氧化性,故C正确;
D.将反应后的气体通过石灰水,二氧化碳能被石灰水吸收,但氮气中含有水蒸气,所以不可得到纯净的氮气,故D错误;
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,易错选项是A,注意根据得失电子数相等来分析解答.1年前查看全部
- (2012•钦州)工业制硝酸主要反应的化学方程式为:3NO2+H2O=2HNO3+X,则X的化学式是( )
(2012•钦州)工业制硝酸主要反应的化学方程式为:3NO2+H2O=2HNO3+X,则X的化学式是( )
A.N2
B.N2O4
C.NO2
D.NO jack-jack1年前1
jack-jack1年前1 -
 咖喱黑猫 共回答了23个问题
咖喱黑猫 共回答了23个问题 |采纳率95.7%解题思路:根据质量守恒定律的微观解释:化学反应前后原子的种类和数目不变.可知在化学反应方程式中,反应物和生成物中所含的原子的种类和数目相同.由此可推断化学反应方程式中反应物或生成物的化学式.根据质量守恒定律和化学方程式可知,X的化学式中含有N的个数为:3-2=1,含有O的个数为:3×2+1-2×3=1,含有H的个数为:2-2=0;故X的化学式为:NO.
故选D.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题是运用化学中的基本思想质量守恒思想,通过归纳不同物质或不同变化过程中相同点和不同点有效地寻找出它们之间的内在联系以及融合点和嫁接点,从而培养了学生的创新思维能力.1年前查看全部
- 工业制硝酸时,发生反应:4NH3(氨气)+5O2 催化剂 . 4NO+6H2O.下列对该反
工业制硝酸时,发生反应:4NH3(氨气)+5O2
4NO+6H2O.下列对该反应的理解正确的是( )催化剂 .
A.该反应属于置换反应
B.参加反应的NH3与O2的质量比为4:5
C.NH3中氮元素的化合价为-3
D.反应中除NH3外其余三种物质均属于氧化物 悠游小鱼1年前1
悠游小鱼1年前1 -
 鲁伊科斯塔 共回答了19个问题
鲁伊科斯塔 共回答了19个问题 |采纳率94.7%解题思路:A、依据置换反应的概念解决;
B、依据化学方程式的意义分析解答;
C、依据化合价原则分析解答;
D、依据氧化物的特点分析解答;A、置换反应的特征是反应物生成物均是由一种单质和一种化合物组成,而该反应的生成物是两种化合物,所以该反应不是置换反应;
B、依据方程式4NH3(氨气)+5O2
催化剂
.
4NO+6H2O可知NH3与O2的质量比为4×17:5×32=17:40;
C、化合物中各元素的化合价代数和是零,由于NH3中氢的化合价是+1,所以氮元素的化合价为-3;
D、氧化物是有两种元素组成且其中一种元素为氧元素的化合物,故两种反应物都不是氧化物,而两种生成物均是氧化物;
故选C点评:
本题考点: 置换反应及其应用;从组成上识别氧化物;有关元素化合价的计算.
考点点评: 此题是对工业制硝酸有关问题的考查,解题的关键是掌握反应类型物质的质量比的计算以及元素的化合价等方面知识的掌握;1年前查看全部
- (2002•兰州)(1)一氧化氮是工业制硝酸的中间产物,生成一氧化氮的化学方程式为:4x+5O2催化剂.△4NO+6H2
(2002•兰州)(1)一氧化氮是工业制硝酸的中间产物,生成一氧化氮的化学方程式为:4x+5O2
4NO+6H2O,根据质量守恒定律可以推断出x的化学式:______.催化剂 .△
(2)汽车尾气中含有一氧化氮,一氧化碳等有毒气体,治理的方法是在汽车尾气管上装一个催化转化器,在催化剂的作用下,一氧化氮与一氧化碳生成二氧化碳和氮气,该反应的方程式为:2NO+2CO
2CO2+N2催化剂 .2NO+2CO.
2CO2+N2催化剂 . ck2131年前1
ck2131年前1 -
 瓣2007 共回答了16个问题
瓣2007 共回答了16个问题 |采纳率87.5%解题思路:(1)根据化学变化前后原子的种类、个数不变,由反应的化学方程式4x+5O2
4NO+6H2O,可推断反应物X的分子构成,确定反应物X的化学式;催化剂 .△
(2)根据在催化剂的作用下,一氧化氮与一氧化碳生成二氧化碳和氮气,确定反应的反应物、生成物,完成反应的化学方程式.(1)由反应的化学方程式4x+5O2
催化剂
.
△4NO+6H2O,根据化学变化前后原子的种类、个数不变,可判断物质x的4个分子中含有4个N原子、12个H原子,则物质x的分子由1个N原子、3个H原子所构成,因此物质x的化学式为NH3;
(2)在催化剂的作用下,一氧化氮与一氧化碳生成二氧化碳和氮气,该反应的方程式为2NO+2CO
催化剂
.
2CO2+N2;
故答案为:(1)NH3;
(2)2NO+2CO
催化剂
.
2CO2+N2点评:
本题考点: 有关化学式的计算和推断;书写化学方程式、文字表达式、电离方程式.
考点点评: 通过书写化学方程式及利用化学方程式推断物质的化学式,本题对化学方程式的书写及意义进行基础考查.1年前查看全部
- 工业制硝酸第一步(氨的催化氧化)
 -战ii枭雄-1年前1
-战ii枭雄-1年前1 -
 侯冰冰 共回答了23个问题
侯冰冰 共回答了23个问题 |采纳率91.3%其法以氨和空气为原料,用Pt—Rh合金网为催化剂在氧化炉中于 800℃进行氧化反应,生成的NO在冷却时与O2生NO2,NO2在吸收塔内用水吸收在过量空气中O2的作用下转化为硝酸,最高浓度可达50%.
4NH3+5O2=催化剂、高温=4N0+6H20 ①
2NO+O2==2NO2 ②
3NO2+H2O==2HNO3+NO ③
4NO2+O2+2H2O==4HNO3 ④
③中的NO可以进入②中继续利用制取的50%的硝酸用硝酸镁或者浓H2SO4做吸水剂,蒸馏,可得到高浓度的硝酸, 甚至98%以上的“发烟”硝酸.
尾气处理, 生产过程中NO循环使用,可以最大程度利用原料,并且减少尾气中的NOX 的排放,
尾气一般用NaOH溶液进行吸收 ,发生氧化还原反应,可以综合利用尾气中的NOX
2NO2+2NaOH =NaNO2 +NaNO3 +H2O
NO +NO2 +2NaOH =2NANO3+H2O1年前查看全部
- 工业制硝酸的其中一步反应为氨气的氧化,反应方程式为:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)
工业制硝酸的其中一步反应为氨气的氧化,反应方程式为:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)
ΔH=-1 025 kJ/mol,氧化过程中还伴随有N2O、N2等物质生成.有
关该反应的说法不正确的是( )
A.反应处于平衡状态时,c(NH3)·c(O2)=c(NO)·c(H2O)
B.反应达到平衡后,3v正(NH3)=2v逆(H2O)
C体系的总压强不变,说明反应已达平衡
D体系的温度不再变化,说明反应已达平衡 狗尾巴哥哥rr1年前1
狗尾巴哥哥rr1年前1 -
 小葵0128 共回答了18个问题
小葵0128 共回答了18个问题 |采纳率100%A是不对的,平衡的时候各物质组成成分不变,指的是正逆反应达到稳定状态,并不意味着浓度之间存在什么样的联系.
B里面,达到平衡的时候,假设有4molNH3和5molO2反应,同时也有4molNO和6molH2O反应,所以反应速率,NH3和H2O的比是4:6=2:3
C里面,平衡的时候各物质组成成分不变,那也就意味着物质的量总量不变,压强不变
D正逆反应同时进行,正方向吸热,逆方向放热,热量值的绝对值相等,所以温度也不变1年前查看全部
- 工业制硝酸中为了制取更高浓度的硝酸,为什么可将稀硝酸与硝酸镁混合后蒸馏浓缩
 mimiaifei1年前1
mimiaifei1年前1 -
 Robben16 共回答了17个问题
Robben16 共回答了17个问题 |采纳率94.1%硝酸镁具有吸水性和难挥发性,而硝酸具有挥发性,加入硝酸镁混合后蒸馏时硝酸挥发,同时少量水也变成水蒸气挥发出来,经过冷却可得高浓度的硝酸.不知你明白了吗?1年前查看全部
- (1)一氧化氮是大气的主要污染物之一,它是工业制硝酸的中间产物,生成一氧化氮的化学方程式为:4x+5O2
(1)一氧化氮是大气的主要污染物之一,它是工业制硝酸的中间产物,生成一氧化氮的化学方程式为:4x+5O2
4NO+6H2O,据质量守恒定律,可以推断出x的化学式是______;催化剂 .
(2)汽车尾气中含有一氧化氮、一氧化碳等有毒气体,治理的方法是在汽车尾气的排气管中装一个催化转化器,使NO、CO反应生成二氧化碳和氮气.此反应化学方程式为2NO+2CO
2CO2+N2催化剂 .2NO+2CO.
2CO2+N2催化剂 .
(3)除NO外,二氧化硫也是大气污染物之一,它主要的危害是形成______.发生这种危害的反应方程式为______. 凄冷无依1年前1
凄冷无依1年前1 -
 借酒问天 共回答了22个问题
借酒问天 共回答了22个问题 |采纳率90.9%解题思路:(1)根据化学变化前后原子的种类、个数不变,由反应的化学方程式4x+5O2
4NO+6H2O,可推断反应物X的分子构成,确定反应物X的化学式;催化剂 .△
(2)题目已经给出反应物和生成物,只要注明条件和配平即可;
(3)了解酸雨的作用,正确书写化学方程式.(1)由反应的化学方程式4x+5O2
催化剂
.
△4NO+6H2O,根据化学变化前后原子的种类、个数不变,可判断物质x的4个分子中含有4个氮原子、12个氢原子,则物质x的分子由1个氮原子、3个氢原子所构成,因此物质x的化学式为NH3;
(2)根据题目信息可知,反应物和生成物已经给出,注意配平和反应条件,故答案为:2NO+2CO
催化剂
.
2CO2+N2
(3)除NO外,二氧化硫也是大气污染物之一,它主要的危害是形成酸雨.发生这种危害的反应方程式为 2SO2+O2+2H2O=2H2SO4.
故答案为:(1)NH3(2)2NO+2CO
催化剂
.
2CO2+N2
(3)酸雨;2SO2+O2+2H2O=2H2SO4点评:
本题考点: 质量守恒定律及其应用;酸的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 掌握物理性质和化学性质的本质区别,学会利用化学方程式计算某种物质的分子式.1年前查看全部
- 工业制硝酸的五步是哪五步?请写出具体化学方程式(五个)
 crystal_221年前1
crystal_221年前1 -
 飞翔一颗心 共回答了16个问题
飞翔一颗心 共回答了16个问题 |采纳率100%3H2+N2=催化剂=2NH3
4NH3+5O2=Pt,加热=4NO+6H2O
2NO+O2=2NO2
3NO2+H2O=2HNO3+NO
好像就只有四个1年前查看全部
- (1)一氧化氮是工业制硝酸的中间产物,生成一氧化氮的化学方程式:4X+5O 2 催化剂 .
(1)一氧化氮是工业制硝酸的中间产物,生成一氧化氮的化学方程式:4X+5O 2
4NO+6H 2 O,根据质量守恒定律可以推断出X的化学式:______.催化剂 .
(2)尾气中含一氧化氮、一氧化碳等有毒气体,处理方法是在汽车尾气管上装一个催化转化器,在催化作用下,一氧化氮与一氧化碳生成二氧化碳和氮气,该反应的方程式为:______. 成琴1年前1
成琴1年前1 -
 开心走过一次 共回答了12个问题
开心走过一次 共回答了12个问题 |采纳率91.7%(1)根据质量守恒定律,化学反应前后元素种类及原子个数不变,由方程式可知,生成物中各元素及原子个数为:N,4;O,10;H,12; 已知反应物中各元素及原子个数为:O,10; 比较可知X中含有N和H元素,原子个数分别为1和3,故化学式为 NH 3 ,故答案为NH 3
(2)根据反应物是一氧化氮与一氧化碳,生成物是二氧化碳和氮气,反应条件是催化剂,写出方程式为2CO+2NO
催化剂
.
2CO 2 +N 2 ;故答案为2CO+2NO
催化剂
.
2CO 2 +N 2
故答案为:(1)NH 3 (2)2CO+2NO
催化剂
.
2CO 2 +N 21年前
11年前查看全部
大家在问
- 1读“亚洲区域示意图”,完成1~2题。
- 2批发衣服时, 三件六毛是什么意思?
- 3(-0.125)^-2009除以(-1/8)^-2008=
- 4如图,点E是矩形纸片ABCD边AB上一点,将△EBC沿EC翻折,使点B落在边AD上的点F处,BE:AE=5:3,若EC=
- 5初一上半学期语文导学练《新知识的摇篮——创造力》的阅读答案
- 6许多动物名词与固定的词搭配就形成了固定短语,专指某人.
- 7九月份用水8吨,比8月份节约了2吨,节约了( )%?
- 8一个长方形长6分米,宽是4分米,以宽为轴迅速旋转形成的图形,侧面积是多少
- 9■ 初3有黑色物质参与的化合反应反应式是什么?
- 10八上,5.6题
- 11我要把字写漂亮
- 125.01+5.02+5.03+5.04...+5.99等于多少?
- 13一道13个自然数的平均数问题,保留两位小数,同学的计算结果21.81,老师说:百分位上数字错了,
- 14Pablo Picasso (1881-1973) was born is Spain. There is no dou
- 15某次数学竞赛,试题上共有五道题,全班52人参加考试,如果把每人做对的题目数相加,全班共做对181道题.已
