净水剂.FeCl3,NaFeO4是用在胶凝过程的还是用在杀菌或其他过程的?为什么?并说明是化学变化还是物理变化?明矾使悬
 pepelulu2022-10-04 11:39:541条回答
pepelulu2022-10-04 11:39:541条回答FeCl3,NaFeO4是用在胶凝过程的还是用在杀菌或其他过程的?为什么?并说明是化学变化还是物理变化?
明矾使悬浮物沉淀是化学变化还是物理变化?为什么含有铝元素的物质都可以净水(和明矾一样都是使悬浮物沉淀吗?
为什么生成碱就可以净水涅
我顺便再问一下,活性炭净水是化学变化还是物理变化?

已提交,审核后显示!提交回复
共1条回复
 网络ee 共回答了14个问题
网络ee 共回答了14个问题 |采纳率100%- 是化学变化,NaFeO4净水是由于它们有较强氧化性,而FeCl3,明矾是由于铁离子,铝离子水解生成对应的碱
- 1年前
相关推荐
- 下列属于胶体的是 (石灰乳 -食盐水-碘酒-净水剂在水中写成的分散系)4选一
下列属于胶体的是 (石灰乳 -食盐水-碘酒-净水剂在水中写成的分散系)4选一
修正液 是不是胶体均一 透明,是不是易燃 易挥发 shirleyzlm1年前1
shirleyzlm1年前1 -
 realxia 共回答了19个问题
realxia 共回答了19个问题 |采纳率100%净水剂在水中会形成胶粒,从而得到胶体.
修正液是将有机溶剂与树胶类物质混合而成的.它属于胶体.其有机溶剂不能燃烧.但极易挥发.
胶体是均一的,不是所有的胶体都完全透明.1年前查看全部
- 高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾强,其本身在反应中被还原为Fe3+.已
高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾强,其本身在反应中被还原为Fe3+.已知制取高铁酸钠的化学方程式为:
2Fe(NO3)3+16NaOH+3Cl2===2Na2FeO4+6NaNO3+6NaCl+8H2O,回答下列问题:
(1)该反应中________得到电子,表现____________(填“氧化性”或“还原性”),Na2FeO4为________(填“氧化剂”、“还原剂”、“氧化产物”或“还原产物”).
(2)若有1 mol Cl2参加反应,则反应中转移电子的物质的量为________.
(3)Na2FeO4之所以能净水,除了能消毒杀菌外,另一个原因是
反应物Fe(NO3)3中铁显+3价,生成物Na2FeO4中铁显+6价,Fe(NO3)3中的
Fe3+失去电子,表现还原性,而反应物Cl2中氯显0价,生成物NaCl中氯显-1价,Cl2得到电子,表现氧化性,因铁的化合价反应后升高,故Na2FeO4为氧化产物.
答案 (1)Cl2 氧化性 氧化产物 (2)2 mol (3)六价铁被还原成三价铁,三价铁水解生成氢氧化铁胶体,具有较大的表面积,能吸附杂质而沉降下来达到净水的目的
第2题的计算过程要详细点 pipi79781年前2
pipi79781年前2 -
 zhtlc 共回答了15个问题
zhtlc 共回答了15个问题 |采纳率86.7%解析
反应物Fe(NO3)3中铁显+3价,生成物Na2FeO4中铁显+6价,Fe(NO3)3中的Fe3+失去电子,表现还原性,而反应物Cl2中氯显0价,生成物NaCl中氯显-1价,Cl2得到电子,表现氧化性,因铁的化合价反应后升高,故Na2FeO4为氧化产物.
答案
(1)Cl2 氧化性 氧化产物 、
(2)2 mol
(3)六价铁被还原成三价铁,三价铁水解生成氢氧化铁胶体,具有较大的表面积,能吸附杂质而沉降下来达到净水的目的1年前查看全部
- 明矾是常用净水剂,其主要成分KAl(SO4)·12H2O的相对分子质量为多少?各元素原子个数比是多少?
 sanyxu1年前5
sanyxu1年前5 -
 半毛钱 共回答了16个问题
半毛钱 共回答了16个问题 |采纳率93.8%第三单元《自然界的水》知识点一、水 1、水的组成:
(1)电解水的实验
A.装置―――水电解器
B.电源种类---直流电
C.加入硫酸或氢氧化钠的目的----增强水的导电性
D.化学反应:2H2O===2H2↑ + O2↑
产生位置 负极正极
体积比2:1
质量比1:8
F.检验:O2---出气口置一根带火星的木条----木条复燃
H2---出气口置一根燃着的木条------气体燃烧,产生淡蓝色的火焰
(2)结论:①水是由氢、氧元素组成的.
②一个水分子是由2个氢原子和1个氧原子构成的.
③化学变化中,分子可分而原子不可分.
例:根据水的化学式H2O,你能读到的信息
化学式的含义H2O
①表示一种物质 ——水这种物质
②表示这种物质的组成——水是由氢元素和氧元素组成的
③表示这种物质的一个分子——一个水分子
④表示这种物质的一个分子的构成 一个水分子是由两个氢原子和一个氧原子构成的
2、水的化学性质
(1)通电分解2H2O===2H2↑+O2↑
(2)水可遇某些氧化物反应生成碱(可溶性碱),例如:H2O+CaO==Ca(OH)2
(3)水可遇某些氧化物反应生成酸,例如:H2O+CO2==H2CO3
3、水的污染:
(1)水资源
A.地球表面71%被水覆盖,但供人类利用的淡水小于1%
B.海洋是地球上最大的储水库.海水中含有80多种元素.海水中含量最多的物质是H2O,最多的金属元素是Na,最多的元素是O.
C.我国水资源的状况分布不均,人均量少.
(2)水污染
A、水污染物:工业“三废”(废渣、废液、废气);农药、化肥的不合理施用
生活污水的任意排放
B、防止水污染:工业三废要经处理达标排放、提倡零排放;生活污水要集中处理达标排放、提倡零排放;合理施用农药、化肥,提倡使用农家肥;加强水质监测.
(3)爱护水资源:节约用水,防止水体污染
4、水的净化
(1)水的净化效果由低到高的是静置、吸附、过滤、蒸馏(均为物理方法),其中净化效果最好的操作是蒸馏;既有过滤作用又有吸附作用的净水剂是活性炭.
(2)硬水与软水
A.定义硬水是含有较多可溶性钙、镁化合物的水;
软水是不含或含较少可溶性钙、镁化合物的水.
B.鉴别方法:用肥皂水,有浮渣产生或泡沫较少的是硬水,泡沫较多的是软水
C.硬水软化的方法:蒸馏、煮沸
D.长期使用硬水的坏处:浪费肥皂,洗不干净衣服;锅炉容易结成水垢,不仅浪费燃料,还易使管道变形甚至引起锅炉爆炸.
5、其他
(1) 水是最常见的一种溶剂,是相对分子质量最小的氧化物.
(2) 水的检验:用无水硫酸铜,若由白色变为蓝色,说明有水存在;CuSO4+5H2O=CuSO4?5H2O
水的吸收:常用浓硫酸、生石灰、固体氢氧化钠、铁粉.
二、氢气 H2 1、物理性质:密度最小的气体(向下排空气法);难溶于水(排水法)
2、化学性质:
(1) 可燃性(用途:高能燃料;氢氧焰焊接,切割金属)2H2+O2====2H2O点燃前,要验纯(方法?)
现象:发出淡蓝色火焰,放出热量,有水珠产生
(2) 还原性(用途:冶炼金属)
H2+CuO===Cu+H2O 氢气“早出晚归”
现象:黑色粉末变红色,试管口有水珠生成
(小结:既有可燃性,又有还原性的物质 H2、C、CO)
3、氢气的实验室制法
原理:Zn+H2SO4=ZnSO4+H2↑Zn+2HCl=ZnCl2+H2↑
不可用浓盐酸的原因浓盐酸有强挥发性;
不可用浓硫酸或硝酸的原因浓硫酸和硝酸有强氧化性.
4、氢能源 三大优点无污染、放热量高、来源广
三、分子与原子 分子 原子
定义 分子是保持物质化学性质最小的微粒 原子是化学变化中的最小微粒.
性质 体积小、质量小;不断运动;有间隙
联系 分子是由原子构成的.分子、原子都是构成物质的微粒.
区别 化学变化中,分子可分,原子不可分.
化学反应的实质:在化学反应中分子分裂为原子,原子重新组合成新的分子.
四、物质的组成、构成及分类 组成:物质(纯净物)由元素组成
物质 构成
原子:金属、稀有气体、碳、硅等.
分子:如氯化氢由氯化氢分子构成.H2、O2、N2、Cl2.
离子:NaCl等离子化合物,如氯化钠由钠离子(Na+)氯离子(Cl-)构成
分类
混合物(多种物质)
单质 :金属、非金属、稀有气体(一种元素)
纯净物 化合物:
有机化合物:H4、C2H5OH、C6H12O6、淀粉、蛋白质(多种元素)(一种物质)
氧化物H2O、CuO、CO2
无机化合物 酸 HCl、2SO4、NO3
碱 NaOH、Ca(OH)2、KOH
盐NaCl、CuSO4、Na2CO3
第四单元物质构成的奥秘复习学案一.物质的构成 1、原子的构成
三决定
决定元素种类质子数(核电荷数)
决定元素化学性质最外层电子数
决定原子的质量原子核
(1)原子结构示意图的认识
(2)在原子中核电荷数=质子数=核外电子数
(3)原子的质量主要集中在原子核上
(4)相对原子质量≈质子数+中子数
说明:最外层电子数相同其化学性质不一定都相同(Mg,He最外层电子数为2)
最外层电子数不同其化学性质有可能相似(He,Ne均为稳定结构)
2、元素
(1)定义:具有相同核电荷数(质子数)的一类原子的总称
*一种元素与另一种元素的本质区别:质子数不同
注意:
*由同种元素组成的物质不一定是单质,(如由O2、O3组成的混合物或金刚石与石墨的混合物)不可能是化合物.
(2)表示方法——元素符号——拉丁文名称的第一个字母大写
a、书写方法:
b、意义
注意:*有些元素符号还可表示一种单质如Fe、He、C、Si
*在元素符号前加上数字后只能有微观意义,没有宏观意义,如3O:只表示3个氧原子
c、有关元素周期表
*发现:门捷列夫
*排列依据
*注:原子序数=质子数
d、分类
e、元素之最:地壳:O、Si、Al、Fe细胞:O、C、H
3、离子:带电的原子或原子团
(1)表示方法及意义:如Fe3+:一个铁离子带3个单位正电荷
(2)离子结构示意图的认识
注意:与原子示意图的区别:质子数=电子数则为原子结构示意图
*原子数≠电子数为离子结构示意图
(3)与原子的区别与联系
粒
子
的
种
类
粒
子
的
区
别
原子
离子
粒子结构
质子数=电子数
质子数电子数
阳离子
质子数电子数阴离子
粒子电性
不显电性
显正电性、 显负电性
符号
用元素符号表示
用阳离子符号表示 用阴离子符号表示
二、物质的组成的表示: 1、化合价--- 元素为把最外层电子数到达8电子的稳定状态,失去或得到的电子数.
a、写法及意义:Mg:镁元素化合价为0价MgCl2:氯化镁中镁元素化合价为+2价
b、几种数字的含义
Fe2+每个亚铁离子带两个单位正电荷 3Fe2+:3个亚铁离子
2H2O两个水分子,每个水分子含有2个氢原子
c、化合物中各元素正、负化合价的代数和为零
d、化合价是元素的原子在形成化合物时表现出来的性质,所以单质分子中元素化合价为0
2、化学式—元素符号和数字构成的,表示物质组成的式成为化学式.
(1)写法:
a单质:金属、稀有气体及大多数固态非金属通常用元素符号表示它们的化学式;而氧气、氢气、氮气、氯气等非金属气体的分子由两个原子构成,其化学式表示为O2、H2、N2、Cl2.
b化合物:正价在前,负价在后(NH3,CH4除外)
(2)意义:如化学式H2O的意义:4点化学式Fe的意义:3点
(3)计算:
a、计算相对分子质量=各元素的相对原子质量×原子个数之和
b、计算物质组成元素的质量比:相对原子质量×原子个数之比
c、计算物质中某元素的质量分数1年前查看全部
- 新型净水剂铁酸钠的化学式是Na 2 FeO 4 ,则该化合物中铁元素的化合价是(
新型净水剂铁酸钠的化学式是Na 2 FeO 4 ,则该化合物中铁元素的化合价是()
A.+2 B.+3 C.0 D.+6  renrendy1年前1
renrendy1年前1 -
 唐玉翔 共回答了17个问题
唐玉翔 共回答了17个问题 |采纳率70.6%D
Na 2 FeO 4 由Na、Fe、O三种元素组成,其中,Na的化合价是+1价,O的化合价为-2价,设Fe的化合价为x,则
(+1)×2+x+(-2)×4=0,x=+61年前查看全部
- (2009•永州)KAl(SO4)m常用作净水剂,如果K为+1价,Al为+3价,那么m值应为( )
(2009•永州)KAl(SO4)m常用作净水剂,如果K为+1价,Al为+3价,那么m值应为( )
A.1
B.2
C.3
D.4 wuu383021年前1
wuu383021年前1 -
 poguanzi2010 共回答了15个问题
poguanzi2010 共回答了15个问题 |采纳率86.7%解题思路:根据在化合物中正负化合价代数和为零,结合KAl(SO4)m的化学式进行解答本题.钾元素显+1价,铝元素显+3价,硫酸根显-2价,根据在化合物中正负化合价代数和为零,可得:(+1)+(+3)+(-2)×m=0,则m=2.
故选B.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题难度不大,掌握利用化合价的原则(化合物中正负化合价代数和为零)计算化学式中指定数字的方法即可正确解答本题.1年前查看全部
- 高效COD去除剂是山东航海环保科技有限公司最新研发的新型净水剂,该产品对原水温度、浊度、碱度及有机物含量的变化适应性强,
高效COD去除剂是山东航海环保科技有限公司最新研发的新型净水剂,该产品对原水温度、浊度、碱度及有机物含量的变化适应性强,还有较强的吸附能力,吸附原水中粘土、胶体、细菌腐殖质等杂物,絮体形成快而大,均匀且稳定,沉淀及过滤性能好.对去除水中COD、色度、异味具有很好的效果.
按分类分为:
SHS-01造纸行业COD去除剂
SHS-02印染行业 COD去除剂
SHS-03木糖醇业COD去除剂
SHS-04乳制品业COD去除剂 jiajia7281年前1
jiajia7281年前1 -
 sentihappy 共回答了16个问题
sentihappy 共回答了16个问题 |采纳率81.3%有这么好的东西就不用担心水污染问题了1年前查看全部
- 新型净水剂高铁酸钠Na2[小写FeO4[小写〕中铁元素化合价是多少,
 子夜念寒冬1年前2
子夜念寒冬1年前2 -
 maggiemeng87 共回答了31个问题
maggiemeng87 共回答了31个问题 |采纳率83.9%+6
+1*2+x-2*4=0
x=+61年前查看全部
- 帮忙解答一道化学题.谢谢.某盐是一种常见的净水剂.该盐溶液的颜色反应成紫色,向该溶液中加入少量氢氧化钠溶液,开始有白色沉
帮忙解答一道化学题.谢谢.
某盐是一种常见的净水剂.该盐溶液的颜色反应成紫色,向该溶液中加入少量氢氧化钠溶液,开始有白色沉淀析出,继续加入适量氯化钠溶液沉淀溶解,再加入适量氯化钡溶液,又产生白色沉淀,则该盐的化学式为------------写出有关上述反应的离子方程式:(1)-----------------(2)-------------(3)------------------
谢谢.帮我解答一下 手持天平1年前4
手持天平1年前4 -
 mozit 共回答了20个问题
mozit 共回答了20个问题 |采纳率90%KAl(SO4)2
Al3++3OH-==Al(OH)3
Al(OH)3+OH-==AlO2-+2H2O
Ba2++SO42-==BaSO41年前查看全部
- 硫酸亚铁做净水剂的原理是什么?
 夏夜11年前1
夏夜11年前1 -
 猴么子 共回答了17个问题
猴么子 共回答了17个问题 |采纳率88.2%水解生成氢氧化亚铁絮状沉淀达到净化水的目的1年前查看全部
- 下列说法不正确的是( )A.过氧化钠可用作供氧剂B.明矾可用作净水剂C.碳酸氢钠可用焙制糕点发酵粉D.可以用电解熔融的
下列说法不正确的是( )
A.过氧化钠可用作供氧剂
B.明矾可用作净水剂
C.碳酸氢钠可用焙制糕点发酵粉
D.可以用电解熔融的氯化钠、氯化镁、氯化铝分别制取钠、镁、铝 joe_sunjun1年前1
joe_sunjun1年前1 -
 7号劳尔 共回答了11个问题
7号劳尔 共回答了11个问题 |采纳率100%解题思路:A、根据过氧化钠能与二氧化碳反应生成碳酸钠和氧气;
B、根据盐类水解的生成物的性质分析;
C、碳酸氢钠受热分解为碳酸钠、水以及二氧化碳,据此回答;
D、氯化铝不导电.A.过氧化钠能与二氧化碳反应生成碳酸钠和氧气,所以过氧化钠可用作供氧剂,故A正确;
B、明矾是强酸弱碱盐,在水溶液里能发生水解生成氢氧化铝胶体,氢氧化铝胶体具有吸附性,所以能作净水剂,故B正确;
C、碳酸氢钠受热分解为碳酸钠、水以及二氧化碳,可用焙制糕点发酵粉,故C正确;
D、氯化铝不导电,工业上利用电解熔融的氧化铝来得到单质铝,故D错误.
故选D.点评:
本题考点: 金属冶炼的一般原理;钠的重要化合物.
考点点评: 本题考查知识点较多,涉及盐类水解、金属冶炼及化学与生活的知识,注重基础知识的考查,题目难度不大.1年前查看全部
- (2009•西城区二模)高铁酸钠是一种新型净水剂,它的化学式为Na2FeO4,高铁酸钠主要通过如下反应制取:2Fe(OH
(2009•西城区二模)高铁酸钠是一种新型净水剂,它的化学式为Na2FeO4,高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3X+5H2O.
(1)物质X的化学式为NaClNaCl.
(2)若某化工厂需要生产332t高铁酸钠,则需要氢氧化钠的质量为多少? ly73771年前1
ly73771年前1 -
 mophyc 共回答了19个问题
mophyc 共回答了19个问题 |采纳率94.7%(1)因为反应前后各元素原子个数相等,X的化学式为NaCl
(2)根据化学方程式,通过物质间的比例关系,可用高铁酸钠的质量计算氢氧化钠的质量:答案为:
设:需要NaOH的质量为x.
2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3X+5H2O
160 332
x 332t
160
x=
332
332t
x=160t
答:需要NaOH的质量为160t.1年前查看全部
- 用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166g•mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进
用二氧化氯(clo2)、铁酸钠(na2feo4摩尔质量为166g•mol-1)等新型净水剂替代传统的净水剂cl2对淡水进行消毒是城市饮用水处理新技术.clo2和na2feo4在水处理过程中分别被还原为cl-和fe3+.
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,clo2、na2feo4、cl2三种消毒杀菌剂的消毒效率由大到小的顺序是______>______>______.
(2)na2feo4溶于水会放出一种***气体,其杀菌消毒、吸附水中的悬浮杂质的原理可用离子方程式表示为______.
(3)工业以ch3oh与naclo3为原料在酸性条件下制取clo2,同时产生co2气体,已知该反应分为两步进行,第一步为2clo3-+2cl-+4h+=2clo2↑+cl2↑+2h2o.
①写出第二步反应的离子方程式______.
②工业生产时需在反应物中加少量cl-,其作用是______.
③生产中会发生副反应clo3-+cl-+h+-cl2↑+h2o(未配平),若测得反应后的混合气体中cl2的体积分数为[3/73],则起始投料时ch3oh与naclo3的物质的量之比为______.
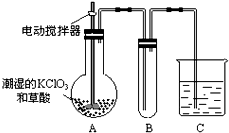
(4)已知二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.clo2也可以看做是亚氯酸(hclo2)和氯酸(hclo3)的混合酸酐.工业上用稍潮湿的kclo3和草酸在60℃时反应制得.某学生用如图所示的装置模拟工业制取及收集clo2,其中a为clo2的发生装置,b为clo2的凝集装置,c为尾气吸收装置.请问: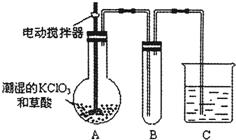
①a部分还应添加温度控制(如水浴加热)装置,b部分还应补充什么装置______;
②c中应装的试剂为______.c中发生反应的化学方程式为:______. porpo_01年前1
porpo_01年前1 -
 nr2a8j 共回答了19个问题
nr2a8j 共回答了19个问题 |采纳率78.9%解题思路:(1)以单位质量的氧化剂所得到的电子数来表示消毒效率,设质量均为m,消毒效率分别为[m/67.5]×5、[m/166]×3、[m/71]×2×1;
(2)高铁酸根离子具有强氧化性,所以能杀菌消毒,高铁酸根离子能发生氧化还原反应生成氧气,同时生成氢氧化铁,氢氧化铁具有吸附性;
(3))①由题中给出的反应物和生成物写出总的离子方程式再叠减第一步的离子方程式得出第二步的离子方程式;
②Cl-为反应的催化剂;
③结合反应的方程式计算;
(4)①二氧化氯的沸点低,B为ClO2的凝集装置,B装置应降低温度;
②C为尾气吸收装置,可选择碱来吸收尾气,发生氧化还原反应.(1)以单位质量的氧化剂所得到的电子数来表示消毒效率,设质量均为m,ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率分别为[m/67.5]×5、[m/166]×3、[m/71]×2×1,所以由大到小的顺序为ClO2>Cl2>Na2FeO4,故答案为:ClO2;Cl2;Na2FeO4;
(2)高铁酸根离子具有强氧化性,所以能杀菌消毒,高铁酸根离子和水反应生成氢氧化铁胶体,胶体具有吸附性是,所以能净水,反应方程式为:4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑,
故答案为:4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑;
(3)①由题中给出的反应物和生成物写出总的离子方程式再叠减第一步的离子方程式得出第二步的离子方程式为CH3OH+3Cl2+H2O=6Cl-+CO2+6H+,
故答案为:CH3OH+3Cl2+H2O=6Cl-+CO2+6H+;
②通过分析离子方程式得出,Cl-没有参加反应,作为催化剂,故答案为:催化剂;
③工业以CH3OH与NaClO3为原料在酸性条件下制取ClO2,同时产生CO2气体,(一般用硫酸酸化)涉及反应的化学方程式为①CH3OH+6NaClO3+3H2SO4→6ClO2+CO2+3Na2SO4+5H2O,生产中会发生副反应②ClO3-+5Cl-+6H+=3Cl2↑+3H2O,生成气体为ClO2、CO2和Cl2,若测得反应后的混合气体中Cl2的体积分数为[3/73],由①可知,如ClO2为60mol,则CO2为10mol,Cl2为3mol,则需要10molCH3OH,(60+1)molNaClO3,则二者体积之比为10:61=1:6.1,
故答案为:1:6.1;
(4)①二氧化氯的沸点低,B为ClO2的凝集装置,B装置应补充(冰水)冷凝装置,故答案为:(冰水)冷凝;
②C为尾气吸收装置,可选择NaOH溶液来吸收尾气,发生氧化还原反应为2ClO2+2NaOH═NaClO2+NaClO3+H2O,
故答案为:NaOH溶液;2ClO2+2NaOH═NaClO2+NaClO3+H2O.点评:
本题考点: 制备实验方案的设计;氯、溴、碘及其化合物的综合应用;性质实验方案的设计.
考点点评: 本题以氯及其化合物的性质考查氧化还原反应及物质的制备实验,把握习题中的信息及知识迁移应用为解答的关键,侧重学生综合应用能力及信息抽取和分析能力的考查,题目难度中等.1年前查看全部
- 明矾能作净水剂的原因,和相关离子方程式.
 ksl1dab_of297c1年前1
ksl1dab_of297c1年前1 -
 qdshfzxsj 共回答了17个问题
qdshfzxsj 共回答了17个问题 |采纳率88.2%kal(so4)2,铝离子水解生成氢氧化铝胶体,会吸附杂质,所以能够净水
al3+ + 3h2o=al(oh)3 + 3h+1年前查看全部
- 铵盐是一类重要的化合物,应用广泛,如NH4Al(SO4)2可用作净水剂、食品添加剂等;NH4HSO4用于定量分析、医药和
铵盐是一类重要的化合物,应用广泛,如NH4Al(SO4)2可用作净水剂、食品添加剂等;NH4HSO4用于定量分析、医药和电子工业中.请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是______(用必要的化学用语和相关文字说明).
(2)如图1是0.1mol•L-1的几种电解质溶液的pH随温度变化的曲线.
①其中符合NH4Al(SO4)2的曲线是______(填写序号),导致pH随温度变化的原因是______;
②25℃时,0.1mol•L-1 NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=______(近似值).
(3)室温时,向100mL0.1mol•L-1 NH4HSO4溶液中滴加0.1mol•L-1 NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图2所示: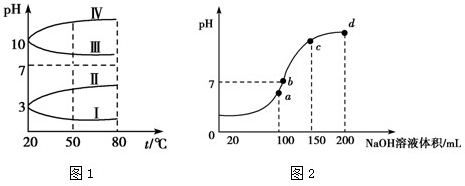
试分析图中a、b、c、d四个点,水的电离程度最大的是______点;在b点,溶液中各离子浓度由大到小的排列顺序是______. jingyuran1年前1
jingyuran1年前1 -
 世界第三包 共回答了23个问题
世界第三包 共回答了23个问题 |采纳率91.3%解题思路:(1)Al3+水解生成的Al(OH)3具有吸附性;
(2)①NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大;②根据电荷守恒定律解题;
(3)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离.b点溶液呈中性.(1)Al3+水解生成的Al(OH)3具有吸附性,离子方程式:Al3++3H2O═Al(OH)3+3H+,Al(OH)3,
故答案为:Al3+水解生成的Al(OH)3具有吸附性,即Al3++3H2O═Al(OH)3+3H+,Al(OH)3吸附悬浮颗粒使其沉降从而净化水;
(2)①NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大,pH减小,符合的曲线为Ⅰ,
故答案为:1;NH4Al(SO4)2水解,溶液呈酸性,升高温度,其水解程度增大,pH减小;
②25℃时,0.1mol•L-1 NH4Al(SO4)2中PH=3,根据电荷守恒,阳离子所带的正电荷总数等于阴离子所带的负电荷总数,c(H+)+c(NH4+)+3c(Al3+)=c(OH-)+2c(SO42-),可以求出2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+)-c(OH-)=10-3 mol•L-1[c(OH-)太小,可忽略],
故答案为:10-3 mol•L-1;
(3)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离.b点溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3•H2O三种成分,a点时c(Na+)=c(SO42-),b点时c(Na+)>c(SO42-),根据N元素与S元素的关系,可以得出c(SO42-)>c(NH4+),故c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),
故答案为:a;c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).点评:
本题考点: 铵盐.
考点点评: 本题考查盐类的水解和离子浓度大小的比较,题目难度中等,(2)②为易错点,注意根据守恒思想解题.1年前查看全部
- (2007•攀枝花)明矾[化学式为KAl(S04)2•l2H2O]是一种常用的净水剂,它在水中离解出K+、Al3+和S0
(2007•攀枝花)明矾[化学式为KAl(S04)2•l2H2O]是一种常用的净水剂,它在水中离解出K+、Al3+和S042-,东东为了探究明矾中哪种粒子有净水作用,进行了如下实验,填写表中空白:
兰兰看到东东的方案后,认为该方案不完善,她对东东的方案进行了补充,请你根据兰兰的补充方案中所用的试剂,把要达到的目的填入下表.实验操作 实验现象 实验结论 在一杯浑浊的水中加入少量KCl,静置 烧杯中的水仍然浑浊 在一杯浑浊的水中加入少量Al2(S04)3,静置 烧杯中的水变澄清
实验目的 使用的试剂 探究______是否有净水作用 AlCl3 探究______是否有净水作用 K2S04  FIREROY1年前1
FIREROY1年前1 -
 DDJX 共回答了8个问题
DDJX 共回答了8个问题 |采纳率87.5%解题思路:明矾在水中能够电离出自由移动的钾离子、铝离子和硫酸根离子,铝离子和水作用能够形成胶体,生成的胶体具有吸附作用,能够吸附水中的悬浮物.加入氯化钾后仍然浑浊,说明钾离子没有净水作用;加入硫酸铝后变澄清,说明铝离子或硫酸根离子有净水作用.填表如下: 实验操作 实验现象 实验结论 在一杯浑浊的水中加入少量KCl,静置 烧杯中的水仍然...
点评:
本题考点: 水的净化.
考点点评: 解答本题要充分理解各种离子的性质方面的知识,只有这样才能对相关方面的问题做出正确的判断.1年前查看全部
- K2FeO4是生活中的新型净水剂,可用NaCLO、Fe(OH)3和KOH制取,其反应的化学方程式为
 linyuaner1年前1
linyuaner1年前1 -
 阿慧617 共回答了12个问题
阿慧617 共回答了12个问题 |采纳率66.7%反应式如下:2Fe(OH)3 + 3NaClO + 4KOH → 2K2FeO4 + 3NaCI + 5H2O,即得到高铁酸钾,氯化钠和水.1年前查看全部
- 对于下列常见化学的认识错误的是 A.碳酸钙是文物陶瓷的主要成分 B.干冰能用于人工降雨 C.明矾可用作净水剂 D.小苏打
对于下列常见化学的认识错误的是
A.碳酸钙是文物陶瓷的主要成分 B.干冰能用于人工降雨 C.明矾可用作净水剂 D.小苏打是一种膨松剂,可用于制作馒头和面包  秀花1681年前1
秀花1681年前1 -
 suzanjia 共回答了17个问题
suzanjia 共回答了17个问题 |采纳率88.2%A
1年前查看全部
- 已知明矾是一种良好的净水剂,可用于家庭饮水的净化,请问明矾是如何净化水的?
已知明矾是一种良好的净水剂,可用于家庭饮水的净化,请问明矾是如何净化水的?
已知K2SO4溶液、KCl溶液的PH=7,A1C13溶液、A12(SO4)3溶液的PH”、“ 模范对象1年前2
模范对象1年前2 -
 12588888 共回答了16个问题
12588888 共回答了16个问题 |采纳率100%明矾净水的原理是:Al3+水解生成Al(OH)3沉淀,将悬浮物沉降
(Al3+)+3H2O==(可逆号)Al(OH)3+3H+
由上述水解方程式可知,用明矾净化后的水,其PH1年前查看全部
- 铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高猛酸钾还强,本身在反应中被还原为Fe?﹢.问:
铁酸钠(na2feo4)是水处理过程中使用的一种新型净水剂,它的氧化性比高猛酸钾还强,本身在反应中被还原为fe?﹢.问:配平制取铁酸钠的化学方程式 fe(no3)3+ naoh+ cl2 = na2feo4+ nano3+ nacl+ h2o.一定要交方法呀,这种题没方法想好久的,简直***的···
 xjfk初一4班1年前1
xjfk初一4班1年前1 -
 心力衰竭1 共回答了16个问题
心力衰竭1 共回答了16个问题 |采纳率93.8%用电子得失法硝酸铁中铁为+3价,到铁酸钠中铁为+6价,失去3个电子.氯气中氯0价,得到一个电子.又因为有两个氯,乘2,所以,得到2个电子.2和3乘以他们的最小公倍数.所以,硝酸铁的系数为2,氯气为3,再观察法来配平.配完之后,计算左右两边的氧原子个数来检查是否正确最后答案是2 16 3 2 6 6 8 面对氧化还原题,教叫你一句口诀 失(失去电子)升(化合价升高)氧(氧化反应)还(还原剂)这是对一种物质而言1年前查看全部
- 用活性炭作净水剂是利用化学性质的吗?
 爱笑的小龙女1年前4
爱笑的小龙女1年前4 -
 影子知道 共回答了17个问题
影子知道 共回答了17个问题 |采纳率94.1%利用物理性质,吸附性.1年前查看全部
- 能正确解释下列反应原理的离子方程式是 [ ] A.用明矾作净水剂:Al
能正确解释下列反应原理的离子方程式是 [ ]
A.用明矾作净水剂:Al 3+ +3H 2 O=Al(OH) 3 ↓+3H +
B.用小苏打治疗胃酸过多:CO 3 2- +2H + =CO 2 ↑+H 2 O
C.用氯化铁溶液腐蚀印刷线路板上的铜:Fe 3+ + Cu= Fe 2+ +Cu 2+
D.含等物质的量的KHCO 3 和Ba(OH) 2 溶液混合:HCO 3 - + Ba 2+ + OH - =BaCO 3 ↓+H 2 O vindi1年前1
vindi1年前1 -
 yufeierron 共回答了27个问题
yufeierron 共回答了27个问题 |采纳率77.8%D1年前查看全部
- 复合聚铝铁净水剂,其化学式为([Al2(OH)nCl6-n]m(Fe(OH)nCl6-n]m ),其中m≤10,p≤10
复合聚铝铁净水剂,其化学式为([Al2(OH)nCl6-n]m(Fe(OH)nCl6-n]m ),其中m≤10,p≤10,则n的值可能是()
A.5 B.6 C7 B.8 城门洞1年前1
城门洞1年前1 -
 王ss 共回答了17个问题
王ss 共回答了17个问题 |采纳率70.6%明显只有A,化学式中有氯原子,所以6-n>0,n1年前查看全部
- Fecl3为什么能做净水剂又能做电路板腐蚀剂?
 猪肉涨价了1年前1
猪肉涨价了1年前1 -
 xy5666 共回答了18个问题
xy5666 共回答了18个问题 |采纳率88.9%Fecl3能做净水剂是因为Fe3+能水解生成氢氧化铁胶体,胶体的胶粒有很大的表面积,可以吸附水中悬浮物,达到净水的目的.
Fe3+水解的离子方程式:Fe3+ + 3H2O =可逆号= Fe(OH)3 + 3H+
Fe3+有很强的氧化能力,能把铜给氧化,2Fe3+ + Cu == 2Fe2+ + Cu2+ 腐蚀电路板就是利用此反应.1年前查看全部
- 高中化学 必修一 铝的重要化合物 :某盐是一种常见的净水剂 钙盐溶液的颜色反应呈紫色透过蓝色钴玻璃.
高中化学 必修一 铝的重要化合物 :某盐是一种常见的净水剂 钙盐溶液的颜色反应呈紫色透过蓝色钴玻璃.
某盐是一种常见的净水剂 钙盐溶液的颜色反应呈紫色透过蓝色钴玻璃 想改溶液中加入少量氢氧化钠溶液,开始有白色沉淀析出,继续加氢氧化钠溶液 沉淀溶解,再加入适量氯化钡溶液,又产生白色沉淀,则该盐的化学式为( ) 并写出有关上述反映的离子方程式. 林一茶1年前3
林一茶1年前3 -
 LifeForFun 共回答了19个问题
LifeForFun 共回答了19个问题 |采纳率89.5%明矾:KAl(SO4)2·12H2O
Al3+3OH-=Al(OH)3 Al(OH)3+OH-=AlO2-+2H2O Ba2++SO42-=BaSO41年前查看全部
- 用高铁酸钠(Na2FeO4)是一种新型净水剂,主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH═nNa2
用高铁酸钠(Na2FeO4)是一种新型净水剂,主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH═nNa2FeO4+3X+5H2O.下列说法中正确的是( )
A.该反应中,铁元素的化合价没有改变
B.该反应中X的化学式为NaCl
C.该反应中化学计量数n=4
D.该反应属于置换反应 wyf9812211年前1
wyf9812211年前1 -
 一只鞋走世界 共回答了21个问题
一只鞋走世界 共回答了21个问题 |采纳率85.7%解题思路:A、根据在化合物中元素化合价的代数和为零的原则进行解答;B、根据质量守恒定律的实质,反应前后各元素的原子个数相等推断X的化学式;C、根据质量守恒定律的实质,反应前后各元素的原子个数相等推断n的值;D、根据置换反应的概念分析.A、该反应中,反应物Fe(OH)3中铁元素的化合价为+3价,生成物Na2FeO4中铁元素的化合价为+6价,故A说法错误;
B、因为反应前后各元素原子个数相等,X的化学式为NaCl,故B说法正确;
C、根据反应前Fe原子的数目为2,可得n=2,故C说法错误;
D、一种单质跟一种化合物起反应,生成另一种单质和另一种化合物的反应叫做置换反应.可见该反应不是置换反应,故D说法错误;
故选:B.点评:
本题考点: 物质的相互转化和制备;有关元素化合价的计算;反应类型的判定;质量守恒定律及其应用.
考点点评: 本题考查化合价原则、置换反应的定义以及质量守恒定律的内容,考查注重基础.1年前查看全部
- 用液氯做自来水消毒剂,FeSO4做净水剂.
用液氯做自来水消毒剂,FeSO4做净水剂.
Ⅰ用这种自来水配制的硝酸银溶液会产生浑浊,发生的化学方程式①②
Ⅱ用这种自来水配制碘化钾溶液时,又是呈黄色,发生的化学反应式①
写出化学反应式 200323441年前3
200323441年前3 -
 我什么也不爱 共回答了16个问题
我什么也不爱 共回答了16个问题 |采纳率87.5%明矾用作净水剂,次氯酸HClO杀菌、消毒、永久性漂白、SO2暂时性漂白 自来水铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑ 28.镁和稀硫酸Mg + H2SO41年前查看全部
- 高一化学中可作净水剂的物质有哪些?其作用原理是?
 浪子七郎1年前2
浪子七郎1年前2 -
 thisisyoung 共回答了17个问题
thisisyoung 共回答了17个问题 |采纳率94.1%常用到的净水剂有聚合氯化铝、聚合氯化铝铁、碱式氯化铝、硫酸亚铁、硫酸铝、聚合硫酸铁等.
作用原理是Al3+、Fe3+在水中生成Al(OH)3、Fe(OH)3胶体,胶体能吸附水中的悬浮物,使物质沉淀,达到净水的目的.1年前查看全部
- (2012•龙岩二模)高效净水剂聚合氯化铝铁(PAFC)的组成可表示为[AlFe(OH)nCl6-n]m,该物质广泛应用
(2012•龙岩二模)高效净水剂聚合氯化铝铁(PAFC)的组成可表示为[AlFe(OH)nCl6-n]m,该物质广泛应用于日常生活用水和工业废水的净化处理.某工厂欲以工业废料(金属铁、铝及其氧化物)为原料、采用如下流程来制取
PAFC:
下列判断无法确定的是( )
A.PAFC因水解而能净水
B.往甲溶液中滴入KSCN溶液后呈血红色
C.试剂X具有氧化性
D.乙溶液肯定不可能呈强碱性 opkopk0011年前1
opkopk0011年前1 -
 回眸一哮 共回答了22个问题
回眸一哮 共回答了22个问题 |采纳率90.9%解题思路:废料中加入过量稀盐酸,充分反应后得到甲溶液,甲溶液中含有AlCl3,由于Al、Fe以及Fe2O3的物质的量关系无法确定,则不能确定溶液中Fe元素的存在形成,不能确定是存在Fe2+还是Fe3+或是二者都有,加入X应为氧化剂,可将Fe2+生成Fe3+,加入NaOH溶液后,调节溶液pH,可生成目标物,以此解答该题.A.[AlFe(OH)nCl6-n]m可水解生成氢氧化铝和氢氧化铁,具有吸附性,可用于净水,故A不选;
B.由于Al、Fe以及Fe2O3的物质的量关系无法确定,则不能确定溶液中Fe元素的存在形成,不能确定是存在Fe2+还是Fe3+或是二者都有,则加入KSCN溶液后溶液不一定成血红色,故B选;
C.加入X应为氧化剂,可将Fe2+生成Fe3+,因.[AlFe(OH)nCl6-n]m中Fe为+3价,可起到净水剂的作用,故C不选;
D.如呈强碱性,则不可能生成.[AlFe(OH)nCl6-n]m,因氢氧化铝与氢氧化钠反应生成偏铝酸钠,故D不选.
故选B.点评:
本题考点: 制备实验方案的设计;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查物质的制备,侧重于学生的分析能力和实验能力的考查,为高考高频考点,注意把握实验的原理,掌握物质的性质为解答该题的关键,难度不大.1年前查看全部
- (2005•乐山一模)铁酸钠(Na2FeO4)是一种新型净水剂,制取铁酸钠的离子反应方程式为:Fe3++OH-+Cl2→
(2005•乐山一模)铁酸钠(Na2FeO4)是一种新型净水剂,制取铁酸钠的离子反应方程式为:Fe3++OH-+Cl2→FeO
+Cl-+H2O,该反应的离子方程式中H2O的化学计量数是( )2−4
A.4
B.6
C.10
D.8 lemon01091年前1
lemon01091年前1 -
 紫风傲剑狂刀 共回答了21个问题
紫风傲剑狂刀 共回答了21个问题 |采纳率90.5%解题思路:先分析化合价变化,铁元素化合价:+3价→+6,化合价升高了3价;氯元素化合价:0→-1,化合价降低了1价,根据化合价升高降低相等计算出铁离子和氯离子的化学计量数,再根据电荷守恒计算出氢氧根离子的计量数,最后根据氢原子守恒计算出水的化学计量数.反应Fe3++OH-+Cl2→FeO42-+Cl-+H2O中,铁元素化合价:+3价→+6,化合价升高了3价;氯元素化合价:0→-1,Cl2参加反应,化合价降低了1×2价,化合价变化的最小公倍数为6,所以Fe3+的化学计量数为2、Cl2的化学计量数为3,根据氯原子守恒,Cl-的计量数为6,即2Fe3++OH-+3Cl2→2FeO42-+6Cl-+H2O,根据电荷守恒,OH-的计量数为16,根据氢原子守恒,水的化学计量数为为:[16/2]=8,
故选D.点评:
本题考点: 离子方程式的书写;氧化还原反应.
考点点评: 本题考查了氧化还原反应的配平,题目难度中等,注意配平氧化还原反应中电子守恒、电荷守恒的应用,该题是高考中的高频题,侧重对学生能力的培养和训练;该题有助于培养学生分析问题、解决问题的能力及灵活应用所学知识能力.1年前查看全部
- (2005•绵阳)(1)硫酸亚铁是一种重要的化工原料,可用作杀虫剂、净水剂和木材防腐剂,还可用来治疗缺铁性贫血.工业上用
 (2005•绵阳)(1)硫酸亚铁是一种重要的化工原料,可用作杀虫剂、净水剂和木材防腐剂,还可用来治疗缺铁性贫血.工业上用废铁屑与稀硫酸反应制硫酸亚铁,主要反应的化学方程式为______.
(2005•绵阳)(1)硫酸亚铁是一种重要的化工原料,可用作杀虫剂、净水剂和木材防腐剂,还可用来治疗缺铁性贫血.工业上用废铁屑与稀硫酸反应制硫酸亚铁,主要反应的化学方程式为______.
废铁屑与硫酸反应产生的气体中含有有毒气体H2S,用CuSO4溶液可以吸收这种气体并产生黑色沉淀,该反应的化学方程式为______.
(2)为了探究CO的还原性,某同学将绕成螺旋状的铜丝放在酒精灯上加热至铜丝变黑后,立即将铜丝伸入盛满CO的集气瓶中(内装适量澄清石灰水),铜丝又恢复光亮的红色,振荡集气瓶,还可以看到集气瓶中______.
上述实验过程中,能表明CO具有还原性的反应的化学方程式是CuO+CO
Cu+CO2△ .CuO+CO.将上述表面变黑的铜丝冷却后放入稀硫酸中,可以看到的现象是____________,______.
Cu+CO2△ .
(3)一包白色固体可能含有NaCl、CuSO4、NH4NO3、BaC12、K2 C O3中的一种或几种.有同学进行下列实验来确定该固体的成分:
(a)取少许固体放入试管,加入NaOH浓溶液并微热,把湿润的红色石蕊试纸放在试管口,试纸变为蓝色.
(b)取一些白色固体放入试管加水溶解,得无色透明溶液.
(c)向实验b所得溶液中滴2滴酚酞试液,溶液变为红色,再向其中加入过量CaC12溶液,红色褪去,产生白色沉淀.
(d)将实验c所得溶液中的沉淀滤去,向滤液中加入AgNO3溶液,又产生白色沉淀.
①根据以上实验现象判断:这包白色固体中一定有______,肯定没有______.
②若用这包白色固体配成稀溶液来浇花,可产生的作用是______(填下列选项的字母序号).
A.促进花草的茎、叶生长茂盛,叶色浓绿
B.促进花草的根系发达,增强抗寒抗旱能力
C.促进花草生长健壮,茎杆粗硬,增强对病虫害和倒伏的抵抗能力
(4)实验室需用20%的稀硫酸(密度为1.14g•cm-3)460mL,若用如图标签所示的硫酸来配制,则至少需用这种硫酸______
mL. tit1111年前1
tit1111年前1 -
 枫籽 共回答了17个问题
枫籽 共回答了17个问题 |采纳率94.1%解题思路:(1)铁屑与稀硫酸反应制硫酸亚铁和氢气,写出化学方程式;已知反应物为硫化氢和硫酸铜,生成物为硫化铜和硫酸,故可写出化学方程式;
(2)根据一氧化碳和氧化铜反应产生铜和二氧化碳写出方程式分析现象;根据氧化铜和硫酸反应产生硫酸铜和水描述现象;
(3)a、取少许固体放入试管,加入NaOH浓溶液并微热,把湿润的红色石蕊试纸放在试管口,试纸变为蓝色,说明产生碱性气体,可证明硝酸铵的存在;
b、取一些白色固体放入试管加水溶解,得无色透明溶液,说明没有蓝色硫酸铜的存在,且碳酸钾和氯化钡反应会产生碳酸钡沉淀,所以碳酸钾和氯化钡不能共存;
c、向实验b所得溶液中滴2滴酚酞试液,溶液变为红色,说明溶液显碱性,再向其中加入过量CaC12溶液,红色褪去,产生白色沉淀,则有碳酸钾的存在;又因为碳酸钾和氯化钡不能共存,故没有氯化钡;
d、将实验c所得溶液中的沉淀滤去,向滤液中加入AgNO3溶液,又产生白色沉淀,说明有氯离子的存在,但氯离子可能来自氯化钠,也可能来自过量的氯化钙,因此氯化钠可能含有;
①据以上现象分析得出结论;②根据物质中含有的营养元素氮、磷、钾的作用分析;
(4)设出浓硫酸的体积,利用m=ρV可计算溶液的质量,再根据溶液配制前后溶质的质量不变来列式计算浓硫酸的质量和体积.(1)铁屑与稀硫酸反应制硫酸亚铁和氢气,反应的方程式为:Fe+H2SO4=FeSO4+H2↑;已知反应物为硫化氢和硫酸铜,生成物为硫化铜和硫酸,故可写出化学方程式.
故答案为:Fe+H2SO4=FeSO4+H2↑;H2S+CuSO4═CuS↓+H2SO4;
(2)一氧化碳和氧化铜反应产生铜和二氧化碳,故看到石灰水变浑浊,反应的方程式为:CuO+CO
△
.
Cu+CO2;氧化铜和硫酸反应产生硫酸铜和水,反应的现象为:黑色固体逐渐消失,反应的方程式为:CuO+H2SO4=CuSO4+H2O;
故答案为:石灰水变浑浊;CuO+CO
△
.
Cu+CO2;黑色固体逐渐消失;溶液由无色变成蓝色;CuO+H2SO4=CuSO4+H2O;
(3)a、取少许固体放入试管,加入NaOH浓溶液并微热,把湿润的红色石蕊试纸放在试管口,试纸变为蓝色,说明产生碱性气体,其中硝酸铵和氢氧化钠反应产生的氨气的水溶液显碱性,可证明硝酸铵的存在;
b、取一些白色固体放入试管加水溶解,得无色透明溶液,说明没有蓝色硫酸铜的存在,且碳酸钾和氯化钡反应会产生碳酸钡沉淀,所以碳酸钾和氯化钡不能共存;
c、向实验b所得溶液中滴2滴酚酞试液,溶液变为红色,说明溶液显碱性,再向其中加入过量CaC12溶液,红色褪去,产生白色沉淀,则有碳酸钾的存在;又因为碳酸钾和氯化钡不能共存,故没有氯化钡;
d、将实验c所得溶液中的沉淀滤去,向滤液中加入AgNO3溶液,又产生白色沉淀,说明有氯离子的存在,但氯离子可能来自氯化钠,也可能来自过量的氯化钙,因此氯化钠可能含有;
①故一定含有:NH4NO3、K2 C O3;一定没有:CuSO4、BaC12;
②根据NH4NO3、K2 C O3中含有的营养成分是氮和钾,氮能够促进作物的叶子生长,钾能够促进作物的茎秆粗壮,故选项为:AC;
(4)设需要浓硫酸的体积为V,则
根据浓溶液在配制稀溶液时溶质的质量不变得,
V×1.84g/cm3×98%=460mL×1.14g/cm3×20%
解得V=58.2mL
故答案为:58.2mL点评:
本题考点: 金属的化学性质;一氧化碳的化学性质;有关溶质质量分数的简单计算;物质的鉴别、推断.
考点点评: 本题考查属于综合性的问题,考查了金属的化学性质、一氧化碳的还原性、物质的鉴别、有关溶质质量分数的计算等,可依据相关的知识逐一分析解答.1年前查看全部
- 一种新型高效净水剂PAFC(化学式为[AlFe(OH)nCl6-n]m),广泛应用于工业污水的处理.该净水剂中铁元素的化
一种新型高效净水剂PAFC(化学式为[AlFe(OH)nCl6-n]m),广泛应用于工业污水的处理.该净水剂中铁元素的化合价为( )
A. 0
B. +2
C. +3
D. +6 我不是基德1年前1
我不是基德1年前1 -
 xiangyu1986323 共回答了26个问题
xiangyu1986323 共回答了26个问题 |采纳率92.3%解题思路:根据在化合物中正负化合价代数和为零,进行解答本题.据在化合物中正负化合价代数和为零,可得高效净水剂PAFC中铁元素的化合价为:
(+3)+x+(-1)×n+(-1)×(6-n)=0,
解得 x=+3;
故选C.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题考查学生根据在化合物中正负化合价代数和为零计算指定元素化合价的能力.1年前查看全部
- (2011•锦州模拟)用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g•mol-1)等新型净水剂替代传
 (2011•锦州模拟)用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g•mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
(2011•锦州模拟)用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g•mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是______>______>______.
(2)高铁酸钠之所以能净水,除它本身具有强氧化性外,另一个原因可能是:______.
(3)二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59°C,沸点为11.0°C,易溶于水.ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60°C时反应制得.某学生用如图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置.请问:
①A部分还应添加温度控制(如水浴加热)装置,B部分还应补充什么装置______;
②C中应装的试剂为______.C中发生反应的化学方程式为:______. lueshuihongjing1年前1
lueshuihongjing1年前1 -
 无情ME 共回答了19个问题
无情ME 共回答了19个问题 |采纳率89.5%解题思路:(1)以单位质量的氧化剂所得到的电子数来表示消毒效率,设质量均为m,消毒效率分别为[m/67.5]×5、[m/166]×3、[m/71]×2×1;
(2)铁离子水解生成胶体,具有吸附性;
(3)①二氧化氯的沸点低,B为ClO2的凝集装置,B装置应降低温度;
②C为尾气吸收装置,可选择碱来吸收尾气,发生氧化还原反应.(1)以单位质量的氧化剂所得到的电子数来表示消毒效率,设质量均为m,ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率分别为[m/67.5]×5、[m/166]×3、[m/71]×2×1,所以由大到小的顺序为ClO2>Cl2>Na2FeO4,故答案为:ClO2;Cl2;Na2FeO4;
(2)高铁酸钠之所以能净水,除它本身具有强氧化性外,另一个原因可能是高铁酸钠的还原产物Fe3+能水解生成Fe(OH)3胶体,能吸附水中悬浮物,从而净水,
故答案为:高铁酸钠的还原产物Fe3+能水解生成Fe(OH)3胶体,能吸附水中悬浮物,从而净水;
(3)①二氧化氯的沸点低,B为ClO2的凝集装置,B装置应补充(冰水)冷凝装置,故答案为:(冰水)冷凝;
②C为尾气吸收装置,可选择NaOH溶液来吸收尾气,发生氧化还原反应为2ClO2+2NaOH═NaClO2+NaClO3+H2O,
故答案为:NaOH溶液;2ClO2+2NaOH═NaClO2+NaClO3+H2O(或其它合理答案).点评:
本题考点: 氯、溴、碘及其化合物的综合应用;铁的氧化物和氢氧化物.
考点点评: 本题以氯及其化合物的性质考查氧化还原反应及物质的制备实验,把握习题中的信息及知识迁移应用为解答的关键,侧重学生综合应用能力及信息抽取和分析能力的考查,题目难度中等.1年前查看全部
- 某含铁盐溶液能够在高浓度的碱性环境下长期稳定存在,且具有较强的灭菌消毒功能,该盐是一种绿色、无污染的净水剂,其化学式为N
某含铁盐溶液能够在高浓度的碱性环境下长期稳定存在,且具有较强的灭菌消毒功能,该盐是一种绿色、无污染的净水剂,其化学式为Na2FeO3.则其中铁元素的化合价是( )
A. +2
B. +3
C. +4
D. +6 refreshlara1年前1
refreshlara1年前1 -
 ii小强 共回答了16个问题
ii小强 共回答了16个问题 |采纳率100%解题思路:根据在化合物中正负化合价代数和为零进行解答本题.根据在化合物中正负化合价代数和为零,可得Na2FeO3 中铁元素的化合价为:(+1)×2+x+(-2)×3=0,
则x=+4;
故选C.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题考查学生根据在化合物中正负化合价代数和为零计算指定元素化合价的解题能力,属于基础题.1年前查看全部
- .明矾的化学式为KAl(SO4)2*12H2O,它是一种常见的净水剂.油条是我国传统的早餐食品之一,其制作过程中要用到一
.明矾的化学式为KAl(SO4)2*12H2O,它是一种常见的净水剂.油条是我国传统的早餐食品之一,其制作过程中要用到一定数量的明矾.研究发现,铝元素会损害人的脑细胞,世界卫生组织指出每人每日铝的安全摄入量应控制在4毫克以下.某饮食店用1000克面粉、4克明矾、小苏打、食盐等辅料加适量水,烹炸得油条24根,平均每根油条50克.求:
(1)明矾的相对原子质量是多少?
我就只有一个问题而已! 为你流泪ss米1年前6
为你流泪ss米1年前6 -
 rr五强rr你 共回答了15个问题
rr五强rr你 共回答了15个问题 |采纳率93.3%额你说的是相对分子质量吧:474 计算:(39+27+(32+16×4)×2+18×12=474)
然后每根油条中铝元素的质量为:0.228g÷24=0.0095g,0.0095g=9.5mg>4mg所以每天吃一根就超标1年前查看全部
- 铁是重要的金属元素,用途极广.(1)高铁酸钾(K2FeO4)具有很强的氧化性,常用作净水剂,对环境无不良影响,被人们称为
铁是重要的金属元素,用途极广.
(1)高铁酸钾(K2FeO4)具有很强的氧化性,常用作净水剂,对环境无不良影响,被人们称为“绿色化学”试剂.工业上,可用铁作阳极,电解KOH溶液制备K2FeO4,其阳极的电极反应式为______.
(2)某高效净水剂可由Fe(OH)SO4聚合得到.工业上以FeSO4、NaNO2和稀硫酸为原料来制备Fe(OH)SO4,反应中有NO生成,化学方程式为______.
(3)已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ/mol
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ/mol
高炉炼铁过程中发生的主要反应为:
[1/3]Fe2O3(s)+CO(g)⇌[2/3] Fe(s)+CO2(g)△H=a kJ/mol,则a=kJ/mol.
已知该反应在不同温度下的平衡常数如下表:
在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时v正______v逆(填“等于”、“大于”或“小于”).经过l0min,在1000℃达到平衡,则该时间范围内反应的平均反应速率v(CO2)=______.欲提高上述反应中CO的平衡转化率,可采取的措施是______;温度/℃ 1000 1115 1300 平衡常数 4.0 3.7 3.5
A.提高反应温度B.移出部分CO2C.加入合适的催化剂D.减小容器的容积
(4)一定温度下的难溶电解质在水溶液中达到溶解平衡时.已知下表数据,对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不科学的是______.
A.向该溶液中加少量铁粉不能观察到红色固体析出物质 Fe(OH)2 Cu(OH)2 Fe(OH)3 Ksp/25℃ 8.0×10-16 2.2×10-20 4.0×10-38 完全沉淀时的PH值 ≥9.6 ≥6.4 3~4
B.该溶液中c(SO42-):[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5:4
C.向该溶液中加入适量氯水,并调节pH值到3~4后过滤,可得到纯净的CuSO4溶液
D.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀. zhqi86861年前1
zhqi86861年前1 -
 月夜的忘忧 共回答了21个问题
月夜的忘忧 共回答了21个问题 |采纳率85.7%解题思路:(1)铁失去电子,在碱性溶液中生成高铁酸根离子,同时有水生成;
(2)此反应为氧化还原反应,反应物中既有氧化剂又有还原剂,依据化合价升降相等配平即可;
(3)依据热化学方程式计算,反应焓变;依据计算得到浓度商和该温度下平衡常数比较判断反应进行方向,依据平衡常数计算生成二氧化碳,结合反应速率概念计算二氧化碳的化学反应速率;欲提高上述反应中CO的平衡转化率,需要反应正向进行;
(4)A.因为Fe3+的氧化性强于Cu2+,所以投入少量铁粉,先发生的反应是:2Fe3++Fe=3Fe2+;
B.Cu2+、Fe2+、Fe3+发生水解,因此它们的物质的量会减少;
C.溶液中混有CuCl2;
D.根据Ksp的大小判断溶解性.(1)铁失去电子,在碱性溶液中生成高铁酸根离子,同时有水生成,阳极的电极反应式为Fe-6e-+8OH-═FeO42-+4H2O,故答案为:Fe-6e-+8OH-═FeO42-+4H2O;
(2)FeSO4→Fe(OH)SO4 ,Fe由+2变为+3,故FeSO4为还原剂,NaNO2→NO,N由+3变为+2,故NaNO2为氧化剂,稀硫酸既不做氧化剂也不做还原剂.FeSO4→Fe(OH)SO4 和NaNO2→NO化合价升降相等,故FeSO4和NaNO2化学计量数相等,依据原子守恒配平可得:2FeSO4+2NaNO2+H2SO4=2Fe(OH)SO4+Na2SO4+2NO↑
故答案为:2FeSO4+2NaNO2+H2SO4=2Fe(OH)SO4+Na2SO4+2NO↑;
(3)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ/mol
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ/mol
依据盖斯定律①×[1/3]-②得到高炉炼铁过程中发生的主要反应为:[1/3]Fe2O3(s)+CO(g)⇌[2/3] Fe(s)+CO2(g)△H=-9.5 kJ/mol,则a=-9.5kJ/mol
在一个容积为:10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,Q=
1mol
10L
1mol
10L=1<K=4,说明费用正向进行,v正>v逆;
设反应一氧化碳物质的量为x
[1/3]Fe2O3(s)+CO(g)⇌[2/3] Fe(s)+CO2(g)
起始量 (mol) 1 1
变化量(mol) x x
平衡量(mol)1-x 1+x
[1+x/1−x]=4
x=0.6
经过l0min,在1000℃达到平衡,则该时间范围内反应的平均反应速率v(CO2)=
0.6mol
10L
10min=0.006mol/L•min;
欲提高上述反应中CO的平衡转化率,应使平衡正向进行;
A.反应是放热反应,提高反应温度,平衡逆向进行,一氧化碳转化率减小,故A不符合;
B.移出部分CO2平衡正向进行,一氧化碳转化率增大,故B符合;
C.加入合适的催化剂,改变反应速率不改变化学平衡,一氧化碳转化率不变,故C不符合;
D.反应前后气体体积不变,减小容器的容积增大压强,平衡不变,一氧化碳转化率不变,故D不符合;
故选B.
(4)A.因为Fe3+的氧化性强于Cu2+,所以投入少量铁粉,先发生的反应是:2Fe3++Fe=3Fe2+,不能观察到红色固体析出,故A正确;
B.因为Cu2+、Fe2+、Fe3+对应的碱全是弱碱,所以这三种离子在溶液中都会发生水解,因此它们的物质的量会减少,故B正确;
C.加入氯水,可以把亚铁离子全氧化成三价,但它的还原产物Cl-肯定还在溶液中,而且在调节pH时加入的试剂也会在溶液中有所保留,所以得到的溶液中不可能只含CuSO4一种溶质,故C错误;
D.从表格中可以看出,Fe(OH)3的Ksp是最小的,所以它最先出现沉淀,故D正确;
故选C.点评:
本题考点: 电解原理;化学平衡常数的含义;化学平衡的影响因素;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查了电解原理,化学平衡影响因素,平衡常数、反应速率概念分析应用,热化学方程式和盖斯定律计算,沉淀溶解平衡的理解应用,掌握基础是关键,题目难度中等.1年前查看全部
- 某含铁盐溶液能够在高浓度的碱性环境下长期稳定存在,且具有较强的灭菌消毒功能,该盐是一种绿色、无污染的净水剂,其化学式为N
某含铁盐溶液能够在高浓度的碱性环境下长期稳定存在,且具有较强的灭菌消毒功能,该盐是一种绿色、无污染的净水剂,其化学式为Na2FeO3.则其中铁元素的化合价是( )
A. +2
B. +3
C. +4
D. +6 qianlanbie1年前10
qianlanbie1年前10 -
 wang_du_du 共回答了17个问题
wang_du_du 共回答了17个问题 |采纳率100%解题思路:根据在化合物中正负化合价代数和为零进行解答本题.根据在化合物中正负化合价代数和为零,可得Na2FeO3 中铁元素的化合价为:(+1)×2+x+(-2)×3=0,
则x=+4;
故选C.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题考查学生根据在化合物中正负化合价代数和为零计算指定元素化合价的解题能力,属于基础题.1年前查看全部
- 明矾[化学式为KAl(SO4)2•12H2O]是农村常用的一种净水剂.
明矾[化学式为KAl(SO4)2•12H2O]是农村常用的一种净水剂.
明矾[化学式为KAl(SO4)2•12H2O]是农村常用的一种净水剂,它在水中离解出K+、Al3+和SO42-,甲同学为了探究明矾中每粒子是否有净水作用,进行了如下实验,请填写表中空白:
实验操作 实验现象 结论
在一杯浑浊的水中加入少量KCl,静置 烧杯中的水仍然浑浊 K+没有净水作用K+没有净水作用
在一杯浑浊的水中加入少量Al2(SO4)3,静置 烧杯中的水变澄清 Al3+或SO42-有净水作用Al3+或SO42-有净水作用
乙同学看到甲方的方案后,认为该方案不完善,他对甲同学的方案进行补充完善,请你把乙同学的补充方案中要达到的目的和所使用的试剂填入下表
实验目的 实验试剂及操作 现象 结论
验证SO42-是否有净水作用 在一杯浑浊的水中加入少量Na2SO4溶液静置 烧杯中依旧浑浊 SO42-没有净水作用
.
认为还需加一步食盐操作,在一杯浑浊的水中加少量______,来检验Al3+是否有净水作用. kaizi19861年前1
kaizi19861年前1 -
 sxr0107 共回答了18个问题
sxr0107 共回答了18个问题 |采纳率94.4%在一杯浑浊的水中加少量_AlCl3_____,来检验Al3+是否有净水作用.
因为甲同学没有确定是Al3+还是SO42-有净水作用,所以在乙同学实验的基础上加入氯化铝可确定Al3+是否有净水作用.1年前查看全部
- 明矾的化学式为KAl(SO4)2·12H2O,它是一种常见的净水剂.油条是我国传统的早餐食品之一
明矾的化学式为KAl(SO4)2·12H2O,它是一种常见的净水剂.油条是我国传统的早餐食品之一
.明矾的化学式为KAl(SO4)2*12H2O,它是一种常见的净水剂.油条是我国传统的早餐食品之一,其制作过程中要用到一定数量的明矾.研究发现,铝元素会损害人的脑细胞,世界卫生组织指出每人每日铝的安全摄入量应控制在4毫克以下.某饮食店用1000克面粉、4克明矾、小苏打、食盐等辅料加适量水,烹炸得油条24根,平均每根油条50克.求:
(1)若在油条制作过程中铝元素不损失,某人一天吃一根油条,铝元素的摄入量是否超过安全摄入 mm骑士20001年前1
mm骑士20001年前1 -
 abcd814817 共回答了23个问题
abcd814817 共回答了23个问题 |采纳率78.3%解析:
KAl(SO4)2·12H2O,摩尔质量=474 g/mol
其中铝元素质量分数 = 27*100% / 474 = 5.7%
假设所有物质混合均匀,
则24根油条平均每根含铝质量 = (4g / 24) *(5.7%) = 0.00949 g = 9.49 mg
超标1年前查看全部
- 可用作净水剂的盐是什么?可生产洗涤剂的碱有什么?
 sh4y1年前1
sh4y1年前1 -
 starcx74 共回答了25个问题
starcx74 共回答了25个问题 |采纳率92%可做净水剂的盐类有明矾KAlSO4 和其他的三价铁盐 铝盐
可生产洗涤剂的碱有氢氧化钠NaOH1年前查看全部
- 为何硫酸铝钾用作净水剂的离子方程式生成的氢氧化铝要写胶体而不写沉淀
 rain19761年前1
rain19761年前1 -
 xixiaixxx 共回答了17个问题
xixiaixxx 共回答了17个问题 |采纳率88.2%之所以明矾能够净水,利用的就是铝离子水解生成氢氧化铝的胶体,而胶体具有吸附性,因此可以净水.1年前查看全部
- 结晶三氯化铁跟水反应生成的氢氧化铁胶体具有净水作用,三氯化铁被称为净水剂,并且具有使用价值.
结晶三氯化铁跟水反应生成的氢氧化铁胶体具有净水作用,三氯化铁被称为净水剂,并且具有使用价值.
明矾也是具有使用价值的净水剂之一,城市自来水厂常用其在常温下对大量水进行净化.(1)如果选择适合的分类标准,可以将结晶三氯化铁和明矾这两种不同的物质规划为同一类物质,请你来进行划分.
1'分类标准:-----------.物质类型名称:-------------.2'分类标准:----------.物质类型名称:---------------.
(2)取黄河水50毫升盛在烧杯中,再向烧杯中加入适量的明矾粉末并用玻璃棒将水搅拌,发生的现象是------------------------------------.
(3)食盐水和明矾水溶液都是无色透明澄清的液体.对这两种溶液进行鉴别的方法有很多,如果不用任何试剂进行鉴别有关的方法、现象和结论是-----------------------------------------------------.
 tony4871年前1
tony4871年前1 -
 88826 共回答了20个问题
88826 共回答了20个问题 |采纳率90%1‘物质属性 盐 2’
(2)烧杯中的水从黄色悬浮液出现分成,上液呈透明无色,下称出现黄色沉淀
(3)方法各取少量两种溶液,然后分别进行加热蒸发,蒸发到还有三分一水分时停止加热,然后冷却至室温.
现象:其中一种出现大量白色结晶,另一出现少量白色结晶
结论:出现大量白色结晶的原溶液是明矾水溶液,出现少量白色结晶的原溶液是食盐水1年前查看全部
- 谁能告诉我从高铁酸钾组成元素角度作为净水剂的优点
 linqing081年前3
linqing081年前3 -
 黄晓鸿 共回答了15个问题
黄晓鸿 共回答了15个问题 |采纳率100%高铁酸钾组成元素有:钾K、铁Fe、氧O
以上元素是人体必需元素,经高铁酸钾净化的水对人体的危害小;铁为最高价态,氧化性强,净水效果好.
所以,优点是对人体危害小,净水效果好.1年前查看全部
- 新型净水剂-高铁酸钾(K2FeO4)为暗紫色固体,可溶于水.工业上制备K2FeO4的常用方法之一是次氯酸盐氧化法:①2F
新型净水剂-高铁酸钾(K2FeO4)为暗紫色固体,可溶于水.工业上制备K2FeO4的常用方法之一是次氯酸盐氧化法:①2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O
②Na2FeO4+2KOH═K2FeO4+2NaOH.下列说法不正确的是( )
A.反应①为氧化还原反应,反应②为复分解反应
B.反应①中氧化产物与还原产物物质的量之比为2:9
C.反应②的产物K2FeO4中Fe为+6价,具有强氧化性,能杀菌消毒
D.若有2mol FeCl3发生反应,转移电子的物质的量为6 mol 天寒地动1年前1
天寒地动1年前1 -
 YoungD 共回答了18个问题
YoungD 共回答了18个问题 |采纳率100%解题思路:反应2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O中,Fe元素化合价升高,由+3价升高到+6价,被氧化,Cl元素化合价由+1价降低到-1价,被还原,NaClO为氧化剂,FeCl3为还原剂,Na2FeO4+2KOH═K2FeO4+2NaOH为复分解反应,元素化合价没有发生变化,以此解答.A.反应①Fe和Cl元素化合价发生变化,为氧化还原反应,反应②元素化合价没有发生变化,为复分解反应,故A正确;
B.反应2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O中,NaClO为氧化剂,FeCl3为还原剂,由方程式可知,氧化产物与还原产物物质的量之比为2:3,故B错误;
C.由化合价代数和为0的原则可知K2FeO4中Fe为+6价,具有强氧化性,能杀菌消毒,故C正确;
D.反应2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O中,Fe元素化合价升高,由+3价升高到+6价,则若有2mol FeCl3发生反应,转移电子的物质的量为6 mol,故D正确.
故选B.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,侧重于学生的分析能力和计算能力的考查,为高考常见题型和高频考点,注意从元素化合价的角度认识氧化还原反应中物质所表现出的性质,明确元素的化合价为解答该类题目的关键,难度中等.1年前查看全部
- 常用作净水剂的物质是明矾 可用于灭菌的物质是------
 霓裳丽影1年前2
霓裳丽影1年前2 -
 天山牧羊人 共回答了18个问题
天山牧羊人 共回答了18个问题 |采纳率83.3%一般都是用漂白粉,便宜.其他灭菌的物质还有很多,如高锰酸钾,次氯酸,二氧化氯,双氧水,紫外线等.1年前查看全部
- 化合物M是铁元素的+6价含氧酸钾盐,常用作净水剂与消毒剂.由铁元素的稳定氢氧化物与次氯酸钾、
化合物M是铁元素的+6价含氧酸钾盐,常用作净水剂与消毒剂.由铁元素的稳定氢氧化物与次氯酸钾、
氢氧化钾溶液反应制取化合物M,则制备M的离子方程式怎么写啊 ylcey1年前1
ylcey1年前1 -
 我的dd在杭州 共回答了21个问题
我的dd在杭州 共回答了21个问题 |采纳率95.2%离子方程式 2 Fe(OH)3 + 3 ClO- + 4 OH- = 2 FeO42- + 3 CI- + 5 H2O
化学方程式 2 Fe(OH)3 + 3 KClO + 4 KOH = 2 K2FeO4 + 3 KCI + 5 H2O
铁元素的稳定氢氧化物是Fe(OH)3,根据·化合价可知M是K2FeO4
剩下的就是配平了1年前查看全部
- 常见的净水剂有哪些?净水原理分别是什么?
 chen_he1年前1
chen_he1年前1 -
 200131390224 共回答了15个问题
200131390224 共回答了15个问题 |采纳率80%净水剂主要的成份类似明矾的化学物质.净水原理就是把水中的细小漂浮颗粒集合到一起,使其比重加大并下沉.
明矾净水:
明矾溶于水后,发生如下电离:
KAl(S04)2=K+ +A13+ +2SO42—
铝离子发生水解,生成具有吸附性的氢氧化铝胶体:
Al3++3H20==(可逆符号) Al(OH)3(胶体)+3H+
氢氧化铝胶体吸附水中的悬浮颗粒并一起沉降下来
氯化铁净水:
Fe3++3H20 ==(可逆符号)Fe(OH)3(胶体)+3H+
氢氧化铁胶体同样具有吸附性.1年前查看全部
- 下列推断合理的是 A.明矾[KAl(SO 4 ) 2 ·12H 2 O]在水中能形成Al(OH) 3 胶体,可用作净水剂
下列推断合理的是
A.明矾[KAl(SO 4 ) 2 ·12H 2 O]在水中能形成Al(OH) 3 胶体,可用作净水剂 B.Na的金属活性比Mg强,故可用Na与MgCl 2 溶液反应制Mg C.浓H 2 SO 4 有强氧化性,但不能与Cu发生反应 D.SO 2 具有还原性,故可作漂白剂  青六六1年前1
青六六1年前1 -
 SB1234 共回答了23个问题
SB1234 共回答了23个问题 |采纳率91.3%A
1年前查看全部
- 一种高效净水剂PAFC(化学式为[A1Fe(OH)nC16
一种高效净水剂PAFC(化学式为[A1Fe(OH)nC16
A、0 B、+2 C、+3 D、+6 我想知道为什么这里Cl的化合价为+1,怎么判断的 夏夏美彦1年前3
夏夏美彦1年前3 -
 luckynumber 共回答了21个问题
luckynumber 共回答了21个问题 |采纳率85.7%净水剂是利用Al3+、Fe3+离子容易发生水解,生成Al(OH)3和Fe(OH)3胶体,而氢氧化铁或氢氧化铝胶粒具有吸附作用,可以吸附水中悬浮的杂质发生聚沉的原理来净水的.
所以[AlFe(OH)nCl6-n]m中Al呈不变化合价+3价,Cl呈-1价,OH呈-1价,根据化合物正负化合价代数和为0可以知道其中Fe呈+3价.1年前查看全部
- 高铁酸钾是一种重要的绿色净水剂,具有净水和消毒双重功能。某课外学习小组设计如下方案制备高铁酸钾:
高铁酸钾是一种重要的绿色净水剂,具有净水和消毒双重功能。某课外学习小组设计如下方案制备高铁酸钾:
(1)高铁酸钾中铁元素的化合价为________,推测它具有的化学性质是________。
(2)在次氯酸钠(NaClO,84消毒液的主要成分)溶液中加入烧碱固体形成碱性环境,将研磨的硝酸铁少量多次地加入到上述溶液中,冰浴中反应1 h。发生的离子反应为2Fe3++3ClO-+10OH-===2FeO2-4+3Cl-+5H2O,氧化剂是________。将KOH加入到反应后的溶液搅拌半小时。静置,抽滤粗产品。该反应的化学方程式为2KOH+Na2FeO4===K2FeO4+2NaOH,根据复分解反应原理,高铁酸钠的溶解度________(填:大于、小于或等于)高铁酸钾的溶解度。
(3)在强碱性溶液中,高铁酸钾能将亚铬酸钾(KCrO2)氧化为铬酸钾(K2CrO4),生成的铬酸盐溶解酸化后,得到的重铬酸钾(K2Cr2O7)用(NH4)2Fe(SO4)2的标准溶液滴定,以二苯胺磺酸钠为指示剂。到达滴定终点时,溶液由紫色变为淡绿色(+6价铬转化成+3价铬),有关离子方程式为FeO2-4+CrO-2+2H2O===CrO2-4+Fe(OH)3↓+OH-,2CrO2-4+2H+===Cr2O2-7+H2O,2Cr2O2-7+6Fe2++14H+===2Cr3++6Fe3++7H2O
现称取5.00g高铁酸钾样品于烧杯中,加入适量氢氧化钾溶液,加入稍过量的KCrO2,充分反应后,转移到250 mL容量瓶中,定容,量取25.00 mL,再用稀硫酸酸化,用0.1000 mol•L-1的(NH4)2Fe(SO4)2标准溶液滴定,用去标准溶液33.33 mL。计算上述实验制得的样品中,高铁酸钾的质量分数为________;
(4)明矾、硫酸铁、高铁酸钾都能净水,简述高铁酸钾净水原理:
________________________________________________________________________。 yiguzhou1年前1
yiguzhou1年前1 -
 晴天5658 共回答了2个问题
晴天5658 共回答了2个问题 |采纳率50%太长了1年前查看全部
大家在问
- 1只有在化合物中才能存在的化学键是 [ ] A.离子键
- 2How far is it from your home to the school?
- 3上面一个大.下面一个多是个什么字啊,
- 4如图ab是圆o的直径弦cd与ab交于点P且AP;PB=1;5 op=2 角DPB=30° 求CD的长
- 5这个数独候选数表,怎样可以安全的删除一些数字?
- 6My English is so poor,I want to study hard to i____ it.这个空填什
- 7六(1)班男生人数的[1/3]与女生人数的[1/4]共16人,女生人数的[1/3]和男生人数的[1/4]共19人,六(1
- 8设向量a,b满足|a|=|b|=1,|3a-2b|=3,则求|3a+2b|=?
- 9Not until his father died _______ what his father really mea
- 10早读课从7时30分开始,到8时下课.一节早读课,钟面上的分针正好旋转了( )周.
- 11AR3126数字绝缘电阻测试仪如何使用?
- 12高二物理波的衍射:已知空气中的声速是340m/s,现有几种声波:(1)周期为0.05s;(2)频率为10^4Hz;……
- 13CQ1190货车这几个字母和数字各是什么意义啊?
- 14英语翻译景公赐晏子狐之白裘,元豹之茈,其赀千金,使梁丘据致之.晏子辞而不受,三反.公曰:“寡人有此二,将欲服之.今夫子不
- 15品味友谊 作文
