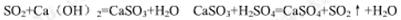硫酸工业生产尾气的处理和回收原理(反应方程式)
 萧然xiaoran2022-10-04 11:39:541条回答
萧然xiaoran2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 dieleng1992610 共回答了12个问题
dieleng1992610 共回答了12个问题 |采纳率83.3%- 硫酸工业中尾气是二氧化硫、三氧化硫,化学反应式为:SO2+2NH3.H2O=(NH4)2SO3 + H2O
SO3+2NH3.H2O=(NH4)2SO4+H2O. - 1年前
相关推荐
- (2009•黄浦区二模)在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都是正确的是( )
(2009•黄浦区二模)在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都是正确的是( )
A.硫铁矿燃烧前需要粉碎,因为大块的硫铁矿不能在空气中燃烧
B.从沸腾炉出来的炉气需净化,因为炉气中二氧化硫会与杂质反应
C.二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率
D.三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以便使三氧化硫吸收完全 moon211年前1
moon211年前1 -
 snkwz 共回答了11个问题
snkwz 共回答了11个问题 |采纳率81.8%解题思路:根据工业上接触法制硫酸的原料、过程,制硫酸原料为硫铁矿,进样前首先将硫铁矿粉碎,增大接触面积;生产分三步,二氧化硫的制取和净化、二氧化硫转化为三氧化硫、三氧化硫的吸收,分别在沸腾炉、接触室、吸收塔中进行;其中从沸腾炉中出来的气体需要净化和干燥,是为了防止在接触室中的催化剂中毒,在接触室中的催化剂可以加快反应的速率,但不会影响平衡的移动,二氧化硫的转化率不会改变;在吸收塔中生成的三氧化硫与水反应生成硫酸,若直接用水吸收会形成酸雾,因此在生产实践中采用98.3%的浓硫酸吸收,这样可以防止形成酸雾,使三氧化硫吸收完全等来解题.A、硫铁矿燃烧前需要粉碎,因为大块的硫铁矿不能在空气中充分燃烧,硫铁矿粉碎后与氧气的接触面积增大,利于其充分的燃烧,大块的硫铁矿在空气中也能燃烧,只是燃烧不充分,会造成资源的浪费,故A错误;
B、从沸腾炉出来的炉气需净化是因为其中带有的杂质气体会让下一步接触室里面的催化剂中毒,催化剂中毒会影响反应的进度,故B错误;
C、一般来说,催化剂是指参与化学反应中间历程的,又能选择性地改变化学反应速率,而其本身的数量和化学性质在反应前后基本保持不变的物质.通常把催化剂可以加速化学反应,使反应尽快达到平衡状态,但不影响化学平衡,故二氧化硫的转化率不会改变,只是达到平衡的时间减短了,故C错误;
D、生成的三氧化硫与水反应生成硫酸,若直接用水吸收会形成酸雾,因此在生产实践中采用98.3%的浓硫酸吸收,这样可以防止形成酸雾,使三氧化硫吸收完全,故D正确;
故选D.点评:
本题考点: 工业制取硫酸.
考点点评: 本题考查了工业上接触法制硫酸的原料、过程.明确发生的化学反应及设备、原料、在生产实践中采用98.3%的浓硫酸吸收的原因是解答本题的关键,并注意理论与实际生产中的差别来解答.1年前查看全部
- (2011•太原二模)[化学-化学与技术]硫酸工业生产应考虑综合经济效益问题.
(2011•太原二模)[化学-化学与技术]硫酸工业生产应考虑综合经济效益问题.
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在______的郊区(填标号);
A.有丰富黄铁矿资源的城市
B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市
D.人口稠密的文化、商业中心城市
(2)CuFeS2是黄铁矿的另一成分,煅烧时CuFeS2转化为CuO、Fe2O3 和SO2,该反应的化学方程式为4CuFeS2+13O2
4CuO+2Fe2O3+8SO2煅烧 .4CuFeS2+13O2.
4CuO+2Fe2O3+8SO2煅烧 .
(3)在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都是正确的是______.
A.黄铁矿燃烧前需要粉碎,因为大块的黄铁矿不能在空气中燃烧
B.从沸腾炉出来的炉气需净化,因为炉气中二氧化硫会与杂质反应
C.二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率
D.三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率
(4)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3 在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
已知CuSO4 在低于660℃时不会分解,请简要分析上表中CuSO4的质量分数随温度升高而降低的原因______.沸腾炉温度/℃ 600 620 640 660 炉渣中CuSO4的质量分数/% 9.3 9.2 9.0 8.4  bingleng1681年前0
bingleng1681年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 下列关于工业生产说法正确的是 A.在侯氏制碱工业中,向饱和氯化钠溶液中先通氨气,后通二氧化碳 B.在硫酸工业、合成氨工业
下列关于工业生产说法正确的是
A.在侯氏制碱工业中,向饱和氯化钠溶液中先通氨气,后通二氧化碳 B.在硫酸工业、合成氨工业、硝酸工业中,均必须对尾气进行吸收处理 C.工业上用电解熔融氧化物的方法制金属镁和铝 D.氯碱工业中的阳离子交换膜阻止阳离子通过  ii_ii1年前1
ii_ii1年前1 -
 金gg小白兔 共回答了18个问题
金gg小白兔 共回答了18个问题 |采纳率88.9%A
本题考查了常见的工业制法。在侯氏制碱法中,由于二氧化碳溶解度小,故先通入过量氨气再通而二氧化碳。电解法制活泼金属时,制铝用氧化物,制镁用氯化物。氯碱工业中,阳离子交换膜不允许小分子、阴离子通过。在硫酸工业、合成氨工业、硝酸工业中,尾气往往要回收以提高原料利用率。1年前查看全部
- (2013•山东模拟)合成氨工业、硫酸工业的生产工艺流程大致为:
(2013•山东模拟)合成氨工业、硫酸工业的生产工艺流程大致为:
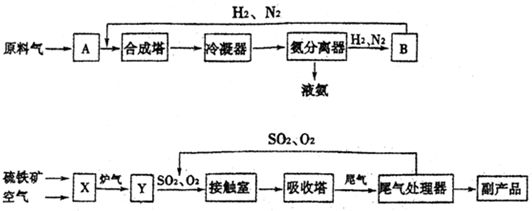
合成塔和接触室中的反应分别为:
N2(g)+3H2(g)⇌2NH3(g)△H<0;2SO2(g)+O2(g)⇌2SO3(g)△H<0
(1)写出流程中设备的名称:B______,X______.
(2)进入合成塔和接触室中的气体都要进行热处理,最理想的热处理方法是______.
(3)采用循环操作可提高原料的利用率,下列生产中,采用循环操作的是______(填序号).
①硫酸工业②合成氨工业③硝酸工业
(4)工业上常用98.3%的浓硫酸吸收SO3而不用稀硫酸或水的原因是______.
(5)工业生产中常用氨--酸法进行尾气脱硫,以达到消除污染、废物利用的目的.硫酸工业尾气中的SO2经处理可以得到一种化肥,该肥料的化学式是______. lxc88881年前1
lxc88881年前1 -
 superyellow 共回答了14个问题
superyellow 共回答了14个问题 |采纳率85.7%解题思路:(1)依据工业合成氨、接触法制硫酸的工业流程和设备反应分析判断;
(2)根据合成塔中的反应要吸热,接触室中的反应要放热,能量循环使用;
(3)①硫酸工业中在接触室发生了二氧化硫的催化氧化,采用循环操作可提高二氧化硫的利用率;
②合成氨生产中产生了氨气,采用循环操作可提高N2、H2的转化率
③硫酸工业中涉及到合成氨,合成氨生产中产生了氨气,采用循环操作可提高N2、H2的转化率;
(4)在吸收塔中用水吸收三氧化硫,反应放热易形成酸雾阻止对三氧化硫的吸收;
(5)工业生产中常用氨-酸法进行尾气脱硫,即先用氨水吸收,再用浓硫酸处理.先用氨水吸收时,发生反应:SO2+2NH3•H2O═(NH4)2SO3,再用浓硫酸处理时,发生反应:(NH4)2SO3+H2SO4═(NH4)2SO4+SO2↑+H2O.(1)合成氨工业中,利用氨易液化,分离出N2、H2通过循环压缩机循环使用,可提高氨的产率;X设备是煅烧黄铁矿的设备,在沸腾炉进行反应,故答案为:循环压缩机;沸腾炉;
(2)合成塔中的反应要吸热,接触室中的反应要放热,可以充分利用反应中放出的热量加热反应气,故答案为:充分利用反应中放出的热量加热反应气;
(3)①硫酸工业中在接触室发生了二氧化硫的催化氧化,采用循环操作可提高二氧化硫的利用率,故①正确;
②合成氨生产中产生了氨气,采用循环操作可提高N2、H2的转化率,故②正确;
③硫酸工业中涉及到合成氨,合成氨生产中产生了氨气,采用循环操作可提高N2、H2的转化率,故③正确;
故选:①②③;
(4)在吸收塔中用水吸收三氧化硫,反应放热易形成酸雾阻止对三氧化硫的吸收,故答案为:由于用稀硫酸或水吸收SO2时易形成酸雾,不利于SO2吸收;
(5)工业生产中常用氨-酸法进行尾气脱硫,即先用氨水吸收,再用浓硫酸处理.先用氨水吸收时,发生反应:SO2+2NH3•H2O═(NH4)2SO3,再用浓硫酸处理时,发生反应:(NH4)2SO3+H2SO4═(NH4)2SO4+SO2↑+H2O,硫酸工业尾气中的SO2经处理可以得到一种化肥为(NH4)2SO4,故答案为:(NH4)2SO4.点评:
本题考点: 工业合成氨;工业制取硫酸.
考点点评: 本题主要考查了合成氨工业、硫酸工业的生产工艺流程,掌握生产的原理和步骤是解题的关键,难度中等.1年前查看全部
- 导致空气污染的主要原因来自于化石燃料燃烧、硫酸工业和汽车尾气的排放;致使大量二氧化硫和氮氧化物排入大气中。利用化学反应原
导致空气污染的主要原因来自于化石燃料燃烧、硫酸工业和汽车尾气的排放;致使大量二氧化硫和氮氧化物排入大气中。利用化学反应原理研究治理环境污染的方法是当前环保工作的重要研究内容之一。
(1)反应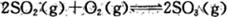 是硫酸工业中的重要反应;提高SO 2 的平衡转化率有利于减少尾气排放:已知该反应是放热反应;当该反应处于平衡状态时,为了提高SO 2 的转化率:下列可采用的措施是
是硫酸工业中的重要反应;提高SO 2 的平衡转化率有利于减少尾气排放:已知该反应是放热反应;当该反应处于平衡状态时,为了提高SO 2 的转化率:下列可采用的措施是
A.加入V 2 O 5 作催化剂 B.通入过量空气 C.高温 D.增大压强
(2)一定条件下,向2L密闭容器中通入2molSO 2 (g)、1molO 2 (g)和0.2SO 3 (g),2min后反应达到平衡时,测得SO 2 的转化率为50%,则该可逆反应的平衡常数K=_________;用O 2 的浓度变化表示从O-2min内该反应的平均速率v=_________;恒温下,若向容器中再加入2molSO 2 (g),则重新达到平衡时SO 2 的总转化率____________50%(填“>”、“<”、“=”)
(3)能说明该反应已经达到平衡状态的是
A.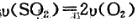 B.容器内压强保持不变.
B.容器内压强保持不变.
C.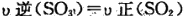 D.容器内物质的密度保持不变.
D.容器内物质的密度保持不变.
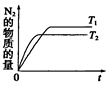
(4)在催化剂作用下用CH 4 将氮氧化物还原为N 2 可以消除氮氧化物带来的污染, 请写出CH 4 与NO反应的化学方程式:_________;温度为T 1 时在密闭容器中研究CH 4 催化还原氮氧化物的反应,反应过程中产物N 2 的物质的量随时间的变化曲线如图所示,请在图中补画出温度为T 2 (T 2 >T 1 )时,n(N 2 )的变化曲线(已知该反应是放热反应)。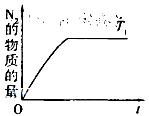
 zjcsg1年前1
zjcsg1年前1 -
 aa母 共回答了21个问题
aa母 共回答了21个问题 |采纳率85.7%1年前查看全部
- 硫酸工业中用氨水吸收尾气有什么氧化还原反应
 峰乔YY专用oo1年前1
峰乔YY专用oo1年前1 -
 wxj715 共回答了15个问题
wxj715 共回答了15个问题 |采纳率80%硫酸工业中尾气是二氧化硫、三氧化硫,化学反应式为:搜SO2+2NH3.H2O=(NH4)2SO3=H2O,SO3+2NH3.H2O=(NH4)2SO4+H2O.没有氧化还原反应.1年前查看全部
- 下列说法不正确的是:a硫酸工业尾气必须回收,净化处理,主要是为了在防止污染大气的同时充分利用原料b所谓“酸雨”,主要是指
下列说法不正确的是:a硫酸工业尾气必须回收,净化处理,主要是为了在防止污染大气的同时充分利用原料b所谓“酸雨”,主要是指含有硫的氧化物和氮的氧化物的雨水c大气中大量的SO2来源于煤和石油的燃烧以及金属矿石的冶炼d消除大气污染的主要方法之一是减少污染物的排放.)
 紫游儿1年前1
紫游儿1年前1 -
 hover21 共回答了22个问题
hover21 共回答了22个问题 |采纳率86.4%B错了,酸雨是指PH值小于5.6的雨雪或其他形式的降水.1年前查看全部
- (2011•江西一模)[化学与技术]硫酸工业生产应考虑综合经济效益问题.
(2011•江西一模)[化学与技术]硫酸工业生产应考虑综合经济效益问题.
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在______的郊区(填选项的标号)
A.有丰富黄铁矿资源的城市B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市D.人口稠密的文化、商业中心城市
(2)据测算,接触法制硫酸过程中,若反应热都未被利用,则每生产1t 98%硫酸需消耗3.6×105kJ能量.请通过计算判断,若反应:SO2(g)+[1/2]O2⇌SO3 △H=-98.3kJ•mol-1放出的热量能在生产过程中得到充分利用,则每生产1t98%硫酸只需外界提供(或可向外界输出)______千焦能量(H2SO4的摩尔质量为98g•mol-1)
(3)CuFeS2是黄铁矿的另一成分,煅烧时,CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为4CuFeS2+13O2
4CuO+2Fe2O3+8SO2煅烧 .4CuFeS2+13O2.
4CuO+2Fe2O3+8SO2煅烧 .
(4)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
已知CuSO4在低于660℃时不会分解,请简要分析上表中CuSO4的质量分数随温度升高而降低的原因______.沸腾炉温度/℃ 600 620 640 660 矿渣中CuSO4的质量分数/% 9.3 9.2 9.0 8.4  jiuzhiye1年前1
jiuzhiye1年前1 -
 看呵 共回答了16个问题
看呵 共回答了16个问题 |采纳率93.8%解题思路:(1)硫酸工业生产应考虑综合经济效益问题,同时要考虑当地的需求量情况,硫酸厂是一座具有一定污染性的工厂;
(2)根据硫原子守恒,外界提供的能量即为硫酸生产过程放出的热量和需消耗的能量之间的差值;
(3)根据反应物和生成物结合质量守恒来书写化学方程式;
(4)根据硫酸铜的生产原理和化学平衡移动的影响因素来考虑.(1)硫酸工业生产应考虑综合经济效益问题,同时要考虑当地的需求量情况,硫酸厂是一座具有一定污染性的工厂,所以厂址宜选在消耗硫酸甚多的工业城市,故答案为:C;
(2)根据原子守恒,则SO2~SO3~H2SO4 放出的热量
98g 98.3KJ
1×106×98%g x
[98g
1×106×98%g=
98.3kJ/x]
解得:x=9.83×105kJ
可向外界输出的能量:9.83×105kJ-3.6×105KJ=6.23×105KJ,故答案为:6.23×105;煅烧
(3)反应物和生成物已知,结合质量守恒来书写化学方程式为:4CuFeS2+13O2
煅烧
.
4CuO+2Fe2O3+8SO2,故答案为:
4CuFeS2+13O2
煅烧
.
4CuO+2Fe2O3+8SO2;
(4)SO2转化为SO3是正反应放热的可逆反应,随温度升高,平衡逆移,SO3物质的量减少,所以CuSO4的量减少(或温度升高,SO3物质的量减少,故CuSO4的量减少),
故答案为:SO2转化为SO3是正反应放热的可逆反应,随温度升高,平衡逆移,SO3物质的量减少,所以CuSO4的量减少(或温度升高,SO3物质的量减少,故CuSO4的量减少).点评:
本题考点: 工业制取硫酸.
考点点评: 本题是一道关于硫酸的工业生产知识题目,综合性较强,难度较大.1年前查看全部
- 下列有关工业生产的说法不正确的是()A,硫酸工业生产中第一步所用设备为沸腾炉
下列有关工业生产的说法不正确的是()A,硫酸工业生产中第一步所用设备为沸腾炉
19 下列有关工业生产的说法不正确的是
A.硫酸工业生产中第一步所用设备为沸腾炉
B.硫酸工业生产中要用到热交换器
C.工业上获得C12的重要手段是电解饱和食盐水
D.工业上合成氨的反应为
D,.反应为Cu(OH)2+2NH4Cl====CaCl2+2NH3↑+2H2O 6869961年前1
6869961年前1 -
 keke030119 共回答了22个问题
keke030119 共回答了22个问题 |采纳率95.5%D D是实验室的1年前查看全部
- (2007•南京二模)化工生产必须在遵循科学原理、实现某个反应的基础上,着重考虑综合经济效益.从硫酸工业遵循的科学原理和
(2007•南京二模)化工生产必须在遵循科学原理、实现某个反应的基础上,着重考虑综合经济效益.从硫酸工业遵循的科学原理和综合经济效益分析,下列说法不正确的是( )
A.硫酸厂不应建在人口稠密的居民区和环保要求高的地区
B.硫酸厂靠近原料产地比靠近硫酸消费中心更为有利
C.硫酸厂生产过程中的污水,含有硫酸等杂质,可用石灰乳中和处理
D.可利用硫酸厂生产过程中产生的“废热”来供热和发电 白木马1年前1
白木马1年前1 -
 1121001 共回答了27个问题
1121001 共回答了27个问题 |采纳率96.3%解题思路:硫酸厂厂址的选择从综合经济效益和环保要求考虑,主要是硫酸为危险品,硫酸的运输成本要高于原料黄铁矿的运输成本,工厂废气有污染性气体,再结合硫酸的性质分析.A.硫酸工厂的废气会产生污染,所以不能在人口稠密的居民区和环保要求高的地区,故A正确;
B.由于硫酸产品具有强腐蚀性不方便运输,所以运输成本要高于原料黄铁矿的运输成本,所以厂址应选择在消耗硫酸甚多的工业城市郊区,故B错误;
C.石灰乳能与硫酸反应,所以能消除硫酸形成的污染,故C正确;
D.硫酸厂生产过程中产生的“废热”来供热和发电,充分利用能量,节省能源,故D正确;
故答案为:B;点评:
本题考点: 工业制取硫酸.
考点点评: 本题是一道关于硫酸的工业生产知识题目,涉及的知识点较简单,题目难度不大.1年前查看全部
- 硫酸是重要的化工原料,二氧化硫生成三氧化硫是硫酸工业的重要反应之一.
硫酸是重要的化工原料,二氧化硫生成三氧化硫是硫酸工业的重要反应之一.
(1)将0.100mol SO2(g)和0.060mol O2(g)放入容积为2L的密闭容器中,反应2SO2(g)+O2(g)⇌2SO3(g)在一定条件下5分钟末达平衡状态,测得c(SO3)=0.040mol/L.
①从平衡角度分析采用过量O2的目的是______;
②列式并计算该条件下反应的平衡常数K=______.
③已知:K(300℃)>K(350℃),若反应温度升高,SO2的转化率______(填“增大”、“减小”或“不变”).
④能判断该反应达到平衡状态的标志是______.(填字母)
A.SO2和SO3浓度相等
B.容器中混合气体的平均分子量保持不变
C.容器中气体的压强不变
D.SO3的生成速率与SO2的消耗速率相等.
(2)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图1所示.平衡状态由A变到B时,平衡常数K(A)______K(B)(填“>”、“<”或“=”).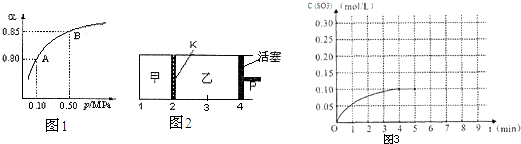
(3)如图2所示,保持温度不变,在一定反应条件下,将2molSO2和1molO2加入甲容器中,将4molSO2和2molO2加入乙容器中,隔板K不能移动.此时控制活塞P,使乙的容积为甲的2倍.
①若移动活塞P,使乙的容积和甲相等,达到新平衡时,SO3的体积分数甲______乙.(填:“大于”、“小于”、或“等于”)
②若在甲容器中通入一定量的He气,使容器内的压强增大,则c(SO3)/c(SO2)将______填:“增大”、“减小”、“不变”、“无法确定”)
(4)将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,c(SO3)的变化如图3所示.若在第5分钟将容器的体积缩小一半后,在第8分钟达到新的平衡(此时SO3的浓度约为0.25mol/L).请在图3中画出此变化过程中SO3浓度的变化曲线. 糊涂大马哥21年前1
糊涂大马哥21年前1 -
 大漠孤烟hg 共回答了10个问题
大漠孤烟hg 共回答了10个问题 |采纳率100%解题思路:(1)①增大反应物氧气会提高二氧化硫的转化率;
②依据平衡三段式列式计算平衡浓度,结合平衡常数概念计算得到;
③K(300℃)>K(350℃),说明温度越高平衡常数越小,依据平衡移动原理分析,升温平衡向吸热反应方向进行;
④平衡标志是正逆反应速率相同,各成分含量保持不变;
(2)平衡常数随温度变化,温度不变,平衡常数不变;
(3)①甲为恒温恒容容器,若移动活塞P,使乙的容积和甲相等,为恒温恒容容器,乙中加入4mol三氧化硫相当于加入2mol三氧化硫,再加入2mol三氧化硫,增大压强,平衡正向进行,SO3的体积分数增大;
②甲为恒温恒容容器,加入氦气总压增大,分压不变,平衡不变,则c(SO3)/c(SO2)不变;
(4)在第5分钟末将容器的体积缩小一半后,压强增大平衡正向进行,若在第8分钟末达到新的平衡(此时SO3的浓度约为0.25mol/L),依据三氧化硫浓度变化,和平衡浓度画出变化图象.(1)①从平衡角度分析采用过量O2的目的是,利用廉价原料提高物质转化率,加入氧气提高二氧化硫的转化率,故答案为:提高二氧化硫的转化率;
②将0.100mol SO2(g)和0.060mol O2(g)放入容积为2L的密闭容器中,反应2SO2(g)+O2(g)⇌2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol/L,2SO2(g)+O2(g)⇌2SO3
起始量(mol/L) 0.050.03 0
变化量(mol/L)0.04 0.02 0.04
平衡量(mol/L)0.01 0.01 0.04
平衡常数K=
0.042
0.01 2×0.01=1600,
故答案为:1600;
③K(300℃)>K(350℃),说明温度越高平衡常数越小,反应逆向进行,即升温平衡逆向进行,二氧化硫转化率减小,故答案为:减小;
④2SO2(g)+O2(g)⇌2SO3(g),反应是气体体积变小的放热反应
A.二氧化硫和三氧化硫起始量和变化量有关,SO2和SO3 浓度相等,不能说明反应达到平衡状态,故A错误;
B.因为反应前后总质量不变,总物质的量在变,所以容器中混合气体的平均分子量保持不变,说明反应达到平衡状态,故B正确;
C.反应前后压强不同,容器中气体的压强不变,说明反应达到平衡状态,故C正确;
D.SO3的生成速率与SO2的消耗速率相等,说明平衡正向进行,不能说明反应达到平衡状态,故D错误;
故答案为:BC;
(2)平衡常数只与温度有关,与压强无关,在温度不变的条件下,无论压强怎样变化,平衡常数都不变,故答案为:=;
(3)将2mol SO2和1mol O2加入甲容器中,将4mol SO3加入乙容器中,隔板K不能移动.此时控制活塞P,使乙的容积为甲的2倍,分析可知甲、乙中最后达到相同的平衡状态;
①若移动活塞P,使乙的容积和甲相等,增大压强,平衡正向进行,SO3的体积分数增大,SO3的体积分数甲小于乙,故答案为:小于;
②甲为恒温恒容容器,加入氦气总压增大,分压不变,平衡不变,则c(SO3)/c(SO2)不变,故答案为:不变;
(4)在第5分钟末将容器的体积缩小一半后,压强增大平衡正向进行,若在第8分钟末达到新的平衡(此时SO3的浓度约为0.25mol/L),依据三氧化硫浓度变化和平衡浓度画出变化图象为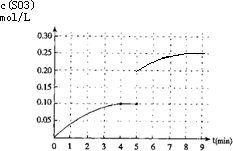 ,故答案为:
,故答案为: .
.点评:
本题考点: 化学平衡的计算;化学平衡的影响因素.
考点点评: 本题考查了化学平衡常数、平衡转化率、影响化学平衡的外界条件综合应用及知识迁移能力等考点,题目难度中等,注意平衡常数在计算中的应用,等效平衡的分析判断.1年前查看全部
- 下列关于环境、健康和发展的叙述中,不正确的是( ) A.光导纤维是以二氧化硅为主要原料制成的 B.硫酸工业尾气未经处理
下列关于环境、健康和发展的叙述中,不正确的是( ) A.光导纤维是以二氧化硅为主要原料制成的 B.硫酸工业尾气未经处理就直接排放,将直接导致“温室效应” C.一些有效成分为碳酸钙的补钙剂需嚼烂服用,目的在于加快消化吸收 D.铁质器具表面刷漆或将其置于干燥处保存,均能有效减缓铁的锈蚀  xiayuren1年前1
xiayuren1年前1 -
 tangdou402972746 共回答了14个问题
tangdou402972746 共回答了14个问题 |采纳率92.9%A、光导纤维的主要原料是二氧化硅,硅单质用于制造半导体,故A正确.
B、硫酸工业尾气中含有硫的氧化物,未经处理就直接排放,将直接导致酸雨,故B错误.
C、碳酸钙的补钙剂需嚼烂服用,能增大碳酸钙反应的接触面积,加快反应速率,酸雨目的在于加快消化吸收,故C正确.
D、铁质器具表面刷漆或将其置于干燥处保存,能阻止铁、碳和电解质溶液构成原电池,从而能有效减缓铁的锈蚀,故D正确.
故选B.1年前查看全部
- 下列化工生产过程中不涉及氧化还原反应的是( ) A.氯碱工业 B.硫酸工业 C.玻璃工业 D.合成氨工业
 肥猪唛1年前1
肥猪唛1年前1 -
 Domigo 共回答了15个问题
Domigo 共回答了15个问题 |采纳率93.3%1年前查看全部
- 硫酸工业里尾气吸收除了氨水还有什么方法
 dolphin24281年前1
dolphin24281年前1 -
 卜小 共回答了17个问题
卜小 共回答了17个问题 |采纳率94.1%硫酸工业里尾气吸收方法:可以用氨气、石灰乳吸收二氧化硫或者将尾气用Na2SO3溶液吸收,再往溶液中加入氧化锌固体.这种方法的优点是除SO2可回收外,ZnO和Na2SO3还可循环使用.1年前查看全部
- 在线求指导:在硫酸工业生产过程中
在线求指导:在硫酸工业生产过程中
在硫酸工业生产过程中,有反应2SO 2 (g)+O 2 (g)  2SO 3 (g)(正反应为放热反应),根据下表提供的不同压强下SO 2 的转化率(%)的数据试选择该反应的适宜条件(以V 2 O 5 作催化剂)
2SO 3 (g)(正反应为放热反应),根据下表提供的不同压强下SO 2 的转化率(%)的数据试选择该反应的适宜条件(以V 2 O 5 作催化剂) 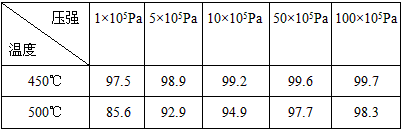
(1)温度____________;(2)压强____________.  chenfsp1年前1
chenfsp1年前1 -
 大力水手88 共回答了12个问题
大力水手88 共回答了12个问题 |采纳率91.7%(1)450℃
(2)1×10 5 Pa1年前查看全部
- 急 硫酸工业中将尾气通入氨水中能发生多个反应写出其中可能发生的两个氧化还原反应的化学方程式
 xiaoyao_00_1151年前1
xiaoyao_00_1151年前1 -
 xishi2007 共回答了18个问题
xishi2007 共回答了18个问题 |采纳率94.4%2SO2+O2====2SO3
4NH3+5O2===4NO+6H20(在催化剂、加热条件下)1年前查看全部
- 下列事实可用勒夏特列原理解释的是 A.使用催化剂有利于加快合成氨反应的反应速率 B.硫酸工业中,将黄铁矿粉碎后加入沸腾炉
下列事实可用勒夏特列原理解释的是
A.使用催化剂有利于加快合成氨反应的反应速率 B.硫酸工业中,将黄铁矿粉碎后加入沸腾炉中 C.500℃左右比在室温时更有利于提高合成氨的转化率 D.配制氯化铁溶液时,将氯化铁加入盐酸中,然后加水稀释  mmcyxnn1年前1
mmcyxnn1年前1 -
 中一cc 共回答了16个问题
中一cc 共回答了16个问题 |采纳率87.5%D
1年前查看全部
- (2014•资阳)硫酸工业的部分生产流程如下:
(2014•资阳)硫酸工业的部分生产流程如下:
SO2
SO3→H2SO4O2 V2O5
某硫酸生产厂以黄铁矿(主要成分为FeS2)为原料生产硫酸,首先将矿石粉吹入沸腾炉里燃烧,制得SO2,其反应可表示为:□FeS2+□O2=□Fe2O3+□SO2.
(1)配平矿石粉在沸腾炉中燃烧的反应方程式.
(2)若以SO2为原料生产硫酸,其过程中的反应均为化合反应,写出其反应的化学方程式:
SO2→SO3:2SO2+O2
3SO3V2O5 .△ 2SO2+O2;SO3+______→H2SO4:______.
3SO3V2O5 .△
(3)SO2→SO3的反应过程中,V2O5的作用是:______.
(4)沸腾炉的炉渣主要成分为Fe2O3,可变废为宝用于炼铁.写出高炉炼铁主要反应的化学方程式:3CO+Fe2O3
2Fe+3CO2高温 .3CO+Fe2O3.
2Fe+3CO2高温 .
(5)市售硫酸多为98%的浓硫酸,实验室常将浓硫酸稀释成稀硫酸使用.稀释操作时,必须将______,否则会造成危险. op0121年前1
op0121年前1 -
 pippyfly 共回答了25个问题
pippyfly 共回答了25个问题 |采纳率92%解题思路:(1)根据反应前后原子种类和原子个数不变分析;
(2)根据化合反应的特点结合元素守恒分析;
(3)根据反应条件及反应的方程式分析作用;
(4)根据高炉炼铁的原理写出反应的方程式;
(5)根据浓硫酸的稀释方法分析.(1)根据化学反应前后原子种类、原子个数不变,结合化学方程式的配平(奇数配偶法)可知:在氧化铁化学式的前面加2,使氧原子的个数变成偶数,因此铁原子的个数是4,再二硫化亚铁的化学式前加4,硫原子的个数是8,因此在二氧化硫化学式的前面加8,再结合氧原子的个数,在氧气化学式的前面加11,故化学方程式为:4FeS2+11O2=2Fe2O3+8SO2;
(2)以SO2为原料生产硫酸,其过程中的反应均为化合反应,因此SO2→SO3是二氧化硫和氧气的反应生成三氧化硫;SO3→H2SO4是三氧化硫和水反应生成硫酸,故反应的方程式为:2SO2+O2
V2O5
.
△3SO3;SO3+H2O═H2SO4;
(3)SO2→SO3的反应过程中,V2O5是作为反应条件,因此是催化剂,起到催化作用;故答案为:催化作用;
(4)高炉炼铁是一氧化碳与氧化铁反应生成铁和二氧化碳,故反应的方程式为:3CO+Fe2O3
高温
.
2Fe+3CO2;
(5)稀释浓硫酸时,必须把浓硫酸缓慢倒入水中,并不断搅拌,否则容易产生危险;故答案为:浓硫酸缓慢倒入水中,并不断搅拌.点评:
本题考点: 物质的相互转化和制备;浓硫酸的性质及浓硫酸的稀释;铁的冶炼;化学方程式的配平;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题综合考查了质量守恒定律、方程式的书写、浓硫酸的稀释以及实验方案的设计,考查了学生的基础知识的熟练程度以及知识的灵活运用能力.1年前查看全部
- 以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等
以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质.合成路线如下:
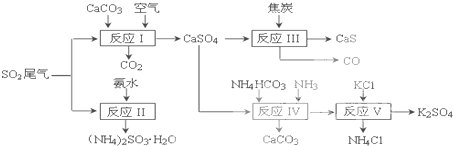
(1)写出反应Ⅰ的化学方程式______.
(2)生产中,向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是______.
(3)下列有关说法正确的是______.
a.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
b.反应Ⅲ中氧化剂与还原剂的物质的量之比为4:1
c.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解
d.反应Ⅴ中的副产物氯化铵可用作氮肥
(4)反应Ⅴ在25℃、40%乙二醇溶液中进行,不断有硫酸钾晶体从溶液中析出,硫酸钾的产率会超过90%,选用40%乙二醇溶液的原因是______.
(5)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,写出二氧化氮与亚硫酸铵反应的化学方程式______. wang158098231年前1
wang158098231年前1 -
 yuyi919 共回答了15个问题
yuyi919 共回答了15个问题 |采纳率93.3%解题思路:(1)根据反应物和生成物写出反应的化学方程式;
(2)亚硫酸氨中的硫为+4价,易被空气中的氧气氧化;
(3)a.依据流程图结合反应生成物分析,过量的空气把亚硫酸钙氧化为硫酸钙;
b.反应Ⅲ化学方程式为:CaSO4+4C=CaS+4CO↑,氧化剂为CaSO4,还原剂为C;
c.防止碳酸氢铵在温度过高时分解;
d.氯化铵是一种氮肥;
(4)利用硫酸钾在不同溶剂中溶解度的不同,达到析出晶体的目的;
(5)二氧化氮具有强氧化性能氧化亚硫酸铵反应,生成硫酸铵,本身被还原为氮气,结合原子守恒配平写出.(1)碳酸钙、二氧化硫和氧气反应生成硫酸钙和二氧化碳,方程式为2CaCO3+2SO2+O2═2CaSO4+2CO2,故答案为:2CaCO3+2SO2+O2═2CaSO4+2CO2;
(2)对苯二酚具有还原性,空气中的氧气具有氧化性,亚硫酸氨中+4价的硫具有还原性,故答案为:防止亚硫酸铵被氧化;
(3)a.过量的空气把亚硫酸钙氧化为硫酸钙,故a正确;
b.反应Ⅲ化学方程式为:CaSO4+4C=CaS+4CO↑,氧化剂为CaSO4,还原剂为C,氧化剂与还原剂物质的量之比为1:4,故b错误;
c.防止碳酸氢铵在温度过高时分解得不到需要的目标产物,故c正确;
D、氯化铵含N元素,是一种氮肥,故d正确;
故答案为:acd;
(4)反应V中选用了40%的乙二醇溶液,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液原因是利用乙二醇降低硫酸钾溶解度,有利于析出,
故答案为:乙二醇是有机溶剂能减小K2SO4的溶解度,使硫酸钾充分析出;
(5)④(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统,二氧化氮与亚硫酸铵反应,二氧化氮具有强氧化性能氧化亚硫酸铵反应,生成硫酸铵,本身被还原为氮气,由原子守恒可知化学方程式为4(NH4)2SO3+2NO2=4(NH4)2SO4+N2,
故答案为:4(NH4)2SO3+2NO2=4(NH4)2SO4+N2.点评:
本题考点: 制备实验方案的设计;二氧化硫的化学性质.
考点点评: 本题考查二氧化硫的性质及物质的制备,为高频考点,把握习题中的信息及发生的反应为解答的关键,侧重二氧化硫的还原性及学生分析能力的考查,题目难度中等.1年前查看全部
- 85%磷酸食品级和98%硫酸工业级混合 如何分析磷酸和硫酸浓度?
85%磷酸食品级和98%硫酸工业级混合 如何分析磷酸和硫酸浓度?
用酸碱滴定的方法 请写出来 急用 iamxiaoling1年前1
iamxiaoling1年前1 -
 zqq9585 共回答了29个问题
zqq9585 共回答了29个问题 |采纳率96.6%首先问题不明确,因为知道磷酸和硫酸的浓度,如果知道是按什么比例混合,计算混合后的两种酸的浓度,应该很好计算.
如果不知道混合的比例,两种酸的浓度就失去了意义,如果要计算两种酸的浓度,我想首先可以用硫酸钡重量法测出硫酸的含量,再通过酸碱滴定测出总的酸的含量,减去已知的硫酸含量,得出磷酸的含量.1年前查看全部
- 下列关于硫酸工业生产过程的叙述错误的是 A.在接触室中使用铁粉作催化剂 B.在接触室中运用热交换技术可充分利用能源 C.
下列关于硫酸工业生产过程的叙述错误的是
A.在接触室中使用铁粉作催化剂 B.在接触室中运用热交换技术可充分利用能源 C.把硫铁磨成细粉末,可以提高原料的利用率 D.该反应采用450~500℃主要是因为该温度下催化剂活性好  果冻丁儿1年前1
果冻丁儿1年前1 -
 北溟大鹏 共回答了16个问题
北溟大鹏 共回答了16个问题 |采纳率93.8%A
硫酸工业生产中的铁触媒的主要成分是Fe 3 O 4 ,而不是铁粉,A错。
【考点定位】本题考查硫酸工业。1年前查看全部
- 合成氨工业和硫酸工业相似之处.是否都需要用热交换器.是否都要用吸收塔.
 格来美梦想1年前1
格来美梦想1年前1 -
 tanchunlin 共回答了17个问题
tanchunlin 共回答了17个问题 |采纳率88.2%都要高温高压催化剂条件;都是可逆反应,要想提高产率必须分离产物.因此两个回答都是“是”.1年前查看全部
- (15分)[化学与技术]硫酸在日常生产生活中应用非常广泛。请回答硫酸工业中的如下问题:
(15分)[化学与技术]硫酸在日常生产生活中应用非常广泛。请回答硫酸工业中的如下问题:
(1)早期生产硫酸以黄铁矿为原料,目前很多***都已经限制以黄铁矿为原料而以硫黄为原料,以硫黄为原料的优点是 。
(2)工业上生产硫酸时,利用催化氧化反应将so 2 转化为so 3 ,是一个关键步骤。压强及温度对so 2 转化率的影响如下表(原料气各成分的体积分数为:so 2 7%;o 2 11%;n 2 82%);
利用表中数据分析。在实际生产中选择的适宜生产条件是:温度_______ ℃,压强 ___________mpa。
 压强/mpa
压强/mpa
转化率/%
温度/℃0.1 0.5 1 10 400 99.2 99.6 99.7 99.9 500 93.5 96.9 97.8 99.3 600 73.7 85.8 89.5 96.4
(3)选择适宜的催化剂,是否可以提高so 2 的转化率? _______(填“是”或“否”),是否可以增大该反应所放出的热量? (填“是” 或“否”)。
(4)为提高so 3 吸收率,实际生产中用 吸收so 3 。
(5)在催化反应室中设有热交换装置,以下叙述与热交换装置的作用有关的是______(填写序号)。
(6)在硫酸工业尾气中,so 2 是主要大气污染物,必须进行净化处理,处理方法可用 ________(填名称)吸收,然后再用硫酸处理,重新生成so 2 和一种生产水泥的辅料,写出这两步反应的化学方程式_______________________________________。a.保护环境。防止空气污染 b.充分利用热量,降低生产成本 c.升高温度,提高so 2 的转化率 d.防止催化剂中毒  五层熟1年前1
五层熟1年前1 -
 伫雨 共回答了19个问题
伫雨 共回答了19个问题 |采纳率89.5%1年前查看全部
- 硫酸工业排放的so2气体,是形成酸雨的主要原因,我们可以用什么溶液来吸收:
 美然纯洁可爱1年前1
美然纯洁可爱1年前1 -
 chenpu7070 共回答了22个问题
chenpu7070 共回答了22个问题 |采纳率90.9%可以用氢氧化钠溶液来吸收,化学式NaOH,反应方程式:2NaOH+SO2=Na2SO3+H2O1年前查看全部
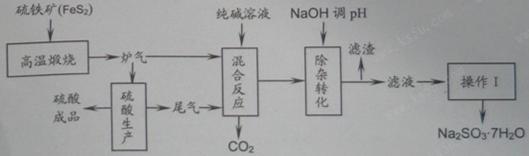
- 抗氧剂亚硫酸钠可利用硫酸工业的炉气和尾气与纯碱反应来制取,生产流程如下图 已知:①炉气、尾气中含有SO 2 ;②混合反应
抗氧剂亚硫酸钠可利用硫酸工业的炉气和尾气与纯碱反应来制取,生产流程如下图 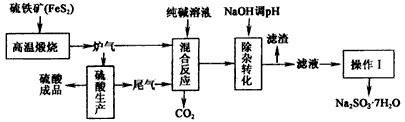
已知:①炉气、尾气中含有SO 2 ;②混合反应中还溶解有少量Fe 2 O 3 、MgO等矿尘。
(1)煅烧1mol FeS 2 放出热量为853 kJ,则FeS 2 燃烧的热化学方程式为_________________。
(2)“混合反应”中纯碱(Na 2 CO 3 )参与反应的化学方程式为______________________(任写一个)。
(3)用NaOH“除杂”时,主要的离子方程式为______________________(任写一个)。
(4)通过“操作I”可以得到亚硫酸钠品体,写出主要操作步骤的名称:______________。
(5)硫酸生产中炉气转化反应为:2SO 2 (g)+O 2 (g) 2SO 3 (g)。研究发现,SO 3 的体积分数(SO 3 %) 随温度(T)的变化如曲线I所示。下列判断正确的是__________。
2SO 3 (g)。研究发现,SO 3 的体积分数(SO 3 %) 随温度(T)的变化如曲线I所示。下列判断正确的是__________。 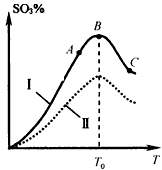
A.该反应的正反应为放热反应
B.曲线I上A、C两点反应速率的关系是:vA>vC
C.反应达到B点时,2v 正 (O 2 )=v 逆 (SO 3 )
D.已知V 2 O 5 的催化效果比Fe 2 O 3 好,若I表示用V 2 O 5 催化剂的曲线,则Ⅱ是Fe 2 O 3 作催化剂的曲线 sadlgjwaklrgrsth1年前1
sadlgjwaklrgrsth1年前1 -
 一见喜来 共回答了17个问题
一见喜来 共回答了17个问题 |采纳率100%(1)4FeS 2 (s)+11O 2 (g)=8SO 2 (g)+2Fe 2 O 3 (s) △H= -3412 kJ/mol
(2)SO 2 +Na 2 CO 3 =Na 2 SO 3 +CO 2 ↑(或2SO 2 +Na 2 CO 3 +H 2 O=NaHSO 3 +CO 2 ↑)
(3)Fe 3+ +3OH - =Fe(OH) 3 ↓(或Fe 2+ +2OH - =Fe(OH) 2 ↓或Mg 2+ +2OH - =Mg(OH) 2 ↓或HSO 3 - +OH - =SO 3 2- +H 2 O)
(4)加热蒸发、冷却结晶、过滤(洗涤干燥)
(5)AC1年前查看全部
- 化学选择题 请解释下答案 谢谢①硫酸工业尾气②硝酸工业尾气③高炉煤气④焦炉气⑤炼钢过程中产生的棕色烟气⑥煅烧石灰石的气体
化学选择题 请解释下答案 谢谢
①硫酸工业尾气②硝酸工业尾气③高炉煤气④焦炉气⑤炼钢过程中产生的棕色烟气⑥煅烧石灰石的气体产物等烟气经净化处理后,可以用作气体燃料的是( ) A①②④ (B)①③⑤(C)④⑤⑥(D)③④⑤
 机械nn1年前1
机械nn1年前1 -
 蜈蚣鞋子 共回答了14个问题
蜈蚣鞋子 共回答了14个问题 |采纳率85.7%①硫酸工业尾气主要是二氧化硫,不能作燃料
②硝酸工业尾气主要是一氧化氮、二氧化氮等,不能作燃料
③高炉煤气,主要是一氧化碳,可作燃料
④焦炉气,焦炉气是混合物,其主要成分为氢气(55%~60%)和甲烷(23%~27%),另外还含有少量的一氧化碳(5%~8%)、C2以上不饱和烃(2%~4%)、二氧化碳(1.5%~3%)、氧气(0.3%~0.8%))、氮气(3%~7%).其中氢气、甲烷、一氧化碳、C2以上不饱和烃为可燃组分,
⑤炼钢过程中产生的棕色烟气,它的成分是氧化铁尘粒和高浓度的一氧化碳,可作燃料
⑥煅烧石灰石主要成分是二氧化碳,不能燃烧
正确选项是D1年前查看全部
- 2012年硫酸工业污染物排放标准中二氧化硫在尾气中的含量不得超过0.05mg/m3,可见硫酸工业生产既要考虑经济效益,也
2012年硫酸工业污染物排放标准中二氧化硫在尾气中的含量不得超过0.05mg/m3,可见硫酸工业生产既要考虑经济效益,也要考虑社会效益.
(1)在用硫铁矿生产硫酸的过程中,与之无关的设备是______
a.吸收塔b.接触室c.沸腾炉d.氧化炉
(2)为了提高SO2转化为SO3的质量分数,工业上常使用适当过量的空气,这样从接触室导出的气体的成分是______.
(3)在硫酸工业中,常用浓H2SO4而不用水吸收SO3是因为______; 为了消除硫酸厂尾气排放对环境污染,常用氨水吸收SO2,化学方程式为______.
(4)催化氧化的原料气成分(体积分数)为:SO28%,O2 11%,N2 82%.压强及温度对SO2转化率的影响如下:
工业上,二氧化硫催化氧化过程采用的是常压而不是高压,主要原因是______.分析上表数据可知,二氧化硫的催化氧化是放热反应,理由是______.
0.1 0.5 1 10 400 99.2 99.6 99.7 99.9 500 93.5 96.9 97.8 99.3 600 73.7 85.8 89.5 96.4
(5)接触法制硫酸的过程中,已知进入接触室的气体体积组成是:SO2占8%、N2占81%、O2占11%,在一定温度下,反应达到平衡后总体积变为原来的96.5%,则SO2转化为SO3的百分率为______.该温度条件下的平衡常数是______. eshan20061年前1
eshan20061年前1 -
 ss一流星 共回答了23个问题
ss一流星 共回答了23个问题 |采纳率91.3%解题思路:(1)工业制硫酸的过程是硫铁矿石在沸腾炉中燃烧生成二氧化硫,二氧化硫在接触室中氧化为三氧化硫,三氧化硫在吸收塔中被浓硫酸吸收生成硫酸;
(2)二氧化硫被空气氧化为三氧化硫是可逆反应;
(3)在吸收塔中用水吸收三氧化硫,反应放热易形成酸雾阻止对三氧化硫的吸收;
(4)根据数据进行判断,常压时SO2的转化率已经很大;
(5)假定反应前气体的体积为100,则SO2的体积为8、N2的体积为81、O2的体积为11,经过催化氧化反应掉氧气的体积为x,反应平衡后混合气体的体积为8-2x+11-x+2x+81=96.5,解得x=3.5,以此计算SO2转化及K.(1)工业制硫酸的过程是硫铁矿石在沸腾炉中燃烧生成二氧化硫,二氧化硫在接触室中氧化为三氧化硫,三氧化硫在吸收塔中被浓硫酸吸收生成硫酸,故与之无关的设备是氧化炉,
故答案为:d;
(2)二氧化硫被空气氧化为三氧化硫是可逆反应,因此从接触室中导出的气体是SO3、O2、SO2、N2,
故答案为:SO3、O2、SO2、N2;
(3)吸收塔中SO3如果用水吸收,发生反应:SO3+H2O═H2SO4,该反应为放热反应,放出的热量易导致酸雾形成,阻隔在三氧化硫和水之间,阻碍水对三氧化硫的吸收;而浓硫酸的沸点高,难以气化,不会形成酸雾,同时三氧化硫易溶于浓硫酸,所以工业上从吸收塔顶部喷洒浓硫酸作吸收液,最终得到“发烟”硫酸.二氧化硫与氨气反应生成亚硫酸铵,方程式为:SO2+2NH3+H2O═(NH4)2SO3,
故答案为:用水吸收易形成酸雾,阻碍SO3再吸收;SO2+2NH3+H2O═(NH4)2SO3;
(4)由表中数据可知:常压时SO2的转化率已经很大,增大压强会增加动力成本和设备成本.由表中数据可知:压强一定时,随着温度的升高,转化率减小,
故答案为:常压时SO2的转化率已经很大,增大压强会增加动力成本和设备成本;压强一定时,温度升高SO2转化率下降;
(2)设总体积为100,则SO2的体积为8、N2的体积为81、O2的体积为11,经过催化氧化反应掉二氧化硫的体积为x,则
2SO2 +O2=2SO3
初始 8 11 0
转化 x 0.5x x
平衡8-x 11-0.5x x
[8−x+11−0.5x+x+81/100]=96.5%,x=7
转化率=[7/8]×100%=87.5%.
K=[7×7/1×1×7.5]=6.53,
故答案为:87.5%;6.53.点评:
本题考点: 化学平衡的影响因素;化学平衡的调控作用;化学平衡的计算;常见的生活环境的污染及治理.
考点点评: 本题考查工业接触法制硫酸的原理及相关计算,难度中等.1年前查看全部
- 抗氧剂亚硫酸钠可利用硫酸工业的炉气和尾气与纯碱反应来制取,生产流程如下图:
抗氧剂亚硫酸钠可利用硫酸工业的炉气和尾气与纯碱反应来制取,生产流程如下图:
已知:①炉气、尾气中含有SO 2 ;②混合反应中还溶解有少量Fe 2 O 3 、MgO等矿尘。
(1)煅烧1molFeS 2 放出热量为853kJ,则FeS 2 燃烧的热化学方程式为_____________。
(2)“混合反应”中纯碱(Na 2 CO 3 )参与反应的化学方程式为_____________(任写一个)。
(3)用NaOH“除杂”时,主要的离子方程式为_____________(任写一个)。
(4)通过“操作Ⅰ”可以得到亚硫酸钠晶体,写出主要操作步骤的名称:__________。
(3)硫酸生产中炉气转化反应为:2SO 2 (g)+ O 2 (g) 2SO 3 (g)。研究发现,SO 3 的体积分数(SO 3 %)随温度(T)的变化如曲线Ⅰ所示。下列判断正确的是________
2SO 3 (g)。研究发现,SO 3 的体积分数(SO 3 %)随温度(T)的变化如曲线Ⅰ所示。下列判断正确的是________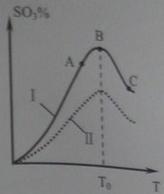
A.该反应的正反应为放热反应
B.曲线Ⅰ上A、C两点反应速率的关系是: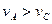
C.反应达到B点时,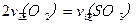
D.已知V 2 O 5 的催化效果比Fe 2 O 3 好,若Ⅰ表示用V 2 O 5 催化剂的曲线,则Ⅱ是Fe 2 O 3 作催化剂的曲线 whiteseal1年前1
whiteseal1年前1 -
 草上肥肥 共回答了16个问题
草上肥肥 共回答了16个问题 |采纳率100%(1)4FeS 2 (S)+11O 2 (g)=8SO 2 (g)+2Fe 2 O 3 (s) ,△H= -3412 kJ ·mol -1
(2)SO 2 + Na 2 CO 3 =Na 2 SO 3 +CO 2 ↑
2 SO 2 + Na 2 CO 3 +H 2 O=NaHSO 3 +CO 2 ↑ (写对任意一个均给分)
(3)Fe 3+ +3OH - = Fe(OH) 3 ↓或Fe 2+ +2OH - = Fe(OH) 2 ↓
或Mg 2+ +2OH - = Mg(OH) 2 ↓或HSO 3 - + OH - = SO 3 2 - + H 2 O
(4)加热蒸发、冷却结晶、过滤(洗涤干燥)
(5)AC
略1年前查看全部
- 硫酸工业尾气中SO2、O2的体积分数分别为0.4%和0.5%.向硫酸工业尾气中通入空气(设空气中O2的体积分数为20.5
硫酸工业尾气中SO2、O2的体积分数分别为0.4%和0.5%.向硫酸工业尾气中通入空气(设空气中O2的体积分数为20.5%,且不含SO2),使SO2的体积分数由0.4%降为0.2%.
① 通入的空气与原硫酸工业尾气的体积比为
② 通入的空气后的混合气体中O2的体积分数为 ahalf1年前1
ahalf1年前1 -
 二度递葛 共回答了17个问题
二度递葛 共回答了17个问题 |采纳率94.1%SO2的体积分数由0.4%降为0.2%.
则总气体体积为之前的2倍.也就是通入的空气与原硫酸工业尾气的体积比为1:1
通入的空气后的混合气体中O2的体积分数为:(0.5%+20.5%)/2= 10.5%1年前查看全部
- 硫酸工业尾气必须回收、净化处理,主要是为了在防治大气污染的同时充分利用原料.
 Hiev1年前1
Hiev1年前1 -
 游遍天上地下 共回答了17个问题
游遍天上地下 共回答了17个问题 |采纳率100%硫酸工业尾气主要是二氧化硫,其处理一般是用石灰石灰石湿法脱硫,生成的副产物硫酸钙可用于水泥生产.故该命题正确.1年前查看全部
- 下列关于硫酸工业生产过程的叙述错误的是( ) A.在接触室中使用铁粉作催化剂 B.在接触室中运用热交换技术可充分利用能
下列关于硫酸工业生产过程的叙述错误的是( )
A.在接触室中使用铁粉作催化剂 B.在接触室中运用热交换技术可充分利用能源 C.把硫铁矿磨成细粉末,可以提高原料的利用率 D.该反应采用450~500°C主要是因为该温度下催化剂活性好  每一日芒果1年前0
每一日芒果1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MgO.某探究性学习小组的同学设计以下方案,进行硫酸
硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MgO.某探究性学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验.

已知溶液pH=3.7时,Fe3+已经沉淀完全;一水合氨电离常数Kb=1.8×10-5,其饱和溶液中c(OH-)约为1×10-3mol•L-1.请回答:
(1)写出A与氢氧化钠溶液反应的化学方程式:______.
(2)上述流程中两次使用试剂①,推测试剂①应该是______(填以下字母编号)
A.氢氧化钠 B.氧化铝 C.氨水 D.水
(3)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是______;(任写一点)
(4)固体E为______,写出溶液F通入过量CO2生成固体G和溶液H的化学方程式:______.
(5)计算溶液F中c(Mg2+)=______(25℃时,氢氧化镁的Ksp=5.6×10-12) 青蛙顺时针1年前1
青蛙顺时针1年前1 -
 zegap 共回答了24个问题
zegap 共回答了24个问题 |采纳率87.5%解题思路:先判断各物质的组成,在根据题目要求分析该题.
硫酸渣的成分为SiO2、Fe2O3、Al2O3、MgO,当向硫酸渣中加过量盐酸时,二氧化硅和盐酸不反应,所以固体A是二氧化硅,氧化铁、氧化铝、氧化镁和盐酸反应,所以溶液B的溶质是氯化镁、氯化铁、氯化铝、盐酸;向溶液B中加试剂①并调节溶液的PH值为3.7,结合题意溶液pH=3.7时Fe3+已经沉淀完全知,试剂①是能和氯化铁反应生成沉淀的物质且和铝离子反应没有沉淀生成,所以试剂①只能是强碱溶液,固体C是氢氧化铁;向溶液D中加入试剂①并调节溶液的PH值为13,溶液呈强碱性溶液,铝元素在溶液中以偏铝酸根离子存在,镁离子和氢氧根离子生成氢氧化镁沉淀,所以固体E是氢氧化镁;溶液F的溶质含有偏铝酸钠和氯化钠,向F溶液中通入过量二氧化碳气体,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀,所以G是氢氧化铝.
(1)根据二氧化硅和氢氧化钠的性质写出相应的化学反应方程式.
(2)能使铁离子产生沉淀,而铝离子不产生沉淀的物质只能是强碱.
(3)在强碱性条件下,铝元素以偏铝酸根离子存在,镁元素以氢氧化镁存在,据此分析.
(4)氢氧化铝的酸性比碳酸还弱,根据强酸制取弱酸知,偏铝酸钠和过量二氧化碳能反应生成氢氧化铝和碳酸氢钠.
(5)根据c(Mg2+)=
计算.Ksp C(OH−)2 硫酸渣的成分为SiO2、Fe2O3、Al2O3、MgO,当向硫酸渣中加过量盐酸时,二氧化硅和盐酸不反应,所以固体A是二氧化硅,氧化铁、氧化铝、氧化镁和盐酸反应,所以溶液B的溶质是氯化镁、氯化铁、氯化铝、盐酸;向溶液B中加试剂①并调节溶液的PH值为3.7,结合题意溶液pH=3.7时Fe3+已经沉淀完全知,试剂①是能和氯化铁反应生成沉淀的物质且和铝离子反应没有沉淀生成,所以试剂①只能是强碱溶液,固体C是氢氧化铁;向溶液D中加入试剂①并调节溶液的PH值为13,溶液呈强碱性溶液,铝元素在溶液中以偏铝酸根离子存在,镁离子和氢氧根离子生成氢氧化镁沉淀,所以固体E是氢氧化镁;溶液F的溶质含有偏铝酸钠和氯化钠,向F溶液中通入过量二氧化碳气体,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀,所以G是氢氧化铝.
(1)通过以上分析知,A是二氧化硅,二氧化硅是酸性氧化物,能和强碱反应生成盐和水,
所以反应方程式为:SiO2+2NaOH=Na2SiO3+H2O.
故答案为:SiO2+2NaOH=Na2SiO3+H2O.
(2)向溶液B中加试剂①并调节溶液的PH值为3.7,结合题意知,溶液pH=3.7时Fe3+已经沉淀完全知,试剂①是能和氯化铁反应生成沉淀的物质且和铝离子反应没有沉淀生成,所以试剂①只能是强碱溶液,符合条件的是A选项.
故选A.
(3)在强碱性条件下,铝元素以偏铝酸根离子存在,镁元素以氢氧化镁存在,当溶液的PH=13时,溶液呈强碱性,如果pH过小,可能导致的后果是镁离子沉淀不完全或氢氧化铝溶解不完全等.
故答案为:镁离子沉淀不完全或氢氧化铝溶解不完全等.
(4)通过以上分析知,固体E为Mg(OH)2,氢氧化铝的酸性比碳酸还弱,根据强酸制取弱酸知,偏铝酸钠和过量二氧化碳能反应生成氢氧化铝和碳酸氢钠,反应方程式为 NaAlO2+CO2+H2O=Al(OH)3↓+NaHCO3.
故答案为:Mg(OH)2;NaAlO2+CO2+H2O=Al(OH)3↓+NaHCO3.
(5)c(Mg2+)=
Ksp
C(OH−)2=
5.6×10−12
(0.1)2mol/L=5.6×10-10 mol/L
故答案为:5.6×10-10 mol/L.点评:
本题考点: 常见金属元素的单质及其化合物的综合应用;物质的分离、提纯的基本方法选择与应用.
考点点评: 本题考查了物质的分离、提纯的方法选择及应用,难度不大,明确各物质的性质是解本题的关键.1年前查看全部
- (2012•厦门二模)用Na2SO3溶液吸收硫酸工业尾气中的SO2,所得混合液可电解循环再生(A为阳离子交换膜;B为阴离
 (2012•厦门二模)用Na2SO3溶液吸收硫酸工业尾气中的SO2,所得混合液可电解循环再生(A为阳离子交换膜;B为阴离子交换膜).相关物料的传输与转化关系如右图.下列说法不正确的是( )
(2012•厦门二模)用Na2SO3溶液吸收硫酸工业尾气中的SO2,所得混合液可电解循环再生(A为阳离子交换膜;B为阴离子交换膜).相关物料的传输与转化关系如右图.下列说法不正确的是( )
A.X为直流电源的负极,Pt(Ⅱ)为阳极
B.阳极区pH减小
C.图中的n<m
D.阴极电极反应式为2H++2e-=H2↑ tycoms1年前1
tycoms1年前1 -
 学山来客 共回答了13个问题
学山来客 共回答了13个问题 |采纳率92.3%解题思路:A.根据电解质溶液中阴阳离子的移动方向确定电源的正负极;
B.阳极上亚硫酸根离子被氧化生成硫酸根离子,溶液酸性增强;
C.根据S原子守恒判断m、n大小;
D.电解池阴极上氢离子得电子,阳极上亚硫酸根离子失电子.A.根据阴阳离子的移动方向知,Pt(I)为阴极,Pt(II)为阳极,所以X为直流电源的负极,Y为直流电源的正极,故A正确;
B.阳极上,亚硫酸根离子被氧化生成硫酸根离子,亚硫酸是弱电解质,硫酸是强电解质,所以阳极附近氢离子浓度增大,溶液的pH减小,故B正确;
C.阳极室中,出来的硫酸中不仅有加入的稀硫酸还有亚硫酸根离子被氧化生成的硫酸,所以n>m,故C错误;
D.该电解池中阳极上生成硫酸,阴极上生成氢气,阴极电极反应式为2H++2e-=H2↑,所以该过程中的产品主要为H2SO4和H2,故D正确;
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查学生电解池的工作原理,能正确分析图片是解本题的关键,注意图片中加入物质和析出物质的变化,题目难度较大.1年前查看全部
- 化工生产必须在遵循科学原理、实现某个反应的基础上,着重考虑综合经济效益。从硫酸工业遵循的科学原理和综合经济效益分析,下列
化工生产必须在遵循科学原理、实现某个反应的基础上,着重考虑综合经济效益。从硫酸工业遵循的科学原理和综合经济效益分析,下列说法不正确的是( )。
A.硫酸厂不应建在人口稠密的居民区和环保要求高的地区 B.硫酸厂靠近原料产地比靠近硫酸消费中心更为有利 C.硫酸厂生产过程中的污水,含有硫酸等杂质,可用石灰乳中和处理 D.可利用硫酸厂生产过程中产生的“废热”来供热和发电  okboy21年前1
okboy21年前1 -
 mouleechus 共回答了16个问题
mouleechus 共回答了16个问题 |采纳率93.8%B
因为硫酸成品的运输比较困难,所以应该靠近消费中心。1年前查看全部
- 钒(V)及其化合物在工业催化、新材料和新能源等领域中有广泛的应用,其中接触法制硫酸工业中就要用到V 2 O 5 作催化剂
钒(V)及其化合物在工业催化、新材料和新能源等领域中有广泛的应用,其中接触法制硫酸工业中就要用到V 2 O 5 作催化剂:
2SO 2 (g)+O 2 (g)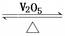 2SO 3 (g) ΔH<0。
2SO 3 (g) ΔH<0。
某温度下,将2 mol SO 2 和1 mol O 2 置于10 L密闭容器中,在V 2 O 5 作催化剂下经5min反应达平衡,SO 2 的平衡转化率(α)为80%。
(1)5min内 v(SO 3 )= mol·L - 1 ·min - 1
(2)该温度下平衡常数K=
(3)若缩小容器体积,至达到新的平衡,在图中画出反应速率变化图象。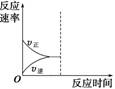
(4)硫酸工业尾气SO 2 用浓氨水吸收,反应的离子方程式是 ,吸收后的产物最终可制成肥料硫铵[即(NH 4 ) 2 SO 4 ]。
(5)某含钒化合物及硫酸的电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如下图所示。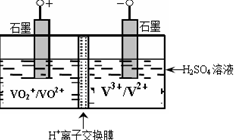
①用该电池电解(NH 4 ) 2 SO 4 溶液生产(NH 4 ) 2 S 2 O 8 (过二硫酸铵)。电解时均用惰性电极,阳极电极反应式可表示为 ;若电解得1mol(NH 4 ) 2 S 2 O 8 ,则电池左槽中H + 将 (填“增大”或“减少”) mol。
②电池使用一段时间后对其进行充电,充电过程中,阳电极反应式为: 。 别家他和她1年前1
别家他和她1年前1 -
 xhgutvdc 共回答了16个问题
xhgutvdc 共回答了16个问题 |采纳率100%(1) 0.032…2分
(2) 800…2分
(3) …2分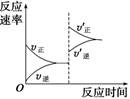
(4)2NH 3 ·H 2 O +SO 2 =2NH 4 + +SO 3 2 - 或NH 3 ·H 2 O +SO 2 =NH 4 + +HSO 3 - …2分
(5)①2SO-2e - ===S 2 O …2分 减小…1分 2…1分
②VO 2 + +H 2 O-e - === VO+2H + …2分
(1)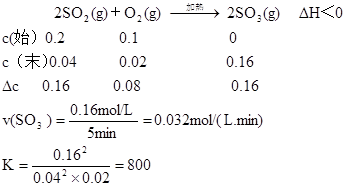
(4)2NH 3 ·H 2 O +SO 2 =2NH 4 + +SO 3 2 -
(5)①2SO-2e - ===S 2 O阳极发生氧化反应,失电子,化合价升高;
②VO 2 + +H 2 O-e - === VO+2H +1年前
41年前查看全部
- (2014•山东模拟)铁触媒(铁的氧化物)是硫酸工业的催化剂.某同学设计了以下两种方案研究铁触媒的组成.
(2014•山东模拟)铁触媒(铁的氧化物)是硫酸工业的催化剂.某同学设计了以下两种方案研究铁触媒的组成.
方案一:用下列装置测定铁触媒的含铁量,确定其组成.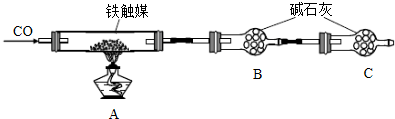
方案二:用下列实验方法测定铁触媒的含铁量,确定其组成.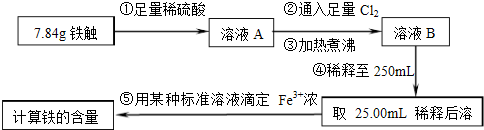
(1)步骤④中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和______.
(2)因为通入Cl2不足量,“溶液B”中还含有______会影响测定结果.
(3)因为通入Cl2过量且加热煮沸不充分,“溶液B”中可能含有Cl2.请设计实验方案检验Cl2,完成下列实验报告.
限选试剂:0.1mol•L-1酸性KMnO4溶液、紫色石蕊试液、品红稀溶液、淀粉-KI溶液、0.1moL•L-1KSCN溶液
(4)“干燥管C”的作用是______.实验操作 实验现象与结论 ______ ______
(5)称取15.2g铁触媒进行上述实验.充分反应后,测得“干燥管B”增重11.0g,则该铁触媒的化学式可表示为______. lgl011年前1
lgl011年前1 -
 wzygj0223 共回答了12个问题
wzygj0223 共回答了12个问题 |采纳率100%解题思路:(1)容量瓶是一种玻璃定容仪器;
(2)氯气具有氧化性,可以将亚铁离子氧化为三价铁离子,铁触媒和硫酸以及氯气反应的产物来回答;
(3)根据氯气的性质:能使石蕊试液先变红后退色来检验氯气的存在;
(4)一氧化碳可以和铁的氧化物之间发生反应,得到气体产物二氧化碳,干燥管B可以吸收生成的二氧化碳,但是要排除空气的干扰,据此来回答;
(5)根据一氧化碳和铁的氧化物之间发生的反应,“干燥管B”增重11.0g即为生成的二氧化碳的质量来回答.(1)将溶液稀释为250mL,可以采用定容仪器容量瓶,故答案为:250mL容量瓶;
(2)通入Cl2的作用是将亚铁离子氧化为铁离子,氯气量不足时,“溶液B”中会含有亚铁离子,即FeCl2或者FeSO4,故答案为:FeCl2或者FeSO4或者Fe2+;
(3)氯气的性质:能使石蕊试液先变红后退色,向溶液B中加入石蕊试液,如果石蕊试液显红色,后红色褪去,这是氯水的性质,证明含有氯气,若溶液变红后不褪色,溶液B不含有Cl2,故答案为:
实验操作 预期现象和结论
取适量溶液B于试管中,滴加2-3滴紫色石蕊试液,振荡,观察现象. 若溶液显红色,后红色褪去,则溶液B中含Cl2;
若溶液变红后不褪色,则溶液B不含有Cl2(4)一氧化碳可以和铁的氧化物之间发生反应,得到气体产物二氧化碳,干燥管B可以吸收生成的二氧化碳,测定二氧化碳的量可以获得铁触媒的量,但是要排除空气成份的干扰,所以C的作用是:防止空气中的CO2和水蒸气进入B中,故答案为:防止空气中的CO2和水蒸气进入B中;
(5)根据实验方案一的原理,15.2g铁触媒充分反应生成二氧化碳的质量是11.0g,设发生的反应为:
yCO+FexOy
加热
.
xFe+yCO2,
1 y
[15.2/56x+16y][11/44]
即[15.2y/56x+16y=
1
4],解得x:y=4:5,
所以氧化物的化学式为:Fe4O5或2FeO•Fe2O3,故答案为:Fe4O5或2FeO•Fe2O3.点评:
本题考点: 探究物质的组成或测量物质的含量.
考点点评: 本题是一道考查学生物质的含量和组成的综合知识考查题,涉及氯气的性质、一氧化碳和铁的氧化物之间的反应等知识,综合性强,难度大.1年前查看全部
- 下列事实,不能用勒夏特列原理解释的是 A.硫酸工业中,增大O 2 的浓度有利于提高SO 2 的转化率 B.对2HI H
下列事实,不能用勒夏特列原理解释的是
A.硫酸工业中,增大O 2 的浓度有利于提高SO 2 的转化率 B.对2HI  H 2 +I 2 平衡体系增加压强使颜色变深
H 2 +I 2 平衡体系增加压强使颜色变深C.开启啤酒瓶后,瓶中立刻泛起大量泡沫 D.滴有酚酞的氨水溶液,适当加热溶液(氨气不挥发)后颜色变深  檬梦1年前1
檬梦1年前1 -
 非她莫属41 共回答了20个问题
非她莫属41 共回答了20个问题 |采纳率95%B
1年前查看全部
- 下列关于工业生产说法不正确的是( ) A.电解精炼铜时,用粗铜做阴极,纯铜做阳极 B.在硫酸工业、合成氨工业、硝酸工业
下列关于工业生产说法不正确的是( ) A.电解精炼铜时,用粗铜做阴极,纯铜做阳极 B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率 C.在炼铁工业,需要的原料有铁矿石、焦炭、空气、石灰石等 D.在侯氏制碱工业中,向饱和氯化钠溶液中先通氨气,后通二氧化碳  leeyxu1年前1
leeyxu1年前1 -
 可悲的老虎 共回答了14个问题
可悲的老虎 共回答了14个问题 |采纳率78.6%A、电解精炼铜时,金属铜在阴极析出,粗铜作阳极不断的溶解,纯铜作阴极析出金属铜,故A错误;
B、化学反应产物的循环利用可以提高原料利用率,故B正确;
C、高炉炼铁的原理是一氧化碳还原氧化铁,一氧化碳可以由焦炭还原二氧化碳得到,原料有铁矿石、焦炭、空气、石灰石,故C正确;
D、因为氨气溶解度非常大,先氨气后二氧化碳,能增大二氧化碳的吸收,有利于生成纯碱,故D正确.
故选A.1年前查看全部
- 硫酸工业中常用浓氨水来吸收二氧化硫,则有关反应方程为____________,____________(共2个)配一下平
硫酸工业中常用浓氨水来吸收二氧化硫,则有关反应方程为____________,____________(共2个)配一下平~
 boy231年前1
boy231年前1 -
 華原瞳 共回答了15个问题
華原瞳 共回答了15个问题 |采纳率100%一种就是硫酸过量,生成硫氢铵,一种是氨水过量生成硫酸铵.相信你自己一定能写出方程式的.1年前查看全部
- 在硫酸工业中,为了提高二氧化硫的转化率,为什么不可以采用升高温度的方法?
 lhl700tt1年前1
lhl700tt1年前1 -
 yxzjj 共回答了11个问题
yxzjj 共回答了11个问题 |采纳率100%我不是学化学的 不过听说有SO3 也许加温后SO2会再加个氧原子变SO31年前查看全部
- 化学方程式训练一、化工生产:1、氯碱工业2、制盐酸:3、制漂白粉:4、硫酸工业:,,.5、硝酸工业:,,.6、合成氨:7
化学方程式训练
一、化工生产:
1、氯碱工业
2、制盐酸:
3、制漂白粉:
4、硫酸工业:,,
.
5、硝酸工业:,,
.
6、合成氨:
7、制粗硅及粗硅的提纯:,,
.
8、制二氧化碳:
9、水煤气的反应:,.
10、制玻璃:,.
11、金属的冶炼:钠:,镁:,
铝:,铁:.
12、侯氏制碱法:
二、实验室制备:
13、氯气:或 .
14、氯化氢:
15、硫化氢:
16、二氧化硫:
17、氧气:或 或 .
18、氨气:或 .
19、硝酸:
20、一氧化氮:
21、二氧化氮:
22、二氧化碳:
23、氢气: qzwjq1年前1
qzwjq1年前1 -
 bainiangudu6677 共回答了20个问题
bainiangudu6677 共回答了20个问题 |采纳率85%常温下钠与氧气反应:4Na + O2 = 2Na2O
钠与氧气在加热条件下反应:2Na + O2 Na2O2
钠与水反应:2Na + 2H2O = 2NaOH + H2↑
过氧化钠与水反应:2Na2O2 + 2H2O = 4NaOH + O2↑
过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3 + O2
碳酸氢钠受热分2NaHCO3 Na2CO3+H2O+CO2↑
Al与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O===2NaAlO2 + 3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
Al2O3与盐酸反应:Al2O3 + 6HCl ===2AlCl3 + 3H2O
Al2O3+6H+=2Al3++3H2O
Al2O3与氢氧化钠溶液反应:Al2O3 + 2NaOH === 2NaAlO2 + H2O
Al2O3+2OH-=2AlO2-+H2O
Al(OH)3 与盐酸反应:Al(OH)3 + 3HCl ===AlCl3 + 3H2O
Al(OH)3+3H+=Al3++3H2O
Al(OH)3 与氢氧化钠溶液反应:Al(OH)3 + NaOH === NaAlO2 + 2H2O
Al(OH)3+OH-=AlO2-+2H2O
实验室制取氢氧化铝(铝盐溶液加氨水):
Al2(SO4)3 + 6NH3•H2O = 2Al(OH)3↓ + 3(NH4)2SO4
氢氧化铝加热分2Al(OH)3 Al2O3 + 3H2O
铁与水蒸气反应:3Fe + 4H2O(g) Fe3O4 + 4H2
氧化亚铁与盐酸反应:FeO+2HCl=FeCl2+H2O
FeO+2H+=Fe2++H2O
氧化铁与盐酸反应:Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Fe2O3+6H+=2Fe3++3H2O
硫酸亚铁与氢氧化钠溶液反应:
FeSO4 + 2NaOH = Na2SO4 + Fe(OH)2↓(白色)
Fe2++2OH-=Fe(OH)2↓
氢氧化亚铁被空气中的氧气氧化成氢氧化铁:
4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3
实验现象:白色沉淀→迅速灰绿色→红褐色沉淀
氢氧化铁加热分2Fe(OH)3 3H2O↑+ Fe2O3 (红棕色粉末)
FeCl3溶液与铁粉反应:2FeCl3 + Fe = 3FeCl2
2Fe3++Fe=3Fe2+
氯化亚铁中通入氯气:2FeCl2 + Cl2 = 2FeCl3
2Fe2++Cl2=2Fe3++2Cl-
二氧化硅与氢氟酸反应:SiO2 + 4HF = SiF4 ↑+ 2H2O
二氧化硅与氧化钙在高温时反应:SiO2 + CaO CaSiO3
二氧化硅与氢氧化钠溶液反应:SiO2 + 2NaOH = Na2SiO3 + H2O
硅酸钠与盐酸反应:Na2SiO3 + 2HCl = 2NaCl + H2SiO3(胶体)
次氯酸光照分2HClO 2HCl + O2↑
氯气通入冷的消石灰中制漂白粉:2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
硫的燃烧 S+O2 SO2
二氧化硫与氧气反应:2SO2+O2 2SO3
三氧化硫与水反应:SO3 + H2O = H2SO4
三氧化硫与氧化钙反应:SO3+CaO=CaSO4
三氧化硫与石灰水反应:SO3 + Ca(OH)2 = CaSO4 +H2O
氮气与氧气在放电下反应:N2 + O2 2NO
一氧化氮与氧气反应:2NO + O2 = 2NO2
二氧化氮与水反应:3NO2 + H2O = 2HNO3 + NO
工业合成氨:N2+3H2 2NH3
氨气溶于水: NH3 + H2O NH3•H2O
氨水受热分NH3•H2O NH3↑ + H2O
氨气与氯化氢反应:NH3 + HCl = NH4Cl
氯化铵受热分NH4Cl NH3↑ + HCl↑
碳酸氢铵受热分NH4HCO3 NH3↑ + H2O↑ + CO2↑
硝酸铵与氢氧化钠反应:NH4NO3 + NaOH NaNO3 + H2O+NH3↑
NH4++OH- NH3↑ + H2O
氨的催化氧化:4NH3+5O2 4NO+6H2O
你自己找找吧,或许有用~1年前查看全部
- 在硫酸工业中,为了提高二氧化硫的转化率,为什么不可以采用升高温度的方法?
 mamingguo1年前1
mamingguo1年前1 -
 rainbow_zj 共回答了10个问题
rainbow_zj 共回答了10个问题 |采纳率90%2SO2 + O2 ====2SO3 放热反应,升温会使向逆方向反应,会减少二氧化硫的转化率.1年前查看全部
- 硫酸工业用什么吸收SO3
 ahappyapple1年前1
ahappyapple1年前1 -
 Lentil 共回答了20个问题
Lentil 共回答了20个问题 |采纳率90%98.3%的浓硫酸,之后变成发烟硫酸,不用水吸收,防止三氧化硫溶于水放出大量的热形成烟雾.
但方程式一般还写三氧化硫和水反应的那个1年前查看全部
- 下列有关工业生产的叙述中,不正确的是高温( ) A.硫酸工业中,在接触室安装热交换器是为了循环利用反应放出的热量 B.
下列有关工业生产的叙述中,不正确的是高温( ) A.硫酸工业中,在接触室安装热交换器是为了循环利用反应放出的热量 B.工业上用热还原法冶炼铝:Al 2 O 3 +CO═3CO 2 +2Al C.在铁管上镀铜时,用铁管做电解池阴极,铜块做阳极 D.工业合成氨生产中,适当提高原料气中氮气的含量,可提高H 2 的转化率  月青书1年前1
月青书1年前1 -
 嚣张乞丐 共回答了14个问题
嚣张乞丐 共回答了14个问题 |采纳率92.9%A、SO 2 转化为SO 3 放出热量,硫酸工业中,在接触室安装热交换器可以实现能量的循环利用,故A正确;
B、工业上金属铝的冶炼采用电解熔融的氧化铝的方法来获得,不能采用还原法,故B错误;
C、电镀装置中,镀件作阴极,镀层金属做阳极,在铁管上镀铜时,用铁管做电解池阴极,铜块做阳极,故C正确;
D、工业合成氨生产中,提高原料气中氮气的含量,会导致化学平衡正向移动,可提高H 2 的转化率,故D正确.
故选B.1年前查看全部
- 硫酸工业常用浓氨水吸收二氧化碳化学方程式
 hejing50001年前1
hejing50001年前1 -
 ahuii 共回答了19个问题
ahuii 共回答了19个问题 |采纳率84.2%2NH3.H2O+CO2===(NH4)2CO3+H2O1年前查看全部
- 硫酸工业上大多用接触法制硫酸(设空气中氧气的体积分数为20%),为使黄铁矿煅烧充分,常通入过量40%的空气,将上述炉气经
硫酸工业上大多用接触法制硫酸(设空气中氧气的体积分数为20%),为使黄铁矿煅烧充分,常通入过量40%的空气,将上述炉气经净化除尘后直接送入接触室,气体体积减少了5%(同温同压下测定),试计算SO2的转化率
 端木秋1年前1
端木秋1年前1 -
 testing33333 共回答了18个问题
testing33333 共回答了18个问题 |采纳率94.4%解析:
相关反应方程式:
4FeS2 + 11O2 ―(高温煅烧)→ 2Fe2O3 + 8SO2
2SO2 + O2 =(400℃~500℃,V2O5)= 2SO3 (=表示可逆符号)
通入过量40%的空气,那么氧气也同样过量40%,
则氧气初始计量 = 11 * 1.4 = 15.4,反应掉11体积的O2,剩余4.4体积O2
反应前空气总量 = 15.4 / 0.2 = 77 体积
第一步反应:消耗11体积O2,生成8体积SO2,反应后气体总量 = 77 - 11 + 8 = 74体积
第二步反应:气体体积减少了5%
设反应掉的SO2 体积 为 x,反应掉的O2 体积 为 y,生成的SO3体积 为 z,则有:
2SO2 + O2 =(400℃~500℃,V2O5)= 2SO3 (=表示可逆符号)………… △V
2 1 2 (2+1-2)
x y z 5%
解得:x = 10%,y = 5%,z = 10%
则SO2转化率 = (74*10%)*100% / 8 = 92.5 %1年前查看全部
- 在硫酸工业生产中,SO 3 的吸收过程是在吸收塔(如右图)中进行的,吸收塔里还装入大量瓷环。下列有关说法中,不正确的是
在硫酸工业生产中,SO 3 的吸收过程是在吸收塔(如右图)中进行的,吸收塔里还装入大量瓷环。下列有关说法中,不正确的是

A.从①处通入含SO 3 的混合气体,整个吸收操作采取逆流的形式 B.从②处喷下98.3%的硫酸,瓷环的作用是增大接触面积 C.从③处导出的尾气中含量最高的气体是SO 2 ,所以不可直接排入大气 D.从④处流出的是可用水或稀硫酸稀释的“发烟”硫酸  水色嘟嘟1年前1
水色嘟嘟1年前1 -
 FBB蛇美精 共回答了20个问题
FBB蛇美精 共回答了20个问题 |采纳率95%C
在硫酸工业生产中,为了使SO 3 的吸收充分,采取逆流的形式,A正确;在吸收塔中装有瓷环,其目的是增大浓硫酸与SO 3 的接触面积,使SO 3 尽可能被浓硫酸吸收,B正确,从③处导出的尾气中含量最高的气体是N 2 ,同时还含有未反应完全的SO 2 、SO 3 、O 2 等气体,所以不可直接排入大气中,C错;SO 3 被浓硫酸吸收后,硫酸成为“发烟硫酸”,此时的“烟”实际上是雾,硫酸小液滴,但是习惯上人们将其称为“烟”,D正确。1年前查看全部
- 下列说法中正确的是( )A.硫酸工业、合成氨工业、玻璃工业中都涉及氧化还原反应B.因氨水对许多金属有腐蚀作用,所以氨水
下列说法中正确的是( )
A.硫酸工业、合成氨工业、玻璃工业中都涉及氧化还原反应
B.因氨水对许多金属有腐蚀作用,所以氨水不能用金属容器盛装
C.一般合金的硬度比各成分金属要高,多数合金的熔点也比成分金属要高
D.在氧气参加的任何发光、发热的剧烈的化学反应才能称之为燃烧 韬武1年前1
韬武1年前1 -
 羔羊不迷途 共回答了20个问题
羔羊不迷途 共回答了20个问题 |采纳率90%解题思路:A.凡是有化合价升降的反应为氧化还原反应;
B.氨水腐蚀金属;
C.合金的硬度大熔点低;
D.燃烧是一种发光、发热的剧烈的化学反应.A.普通玻璃工业中不涉及氧化还原反应,故A错误;
B.氨能够与金属离子反应生成络合离子,从而腐蚀金属,故B正确;
C.合金的熔点比组成它的各成分的熔点都低,故C错误;
D.燃烧是一种发光、发热的剧烈的化学反应,不一定有氧气参与,故D错误.
故选B.点评:
本题考点: 金属与合金在性能上的主要差异;工业制取硫酸;工业合成氨;氨的化学性质.
考点点评: 本题考查氧化还原反应、金属腐蚀、合金和燃烧,题目难度不大,注意燃烧不一定有氧气参与.1年前查看全部
- 综合利用转炉煤气[CO(60~80%)、CO 2 (15~20%)及微量N 2 等]和硫酸工业尾气中的SO 2 ,既能净
综合利用转炉煤气[CO(60~80%)、CO 2 (15~20%)及微量N 2 等]和硫酸工业尾气中的SO 2 ,既能净化尾气,又能获得保险粉(Na 2 S 2 O 4 ),其部分工艺流程如下:

(1)转炉炼钢时,存在反应:Fe 3 C(s)+CO 2 (g)2CO(g)+3Fe(s),其平衡常数表达式为K=________。
(2)煤气净化时,先用水洗再用NaOH溶液洗涤,其目的是________。
(3)从滤液中回收甲醇的操作方法是____________________________;
还可回收的盐类物质是______________________________________(只写一种化学式)。
(4)合成保险粉反应的化学方程式为_________________________。
(5)保险粉、H 2 O 2 均可用于纸浆漂白,写出保险粉与过量的H 2 O 2 ,在水溶液中反应生成硫酸盐等物质的离子方程式:________________________________。 tiki801年前1
tiki801年前1 -
 zouxunsai 共回答了18个问题
zouxunsai 共回答了18个问题 |采纳率94.4%(1)c 2 (CO)/c(CO 2 ) (2)除去CO 2 等酸性气体 (3)蒸馏 Na 2 SO 3 (或NaHSO 3 )
(4)HCOONa+2SO 2 +NaOH=Na 2 S 2 O 4 +CO 2 +H 2 O
(5)S 2 O 4 2- +3H 2 O 2 =2SO 4 2- +2H + +2H 2 O
(1)固体物质不能写入平衡常数表达式中,K=c 2 (CO)/c(CO 2 )。(2)煤气中含有CO 2 等酸性气体,故用NaOH溶液洗涤以除去这些酸性气体。(3)甲醇易溶于水,但沸点较低,故可用蒸馏法回收甲醇;由于用到了二氧化硫和NaOH溶液,故可回收的盐类物质是Na 2 SO 3 或NaHSO 3 。(5)保险粉中S的化合价为+3,硫酸盐中S的化合价为+6,故H 2 O 2 作氧化剂,离子方程式为S 2 O 4 2- +3H 2 O 2 =2SO 4 2- +2H + +2H 2 O。1年前查看全部
大家在问
- 1She ______ her mother’s work since she was admitted into hos
- 2用物理学的角度说明什么叫天文数字?
- 3“少壮不努力 ,老大徒伤悲”的作者是谁?
- 4(215)10=( )2 十进制转换二进制
- 5英语翻译“不过我总是这么懒,吃不了苦,以至于我到现在还只是说的到做不到…哎,又要开始自卑了……不过……现在我已经不怕了!
- 6帮我算一道大题,不用写公式了某公司的某产品由三个公司分别加工生产,其中甲公司的产品占产品总数的20%,乙公司占40%,其
- 7把15比七分之五化成最简整数比()比值是()
- 8一种大豆,每2kg中大约有800g蛋白质、580g淀粉和400g脂肪.这三种物质各占总重量的几分之几.
- 9一批化肥重10吨,用了四吨,剩下的占总数的几分之几?
- 10小明向他爸借了500元,向他妈借了500元,买了一双970元的鞋还剩30元,还爸10元换还妈10元自己还剩10元,所以还
- 11相邻长度单位进率是
- 12需要100道二元一次方程组计算题(不是应用题)切记“不含”答案,谢谢
- 13分数三分之一,小数( ),百分数( )
- 14关于离子共存的题目1,下列各组离子能在无色透明的酸性溶液中大量共存的是A.Fe3+ Cu2+ SO4 2- NO3-B.
- 15一道离子共存题酸性溶液中,以下离子不能共存的原因是:A.Fe2+ SO4 2- Na+ CO3 2-B.Al3+ Fe3