电化学在日常生活中用途广泛,下图①是镁、次氯酸钠燃料电池的示意图,电池总反应式为:Mg+ClO-+H2O═Cl-+Mg(
 江城子II2022-10-04 11:39:541条回答
江城子II2022-10-04 11:39:541条回答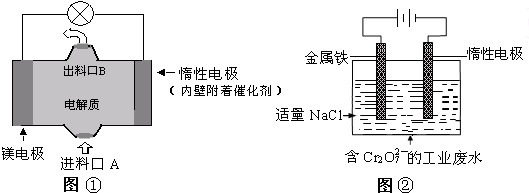
A.图②中Cr2O72-离子向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
B.图②中阳极上的电极反应式为:Fe-3e-═Fe3+
C.图①中发生的还原反应是:Mg2++ClO-+H2O+2e-═Cl-+Mg (OH)2↓
D.若图①中3.6g镁溶解产生的电量用以图②废水处理,理论可产生10.7g氢氧化铁沉淀

已提交,审核后显示!提交回复
共1条回复
 wuxiaozizi 共回答了19个问题
wuxiaozizi 共回答了19个问题 |采纳率94.7%- 解题思路:A.图②中惰性电极为阴极;
B.阳极铁被氧化生成Fe2+;
C.该原电池中,镁作负极,负极上镁失电子发生氧化反应,负极反应为Mg-2e-=Mg2+,电池反应式为Mg+ClO-+H2O=Mg(OH)2↓+Cl-,正极上次氯酸根离子得电子发生还原反应;
D.由电子守恒可知,Mg~2e-~Fe2+,由原子守恒可知Fe2+~Fe(OH)3↓,以此计算.A.图②中惰性电极为阴极,Fe电极为阳极,则Cr2O2-7离子向金属铁电极移动,与亚铁离子发生氧化还原反应生成的金属阳离子与惰性电极附近的OH-结合转化成Cr(OH)3除去,故A错误;
B.图②中阳极上的电极反应式为:Fe-2e-═Fe2+,故B错误;
C.该原电池中,镁作负极,负极上镁失电子发生氧化反应,负极反应为Mg-2e-=Mg2+,电池反应式为Mg+ClO-+H2O=Mg(OH)2↓+Cl-,正极上次氯酸根离子得电子发生还原反应,则总反应减去负极反应可得正极还原反应为Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓,故C正确;
D.由电子守恒可知,Mg~2e-~Fe2+,由原子守恒可知Fe2+~Fe(OH)3↓,则n(Mg)=[3.6g/24g/mol]=0.15mol,理论可产生氢氧化铁沉淀的质量为0.15mol×107g/mol=16.05g,故D错误;
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题综合考查电解原理,涉及电解、氧化还原反应、电子守恒的计算等问题,为高频考点,要求具有较好的分析和解决问题的能力,题目难度中等. - 1年前
相关推荐
- 电化学与普通化学反应的区别
 xie_abc1年前3
xie_abc1年前3 -
 death125 共回答了12个问题
death125 共回答了12个问题 |采纳率91.7%首先,电化学必定是氧化还原反应,而普通化学不一定,电化学其实就是发生氧化还原反应的同时构成了原电池,而原电池的构成会加快氧化还原反应的进行,电化学可以认为是氧化还原反应中的特殊一种.1年前查看全部
- 相关二氧化氮的电化学方程式有哪些?请写出正负极和总反应方程.
 heshihuan1年前1
heshihuan1年前1 -
 zcw52010000 共回答了26个问题
zcw52010000 共回答了26个问题 |采纳率88.5%双水解反应将是这种情况.
大多数弱酸弱碱盐,虽然水解离子相互促进,水解程度还小,如碳酸氢铵,可以匹配的解决方案.某些阳离子和阴离子中的一些水解的溶液可以彼此发生反应,以促进水解反应趋于完成这种类型的反应是双水解反应.
那些阳离子阴离子溶液水解反应可以发生一倍呢?
已有教科书部酸盐的溶解度表“ - ”铝离子,铁离子和碳酸根离子的标志,双水解反应可发生,即使用泡沫灭火器也双水解反应时发生的反应.还弱酸比碳酸相应的酸的酸基团,如硫化物,氢硫化物离子,铝离子等和铝离子在溶液中可能会发生双水解反应.注意:硫化物离子,氢硫化物离子和铁离子的主要氧化还原反应.
两种离子如果能增加一倍,水解反应发生的方案中,系统将不能够采取在该溶液中.如碳酸铝不存在,硫化铝和硫作为用于制作,而不是由复分解反应原料铝.
双水解反应是复分解反应,反应要抓住精髓离子方程式可以直接用原子守恒和电荷守恒可以轻松修剪写入.
--------点击看详细3(HCO3 - )+(铝离子)= 3CO2↑+的Al(OH)3↓点击看详细 BR>
Al2S3 + 3H2O = 2AL(OH)3↓+ 3H2S↑
中国的AlN + 3H2O =的Al(OH)3↓+ NH3↑
- - 点击看详细普通高中化学可能发生“双水解反应”离子对有:
中国的Al3 +和HCO3-,CO32 - ,HS - ,S2-,CLO-,ALO2-;
中国的Fe3 +和HCO3-,CO32-,CLO-,ALO2-;1年前查看全部
- 高考化学小题,关于电化学,对于此装置的下面的叙述是否正确?:装置④中的铁钉几乎不被腐蚀.Why.thank you
 关你吊N事1年前1
关你吊N事1年前1 -
 xubin1018 共回答了17个问题
xubin1018 共回答了17个问题 |采纳率94.1%正确,浓硫酸的强氧化性和吸水性,是的铁钉那边没有水分,保持的非常干燥的环境中,所以不会腐蚀.1年前查看全部
- 电化学发光的好处
 杨莉莉1年前2
杨莉莉1年前2 -
 mmcly 共回答了22个问题
mmcly 共回答了22个问题 |采纳率90.9%电化学发光现在是很热的研究领域,虽然已经发展了五六十年,但随着检测技术和电极(特别是透明电极的发展),电致发光得到了进一步应用,在生物分析、电分析领域发挥到越来越大的作用.
其中电化学发光与光谱学(比如紫外、荧光等)联用,可以实现高灵敏度、高选择性分析及电化学体系的测定.我正在看电化学大神J.Bard的《电化学方法原理与应用》,书里对电化学发光的描述:
60年代初,美国著名电化学家R.N.Adams教授在指导他的研究生T.Kuwana进行邻二苯胺衍生物电氧化时,观察到电极反应伴随有颜色的变化,他提出了这样的设想:“能不能设计出一种能看穿的电极,以光谱的方法来识别所形成的有色物质呢?”.这个创新思想终于在1964年由Kuwana 实现了.他们第一次使用的光透电极(OTE)是在玻璃板上镀了一薄层掺杂Sb的SnO2
玻璃(Nesa玻璃).光谱电化学从此得到了迅速发展,已成为电化学的一个重要分支.它是各种波谱技术和电化学方法相结合,在同一个电解池内同时进行测量的方法.其特点是同时具有电化学和波谱学二者的特性,可以在电极反应过程中获得多种有用的信息,对于研究电极过程机理、电极表面特性,检测反应中间体、瞬间状态和产物性质,测定式量电位、电子转移数,电极反应速率常数和扩散系数等,提供了非常用力的研究手段.1年前查看全部
- 电化学有关的知识为何铜作负级,石墨作正级时,即使溶液是酸性的也一定是吸氧腐蚀?
 殷昌富1年前3
殷昌富1年前3 -
 ss的蜗牛 共回答了18个问题
ss的蜗牛 共回答了18个问题 |采纳率83.3%因为根据金属活动性顺序,K,Ca.Na,My,Al,Zn,Fe,Sn,Pd,H,Cu,Hg,Ag,Au.氢比铜活泼,所以不可能发生析氢腐蚀,只能发生吸氧腐蚀.1年前查看全部
- 甲烷燃料电池电解质是碱性 电化学方程式
 caoliang19841年前3
caoliang19841年前3 -
 fun10000 共回答了18个问题
fun10000 共回答了18个问题 |采纳率88.9%首先写出总的离子反应方程式:CH4+2O2+2OH-==CO32-+3H20 ①就是CH4在O2中燃烧,生成的CO2和OH-反应生成CO32-的离子反应方程式接着写正极,记住:正极在碱性条件下的反应一定是:O2+4e-+2H2O==4OH- ②接着将总反应式减去正极反应式就是负极反应式,这里有一点非常重要,就是一定要将O2消去,因为原电池负极发生氧化反应,而O2发生还原反应 故一定要将O2消去将②X2 得到 2O2+8e-+4H2O===8OH- ③①-③ 得到CH4-8e--4H2o+2OH-==CO32-+3H2O-8OH-移项的到负极反应式:CH4+10OH--8e-==CO32-+7H20总反应:CH4+2O2+2OH-==CO32-+3H20负极:CH4+10OH--8e-==CO32-+7H20正极:O2+4e-+2H2O==4OH-希望我的方法对你有帮助1年前查看全部
- 电化学知识,开路电位与腐蚀电位有何关系
 linqp5951年前1
linqp5951年前1 -
 老狼H 共回答了12个问题
老狼H 共回答了12个问题 |采纳率66.7%金属材料与电解质溶液接触 ,通过电极反应产生的腐蚀.电化学腐蚀反应是一种氧化还原反应.在反应中,金属失去电子而被氧化,其反应过程称为阳极反应过程,反应产物是进入介质中的金属离子或覆盖在金属表面上的金属氧化物...1年前查看全部
- 一道物理可以说是电化学的题美国科研人员正在研制一种新型镍铜长效电池,它是采用半衰期长达100年的放射性同位素63(Ni)
一道物理可以说是电化学的题
美国科研人员正在研制一种新型镍铜长效电池,它是采用半衰期长达100年的放射性同位素63(Ni)和铜两种金属作为长寿命电池的材料,利用镍63发生β衰变时释放电子给铜片,把镍63和铜片做电池两极外界负载,为负载提供电能.下面正确的是.
AB,我懂
C 外接负载时镍63的电势比铜片高.
D 该电池内电流方向是从镍到铜片.
我的疑问是:镍63衰变后变成铜原子,为什么带正电,做正极? 马中宝1年前2
马中宝1年前2 -
 洋葱蛛猪 共回答了21个问题
洋葱蛛猪 共回答了21个问题 |采纳率85.7%就是“镍63发生β衰变时释放电子给铜片”这句话最关键,其他都是没有的话,
电子运动方向是从镍63到铜片,电流方向就是铜片到镍,但是电池内部电流方向是负极到正极,所以镍是正极,正极当然电势比负极高啊!1年前查看全部
- 原电池 电解池化学方程式要够新,全面 看清楚是电化学的最好新型材料的.写好正负极 和 电解质
 牛公20071年前1
牛公20071年前1 -
 gdj007 共回答了9个问题
gdj007 共回答了9个问题 |采纳率88.9%用Cu作导线,这是最环保的燃料电池:
Cu的左端,(负极):2H2-4e-=4H+
Cu的右端,(正极):O2+4e-+H2O=4OH-
总反应:2H2+O2=2H2O
电解质溶液是NaCl.1年前查看全部
- 【问题】电化学方面的,能人请进1.]那个对啊?A电池反应中,锂、锌、银、铅各失去1mol电子,金属锂所消耗的质量最小B合
【问题】电化学方面的,能人请进
1.]那个对啊?
A电池反应中,锂、锌、银、铅各失去1mol电子,金属锂所消耗的质量最小
B合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
C硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
D铜解电源正极,碳棒解负极的电解池,电解一定时间后,石墨电极上有铜析出
E镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
2]计算:以惰性电极电解CuSO4溶液,若阳极析出气体0.01mol,则阴极上析出Cu为
3]取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通
直流电源,一段时间后,发现电极与试纸接触处出现一个双色同心圆,内圆
为白色,外圆呈浅红色.则下列说法错误的是
A.b电极是阴极 B.a电极与电源的正极相连接
C.电解过程中,水是氧化剂 D.b电极附近溶液的pH变小
4.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法, bofeng081年前1
bofeng081年前1 -
 声大 共回答了20个问题
声大 共回答了20个问题 |采纳率80%1.A,算一下就可以了
D选项题目是不是有问题?
2.阴极:Cu2+2e=Cu
阳极:2OH-4e=O2
所以nCu=0.005mol
3.a和b在哪里?
4.对.Zn比Fe更容易失去电子,所以Fe没有被氧化而Zn被氧化.1年前查看全部
- 金属材料的知识点 金属电化学性质 的 知识点 和 重点 考点
 adgf1年前1
adgf1年前1 -
 忧郁是我的名字 共回答了16个问题
忧郁是我的名字 共回答了16个问题 |采纳率100%1、金属与氧气的反应;
2、掌握镁、铝、锌、铁分别与盐酸和硫酸反应的现象以及化学方程式;
3、理解置换反应的涵义;
4、掌握金属活动顺序,应用金属活动顺序进行相关判定,并能运用其进行试验探究.(重点)1年前查看全部
- 电化学方程式正负极怎么写
 xchhcx1231年前1
xchhcx1231年前1 -
 yz0127 共回答了14个问题
yz0127 共回答了14个问题 |采纳率100%原电池,负极氧化正极还原 电解池阳极氧化阴极还原
弄清楚谁得电子谁失电子 ; 考虑原电池的环境,如果是酸性环境不产生氢氧根,碱性不产生氢离子,
如果是燃料电池,有机物的话失电子数为碳失四,氢失一,氧得二,如果是中性或碱性环境,负极生成碳酸根,正极生成氢氧根.给你几个例子:
Cu─H2SO4─Zn原电池
正极:2H+ +2e- →H2↑
负极:Zn-2e- →Zn2+
总反应式:Zn+2H+==Zn2++H2↑
氢氧燃料电池(碱性介质)
正极:O2+2H2O+4e- →4OH-
负极:2H2-4e- +4OH- →4H2O
总反应式:2H2+O2==2H2O
氢氧燃料电池(酸性介质)
正极:O2+4H+ + 4e-→2H2O
负极:2H2-4e- →4H+
总反应式:2H2+O2=2H2O
CH4燃料电池(碱性介质)
正极:2O2+4H2O+8e- →8OH-
负极:CH4-8e- +10OH- →(CO3)2-+7H2O1年前查看全部
- 高二电化学.电解普通水(H20)和重水(D2O)的混合物,通电一段时间后,两极共生成气体18.5g,其体积为33.6L(
高二电化学.
电解普通水(H20)和重水(D2O)的混合物,通电一段时间后,两极共生成气体18.5g,其体积为33.6L(标况),在所生成的启气体中,D和H的原子个数比为
A.2:3 B.2:5 C.1:2 D.1:3
我算了没算出来,如果解释的清楚的话一定追分!~ 亚热带的忧伤1年前1
亚热带的忧伤1年前1 -
 hyncb 共回答了26个问题
hyncb 共回答了26个问题 |采纳率92.3%选D.列方程求解,设水的反应式生成氧为X则氢为2x,重水氧为yD2为2y.利用质量和物质的量两个式子求x,y.即3X+3y=1.5,4x+8y+32(x+y)=18.5解得即可.…给我分吧.…多加点.1年前查看全部
- 我看了您解答的关于书写电化学方程式的方法 请问 燃料电池怎么书写呢?
 大老鸟1年前1
大老鸟1年前1 -
 su_ruo 共回答了13个问题
su_ruo 共回答了13个问题 |采纳率84.6%燃料电池,都是燃料和氧气反应啊,所以,燃料都做负极,氧气都做正极.
1、燃料电池总反应方程式的书写
因为燃料电池发生电化学反应的最终产物与燃料燃烧的产物相同,可根据燃料燃烧反应写出燃料电池的总反应方程式,但要注意燃料的种类.若是氢氧燃料电池,其电池总反应方程式不随电解质的状态和电解质溶液的酸碱性变化而变化,即2H2+O2=2H2O.若燃料是含碳元素的可燃物,其电池总反应方程式就与电解质的状态和电解质溶液的酸碱性有关,如甲烷燃料电池在酸性电解质中生成CO2和H2O,即CH4+2O2=CO2+2H2O;在碱性电解质中生成CO32-离子和H2O,
即CH4+2OH-+2O2=CO32-+3H2O.
所有的燃料电池的工作原理都是一样的,其电极反应式的书写也同样是有规律可循的.书写燃料电池电极反应式一般分为三步:第一步,先写出燃料电池的总反应方程式;第二步,再写出燃料电池的正极反应式;第三步,在电子守恒的基础上用燃料电池的总反应式减去正极反应式即得到负极反应式.
2、燃料电池正极反应式的书写
因为燃料电池正极反应物一律是氧气,正极都是氧化剂氧气得到电子的还原反应,所以可先写出正极反应式,正极反应的本质都是O2得电子生成O2-离子,故正极反应式的基础都是O2+4e-=2O2-.正极产生O2-离子的存在形式与燃料电池的电解质的状态和电解质溶液的酸碱性有着密切的关系.这是非常重要的一步.现将与电解质有关的五种情况归纳如下.
⑴电解质为酸性电解质溶液(如稀硫酸)
在酸性环境中,O2-离子不能单独存在,可供O2-离子结合的微粒有H+离子和H2O,O2-离子优先结合H+离子生成H2O.这样,在酸性电解质溶液中,正极反应式为O2+4H++4e-=2H2O.
⑵电解质为中性或碱性电解质溶液(如氯化钠溶液或氢氧化钠溶液)
在中性或碱性环境中,O2-离子也不能单独存在,O2-离子只能结合H2O生成OH-离子,故在中性或碱性电解质溶液中,正极反应式为O2+2H2O +4e-=4OH-.
⑶电解质为熔融的碳酸盐(如LiCO3和Na2CO3熔融盐混和物)
在熔融的碳酸盐环境中,O2-离子也不能单独存在, O2-离子可结合CO2生成CO32-离子,则其正极反应式为O2+2CO2 +4e-=2CO32-.
⑷电解质为固体电解质(如固体氧化锆—氧化钇)
该固体电解质在高温下可允许O2-离子在其间通过,故其正极反应式应为O2+4e-=2O2-.
综上所述,燃料电池正极反应式本质都是O2+4e-=2O2-,在不同电解质环境中,其正极反应式的书写形式有所不同.因此在书写正极反应式时,要特别注意所给电解质的状态和电解质溶液的酸碱性.
下面来看几道例题的讲
1、电解质为酸性电解质溶液
例1、科学家预言,燃料电池将是21世纪获得电力的重要途径,美国已计划将甲醇燃料用于军事目的.一种甲醇燃料电池是采用铂或碳化钨作电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气.
试回答下列问题:
⑴这种电池放电时发生的化学反应方程式是 .
⑵此电池的正极发生的电极反应是 ;负极发生的电极反应是 .
⑶电解液中的H+离子向 极移动;向外电路释放电子的电极是 .
⑷比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其中主要有两点:首先是燃料电池的能量转化率高,其次是 .
解析:因燃料电池电化学反应的最终产物与燃料燃烧的产物相同,又且其电解质溶液为稀硫酸,所以该电池反应方程式是2CH3OH+3O2=2CO2+4H2O.按上述燃料电池正极反应式的书写方法1知,在稀硫酸中,其正极反应式为:3O2+12H++12e-=6H2O,然后在电子守恒的基础上利用总反应式减去正极反应式即得负极反应式为:2CH3OH+2H2O-12e-=2CO2↑+12H+.由原电池原理知负极失电子后经导线转移到正极,所以正极上富集电子,根据电性关系知阳离子向正极移动,阴离子向负极移动.故H+离子向正极移动,向外电路释放电子的电极是负极.
答案:⑴2CH3OH+3O2=2CO2+4H2O
⑵正极3O2+12H++12e-=6H2O;负极2CH3OH+2H2O-12e-=2CO2↑+12H+
⑶正;负 ⑷对空气的污染较小
2、电解质为碱性电解质溶液
例2、甲烷燃料电池的电解质溶液为KOH溶液,下列关于甲烷燃料电池的说法不正确的是 ( )
A、负极反应式为CH4+10OH--8e-=CO32-+7H2O
B、正极反应式为O2+2H2O +4e-=4OH-
C、随着不断放电,电解质溶液碱性不变
D、甲烷燃料电池的能量利用率比甲烷燃烧的能量利用率大
解析:因甲烷燃料电池的电解质为KOH溶液,生成的CO2还要与KOH反应生成K2CO3,故该电池发生的反应方程式是CH4+2OH-+2O2=CO32-+3H2O.从总反应式可以看出,要消耗OH-,故电解质溶液的碱性减小,C错.按上述燃料电池正极反应式的书写方法2知,在KOH溶液中,其正极反应式为:O2+2H2O +4e-=4OH-.通入甲烷的一极为负极,其电极反应式可利用总反应式减去正极反应式为CH4+10OH--8e-=CO32-+7H2O.选项A、B均正确.根据能量转化规律,燃烧时产生的热能是不可能全部转化为功的,能量利用率不高,而电能转化为功的效率要大的多,D项正确.故符合题意的是C.
3、电解质为熔融碳酸盐
例3、某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.试回答下列问题:
⑴写出该燃料电池的化学反应方程式.
⑵写出该燃料电池的电极反应式.
⑶为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定.为此,必须在通入的空气中加入一种物质,加入的物质是什么,它从哪里来?
解析:由于电解质为熔融的K2CO3,且不含O2-和HCO3-,生成的CO2不会与CO32-反应生成HCO3-的,故该燃料电池的总反应式为: 2C4H10+13O2=8CO2+10H2O.按上述燃料电池正极反应式的书写方法3知,在熔融碳酸盐环境中,其正极反应式为O2+2CO2 +4e-=2CO32-.通入丁烷的一极为负极,其电极反应式可利用总反应式减去正极反应式求得,应为2C4H10+26CO32--52e-=34CO2+10H2O.从上述电极反应式可看出,要使该电池的电解质组成保持稳定,在通入的空气中应加入CO2,它从负极反应产物中来.
答案:⑴2C4H10+13O2=8CO2+10H2O
⑵正极:O2+2CO2 +4e-=2CO32-,负极:2C4H10+26CO32--52e-=34CO2+10H2O
⑶CO2 从负极反应产物中来
4、电解质为固体氧化物
例4、一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-.下列对该燃料电池说法正确的是 ( )
A. 在熔融电解质中,O2-由负极移向正极
B. 电池的总反应是:2C4H10+13O2 ® 8CO2+10H2O
C. 通入空气的一极是正极,电极反应为:O2+4e-=2O2-
D. 通入丁烷的一极是正极,电极反应为:C4H10+26e-+13O2-=4CO2+5H2O
解析:本题以丁烷燃料电池为载体综合考查了原电池原理涉及的有关“电子流向、电极反应式、总反应式”等内容,因正极上富集电子,根据电性关系,O2-不可能移向正极,A错.由丁烷的燃烧反应及电解质的特性知该电池的总反应式为2C4H10+13O2 ® 8CO2+10H2O,B正确.按上述燃料电池正极反应式的书写方法5知,在熔融状态下允许O2-在其间通过,故其正极反应式为O2+4e-=2O2-,C正确.通入丁烷的一极应为负极,D错.故符合题意的是B、C.1年前查看全部
- 电化学中的氧化态,还原态怎么确定
 彩虹的幻想1年前1
彩虹的幻想1年前1 -
 w鬃樊nbkgl 共回答了13个问题
w鬃樊nbkgl 共回答了13个问题 |采纳率92.3%以较高化合价出现的状态,与以较低化合价出现的状态相对而言,叫做该元素的氧化态,以较低化合价出现的状态叫还原态.如铁元素:Fe3O4与FeO相比,它就是氧化态,与Fe2O3相比,它就是还原态.1年前查看全部
- 高中化学——选修4——化学反应原理——第四章电化学基础
高中化学——选修4——化学反应原理——第四章电化学基础
离子的放电顺序是应用于电解池,还是应用于原电池? drdr121年前4
drdr121年前4 -
 任性的桃子 共回答了22个问题
任性的桃子 共回答了22个问题 |采纳率77.3%很确定.
用于电解池.1年前查看全部
- 电化学中的阴极保护法怎样理解?
 熊猫美人1年前4
熊猫美人1年前4 -
 jiarongzhen 共回答了20个问题
jiarongzhen 共回答了20个问题 |采纳率80%牺牲阳极的阴极保护法,又称牺牲阳极保护法.是一种防止金属腐蚀的方法.具体方法为:将还原性较强的金属作为保护极,与被保护金属相连构成原电池,还原性较强的金属将作为负极发生氧化反应而消耗,被保护的金属作为正极就可以避免腐蚀.因这种方法牺牲了阳极(原电池的负极)保护了阴极,因而叫做牺牲阳极(原电池的阴极)保护法.1年前查看全部
- 高中化学:关于电化学的问题在电解反应中,电解质溶液是氢氧化钠,该反应实质是在电解水,请问:为什么开始发生反应后电解质溶液
高中化学:关于电化学的问题
在电解反应中,电解质溶液是氢氧化钠,该反应实质是在电解水,请问:为什么开始发生反应后电解质溶液的浓度会增大?pH会增大?为什么电解质溶液复原为水?
同样的道理,如果电解质溶液时硫酸呢? macgery1年前1
macgery1年前1 -
 板板800 共回答了23个问题
板板800 共回答了23个问题 |采纳率82.6%c(NaOH)=n(NaOH)/V.n不变水减少,V减小,c增大,c(OH-)越大,PH越大.加水把消耗的水补充回来.电解硫酸也是电解水,c
(H-)增大,PH减小1年前查看全部
- 铁棒做阳极,石墨做阴极,溶质是氯化钠溶液,反应的电化学方程(包括阴极阳极和总的)是什么
 xiaoailin1年前1
xiaoailin1年前1 -
 liu16dan 共回答了19个问题
liu16dan 共回答了19个问题 |采纳率84.2%阳极.Fe-2e-=Fe2+
阴极2H++2e-=2H2.
总方程式Fe+2H2O=通电=Fe(OH)2 + H21年前查看全部
- 电化学!电解池部分!急求高手解答
电化学!电解池部分!急求高手解答
形成电解池后!若要在铁棒上镀铜!就让铁做阴极!铜做阳极!为什么电解质不能用氯化钠溶液? liuping52021年前3
liuping52021年前3 -
 沧海一声笑123456 共回答了17个问题
沧海一声笑123456 共回答了17个问题 |采纳率94.1%用氯化钠溶液,开始一段时间是水的电子,这样显然会浪费电能.
用铜盐溶液就直接铜离子得电子了1年前查看全部
- 电化学测试中为什么要用KOH作电解液
 林太平20031年前0
林太平20031年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 关于电池的问题 (高中化学)1 我们平时所用的电池跟电化学中所学的原电池有什么区别?是一回事吗?那平常的电池举个例,结合
关于电池的问题 (高中化学)
1 我们平时所用的电池跟电化学中所学的原电池有什么区别?是一回事吗?那平常的电池举个例,结合化学知识,说明一下工作原理.
2 在学电解池时,老师说跟电池的负极相连的电极附近有大量自由电子,而正极缺少电子.这是为什么?求解释
 面小四1年前1
面小四1年前1 -
 audrey_zw 共回答了17个问题
audrey_zw 共回答了17个问题 |采纳率76.5%1,没区别.生活中干电池(碱性电池)工作原理:Zn+2MnO2+2H2O==2MnOOH+Zn(OH)2.钮扣电池Zn+Ag2O===ZnO+2Ag.铅蓄电池:Pb+2H2SO4+PbO2=2PbSO4+2H2O7
都是利用氧化还原反应过程中的电子转移形成电流7
2,电子从电池的负极产生,沿着导线到达阴极.电池正极刚好相反,阳离子在这里放出电子,电子沿导线到达电池正极7
手打不容易,望采纳,有啥不清楚请继续问7
错了,阴离子在阳极放出电子7
你可以粗略理解为阳极带正电.本质是电池正负极的电势差(有点向地势差,球从地势高的地方掉到地势低的地方),电子从电势低处移动到电势高的地方,物理选修3-1会学1年前查看全部
- 高中电化学对于金属保护的理解为什么用牺牲阳极的阴极保护法和外加电流的阴极保护法能保护金属?好像有关电子转移的吧?这两种方
高中电化学对于金属保护的理解
为什么用牺牲阳极的阴极保护法和外加电流的阴极保护法能保护金属?好像有关电子转移的吧?这两种方法究竟是阻止电子的移向还是什么?求各位达人解答,感激不尽~
 geplow1年前1
geplow1年前1 -
 Royalknight 共回答了16个问题
Royalknight 共回答了16个问题 |采纳率87.5%牺牲阳极的阴极保护法 利用的是原电池的原理
在原电池中 负极电极材料失电子变为离子 而阳极材料不发生反应
原电池虽然只有正负极 但是事实上 也有阴阳极的
原电池中当然有阴阳极
阳极:发生氧化反应的电极.
阴极:发生还原反应的电极.
正极:电势较高的电极.
阴极:电势较低的电极.
原电池的阳极为负极,阴极为正极;电解池的阳极为正极,阴极为负极.
正因为正极材料在有负极的情况下不会发生反应 这样就可以保护正极上的金属材料
比如海船在海中 铁制船体容易被海水腐蚀 于是人们就在船上装上一些锌块
锌块的活泼性强于铁 在海水中更容易发生反应 这个锌铁原电池中铁就做正极不发生反应了
如此就保护了铁 也就是牺牲阳极的阴极保护法
外加电流的阴极保护法 是利用电解池的原理
电解池需要电源电解物质 同理阳极电极物体失电子 阴极不反应
这样也就保护了阴极的金属
不懂欢迎追问1年前查看全部
- 关于铁的电化学腐蚀常温下将铁丝放在潮湿的空气中属于电化学腐蚀,那么将潮湿的铁丝放在常温的氧气流中是属于化学腐蚀还是电化学
关于铁的电化学腐蚀
常温下将铁丝放在潮湿的空气中属于电化学腐蚀,那么将潮湿的铁丝放在常温的氧气流中是属于化学腐蚀还是电化学腐蚀呢(我要原因)~为什么将潮湿的铁丝放在高于常温的氧气流中会比放常温的氧气流中腐蚀得更快? Suckmydick0001年前1
Suckmydick0001年前1 -
 铁笔铜胳膊 共回答了13个问题
铁笔铜胳膊 共回答了13个问题 |采纳率76.9%电化学腐蚀 :金属材料与电解质溶液接触 ,通过电极反应产生的腐蚀
可能是铁丝在潮湿的空气中发生原电池反应,才是电化学腐蚀
将潮湿的铁丝放在常温的氧气流中是属于电化腐蚀
为什么将潮湿的铁丝放在高于常温的氧气流中会比放常温的氧气流中腐蚀得更快?
因为氧气的浓度1年前查看全部
- 什么是电化学极化的经验规律
 humanlord1年前1
humanlord1年前1 -
 dayoubutong 共回答了18个问题
dayoubutong 共回答了18个问题 |采纳率94.4%电化学过程,那一步的反应过慢就受哪一步控制.电子转移慢,就是电化学极化.溶液传质慢,就是浓差极化.还有一个欧姆极化1年前查看全部
- 运用电化学的方法使金属表面钝化“将被保护金属接到外加电源的正极上,那么阳极金属就失电子,生成致密的氧化膜”为什么失电子会
运用电化学的方法使金属表面钝化
“将被保护金属接到外加电源的正极上,那么阳极金属就失电子,生成致密的氧化膜”为什么失电子会生成致密的氧化膜? fioreal1年前1
fioreal1年前1 -
 mengyao5720 共回答了19个问题
mengyao5720 共回答了19个问题 |采纳率89.5%失去电子被氧化呀1年前查看全部
- 由阳极极化引起的金属钝化现象,叫阳极钝化或电化学钝化.
由阳极极化引起的金属钝化现象,叫阳极钝化或电化学钝化.
Fe置于H2SO4溶液中作为阳极,用外加电流使阳极极化,采用一定仪器使铁电位升高一定程度,Fe就钝化了.(解析到我明白马上采纳) 诗意之失意1年前1
诗意之失意1年前1 -
 qqffpp 共回答了18个问题
qqffpp 共回答了18个问题 |采纳率94.4%通电后,阳极活泼金属如铁失去电子后变成的二价铁离子不会立即进入溶液,而是吸附在铁表面,形成钝化膜.
钝化膜有降低金属电势的功效(金属内阳离子浓度不变,电子浓度变小了)1年前查看全部
- 电化学,求转移电子数用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1MOLCu2(OH)2CO
电化学,求转移电子数
用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1MOLCu2(OH)2CO3后恰能恢复到电解钱的浓度和PH(不考虑CO2的溶解).则电解过程中转移电子的总物质的量为多少?答案是0.6MOL 怨念丛生的蓝1年前1
怨念丛生的蓝1年前1 -
 喷火兵 共回答了21个问题
喷火兵 共回答了21个问题 |采纳率81%电解是分两步的,首先消耗铜离子和氢氧根生成硫酸溶液,然后是电解水的过程.加入0.1MOLCu2(OH)2CO3后恰能恢复到电解钱的浓度,说明消耗了0.2mol铜离子,则有0.4mol电子转移.而生成硫酸会降低溶液PH,加入0.2mol氢氧根及0.1mol碳酸根恢原复PH,说明电解最终产生了0.4mol氢离子,而消耗铜离子时产生的氢离子恰好是0.4mol,说明没有氢离子得到电子,也就是电解水的反应没有发生.所以答案是0.4mol1年前查看全部
- 电化学驱动力.钾离子,钠离子,氯离子,钙离子在神经细胞静息电位中,电化学驱动力最大的是哪个,最小的是哪个,要计算方法.没
电化学驱动力.
钾离子,钠离子,氯离子,钙离子在神经细胞静息电位中,电化学驱动力最大的是哪个,最小的是哪个,要计算方法.
没人会么,逼我出绝招! 灭回1年前1
灭回1年前1 -
 爱蚊子的鱼 共回答了23个问题
爱蚊子的鱼 共回答了23个问题 |采纳率78.3%顾艳南版的解答是最大的是钠,最小的是氯,是根据书上的减出来的,但是老贺真题里的算法是把钙的电荷给除了一下,我也有点儿一头雾水,但顾艳南是北大的,所以倾向一下1年前查看全部
- Mn2+相关问题(电化学)我现在有一种以碳酸酯类+锂盐的有机物组成的电池,但是里面有Mn2+,在使用时,Mn2+会还原成
Mn2+相关问题(电化学)
我现在有一种以碳酸酯类+锂盐的有机物组成的电池,但是里面有Mn2+,在使用时,Mn2+会还原成Mn附着在负极上,请问有什么办法解决?能否加入某种物质使Mn的沉积电位改变(负极的电极电位是0.08V)而是Mn2+不再负极沉积?当然直接减少Mn2+更好?
含有Mn2+,是有正极材料锰酸锂中脱离出来的 xlnhm1001年前4
xlnhm1001年前4 -
 ss督察 共回答了19个问题
ss督察 共回答了19个问题 |采纳率100%直接减少Mn2+
1、加入氢氧化钠溶液,使Mn2+转为沉淀Mn(OH)2(溶解性:溶于酸和铵盐,不溶于水和碱.热稳定性:加热到140℃分解 )
2、或者加硫化钠溶液,使Mn2+转为沉淀MnS2(难溶)【参考以下资料,可以去看看锂、锰电池中有效成分的回收,也许对您有启发http://d.wanfangdata.com.cn/Periodical_whgydxxb200211005.aspx】1年前查看全部
- 电化学中电解池部分的化学方程式该怎么写?(阴阳两极分开写)
电化学中电解池部分的化学方程式该怎么写?(阴阳两极分开写)
电解质不同时,方程式中有时有OH根,有时是别的酸根等等。看的话能看懂,让我根据题目写, landonge1年前3
landonge1年前3 -
 岸边蝴碟 共回答了23个问题
岸边蝴碟 共回答了23个问题 |采纳率95.7%电解池的电极反应符合异性相吸的原理,阳极连着电源的正极带正电性,所以能吸引溶液中的阴离子到电极上反应,而阴极连着电源的负极带负电性,能吸引溶液中的阳离子到电极上反应.参加电极反应的离子有一定的顺序:阳离子一般以金属活动性顺序表为基准,排在H+后面的金属阳离子先得电子,如果是活泼金属的阳离子则轮到水电离出来的H+先得电子;阴离子看组成,如果是简单阴离子如 Cl-、Br-、S2-等,那么就是它们先失电子,如果酸根阴离子是硫酸根离子、碳酸根离子、硝酸根离子这些复杂原子团时,那么就轮到水电离出来的OH-先失电子了
如: 电解NaCl溶液:阳离子是H+在阴极得电子,阴离子就是Cl-在阳极失电子;
电解Na2SO4溶液:阳离子是H+在阴极得电子,阴离子就是OH-在阳极失电子;
电解CuSO4溶液:阳离子是Cu2+在阴极得电子,阴离子就是OH-在阳极失电子;
电解CuCl2溶液:阳离子是Cu2+在阴极得电子,阴离子就是Cl-在阳极失电子;1年前查看全部
- 电化学测量为何一般采用三电极体系?
 咏宝儿1年前1
咏宝儿1年前1 -
 hp_locust 共回答了16个问题
hp_locust 共回答了16个问题 |采纳率81.3%由于体系中有电流通过,产生了溶液电压降和对电极的极化,因此工作电极的电位难以准确测定,由此引入参比电极.参比电极有着非常稳定的电位,且电流不经过参比电极不会引起极化,从而工作电极的电位可以由参比电极得到,而电流由工作电极-辅助电极回路得到.
当体系中没有电流通过,工作电极的电位可以由对电极直接准确测定,因此可以用双电极体系.
由此可得,如果体系中没有电流通过,都可以用双电极体系.一旦有电流通过,要采用三电极体系,以同时测得工作电极的电位和电流.1年前查看全部
- 化学与生活息息相关,下列说法正确的是 A.XX化妆品从纯天然植物中提取,不含任何化学物质 B.自行车钢架生锈通常是电化学
化学与生活息息相关,下列说法正确的是
A.XX化妆品从纯天然植物中提取,不含任何化学物质 B.自行车钢架生锈通常是电化学腐蚀所致 C.淀粉、油脂和蛋白质都是高分子化合物 D.医用酒精的浓度通常是95%  网实1年前1
网实1年前1 -
 幸福还有一段路 共回答了22个问题
幸福还有一段路 共回答了22个问题 |采纳率86.4%B
1年前查看全部
- 某实验小组用以下几个实验装置探究电化学过程对金属与稀硫酸反应速率的影响,烧杯中都盛有稀H2SO4.
某实验小组用以下几个实验装置探究电化学过程对金属与稀硫酸反应速率的影响,烧杯中都盛有稀H2SO4.
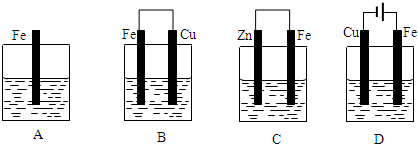
试回答:
(1)B装置中Cu电极上的电极反应式为______,D装置中Fe电极上的电极反应式为______.
(2)D装置中的实验现象有______,若用电流表测量反应时通过导线的电子流量为0.2mol,则Fe电极的质量变化为______.
(3)B、C两个装置中Fe片被腐蚀的速率更快的是______(填B或C). heenim351年前1
heenim351年前1 -
 大度从容 共回答了19个问题
大度从容 共回答了19个问题 |采纳率94.7%解题思路:(1)B装置是原电池,负极上失电子发生氧化反应,正极上得电子发生还原反应;D装置是电解池,阳极上电极材料失电子发生氧化反应,阴极上得电子发生还原反应;
(2)D装置是电解池,阳极材料是活泼电极,则阳极上金属电极失电子发生氧化反应,阴极上氢离子得电子发生还原反应,根据铁和转移电子之间的关系式计算;
(3)电化学腐蚀的速率大于化学腐蚀的速率,金属做原电池正极时得到保护,作原电池负极加快腐蚀,作电解池阳极腐蚀最快.(1)B装置是原电池,铜作正极,正极上氢离子得电子发生还原反应,电极反应式为:2H++2e-=H2↑;D装置是电解池,阳极上铁失电子发生氧化反应,电极反应式为:Fe-2e-=Fe2+;
故答案为:2H++2e-=H2;Fe-2e-=Fe2+;
(2)D装置是电解池,铁是活泼电极,电解池工作时,阳极上铁失电子发生氧化反应,阴极上氢离子得电子发生还原反应,所以看到的现象是:Fe电极不断溶解,Cu电极上有气体放出;当通过导线的电子流量为0.2mol,则Fe电极变化的质量=[0.2mol/2]×56g/mol=5.6g,所以阳极上铁的质量减少5.6g,
故答案为:Cu电极上有气泡,Fe电极逐渐溶解,溶液逐渐变为浅绿色;减小5.6g;
(3)B中铁比铜活泼,铁为负极,发生电化学腐蚀,C中锌比铁活泼,铁做原电池的正极而被保护,则腐蚀更快的为B,
故答案为:B.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池和电解池原理,题目难度不大,注意金属的电化学腐蚀与化学腐蚀的区别,以及比较金属腐蚀快慢的方法.1年前查看全部
- 电化学部分,会一个也行1.从硝酸根,硫酸根,氢离子,铜离子,钡离子,银离子,氯离子中选出适当的离子组成电解质,采用惰性电
电化学部分,会一个也行
1.从硝酸根,硫酸根,氢离子,铜离子,钡离子,银离子,氯离子中选出适当的离子组成电解质,采用惰性电极对其溶液进行水解.若两极分别放出气体,且体积比为1:1,电解质的化学式可能是( )
答案是HCL或BaCl2,为什么?
2.下列溶液导电性最强的是()
A.1L0.1mol/L醋酸 B.0.1L0.1mol/L硫酸溶液
C.0.5L0.1mol/L盐酸 D.2L0.1mol/LH3PO4溶液
答案是B不是D,为什么?
2题我弄懂了有没有会1题的? 小闹心的1年前3
小闹心的1年前3 -
 fly9820 共回答了18个问题
fly9820 共回答了18个问题 |采纳率88.9%2题,因为h3po4不是强酸,不完全电离,大部分仍以分子状态存在,因此选择B硫酸
1题采用惰性电极,电极不参与反应,从容液中可能存在的各种离子来看,只有在相当于电解氯化氢时产生的气体才有可能是1:1.因此阴离子必须是氯离子,而阳离子放电顺序必须是在氢后面的,也就是金属活动性顺序表在氢前面的,当然也包括氢,因此为hcl或bacl21年前查看全部
- 电化学中nanomountain是什么意思
 lxc1471年前1
lxc1471年前1 -
 江河166 共回答了15个问题
江河166 共回答了15个问题 |采纳率93.3%可能是纳米量1年前查看全部
- 电催化 电解氯化镁?常规的电解融融氯化镁才能产生金属镁,电解氯化镁溶液产生氢气 如果研究电化学催化剂,能不能在氯化镁溶液
电催化 电解氯化镁?
常规的电解融融氯化镁才能产生金属镁,电解氯化镁溶液产生氢气 如果研究电化学催化剂,能不能在氯化镁溶液中电解出金属镁?很傻的外行问题, liuwenrong1年前1
liuwenrong1年前1 -
 KEN_BAX 共回答了19个问题
KEN_BAX 共回答了19个问题 |采纳率94.7%氯化熔盐电解法包括氯化镁的生产及电解制镁两大过程.该方法又可分为以菱镁矿为原料的无水氯化镁电解法和以海水为原料制取无水氯化镁的电解法.其中后者最大的难点是如何去除MgCl2·6H2O中的结晶水.一般来说:采用普通的加热法可以去除部分结晶水,生成MgCl2·3/2H2O.但MgCl2·3/2H2O在空气中加热时很容易发生水解反应,生成不利于电解过程的杂质,如Mg(OH)2.电解法生产镁的工艺很多,但基本原理相同,其中最有代表性的有DOW工艺、I.G.Farben工艺、Magnola工艺等. 查看原帖1年前查看全部
- 铁生锈的5个方程式 理论上说是电化学方程式
 shiyilang12231年前4
shiyilang12231年前4 -
 baidu1909 共回答了17个问题
baidu1909 共回答了17个问题 |采纳率100%负极:2Fe-4e-===2Fe2+;
正极:O2+2H2O+4e-===4OH-;
电池反应:2Fe+O2+2H2O===2Fe(OH)2;
4Fe(OH)2+O2+2H2O===4Fe(OH)3;
2Fe(OH)3 ===Fe2O3·xH2O+(3-x)H2O.1年前查看全部
- 某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转.请回答下列问题:
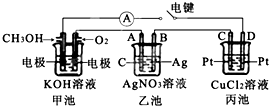 某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转.请回答下列问题:
某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转.请回答下列问题:
(1)甲池中通入CH3OH电极的电极反应为______.
(2)乙池中A(石墨)电极的名称为______(填“正极”、“负极”或“阴极”、“阳极”),乙池中总反应式为4AgNO3+2H2O
4Ag+O2↑+4HNO3通电 .4AgNO3+2H2O.
4Ag+O2↑+4HNO3通电 .
(3)当乙池中B极质量增加5.40g时,甲池中理论上消耗O2的体积为______mL(标准状况),丙池中______(填“C”或“D”)极析出______g铜. 霉酸1年前1
霉酸1年前1 -
 q1541 共回答了24个问题
q1541 共回答了24个问题 |采纳率75%解题思路:(1)甲池为原电池,燃料在负极失电子发生氧化还原反应在碱溶液中生成碳酸盐,结合电荷守恒写出电极反应;
(2)乙池是电解池,A为阳极,B为阴极,电池中是电解硝酸银溶液生成银,硝酸和氧气;
(3)乙池是电解池结合电子守恒计算消耗氧气的体积,丙为电解池C为阳极,D为阴极,电解氯化铜溶液铜离子在阴极得到电子析出铜.(1)甲池为原电池,燃料在负极失电子发生氧化还原反应在碱溶液中生成碳酸盐,甲池中通入CH3OH电极的电极反应为:CH3OH-6e-+8OH-═CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-═CO32-+6H2O;
(2)乙池是电解池,A为阳极,B为阴极,电池中是电解硝酸银溶液生成银,硝酸和氧气,电池反应为:4AgNO3+2H2O
通电
.
4Ag+O2↑+4HNO3,
故答案为:阳极;4AgNO3+2H2O
通电
.
4Ag+O2↑+4HNO3 ;
(3)当乙池中B极质量增加5.4g为Ag,物质的量=[5.4g/108g/mol]=0.05mol,依据电子守恒计算4Ag~O2~4e-,甲池中理论上消耗O2的体积=[0.05/4]mol×22,4L/mol=0.28L=280ml;丙为电解池C为阳极,D为阴极,电解氯化铜溶液铜离子在阴极得到电子析出铜,结合电子守恒计算2Ag~Cu~2e-,析出铜质量=[0.05/2]×64g/mol=1.6g;
故答案为:280;D;1.6.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池电解池的相互串联问题,注意首先区分原电池和电解池,题目难度中等.1年前查看全部
- 电化学知识是化学反应原理的重要部分,以下是常见的电化学装置:
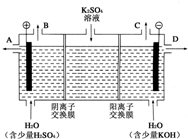 电化学知识是化学反应原理的重要部分,以下是常见的电化学装置:
电化学知识是化学反应原理的重要部分,以下是常见的电化学装置:
某兴趣小组同学模拟工业上用离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾.
①该电解槽阳极电极反应式为______.
②得到的氢氧化钾从______(填A,或D)排放出.若将得到的2L浓度为0.25mol/L的KOH溶液与2L0.025mol/L的硫酸溶液混合,混合后的溶液pH为______
③此时通过阴离子交换膜的离子数______(填大于,小于或等于)通过阳离子交换膜的离子数.
④若将制得的氢气、氧气和硫酸溶液组合为氢氧燃料电池,则电池正极的电极反应式为______. 爱上李清照1年前1
爱上李清照1年前1 -
 wf15 共回答了19个问题
wf15 共回答了19个问题 |采纳率78.9%解题思路:①电解时,溶液中的氢氧根离子的放电能力大于硫酸根离子的放电能力,阳极上失电子发生氧化反应;
②根据氢氧化钾生成的电极判断导出口;计算混合后氢氧根离子离子浓度,根据水的离子积常数计算氢离子浓度,求pH;
③根据阴阳离子的移动方向,通过相同电量时,阴阳离子交换的个数判断;
④燃料原电池中,正极上氧化剂得电子发生还原反应,写出相应的电极反应式,注意结合电解质溶液的酸碱性书写.①电解时,阳极上失电子发生氧化反应,溶液中的氢氧根离子的放电能力大于硫酸根离子的放电能力,所以阳极上氢氧根离子失电子生成水和氧气4OH--4e-=2H2O+O2↑,故答案为:4OH--4e-=2H2O+O2↑;
②电解时氢离子在阴极得电子生成氢气,则氢氧化钾在阴极生成,所以在D口导出;2L浓度为0.25mol/L的KOH溶液与2L0.025mol/L的硫酸溶液混合后,
c(OH-)=[2×0.25−2×0.025×2/2+2]=0.1,c(H+)=
1×10−14
0.1=10-13,pH=13,故答案为:D;13;
③阳极氢氧根离子放电,因此硫酸根离子向阳极移动,阴极氢离子放电,因此钠离子向阴极移动,所以通过相同电量时,通过阴离子交换膜的离子数小于通过阳离子交换膜的离子数;故答案为:小于;
④燃料原电池中,燃料在负极上失电子发生氧化反应,氧化剂在正极上得电子发生还原反应,该燃料原电池中,氧气是氧化剂,所以氧气在正极上得电子和氢离子结合生成水,电极反应式为4H++O2+4e-═2H2O,故答案为:4H++O2+4e-═2H2O.点评:
本题考点: 电解原理;原电池和电解池的工作原理.
考点点评: 本题考查了原电池和电解池原理,难度不大,注意燃料原电池电极反应式的书写时,要根据电解质溶液的酸碱性确定生成的离子或物质.1年前查看全部
- 高中电化学(关于盐桥原电池)我们在化学必修2中学原电池时,是两个电极同时插入一个电解质溶液中(使得活泼的金属与电解质溶液
高中电化学(关于盐桥原电池)
我们在化学必修2中学原电池时,是两个电极同时插入一个电解质溶液中(使得活泼的金属与电解质溶液接触从而发生氧化反应).但是在含有盐桥原电池中活泼电极与电解质溶液隔开,那么为什么还能产生电流呢.
可能是我忘了相关知识.也请大家回答时将一些基本原理也回答上.
有盐桥原电池中活泼电极与“可反应”电解质溶液隔开。加点字 伊-娃1年前2
伊-娃1年前2 -
 黄同乐hh 共回答了13个问题
黄同乐hh 共回答了13个问题 |采纳率92.3%这将会涉及到电势差的问题,在铜锌原电池中,利用盐桥时,分别形成外电路和内电路,这样就形成了一个闭合电路,虽然活泼金属与可反应溶液分开,在现有知识下开来时不反应的,但是在金属和溶液的接触面存在着电势差,在这种差值下,电子就有了流动的趋势,那么在闭合回路中就有了电子的运动,形成了电流,也就是构成了原电池.1年前查看全部
- 关于仪器分析电化学部分的疑问控制电位电解,溶液中被测离子浓度降低,电流下降,被测离子几乎完全析出后,电流趋近于零,我看不
关于仪器分析电化学部分的疑问
控制电位电解,溶液中被测离子浓度降低,电流下降,被测离子几乎完全析出后,电流趋近于零,我看不懂啊 幽-红色幽灵1年前1
幽-红色幽灵1年前1 -
 sunximeng 共回答了21个问题
sunximeng 共回答了21个问题 |采纳率81%电解溶液就是在溶液中通电使其发生化学反应,溶液能导电靠的是溶液中的离子,电解使离子逐步析出,也就是在溶液中的离子逐步减少,导电能力就越来越弱,电流就越来越小,最后被测离子几乎完全析出后,电流趋近于零,电解完成.1年前查看全部
- 电化学-电解溶液时,阴阳极得是电子的顺序
电化学-电解溶液时,阴阳极得是电子的顺序
麻烦说一下规律,做题时该怎么考虑
举一些常见离子 暮晚掠雨1年前1
暮晚掠雨1年前1 -
 sou777 共回答了23个问题
sou777 共回答了23个问题 |采纳率87%阳极:当电极为惰性电极(石墨或铂金)时,溶液中离子失电子
顺序:硫离子>碘离子>溴离子>氯离子>氢氧根
不是惰性电极的,电极金属失电子
阴极:溶液中离子得电子
顺序:银离子>3价铁离子>铜离子>2价铁离子>氢离子1年前查看全部
- 一个电化学填空在铁钉中部紧绕铜丝,放在含有K3【Fe(CN)6】和酚酞的冻胶里面.形成腐蚀电池.其中铜丝是( )级,电极
一个电化学填空
在铁钉中部紧绕铜丝,放在含有K3【Fe(CN)6】和酚酞的冻胶里面.形成腐蚀电池.其中铜丝是( )级,电极反应是( ),故铜丝附近出现()色.
铁钉是( )级,电极反应是( ),故铁钉附近出现()色,这是由于生成了()的原因 ncdaizf1年前1
ncdaizf1年前1 -
 猫猫袄 共回答了20个问题
猫猫袄 共回答了20个问题 |采纳率100%其中铜丝为阴极,其电极反应为:O2 + 2H2O + 4e- = 4OH- ,故铜丝附近显红色,铁钉为阳极,其电极反应为Fe - 2e- = Fe2+ ,铁钉附近显蓝绿色,这是由于生成了Fe3[Fe(CN)6]21年前查看全部
- 有关电化学三极与两极传感器电路对于两极电化学气体传感器,工作极WORKING,对电极COUNTER,进入的气体量越大,反
有关电化学三极与两极传感器电路
对于两极电化学气体传感器,工作极WORKING,对电极COUNTER,进入的气体量越大,反应越强烈,则电位差越大,电流越大;当气体浓度大到一定程度时,由于极化作用,两电极之间的电位差会缩小,使输出电流与气体浓度不能成线性关系;于是引入参考电极REFERENCE,可是引入参考电极后,只是把工作电极W的电位固定而已,当气体浓度变大时,工作电极W与对电极C之间照样会因极化作用缩小电位差,输出电流也不能与气体浓度成线性关系啊?为什么还要引入参考电极,说使测量范围变大?
谢谢! wu_di1年前1
wu_di1年前1 -
 wuxin3153 共回答了15个问题
wuxin3153 共回答了15个问题 |采纳率80%参考电极的作用是稳定电位,而不是减小极化反应.1年前查看全部
- 【求助】电化学过程中的活化能单位是怎样换算的
 小老鼠扮酷1年前1
小老鼠扮酷1年前1 -
 谈笑人生22 共回答了17个问题
谈笑人生22 共回答了17个问题 |采纳率88.2%电阻是和反应速率有点关系,主要是由于特定电压下的电流控制,即电流是速率.
所以你可以根据这个关系理清思路,电化学阻抗可是变化的啊,所以活化能的函数中包含好几个参数.细细想想,很有收获的.jlj0104(站内联系TA)我是从文献中看到的,他将阻抗谱中得到的随不同温度变化的欧姆阻抗和电极极化阻抗求对数后,分别以温度的倒数为函数得到的斜率就是单位为ev的活化能,怎么想我也想不清楚活化能是怎么得到的.zjqfree(站内联系TA)学习一下.skymahao(站内联系TA)学习了,窃听专家慢慢分解.D:Dliuruiphd(站内联系TA)学习一下哈哈nktornado(站内联系TA)电化学反应电阻和1/c可以求得速率常数.
lnk=A-G/RT公式不好写,没有准确表达.
就可以导出 lnR电阻转移阻抗正比于1/t,斜率和G有关,也就是和活化能有关.
Yamada H.,Shiku H.,M atsue T.et al..J.Phys.Chem.,1993,97:9547
这个文献是第一行的文献.第二行公式大家都知道.1年前查看全部
- (2014•临沂二模)下列有关四个电化学装置的叙述正确的是( )
(2014•临沂二模)下列有关四个电化学装置的叙述正确的是( )

A.图Ⅰ装置中MnO2作催化剂
B.图Ⅱ装置工作一段时间后,滴加少量K3[Fe(CN)6]溶液,无明显现象
C.图Ⅲ装置中Cu作阳极,为电解液提供Cu2+,保持溶液中Cu2+浓度恒定
D.图Ⅳ装置工作时,为平衡电荷,a烧杯中的Zn2+经盐桥移向b烧杯中 mywebpage1年前1
mywebpage1年前1 -
 hougao 共回答了15个问题
hougao 共回答了15个问题 |采纳率86.7%解题思路:A.二氧化锰作正极;
B.形成原电池反应,铁为负极,被氧化生成Fe2+;
C.为电镀装置,电解液浓度不变;
D.锌为负极,盐桥中阴离子向a移动,阳离子向b移动.A.该电池反应中二氧化锰得到电子被还原,为原电池的正极,故A错误;
B.形成原电池反应,铁为负极,被氧化生成Fe2+,滴加少量K3[Fe(CN)6]溶液,生成蓝色沉淀,故B错误;
C.为电镀装置,电解液浓度不变,故C正确;
D.锌为负极,盐桥中阴离子向a移动,阳离子向b移动,故D错误.
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池和电解池原理,为高频考点,侧重于学生的分析能力的考查,明确电极上发生的反应是解本题关键,难度不大.1年前查看全部
- 下列有关电化学知识的叙述正确的是( ) A.原电池中,溶液中的阴离子向正极移动 B.电解法提纯铜时,一定用纯铜作阴极
下列有关电化学知识的叙述正确的是( )
A.原电池中,溶液中的阴离子向正极移动 B.电解法提纯铜时,一定用纯铜作阴极 C.电解池中,阳极本身一定不参加反应 D.电解池工作时,阳极上不一定析出物质  幸福村的不幸福哦1年前1
幸福村的不幸福哦1年前1 -
 wang_god 共回答了22个问题
wang_god 共回答了22个问题 |采纳率72.7%BD
原电池中,阴离子移向负极,阳离子移向正极;电解池中,如果阳极是活泼金属,那么阳极就参加反应;电解池工作时,阳极上可能有物质析出,如Cl - 放电生成Cl 2 ,也可能没有物质析出。1年前查看全部
- 大学无机化学题 电化学部分Fe的元素电势图为 FeO4 2- 1.9V Fe3
大学无机化学题 电化学部分

Fe的元素电势图为 FeO4 2- 1.9V Fe3+ 0.771V Fe2+ -0.414V Fe
(1)问酸性溶液中Fe3+ 能否将过氧化氢 氧化为氧气
已知O2+2H+ +2e =H2O2 &=0.682v
(2)计算下列反应应得平衡常(酸性溶液,298K) Fe(s)+2Fe3+(aq)=3Fe2+(aq)
 linlin78781年前2
linlin78781年前2 -
 xll_1122 共回答了16个问题
xll_1122 共回答了16个问题 |采纳率87.5%(1)能将过氧化氢氧化为氧气
原因如下:
三价铁与过氧化氢的反应,全反应式为:
4Fe3+ + 2H2O2 ----》 4Fe2+ + 2O2 + 4H+
该反应可以分为两个半反应,分别为:
Fe3+ + e- ---》 Fe2+ 依题意,φ = +0.77
O2 + 2H+ + 2e- ---》 H2O2 依题意,φ = +0.682
另有全反应的自由能量G= - vFφ (F为法拉第常数,v为移动电荷数)
自由能量为负时,反应会自发发生
又,全反应 φ的变化为两个半反应的 φ的差
此题中,该差为正数,全反应自由能量为负,反应自发进行.
(2)⊿G=-RTlnK= -vFφ
可得K=exp(-⊿G/RT) = exp(vFφ/RT)
全反応式:Fe + 2Fe3+ ----> 3Fe2+ + H2
半反応式分别为:
Fe3+ + e- ----> Fe2+ φ= +0.771
Fe2+ + H2 ----> Fe + 2H+ φ= -0.414
半反应的上式减下式即得到全反应式.
所以该反应全反应的φ为+0.771-(-0.414)= 1.185
另外,反应中有两个三价铁,每个三价铁对应一个电荷移动,所以电荷移动数为2,即v=2
法拉第常数为F= 96.485 kC/mol
所以K= exp(2 * 96.485 kC/mol * 1000/k * 1.185 V/ (8.3145 J/Kmol * 298 K))
另外,1J = 1CV,
上式可以计算得出K=1.2054 * 10^401年前查看全部
大家在问
- 1行测资料分析题2008年上半年,我国出口额6666亿美元,同比增长21.9%,增速同比回落5.7个百分点。问:2008年
- 2当a小于0时,a与-a的关系为?
- 31952年,美国科学家______设置了模拟原始大气环境的装置.实验中采用______模拟原始地球上的闪电,输入早期地球
- 4April is the eight month of the the year.中间有错的是那个词
- 5He will be watching her anxiously _______ she swims the long
- 6酒精分子和水分子比哪个体积更大
- 7空中的鸟!何必和笼里的同伴争噪呢?你自由你的天地.进行仿写一首小诗
- 8七年级学生小丹在乘公交车回家的时候,看见一名扒手正在偷一位乘客的钱包。面对这种情况,小丹的正确做法是 [
- 9单选题We are all for your proposal that the discussion.
- 10实数的运算按照如下顺序进行:先算____,然后算____,最后算____
- 11‘好好享受在一起的时间’用英文甚么说?
- 12在图像处理中 为什么说图像的能量主要集中在低频区域?
- 13这幅图表示的是什么成语,注意要有下面的字!必须是由下面的字组成的成语,是四个字的成语!
- 14在同一钟面上,当时针针尖移动1厘米时,分针移动12厘米.______.(判断对错)
- 15师徒两人共加工一批零件,已知徒弟做了五分之二,比师傅少做100个.这批零件一共有多少个?
