求氧化剂 还原剂物质的量比3no2+h2o=2hno3+no8nh3+3cl2=6nh4cl+n2
 zhang1681982022-10-04 11:39:542条回答
zhang1681982022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 忘了隐藏001 共回答了17个问题
忘了隐藏001 共回答了17个问题 |采纳率88.2%- 1.NO2中的氮元素是+4价,HNO3中的氮元素是+5价,NO中的氮元素是+2价
NO2既是氧化物又是还原物,所以3molNO2中有2mol发生氧化反应,是还原剂.1mol发生还原反应,是氧化剂.所以氧化剂与还原剂物质的量比为1:2 .
2.N由NH3中的-3价变为N2中的0价,是还原剂,8mol中有2mol NH3参与氧化反应,Cl2由Cl2中的0价变为NH4Cl中的-1价,是氧化剂,所以氧化剂与还原剂物质的量比为3:2. - 1年前
 三围很棒的螃蟹 共回答了364个问题
三围很棒的螃蟹 共回答了364个问题 |采纳率- 1. 2:1
2. 3:2 - 1年前
相关推荐
- 常温下,在溶液中可以发生反应:X+2Y3+=2Y2++X2+,则下列叙述①X被氧化;②X是氧化剂;③X具有还原性;④Y2
常温下,在溶液中可以发生反应:X+2Y3+=2Y2++X2+,则下列叙述①X被氧化;②X是氧化剂;③X具有还原性;④Y2+是氧化产物;⑤Y2+具有还原性;⑥Y3+的氧化性比X2+的氧化性强。以下叙述中正确的是
A. ①③⑤⑥ B. ①③④ C. ②④⑥ D. ②⑤ tz_jxm1年前2
tz_jxm1年前2 -
 lvmz12 共回答了52个问题
lvmz12 共回答了52个问题 |采纳率38.5%A1年前查看全部
- 在Mg+2HCl=MgCl+H2|中,氧化剂是
在Mg+2HCl=MgCl+H2|中,氧化剂是
在Mg+2HCl=MgCl+H2→中,氧化剂是 ,还原剂是 ,氧化产物是 ,还原产物是 ,元素被氧化,若消耗2molMg,则在标准状况下生成H2的体积是 ,转移的电子数是 . 俺是夜猫子1年前1
俺是夜猫子1年前1 -
 夜光吻杯 共回答了19个问题
夜光吻杯 共回答了19个问题 |采纳率94.7%HCl Mg MgCl2是氧化产物,H2是还原产物
Mg 44.8L 4NA1年前查看全部
- 氧化剂和还原剂换底公式log3^6/llog3^2能不能直接写成log3^6—log3^2
 884299741年前2
884299741年前2 -
 rn002sunan 共回答了21个问题
rn002sunan 共回答了21个问题 |采纳率85.7%不可以.因为 logA+logB=logA*B.logA-logB=logA/B.而logA/logB是无法简化的.这个式子log3^6/log3^2倒是可以这样简化:6log3/2log3=31年前查看全部
- 发射宇宙飞船的火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水(H2O2),当它们混合时,即产生大量的氮气
发射宇宙飞船的火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水(H2O2),当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热,写出该反应的化学方程式______,该反应用于火箭推进器的优点是______.
 臻锋1年前3
臻锋1年前3 -
 liuliju 共回答了20个问题
liuliju 共回答了20个问题 |采纳率85%解题思路:根据偏二甲肼和双氧水反应水生成氮气和水蒸气进行分析;根据化学方程式所表现出的信息进行分析第二个空.液态肼和过氧化氢反应会生成水蒸气和氮气,故答案为:N2H4+2H2O2=4H2O↑+N2↑
因为从液态肼和双氧水反应的化学方程式可以看出,生成物只有水和氮气,不会造成粉尘等污染,故答案为:产物无污染.
故答案为:N2H4+2H2O2=4H2O↑+N2↑;产物无污染.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查学生对所学知识在特殊环境下的应用.学生需充分考虑特定因素,才能正确答题.1年前查看全部
- h2o2作氧化剂一定会生成o2?
 oo龄1年前1
oo龄1年前1 -
 SkyPine 共回答了12个问题
SkyPine 共回答了12个问题 |采纳率91.7%不一定,比如:
H2O2+SO2=H2SO41年前查看全部
- 双氧水(H 2 O 2 )既是工业上重要的绿色氧化剂,又是常用的医用消毒剂.
双氧水(H 2 O 2 )既是工业上重要的绿色氧化剂,又是常用的医用消毒剂.
(1)小明配制了5%的双氧水600g,则600g溶液中溶质为______克,溶剂为______克.
(2)小明倒出了300g双氧水溶液进行消毒,则剩下的溶液中溶质的质量分数为______. 上只角小开1年前1
上只角小开1年前1 -
 小言不分 共回答了28个问题
小言不分 共回答了28个问题 |采纳率82.1%(1)溶质=溶液的质量×溶液中溶质的质量分数=600g×5%=30g;溶剂=溶液-溶质=600g-30g=570g
(2)溶液具有均一性,所以剩下的溶液中的溶质质量分数不变.
故答案:(1)30;570;(2)5%1年前查看全部
- 什么时候必须要加入氧化剂或者还原剂这种题目,还不是很会.比如:下列变化一定需要加入氧化剂才能进行的是 A cu²+→CU
什么时候必须要加入氧化剂或者还原剂这种题目,还不是很会.比如:下列变化一定需要加入氧化剂才能进行的是 A cu²+→CU B HCO3失一个电子→co2 C cl2→clo失一个电子 D NA→NA得一个电子 请把思考过程写出来.
 巧克力shiro1年前1
巧克力shiro1年前1 -
 yearnyang 共回答了19个问题
yearnyang 共回答了19个问题 |采纳率94.7%需要加入氧化剂,氧化剂得电子,而选项要失电子才行,失电子价态升高,所以你得找选项中有价态升高的C
氧化还原反应中有得必有失,价态有高比有降,简单记:
高---- ---失--- -氧
(价态) 被氧化
低------得 -还1年前查看全部
- H2S和SO2反应中,SO2是氧化剂吗
 仓木牌小毛衣1年前3
仓木牌小毛衣1年前3 -
 bybwkj 共回答了19个问题
bybwkj 共回答了19个问题 |采纳率94.7%SO2的化合价由+4到0,说明它被还原,所以是氧化剂.1年前查看全部
- 下列变化中,需要加入氧化剂才能实现的是( )
下列变化中,需要加入氧化剂才能实现的是( )
A.HCl→H2
B.CO→CO2
C.MnO4-→Mn2+
D.FeCl3→FeCl2 hmily001年前1
hmily001年前1 -
 哀之伤 共回答了18个问题
哀之伤 共回答了18个问题 |采纳率72.2%解题思路:需要加入氧化剂才能实现,则选项中为还原剂的氧化反应,还原剂中某元素的化合价升高,以此来解答.A.HCl→H2中,H元素的化合价降低,需要加还原剂才能实现,故A错误;
B.CO→CO2中,C元素的化合价升高,需要加氧化剂才能实现,故B正确;
C.MnO4-→Mn2+中,Mn元素的化合价降低,加还原剂可实现,故C错误;
D.FeCl3→FeCl2中,Fe元素的化合价降低,需要加还原剂才能实现,故D错误;
故选B.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高考常见题型,明确选项中元素的化合价变化即可解答,注意还原剂中元素的化合价升高为解答的关键,题目难度中等.1年前查看全部
- 氧化剂最好选用H2O2,理由是什么?
 疋玄1年前4
疋玄1年前4 -
 波168 共回答了20个问题
波168 共回答了20个问题 |采纳率75%应该有其他条件把不可能直接这么问问你.
用H2O2做氧化剂的好处倒是很多.
第一反应条件温和.用H2O2的水溶液就是双氧水常温下就可以有比较强的氧化性.
第二是产物环保.H2O2转变成水,相比中学常见的其他强氧化剂来说,产物环保,分离也方便.
第三就是对于这个反应H2O2的氧化性正好,不会在过量情况下将碘反应至高价态.1年前查看全部
- 比碘氧化性强的氧化剂把铁氧化到+3价,是不是所有的比碘氧化性强的都会这样
 O赵剑O1年前2
O赵剑O1年前2 -
 谁能yyyy 共回答了15个问题
谁能yyyy 共回答了15个问题 |采纳率73.3%比碘氧化性强的的氧化剂不一定都能把铁氧化到+3价,比碘氧化性要强到足以把铁氧化到+3价才行,要以实验为根据.1年前查看全部
- 常见氧化剂和还原剂1常见氧化剂:(1)活泼的非金属单质(2)含高价元素的含氧酸(3)含高价元素的盐(4)含高价元素的氧化
常见氧化剂和还原剂
1常见氧化剂:(1)活泼的非金属单质(2)含高价元素的含氧酸(3)含高价元素的盐(4)含高价元素的氧化物(5)过氧化物;2常见的还原剂(1)活泼的金属单质(2)某些非金属单质(3)元素处于低价态物质…各举三例哈,谢谢大家~
 黑玫瑰01年前1
黑玫瑰01年前1 -
 dy787mbf 共回答了18个问题
dy787mbf 共回答了18个问题 |采纳率72.2%1.)Br2、F2、Cl2; 2.)HClO、HCLO、浓硝酸 3.)KMnO4、NH4NO3、KNO3
4.)MnO2、SO3
5)H2O2、金属过氧化物
1)K、Na、Li
2)c、Si、H2
3)so2、co、No
我是学化学的,应该都对吧,嘻1年前查看全部
- 为什么说强氧化剂将HCL中的CL-氧化成CL2,还原成不可以吗
 linlin74001年前1
linlin74001年前1 -
 fanano 共回答了15个问题
fanano 共回答了15个问题 |采纳率93.3%不可以,氯化合价升高,被氧化1年前查看全部
- 氧化剂具有氧化性还是还原性,分别说明氧化剂还原剂,氧化性还原性是什么?
 karl19881311年前1
karl19881311年前1 -
 joanna_0080151 共回答了15个问题
joanna_0080151 共回答了15个问题 |采纳率100%一个诀窍; 失升还被氧化 得降氧被还原
解;失电子化合价上升具有还原性被氧化是还原剂
你自己推下一句!加油!1年前查看全部
- 如何判断化学反应中什么物质是氧化剂或是还原剂
 迎柳豆豆1年前4
迎柳豆豆1年前4 -
 wanghuachong666 共回答了25个问题
wanghuachong666 共回答了25个问题 |采纳率88%要判断物质是否是氧化剂或还原剂,前提要在氧化还原反应中
氧化物被还原,得到电子,化合价下降,发生还原反应,得到还原产物
还原剂被氧化,失去电子,化合价上升,发生氧化反应,得到氧化产物
例如:C+O2=点燃=CO2,其中C为还原剂,因为它从0到+2,O2为氧化剂,因为它从0到-21年前查看全部
- 高锰酸钾(KMnO 4 )是一种常用的氧化剂。
高锰酸钾(kmno 4 )是一种常用的氧化剂。
i.(1)有下列变化: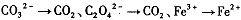 ,找出其中一个变化与“
,找出其中一个变化与“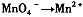 ”组成一个反应,写出该反应的离子方程式____ 。
”组成一个反应,写出该反应的离子方程式____ 。
(2)不同条件下高锰酸钾可发生如下反应: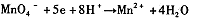
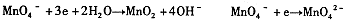 由此可知,高锰酸根离子(mno — 4 )反应后的产物与 有关。
由此可知,高锰酸根离子(mno — 4 )反应后的产物与 有关。
(3)高锰酸钾溶液与硫化亚铁有如下反应:
若上述反应前后固体的质量减少了2.8g,则硫元素与kmno 4 之间发生电子转移的数目为 个。
Ⅱ.酒后驾车已成为一个***问题。检测驾驶人员呼气中酒精浓度(brac)的方法有多种。
(4)早期是利用检测试剂颜色变化定性判断brac,曾用如下反应检测brac:
完成并配平上述反应。
(5)受上述方法启发,后来用五氧化二碘的淀粉溶液检测brac,乙醇被氧化为乙醛,该反应的化学方程式为____。 TheEyeOfDay1年前1
TheEyeOfDay1年前1 -
 风云慕 共回答了18个问题
风云慕 共回答了18个问题 |采纳率83.3%14分
⑴2MnO 4 - +16H + +5C 2 O 4 2- =2Mn 2+ +10CO 2 ↑+8H 2 O (3分)
⑵溶液酸碱性 (2分)
⑶0.1N A (6.02×10 22 ) (3分)
⑷3CH 3 CH 2 OH+2KMnO 4 =3CH 3 CHO+2MnO 2 +2KOH+2H 2 O (3分)
⑸I 2 O 5 +5 CH 3 CH 2 OH→I 2 +5CH 3 CHO+5H 2 O (3分)
1年前查看全部
- 下列反应哪些是氧化还原反应?哪些不是?是氧化还原反应的,指出哪些物质是氧化剂?哪些物质是还原剂?
下列反应哪些是氧化还原反应?哪些不是?是氧化还原反应的,指出哪些物质是氧化剂?哪些物质是还原剂?
(1)H3PO4+2NaOH=NaHP4+2H2O
(2)HgCL2+2NaO=HgO+H2O+2NaCL
(3)Cu+HgCL2=CuCL2+Hg
(4)2FeCL3+SnCL2=2FeCL2+SnCL4
(5)4NH3+5O2=Pt=4NO+6H2O
麻烦各位将化合价的变化,是什么反应写清楚点! javehtp1年前2
javehtp1年前2 -
 wqj1008 共回答了13个问题
wqj1008 共回答了13个问题 |采纳率92.3%判断是不是氧化还原反应要从是否有化合价升降着手,有化合价升降的就是氧化还原反应.而氧化剂的化合价会降低,还原剂的化合价会升高.
1、没有化合价升降,不是氧化还原反应;
2、没有化合价升降,不是氧化还原反应;
3、铜从0价升高到+2价,汞从+2价降低到0价,所以是氧化还原反应,还原剂Cu,氧化剂HgCl2;
4、铁从+3价降低到+2价,锡从+2价升高到+4价,所以是氧化还原反应,其中还原剂SnCl2,氧化剂FeCl3;
5、氮元素从-3价升高到+2价,氧元素从0价降低到-2价,所以是氧化还原反应,其中还原剂NH3;氧化剂O2;1年前查看全部
- SO2做氧化剂和作还原剂的方程式,越多越好
 zsp10061年前1
zsp10061年前1 -
 zz好多哦 共回答了15个问题
zz好多哦 共回答了15个问题 |采纳率86.7%so2+h2s=s+h2o
kmno4+so2+h2so4=k2so4+mnso4+h2o1年前查看全部
- (14分)(1)火箭发射时可用肼(N 2 H 4 )为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。已知:N
(14分)
(1)火箭发射时可用肼(N 2 H 4 )为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。
已知:N 2 (g) + 2O 2 (g)= 2NO 2 (g)△H =" +67.7" kJ/mol;
N 2 H 4 (g)+ O 2 (g)=N 2 (g)+2H 2 O(g) △H=-534 kJ/mol
则N 2 H 4 和NO 2 反应生成氮气和水蒸气的热化学方程式为__________________ 。
(2)已知:常温下0.1mol/L的某酸H 2 A的pH=4,则该酸为 酸(填“强”或“弱”), H 2 A的电离方程式为 ,该溶液中由水电离出的c(H + )= 。
(3)一定温度下,两种酸:a、盐酸 b、醋酸:
①当两种酸的物质的量浓度相同时,c(H + ):a b(填“>”、“<”或“=”,下同)。
②在pH相同、体积相同的两种酸溶液中加入过量的铁粉,反应结束时生成H 2 的总体积:a b。
③将pH相同,体积相同的两种酸溶液分别加水稀释100倍,所得溶液的pH值:a b 你为什么要哭1年前0
你为什么要哭1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 用盐酸与硫脲可以直接浸金吗?如果不行加什么氧化剂可以溶解金?
 zhujiaguo21601年前2
zhujiaguo21601年前2 -
 m72fca 共回答了7个问题
m72fca 共回答了7个问题 |采纳率100%硫脲能溶解三氯化金,盐酸能使三氯化金形成氯金酸.王水可以,氰化钠也可以.一般化验用王水,工业生产用氰化钠1年前查看全部
- 还原剂为什么发生氧化反应.氧化剂量为什么发生还原反应?
 ndpbln1年前6
ndpbln1年前6 -
 艾城故事 共回答了26个问题
艾城故事 共回答了26个问题 |采纳率100%物质失电子的作用叫氧化反应;得电子的作用叫还原.狭义的氧化指物质与氧化合;还原指物质失去氧的作用.氧化时氧化值升高;还原时氧化值降低.氧化、还原都指反应物(分子、离子或原子).氧化也称氧化作用或氧化反应.
还原剂:在氧化还原反应里,失去电子或有电子对偏离的物质.还原剂失去电子自身被氧化变成氧化产物,如用氢气还原氧化铜的反应,氢气失去电子被氧化变成水.还原剂在反应里表现还原性.还原能力强弱是还原剂失电子能力的强弱,如钠原子失电子数目比铝电子少,钠原子的还原能力比铝原子强.含有容易失去电子的元素的物质常用作还原剂,在分析具体反应时,常用元素化合价的升降进行判断:所含元素化合价升高的物质为还原剂.
氧化剂:氧化还原反应里得到电子或有电子对偏向的物质.氧化剂从还原剂处得到电子自身被还原变成还原产物.氧化剂和还原剂是相互依存的.1年前查看全部
- 盐酸在做反应物时,既做氧化剂,又做还原剂的化学反应式
 绮萃1年前2
绮萃1年前2 -
 hcg2 共回答了27个问题
hcg2 共回答了27个问题 |采纳率85.2%2HCl=通电=H2↑+Cl2↑1年前查看全部
- 下列反应中,CO2作氧化剂的是( )
下列反应中,CO2作氧化剂的是( )
A.H2O+CO2═H2CO3
B.CO2+C
2CO高温 .
C.C+2CuO
2Cu+CO2↑高温 .
D.CaCO3+2HCl═CaCl2+CO2↑+H2O hxm718141年前1
hxm718141年前1 -
 兰叶葳蕤秋自华 共回答了13个问题
兰叶葳蕤秋自华 共回答了13个问题 |采纳率84.6%解题思路:CO2作氧化剂,则反应中C元素的化合价降低,以此来解答.A.没有元素的化合价变化,为非氧化还原反应,故A不选;
B.CO2中C元素的化合价降低,则作氧化剂,故B选;
C.CO2为生成物,不作氧化剂,故C不选;
D.没有元素的化合价变化,为非氧化还原反应,故D不选;
故选B.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化剂判断的考查,题目难度不大.1年前查看全部
- 下列氧化还原反应中,水作为氧化剂的是 A.2F 2 +2H 2 O=4HF+O 2 B.Cl 2 +H 2 O=HClO
下列氧化还原反应中,水作为氧化剂的是
A.2F 2 +2H 2 O=4HF+O 2 B.Cl 2 +H 2 O=HClO+HCl C.2Na 2 O 2 +2H 2 O=4NaOH+O 2 ↑ D.CO+H 2 O  CO 2 +H 2
CO 2 +H 2  cqf11nec1年前1
cqf11nec1年前1 -
 瑟瑟男追一 共回答了18个问题
瑟瑟男追一 共回答了18个问题 |采纳率88.9%D
正确答案:D
A水作还原剂;B水即不作还原剂,也不作氧化剂;C、水即不作还原剂,也不作氧化剂;D、水作为氧化剂。1年前查看全部
- 下列反应属于氧化还原反应,且水既不是氧化剂又不是还原剂的是( )
下列反应属于氧化还原反应,且水既不是氧化剂又不是还原剂的是( )
A.2Na+2H2O=2NaOH+H2↑
B.2F2+2H2O=4HF+O2↑
C.CaO+H2O=Ca(OH)2
D.Cl2+H2O=HCl+HClO 五脚猪A1年前1
五脚猪A1年前1 -
 chenkongdefeng 共回答了21个问题
chenkongdefeng 共回答了21个问题 |采纳率95.2%解题思路:含元素化合价变化的反应为氧化还原反应,水既不是氧化剂又不是还原剂,则水中H、O元素的化合价不变,以此来解答.A.水中H元素的化合价降低,水为氧化剂,故A不选;
B.水中O元素的化合价升高,水为还原剂,故B不选;
C.没有元素的化合价变化,不属于氧化还原反应,故C不选;
D.只有Cl元素的化合价变化,为氧化还原反应,且水既不是氧化剂又不是还原剂,故D选;
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化剂、还原剂判断的考查,注意从化合价角度分析,题目难度中等.1年前查看全部
- 关于氧化还原反应的化学题过氧化钠和水反应生成氢氧化钠和氧气,在这个反应中,水的作用是什么?是氧化剂还是还原剂?还是什么都
关于氧化还原反应的化学题
过氧化钠和水反应生成氢氧化钠和氧气,在这个反应中,水的作用是什么?是氧化剂还是还原剂?还是什么都不做? 看图1年前3
看图1年前3 -
 fangkangzhen 共回答了12个问题
fangkangzhen 共回答了12个问题 |采纳率83.3%什么都不做.它的反应原理是:过氧化钠和水反应生成双氧水和氢氧化钠,然后双氧水再分解生成氧气1年前查看全部
- 过氧化钠和二氧化碳反应,氧化剂和还原剂分别是什么拜托各位了 3Q
 zsscool1年前1
zsscool1年前1 -
 悲伤的苹果 共回答了20个问题
悲伤的苹果 共回答了20个问题 |采纳率85%氧化剂和还原剂都是过氧化钠,这是个歧化反应
满意请采纳1年前查看全部
- 在氧化还原反应3S+6KOH=K2SO3+2K2S+3H2O中,氧化剂和还原剂的物质的量之比为( )
在氧化还原反应3S+6KOH=K2SO3+2K2S+3H2O中,氧化剂和还原剂的物质的量之比为( )
A.1:2
B.2:1
C.1:1
D.3:2 zy123zy1年前1
zy123zy1年前1 -
 世界的人 共回答了18个问题
世界的人 共回答了18个问题 |采纳率100%解题思路:在3S+6KOH=K2SO3+2K2S+3H2O反应中,S元素化合价分别由0价升高为+4价,被氧化,降低为-2价,被还原,反应中硫既作氧化剂又作还原剂,根据还原产物与氧化产物的化学计量数进行判断.在3S+6KOH=2K2S+K2SO3+3H2O反应中,硫元素化合价由0价升高为+4价,被氧化,氧化产物为K2SO3,硫元素由0价降低为-2价,被还原,还原产物为K2S,所以硫既作氧化剂又作还原剂,氧化剂被还原生成还原产物,还原剂被氧化生成氧化产物,根据还原产物与氧化产物的化学计量数可知,氧化剂和还原剂的物质的量之比为2:1,
故选B.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应概念与计算,侧重于学生的分析能力和计算能力的考查,为高频考点,难度不大,根据化合价判断氧化剂与还原剂、还原产物与氧化产物是关键,判断后也可根据电子转移守恒计算氧化剂与还原剂的物质的量之比.1年前查看全部
- 在下列各氧化还原反应中,水既不作氧化剂,也不作还原剂的是( )
在下列各氧化还原反应中,水既不作氧化剂,也不作还原剂的是( )
A.2F2+2H2O=4HF+O2
B.C+H2O
CO+H2△ .
C.2Na+2H2O=2NaOH+H2↑
D.Cl2+H2O=HCl+HClO 心肝宝贝是我1年前1
心肝宝贝是我1年前1 -
 大ll007 共回答了13个问题
大ll007 共回答了13个问题 |采纳率100%解题思路:H2O中H元素的化合价为+1价,O元素的化合价为-2价,如水既不是氧化剂也不是还原剂,则H和O的化合价不变化.A.反应中O的化合价升高,水为还原剂,故A错误;
B.反应中,水中H元素的化合价降低,则水作氧化剂,故B错误;
C.反应中,水中H元素的化合价降低,则水作氧化剂,故C错误;
D.反应中,水中H和O元素的化合价不变,所以水既不作氧化剂又不作还原剂,故D正确;
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应及氧化还原反应中水的作用,明确元素的化合价变化是解答的关键,难度不大.1年前查看全部
- (2011•重庆)臭氧是一种强氧化剂,常用于消毒、灭菌等.
 (2011•重庆)臭氧是一种强氧化剂,常用于消毒、灭菌等.
(2011•重庆)臭氧是一种强氧化剂,常用于消毒、灭菌等.
(1)O3与KI溶液反应生成的两种单质是______和______.(填分子式)
(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示.已知:O3的起始浓度为0.0216mol/L.
①pH增大能加速O3分解,表明对O3分解起催化作用的是______.pH
t/min
T/℃3.0 4.0 5.0 6.0 20 301 231 169 58 30 158 108 48 15 50 31 26 15 7
②在30℃、pH=4.0条件下,O3的分解速率为______mol/(L•min);
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为______.(填字母代号)
a. 40℃、pH=3.0 b. 10℃、pH=4.0 c. 30℃、pH=7.0
(3)O3可由臭氧发生器(原理如图)电解稀硫酸制得.
①图中阴极为______(填“A”或“B”),其电极反应式为______.
②若C处通入O2,则A极的电极反应式为______.
③若C处不通入O2,D、E处分别收集到x L和y L气体(标准状况),则E处收集的气体中O3所占的体积分数为[x−2y/y][x−2y/y](忽略O3的分解). 跟着小孩混1年前1
跟着小孩混1年前1 -
 gz_xiaoliang 共回答了19个问题
gz_xiaoliang 共回答了19个问题 |采纳率84.2%解题思路:(1)O3与KI溶液反应生成的两种单质只能为O2、I2;
(2)①pH增大,则OH-浓度增大;
②根据v=[△c/t]计算;
③根据pH和温度判断达到平衡所用的时间的范围,可判断分解速率;
(3))①由图可知,B极生成O2、O3,B极反应氧化反应,电解池阳极发生氧化反应,故A为阴极;
②C处通入O2,O2发生还原反应,在酸性条件下生成水;
③若C处不通入O2,实质为电解水,D处为氢气,体积为x L,E处为氧气、臭氧,体积共为yL,令臭氧的体积为ZL,利用电子转移守恒列放出计算Z的值,再根据体积分数定义计算.(1)O3与KI溶液反应生成的两种单质只能为O2、I2,故答案为:O2;I2;
(2)①pH增大,则OH-浓度增大,pH增大能加速O3分解,表明对O3分解起催化作用的是OH-,故答案为:OH-;
②v=[△c/t]=[0.0108mol/L/108min]=1.00×10-4mol/(L•min),故答案为:1.00×10-4;
③由表中数据可知,40°C、pH=3.0时,所需时间在31min~158min之间;
10°C、pH=4.0时,所需时间>231min;
30°C、pH=7.0时,所需时间<15min,则分解速率依次增大的顺序为b、a、c,
故答案为:b、a、c.
(3))①由图可知,B极生成O2、O3,B极反应氧化反应,电解池阳极发生氧化反应,故A为阴极,电极反应为2H++2e-═H2↑;
故答案为:A;2H++2e-═H2↑;
②C处通入O2,O2发生还原反应,在酸性条件下生成水,电极反应式为O2+4H++4e-=2H2O,故答案为:O2+4H++4e-=2H2O.
③若C处不通入O2,实质为电解水,D处为氢气,体积为x L,E处为氧气、臭氧,体积共为y L,令臭氧的体积为ZL,根据电子转移守恒有
x×2=Z×3×2+(y-Z)×2×2,解得Z=x-2y,所以E处收集的气体中O3所占的体积分数为[x−2y/y],
故答案为:[x−2y/y].点评:
本题考点: 臭氧;反应速率的定量表示方法;化学反应速率的影响因素;电解原理.
考点点评: 本题考查化学反应速率的影响因素的实验探究,原电池与电解池反应原理,题目难度中等,本题注意对表中数据的分析和处理.1年前查看全部
- 下列叙述正确的是( )A. 元素的单质一定由氧化或还原该元素的化合物制得B. 在化学反应中,得电子越多的氧化剂,其氧化
下列叙述正确的是( )
A. 元素的单质一定由氧化或还原该元素的化合物制得
B. 在化学反应中,得电子越多的氧化剂,其氧化性就越强
C. 阳离子只能得到电子被还原,阴离子只能失去电子被氧化
D. 含有最高价元素的化合物不一定具有很强的氧化性 舞珞1年前4
舞珞1年前4 -
 cathy0517 共回答了22个问题
cathy0517 共回答了22个问题 |采纳率95.5%解题思路:A.不活泼金属元素的单质可由自然界直接得到;
B.氧化性的强弱与得电子的难易程度有关,与数目无关;
C.处于中间价态的离子既能被氧化又能被还原;
D.一般含最高价元素的化合物具有很强的氧化性.A.大多数元素的单质由氧化或还原该元素的化合物制得,但不活泼金属元素的单质可由自然界直接得到,故A错误;
B.氧化性的强弱与得电子的难易程度有关,则在化学反应中,得电子越多的氧化剂,其氧化性不一定强,故B错误;
C.处于中间价态的离子既能被氧化又能被还原,如Fe2+、SO32-等,故C错误;
D.一般含最高价元素的化合物具有很强的氧化性,如高锰酸钾、硝酸等,但二氧化碳不具有强氧化性,故D正确;
故选D.点评:
本题考点: 氧化还原反应;氧化性、还原性强弱的比较.
考点点评: 本题考查氧化还原反应,熟悉氧化还原反应的概念及元素的化合价与离子、物质的性质即可解答,注意利用实例来解答,难度不大.1年前查看全部
- 二氧化碳和碳反应中什么是氧化剂或还原剂?
二氧化碳和碳反应中什么是氧化剂或还原剂?
如题,或说明电子转移情况 raidas201年前1
raidas201年前1 -
 heatwade 共回答了17个问题
heatwade 共回答了17个问题 |采纳率94.1%CO2中的C化合价降低了,CO2是氧化剂;C化合价升高了,C是还原剂
C+CO2=2CO(条件:加热)
转移的电子是2mol1年前查看全部
- 发射卫星的火箭用联氨(N2H4)作燃料,以四氧化二氮作氧化剂,燃烧尾气由氮气与水蒸气组成.该反应的化学方程式为2N2H4
发射卫星的火箭用联氨(N2H4)作燃料,以四氧化二氮作氧化剂,燃烧尾气由氮气与水蒸气组成.该反应的化学方程式为2N2H4+N2O4
3N2+4H2O点燃 .2N2H4+N2O4.
3N2+4H2O点燃 . shangxinzhidi1年前1
shangxinzhidi1年前1 -
 品尝qq 共回答了11个问题
品尝qq 共回答了11个问题 |采纳率90.9%解题思路:根据题意,发射卫星的火箭用联氨(N2H4)作燃料,以四氧化二氮作氧化剂,燃烧尾气由氮气与水蒸气组成,写出反应的化学方程式即可.联氨(N2H4)作燃料,以四氧化二氮作氧化剂,燃烧尾气由氮气与水蒸气组成,反应的化学方程式为:2N2H4+N2O4
点燃
.
3N2+4H2O.
故答案为:2N2H4+N2O4
点燃
.
3N2+4H2O.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.1年前查看全部
- 稀硝酸作为较强氧化剂在溶液中发生的反应是: 2NO 3 — +8H + +6e — =2NO↑+4H 2 O,下列离子能
稀硝酸作为较强氧化剂在溶液中发生的反应是: 2NO 3 — +8H + +6e — =2NO↑+4H 2 O,下列离子能让此反应过程发生的是

①Fe 2+ ;②Mg 2+ ;③SO 3 2 — ;④S 2 — ;⑤I — ;⑥ClO — 。
A.①③④⑤ B.①②③④⑤⑥ C.②③④⑥ D.①③④⑥ 
 ghq20081年前1
ghq20081年前1 -
 水中的曼陀罗 共回答了21个问题
水中的曼陀罗 共回答了21个问题 |采纳率85.7%A
具有还原性的离子符合题意,Fe 2+ 、SO 3 2 — 、S 2 — 、I — 均具有较强是还原性,可以被稀硝酸氧化。1年前查看全部
- 下列变化需加入氧化剂才能实现的是( )
下列变化需加入氧化剂才能实现的是( )
A. Fe3+→Fe2+
B. CuO→Cu
C. Cl-→Cl2
D. H2SO4→BaSO4 sandy18121年前1
sandy18121年前1 -
 川原田裕明 共回答了19个问题
川原田裕明 共回答了19个问题 |采纳率100%解题思路:加入氧化剂才能实现,则题中物质应具有还原性,与氧化剂发生氧化还原反应,所含元素被氧化,化合价升高,以此解答.A.Fe元素化合价降低,被还原,应加入还原剂,故A错误;
B.元素化合价没有发生变化,不是氧化还原反应,故B错误;
C.Cl元素化合价升高,被氧化,应加入氧化剂,故C正确;
D.元素化合价没有发生变化,不是氧化还原反应,故D错误.
故选C.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高考常见题型和高频考点,侧重于学生的分析能力和基本概念的理解,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大.1年前查看全部
- 同一种物质既作氧化剂又作还原剂的反应两个
 sha沙1年前1
sha沙1年前1 -
 小小小喇叭花 共回答了15个问题
小小小喇叭花 共回答了15个问题 |采纳率100%双氧水分解,电解水1年前查看全部
- (1)在火箭推进器中以肼(N2H4)作为燃料,可以选O2或NO2作为氧化剂,如果以氧气作为氧化剂,其化学反应
(1)在火箭推进器中以肼(N2H4)作为燃料,可以选O2或NO2作为氧化剂,如果以氧气作为氧化剂,其化学反应
(1)在火箭推进器中以肼(N2H4)作为燃料,可以选O2或NO2作为氧化剂,如果以氧气作为氧化剂,其化学反应与能量关系如下,请写出该反应的热化学方程式.______
(2)已知N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol 请写出用NO2做氧化剂时的热化学方程式(产物为N2和H2O)______,通过上述数据可知,在O2、NO2两者间,火箭发射通常用______做氧化剂,原因是______.
 很认真地用kk1年前1
很认真地用kk1年前1 -
 yuanaji 共回答了22个问题
yuanaji 共回答了22个问题 |采纳率95.5%(1)根据化学反应的焓变意义,结合图中给出反应的焓变,得到热化学方程式为:N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ/mol,
故答案为:N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ/mol;
(2)二氧化氮和肼反应生成氮气和水,N2H4(g)+NO2(g)═[3/2]N2(g)+2H2O(g),
已知反应①N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ/mol;
②N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol,
所求反应可以是①-②×[1/2]得到,所以N2H4(g)+NO2(g)═[3/2]N2(g)+2H2O(g)的焓变△H=-567.85kJ/mol,
对比反应①和②,可以看出消耗相同的N2H4 产生的热量更多,并且NO2的沸点更高,更容易储存,
故答案为:N2H4(g)+NO2(g)═[3/2]N2(g)+2H2O(g)△H=-567.85kJ/mol;NO2;消耗相同的N2H4 产生的热量更多,NO2的沸点更高,更容易储存.1年前查看全部
- 14.SiO2与碳在高温下可发生反应:SiO2+3C=SiC+CO↑在这一反应中氧化剂与还原剂的质量之比为:
14.SiO2与碳在高温下可发生反应:SiO2+3C=SiC+CO↑在这一反应中氧化剂与还原剂的质量之比为:
帮帮忙
 毛利小四郎1年前1
毛利小四郎1年前1 -
 快乐小竹 共回答了14个问题
快乐小竹 共回答了14个问题 |采纳率100%在这个反应种,化合价有变化的就只有C,原来的0价变为CO +2价(被氧化),和SiC -4价(被还原).
再根据生成物的SiO2+3C=SiC+2CO↑的物质的量之比为1:2.得到氧化剂与还原剂的质量之比为1:2(氧化剂和还原剂都是碳)1年前查看全部
- 判断氧化剂与还原剂?氯化铁中有+3价的铁元素,所以氯化铁是氧化剂.那为什么二氧化硫中有+4价的硫元素却即可以做氧化剂又可
判断氧化剂与还原剂?
氯化铁中有+3价的铁元素,所以氯化铁是氧化剂.那为什么二氧化硫中有+4价的硫元素却即可以做氧化剂又可以做还原剂? onlyhanyan1年前5
onlyhanyan1年前5 -
 雪rr嫩 共回答了14个问题
雪rr嫩 共回答了14个问题 |采纳率85.7%氧化剂和还原剂的判断一般是在具体的化学反应中来说的,在化学反应中,只要有升价此物质即为还原剂,有降价即为氧化剂.(如H2+O2).
如果单从物质判断,那么就要判断此元素是否还可以升价(还原性)或降价(氧化性)
如Cl元素,最高价为+7 ,最低位-1价,当Cl处于+1,+3,+5价时(2价Fe也是),均具有氧化性和还原性,因为均可再升或再降.当元素处于最低或最高价时,没有氧化性(不能再降)和还原性(不能再升).1年前查看全部
- 化学反应中、(无机物)当一种还原剂和二种氧化剂同时相遇时是先和氧化性强的反应在紧接着和氧化性弱的反应也就是说反应可以同时
化学反应中、(无机物)当一种还原剂和二种氧化剂同时相遇时是先和氧化性强的反应在紧接着和氧化性弱的反应也就是说反应可以同时存在但不是同时发生、还是反应不能同时存在先和氧化性强的反应、反应完强氧化剂在和弱氧化剂反应?
有机物反应 是 可以同时存在但不同时发生 还是不能同时存在二个反应? 馋裤1年前3
馋裤1年前3 -
 周鸣 共回答了17个问题
周鸣 共回答了17个问题 |采纳率100%从微观讲,反应肯定是同时都会发生的,只是反应速率有快慢,而且反应平衡会向与强氧化剂的反应倾斜,所以最终产物优先是被强氧化剂氧化的产物1年前查看全部
- 5KClO3+6P=3P2O5+5KCl方程中,反应中氧化剂和还原剂的个数之比是多少?
 hsb03071年前1
hsb03071年前1 -
 lemon七七 共回答了13个问题
lemon七七 共回答了13个问题 |采纳率92.3%质量比为692.5:186,分子个数比为6:5.是不1年前查看全部
- 关于铜和浓硫酸的反应这个反应中氧化剂还原剂和氧化产物还原产物分别是什么?
 zoujuan1年前3
zoujuan1年前3 -
 理查德泰森123 共回答了17个问题
理查德泰森123 共回答了17个问题 |采纳率88.2%氧化剂浓硫酸,还原剂铜
氧化产物硫酸铜,还原产物二氧化硫
Cu+2H2SO4(浓)=加热=CuSO4+SO2↑+2H2O1年前查看全部
- 铜离子有强氧化性,为什么氢氧化铜是弱氧化剂
铜离子有强氧化性,为什么氢氧化铜是弱氧化剂
银粒子也有强氧化性,为什么银氨溶液也是弱氧化剂? htyighmdf1年前1
htyighmdf1年前1 -
 幻梦人生 共回答了20个问题
幻梦人生 共回答了20个问题 |采纳率95%离子一旦被络合以后,你上述的情况就是被络合了,离子本身就不再是游离的了,也就是说离子本身已经不存在了,存在的是络合离子,而上述两种络合离子都是结构非常稳定的.
铜离子为例,实际上存在形态为:Cu[(OH)4]2-,每个铜离子外面包裹了氢氧根离子,因而不再容易获得电子,也就是表观的氧化性降低了.1年前查看全部
- 铝热反应生成铁amol,请问该反应至少需要氧化剂 mol?
铝热反应生成铁amol,请问该反应至少需要氧化剂 mol?
铝和氧化铁反应 大热点中1年前4
大热点中1年前4 -
 lqrwblyd 共回答了19个问题
lqrwblyd 共回答了19个问题 |采纳率94.7%0.5a
Fe2O3+2Al=Al2O3+2Fe
0.5a a1年前查看全部
- Cl2+2NaOH=NaCl+NaClO+H2O 这个化学方程式中的氧化剂是啥?还有Cl的升降应该看NaCl里面的还是看
Cl2+2NaOH=NaCl+NaClO+H2O 这个化学方程式中的氧化剂是啥?还有Cl的升降应该看NaCl里面的还是看NaClO里面的?
 JAON091年前2
JAON091年前2 -
 lvjinglingqq 共回答了16个问题
lvjinglingqq 共回答了16个问题 |采纳率93.8%此反应的氧化剂和还原剂是一种物质都是氯气.
反应氯元素的化合价为0,反应氯化钠中氯元素的化合价为-1、次氯酸钠中氯元素的化合价为+1,氯元素的化合价既升高了又降低了,所以氯气既是氧化剂也是还原剂,此反应是歧化反应,在同一元素之间进行的氧化还原反应.
希望我的回答能对你的学习有帮助!1年前查看全部
- 一种氧化剂和多种还原剂发生反应时,为什么是还原性强的先反应
 happy小垭1年前2
happy小垭1年前2 -
 xxx5000 共回答了20个问题
xxx5000 共回答了20个问题 |采纳率75%还原性即失电子能力,还原性越强说明失电子能力越强,那麼当然先反应咯1年前查看全部
- 谁可以和我说下强氧化性,又还原性,氧化剂,还原剂,什么关系?
 心绪万千1年前1
心绪万千1年前1 -
 dd王7 共回答了15个问题
dd王7 共回答了15个问题 |采纳率86.7%升失氧,被氧化,作还原剂显还原性.如金属单质,容易失电子.价态只能从0到正数所以多作为还原剂
相反对应降得还.口诀
还原剂强弱不是影响很大.氧化剂强弱是重点多看看.1年前查看全部
- Al溶于NaOH溶液中,1molAl失去的电子被水获得,则作氧化剂的水的物质的量为
Al溶于NaOH溶液中,1molAl失去的电子被水获得,则作氧化剂的水的物质的量为
A 1mol B 1.5mol C 3mol D6mol
你们再想想嘛……要解释哈 lion37401年前2
lion37401年前2 -
 海之韵1234 共回答了17个问题
海之韵1234 共回答了17个问题 |采纳率100%1.5mol
你分开写方程嘛
就是Al+H20=Al(OH)3+H2
Al(OH)3+NaOH=NaAlO2+H20
只有第一步是氧化还原反应~1年前查看全部
- 有关氧化还原反应的 氧化还原反应中遵守以强制弱原则 就是氧化性强的做氧化剂 氧化性弱的做还原剂 那
有关氧化还原反应的 氧化还原反应中遵守以强制弱原则 就是氧化性强的做氧化剂 氧化性弱的做还原剂 那
有关氧化还原反应的
氧化还原反应中遵守以强制弱原则 就是氧化性强的做氧化剂 氧化性弱的做还原剂 那过氧化氢与二氧化硫反应反应生成硫酸 为什么它们可以反应啊 还有高中的化学方程式是不是可以自己推出来感到作业中有好多没见过的方程式 请讲的通俗一点 伟大ll手电筒1年前1
伟大ll手电筒1年前1 -
 形只影单的美美 共回答了18个问题
形只影单的美美 共回答了18个问题 |采纳率88.9%等式两边看化合(he)价的变化化合价升高失去电子被氧化是还原剂(绅士养花还原剂)H2O2有较强氧化(也有一定还原性)性,SO2有还原性反应中S+2价做还原剂升高到+6价生成H4SO4 H2O2中两氧合成过氧根离子表现-2价(就当每个-1价)氧化剂降到-2价(你应该是高一吧,高一好生学习吧)1年前查看全部
大家在问
- 1求图形中阴影部分面积
- 2某种商品原价20元,甲、乙、丙、丁四个商店以不同的销售方式促销.甲店降价百分之九 乙店打九折出售
- 3英语翻译This is the last place where I expect to meet you.这里能翻译成
- 4The committee ___ 10 persons.
- 5英语问题定语从句the doctor did all_____to save the wounded boy.A.wha
- 6蓝鲸是地球上最大的动物,请计算一头质量为140t的蓝鲸的体积是多少m3?(蓝鲸的密度与水的密度差不多,可以看成1×103
- 7人口质量统计指标的概念
- 8蓝蓝的天空飘着几朵白云划分句子成分
- 9陆游的《冬夜读书示子聿》,诗中作者用“读书”生发感想告诉儿子子聿书本知识与实践的关系
- 10阳光伴我成长 这个作文题目还可以换成什么题目 意思相近的
- 11小球从空中初速度为零释放,若要小球弹跳的高度高于原来抛球的速度,应如何抛球,根据什么?
- 12My school(50个词)
- 13你先离开我后离开的句子
- 14英语翻译它高20厘米It is 20 cm high 这句话有错误吗,如果有,谁能发下正确句子!
- 15写出符号“2CH4”中数字的含义:
