C+O2=CO2 ΔH=-393.5KJ/mol CaCO3=CaO+CO2 Δ
 目成2022-10-04 11:39:541条回答
目成2022-10-04 11:39:541条回答C+O2=CO2 ΔH=-393.5KJ/mol
CaCO3=CaO+CO2 ΔH=178.2KJ/mol
若要将1tCaCO3煅烧成生石灰,理论上至少需要多少千克焦炭?
答案是54.3Kg 为什么?

已提交,审核后显示!提交回复
共1条回复
 robert0220 共回答了21个问题
robert0220 共回答了21个问题 |采纳率85.7%- 设1吨CaCO3煅烧成生石灰需要的热量为X,理论上至少需要焦炭的质量为YCaCO3(s) =CaO(s) + CO2(g)ΔH=+178.2KJ/mol 100 178.2 10^6g XX=1.782*10^6KJC(s)+O2(g)=CO2(g) ΔH=-393.5KJ/mol12 393.5 Y 1.782*10^6KJY=5.43*10^4g=54.3Kg希望我的回答能对你的学习有帮助!
- 1年前
相关推荐
- 已知:C(s)+O2(g)=CO2(g) 变量H=-393.5kJ/mol,CaCO3(s)=CaO(s)+CO2(g)
已知:C(s)+O2(g)=CO2(g) 变量H=-393.5kJ/mol,CaCO3(s)=CaO(s)+CO2(g)变量H=178.2kJ/mol
若要将1t碳酸钙煅烧成生石灰,理论上至少需用多少千克焦炭 zsc7231年前1
zsc7231年前1 -
 a4201261 共回答了18个问题
a4201261 共回答了18个问题 |采纳率94.4%CaCO3摩尔质量为100g/mol
1t碳酸钙物质的量为10000mol
需要的热量为178.2kJ/mol×10000mol=1782000kj
需要焦炭物质的量为1782000kj÷393.5kJ/mol=4529mol
焦炭质量为4529mol×12g/mol=54343g=54.343kg1年前查看全部
- 已知C(石墨)、H2和CO的燃烧热分别为393.5KJ/mol、285.8KJ/mol、282.8KJ/mol.现有H2
已知C(石墨)、H2和CO的燃烧热分别为393.5KJ/mol、285.8KJ/mol、282.8KJ/mol.现有H2和CO组成的混合气体56.0L(标准状况),经充分燃烧后,放出总热量为710.0kJ,并生成液态水.下列热化学方程式或描述正确的是( )
A 2CO(g)+O2(g)=2CO(g) ΔH=+282.8kJ/mol
B 2H2(g)+O2(g)=2H2O(g) ΔH=-571.6kJ/mol
C C(石墨,s)+1/2O2(g)=CO(g) ΔH=-110.7kJ/mol
D 燃烧前混合气体中H2的体积分数为40% 千里单骑百年舒服1年前1
千里单骑百年舒服1年前1 -
 李冰1 共回答了15个问题
李冰1 共回答了15个问题 |采纳率86.7%B,C 应该是正值,A应该是282.8*2,参看燃烧热定义就行.
D.设H2为x mol,则CO为2.5-x mol.
(285.8)/2+(2.5-x)/2*282.8=7101年前查看全部
- 根据下列热化学方程式(1)C(s)+O2(g)═CO2 (g)△H1=-393.5kJ/mol(2)H2(g)
根据下列热化学方程式
(1)C(s)+O2(g)═CO2 (g)△H1=-393.5kJ/mol
(2)H2(g)+[1/2]O2(g)═H2O(l)△H2=-285.8kJ/mol
(3)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H3=-870.3kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)═CH3COOH(l)的反应热为( )
A.△H=-488.3 kJ/mol
B.△H=+244.1 kJ/mol
C.△H=-996.6 kJ/mol
D.△H=+996.6 kJ/mol 忍者神人1年前1
忍者神人1年前1 -
 yalong 共回答了11个问题
yalong 共回答了11个问题 |采纳率100%解题思路:依据热化学方程式和盖斯定律计算分析,反应的焓变与反应过程无关,只与起始状态和终了状态有关.(1)C(s)+O2(g)═CO2 (g)△H1=-393.5kJ/mol
(2)H2(g)+[1/2]O2(g)═H2O(l)△H2=-285.8kJ/mol(3)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H3=-870.3kJ/mol
依据盖斯定律(1)×2-(3)+(2)×2得到
2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H=-488.3 kJ/mol
故选A.点评:
本题考点: 用盖斯定律进行有关反应热的计算.
考点点评: 本题考查热化学方程式的书写和盖斯定律的计算应用,题目较简单.1年前查看全部
- 根据下列热化学方程式(1)C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol(2)H2(g)+[1/2]
根据下列热化学方程式
(1)C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol
(2)H2(g)+[1/2]O2(g)=2H2O(l)△H2=-285.8kJ/mol
(3)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H3=-870.3kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为( )
A. △H=244.1kJ/mol
B. △H=-488.3kJ/mol
C. △H=-996.6kJ/mol
D. △H=996.6kJ/mol qinshuxia1年前3
qinshuxia1年前3 -
 共同ww过娼 共回答了24个问题
共同ww过娼 共回答了24个问题 |采纳率91.7%解题思路:依据热化学方程式和盖斯定律进行分析计算,通过热化学方程式(1)×2和(2)×2相加再减去(3)消去二氧化碳和水得到所求的热化学方程式,注意热化学方程式改变系数,焓变随之改变.(1)C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol
(2)H2(g)+[1/2]O2(g)=H2O(l)△H2=-285.8kJ/mol
(3)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H3=-870.3kJ/mol
依据热化学方程式(1)×2+(2)×2-(3)得到:△H=-488.3KJ/mol,
故选B.点评:
本题考点: 用盖斯定律进行有关反应热的计算.
考点点评: 本题考查了热化学方程式的理解和分析,盖斯定律的计算应用,掌握基础是关键,题目难度中等.1年前查看全部
- C﹙s﹚+O2﹙g﹚=CO2﹙g﹚ △H=﹣393.5kj/mol H2﹙g﹚+0.5O2﹙g﹚=H20﹙g﹚ △H=﹣
C﹙s﹚+O2﹙g﹚=CO2﹙g﹚ △H=﹣393.5kj/mol H2﹙g﹚+0.5O2﹙g﹚=H20﹙g﹚ △H=﹣242.0kj/mol
CO﹙g﹚+0.5O2﹙g﹚=CO2﹙g﹚ △H=﹣283.0kj/mol
写出碳固体与水蒸气反应的热化学方程式,并计算反应热.
过程详细点,谢谢! jiayizifei1年前2
jiayizifei1年前2 -
 小本营 共回答了22个问题
小本营 共回答了22个问题 |采纳率95.5%4.C(s)+H2O(g)=CO(g)+H2(g)
1.C﹙s﹚+O2﹙g﹚=CO2﹙g﹚
2.CO﹙g﹚+0.5O2﹙g﹚=CO2﹙g﹚
3.H2﹙g﹚+0.5O2﹙g﹚=H20﹙g﹚
1-2-3=4
则 △H=-393.5-(-242.0)-(-283.0)=1年前查看全部
- 有关盖斯定律的运算比如说已知C+O2=CO2 △H1=-393.5KJ/molH2+1/2O2=
有关盖斯定律的运算
比如说已知C+O2=CO2 △H1=-393.5KJ/molH2+1/2O2=H20 △H2=-242.0kj/molCO+1/2O2=CO2 △H2=-283.0kj/mo求C+H20=CO+H2 的 最好把过程讲得详细一点 peak9911年前1
peak9911年前1 -
 1a604 共回答了19个问题
1a604 共回答了19个问题 |采纳率89.5%C+O2=CO2 △H1=-393.5KJ/mol
+H20= H2+1/2O2 △H2=+242.0kj/mol
+CO2 = CO+1/2O2 △H3=+283.0kj/mol
---------------------------------------------------
C(s)+H20(g)=CO(g)+H2 (g) △H=+131.5KJ/mol1年前查看全部
- 已知下列反应的热化学方程式为:(1)C(s)+O2(g)═CO2(g)△H1=-393.5kJ/mol(2)CH3COO
已知下列反应的热化学方程式为:
(1)C(s)+O2(g)═CO2(g)△H1=-393.5kJ/mol
(2)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H2=-870.3kJ/mol
(3)2H2(g)+O2(g)═2H2O(l)△H3=-571.6kJ/mol
请计算:2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H4=______. rxw19831年前1
rxw19831年前1 -
 星2007 共回答了15个问题
星2007 共回答了15个问题 |采纳率100%解题思路:依据热化学方程式,结合盖斯定律构造目标热化学方程式计算得到;(1)C(s)+O2(g)═CO2(g)△H1=-393.5kJ/mol
(2)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H2=-870.3kJ/mol
(3)2H2(g)+O2(g)═2H2O(l)△H3=-571.6kJ/mol
依据盖斯定律计算(1)×2-(2)+(3)得到反应的热化学方程式:2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H4=-488.3KJ/mol;
故答案为:-488.3KJ/mol;点评:
本题考点: 用盖斯定律进行有关反应热的计算.
考点点评: 本题考查了热化学方程式和盖斯定律的计算应用,掌握基础是关键,题目较简单.1年前查看全部
- 已知在101kPa时,C(石墨)、H2和CO的燃烧热分别为393.5kJ/mol、285.8kJ/mol和282.8kJ
已知在101kPa时,C(石墨)、H2和CO的燃烧热分别为393.5kJ/mol、285.8kJ/mol和282.8kJ/mol.现有H2和CO组成的混合气体112L(标况),经充分燃烧后,放出总热量为1420kJ,并生成液态水.下列热化学方程式或描述中正确的是( )
A.2CO(g)+O2(g)═2CO2(g);△H=+282.8 kJ/mol
B.2H2(g)+O2(g)═2H2O(g);△H=-571.6 kJ/mol
C.C(石墨,s)+[1/2]O2(g)═CO(g);△H=-110.7 kJ/mol
D.燃烧前混合气体中H2的体积百分数为50% xuqi_pti1年前1
xuqi_pti1年前1 -
 福自天来 共回答了13个问题
福自天来 共回答了13个问题 |采纳率76.9%解题思路:A、依据一氧化碳燃烧热分析判断,一氧化碳燃烧是放热反应焓变为负值;B、氢气燃烧热是1mol氢气完全燃烧生成液态水放出的热量分析;C、1mol碳的燃烧热是碳燃烧生成二氧化碳稳定氧化物放出的热量,依据一氧化碳燃烧热和碳燃烧热结合盖斯定律计算分析;D、依据氢气和一氧化碳燃烧热的热化学方程式分析计算判断;A、一氧化碳燃烧热为282.8kJ/mol,依据燃烧热概念,热化学方程式为,CO(g)+[1/2]O2(g)═CO2(g);△H=-282.8 kJ/mol,故A错误;
B、氢气燃烧热为285.8kJ/mol,热化学方程式为:2H2(g)+O2(g)═2H2O(l);△H=-571.6 kJ/mol,故B错误;
C、一氧化碳燃烧热化学方程式为,CO(g)+[1/2]O2(g)═CO2(g);△H=-282.8 kJ/mol,碳燃烧热化学方程式为:C(s)+O2(g)═CO2(g);△H=-393.5 kJ/mol,两式相减得到C(石墨,s)+[1/2]O2(g)═CO(g);△H=-110.7 kJ/mol,故C正确;
D、H2和CO组成的混合气体112L(标况)物质的量为5mol,经充分燃烧后,放出总热量为1420kJ,并生成液态水,依据氢气和一氧化碳燃烧热的热化学方程式计算,设氢气物质的量为x,一氧化碳物质的量为y,则x+y=5,285.8x+282.8y=1420,计算得到x=2,y=3,燃烧前混合气体中H2的体积百分数=[2/5]×100%=40%,故D错误;
故选:C.点评:
本题考点: 热化学方程式.
考点点评: 本题考查了燃烧热概念的分析应用,热化学方程式和盖斯定律的计算应用,掌握基础是解题关键,题目难度中等.1年前查看全部
- 根据下列热化学方程式(1)C(s)+O 2 (g)═CO 2 (g)△H 1 =-393.5kJ/mol(2
根据下列热化学方程式
(1)C(s)+O 2 (g)═CO 2 (g)△H 1 =-393.5kJ/mol
(2)H 2 (g)+
O 2 (g)═H 2 O(l)△H 2 =-285.8kJ/mol1 2
(3)CH 3 COOH(l)+2O 2 (g)═2CO 2 (g)+2H 2 O(l)△H 3 =-870.3kJ/mol
可以计算出2C(s)+2H 2 (g)+O 2 (g)═CH 3 COOH(l)的反应热为( )A.△H=-488.3 kJ/mol B.△H=+244.1 kJ/mol C.△H=-996.6 kJ/mol D.△H=+996.6 kJ/mol  aimo早1年前1
aimo早1年前1 -
 SuperXia 共回答了17个问题
SuperXia 共回答了17个问题 |采纳率100%(1)C(s)+O 2 (g)═CO 2 (g)△H 1 =-393.5kJ/mol
(2)H 2 (g)+
1
2 O 2 (g)═H 2 O(l)△H 2 =-285.8kJ/mol
(3)CH 3 COOH(l)+2O 2 (g)═2CO 2 (g)+2H 2 O(l)△H 3 =-870.3kJ/mol
依据盖斯定律(1)×2-(3)+(2)×2得到
2C(s)+2H 2 (g)+O 2 (g)═CH 3 COOH(l)△H=-488.3 kJ/mol
故选A.1年前查看全部
- 已知通常情况下,1molC(石墨)完全燃烧生成CO2气体时放热393.5KJ,1molCO气体完全燃烧生成CO2气体时放
已知通常情况下,1molC(石墨)完全燃烧生成CO2气体时放热393.5KJ,1molCO气体完全燃烧生成CO2气体时放热283.0KJ.下列说法正确的是( )
A. 石墨燃烧生成CO气体的热化学方程式为:2C(石墨)+O2(g)=2CO(g)△H=-110.5kJ/mol
B. C(石墨)不完全燃烧,生成CO2和CO两种气体时,可放热283.0kJ
C. C(石墨)和CO2(g)反应生成CO(g)的反应是吸热反应
D. 若金刚石的燃烧生成CO2气体放出的热量大于石墨,则石墨变成金刚石的变化是放热反应 马婷1年前1
马婷1年前1 -
 zhjjly 共回答了21个问题
zhjjly 共回答了21个问题 |采纳率90.5%解题思路:A、根据石墨、一氧化碳的燃烧的热化学方程式,利用盖斯定律,进行方程式叠加,构造出目标反应式;
B、1mol石墨不完全燃烧,无法计算生成CO2和CO各自物质的量,无法计算具体反应热;
C、根据石墨、一氧化碳的燃烧的热化学方程式,利用盖斯定律,进行方程式叠加,构造出目标反应式分析判断;
D、金刚石的燃烧热大于石墨的燃烧热,可知金刚石的能量比石墨能量高,根据能量守恒判断.A、石墨、一氧化碳的燃烧热分别是393.5kJ•mol-1和283.0KJ•mol-1,
石墨燃烧的热化学方程式为(1)C(s,石墨)+O2(g)═CO2(g)△H1=-393.5kJ/mol;
一氧化碳燃烧的热化学方程式为(2)CO(g)+[1/2]O2(g)═CO2(g)△H2=-283.0kJ/mol;
根据盖斯定律,(1)-(2)得C(石墨)+[1/2]O2(g)=CO(g)△H=-110.5kJ•mol-1,
即2C(石墨)+O2(g)=2CO(g)△H=-221kJ•mol-1,故A错误;
B、1mol石墨不完全燃烧生成CO2和CO,无法计算生成CO2和CO各自物质的量,无法计算具体反应热,故B错误;
C、石墨燃烧的热化学方程式为(1)C(s,石墨)+O2(g)═CO2(g)△H1=-393.5kJ/mol;
一氧化碳燃烧的热化学方程式为(2)CO(g)+[1/2]O2(g)═CO2(g)△H2=-283.0kJ/mol;
根据盖斯定律,(1)-(2)×2得C(s,石墨)+CO2(g)=2CO(g)△H=+172.5kJ•mol-1,反应是吸热反应,故C正确;
D、金刚石的燃烧放热大于石墨的燃烧放热,根据能量守恒,可知金刚石的能量比石墨能量高,所以石墨转变为金刚石需要吸热,故D错误;
故选C.点评:
本题考点: 反应热和焓变.
考点点评: 本题主要考查了盖斯定律的应用,热化学方程式书写,反应中的能量转化等,难度中等.1年前查看全部
- 非专业人问个问题,根据标准生成焓定义,C+O2=CO2,标准生成焓为-393.5KJ/mol,其中C为石墨.
非专业人问个问题,根据标准生成焓定义,C+O2=CO2,标准生成焓为-393.5KJ/mol,其中C为石墨.
我觉得C按标煤算应该是7000千卡/kg.而我现在有个反应,用到的是精煤粉,热含量高,按8000千卡/kg计算.不知道用在那个上面那个方程式里,1mol的CO2的热值是多少?(我的意思是放出的热量是多少,但是不知道怎么计算)应该怎么计算呢? fjing1年前1
fjing1年前1 -
 亦既见止 共回答了9个问题
亦既见止 共回答了9个问题 |采纳率100%那叫标准摩尔焓变.标准摩尔焓变等于生成物的标准摩尔生成焓乘以各自的系数之和再减去反应物的标准摩尔生成焓乘以各自的系数之和.单位千焦每摩尔.1年前查看全部
- 已知下列反应的热化学方程式为:(1)C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol(2)CH3COO
已知下列反应的热化学方程式为:
(1)C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol
(2)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H2=-870.3kJ/mol
(3)H2(g)+[1/2]O2(g)=H2O(l)△H3=-285.8kJ/mol
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l) 的反应热(焓变)为( )
A.+488.3kJ/mol
B.-488.3kJ/mol
C.-244.15kJ/mol
D.+244.15kJ/mol 龙行天下ZYH1年前1
龙行天下ZYH1年前1 -
 shaowang66 共回答了11个问题
shaowang66 共回答了11个问题 |采纳率81.8%解题思路:根据盖斯定律构造出目标反应热化学反应方程式,据此判断.注意化学计量数乘以不同的系数,进行加减,焓变也要乘以相同的系数,做相应加减.已知:(1)C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol
(2)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H2=-870.3kJ/mol
(3)H2(g)+[1/2]O2(g)=H2O(l)△H3=-285.8kJ/mol
根据盖斯定律,(1)×2+(3)×2-(2)得2C(s)+2H2(g)+O2(g)=CH3COOH(l)△H=-488.3kJ/mol.
故选:B.点评:
本题考点: 用盖斯定律进行有关反应热的计算.
考点点评: 本题考查反应热的计算,题目难度不大,注意盖斯定律的理解与应用.盖斯定律只适用于等温等压或等温等容过程,各步反应的温度应相同.1年前查看全部
- 1MOL碳与氧气完全反应生成1MOL二氧化碳放出393.5KJ热量,能否说是12克碳完全燃烧能放出393.5KJ 的热量
1MOL碳与氧气完全反应生成1MOL二氧化碳放出393.5KJ热量,能否说是12克碳完全燃烧能放出393.5KJ 的热量?
1MOL碳与1MOL氧气完全反应生成1MOL二氧化碳,并放出393.5KJ热量,能否说是12克碳完全燃烧能放出393.5KJ 的热量?
1MOL碳=12克碳,也就是12克碳完全反应后放出393.5KJ ,而碳的热值是3.4X10的4次方千焦每千克,则0.012千克X3.4X10的4次方=408千焦,怎么两个数值不对呢? 裴叶1年前3
裴叶1年前3 -
 linaaa 共回答了17个问题
linaaa 共回答了17个问题 |采纳率82.4%316 32 31.6g 3.2g 0.2mol 0.1mol C+O2=CO2 产生的氧气能与多少1mol碳恰好完全反应生成二氧化碳 烧杯增重质量,为CO2增加质量,8.8g÷44g/mol=0.1年前查看全部
- 25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、285.8kJ/mol、890.3k
25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、285.8kJ/mol、890.3kJ/mol、2800kJ/mol,则下列热化学方程式正确的是( )
A. C(s)+12O2(g)=CO(g)△H=-393.5 kJ/mol
B. 2H2(g)+O2(g)=2H2O(l)△H=+571.6 kJ/mol
C. CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ/mol
D. C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)△H=-2800 kJ/mol 鬼老二1年前1
鬼老二1年前1 -
 玉子烟_ss 共回答了13个问题
玉子烟_ss 共回答了13个问题 |采纳率76.9%解题思路:燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量,H生成液态水,C生成二氧化碳,据此分析判断.燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量,H生成液态水,C生成二氧化碳,
A、反应中生成一氧化碳不是稳定氧化物,故A错误;
B、氢气燃烧是放热反应,故B错误;
C、生成物水是气体不是稳定氧化物,故C错误;
D、符合燃烧热的概念,故D正确;
故选D.点评:
本题考点: 反应热和焓变.
考点点评: 本题考查了燃烧热的概念分析判断和实际应用,理解概念是解题关键,题目较简单.1年前查看全部
- 已知C(s)、H2(g)、CH3COOH(l)的燃烧热分别是393.5kJ/mol、285.8kJ/mol和870.3k
已知C(s)、H2(g)、CH3COOH(l)的燃烧热分别是393.5kJ/mol、285.8kJ/mol和870.3kJ/mol,(注:CH3COOH的燃烧产物是CO2和H2O)则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的△H为( )
A.-488.3KJ•mol-1
B.-762.6kJ•mol-1
C.-654.9kJ•mol-1
D.+191kJ•mol-1 hzdandy1年前1
hzdandy1年前1 -
 yangzhiyuan123 共回答了19个问题
yangzhiyuan123 共回答了19个问题 |采纳率100%解题思路:根据燃烧热写出热化学方程式,再利用盖斯定律来计算反应2C(s)+2H2(g)+O2(g)=CH3COOH(1)的反应热.25℃、101kPa下,H2(g)、C(s)和CH3COOH(l)的燃烧热分别是285.8kJ•mol-1、393.5kJ•mol-1和870.3kJ•mol-1,
则H2(g)+[1/2]O2(g)=H2O(l)△H=-285.8kJ•mol-1①,
C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1②,
CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H=-870.3kJ•mol-1③,
由盖斯定律可知,①×2+②×2-③可得反应2C(s)+2H2(g)+O2(g)=CH3COOH(1),
其反应热为2×(-285.8kJ•mol-1)+2×(-393.5kJ•mol-1)+870.3kJ•mol-1=-488.3KJ•mol-1,
故选A.点评:
本题考点: 用盖斯定律进行有关反应热的计算.
考点点评: 本题考查学生盖斯定律计算反应热的知识,可以根据所学知识进行回答,难度不大.1年前查看全部
- 已知:C(s)+O2(g)=CO2(g);ΔH=-393.5KJ/mol.H2(g)+
 chen007010031年前2
chen007010031年前2 -
 错过17岁了 共回答了20个问题
错过17岁了 共回答了20个问题 |采纳率90%楼主你要问什么?
通过你的已知我只知道你写的C(s)+O2(g)=CO2(g)是放热反应,且放出热量为393.5KJ/mol……1年前查看全部
- 已知在298k时,有如下两个热化学方程式;C(s)+O2(g)==CO2(g) △H=-393.5kJ/mol
已知在298k时,有如下两个热化学方程式;C(s)+O2(g)==CO2(g) △H=-393.5kJ/mol
2H2(g)+O2(g)==2H2O(g) △H=-483.6kJ/mol
现有0.2mol炭粉和H2的混合物在O2中完全燃烧共放出63.53kj热量.则混合物中炭粉和H2的物质的量之比是? suzi191年前1
suzi191年前1 -
 九月911 共回答了18个问题
九月911 共回答了18个问题 |采纳率77.8%设碳粉Xmol 氢气Ymol
X+Y=0.2
393.5X+Y*(483.6/2)=63.53 此处483.6需要除2是因为反应方程式中H2参与了2mol
第一条方程式乘以 317.8 得到
317.8X+317.8Y=63.53 与第二条方程式相减 得到
75.7X=76Y
所以两者物质的量只比≈1:11年前查看全部
- 实验测得碳单质、氢气、甲烷的燃烧热(△H)分别为-393.5kJ/mol、-285.8kJ/mol、-890.3kJ/m
实验测得碳单质、氢气、甲烷的燃烧热(△H)分别为-393.5kJ/mol、-285.8kJ/mol、-890.3kJ/mol.则CH4(g)═C(s)+2H2(g)的反应焓变(△H)为( )
A.-74.8 kJ/mol
B.+74.8 kJ/mol
C.-211kJ/mol
D.+211kJ/mol gol02711年前1
gol02711年前1 -
 kuer080 共回答了16个问题
kuer080 共回答了16个问题 |采纳率87.5%解题思路:燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,表示燃烧热的热化学方程式中可燃物为1mol,产物为稳定氧化物.碳单质、氢气、甲烷的热化学方程式分别为:
①C(S)+O2(g)═CO2(g)△H=-393.5kJ/mol;②H2(g)+[1/2]O2(g)═H2O(l)△H=-285.8kJ/mol;③CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol,根据盖斯定律构造目标热化学方程式解答.实验测得碳单质、氢气、甲烷的燃烧热(△H)分别为-393.5kJ/mol、-285.8kJ/mol、-890.3kJ/mol,则它们的热化学反应方程式分别为:①C(S)+O2(g)═CO2(g)△H=-393.5kJ/mol;②H2(g)+[1/2]O2(g)═H2O(l)△H=-285.8kJ/mol;③CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol;根据盖斯定律③-(①+②×2)得CH4(g)=C(S)+2H2(g),故△H=(-890.3KJ/mol)-【(-393.5KJ/mol)+(-285.8kJ/mol)×2】=+74.8KJ/mol,
故选B.点评:
本题考点: 用盖斯定律进行有关反应热的计算.
考点点评: 本题考查反应热的有关计算,注意掌握根据盖斯定律、燃烧热等进行的计算,题目难度中等.1年前查看全部
- )已知:C(s)+O2(g)== CO2(g) △H= -393.5kJ/mol CO(g)+1/2O2(g)== CO
)已知:C(s)+O2(g)== CO2(g) △H= -393.5kJ/mol CO(g)+1/2O2(g)== CO2(g) △H= -283kJ/mol
)已知:C(s)+O2(g)== CO2(g) △H= -393.5kJ/mol
CO(g)+1/2O2(g)== CO2(g) △H= -283kJ/mol
则1 mol C(s)与O2(g)反应生成CO(g)的热化学方程式为 骑游兵1年前2
骑游兵1年前2 -
 霜河GG 共回答了18个问题
霜河GG 共回答了18个问题 |采纳率100%C(s)+O2(g)== CO2(g) △H= -393.5kJ/mol ①
CO(g)+1/2O2(g)== CO2(g) △H= -283kJ/mol ②
①-②得:
C(s)+1/2O2(g)=CO(g) △H= -110.5kJ/mol1年前查看全部
- 已知如下两个热化学方程式:C(s)+O2(g)→CO2(g)+393.5KJ,2H2(g)+O2(g)→2H2O(g)+
已知如下两个热化学方程式:C(s)+O2(g)→CO2(g)+393.5KJ,2H2(g)+O2(g)→2H2O(g)+483.6KJ
现有0.2mol炭粉和H2组成气、固混合物,在O2中完全燃烧,共放出63.53KJ热量,则混合物中,炭粉和H2的物质的量之比为? lllkkklllkkk1年前3
lllkkklllkkk1年前3 -
 绝地反击741 共回答了16个问题
绝地反击741 共回答了16个问题 |采纳率100%设炭粉xmol,则H2为(0.2-x)mol
C(s)+O2(g)→CO2(g)+393.5KJ,
2H2(g)+O2(g)→2H2O(g)+483.6KJ
393.5x+483.6(0.2-x)×1/2=63.53
x=15.17/151.7=0.1
则H2为0.2-x=0.2-0.1=0.1mol
炭粉和H2的物质的量之比为1:11年前查看全部
- 已知:C(S)+O2(g)=CO2(g) △H=-393.5kj/mol CACO3(S)=CAO(S)+CO2(g)
已知:C(S)+O2(g)=CO2(g) △H=-393.5kj/mol CACO3(S)=CAO(S)+CO2(g) △H=+178.2/mol
若将1吨CACO3煅烧 成CAO,理论上需用含百分之杂质的焦炭多少千克?
理论上需用含百分之5杂质的焦炭多少千克? nkxiaoliao1年前2
nkxiaoliao1年前2 -
 残雪孤松 共回答了22个问题
残雪孤松 共回答了22个问题 |采纳率81.8%CaCO3的 △H=+178.2 /mol 单位应该是kj/mol吧?
1吨CaCO3折算成摩尔数为10000摩尔.
那么需要纯C的量为10000*178.2/393.5=4529 mol
如果计算入5%的杂质,那么需要焦炭4529/95% = 4767 mol
根据碳的摩尔质量12g/mol,可知需要57.2kg1年前查看全部
- 高一化学题,求大师解答已知CaCO3=CaO+CO2 +175.7KJ*mol-1 C+O2=CO2 -393.5KJ*
高一化学题,求大师解答
已知CaCO3=CaO+CO2 +175.7KJ*mol-1
C+O2=CO2 -393.5KJ*mol-1
求一吨碳酸钙煅烧生成生石灰理论上需要含杂质10%的焦炭多少千克? liulangerya1年前2
liulangerya1年前2 -
 江河不尽 共回答了24个问题
江河不尽 共回答了24个问题 |采纳率87.5%碳酸钙的摩尔质量是100g/mol,一顿就是10000mol(我直接用e4表示,e4就是10的四次方),所以需要的能量是175.7×e4=1.757e6KJ,需要碳是1.757×e6KJ÷393.5KJ*mol-1=4.47e3mol=4470mol,1molC是12g,所以就是53640g=53.64Kg,再除以纯度90%得到59.6Kg.
希望对你有所帮助!1年前查看全部
- 已知两个热化学方程式: C(s)+O 2 (g)==CO 2 (g) △H = -393.5kJ
已知两个热化学方程式: C(s)+O 2 (g)==CO 2 (g) △H = -393.5kJ/mol
2H 2 (g)+O 2 (g)==2H 2 O(g) △H = -483.6kJ/mol
现有0.2mol炭粉和H 2 组成悬浮气,使其在O 2 中完全燃烧,共放出63.53kJ的热量,则炭粉与H 2 的物质的量之比是A.1:1 B.1:2 C.2:3 D.3:2  yichihongling1年前1
yichihongling1年前1 -
 王琦_5185 共回答了21个问题
王琦_5185 共回答了21个问题 |采纳率85.7%A
正确答案:A
炭粉与H 2 的物质的量分别为x和y
X+y=0.2mol,393.5x+241.8y=63.53kJ
解得x=y=0.1mol,故A正确。1年前查看全部
- 已知:25℃、101kPa时,C(s)和CO(g)的燃烧热分别为393.5kJ/mol和283.0kJ/mol,Fe2O
已知:25℃、101kPa时,C(s)和CO(g)的燃烧热分别为393.5kJ/mol和283.0kJ/mol,Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H=+489.0kJ/mol.则4Fe(s)+3O2(g)═2Fe2O3(s)△H=( )
A.+663.5kJ/mol
B.+3081kJ/mol
C.-1641.0kJ/mol
D.-2507.0kJ/mol 天黑之后1年前1
天黑之后1年前1 -
 需求 共回答了22个问题
需求 共回答了22个问题 |采纳率95.5%解题思路:根据C(s)和CO(g)的燃烧热书写相应的热化学方程式,再利用盖斯定律来计算反应4Fe(s)+3O2(g)═Fe2O3(s)的反应热.25℃、101kPa下,C(s)和CO(g)的燃烧热分别是285.8kJ/mol、283kJ/•mol,
则:C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol ①,
CO(g)+[1/2]O2(g)=CO2(g)△H=-283kJ/mol ②,
已知:Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H=+489.0kJ/mol ③,
根据盖斯定律,[①×3-②×3]×2-③×2得:4Fe(s)+3O2(g)═2Fe2O3(s),则△H=[3×(-393.5kJ/mol)-3×(-283kJ/mol)]×2-2×489.0kJ/mol=-1641.0kJ/mol,
故选C.点评:
本题考点: 有关反应热的计算.
考点点评: 本题考查根据盖斯定律进行反应热计算,难度中等,关键是构造目标热化学方程式.1年前查看全部
- 已知C(石墨)、H 2 和CO的燃烧热分别为393.5kJ/mol、285.8kJ/mol和282.8kJ/mol。现有
已知C(石墨)、H 2 和CO的燃烧热分别为393.5kJ/mol、285.8kJ/mol和282.8kJ/mol。现有H 2 和CO组成的混合气体56. 0L(标准状况),经充分燃烧后,放出总热量为710.0kJ,并生成液态水。下列热化学方程式或描述中,正确的是 [ ]A. 2CO(g)+O 2 (g)=2CO 2 (g) △H=+282.8kJ/mol
B. 2H 2 (g)+O 2 (g)=2H 2 O(g) △H=-571.6kJ/mol
C. C(石墨,s)+1/2O 2 (g)=CO(g) △H=-110.7kJ
D. 燃烧前混合气体中,H 2 的体积分数为40% alva961年前1
alva961年前1 -
 xiazhimengll 共回答了20个问题
xiazhimengll 共回答了20个问题 |采纳率90%D1年前查看全部
- 下列热化学方程式书写正确的是( ) A.C(s)+O 2 (g)═CO 2 (g);△H=+393.5kJ/mol B
下列热化学方程式书写正确的是( ) A.C(s)+O 2 (g)═CO 2 (g);△H=+393.5kJ/mol B.2SO 2 +O 2 ═2SO 3 ;△H=-196.6kJ/mol C.H 2 (g)+
O 2 (g)═H 2 O(l);△H=-285.8kJ/mol1 2 D.2H 2 (g)+O 2 (g)═2H 2 O(l);△H=-571.6KJ  yazhong20001年前1
yazhong20001年前1 -
 sucai0004 共回答了22个问题
sucai0004 共回答了22个问题 |采纳率95.5%A、反应是放热反应,C(s)+O 2 (g)═CO 2 (g);△H=-393.5kJ/mol,故A错误;B、反应热化学方程式为:2SO 2 (g)+O 2 (g)═2SO 3 (g);△H=-196.6kJ/mol,故B错误;C、反应热化学方程式符合要求,H 2 ...1年前查看全部
- 已知两个热化学方程式:C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol;2H2(g)+O2(g)═2H2
已知两个热化学方程式:
C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol;
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol.
现有0.2mol炭粉和H2组成悬浮气,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是( )
A.1:1
B.1:2
C.2:3
D.3:2 马褂31年前1
马褂31年前1 -
 129-8897663 共回答了16个问题
129-8897663 共回答了16个问题 |采纳率93.8%解题思路:根据物质的量与反应放出的热量成正比,利用热化学反应方程式计算C、H2燃烧放出的热量,以此来计算.设碳粉xmol,则氢气为(0.2-x)mol,则
C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
1 393.5kJ
x 393.5xkJ
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol
2483.6kJ
(0.2-x)mol 241.8(0.2-x)kJ
所以393.5xkJ+241.8(0.2-x)kJ=63.53kJ,
解得x=0.1mol,
则炭粉与H2的物质的量之比为0.1mol:0.1mol=1:1,
故选A.点评:
本题考点: 有关反应热的计算.
考点点评: 本题考查有关反应热的计算,明确热化学反应方程式中物质的量与热量的关系即可解答,题目难度不大.1年前查看全部
- 已知石墨、金刚石燃烧的热化学方程式分别为C(石墨、s)+O2(g)=CO2(g)△H2=-393.5kJ/mol,C(金
已知石墨、金刚石燃烧的热化学方程式分别为C(石墨、s)+O2(g)=CO2(g)△H2=-393.5kJ/mol,C(金刚石、s)+O2(g)=CO2(g)△H2=-395.4kJ/mol.关于石墨和金刚石的相互转化,下列说法正确的是( )
A.石墨转化成金刚石是自发进行的过程
B.金刚石转化石墨是非自发进行的过程
C.相同质量时,石墨比金刚石能量低
D.相同质量时,金刚石比石墨能量低 1988tyq1年前1
1988tyq1年前1 -
 David_Ho 共回答了17个问题
David_Ho 共回答了17个问题 |采纳率94.1%解题思路:根据石墨、金刚石燃烧的热化学方程式,利用盖斯定律写出金刚石与石墨转化的热化学方程式,根据反应热比较金刚石与石墨的能量大小,物质能量越高越不稳定,反应自发就得判断依据是△H-T△S<0.由石墨、金刚石燃烧的热化学方程式①C(石墨)+O2(g)=CO2(g)△H=-393.51kJ•mol-1②C(金刚石)+O2(g)=CO2(g)△H=-395.41kJ•mol-1,利用盖斯定律将①-②可得:C(石墨)=C(金刚石)△H=+1.9kJ•mol-1,则A...
点评:
本题考点: 反应热和焓变.
考点点评: 本题考查热化学方程式的书写及应用,题目难度不大,注意反应的热效应与物质能量的关系.1年前查看全部
- 关于一道反应热的题目~已知C(s)+O2(g)===CO2(g);△H=-393.5KJ/mol;煅烧1.00molCa
关于一道反应热的题目~
已知C(s)+O2(g)===CO2(g);△H=-393.5KJ/mol;煅烧1.00molCaCO3生成CaO和CO2,需要吸收177.7KJ的热量.如果这些热量全部由C燃烧来提供,从理论上计算,煅烧10.0molCaCO3需要燃烧C的质量.
我的参考书上有这样解释:10molCaCO3分解所吸收的热量与一定质量的C燃烧放出的热量相等.
就是这句话,我死都想不通,为什么这样阿?谁能给我解释下阿.
只要解释这个就行了. rolan1211年前2
rolan1211年前2 -
 zgst 共回答了22个问题
zgst 共回答了22个问题 |采纳率72.7%因为题干中假设了“如果这些热量全部由C燃烧来提供”,所以分解需要多少热量,就得让碳放出多少热量吧,应该没别的意思.1年前查看全部
- 25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、285.8kJ/mol、890.3k
25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、285.8kJ/mol、890.3kJ/mol、2800kJ/mol,则下列热化学方程式正确的是 [ ]
A.C(s)+1/2O 2 (g)==CO(g) △H=-393.5kJ/mol
B.2H 2 (g)+O 2 (g)==2H 2 O(g) △H=+571.6kJ/mol
C.CH 4 (g)+2O 2 (g)==CO 2 (g)+2H 2 O(g) △H=-890.3kJ/mol
D.1/2C 6 H 12 O 6 (s)+3O 2 (g)==3CO 2 (g)+3H 2 O(l) △H=-1400kJ/mol liujiye1191年前1
liujiye1191年前1 -
 crystal__prince 共回答了14个问题
crystal__prince 共回答了14个问题 |采纳率100%D1年前查看全部
- 已知在101kPa时,C(石墨)、H 2 和CO的燃烧热分别为393.5kJ/mol、285.8kJ/mol和282.8
已知在101kPa时,C(石墨)、H 2 和CO的燃烧热分别为393.5kJ/mol、285.8kJ/mol和282.8kJ/mol.现有H 2 和CO组成的混合气体112L(标况),经充分燃烧后,放出总热量为1420kJ,并生成液态水.下列热化学方程式或描述中正确的是( ) A.2CO(g)+O 2 (g)═2CO 2 (g);△H=+282.8kJ/mol B.2H 2 (g)+O 2 (g)═2H 2 O(g);△H=-571.6kJ/mol C.C(石墨,s)+
O 2 (g)═CO(g);△H=-110.7kJ/mol1 2 D.燃烧前混合气体中H 2 的体积百分数为50%  paintery21年前1
paintery21年前1 -
 eddie_lolo 共回答了12个问题
eddie_lolo 共回答了12个问题 |采纳率83.3%A、一氧化碳燃烧热为282.8kJ/mol,依据燃烧热概念,热化学方程式为,CO(g)+
1
2 O 2 (g)═CO 2 (g);△H=-282.8 kJ/mol,故A错误;
B、氢气燃烧热为285.8kJ/mol,热化学方程式为:2H 2 (g)+O 2 (g)═2H 2 O(l);△H=-571.6 kJ/mol,故B错误;
C、一氧化碳燃烧热化学方程式为,CO(g)+
1
2 O 2 (g)═CO 2 (g);△H=-282.8 kJ/mol,碳燃烧热化学方程式为:C(s)+O 2 (g)═CO 2 (g);△H=-393.5 kJ/mol,两式相减得到C(石墨,s)+
1
2 O 2 (g)═CO(g);△H=-110.7 kJ/mol,故C正确;
D、H 2 和CO组成的混合气体112L(标况)物质的量为5mol,经充分燃烧后,放出总热量为1420kJ,并生成液态水,依据氢气和一氧化碳燃烧热的热化学方程式计算,设氢气物质的量为x,一氧化碳物质的量为y,则x+y=5,285.8x+282.8y=1420,计算得到x=2,y=3,燃烧前混合气体中H 2 的体积百分数=
2
5 ×100%=40%,故D错误;
故选:C.1年前查看全部
- 已知两个热化学方程式:C(s)+O2(g)===CO2(g) 焓变=-393.5kJ/mol
已知两个热化学方程式:C(s)+O2(g)===CO2(g) 焓变=-393.5kJ/mol
2H2(g)+O2(g)===2H2O(g) 焓变=-483.6kJ/mol
现有碳粉和氢气组成的悬浮气共0.2mol,使其在氧气中完全燃烧,共放出63.53kJ热量,则碳粉与氢气的物质的量之比是
A.1:1 B.1:2 C.2:3 D.3:2 skyln1年前2
skyln1年前2 -
 南牌奶粉 共回答了19个问题
南牌奶粉 共回答了19个问题 |采纳率84.2%A
0.2C(s)+0.2O2(g)===0.2CO2(g) -78.7kJ/mol
0.2X. 78.7X
0.2H2(g)+0.1O2(g)===0.2H2O(g) -48.36kJ/mol
0.2Y .48.36Y
78.7X+48.36Y=63.53
X+Y=1
得到1:11年前查看全部
- 已知在25度,10^5Pa时,1mol石墨.一氧化碳的燃烧的反应热分别是393.5KJ/mol和283KJ/mol,下列
已知在25度,10^5Pa时,1mol石墨.一氧化碳的燃烧的反应热分别是393.5KJ/mol和283KJ/mol,下列说法或方程式正确的是
A.在相同条件下,2C(S,石墨)+O2(g)=2CO(g) H=-110.5KJ/mol
B.1mol石墨不完全燃烧,生成CO2和CO的混合气体时,放热504KJ
C.在相同条件下,C(S,石墨)+CO2(g)=2CO(g) H=172.5KJ/mol
D.若1mol金刚石燃烧的反应放热大于1mol石墨燃烧的反应热,则石墨转边成金刚石需要放热
D.若1mol金刚石燃烧的反应热大于1mol石墨燃烧的反应热,则石墨转边成金刚石需要放热
我觉得应该选D吧。(改完后?) desertsha1年前1
desertsha1年前1 -
 chenying52 共回答了19个问题
chenying52 共回答了19个问题 |采纳率100%C+O2=CO2-------①,△H1=-393.5kJ/mol
2CO+O2=2CO2-----②,△H2=-566kJ/mol
则,2C+O2=2CO-----③,△H3
①×2-②=③ ,△H3=2×△H1-△H2=-221 kJ/mol
故,AB均错
若1mol金刚石燃烧的反应放热大于1mol石墨燃烧的反应热,说明金刚石的能量高于石墨,则石墨转边成金刚石需要吸热,D错
正确答案为C
C(S,石墨)+CO2(g)=2CO(g) 这个反应由①-②得到,则 ,△H=△H1-△H2=-+172.5 kJ/mol1年前查看全部
- 已知:C(s)+O2(g)=CO2(g);△H=-393.5kJ/mol
已知:C(s)+O2(g)=CO2(g);△H=-393.5kJ/mol
H2(g)+[1/2]O2(g)=H2O(l);△H=-241.8kJ/mol
欲得到相同的热量,需分别燃烧固体碳和氢气的质量比约为( )
A.2:3.25
B.12:3.25
C.1:1
D.393.5:241 fengxiangni1年前1
fengxiangni1年前1 -
 沐骊鸸 共回答了17个问题
沐骊鸸 共回答了17个问题 |采纳率100%解题思路:假设它们都是1g,则1gH2(g)放出的热量为[241.8/2]kJ;1gC(s)放出的热量为[393.5/12]kJ,利用物质的质量=[热量/1g该物质燃烧放出的热量]解答.假设它们都是1g,则1gH2(g)放出的热量为[241.8/2]kJ;1gC(s)放出的热量为[393.5/12]kJ,欲得到相同的热量,需分别燃烧固体碳和氢气的质量比约利用物质的质量=
Q
393.5
12
Q
241.8
2=[241.8×12/393.5×2]=[12/3.25],故选B.点评:
本题考点: 有关反应热的计算.
考点点评: 本题主要考查了反应热的计算,反应中热量与计量系数成正比,难度不大.1年前查看全部
- (2012•长春一模)25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是△H=-393.5kJ/mol、△H=
(2012•长春一模)25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是△H=-393.5kJ/mol、△H=-285.8kJ/mol、△H=-890.3kJ/mol、△H=-2800kJ/mol,则下列热化学方程式正确的是( )
A.C(s)+[1/2]O2(g)═CO(g)△H=-393.5 kJ/mol
B.2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol
C.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol
D.[1/2]C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(g)△H=-1400 kJ/mol 有TMC-3的人1年前1
有TMC-3的人1年前1 -
 sev7n831021 共回答了9个问题
sev7n831021 共回答了9个问题 |采纳率77.8%解题思路:燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量,依据概念分析判断.A、反应中生成的一氧化碳不是最稳定氧化物,故A错误;
B、氢气燃烧最稳定的产物是液态水,并且燃烧是放热反应,符合燃烧热的含义,故B正确;
C、甲烷燃烧生成物气体水不是稳定氧化物,故C错误;
D、燃烧生成物气体水不是稳定氧化物,不符合燃烧热的概念,故D错误;
故选:B.点评:
本题考点: 热化学方程式.
考点点评: 本题考查热化学方程式的书写,注意反应物、生成物的状态与反应热的关系是关键,难度不大.1年前查看全部
- (2013•哈尔滨模拟)25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、285.8k
(2013•哈尔滨模拟)25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、285.8kJ/mol、890.3kJ/mol、2800kJ/mol,则下列热化学方程式正确的是( )
A.C(s)+[1/2]O2(g)═CO(g)△H=-393.5kJ/mol
B.2H2(g)+O2(g)═2H2O(g)△H=+571.6kJ/mol
C.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ/mol
D.[1/2]C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=-1400kJ/mol 浪子无羽1年前1
浪子无羽1年前1 -
 yujun1978 共回答了16个问题
yujun1978 共回答了16个问题 |采纳率100%解题思路:燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,根据燃烧热的定义判断热化学方程式是否正确.A.C完全燃烧应生成CO2,生成CO,反应热小于393.5kJ/mol,故A错误;
B.H2完全燃烧生成的稳定的氧化物为液态水,故B错误;
C.CH4完全燃烧生成稳定的氧化物为CO2和液态水,故C错误;
D.1mol葡萄糖完全燃烧生成CO2和H2O(l),燃烧热为2800kJ/mol,则[1/2]mol葡萄糖完全燃烧放出1400kJ热量,故D正确.
故选D.点评:
本题考点: 热化学方程式.
考点点评: 本题考查热化学方程式,题目难度不大,本题注意把握燃烧热的概念,特别是水,稳定状态为液态.1年前查看全部
- 已知:C(s)+O2(g)═CO2(g);△H=-393.5kJ/mol;
已知:C(s)+O2(g)═CO2(g);△H=-393.5kJ/mol;
H2(g)+[1/2]O2(g)═H2O(l);△H=-285.8kJ/mol,
现有0.2mol的炭粉和氢气组成的悬浮气,因混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中C与H2的物质的量之比约为( )
A.1:2
B.1:1
C.2:5
D.3:2 宁小米1年前1
宁小米1年前1 -
 52525 共回答了22个问题
52525 共回答了22个问题 |采纳率77.3%解题思路:物质放出的热量数值与物质的物质的量成正比,依据C、H2燃烧的热化学方程式分别计算出各自反应放出的热量据此解答.设0.2mol的炭粉和氢气中碳的物质的量为xmol,氢气的物质的量为ymol,依据C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1,xmol碳燃烧放出的热量为393.5xkJ;依据H2(g)+[1/2]O2(g)═H2O(l);△H=-285.8kJ/mol,现,ymol氢气燃烧放出的热量285.8×yKJ,由题意得:
393.5xkJ+285.8×ykJ=63.53kJ,
x+y=0.2mol,
解得:x=0.1mol,y=0.1mol 所以混合物中C与H2的物质的量之比为0.1mol:0.1mol=1:1,
故选B.点评:
本题考点: 有关反应热的计算.
考点点评: 本题考查了燃烧热的概念和热化学方程式的书写和计算,题目较简单,注意焓变计算和物质聚集状态的标注.1年前查看全部
- 高中化学反应热问题已知两个热化学方程式: C(s)+O2(g) = CO2(g) △H=-393.5kJ/mol 2H2
高中化学反应热问题
已知两个热化学方程式:
C(s)+O2(g) = CO2(g) △H=-393.5kJ/mol
2H2(g)+O2(g) = 2H2O(g) △H=-483.6kJ/mol
现有炭粉和H2组成的悬浮气共0.2mol,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是
A.2︰3 B.1︰2 C. 1︰1 D.3︰2 lijiaxin16661年前4
lijiaxin16661年前4 -
 网游一刀拿下 共回答了22个问题
网游一刀拿下 共回答了22个问题 |采纳率95.5%这道题 考到的主要是数学能力
设 碳粉 物质的量为 x mol H2 物质的量为 y mol
则 x+y=0.2
393.5x+483.6/2y=63.53
解得
x=0.1 y=0.1
则 选 C1年前查看全部
- 实验测得碳单质、氢气、甲烷的燃烧热(△H)分别为-393.5kJ/mol、-285.8kJ/mol、-890.3kJ/m
实验测得碳单质、氢气、甲烷的燃烧热(△H)分别为-393.5kJ/mol、-285.8kJ/mol、-890.3kJ/mol.则CH4(g)═C(s)+2H2(g)的反应焓变(△H)为( )
A. -74.8 kJ/mol
B. +74.8 kJ/mol
C. -211kJ/mol
D. +211kJ/mol 落叶芬飞雪1年前1
落叶芬飞雪1年前1 -
 wang_123 共回答了12个问题
wang_123 共回答了12个问题 |采纳率100%解题思路:燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,表示燃烧热的热化学方程式中可燃物为1mol,产物为稳定氧化物.碳单质、氢气、甲烷的热化学方程式分别为:
①C(S)+O2(g)═CO2(g)△H=-393.5kJ/mol;②H2(g)+[1/2]O2(g)═H2O(l)△H=-285.8kJ/mol;③CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol,根据盖斯定律构造目标热化学方程式解答.实验测得碳单质、氢气、甲烷的燃烧热(△H)分别为-393.5kJ/mol、-285.8kJ/mol、-890.3kJ/mol,则它们的热化学反应方程式分别为:①C(S)+O2(g)═CO2(g)△H=-393.5kJ/mol;②H2(g)+[1/2]O2(g)═H2O(l)△H=-285.8kJ/mol;③CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol;根据盖斯定律③-(①+②×2)得CH4(g)=C(S)+2H2(g),故△H=(-890.3KJ/mol)-【(-393.5KJ/mol)+(-285.8kJ/mol)×2】=+74.8KJ/mol,
故选B.点评:
本题考点: 用盖斯定律进行有关反应热的计算.
考点点评: 本题考查反应热的有关计算,注意掌握根据盖斯定律、燃烧热等进行的计算,题目难度中等.1年前查看全部
- 化学反应中的热效应已知:C(s)+ O2(g)= CO2(g) △H = -393.5kj/molCaCO3(g)= C
化学反应中的热效应
已知:
C(s)+ O2(g)= CO2(g) △H = -393.5kj/mol
CaCO3(g)= CaO(s)+ CO2(g) △H = 178.2kj/mol
若要将1t碳酸钙煅烧成生石灰,理论上需要用多少千克焦炭? 红娘0011年前1
红娘0011年前1 -
 工业电风扇 共回答了21个问题
工业电风扇 共回答了21个问题 |采纳率95.2%CaCO3(g)= CaO(s)+ CO2(g) △H = 178.2kj/mol
100g
1000kg
将1t碳酸钙煅烧成生石灰,所需能量为(1000kg/100g)*178.2kJ=1782000kJ
需要用焦炭的物质的量=1782000kJ/393.5kJ/mol =4528.59mol
需要用焦炭的质量=4528.59mol*12=54343g=54.343kg1年前查看全部
- 已知1molCaCO 3 分解需要吸收178kJ 热量,1mol焦炭完全燃烧放出393.5kJ ,试回答下列问题
已知1molCaCO 3 分解需要吸收178kJ 热量,1mol焦炭完全燃烧放出393.5kJ ,试回答下列问题
(1)写出碳酸钙分解的热化学反应方程式
(2)试计算如果0.5t CaCO 3 煅烧成CaO(s),在理论上要用焦炭多少千克 虎步阳关1年前1
虎步阳关1年前1 -
 野翛 共回答了18个问题
野翛 共回答了18个问题 |采纳率100%(5分)(1)CaCO 3 (s)=" CaO(s)+" CO 2 (g),△H="+178kJ/mol" (2)27.14kg
1年前查看全部
- (1)已知:C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
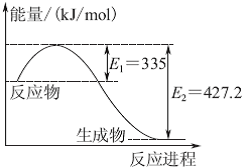 (1)已知:C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
(1)已知:C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
请回答:①写出常温下,固体单质C与气体O2反应生成CO气体的热化学方C(s)+[1/2]O2(g)═CO(g)△H=-110.5KJ/molC(s)+[1/2]O2(g)═CO(g)△H=-110.5KJ/mol.
②若24g C单质与一定量的O2充分反应后,放出了362.5kJ热量,则所得各产物的物质的量之比为______.
(2)合成氨在工农业生产与生活中有着重要作用.请根据下列要求回答问题:
①如图是N2与H2反应生成2mol NH3过程中的能量变化示意图,请写出该反应的热化学反应方程式______
②根据反应特点,在反应过程中不再添加任何反应物前提下,若要进一步提高氮气的转化率,可采用______方法. 下好片子1年前1
下好片子1年前1 -
 ttk2002 共回答了16个问题
ttk2002 共回答了16个问题 |采纳率100%解题思路:(1)①依据盖斯定律计算得到所需热化学方程式;
②若24gC单质与一定量的O2充分反应后,放出了362.5kJ热量,说明碳没有完全燃烧,生成CO和CO2,利用热化学方程式计算;
(2)①先求出此反应的焓变,根据热化学方程式的书写规则再写出热化学方程式;
②提高氮气的转化率,应使平衡向正反应方向移动,利用浓度、温度、压强对化学平衡的影响来判断.(1)①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol ①
2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ/mol ②
依据盖斯定律①-②×[1/2]得到:C(s)+[1/2]O2(g)═CO(g)△H=-110.5KJ/mol;
故答案为:C(s)+[1/2]O2(g)═CO(g)△H=-110.5KJ/mol;
②若24gC单质与一定量的O2充分反应后,放出了362.5kJ热量,说明碳没有完全燃烧,生成CO和CO2,设生成xmolCO2,ymolCO,
则
x+y=
24
12
393.5x+110.5y=362.5,
解之得x=0.5,y=1.5,则x:y=1:3,
故答案为:1:3;
(2)①反应物总能量大于生成物总能量,应为放热反应,生成2mol氨气放出92.2kJ热量,则反应的热化学方程式为N2(g)+3H2(g)⇌2NH3(g)△H=-92.2kJ/mol,
故答案为:N2(g)+3H2(g)⇌2NH3(g)△H=-92.2kJ/mol;
③提高氮气的转化率,应使平衡向正反应方向移动,可降温或及时液化并分离出NH3或加压,
故答案为:降温或及时液化并分离出NH3或加压.点评:
本题考点: 热化学方程式;有关反应热的计算.
考点点评: 本题主要考查化学反应与能量变化知识,注意物质的总能量、键能与反应热的计算关系,把握盖斯定律的计算方法,题目难度中等.1年前查看全部
- 12g碳完全燃烧是可放出393.5kj的热,若完全燃烧27g碳,放出多少热量
 StoneSu1年前4
StoneSu1年前4 -
 cuiwei_9999 共回答了19个问题
cuiwei_9999 共回答了19个问题 |采纳率89.5%12g碳完全燃烧是可放出393.5KJ的热,若完全燃烧27g碳,放出多少热量?
设完全燃烧27g碳,放出的热量为Q KJ,则据题意有:
12g 393.5 KJ
27g Q
列比,12:27 = 393.5:Q
解得:Q = 885.375 (KJ)
即为所求.1年前查看全部
- 化学,急,马上就要!已知下列两个热化学方程式: C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol^-1
化学,急,马上就要!
已知下列两个热化学方程式:
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol^-1
2H2(g)+O2(g)=2H2O(g) △H=-483.6KJ·mol^-1
现有0.2mol碳粉和氢气组成的悬浮气体,在氧气中完全燃烧,功放出63.53kJ的热量,则碳和氢气的质量之比是________
答案为1:1
请各位大大们帮帮忙计算一下并请写出详细的计算过程,谢谢 annulment1年前1
annulment1年前1 -
 ybccrea 共回答了18个问题
ybccrea 共回答了18个问题 |采纳率94.4%设C有x mol;则H2有(0.2-x)mol
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol^-1
1 393.5
x 393.5x --(1)
2H2(g)+O2(g)=2H2O(g) △H=-483.6KJ·mol^-1
2 483.6
0.2-x 483.6*(0.2-x)/2---(2)
由(1)+(2)=63.53:
x=0.1 mol,即:C有0.1 mol;则H2有(0.2-0.1)=0.1mol,应该是物质的量之比.1年前查看全部
- 已知C(石墨)、H 2 和CO的燃烧热分别为393.5kJ/mol、285.8kJ/mol和282.8kJ/mol。现有
已知C(石墨)、H 2 和CO的燃烧热分别为393.5kJ/mol、285.8kJ/mol和282.8kJ/mol。现有H 2 和CO组成的混合气体56. 0L(标准状况),经充分燃烧后,放出总热量为710.0kJ,并生成液态水。下列热化学方程式或描述中,正确的是 [ ]A. 2CO(g)+O 2 (g)=2CO 2 (g) △H=+282.8kJ/mol
B. 2H 2 (g)+O 2 (g)=2H 2 O(g) △H=-571.6kJ/mol
C. C(石墨,s)+1/2O 2 (g)=CO(g) △H=-110.7kJ
D. 燃烧前混合气体中,H 2 的体积分数为40% 诶彼西帝1年前1
诶彼西帝1年前1 -
 出没猩鼯号 共回答了25个问题
出没猩鼯号 共回答了25个问题 |采纳率88%D1年前查看全部
- 已知下列数据:△fHmΘ(CO2,g)= -393.5KJ/mol△fHmΘ(Fe2O3,s)= -822.2KJ/mo
已知下列数据:
△fHmΘ(CO2,g)= -393.5KJ/mol
△fHmΘ(Fe2O3,s)= -822.2KJ/mol
△fGmΘ(CO2,g)= -394.4KJ/mol
△fGmΘ(Fe2O3,s)= -741.0KJ/mol
求反应Fe2O3(s) + 3/2C(s) → 2Fe(s) + 3/2CO2(g)在什么温度下能自发进行?
得到Fe2O3和CO2的ΔfSmΘ
CFe未知 如何求总反应的△S?
还有CFe的标准生成热是不是0? 5ysru21年前1
5ysru21年前1 -
 回来的爱人 共回答了22个问题
回来的爱人 共回答了22个问题 |采纳率100%标准生成热和标准生成吉布斯自由能一样,最稳定的单质为0
根据反应,可以从吉布斯自由能和焓变,该数据所在的温度求出该温度下的总熵变.
然后就可以根据各函数随温度的变化,求出该反应自发进行的温度了.
仅供参考1年前查看全部
- 一道热化学方程式题,已知:C(S)+O2(G)=CO2(G) ►H=-393.5KJ/MOL H2(g)+0.5O2(g
一道热化学方程式题,
已知:C(S)+O2(G)=CO2(G) ►H=-393.5KJ/MOL H2(g)+0.5O2(g)=H2O(l) ►H=-241.8KJ/MOL
欲得到相同的热量,须分别燃烧固体碳和氢的质量比约为()
A2:3.25 B12:3.25 C1:1 D393.5:241.8 羽爵1年前2
羽爵1年前2 -
 Α_α 共回答了17个问题
Α_α 共回答了17个问题 |采纳率94.1%让焓变相同就行了 -393.5/(-241.8)=1.627 1.627*2=3.25(g) 碳的质量为12g,那就选B1年前查看全部
- 已知热化学方程式 C(g)+O2(g)=CO2(g); △H=-393.5kJ/mol H2(g)+1/2O2(g)=h
已知热化学方程式 C(g)+O2(g)=CO2(g); △H=-393.5kJ/mol H2(g)+1/2O2(g)=h2o(g); △H=-28.58kJ/mol
试通过计算说明等质量的氢气和碳燃烧时产生热量的比 分众天下1年前2
分众天下1年前2 -
 mitang662000mita 共回答了15个问题
mitang662000mita 共回答了15个问题 |采纳率93.3%12g碳产生的热量是393.5KJ
2g氢气产生的热量是28.58KJ
那么等质量的热量比就是393.5/12:28.58/2
答案就自己算吧1年前查看全部
- 已知热化学方程式 C(g)+O2(g)=CO2(g); △H=-393.5kJ/mol H2(g)+1/2O2(g)=h
已知热化学方程式 C(g)+O2(g)=CO2(g); △H=-393.5kJ/mol H2(g)+1/2O2(g)=h2o(g); △H=-28.58kJ/mol
欲得到相同的热量,需分别燃烧固体碳和氢气的质量比为 cold-mountain1年前2
cold-mountain1年前2 -
 babaa 共回答了19个问题
babaa 共回答了19个问题 |采纳率78.9%H2(g)+1/2O2(g)=h2o(g); △H=-285.8kJ/mol
n(C)x393.5=n(H2)x285.8
n(c)/n(H2)=285.8/393.5
m(c)/m(H2)=285.8x12/393.5x2=4.36:11年前查看全部
大家在问
- 1(本小题满分12分)如图1,已知抛物线经过坐标原点 和 轴上另一点 ,顶点 的坐标为 ;矩形 的顶点 与点 重合, 分别
- 2听下面一段材料,回答第1-3题。
- 3I 'd like 8 by 10 blow ups of these negatives.这里的up怎么会加s?blo
- 4初一有几门主课?它们分别是什么?
- 5VB中表示条件“变量X为能被7整除的奇数”的逻辑表达式是
- 6This watch is _____ to all the other watches on the market.
- 7五年级第八单元作文人教版 上册选一个场景,要按时间顺序写班级联欢会或学校开展的一次活动最好多写几篇
- 8已知直线√3x-3y-3=0 则直线的倾斜角是
- 9求一篇六年级上的英语小作文.急.明天就要交.单词要简单.帮个忙啊
- 10下列有关亚洲的世界之最叙述不正确的是( )
- 11同义句转化,划线句提问1.This computer is the cheapest of the three.This
- 12在等差数列{an}中,a1+a9=10,则a5的值为______.
- 13Look at the blackboard 改为否定句
- 14英语作文:想象一个事物,写一篇关于它的外貌和作用.你可以使用这些句子:I‘m sure it will...,but I
- 15数学---圆弧如图以等腰三角形ABC的腰AC为直径的半圆O交另一腰AB于点E,交底边BC于点D,弧DE于弧DC有什么关系
