风吹海水千层浪,雨打沙滩万点坑是什么意思
 123娃哈哈2022-10-04 11:39:542条回答
123娃哈哈2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 移动阿瓜 共回答了22个问题
移动阿瓜 共回答了22个问题 |采纳率86.4%- 海风吹着海水,形成一层一层的浪,不停地冲向海岸,雨滴下在了沙滩上,沙子上便出现了许许多多的小坑.
- 1年前
 祖厉河zlh 共回答了25个问题
祖厉河zlh 共回答了25个问题 |采纳率- 很真实的情景
- 1年前
相关推荐
- 近年来有人提出了利用海水(含氯化钠)处理含二氧化硫的废气,该方法的流程如下:
近年来有人提出了利用海水(含氯化钠)处理含二氧化硫的废气,该方法的流程如下: 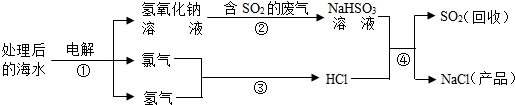
(1)上图中从海水最终得到“NaCl(产品)”的过程属于______(填“物理变化”或“化学变化”).
(2)图中反应①、③、④属于化合反应的是______ (填序号).
(3)①中的反应物是氯化钠和______,该反应的化学方程式为______.
(4)反应④的化学方程式为______. hermitwing1年前1
hermitwing1年前1 -
 阿飞甲 共回答了21个问题
阿飞甲 共回答了21个问题 |采纳率90.5%(1)从海水最终得到“NaCl(产品)”是反应生成的氯化钠,该变化属于化学变化.故答案为:化学变化.
(2)氯气和氢气反应生成氯化氢的反应属于化合反应.故答案为:③
(3)①中的反应物是氯化钠和水.故答案为:水.反应的化学方程式为:2NaCl+2H 2 O
通电
.
2NaOH+H 2 ↑+Cl 2 ↑
(4)反应④的化学方程式为:NaHSO 3 +HCl═NaCl+H 2 O+SO 2 ↑1年前查看全部
- 海水中所含元素有哪些
 秋ヅ水1年前5
秋ヅ水1年前5 -
 352153833 共回答了20个问题
352153833 共回答了20个问题 |采纳率95%海水是一种非常复杂的多组分水溶液.海水中各种元素都以一定的物理化学形态存在.在海水中铜的存在形式较为复杂,大部分是有机络合物形式存在的.在自由离子中仅有一小部分以二价正离子形式存在大部分都是以负离子络合物出现.所以自由铜离子仅占全部溶解铜的一小部分.海水中有含量极为丰富的钠,但其化学行为非常简单.它几乎全部以Na+离子形式存在.
海水中的溶解有机物十分复杂,主要是一种叫做“海洋腐殖质”的物质,它的性质与土壤中植被分解生成的腐殖酸和富敏酸类似.海洋腐殖质的分子结构还没有完全确定,但是它与金属能形成强络合物. 海水中的成分可以划分为五类: 1.主要成分(大量、常量元素):指海水中浓度大于1×106mg/kg的成分.属于此类的有阳离子Na+,K+,Ca2+,Mg2+和Sr2+五种,阴离子有Cl¯,SO42¯,Br¯,HCO3¯(CO32¯),F¯五种,还有以分子形式存在的H3BO3,其总和占海水盐分的99.9%.所以称为主要成分. 由于这些成分在海水中的含量较大,各成分的浓度比例近似恒定,生物活动和总盐度变化对其影响都不大,所以称为保守元素. 海水中的Si含量有时也大于1mg/kg,但是由于其浓度受生物活动影响较大,性质不稳定,属于非保守元素,因此讨论主要成分时不包括Si. 2.溶于海水的气体成分,如氧、氮及惰性气体等. 3.营养元素(营养盐、生源要素):主要是与海洋植物生长有关的要素,通常是指N、P及Si等.这些要素在海水中的含量经常受到植物活动的影响,其含量很低时,会限制植物的正常生长,所以这些要素对生物有重要意义. 4.微量元素:在海水中含量很低,但又不属于营养元素者. 5.海水中的有机物质:如氨基酸、腐殖质、叶绿素等1年前查看全部
- 海水中元素含量排列从大到小
 flightflight1年前1
flightflight1年前1 -
 brokenball007 共回答了22个问题
brokenball007 共回答了22个问题 |采纳率86.4%海水的成分是很复杂的.海水中化学元素的含量差别很大.除氢和氧外,每升海水中含量在 1 毫克以上的元素有Cl、Na、Mg、S、Ca、K、Br、C、Sr、B 和 F 11种,一般称为“主要元素”.每升海水中含量在 1 毫克以下的元素,叫“微量元素”或“痕量元素”.海水中几种主要无机盐的浓度如下:Cl- 19.10g/kg,Na+ 10.62 g/kg,SO4-- 2.66g/kg,Mg+ + 1.28g/kg,Ca+ + 0.40g/kg,K+ 0.38g/kg,痕量元素 0.25g/kg.参考:《海洋手册》,郭 琨 编著,海洋出版社,1984年.另外 海水是一种化学成分复杂的混合溶液,包括水、溶解干水中的多种化学元素和气体.迄今已发现的化学元素达80多种,依其含量可分为三类:、常量元素、微量元素和痕量元素.有时,后两类也通称微量元素.每升海水超过100毫克的元素.称为常量元素.最主要的常量元素有氧、钠、镁、硫、钙、钾、溴 、碳、鳃、硼、氟11种,约占化学元素总含量的99.99.9 .其他化学元素含量极少,其中,每升海水含有l~100毫克的元素.称为微量元素.如铁、钼、钾、铀、碘等.每升海水含有1毫克以下的元素称为痕量元素.如金、银、镉等.溶解于海水中的化学元素绝大多数是以盐类离子的形式存在的,其中氯化钠最多,占88.6%,硫酸盐占10.8%.海水的常量元素之间的浓度比例几乎不变.具有恒定性,这对于研究海水浓度具有重要意义. 海水的主要盐分 盐类组成成分 每千克海水中的克数 百分比 氯化钠 27.2 77.7 氯化镁 3.8 10.9 硫酸镁 1.7 4.9 硫酸钙 1.2 3.6 硫酸钾 0.9 2.5 碳酸钙 0.1 0.3 溴化镁及其他 0.1 0.3 总计 35.0 100.0 海水中的气体主要由氮、氧和二氧化碳组成.氮占64%,氧化碳约占2%,氧易溶于水,并随水温增高而减少,温度0℃时.约占40%.1年前查看全部
- 100克海水能晒出3克盐,要晒出3千克盐需要海水()千克.1吨海水能晒出盐()千克
 为钱出卖一切1年前1
为钱出卖一切1年前1 -
 来跟泡泡扎 共回答了12个问题
来跟泡泡扎 共回答了12个问题 |采纳率91.7%这道题应该是问重量的比例换算,1吨=1000千克=1000*1000克.1千克=1000克
则 要晒出3千克的盐需要海水3000/3*100=100000克=100千克
1吨海水能晒出1000000/100*3=30000克=30千克1年前查看全部
- 养鱼需要海水比重为1.005 按1升水来算 要加多少克的盐才能达到1.005的比重
 落-叶11年前1
落-叶11年前1 -
 9812036 共回答了15个问题
9812036 共回答了15个问题 |采纳率86.7%0.005克1年前查看全部
- 海水是咸水,但却可以变成淡水跑到陆地上来,在这一过程中,包含了水的哪几种物态变化?
 鬼魅女巫1年前2
鬼魅女巫1年前2 -
 lynn8431 共回答了17个问题
lynn8431 共回答了17个问题 |采纳率100%海水是液态混合物 液态变成气态主要是蒸发跟沸腾
海水汽化主要是蒸发
海水沸腾很少见哈 除非海底火山爆发 导致海水局部沸腾
海水汽化成水蒸气 水汽凝结成云
这就涉及到了云的构成了
云彩是由许多细小的水滴或冰晶组成的,有的是由小水滴或小冰晶混合在一起组成的
水蒸气变成液体水滴是液化
水蒸气变成冰晶是凝结
水汽从蒸发表面进入低层大气后,这里的温度高,所容纳的水汽较多,如果这些湿热的空气被抬升,温度就会逐渐降低,到了一定高度,空气中的水汽就会达到饱和.如果空气继续被抬升,就会有多余的水汽析出.如果那里的温度高于0°C,则多余的水汽就凝结成小水滴;如果温度低于0°C,则多余的水汽就凝化为小冰晶.在这些小水滴和小冰晶逐渐增多并达到人眼能辨认的程度时,就是云了.
当大气上升气流不能托住云层的时候就会降雨或者下冰雹降落到地面
冰雹落地后如果温度合适就会 液化
还有一种情况 就是平时早上看见的 霜露
霜是固态 由水蒸气 直接凝结成
露是液态 由水蒸气 液化而成1年前查看全部
- 一个晒盐场用500千克海水可以晒15千克盐.照这样计算,用100吨海水可以晒多少吨盐?
一个晒盐场用500千克海水可以晒15千克盐.照这样计算,用100吨海水可以晒多少吨盐?
不用换算单位么?
用比例方法解答 funkysoul1年前1
funkysoul1年前1 -
 lixiangdexin 共回答了14个问题
lixiangdexin 共回答了14个问题 |采纳率92.9%你好:因为比值(出盐率)一定,可以不用换算单位.只要前后项单位一致就行.
设用100吨海水可以晒x吨盐
x :100=15 :500
x=100×15÷500
x=3
答:用100吨海水可以晒3吨盐1年前查看全部
- 一辆船的吃水深度为4.4米,排水量是7000吨 求在海面下3米处海水对船的压强
一辆船的吃水深度为4.4米,排水量是7000吨 求在海面下3米处海水对船的压强
急 zhongcui1年前3
zhongcui1年前3 -
 流光一霎 共回答了20个问题
流光一霎 共回答了20个问题 |采纳率95%p=ρgh
p=1000×10×3
p=30000帕
液体压强和浸入液体的深度有关
船的吃水深度在此题中是迷惑条件1年前查看全部
- 下图表示枪乌贼离体神经纤维在Na+浓度不同的两种海水中受刺激后的膜电位变化情况.下列描述错误的是 A. 曲线a代表正常海
下图表示枪乌贼离体神经纤维在Na+浓度不同的两种海水中受刺激后的膜电位变化情况.下列描述错误的是 A. 曲线a代表正常海水中膜电位的变化 B. 两种海水中神经
下图表示枪乌贼离体神经纤维在Na+浓度不同的两种海水中受刺激后的膜电位变化情况.下列描述错误的是
A. 曲线a代表正常海水中膜电的变化
B. 两种海水中神经纤维的静息电位同
C. 低Na+海水中神经纤维静息时,膜内Na+浓度高于膜外
D. 正常海水中b 图要顶点为什么是负

 嫣嫣宝贝1年前1
嫣嫣宝贝1年前1 -
 hh2005 共回答了19个问题
hh2005 共回答了19个问题 |采纳率100%答案是:C.
A正确,正常情况下(在正常海水中),神经纤维某处受刺激时会发生如图中a曲线所示的变化;
B正确,两种海水中静息电位是相同的,从坐标轴上可以看出都是—70.
C错,无论是哪种海水中,神经纤维静息时,膜内的钠都低于膜外;
D正确,解析见C项.
b 图要顶点为什么是负?
由于海水中的钠低,所以神经纤维受到刺激后,流入神经纤维内的钠不足以使电位变成外正内负.1年前查看全部
- 海水里面提取出250克,225克都是水,现在有这样的海水5000千克
海水里面提取出250克,225克都是水,现在有这样的海水5000千克
1、求海水的浓度
2、现在要浓度要成为百分之15,那还需要加入多少盐?
要有过程 秋秋baobao1年前1
秋秋baobao1年前1 -
 绥芬河市归 共回答了19个问题
绥芬河市归 共回答了19个问题 |采纳率100%1.10,
2.(x+500)/(x+5000)=15%
解出X=5000/17约等于294克1年前查看全部
- 山海关孟姜女庙联,海水朝,朝朝朝,朝朝朝落,浮云长,长长长消.多音字注音
 lijing_8307111年前1
lijing_8307111年前1 -
 奕柳楠 共回答了21个问题
奕柳楠 共回答了21个问题 |采纳率85.7%海水chao,zhaozhaochao ,zhaochao zhao 落,浮云zhang ,changchangzhang,changzhangchang消.1年前查看全部
- (2012•镇平县模拟)在打捞海底沉船时,常用水下机器人潜入水下打捞船上物品,已知ρ海水=1.03×103kg/m3,g
(2012•镇平县模拟)在打捞海底沉船时,常用水下机器人潜入水下打捞船上物品,已知ρ海水=1.03×103kg/m3,g=10N/kg,
(1)机器人在水下70m处受到海水产生的压强是多大?
(2)某时刻机器人在水下用竖直向上的力举着体积为0.02m3、密度为2.7×103kg/m3的物体静止不动,求该力的大小. johnnymao1年前1
johnnymao1年前1 -
 followme1 共回答了20个问题
followme1 共回答了20个问题 |采纳率90%解题思路:(1)已知机器人所处的深度,根据p=ρgh求出受到海水产生的压强;
(2)先根据阿基米德原理求出物体受到的浮力,再根据密度公式和G=mg求出物体的重力,最后对物体正确受力分析,然后由平衡条件得出机器人的举力.(1)机器人在水下70m处受到海水产生的压强:
p=ρ海水gh=1.03×103kg/m3×10N/kg×70m=7.21×105Pa;
(2)铝块受到的浮力:
F浮=ρ海水gv排=ρ海水gv=1.03×103kg/m3×10N/kg×0.02m3=206N,
铝块受到的重力:
G=mg=ρvg=2.7×103kg/m3×0.02m3×10N/kg=540N,
∵物体受竖直向下的重力G,竖直向上的浮力F浮,机器人向上的举力F,
∴机器人对铝块的举力为
F=G-F浮=540N-206N=334N.
答:(1)机器人在水下70m处受到海水产生的压强是7.21×105Pa.
(2)举力为334N.点评:
本题考点: 液体的压强的计算;密度公式的应用;重力的计算;阿基米德原理.
考点点评: 本题考查了密度公式、重力公式、阿基米德原理、液体压强公式的应用,关键是会分析机器人在水下举着物体静止不动时受到的力,即得出举力的表达式.1年前查看全部
- 海水是人类宝贵的自然资源,从海水中可以提取多种化工原料,下图是某工厂对海水资源综合利用的示意图:
海水是人类宝贵的自然资源,从海水中可以提取多种化工原料,下图是某工厂对海水资源综合利用的示意图: 
(1)请列举海水淡化的两种方法______、______.
(2)步骤Ⅰ中已获得Br 2 ,步骤Ⅱ中又将Br 2 还原为Br - ,其目的是:______.步骤Ⅱ用SO 2 水溶液吸收Br 2 ,吸收率可达95%,有关反应的离子方程式______
(3)在制取无水氯化镁时需要在干躁的HCl气流中加热MgCl 2 •6H 2 O的原因______
(4)电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用做镁蒸气的冷却剂的是______
A.H 2 B.CO 2 C.空气D.O 2 E.水蒸气
(5)从各种经营综合开发,打造大而强的现代企业以及本厂生产所需要的原料等方面来看,你认为该化工厂还可以再增加的生产项目的______.
(6)上述工艺中可以得到金属Mg,请写出工业上制备金属铝的化学方程式______. ywl011年前1
ywl011年前1 -
 imqun 共回答了23个问题
imqun 共回答了23个问题 |采纳率100%(1)海水淡化的方法有:蒸馏法、电渗析法、离子交换法等,
故答案为:蒸馏法、电渗析法、离子交换法及其他合理答案中的任意两种;
(2)步骤Ⅰ中已获得Br 2 ,步骤Ⅱ中又将Br 2 还原为Br - ,是为了富集溴元素,用SO 2 水溶液吸收Br 2 的原理方程式为:
Br 2 +SO 2 +2H 2 O=4H + +SO 4 2- +2Br - ,故答案为:富集溴元素;Br 2 +SO 2 +2H 2 O=4H + +SO 4 2- +2Br - ;
(3)氯化镁中的镁离子易水解,在干燥的HCl气流中,抑制了MgCl 2 水解,且带走MgCl 2 •6H 2 O受热产生的水汽,故能得到无水MgCl 2 ,故答案为:在干燥的HCl气流中,抑制了MgCl 2 水解,且带走MgCl 2 •6H 2 O受热产生的水汽,故能得到无水MgCl 2 ;
(4)能和金属镁发生反应的气体:氮气、氧气、二氧化碳、水,所以可以用氢气做镁蒸气的冷却剂,故选A;
(5)工业上,电解熔融的氧化铝可以获得金属铝,原理方程式为:2Al 2 O 3 (熔融)
电解
.
4Al+3O 2 ↑,故答案为:2Al 2 O 3 (熔融)
电解
.
4Al+3O 2 ↑.1年前查看全部
- 我们通常所说水资源是指( )A.海水资源B.地球上所有水C.陆地上淡水资源D.大气水
 飘荡的风铃1年前1
飘荡的风铃1年前1 -
 sir3241879 共回答了15个问题
sir3241879 共回答了15个问题 |采纳率80%解题思路:地球上的水资源,从广义来说是指水圈内水量的总体.包括经人类控制并直接可供灌溉、发电、给水、航运、养殖等用途的地表水和地下水,以及江河、湖泊、井、泉、潮汐、港湾和养殖水域等.水是一种重要的自然资源,我们通常所说的水资源,指陆地上的淡水资源.
故选:C.点评:
本题考点: 水资源的数量和存在形式.
考点点评: 此题属于基础题,较简单.1年前查看全部
- 我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务.
我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务.

(1)被称作海洋元素的是______(写元素符号).
(2)工业上常以食盐为原料制备氯气,再用氯气制备漂白粉,请写出漂白粉长期露置在空气中失效的有关反应的化学方式:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;2HClO
2HCl+O2↑光照 .Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;2HClO.
2HCl+O2↑光照 .
(3)从海水中提取食盐和溴的过程如图1:
①步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为富集溴元素,请写出步骤Ⅱ的化学方程式,______.
②在3mL溴水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象为图2中______. bobochou1年前1
bobochou1年前1 -
 zhang33bo 共回答了11个问题
zhang33bo 共回答了11个问题 |采纳率90.9%解题思路:(1)溴元素99%存在海洋中;
(2)漂白粉的有效成分是次氯酸钙,空气中含有二氧化碳和水蒸气,会和次氯酸钙反应生成次氯酸,次氯酸见光分解生成氧气和氯化氢失去漂白性;
(3)①海水淡化得到的母液和电解氯化钠溶液生成的氯气反应,得到的溴单质浓度低,溴单质在水中有一定的溶解性且和水反应,提取时消耗过的能源和原料,降低了经济效益;SO2吸收溴,依据氧化还原反应生成物书写基本规律,Br元素在自然中-1价稳定.由于此反应有强酸HBr和H2SO4生成,易腐蚀设备,顺利写出工业生产需要解决的问题;
②依据四氯化碳性质和溶解性,溴单质赵水中的溶解性和在四氯化碳中的溶解性不同分析判断;(1)地球上99%以上的溴都蕴藏在汪洋大海中,故溴有“海洋元素”的美称,故答案为:Br;
(2)工业上常以食盐为原料制备氯气,再用氯气制备漂白粉,请写出漂白粉长期露置在空气中失效,漂白粉的有效成分是次氯酸钙,空气中含有二氧化碳和水蒸气,会和次氯酸钙反应生成次氯酸,次氯酸见光分解生成氧气和氯化氢失去漂白性,反应的化学方程式为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO、2HClO
光照
.
2HCl+O2↑,
故答案为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;2HClO
光照
.
2HCl+O2↑;
(3)①步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,目的是低浓度的Br2溶液在提取时消耗过多的原料和能源,转化为HBr后易被氧化剂氯气氧化为溴单质,用于富集溴元素,二氧化硫吸收溴单质发生反应的化学方程式,SO2+Br2+2H2O=H2SO4+2HBr;故答案为:SO2+Br2+2H2O=H2SO4+2HBr;
②在3mL溴水中,加入1mL四氯化碳,振荡、静置后,四氯化碳是难溶于水比水重的液体,溴单质在四氯化碳中的溶解度大于水中的溶解度,故答案为:D;点评:
本题考点: 海水资源及其综合利用.
考点点评: 本题考查了海水资源的综合利用,海水提溴工艺,实验基本操作,漂白粉的性质应用,题目难度中等.1年前查看全部
- 根据如图海水综合利用的工业流程图,判断下列说法正确的是( )已知:MgCl2•6H2O受热生成Mg(OH)Cl和HCl
根据如图海水综合利用的工业流程图,判断下列说法正确的是( )已知:MgCl2•6H2O受热生成Mg(OH)Cl和HCl气体等
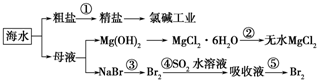
A.除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.在过程②中将MgCl2•6H2O灼烧即可制得无水MgCl2
C.从能量转换角度来看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程
D.从第③步到第⑤步的目的是为了浓缩 涂土1年前1
涂土1年前1 -
 香自苦寒来 共回答了23个问题
香自苦寒来 共回答了23个问题 |采纳率95.7%解题思路:A.过程①加入的药品顺序为BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸;
B、氯化镁易水解,为防止水解过程③中结晶出的MgCl2•6H2O要一定条件下加热脱水制得无水MgCl2;
C、电解原理分析,电解饱和食盐水是电能转化为化学能;
D、溴离子被氧化为溴单质后,被二氧化硫吸收生成溴离子,加入氧化剂氧化溴离子为溴单质,富集溴元素;A.过程①加入的药品顺序为BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸,如果再过滤沉淀前加入过量BaCl2溶液,稀盐酸不能除去氯化钡溶液,所以会产生杂质,故A错误;
B、氯化镁易水解,为防止水解,过程③中结晶出的MgCl2•6H2O要氯化氢氛围中加热脱水制得无水MgCl2,故B错误;
C、电解原理分析,电解饱和食盐水是电能转化为化学能,故C错误;
D、溴离子被氧化为溴单质后,被二氧化硫吸收生成溴离子,加入氧化剂氧化溴离子为溴单质,富集溴元素,从第③步到第⑤步的目的是为了浓缩,故D正确;
故选D.点评:
本题考点: 海水资源及其综合利用.
考点点评: 本题考查了海水资源的综合利用,明确该过程中发生的反应及反应原理是解本题关键,注意除杂剂的滴加顺序、由MgCl2•6H2O制备无水MgCl2的条件,为易错点,题目难度中等.1年前查看全部
- 海水中有取之不尽的化 海水中有取之不尽的化学资源,从海水中可提取多种化工原料.下图是某工厂对海水资源的综合利用的示意图.
海水中有取之不尽的化
海水中有取之不尽的化学资源,从海水中可提取多种化工原料.下图是某工厂对海水资源的综合利用的示意图. 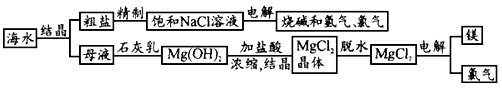
试回答下列问题:
(1)粗盐中含有Ca 2+ 、Mg 2+ 、SO 4 2- 等杂质,精制后可得NaCl饱和溶液,精制时通常在溶液中依次加入过量的BaCl 2 溶液,过量的NaOH溶液和过量的Na 2 CO 3 溶液,最后加入盐酸至溶液呈中性.请写出加入盐酸后可能发生的化学反应的离子方程式为__________________.
(2)海水提取食盐后的母液中含有K + 、Na + 、Mg 2+ 等阳离子.从离子反应的角度思考,在母液里加入石灰乳起什么作用?_______________________________________
(3)海水里的镁元素处于游离态还是化合态?从海水中提取氯化镁的反应是不是氧化还原反应?用电解法冶炼金属镁的反应是不是氧化还原反应?为什么?
____________________________________
(4)电解无水氯化镁所得的镁蒸气冷却后即为固体镁.请思考镁蒸气可以在下列哪种气体氛围中冷却___________
A.H 2 B.CO 2 C.空气D.O 2 cyhao25251年前1
cyhao25251年前1 -
 sbhaudio 共回答了19个问题
sbhaudio 共回答了19个问题 |采纳率94.7%(1)OH - +H + =H 2 O、CO 3 2- +2H + =H 2 O+ CO 2 ↑
(2)将Mg 2+ 转化为Mg(OH) 2 沉淀
(3)化合态;不是;是,因为发生了化合价的变化
(4)A1年前查看全部
- 世界七大洋中密度最大的海洋是那个?就问是马里亚纳海沟与西太平洋哪个地区的海水密度大?
 闷男1年前2
闷男1年前2 -
 dedicatedto3 共回答了21个问题
dedicatedto3 共回答了21个问题 |采纳率61.9%选择马里亚纳海沟的原因不是那样的,因为地球上海洋水深能够达到7000米的地方不多,只占总海洋面积的不到1%,马里亚纳海沟深11034米,是个难得深潜的好地方.1年前查看全部
- 怎样捉到活的深海鱼据说因为压强原因,深海鱼由深海到浅海会死亡.那么假设在海底深处,用一个密闭的箱子将深海鱼与附近的海水完
怎样捉到活的深海鱼
据说因为压强原因,深海鱼由深海到浅海会死亡.那么假设在海底深处,用一个密闭的箱子将深海鱼与附近的海水完全封闭起来,再取回海面,那么此时深海鱼还可能存活吗?或者说此时深海鱼在箱内受到的压强与之前海底深处受到的压强是否依然相同? 高山长风1年前1
高山长风1年前1 -
 CCTV-0 共回答了13个问题
CCTV-0 共回答了13个问题 |采纳率100%把人装到神舟飞船里,然后发射到太空,问人能不能活?答案是能活.把鱼装在密闭容器里,带到海面,如果这个密闭容器像神舟飞船一样,我认为也能活.1年前查看全部
- (u008•辽宁)海洋是r个巨大的资源库,我们可以从海水中提取食盐,并以此为原料制得具有广泛用途的烧碱.其制取的主要工艺
(u008•辽宁)海洋是r个巨大的资源库,我们可以从海水中提取食盐,并以此为原料制得具有广泛用途的烧碱.其制取的主要工艺流程如下:
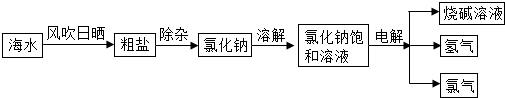
(1)利用风吹日晒可以从海水中提取粗盐,风吹日晒的主要作用是______.
(u)要除去食盐水中混有的少量泥沙,操作方法是______.
(1)写出电解氯化钠溶液的化学方程式umaCl+uHuO
umaOH+Hu↑+Clu↑通电 .umaCl+uHuO.
umaOH+Hu↑+Clu↑通电 .
(他)该化工厂将副产品氢气和氯气加以利用:氢气在氯气中燃烧生成氯化氢,氯化氢溶于水得到盐酸.写出氢气在氯气中燃烧的化学方程式:Hu+Clu
uHCl点燃 .Hu+Clu,通过这个化学反应,你对燃烧的新认识是______.
uHCl点燃 . 轩轩55号1年前1
轩轩55号1年前1 -
 qianj555 共回答了17个问题
qianj555 共回答了17个问题 |采纳率88.2%解题思路:(1)根据晒盐的原理分析即可;
(2)根据混合物分离的方法分析;
(3)根据题意再结合元素守恒分析即可;
(4)根据题目信息与燃烧的概念进行分析即可作答.(r)从海水中提取食盐采用蒸发结晶的方法,风吹日晒是为了加速水分的蒸发,故答案为:蒸发水分;(2)因为泥沙不溶于水,而氯化钠溶于水,所以可以采用过滤的方法滤去泥沙,故答案为:过滤;(五)根据题意:电解氯...
点评:
本题考点: 对海洋资源的合理开发与利用;过滤的原理、方法及其应用;结晶的原理、方法及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 可燃物在氧气中可以燃烧,但燃烧不一定需要氧气氧气参加,如:H2+Cl2 点燃 . 2HCl,同学们需要注意!1年前查看全部
- 淡水鱼为什么不能生活在水里为什么不能生活在海水里?
 犁地ss师1年前1
犁地ss师1年前1 -
 newjie 共回答了15个问题
newjie 共回答了15个问题 |采纳率93.3%淡水鱼在海水中是脱水而死的.而 海水鱼在淡水中是被撑死的.
一般说来,地球上海水的含盐浓度为16—47(一般为35),而淡水的含盐浓度只有0.01-0.5,两者相差悬殊.
海水鱼鱼体组织的含盐浓度比外界海水的含盐浓度要低得多,由于海水中有大量盐分,故比重高、密度大.根据渗透压原理,海水鱼鱼体组织中的水力,将不断地从鳃和体表向外渗出.为了保持体内水分平衡,海水鱼便不得不吞食大量海水,以弥补体内的失水.然而,由于大口大口地吞食海水,进入鱼体内的盐分也大大增加了,这样,海水鱼除了从肾脏排除掉一部分盐分外,主要还是依靠鳃组织中的“泌氯细胞”来完成排盐任务.此外,也有一些海水鱼,主要是软骨鱼类,如鲨鱼,则将代谢后的氮化物,以尿素形式贮存于血液中,使血液浓度增高,渗透压也变得与海水相当,这样,也就不存在吞水和排盐问题了.
淡水鱼与海水鱼大不一样,淡水鱼鱼体组织的含盐浓度比外界谈水的含盐浓度要高,也就是说,淡水的含盐浓度低、比重低、密度小,根据渗透压原理,外界淡水将不断地大量进入鱼体,为此,淡水鱼只有通过肾脏,将过多的水分排出体外.
有些鱼类是可以的,如大马哈鱼,七彩鲑鱼,鳗鱼等.这些鱼称为广盐性生物.
广盐性生物指生物可耐受外界广阔范围的盐分浓度变化而能生活的性质.具有这种性质的生物,称为广盐性生物.栖息于河口附近淡海水域的生物,干沙滩及大型水库的生物,往返于江河和海洋的回游鱼类等,均属于此类生物.动物要耐受外界环境盐分浓度的变化,有二种方法,第一是渗透适应型,常见的有栖于淡水海滨的体表渗透性高的无脊椎动物,例如贻贝、沙蠋属(Arenicola)蚕等,它们均能生活于100%至20—30%的海水水域,体液浓度与外界浓度为等渗的.另外,半陆生性的寄居虫能在50—200%的海水中生活.第二是渗透调节型,如鲽类(Pleuronecti-formes)、鲻属(Mugil)、虎鱼属(Gobius)、鳉鱼属(Oryzias)、大马哈鱼属(Oncorhynchus)、鳗鲡属(Anguilla)等硬骨鱼类,均能生活于淡水或10%海水至100—200%的海水中,而其体液浓度维持恒定.无脊椎动物,如栖息于河口的Palaemonetesvarians可在2—110%海水中、栖于内陆碱水湖的Ar-temisia salina在10%的海水至饱和盐水中,能比较稳定地维持其体液浓度而生存.在植物,芦苇等就是属于广盐性植物.
与之相对的就是狭盐性生物,指生物对外界盐度变化的耐受能力不大,往往只能生活于一定盐度的环境中,这性质称为狭盐性.许多海洋无脊椎动物和外洋性鱼类均为狭性生物,特别是深海生物,因为只生活在盐度一定的海水中,其狭盐性更为显著.淡水动物的体液渗透浓度虽然比外界为高,但许多在比体液浓度高的条件中因缺乏排出浸入体内盐类的能力而不能生存,所以也是狭盐性生物.
引起鱼类洄游的原因很多,外界环境条件是重要的因素,但是鱼类本身生理上的要求则是主要的因素.各种鱼类的生理情况不同,鱼类为了维持自己的生命和新陈代谢,就必须按照本身的生理要求,随外界环境的变化而作有规律的洄游.一般可以分为生殖洄游,适温洄游,索饵洄游1年前查看全部
- 海水中提取碘的基本化学原理是什么?
 haihao81年前1
haihao81年前1 -
 s2p6cib9ukuf044 共回答了23个问题
s2p6cib9ukuf044 共回答了23个问题 |采纳率91.3%I-有还原性,利用氧化剂把I2氧化出来,再利用萃取利用有机物把碘提炼出来1年前查看全部
- 假如你身处偏远海岛,缺乏生存所需的淡水怎么办?小明为你提供一种简便的海水淡化方法.在地面上挖一水池,往池内灌海水,按图所
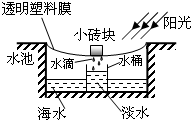 假如你身处偏远海岛,缺乏生存所需的淡水怎么办?小明为你提供一种简便的海水淡化方法.在地面上挖一水池,往池内灌海水,按图所示完成设备的安装,即可回收淡水.其中涉及到的物理知识是:
假如你身处偏远海岛,缺乏生存所需的淡水怎么办?小明为你提供一种简便的海水淡化方法.在地面上挖一水池,往池内灌海水,按图所示完成设备的安装,即可回收淡水.其中涉及到的物理知识是:
(1)阳光照射使池内海水加快______(填一物态变化名称),形成水蒸气;
(2)水蒸气在塑料膜上______ (填一物态变化名称),形成小水滴;
(3)塑料膜下表面结成的水滴受重力的作用滑到最低处后滴入水桶中,得到淡水. 银杏之魂20681年前1
银杏之魂20681年前1 -
 tropicalfish 共回答了18个问题
tropicalfish 共回答了18个问题 |采纳率100%解题思路:海水在阳光的照射下会很快的蒸发变成水蒸气,水蒸气遇冷又会液化成小水滴,然后在重力的作用下滑落至最低处后滴入水桶中,得到淡水.(1)阳光照射使池内海水加快蒸发,形成水蒸气;
(2)水蒸气在塑料膜上液化,形成小水滴;
(3)塑料膜下表面结成的水滴受重力的作用滑到最低处后滴入水桶中,得到淡水;
故答案为:蒸发,液化.点评:
本题考点: 影响蒸发快慢的因素;液化及液化现象.
考点点评: 解决此类问题要结合蒸发和液化的物态转化进行分析解答,知道重力的方向是竖直向下的.1年前查看全部
- 如何提高循环水的PH值,补充水为海水,水质是腐蚀性水质.不要说往水池加氢氧化钠,很不现实.1万方的循环水量.而且是经常偏
如何提高循环水的PH值,
补充水为海水,水质是腐蚀性水质.不要说往水池加氢氧化钠,很不现实.1万方的循环水量.而且是经常偏低.是铁合金厂,排除酸性气体泄露. w神1年前3
w神1年前3 -
 欢天喜地过大年 共回答了19个问题
欢天喜地过大年 共回答了19个问题 |采纳率84.2%补充水中氨氮含量高、水体污染严重是导致循环水p H值降低的主要原因;
在循环水中存在大量硝化菌群,发生了硝化过程,在硝化过程中产生H+也导致循环水p H值降低
水处理时着重对氨氮进行处理1年前查看全部
- 海水为什么在越深的地方越蓝?
 hnpyy1年前1
hnpyy1年前1 -
 米lier 共回答了10个问题
米lier 共回答了10个问题 |采纳率80%舀一勺海水看看,海水既不是蓝色的,也不是白色的,海水就像自来水一样,是无色透明的.是谁给大海涂上了颜色呢?这是太阳光变的戏法.
太阳光是由红、橙、黄、绿、青、蓝、紫七种颜色的光组成的.当太阳光照射到大海上,红光、橙光这些波长较长的光,能绕过一切阻碍,勇往直前.它们在前进的过程中,不断被海水和海里的生物所吸收.而像蓝光、紫光这些波长较短的光,虽然也有一部分被海水和海藻等吸收,但是大部分一遇到海水的阻碍就纷纷散射到周围去了,或者干脆被反射回来了.我们看到的就是这部分被散射或被反射出来的光.海水越深,被散射和反射的蓝光就越多,所以,大海看上去总是碧蓝碧蓝的.
海洋色彩是由海水的光学性质和海水中所含的悬浮物质、海水的深度、云层的特点及其他因素决定的.海水对不同波长的光的吸收、反射和散射的程度不同.波长较短的蓝光和紫光遇到较纯净的海水分子时就会发生强烈的散射和反射,于是人们所见到的海洋就呈现一片蔚蓝色或深蓝色了.近岸的海水因悬浮物质增多,颗粒较大,对绿光吸收较弱,散射较强,所以多呈浅蓝色或绿色.人的眼睛是有一定偏见的,人的眼睛对紫光的感受能力很弱,所以对海水反射的紫色很不敏感,因此视而不见,相反,人的眼睛对蓝、绿光却比较敏感.1年前查看全部
- 海水是应用前景广阔的化工原料资源,从海水中可提取各种化工原料.如图是工业上对海水的几项综合利用的示意图:
海水是应用前景广阔的化工原料资源,从海水中可提取各种化工原料.如图是工业上对海水的几项综合利用的示意图:

回答下列问题:
(1)①粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用试剂为:A:盐酸;B:BaCl2溶液;C:NaOH溶液;D:Na2CO3溶液.加入试剂的顺序是______.
②电解饱和食盐水时,与电源正极相连的电极上发生的反应为______,与电源负极线连的电极附近溶液pH______(变大、不变、变小).
(2)工业上从海水中提取的NaCl,可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱.
①气体A、B是CO2或NH3,则气体A应是______(填化学式).C的制得发生反应的化学方程式为2NaHCO3
Na2CO3+CO2↑+H2O△ .2NaHCO3.
Na2CO3+CO2↑+H2O△ .
②滤液D中主要含有NH4Cl、NaHCO3等物质,工业上是向滤液D中通入NH3,并加入细小食盐颗粒,冷却析出不含有NaHCO3的副产品
NH4Cl晶体,则通入NH3的作用是______.
(3)空气吹出法工艺,是目前“海水提溴”的最主要方法之一.
a、写出步骤①④反应的离子方程式:①______;④______.
b、在步骤⑥的蒸馏过程中,温度应控制在80-90℃、温度过高过低都不利于生产,请解释原因:______.
c、在步骤①、②之后并未直接用“含溴的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氯化”后再蒸馏,这样操作的意义是______. kathleena05061年前1
kathleena05061年前1 -
 话梅四号 共回答了26个问题
话梅四号 共回答了26个问题 |采纳率88.5%解题思路:(1)①根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子进行分析;
②根据电解池的工作原理,分析两个电极上放电的离子,并确定生成的物质;
(2)①根据制取纯碱的原理:向饱和的氯化钠溶液中依次通入氨气、二氧化碳,析出碳酸氢钠晶体,加热碳酸氢钠晶体可制得纯碱;
②根据氨气溶于水后生成氨水,氨水电离成铵根和氢氧根离子,增大铵根的浓度有利于氯化铵的析出来分析,溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度;
(3)a、氯气具有氧化性,能将溴离子氧化;单质溴具有氧化性,能将二氧化硫氧化;
b、在溴水中,溴的沸点是58.5°C,水的是100°C,温度80℃-90℃时,水不沸腾而溴蒸气挥发;
c、海水中溴离子的含量较少,在海水提取溴之前,必须进行海水浓缩以节约成本.(1)①因用蒸发结晶的方法可以从海水中获得食盐,镁离子用氢氧根离子沉淀,加入过量的石灰乳可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,在进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以添加试剂的顺序为CBDA或BCDA,故答案为:CBDA或BCDA;
②电解饱和食盐水时,阳极是氯离子失电子生成氯气的过程:2Cl--2e-=Cl2↑;阴极是氢离子得电子生成氢气的过程为2H++2e-=H2↑,在该极附近氢离子减少,氢氧根浓度增加,所以大量的氢氧化钠在阴极出现,溶液的PH增大,故答案为:2Cl--2e-=Cl2↑;变大;
(2)①向饱和的氯化钠溶液中依次通入氨气、二氧化碳,析出碳酸氢钠晶体,加热碳酸氢钠晶体可制得纯碱.上述反应的化学方程式分别为NH3+CO2+H2O=NH4HCO3,NH4HCO3+NaCl=NH4Cl+NaHCO3↓,2NaHCO3
△
.
Na2CO3+CO2↑+H2O,故答案为:NH3;2NaHCO3
△
.
Na2CO3+CO2↑+H2O;
②氨气溶于水后生成氨水,氨水电离成铵根和氢氧根离子,增大铵根的浓度有利于氯化铵的析出来,溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度,
故答案为:氨气溶于水后生成氨水,氨水电离成铵根和氢氧根离子,增大铵根的浓度有利于氯化铵的析出来,溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度;
(3)a、氯气具有氧化性,能将溴离子氧化成单质溴:2Br-+Cl2=2Cl-+Br2,故答案为:2Br-+Cl2=2Cl-+Br2;
单质溴具有氧化性,能将二氧化硫氧化成硫酸:SO2+Br2+2H2O=2HBr+H2SO4,故答案为:SO2+Br2+2H2O=2HBr+H2SO4;
b、在溴水中,溴的沸点是58.5°C,水的是100°C,温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低,故答案为:温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低;
c、海水中溴离子的含量较少,在海水提取溴之前,必须进行海水浓缩,故答案为:“空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的浓缩过程,与直接蒸馏含Br2海水相比效率更高,消耗能源少,成本降低.点评:
本题考点: 海水资源及其综合利用;纯碱工业(侯氏制碱法);电解原理;氯、溴、碘及其化合物的综合应用;粗盐提纯.
考点点评: 本题主要考查了粗盐的提纯、候氏制碱、海水提溴的原理,难度不大,根据课本知识即可完成.1年前查看全部
- 在海水淡化稳态过程中,海水含盐3.5%,每小时生产淡水1000kg,排放的废盐水浓度8%.试用物料衡算方法计算每小
 lily19741年前1
lily19741年前1 -
 愚蠢快乐 共回答了13个问题
愚蠢快乐 共回答了13个问题 |采纳率92.3%1000kg/h=进料量*(1-3%/8%)
进料量=1000/0.625=1600kg/h
出料量=1600-1000=600kg/h1年前查看全部
- 谁能告诉我海水是否有利用价值?都用在什么领域?
 H19811年前2
H19811年前2 -
 hefan860 共回答了19个问题
hefan860 共回答了19个问题 |采纳率89.5%海水在微波或者其他的什么波的轰击下会燃烧
如果能量对比经济的话是不错的选择
我想这个也是一个很好的清洁能源
再有轰击完毕后这个水是否可以饮用
如果可以稍有不放心还可以输送至缺水的沙漠培植经济作物
改造土壤1年前查看全部
- 大海结冰的颜色我们这海边的海水都结冰了,白色的,我想问一下这些白色的到底是海水呢还是海水析出的严分呢...还有就是如果是
大海结冰的颜色
我们这海边的海水都结冰了,白色的,我想问一下这些白色的到底是海水呢还是海水析出的严分呢...
还有就是如果是海阳中间结冰的话应该是什么颜色呢··?(不是北极那种常年的零下...就结个一二十公分厚那种... 张大炮1年前4
张大炮1年前4 -
 没有人相信 共回答了13个问题
没有人相信 共回答了13个问题 |采纳率100%大海结冰的颜色是白色的!不管在大海的什么位置!之所以大海看起来是蓝色的不是因为海水是蓝色的,而是海水对光的反射使得看起来是蓝色的!
海水结的冰,一般都只是淡水!海冰里的盐分不多!1年前查看全部
- 加入试剂后如何确定海水中的镁离子已全部转化为氢氧化镁沉淀
 wanghongguang1年前1
wanghongguang1年前1 -
 恶男杰特 共回答了15个问题
恶男杰特 共回答了15个问题 |采纳率93.3%加氢氧化钠无沉淀产生.1年前查看全部
- 如果要提炼136.2克盐,就需要6千克的海水,那么从40千克这样的海水中可以提炼多少克盐?
 bdrnoa1年前1
bdrnoa1年前1 -
 花惜玉 共回答了18个问题
花惜玉 共回答了18个问题 |采纳率88.9%1千克海水可以提炼136.2/6=22.7克盐,那么40千克海水可以提炼40*22.7=908克盐1年前查看全部
- 已知8升海水盐度是33度,所求盐度降为15度,需要加入3度淡水多升?
 哀伤与风1年前0
哀伤与风1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 一种海水,盐水与海水的比是9:6,它的含盐率是( )
 lhmaissl1年前1
lhmaissl1年前1 -
 yhlbbs2 共回答了19个问题
yhlbbs2 共回答了19个问题 |采纳率89.5%6+9=15
9∶15=0.6=60%
一种海水,盐与水的比是9:6,它的含盐率是(60% ) .1年前查看全部
- 海水里最多的是食盐对不对是最多的盐是什么
 jiang851年前4
jiang851年前4 -
 ajw1972 共回答了19个问题
ajw1972 共回答了19个问题 |采纳率94.7%海水里最多的盐是食盐对.1年前查看全部
- 海水为什么会呈绿色?
 三亚学院0071年前1
三亚学院0071年前1 -
 johnsonliu1984 共回答了18个问题
johnsonliu1984 共回答了18个问题 |采纳率94.4%海水的颜色主要是由海水的光学性质,即海水对太阳光线的吸收、反射和散射造成的.我们知道:太阳光是由红、橙、黄、绿、青、蓝、紫七色光复合而成,七色光波长长短不一,从红光到紫光,波长由长渐短,其中波长长的红光、橙光、黄光穿透能力强,最易被水分子所吸收.波长较短的蓝光、紫光穿透能力弱,遇到纯净海水时,最易被散射和反射.又由于人们眼睛对紫光很不敏感,往往视而不见,而对蓝光比较敏感.于是,我们所见到的海洋就呈现出一片蔚蓝色或深蓝色了.海水越深,被散射和被反射的蓝光就越多,看上去也就越蓝了 .如果打一桶海水放在碗中,则海水和普通水一样,是无色透明的.其实海水看上去也不全是蓝色的,而是有红、黄、白、黑等等,五彩缤纷.因为海水颜色除了受以上因素影响外,还会受到海水中的悬浮物质、海水的深度、云层等其他因素的影响.如我国的黄海,看上去一片黄绿,这是因为古代黄河夹带的大量泥沙将海水“染黄”了.虽然现在黄河改道流入渤海,但黄海北部有宽阔的渤海海峡与之相通,加之它还有淮河等河水注入,故海面仍呈浅黄色.
亚非两洲之间的红海,因其水温很高,海里生长着一种水藻,大批死亡后呈红褐色,将海水染成红色.红海由此而得名.
而黑海,由于多瑙河、顿河、第聂伯河等河水的注入,表层密度很小,深层受地中海高盐度海水影响,密度很大.这样,上层密度小,下层密度大,且差异很大,上下层水体难以交换.黑海与地中海之间也仅有 一又窄又浅的土耳其海峡相通,使得它们之间海水也难以大量交换.这样,黑海下层海水长期处于缺氧环境,上层海水中生物分泌的秽物和各种动植物死亡后沉到深处腐烂发臭,大量污泥浊水,使海水变黑了.
北冰洋深入俄罗斯北部的白海,则是因为它的纬度较高,终年寒冷,冰雪茫茫,加之有机物含量少,海水呈现出一片白色,故名白海.
PS:蓝色是缺少生命力的表现,深海处生物较少,所以很多岛屿附近的海都是绿色的.
也有另一种说法.大海因为有黄是海底有好多黄泥,有绿是没有沙没有泥,有白是海水变冰了,有红是海底有一种矿物质,有黑是因为那个海里有很多黑泥,有蓝是因为天蓝映得海变蓝了.
希望这些答案可以给你带来帮助!1年前查看全部
- 激光原理作业:文献调研:光束在介质中的传输特性(大气湍流,大气气溶胶,海水,光纤等各种介
激光原理作业:文献调研:光束在介质中的传输特性(大气湍流,大气气溶胶,海水,光纤等各种介
光束应该算是激光 mould781年前1
mould781年前1 -
 wcswxh 共回答了18个问题
wcswxh 共回答了18个问题 |采纳率94.4%大气湍流: 激光束通过湍流大气传输时,由于湍流大气中折射率的随机不均匀分布,其强度、相位和传输方向会受到扰动而出现随机变化,变化情况与激光束宽w,和湍流尺度l的相对大小有关;当2w/l1时,光束截面内包含许多湍流漩涡,引起光束强度起伏、相位起伏和光束扩展.记在弱湍流下,折射率改变很小,但由于存在大量的不均匀元,以致在一定距离之外,积累效应就十分显著,包括光束漂移、光束扩展、到达角起伏、大气闪烁等.1年前查看全部
- 海水里的盐可不可以直接实用?就是把海水晒干的结晶体是不是可以直接食用,如果不可以,
 dannis19991年前1
dannis19991年前1 -
 我是anan 共回答了21个问题
我是anan 共回答了21个问题 |采纳率81%不可以,因为那里边除了氯化钠之外,还含有一些有害物质和杂质.市场上销售的食用精盐都是经过盐化工厂提纯并去除杂质之后的产品.1年前查看全部
- 纯水的凝固点是0℃,海水的凝固点是-2.5℃,这说明水中如果掺有食盐其凝固点会降低.小华把0℃的碎冰块放在保温杯中,在冰
纯水的凝固点是0℃,海水的凝固点是-2.5℃,这说明水中如果掺有食盐其凝固点会降低.小华把0℃的碎冰块放在保温杯中,在冰中撒一些食盐,搅拌后用温度计插在碎冰块内测量其温度,发现所测得的温度降到0℃以下.小华觉得很奇怪,他认为物体只有放热后温度才会降低,周围环境的温度都比0℃高,冰块怎么会向周围放热呢?请你帮助小华想一想,这个现象有几种可能的解释.你能设计实验来验证或否定你的解释吗?
 kj62341年前1
kj62341年前1 -
 紫星云儿 共回答了15个问题
紫星云儿 共回答了15个问题 |采纳率80%解题思路:(1)晶体物质中混有杂质时,其熔点和凝固点都会降低;
(2)物质在熔化和溶解是都需要吸收热量.有几种可能:
(1)在冰中撒一些食盐,冰的凝固点降低,碎冰块刚从冰箱里拿出来,冰本身的温度低于0℃;
(2)食盐溶解变成盐水的过程中是需要吸收能量以克服溶质分子间的引力,所以是吸收热量的,导致温度降低;
(3)温度计的示数不准等.
设计实验:
(1)同样的容器,同样的冰块,在撒食盐之前,用一金属板将冰块分为相同的两部分,在一部分上加入食盐,同时测量两部分的温度,看是否不同;
(2)将一容器中充满0℃的冰水混合物,再加入食盐,之后用温度计测量温度.点评:
本题考点: 熔化与熔化吸热特点;熔点和凝固点.
考点点评: 冰中加入盐以后熔点降低,低于0℃,盐冰在熔化时吸热温度不变,保持低于0℃.1年前查看全部
- 一个晒盐场用100g海水可以晒出3g盐.多少吨海水可以晒出12吨盐?如果盐田一次放入58500吨水,可晒出多少盐
 东僵孤侠1年前1
东僵孤侠1年前1 -
 倩靓的鱼 共回答了22个问题
倩靓的鱼 共回答了22个问题 |采纳率90.9%100:3=x:12
3x=1200
x=400
答:400吨海水可以晒出12吨盐;
100:3=58500:y
y=585×3
y=1755吨
答:可晒出1755吨盐1年前查看全部
- 一个晒盐场用100g海水可以晒出3g盐,照这样计算,如果要晒出1755t盐,需要在盐田中放入多少t海水
 coolzane1年前4
coolzane1年前4 -
 myajw0128 共回答了20个问题
myajw0128 共回答了20个问题 |采纳率90%设需要x吨
3:100=1755:x
x=1755x100÷3
x=58500
如果本题有什么不明白可以追问,1年前查看全部
- 人们是怎样把海水引进盐田
 断义1年前2
断义1年前2 -
 棉花糖120 共回答了14个问题
棉花糖120 共回答了14个问题 |采纳率92.9%先筑好盐池,然后放开钾门,让海水流进来,之后关上门,让海水被暴晒,等海水被蒸干就好了1年前查看全部
- 光卤石和海水如何制氢氧化镁?
 ningjiafan1年前1
ningjiafan1年前1 -
 零下8的爱 共回答了19个问题
零下8的爱 共回答了19个问题 |采纳率73.7%光卤石 成分为钾、镁的卤化物矿物(KCl·MgCl2·6H2O).
海水-(结晶)-母液-(石灰乳)-Mg(OH)2
海水 光卤石都含有氯化镁
制取的原理都是加入石灰乳或者生石灰把镁离子沉淀.1年前查看全部
- 为什么海水喝不了?
 散漫守望1年前2
散漫守望1年前2 -
 木棉天堂518 共回答了21个问题
木棉天堂518 共回答了21个问题 |采纳率81%海水中含有大量盐类和多种元素,其中许多元素是人体所需要的.但海水中各种物质浓度太高,远远超过饮用水卫生标准,如果大量饮用,会导致某些元素过量进入人体,影响人体正常的生理功能,严重的还会引起中毒.如果喝了海水,可以采取大量饮用淡水的办法补救.大量淡水可以稀释人体摄入过多的矿物质和元素,将其通过汗液排出体外.1年前查看全部
- “”这小屋好似一只在波峰浪谷的小船,随时都有被海水吞没的危险”比喻句在写法上的好处是什么?
 ydqzf1年前2
ydqzf1年前2 -
 kkwl 共回答了19个问题
kkwl 共回答了19个问题 |采纳率94.7%突出了小屋此时的情况特点,随时,表达了危险程度,比喻的方法可是文章更加生动形象1年前查看全部
- 这小屋好似一只在波峰浪谷中颠簸的小船,随时都有被海水吞没的危险(用同样的修辞方法写一句话)
 大大大大鼻子1年前1
大大大大鼻子1年前1 -
 linzx1897 共回答了18个问题
linzx1897 共回答了18个问题 |采纳率100%这小屋像一辆在崎岖山路上颠簸的汽车,随时都有被山洪吞噬的危险.1年前查看全部
- 这小屋随时都有被海水吞没的危险.(改为比喻句)
 义茶亭1年前1
义茶亭1年前1 -
 wanghuiyan780520 共回答了19个问题
wanghuiyan780520 共回答了19个问题 |采纳率84.2%这小屋就像暴风雨中的船只,随时都有被海水吞没的危险1年前查看全部
- 用3种科学方法鉴定从海水中出来的水是淡水
 辛喜若乔1年前1
辛喜若乔1年前1 -
 我爱依然 共回答了15个问题
我爱依然 共回答了15个问题 |采纳率100%1将它们放在酒精灯上把水烧干,烧杯内有盐析出的是海水.
2)海水含盐度很高,降低了海水的冰点.淡水结冰是在0度,含10‰盐度的水冰点为-0.5℃,而含35‰盐度的水冰点是-1.9℃.地球上各大洋海水平均盐度为34.48‰,因此,海水的冰点在-1.9℃左右.
3 加入 酚酞试液 海水更混浊1年前查看全部
- 海水晒盐的过程中留下少量海水就停止蒸发,为什么
海水晒盐的过程中留下少量海水就停止蒸发,为什么
海水又苦又咸,我们从海水中得到的食盐却只咸不苦,是因为盐工们利用了化学原理的缘故.就是在晒盐的过程中故意留下少量海水就停止蒸发.为什么? jinerlilee1年前1
jinerlilee1年前1 -
 打肿鸟充ii 共回答了13个问题
打肿鸟充ii 共回答了13个问题 |采纳率100%为了防止其他物质蒸发结晶.成为杂质.
海水中有很多溶质,溶解度各不相同.我们要的是氯化钠,所以需要使氯化钠最大限度的结晶,同时还不能析出其他物质.所以留下少量的海水.1年前查看全部
- 江水 河水 甜水 泉水 海水(不同类)
 lyy51年前3
lyy51年前3 -
 北在北边 共回答了11个问题
北在北边 共回答了11个问题 |采纳率81.8%海水1年前查看全部
大家在问
- 1大明收到了一份特殊的礼物 Daming ______ _______ _______ _______ for his b
- 2下面的句子中出现了同音字或形近字,你能很快地找到正确的答案吗?
- 3磷 + 水 =
- 4把一个底面积是72平方厘米,高9厘米的圆锥形零件.熔成一块长方形铁块.长9厘米,宽6厘米,.
- 5英文糖醋排骨的做法如题
- 6The boy coming from Beijing is my brother 这里的后置定语用ing形式是不是因为
- 7贾谊 《过秦论》中翻译秦并海内,兼诸侯,南面称帝,以养四海,天下之士斐然乡(向)风,若是者何也?曰:近古吴王者久矣.周室
- 8如图甲所示,两平行金属板间有如图乙所示的随时间t变化的电压U,在金属板右侧有一左边界为MN、右边无界的匀强磁场,磁场边界
- 9他每天练习说英语一小时
- 10x^2+x=0的过程解法!谢谢
- 11小聪的妈妈前年买了某公司的二年期债券4500元,今年到期后,扣除5%的利息税后,共得本息4756.5元,问这种债券的年利
- 12(2014•鼓楼区模拟)如图所示,彗星A在太阳引力作用下沿P→Q→R轨迹运动,Q是彗星A的近日点.由于太阳的照射,彗星表
- 13地球上最早出现的动物是?是原始无脊椎动物吗?
- 14想起为了祖国的解放事业而献身的先烈你会用哪些词语来形容他们
- 15我用微笑,继续骄傲 如何用英文写出来?
