求工业制Al、Mg的详细步骤和化学方程式(高一)
 robertonana2022-10-04 11:39:541条回答
robertonana2022-10-04 11:39:541条回答①将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
②将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
③在Mg(OH)2沉淀中加入盐酸得到MgC12溶液,再经蒸发结晶得到MgC12· 6H2O
④将MgC12· 6H2O在一定条件下加热得到无水MgC12;
⑤电解熔融的氯化镁可得到Mg.
制镁步骤有了 要方程式 如果我的步骤不正确 也可以写自己的步骤

已提交,审核后显示!提交回复
共1条回复
 chenxudong 共回答了23个问题
chenxudong 共回答了23个问题 |采纳率91.3%- CaCO3----->CaO+CO2 CaO+H2O----->Ca(OH)2
MgCl2+Ca(OH)2----->Mg(OH)2+CaCl2
Mg(OH)2+2HCl+4H2O----->MgCl2.6H2O
MgCl2.6H2O----->MgCl2+6H2O
MgCl2----->Mg+Cl2 - 1年前
相关推荐
- (2007•南京二模)某化学兴趣小组参考工业制硝酸的化学原理,在实验室用下列各装置进行组合来制备硝酸并验证硝酸的性质(所
(2007•南京二模)某化学兴趣小组参考工业制硝酸的化学原理,在实验室用下列各装置进行组合来制备硝酸并验证硝酸的性质(所给装置必须用到并且只能用一次,各装置中的试剂均足量.已知常温下CaCl2能吸收氨气).

(1)装置的连接顺序为(用a、b、c、d等字母表示):b接______,______接______,______接______.
(2)写出氨气催化氧化的化学方程式4NH3+5O2
4NO+6H2O催化剂 .△ 4NH3+5O2;
4NO+6H2O催化剂 .△
(3)进行实验时,装置A中碱石灰的作用是______,D中的现象是______;
(4)能证明有硝酸生成的现象是______;
(5)实验开始时,下列操作顺序最合理的是______
a.先加热A装置中的催化剂.再由导管a通入空气
b.先由导管a通入空气,再加热A装置中的催化剂
c.在由导管a通入空气的同时,加热A装置中的催化剂. RahXeRyan1年前1
RahXeRyan1年前1 -
 永远并不太远 共回答了15个问题
永远并不太远 共回答了15个问题 |采纳率93.3%解题思路:实验目的是制备硝酸,原理是空气通入氨水中得到氧气和氨气的混合气体,经碱石灰干燥后,在催化剂、加热条件下反应可生成NO,进而与氧气反应生成NO2,用氯化钙吸收未反应的氨气,在C中NO2和水反应生成硝酸,可观察到C中溶液由紫色变为红色,以此解答该题.(1)实验的顺序应符合气体发生装置、收集装置、性质实验和尾气吸收等顺序,则连接顺序应为b→g→h→e→f→c,故答案为:g;h;e;f;c;
(2)氨气在催化剂条件下加热可生成NO,反应的方程式为4NH3+5O2
催化剂
.
△4NO+6H2O,故答案为:4NH3+5O2
催化剂
.
△4NO+6H2O;
(3)空气通入氨水中得到氧气和氨气的混合气体,气体中混有水蒸气,经碱石灰干燥后,在催化剂、加热条件下反应可生成NO,生成的NO在D中可被氧化生成红棕色的NO2,
故答案为:吸收反应物中的水,防止反应温度降低;气体由无色变为红棕色;
(4)在C中NO2和水反应生成硝酸,可观察到C中溶液由紫色变为红色,故答案为:C中溶液由紫色变为红色;
(5)实验时,为使氨气充分和氧气在较高温度下反应,应先加热催化剂,然后在通入空气,故答案为:a.点评:
本题考点: 制备实验方案的设计;工业制取硝酸.
考点点评: 本题综合考查物质的制备和性质探究等知识,侧重于学生的分析能力、实验能力的考查,为高考常见题型,注意把握实验的操作原理和步骤,把握相关物质的性质,难度中等.1年前查看全部
- 关于工业制金刚砂的反应: 下列说法正确的是 A.Si0 2 是氧化剂,C为还原剂 B.碳的还原性比硅强 C.氧化剂和还原
关于工业制金刚砂的反应:
 下列说法正确的是
下列说法正确的是A.Si0 2 是氧化剂,C为还原剂 B.碳的还原性比硅强 C.氧化剂和还原剂物质的量之比为2:1 D.该反应中电子转移总数为4e 一  我们家k小米1年前1
我们家k小米1年前1 -
 猪之妻 共回答了24个问题
猪之妻 共回答了24个问题 |采纳率95.8%D
本题考查氧化还原反应的知识,关键要准确判断氧化剂和还原剂。该反应中氧化剂和还原剂都是C,3molC中有2molC做还原剂,1molC做氧化剂,转移了4mo le 一 ,故A错, C错,D正确;该反应不能比较碳、硅的还原性,B错。1年前查看全部
- 关于工业制金刚砂的反应:SiO2+3C 高温 . SiC+2CO↑,下列说法中正确的是(
关于工业制金刚砂的反应:SiO2+3C
SiC+2CO↑,下列说法中正确的是( )高温 .
A.SiO2是氧化剂,C为还原剂
B.碳的还原性比硅强
C.氧化剂和还原剂的物质的量之比为2:1
D.1mol SiO2参与反应时,转移电子4mol 马铃薯煎蛋1年前1
马铃薯煎蛋1年前1 -
 永无弈 共回答了20个问题
永无弈 共回答了20个问题 |采纳率85%解题思路:该反应中C元素化合价由0价变为-4价、+2价,Si元素和O元素化合价不变,所以C是氧化剂和还原剂,二氧化硅既不是氧化剂也不是还原剂,再结合二氧化硅和转移电子之间的关系式计算.A.二氧化硅中Si元素和O元素化合价不变,所以二氧化硅既不是氧化剂也不是还原剂,C元素化合价由0价变为-4价、+2价,氧化剂和还原剂都是C,故A错误;
B.碳的非金属性大于Si,所以C的氧化性比Si强,故B错误;
C.氧化剂和还原剂的物质的量之比为1:2,故C错误;
D.1mol SiO2参与反应时,需要1molC作氧化剂,则转移电子的物质的量=1mol×(4-0)=4mol,故D正确;
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查了氧化还原反应,根据元素化合价变化及基本概念来分析解答,注意C的作用,该反应中生成CO而不是二氧化碳,为易错点.1年前查看全部
- 化学中实验室制与工业制的区别全面一些,分开一些
 闽南开水1年前1
闽南开水1年前1 -
 地狱使者0811 共回答了22个问题
地狱使者0811 共回答了22个问题 |采纳率81.8%(1)实验室制法常考虑的是快速和便捷;例如制O2,实验室用加热高锰酸钾,工业上用液化空气在生温分馏;
(2)工业制法常考虑的是经济及产量;例如制NH3,实验室用 碱 和铵盐共热,而工业用 H2和N2在高温、催化剂的作用下进行反应.1年前查看全部
- 氨可用于工业制硝酸,其主反应为:4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H<0若此反应起始的物质的量
氨可用于工业制硝酸,其主反应为:4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H<0若此反应起始的物质的量相同,则下列关系图正确的是( )
A.
B.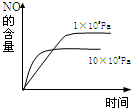
C.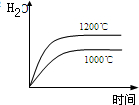
D.
 5201314wby1年前1
5201314wby1年前1 -
 32327777 共回答了20个问题
32327777 共回答了20个问题 |采纳率85%解题思路:A、该反应是放热反应,升高温度,平衡向逆反应方向移动,所以氨气的转化率减小,氨气的含量增大;
B、该反应是气体体积增大的反应,增大压强,反应速率加快,平衡向气体体积减小的方向移动,即正反应方向移动,所以NO的含量增大;
C、该反应是放热反应,升高温度,反应速率加快,平衡向逆反应方向移动,水的含量降低;
D、催化剂只改变反应到达平衡的时间,对化学平衡无影响.A、该反应是放热反应,升高温度,平衡向逆反应方向移动,所以氨气的转化率减小,氨气的含量增大,图象中温度越高,氨气的含量越大,图象与设计不相符,故A错误;
B、该反应是气体体积增大的反应,增大压强,反应速率加快,到达平衡的时间缩短,平衡向气体体积减小的方向移动,即正反应方向移动,所以NO的含量增大,图象与实际相符合,故B正确;
C、该反应是放热反应,升高温度平衡向逆反应方向移动,水的含量降低,图象是温度越高,水的含量越低,图象与实际不相符,故C错误;
D、催化剂缩短反应到达平衡的时间,对化学平衡无影响,图象与实际相符合,故D正确;
故选BD.点评:
本题考点: 体积百分含量随温度、压强变化曲线.
考点点评: 本题考查化学平衡图象、影响化学平衡的因素等,难度不大,注意理解外界条件对化学平衡的影响.1年前查看全部
- 关于工业制金刚砂的反应:SiO2+3C=高温=SiC+2CO,下列说法正确的是( )
关于工业制金刚砂的反应:SiO2+3C=高温=SiC+2CO,下列说法正确的是( )
A.SiO2是氧化剂,C是还原剂
B.碳的还原性比硅强
C.氧化剂和还原剂的物质的量之比为2:1
D.1molSiO2参与反应时,转移电子4MOL
.每一个选项都解释下..我做这道题没有任何思路.. 旋风浪1年前1
旋风浪1年前1 -
 曼兰岚 共回答了11个问题
曼兰岚 共回答了11个问题 |采纳率54.5%D正确
A,SiO2中元素的化合价没变,它不是氧化剂也不是还原剂.
B,在同一族中随着电子层数的增加还原性增强,硅的还原性比碳强.
C,从反应方程式看1molC被还原成SiC,同时有2molC被氧化成CO.氧化剂和还原剂的物质的量之比为1:2.
D,1molSiO2参与反应时1molC被还原成SiC得4mol电子,同时有2molC被氧化成CO失4mol电子.电子转移数为4mol.1年前查看全部
- 求化学元素周期表12种非金属元素中的化学性、实验室制法、工业制法!
求化学元素周期表12种非金属元素中的化学性、实验室制法、工业制法!
H B C N O F Si P S Cl Br i 听风辨器1年前1
听风辨器1年前1 -
 haoyibb 共回答了18个问题
haoyibb 共回答了18个问题 |采纳率100%Cl :化学性:能与金属,非金属反映(如Na,Fe,Cu,H2),能与碱反映; 实验室制法:MnO2+4HCl(浓)=加热= MnCl2 + Cl2↑ + 2H2O 或 2KMnO4+16HCl(浓)== 2MnCl2 + 2KCl +5Cl2↑ + 8H2O 工业制法:电解饱和食盐水 Br:化学性:可溶于水呈橙黄色,易溶于酒精呈红棕色,易溶于CCl4呈红棕色 实验室制法:NaBr+Cl2==NaCl+Br2 工业制法:向海水中通入Cl2(因为海水中有NaCl),再通热空气或水蒸气,吹出粗溴,再精制溴单质 Cl2+2KCl==Br2+2KCl I: 化学性: 可溶于水呈棕黄色,易溶于酒精呈棕褐色,易溶于CCl4呈紫红色 实验室制法:KI+Br2==KBr+I2 工业制法:干海带加水变成浸泡液,通Cl2,过滤,提纯(海水中虽有大量的碘,但溶度低,海水中的植物具有富集碘的能力)1年前查看全部
- 第一题:乙醛合成乙酸丁脂 第二题:丁醇合成乙酸丁脂 请不要写那些工业制法!
第一题:乙醛合成乙酸丁脂 第二题:丁醇合成乙酸丁脂 请不要写那些工业制法!
无机试剂任选! yylli1年前1
yylli1年前1 -
 Feuerfuchs 共回答了25个问题
Feuerfuchs 共回答了25个问题 |采纳率84%乙醛碱性条件下自己加成然后加H2还原变丁醇
乙醛用K2Cr2O7氧化成乙酸
丁醇脱水然后加HBr然后再消除接下来臭氧断双键变乙醛
另外我现在只有大一!
求给分1年前查看全部
大家在问
- 1(1-2的平方分之一)(1-3的平方分之一).(1-2002的平方分之一)(1-2003的平方分之一)
- 2诸暨事期末统考试卷六年级(下)数学 人教版 答案 为了确保是同一个试卷 应用题第一题是一个扇形统计图
- 3正方形的一个顶点为A(-1,0),一边所在直线的方程为x+3y-5=0
- 4小华今年1月1日把积蓄下来的零用钱50元存入银行,定期一年,准备到期后把利息和本金一起捐给希望工程,支援贫困山区的儿童.
- 5用一句话作为文章的结尾(我要一篇600字作文)
- 6向量PQ=(-2,-4,2)向量MQ(-3,-2,-2) 求MQ在PQ上的射影长 以及所利用的功力的证明 Thanks
- 7老师让我们自己出书,全是自己写的作文,谁能帮忙起个有意境又好听的名字
- 8except和beside的区别
- 9如图,在四棱锥P-ABCD中,四边形ABCD为矩形,AB⊥BP,M、N分别为AC、PD的中点.
- 10对曾经说再见翻译成英文
- 11如图,在某小区的规划图上,其中正方形的[10/11]是停车场,圆的[7/8]是花园,已知停车场比花园多占地240平方米,
- 12高一英语Combine the following sentences using Relative Clause1.T
- 13a ship observes a lighthouse in a direction 50°W of N.After
- 14巧算 38*25*6*5*22
- 15《金银岛》的英文简介?要包含谁在什么时候,在哪个地方,做了些什么,为什么要做这些事?50个词左右!
