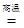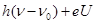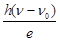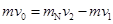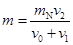懂金属制品加工的请进来回答请问不锈钢门窗是用304不锈钢装饰管做的吗,还用铁艺门窗,扶手之类的用什么做的,还有铝合金门窗
 xodi2022-10-04 11:39:541条回答
xodi2022-10-04 11:39:541条回答请问不锈钢门窗是用304不锈钢装饰管做的吗,还用铁艺门窗,扶手之类的用什么做的,还有铝合金门窗是用什么做的、、》加工工艺和加工设备都一样吗,目前这三个加工哪个比较有前途,

已提交,审核后显示!提交回复
共1条回复
 林林逍遥 共回答了18个问题
林林逍遥 共回答了18个问题 |采纳率94.4%- 不锈钢门窗多是用201不大可能用304,304比201要贵的.做不锈钢钢要用氩弧焊机,切割机、角磨机、安装门窗时还要用到电锤(又叫冲击钻)等工具.
- 1年前
相关推荐
- 我们生活中的金属制品有哪些.并指出所用金属名称比如铁,铜,铝等等(别都是一个种类金属.)元素符号,改用图所利用性质.
我们生活中的金属制品有哪些.并指出所用金属名称比如铁,铜,铝等等(别都是一个种类金属.)元素符号,改用图所利用性质.
小弟懒,但是做这些作业我觉得这么做就可以了.自己做太浪费时间...
我在家找都是不锈钢的.并且.这样我就用不着上网辛辛苦苦找了.也用不着浪费那么多时间了不是吗?我看了您们的答案不就长知识吗?我只是不想浪费时间.您想想.别人帮我做,我自己做.除了找资料的时间有什么不一样吗?最后我照样得到知识.是很有意思啊.不过我找不着.就让您们辛苦了.好的追加20. 阳光下的快乐1年前3
阳光下的快乐1年前3 -
 MM的拥抱 共回答了19个问题
MM的拥抱 共回答了19个问题 |采纳率100%电线里的铜,Cu,是利用其良好的导电性,延展性.
用的锅,螺丝刀,榔头一般为铁,Fe,铁锅烧菜,可以补充我们身体中的铁元素.
电脑散热板里的铝,Al,利用的是其良好的散热性,重量轻.
戒指,金或者银,Au或Ag,在常温下,不容易氧化,比较稳定的金属
记忆合金的眼镜框架,钛Ti,重量轻,强度高,钛合金有良好的刚度和韧性
就这么多吧 老师会给你满分的呵呵1年前查看全部
- 人类的生产和生活都离不开金属。(1)下列金属制品中,利用金属导热性的是
人类的生产和生活都离不开金属。
(1)下列金属制品中,利用金属导热性的是 (填字母序号)。


A. 铝制梯子 B. 铁锅 C.铜导线
(2)铝具有很好的抗腐蚀性能,用电解氧化铝的方法可以制取铝,氧化铝中铝元素和氧元素的质量比为 。
(3)铁是应用最广泛的金属,工业上常以赤铁矿和一氧化碳为原料炼铁,该反应的化学方程式为 。
(4)赤铜矿的主要成分是Cu 2 O,辉铜矿的主要成分是Cu 2 S,将赤铜矿与辉铜矿混合加
热可得铜,请将反应的化学方程式补充完整:2Cu 2 O + Cu 2 S 6Cu + 。
6Cu + 。
(5)某实验室废液中含有稀硫酸、硫酸亚铁和硫酸铜,若向其中加入一定量的锌,充分
反应后过滤,向滤渣中加入盐酸,有气泡产生。则滤渣中一定含有的物质是 ,
滤液中一定含有的物质是 。 了望江流1年前1
了望江流1年前1 -
 爱在左恨在右 共回答了18个问题
爱在左恨在右 共回答了18个问题 |采纳率94.4%1年前查看全部
- (2011•天河区模拟)为预防金属制品锈蚀,下列措施或做法不当的是( )
(2011•天河区模拟)为预防金属制品锈蚀,下列措施或做法不当的是( )
A.用钢丝球清除铝锅内的氧化层
B.在铁制门窗表面喷涂油漆
C.在铁制水管表面镀一层锌
D.将使用后的菜刀洗净擦干 Julia_猪猪1年前1
Julia_猪猪1年前1 -
 xkrr895 共回答了21个问题
xkrr895 共回答了21个问题 |采纳率90.5%解题思路:金属生锈的条件是金属与氧气和水同时接触;酸性溶液、碱性溶液、盐溶液能促进金属生锈;防止金属生锈的方法就是要使就是与水和氧气隔绝.A、铝锅表面的氧化膜对铝锅起到保护作用,阻止铝被进一步氧化,故擦去是错误的.
B、在铁制门窗表面喷涂油漆,使铁与水和氧气隔绝,有利于防锈,故正确;
C、在铁制水管表面镀一层锌,使铁与水和氧气隔绝,有利于防锈,故正确;
D、使用后的菜刀洗净擦干有利于防锈,故正确;
故选A.点评:
本题考点: 金属锈蚀的条件及其防护.
考点点评: 解答本题要掌握金属生锈的条件,只有这样才能找出防止金属生锈的方法.1年前查看全部
- 我知道的金属制品有哪些,玻璃制品有哪些?
 xpqor1年前1
xpqor1年前1 -
 kodaker 共回答了15个问题
kodaker 共回答了15个问题 |采纳率93.3%金属制品:汽车,火车,铁锅,小刀,暖气片,扳手,斧头,电线,钢笔
玻璃制品:杯子,灯泡,玻璃窗,瓶子,烧杯,试管,镜子,电视屏幕1年前查看全部
- 金属在生产和生活中有广泛的应用.下列金属制品中,利用金属导电性的是______(填字母序号).
 2836553931年前1
2836553931年前1 -
 两只蚂蚱 共回答了16个问题
两只蚂蚱 共回答了16个问题 |采纳率93.8%解题思路:性质决定用途,根据金属的性质进行分析解答.黄金饰品是利用了黄金性质稳定,色泽好的性质,铝蒸锅是利用铝导热性能好,钢导线是利用了金属的导电性,
故答案为:C点评:
本题考点: 金属的物理性质及用途.
考点点评: 本题考查金属的用途,性质决定用途,题目难度不大,熟练掌握金属的性质是解答问题的关键.1年前查看全部
- 下列产物哪项是古代两河流域地区缺乏的 A粮食 B硬木 C羊毛 D金属制品
 海岛无边1年前1
海岛无边1年前1 -
 zhaowenhao 共回答了12个问题
zhaowenhao 共回答了12个问题 |采纳率91.7%B硬木
两河流域主要是沼泽,外围是荒漠,缺乏森林树木1年前查看全部
- 金属与人类的生产生活息息相关.(1)下列金属制品中,利用金属导电性的是______(填字母序号).(2)金属腐蚀造成资源
金属与人类的生产生活息息相关.
(1)下列金属制品中,利用金属导电性的是______(填字母序号).
(2)金属腐蚀造成资源浪费,铁生锈的条件是______.
(3)应用金属活动性顺序能帮助我们进一步学习金属性质.已知下列各组物质间均能发生化学反应.
A.Fe和CuSO4溶液B.Mg和MnSO4溶液C.Mn和FeSO4溶液
①写出Fe和CuSO4溶液反应的化学方程式______.
②以上四种金属的活动性由强到弱的顺序是______.
(4)化学小组对含有硫酸铜和硫酸锌的废液进行了如下处理:
①步骤Ⅰ中的操作名称是______.
②滤液的成分是______(写出所有可能). james_4441年前1
james_4441年前1 -
 tieshuai 共回答了13个问题
tieshuai 共回答了13个问题 |采纳率92.3%解题思路:(1)根据金属的性质进行分析;
(2)根据金属生锈的条件进行分析;
(3)根据金属的活动性进行分析;
(4)根据实验操作和金属的化学性质进行分析.(1)根据金属的导电性和三个选项分析可知,铜导线利用了铜具有良好的导电性;
(2)由于氧气的化学性质非常活泼,能与很多金属发生反应,铁生锈也是与空气中的氧气在潮湿的条件直发生反应的结果;
(3)铁能把铜从硫酸铜中置换出来,根据各物质的相互反应分析,四种金属中最活泼的镁,其次是锰,再次是铁,活动能力最差的是铜;
(4)根据实验操作进行分析可知,操作Ⅰ是过滤,根据混合液的成份分析,滤液里面可能有硫酸锌、硫酸亚铁或硫酸锌、硫酸亚铁、硫酸铜.
故答案为:(1)B;(2)接触潮湿的空气;(3)①Fe+CuSO4═FeSO4+Cu; ②镁>锰>铁>铜;(4)①过滤; ②硫酸锌、硫酸亚铁或硫酸锌、硫酸亚铁、硫酸铜.点评:
本题考点: 金属的物理性质及用途;过滤的原理、方法及其应用;金属活动性顺序及其应用;金属锈蚀的条件及其防护;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了金属的性质,与氧气的反应,活动性大小的鉴别,滤液成份等多个知识点,广泛考查了学生对化学知识的掌握程度.1年前查看全部
- 超过多大面积的厂房设火灾探测器,金属制品的厂房!
 shulinn1年前1
shulinn1年前1 -
 wilson2000 共回答了17个问题
wilson2000 共回答了17个问题 |采纳率94.1%1、这种厂房一般是丙类或丁类厂房,不设火灾报警系统
2、当然也要看是几层,或者耐火等级是多少,如果超过防火分区的话,也会有可能设
3、具体要求请参照“建筑设计防火规范”1年前查看全部
- 金属是我们学习的一类重要物质.(1)下列金属制品中(如图1),利用金属导电性的是______(填字母序号).(2)同学们
金属是我们学习的一类重要物质.
(1)下列金属制品中(如图1),利用金属导电性的是______(填字母序号).
(2)同学们在探究金属的化学性质时,做了如图2所示的两个实验(金属片已打磨).
①铁片插入硫酸铜溶液中,铁片表面的现象是______;
②铜片插入硝酸银溶液中,化学的反应方程式是______.
请结合上述两个实验,推测此实验的目的是______.
(3)某同学以铁锈为起始反应物,设计实验流程如下(部分反应条件已省略).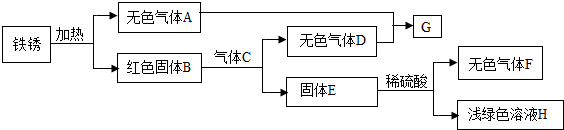
①F的化学式是______;
②B与C反应的化学方程式是3CO+Fe2O3
2Fe+3CO2高温 .3CO+Fe2O3;
2Fe+3CO2高温 .
③A-H中,能使紫色石蕊溶液变成红色的物质是______(填化学式). wsd135571年前1
wsd135571年前1 -
 最近很烦 共回答了16个问题
最近很烦 共回答了16个问题 |采纳率87.5%解题思路:(1)根据金属以及合金的性质进行解答;
(2)根据金属的活动性强弱进行解答;
(3)根据铁锈的成分可知,加热生成红色固体B和无色气体A,说明B是氧化铁,A是水蒸气;氧化铁和气体C反应生成固体E和无色气体D,说明C是一氧化碳,E是固体铁,而D是二氧化碳;二氧化碳和水反应生成碳酸,所以G就是碳酸;铁和硫酸反应生成无色气体F和浅绿色溶液H,所以F就是氢气,H就是硫酸亚铁.然后一一验证即可.(1)不锈钢餐具是利用合金的特性一般情况下不易生锈的特点;金箔是利用金的延展性;铜导线是利用铜的导电性;
(2)①铁比铜活泼,所以铁片插入硫酸铜溶液中会置换出金属铜,同时生成硫酸亚铁,故铁片表面的现象是有红色物质析出;
②铜比银活泼,铜片插入硝酸银溶液中会置换出金属银,同时生成硝酸铜,化学的反应方程式是Cu+2AgNO3=Cu(NO3)2+2Ag;此实验的目的是比较铁、铜、银三种金属的活动性;
(3)由铁锈的成分可知,加热生成红色固体B和无色气体A,说明B是氧化铁,A是水蒸气;氧化铁和气体C反应生成固体E和无色气体D,说明C是一氧化碳,E是固体铁,而D是二氧化碳,反应的化学方程式是3CO+Fe2O3
高温
.
2Fe+3CO2;二氧化碳和水反应生成碳酸,所以G就是碳酸;铁和硫酸反应生成无色气体F和浅绿色溶液H,所以F就是氢气,H就是硫酸亚铁.A-H中,能使紫色石蕊溶液变成红色的物质是二氧化碳和碳酸.
故答案为:(1)C;(2)①有红色物质析出;②Cu+2AgNO3=Cu(NO3)2+2Ag;比较铁、铜、银三种金属的活动性;(3)①H2;②3CO+Fe2O3
高温
.
2Fe+3CO2;③CO2、H2CO3.点评:
本题考点: 金属的物理性质及用途;金属的化学性质;物质的鉴别、推断.
考点点评: 要熟悉金属的判断方法,金属的物理性质,知道性质决定用途,用途反映其性质.1年前查看全部
- (2011•溧阳市模拟)人类发展的历史进程中人们不断研制出各种不同的用具,制造用具的材料也在不断地发生变化,金属制品因其
(2011•溧阳市模拟)人类发展的历史进程中人们不断研制出各种不同的用具,制造用具的材料也在不断地发生变化,金属制品因其美观、耐用、轻便易成型而被人们广泛利用,请根据所学知识及生活知识参与有关金属制品探究.
(1)以下过程中没有化学变化发生的是AA.
A.大浪淘沙,留下真金B.冶炼青铜C.高炉炼铁D.电解法炼铝
(2)请将以下金属材料的冶炼按年代的先后顺序排序BACDBACD(填序号).
A.铁B.青铜C.铝D.钾
(3)古代术士将炉甘石(主要成分为ZnCO3)与赤铜矿(Cu2O)、木炭放在炼炉中高温灼烧,炼出金光灿灿的“黄金”,被古人称为“炼石成金”.
①请你用学过的知识回答,真的可以“炼石成金”吗?说明原因不能,反应物中无金元素不能,反应物中无金元素
②那么,你认为这金光灿灿的“黄金”的成份可能是Zn、Cu合金(黄铜)Zn、Cu合金(黄铜).
(4)研究发现:活泼金属不仅能从不活泼金属的盐溶液中置换出不活泼金属,而且还能将不活泼金属从它们的融化状态下的氧化物中置换出来.例如:有一种焊接钢轨的方法如下:将四氧化三铁粉末和铝粉按一定的比例混合,用镁粉引燃,就可以制得铁水和氧化铝,从而达到焊接钢轨的目的.请写出铝粉和四氧化三铁反应的化学方程式4Al+3Fe3O4
4Al2O3+9Fe4Al+3Fe3O4点燃 .
4Al2O3+9Fe.点燃 .  iswqj1年前1
iswqj1年前1 -
 挣扎的小猪 共回答了17个问题
挣扎的小猪 共回答了17个问题 |采纳率94.1%解题思路:化学变化是指有新物质生成的变化.物理变化是指没有新物质生成的变化.化学变化和物理变化的本质区别是否有新物质生成.由金属利用的历史可以确定先后顺序;由题可知,主要成分中不含金元素,化学反应前后元素种类不可能发生变化,所以不能“炼石成金”.所谓的“黄金”是碳还原的铜锌的合金.由题目所给信息可以写出反应的化学方程式.解;(1)金的化学性质稳定,在自然界能以单质形式存在,故大浪淘沙,留下真金,没有新物质生成,属于物理变化;BCD变化后均有新物质生成,属于化学变化;故选A
(2)青铜出现在夏商时期.朝春秋时期,铁器在生产中广泛使用,铝的冶炼只有100多年的历史,钾在近现代才得以利用;因此顺序为BAC.
(3)在化学变化过程中元素种类不可能发生变化,所谓的“金”不过是炉甘石、赤铜矿和碳在高温下还原反应产生的铜锌合金.故答案为:不能,在化学变化过程中元素种类不可能发生改变;铜锌合金;
(4)由四氧化三铁粉末和铝粉按一定的比例混合,用镁粉引燃,就可以制得铁水和氧化铝,找出反应物、生成物及反应条件,即可写出反应的化学方程式.
故答案为:(1)A
(2)BACD
(3)①不能,反应物中无金元素②Zn、Cu合金(黄铜)
(4)4Al+3Fe3O4
点燃
.
4Al2O3+9Fe点评:
本题考点: 化学变化和物理变化的判别;金属活动性顺序及其应用;质量守恒定律及其应用.
考点点评: 本题难度一般,但综合性强,以信息给予题的形式考查了金属铝的物理性质和化学性质、质量守恒定律的应用等,完成此题可以依据已有的知识进行.1年前查看全部
- 金属铝是应用广泛的金属之一,在工农业生产中有着广泛的应用,对金属制品进行抗腐蚀处理,可延长其使用寿命.
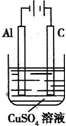 金属铝是应用广泛的金属之一,在工农业生产中有着广泛的应用,对金属制品进行抗腐蚀处理,可延长其使用寿命.
金属铝是应用广泛的金属之一,在工农业生产中有着广泛的应用,对金属制品进行抗腐蚀处理,可延长其使用寿命.
(1)在进行电解前,要对铝电极进行表面处理,是将铝片浸入热的16%NaOH溶液中半分钟左右,目的是______,反应的离子方程式为______.碱洗时常有气泡冒出,原因是______(用离子方程式表示).
(2)以铝片为阳极,在H2SO4溶液中电解,取少量废电解液,加入NaHCO3溶解后产生气泡和白色沉淀,产生沉淀的原因是______.
(3)在金属表面形成一薄层有抗腐蚀、抗磨损能力的金属镀膜.例如在铝片上电镀铜时,电解原理是采用Cu(NO3)2溶液为电解质,用作阳极.而在实际的电镀工艺中,要求控制金属在镀件上的析出速率,使析出的镀层厚度均匀、光滑致密、与底层金属的附着力强.所以电镀铜时,实际使用的电镀液是______(填序号).
a.AlCl3
b.CuCl2
c.K6[Cu(P2O7)2]
d.CuSO4
(4)在如图所示装置中,溶液的体积为100mL,开始时电解质溶液的浓度为0.1mol/L,工作一段时间后导线上通过0.001mol电子.若不考虑盐的水解和溶液体积的变化,则电解后溶液的pH为______. 周亮10031年前1
周亮10031年前1 -
 nn110 共回答了24个问题
nn110 共回答了24个问题 |采纳率100%解题思路:(1)对铝电极进行表面处理除去铝材表面的自然氧化膜,碱洗的目的是除去铝材表面的自然氧化膜,有气泡冒出因2Al+2OH-+2H2O═2AlO2-+3H2↑;
(2)铝为阳极,会发生氧化反应,表面形成氧化膜,必须有水参加,所以电极反应式为:2Al+3H2O-6e-═Al2O3+6H+;HCO3-与H+反应使H+浓度减小,产生Al(OH)3沉淀;
(3)电镀时用镀层金属为阳极,镀件为阴极,含有镀层金属离子的溶液为电解质溶液,因此采用铜为阳极,铜的络离子电离出的铜离子浓度小;
(4)电解过程中的电极反应和电子守恒、氢离子和氢氧根离子守恒计算得到.(1)对铝电极进行表面处理除去铝材表面的自然氧化膜,反应的离子方程式为:Al2O3+2OH-=H2O+2AlO2-,铝能与强碱反应产生氢气,2Al+2OH-+2H2O═2AlO2-+3H2↑;
故答案为:除去铝材表面的自然氧化膜;2Al2O3+2OH-=H2O+2AlO2-;Al+2OH-+2H2O═2AlO2-+3H2↑;
(2)铝为阳极,会发生氧化反应,表面形成氧化膜,必须有水参加,所以电极反应式为:2Al+3H2O-6e-═Al2O3+6H+;加入NaHCO3溶液后产生气泡和白色沉淀,是由于废电解液中含有Al3+,和HCO3-发生了互促水解.或HCO3-与H+反应使H+浓度减小,产生Al(OH)3沉淀,
故答案为:2Al+3H2O-6e-═Al2O3+6H+,HCO3-与H+反应使H+浓度减小,产生Al(OH)3沉淀;
(3)电镀时用镀层金属为阳极,镀件为阴极,含有镀层金属离子的溶液为电解质溶液,因此采用铜为阳极,铜的络离子电离出的铜离子浓度小,析出均匀与底层金属的附着力强,故答案为:C;
(4)电解过程中阳极电极反应为4OH--4e-=2H2O+O2↑,电子转移0.001mol,氢氧根离子减少0.001mol,溶液中增加氢离子0.001mol,溶液中氢离子的浓度=[0.001mol/0.1L]=0.01mol/L,pH=-lg0.01=2,故答案为:2.点评:
本题考点: 电解原理.
考点点评: 本题考查金属的性质、盐类的水解、电解、电镀以及金属的腐蚀及防护知识,考查较为综合,做题时注意把握好Al、AlO2-、Al(OH)3等物质的性质,掌握电解、电镀等知识的原理,了解金属的防护措施,难度不大,但要注意知识的积累,厚积而薄发.1年前查看全部
- (7分)金属在生产和生活中具有广泛的应用。(1)下列金属制品的用途中,利用金属导热性的是
(7分)金属在生产和生活中具有广泛的应用。(1)下列金属制品的用途中,利用金属导热性的是 (填字母序号)。
A.铁锅 B.铜导线 C.铝箔
(2)人类每年从自然界提取大量的金属,其中提取量最大的是铁。赤铁矿(主要成分为Fe 2 O 3 )和一氧化碳炼铁的化学方程式为 。
(3)铁制品容易锈蚀,铁生锈的条件是 。
(4)某工厂废液中含有氯化钠、氯化铜和氯化亚铁。某课外小组利用废液制取海绵铜(Cu)和氧化铁两种产品,过程如下图所示(过程中不引入其他元素)。请回答下列问题:
①溶液D中的溶质为 ;
②检验C过量的方法是 ;
③A~G七种物质中含铁元素的物质有 (填字母序号)。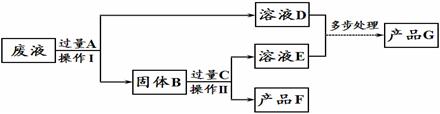
 alfordk1年前1
alfordk1年前1 -
 我发誓我很麻烦 共回答了22个问题
我发誓我很麻烦 共回答了22个问题 |采纳率95.5%1年前查看全部
- 除锈的化学问题?不能将金属制品长时间放在酸溶液中,因为那什么跟酸反应,最后,除铁锈时,什么反应?
 乌呼衰哉1年前2
乌呼衰哉1年前2 -
 钝刀慢剐 共回答了22个问题
钝刀慢剐 共回答了22个问题 |采纳率90.9%是不是:Fe 2HC1=FeC12 H2箭头指上.1年前查看全部
- 常见的金属制品且运用了该金属什么性质
 很难受a1年前2
很难受a1年前2 -
 今夜我很温柔 共回答了14个问题
今夜我很温柔 共回答了14个问题 |采纳率100%铜丝导线:导电性、延展性
铝合金制品:密度小、耐腐蚀、硬度大
钢:硬度大、韧性好1年前查看全部
- (一).对金属制品进行抗腐蚀处理,可延长其使用寿命。
(一).对金属制品进行抗腐蚀处理,可延长其使用寿命。
以下为铝材表面处理的一种方法: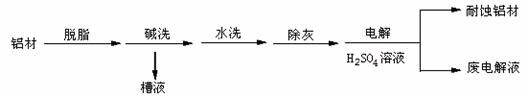
(1)碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出, 为将槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的 。 (填编号)
a.NH 3 b.CO 2 c.NaOHd.HNO 3
(2)以铝材为阳极,在H 2 SO 4 溶液中电解,铝材表面形成氧化膜,
阳极电极反应式为 。取少量废电解液,加入NaHCO 3 溶液,写出发生反应的离子方程式
(二).A—E五种元素中,除A、B外其他均为短周期元素它们的性质或原子结构如下表:元素 元素性质或原子结构 A 单质为生活中常见的金属,该金属的两种黑色氧化物(其中一种有磁性)的相对分子质量相差160 B 单质为生活中常见的金属,其相对原子质量比A大8 C 地壳中含量最多的金属元素 D 元素的主族序数是其所在周期序数的3倍 E E的某种原子的原子核内没有中子
(1)在高温条件下,将D、E组成的气态化合物与A的粉末充分反应,生成8gE的单质和相应的固态化合物时,放出a KJ热量,此反应的热化学方程式是
(2)A的某种氯化物溶液呈黄色,向其中通入足量SO 2 气体,溶液变为浅绿色,此反应的离子方程式是
(3)向2mL 0.5mol/L的ACl 3 溶液中加入3mL 3mol/L KF溶液,
ACl 3 溶液褪成无色,再加入KI溶液和CCl 4 振荡后静置,CCl 4 层不显色,
则下列说法正确的是(已知氧化性Fe 3+ >I 2 ) (填字母)。
a.A 3+ 不与I - 发生反应
b.A 3+ 与F - 结合生成不与I - 反应的物质
c.F - 使I - 的氧化性减弱
d.A 3+ 被F - 还原为A 2+ ,使溶液中不再存在A 3+ hahaho5201年前1
hahaho5201年前1 -
 feng82520 共回答了13个问题
feng82520 共回答了13个问题 |采纳率76.9%(一)、b(1分) ② 2Al+3H 2 O=Al 2 O 3 +6H + +6e - (2分);
Al 3+ +3 HCO 3 - =Al(OH) 3 ↓+ 3CO 2 ↑ (2分)
(二)(1)3Fe(s)+4H 2 O(g)=Fe 3 O 4 (s)+4H 2 (g);△H=-akJ/mol(2分)
(2)2Fe 3+ +SO 2 +2H 2 O=2Fe 2+ +SO 4 2- +4H + (2分)
(3)b (1分)
1年前查看全部
- 阅读下面材料:不同物体的传热能力是否相同小明是个既善于观察又爱动脑筋的学生.他发现在寒冷的冬天,用手摸户外的金属制品和木
阅读下面材料:
不同物体的传热能力是否相同
小明是个既善于观察又爱动脑筋的学生.他发现在寒冷的冬天,用手摸户外的金属制品和木头制品时,感到金属制品比木头制品凉;吃饭时,放在热汤中的金属勺很快就会变得烫手,而陶瓷勺就不会烫手;把热饭装在陶瓷碗中,要比装在金属碗变凉得慢…小明对上述现象进行分析比较,得出了结论:金属物质的导热能力比非金属的导热能力好.
根据你刚才的阅读,请回答下列问题:
(1)在寒冷的冬天,用手摸户外的金属制品和木头制品时,感到金属制品比木头制品凉,这是为什么?
答:因为金属制品的导热能力比木头的______.当手触摸户外的金属制品时,手上的热______(填“很容易”或“不容易”)传递出去,使手的______降低很快,所以感觉金属制品比木头制品凉.
(2)除文中的例子外,举出生产生活中利用和防止物体传热的例子各一个.
例一:______.
例二:______. 馨晴98981年前1
馨晴98981年前1 -
 xuyFlying 共回答了19个问题
xuyFlying 共回答了19个问题 |采纳率100%金属制品的导热能力比木头的强,当手触摸户外的金属制品时,手上的热很容易被传递出去,使手的温度降低,所以在寒冷的冬天,用手摸户外的金属制品和木头制品时,感到金属制品比木头制品凉.
答:(1)强;很容易;温度;
(2)保温瓶的瓶塞选用导热性能较差的非金属;
电饭锅的锅胆选用导热性能较好的金属.1年前查看全部
- (2007•龙岩)为预防金属制品锈蚀,下列措施或做法不当的是( )
(2007•龙岩)为预防金属制品锈蚀,下列措施或做法不当的是( )
A.将使用后的菜刀洗净擦干
B.在铁制门窗表面喷涂油漆
C.在铁制水管表面镀一层锌
D.用力擦去铝锅表面的氧化膜 纤纤出素手1年前1
纤纤出素手1年前1 -
 daminimo 共回答了21个问题
daminimo 共回答了21个问题 |采纳率100%解题思路:钢铁生锈的条件是钢铁与氧气和水同时接触;酸性溶液、碱性溶液、盐溶液能促进金属生锈;防止金属生锈的方法就是要使就是与水和氧气隔绝.A、使用后的菜刀洗净擦干有利于防锈,故正确;
B、在铁制门窗表面喷涂油漆,使铁与水和氧气隔绝,有利于防锈,故正确;
C、在铁制水管表面镀一层锌,使铁与水和氧气隔绝,有利于防锈,故正确;
D、铝锅表面的氧化膜对铝锅起到保护作用,阻止铝被进一步氧化,故擦去是错误的.
故选D.点评:
本题考点: 金属锈蚀的条件及其防护.
考点点评: 解答本题要掌握金属生锈的条件,只有这样才能找出防止金属生锈的方法.1年前查看全部
- (2014•绵阳)金属和金属制品与我们的生活息息相关,铁、铜、银及其合金使用非常广泛.
(2014•绵阳)金属和金属制品与我们的生活息息相关,铁、铜、银及其合金使用非常广泛.
(1)上述三种元素在地壳中含量最多的是______.
(2)要验证上述三种元素的活动性顺序,用一种金属和两种常见的溶液就可完成,这两种溶液的溶质是______,写出对应的化学反应方程式:______.
(3)金属和金属制品除了正常消耗外,还有很多因腐蚀而消耗.防止钢铁生锈的措施有(填两种)______. xinruiwu1年前1
xinruiwu1年前1 -
 tengyunyh 共回答了19个问题
tengyunyh 共回答了19个问题 |采纳率100%解题思路:(1)根据元素在地壳中的按量分析回答;
(2)验证三种金属活动性强弱时,通常采取“三取中”的方法,即取中间金属单质与两端的金属的盐溶液反应或取中间金属的盐溶液与两端金属的单质反应;
(3)根据防止铁生锈的措施分析回答.(1)在铁、铜、银上述三种元素中,在地壳中含量最多的是铁;
(2)要验证上述三种元素的活动性顺序,用一种金属和两种常见的溶液就可完成,这两种溶液的溶质是氯化亚铁、硝酸银,铜能与硝酸银反应不能与硝酸亚铁反应,可比较三种金属的活动性.反应的方程式是:Cu+2AgNO3=Cu(NO3)2+2Ag;
(3)防止钢铁生锈的措施有由很多,例如:涂油、刷漆、保持铁制品表面干燥、洁净等.
故答为:(1)铁;(2)氯化亚铁、硝酸银,Cu+2AgNO3=Cu(NO3)2+2Ag;(3)涂油、刷漆等.点评:
本题考点: 金属活动性顺序及其应用;金属锈蚀的条件及其防护;地壳中元素的分布与含量;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不是很大,考查了金属元素在地壳中的含量、金属活动性顺序的应用、防止铁生锈的措施等知识.掌握金属活动性顺序并能灵活运用是正确解答此类题的关键所在.1年前查看全部
- 对金属制品进行抗腐蚀处理,可延长其使用寿命。以下为铝材表面处理的一种方法:
对金属制品进行抗腐蚀处理,可延长其使用寿命。以下为铝材表面处理的一种方法:
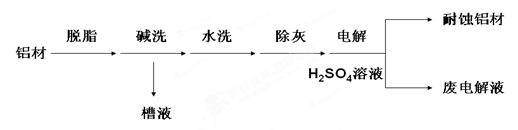
(1)碱洗的目的是除去铝材表面的自然氧化膜,碱洗时候常有气泡冒出,原因是
(用离子方程式表示);
往废电解液中加入NaHCO 3 时会出现气泡,原因是 (用离子方程式表示)
(2)为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的
(3)耐蚀铝材因为其表面形成坚硬的 (填化学式),这种物质有时候也可以用来作耐火材料,是因为A.NH 3 B.CO 2 C.NaOH D.HNO 3  9长1年前1
9长1年前1 -
 yy鞋 共回答了13个问题
yy鞋 共回答了13个问题 |采纳率92.3%
(2) B
(3) Al 2 O 3 ,氧化铝熔点高
答案:⑴2Al+2OH ― +2H 2 O=2AlO 2 ― +3H 2 ↑;HCO 3 ― +H + =CO 2 ↑+H 2 O(2) B (3) Al 2 O 3 ,氧化铝熔点高
解析:(1)碱洗的目的是除去铝材表面的自然氧化膜,碱洗时候常有气泡冒出,原因是铝也能与碱反应:2Al+2OH ― +2H 2 O=2AlO 2 ― +3H 2 ↑;废电解液中有过量的酸,往废电解液中加入NaHCO 3 时会出现气泡,原因是;HCO 3 ― +H + =CO 2 ↑+H 2 O(2)槽液中有AlO 2 ― ,AlO 2 ― +2H 2 O+CO 2 =Al(OH) 3 +HCO 3 ― ,选 B;(3)耐蚀铝材因为其表面形成坚硬的Al 2 O 3 ,氧化铝熔点高,常用作耐火材料。1年前查看全部
- 金属制品怎样防锈自行车,脸盆,铁皮柜,新生产的小刀,暖气片,室外的金属管道电镀,搪瓷,喷漆,刷油
 caiheng20001年前1
caiheng20001年前1 -
 白魔19 共回答了17个问题
白魔19 共回答了17个问题 |采纳率94.1%自行车:电镀
铁皮柜、暖气片、金属管道:喷漆
脸盆:搪瓷
新生产小刀:涂油1年前查看全部
- 在金属制品加工中,金属切削液的化学成分有哪些?在环保上如何处理废弃的切削液?
 bewithout1年前3
bewithout1年前3 -
 kelvinmin 共回答了28个问题
kelvinmin 共回答了28个问题 |采纳率89.3%如果你用的是乳化切削液,那么废液就要交给专门的公司做废物处理.现在有合成的切削液,是环保切削液用后可以直接排放,不会对环境造成影响.
圣哥牌全合成切削液(0769-23324335)采用美国技术,进口原料,经过先进工艺研制而成.全合成切削液为黄绿色透明液体,全合成切削液具有防锈、润滑、冷却、清洗等性能.全合成切削液适用于多种材质的车、磨、铣、锯、钻,五金线切割自动啤专用.机械精加工,可大大提高工件的表面光洁度,全合成切削液也可适用于高精度之CNC、MC、NC等设备.全合成切削液使用周期为乳化油的6倍以上,产品环保,用后可直接排放.1年前查看全部
- 生产下列金属制品,各自利用了金属的什么性质
生产下列金属制品,各自利用了金属的什么性质
(1)铝壶、铁锅.(2)铝制、铜制导线.(3)铝合金门窗 洪兴1年前1
洪兴1年前1 -
 ysonyeye 共回答了22个问题
ysonyeye 共回答了22个问题 |采纳率90.9%(1)铝壶、铁锅.(导热性)(2)铝制、铜制导线.(导电性)(3)铝合金门窗(延展性)1年前查看全部
- (2014•宁波)人类的生活和生产都离不开金属材料.下列金属制品中,主要利用金属导热性的是( )
(2014•宁波)人类的生活和生产都离不开金属材料.下列金属制品中,主要利用金属导热性的是( )
A.
雕塑
B.
车模
C.
导线
D.
炒锅 tiantianxingfu1年前1
tiantianxingfu1年前1 -
 爱上奕 共回答了18个问题
爱上奕 共回答了18个问题 |采纳率94.4%解题思路:根据对金属可塑性、延展性、导电性和导热性的特点分别分析,确定符合题意的选项.A、用金属制成雕塑利用了金属材料的可塑性强的性质.不符合题意;
B、用金属制成车模利用了金属材料的延展性好的性质.不符合题意;
C、用金属制成导线利用了金属材料的导电性能好的性质.不符合题意;
D、用金属制成炒锅利用了金属材料的导热性能好是性质.符合题意.
故选D.点评:
本题考点: 物质的基本属性.
考点点评: 不同的物质具有不同的物理属性,不同的物理属性在实际生活中有不同的应用.1年前查看全部
- 金属与人类的生产生活息息相关。(1)下列金属制品中,利用金属导电性的是_________(填字母序号)。 &
金属与人类的生产生活息息相关。
(1)下列金属制品中,利用金属导电性的是_________(填字母序号)。


A.铁锅 B.铜导线 C.水龙头
(2)金属腐蚀造成资源浪费,铁生锈的条件是 。
(3)应用金属活动性顺序能帮助我们进一步学习金属性质。已知下列各组物质间均能发生化学反应。
A.Fe和CuSO 4 溶液 B. Mg和MnSO 4 溶液 C. Mn和FeSO 4 溶液
①写出Fe和CuSO 4 溶液反应的化学方程式 。
②以上四种金属的活动性由强到弱的顺序是 。
(4)化学小组对含有硫酸铜和硫酸锌的废液进行了如下处理: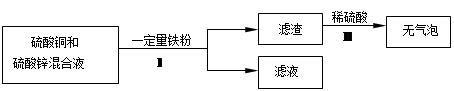
①步骤Ⅰ中的操作名称是___________。
②滤液的成分是 (写出所有可能)。 牛不群1年前1
牛不群1年前1 -
 93次航班 共回答了18个问题
93次航班 共回答了18个问题 |采纳率88.9%(1)B (2)接触潮湿的空气(氧气和水共同接触) (3)①Fe + CuSO 4 = FeSO 4 + Cu
② 镁>锰>铁>铜(4)①过滤 ②硫酸锌、硫酸亚铁或硫酸锌、硫酸亚铁、硫酸铜
1年前查看全部
- 寒假化学作业 各位过来帮个忙!1观察一些金属制品.这些制品分别是由那些金属制成?为什么选用这些金属制造?从中你能否总结出
寒假化学作业 各位过来帮个忙!
1观察一些金属制品.这些制品分别是由那些金属制成?为什么选用这些金属制造?从中你能否总结出人们在选用材料是主要考虑什么?
2你家有哪些金属制品?各含有那些金属?他们的使用寿命如何?废旧金属制品是如何处理的?
〔请大家抱着认真的态度回答,每题各举5个例子 回答的好的再+30分!〕 sclykyo1年前2
sclykyo1年前2 -
 abcff123 共回答了17个问题
abcff123 共回答了17个问题 |采纳率94.1%1锅:铁.导热到,含铁元素.从导热性,使用后的效果来看.废旧的回收高温重加工
2保险丝:铋,铅,镉,锡.熔点低.考虑熔点.废旧的可以重高温加工
3铝制窗框:铝,铜,镁,锰.质量轻,硬度大,延展性好.考虑延展性,硬度,质量.废旧的高温重新加工成硬铝
4体温计:水银.考虑体积的热胀冷缩.体积岁温度变化程度.
浴缸中的不绣钢材料:铁,铬.耐腐蚀.重新锻造1年前查看全部
- 有关铁、铜、铝、金、银、镁、钛、汞的金属制品的名称,只要从中选取两种,跪求金属制品名称.
 chenyan0807661年前1
chenyan0807661年前1 -
 多空平衡 共回答了23个问题
多空平衡 共回答了23个问题 |采纳率91.3%铁,铁锅
铜,电缆
铝,铝合金门窗
金,首饰
银,银牌
镁,压铸镁合金电脑外壳
钛,航空零件
汞,温度计1年前查看全部
- 下列4种金属制品的镀层损坏后,金属腐蚀速率最快的是
下列4种金属制品的镀层损坏后,金属腐蚀速率最快的是
A 镀铝塑扣 B 食品罐头盒 (镀锡) C 白铁水桶(镀锌) D 镀银铜质奖章 ll解决一切1年前3
ll解决一切1年前3 -
 Google测试员4123 共回答了21个问题
Google测试员4123 共回答了21个问题 |采纳率95.2%B最快.这些金属腐蚀都是原电池反应.A铁为正极,被保护,度层腐蚀严重.B铁为负极,加速腐蚀.C同A,为正极,被保护.D虽然也为负极,但是铜活泼性不如铁.鉴定完毕1年前查看全部
- 生活中的金属制品 像铁制锅 铝制窗等等 他们的使用寿命如何?使用完毕之后怎样回收?
 ouyw1721年前1
ouyw1721年前1 -
 bqx1986 共回答了25个问题
bqx1986 共回答了25个问题 |采纳率88%他们一般使用寿命都很长的.因为铝合金的性质很稳定变黑后可以放点醋把黒洗掉.至于回收,好像通过电解能还原成金属单质,好像还能当催化剂1年前查看全部
- 用酸可以清除金属制品的锈,除锈时能否将金属制品长时间放在在酸中?为什么?如题
 慕容公子1191年前2
慕容公子1191年前2 -
 a6512653 共回答了17个问题
a6512653 共回答了17个问题 |采纳率88.2%不能.当看到表面的锈没有时,也就是表面光滑的时候,就要把金属拿出来.因为金属也能和酸发生反应,产生氢气.1年前查看全部
- 生活中的金属制品怎样防锈
 雅聚吧1年前1
雅聚吧1年前1 -
 79bAlL 共回答了10个问题
79bAlL 共回答了10个问题 |采纳率80%1.在表面涂上机油、凡士林、油漆或覆盖搪瓷、塑料等耐腐蚀的非金属材料.2.用电镀、热镀、喷镀等方法,在表面镀上一层不易被腐蚀的金属,如锌、锡、铬、镍等.这些金属常因氧化而形成一层致密的氧化物薄膜,从而阻止水和空气等对钢铁的腐蚀.3.用化学方法使表面生成一层细密稳定的氧化膜.1年前查看全部
- 金属具有广泛的应用.(1)下列金属制品中,利用金属导电性的是______(填字母序号).A.黄金饰品
 金属具有广泛的应用.
金属具有广泛的应用.
(1)下列金属制品中,利用金属导电性的是______(填字母序号).
A.黄金饰品B.铝蒸锅C.铜导线
(2)铁制品在沙漠地区不易锈蚀的原因是______.
(3)工业上用一氧化碳和赤铁矿炼铁反应的化学方程式为3CO+Fe2O3
2Fe+3CO2高温 .3CO+Fe2O3.
2Fe+3CO2高温 .
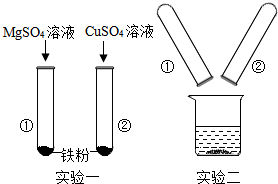
(4)某小组同学在探Mg、Cu、Fe三种金属的性质时进行了如图所示实验.
【实验一】发生反应的化学方程式为______.
【实验二】将实验一反应后的物质倒入烧杯中,发现烧杯内的红色固体明显增多,充分反应后过滤.
Ⅰ.下列对滤液中溶质成分的判断正确的是______(填字母序号).
A.MgSO4 B.MgSO4、FeSO4C.MgSO4、Fe2(SO4)3
D.CuSO4、FeSO4E.MgSO4、FeSO4、CuSO4
Ⅱ.确定滤渣中所含物质成分的实验方案是______. jiaxin64221年前1
jiaxin64221年前1 -
 我照看着天使 共回答了17个问题
我照看着天使 共回答了17个问题 |采纳率94.1%解题思路:(1)用铜丝做导线具是利用了金属具有良好的导电性;
(2)利用铁生锈的条件进行分析;
(3)赤铁矿的主要成份是Fe2O3,Fe2O3能在高温下与一氧化碳反应生成铁,这是炼铁的主要手段;
(4)【实验一】根据方程式的写法和金属与盐反应的条件考虑;
【实验二】Ⅰ、发现烧杯内的红色固体明显增多说明铁在置换铜,硫酸铜可能全部反应,也可能有剩余.
Ⅱ、铁与硫酸铜反应,铁有可能全部反应,也可能有剩余.(1)用铜丝做导线具是利用了金属具有良好的导电性;
(2)铁制品在沙漠地区不易锈蚀的原因是沙漠地区干燥,水分少;
(3)赤铁矿的主要成份是Fe2O3,Fe2O3能在高温下与一氧化碳反应生成铁,这是炼铁的主要手段;其化学方程式是:
3CO+Fe2O3
高温
.
2Fe+3CO2;
(4))【实验一】反应物是铁和硫酸铜,生成物是铜和硫酸亚铁,已经平了改成等号即可;
【实验二】Ⅰ将实验一后①、②试管内的物质倒入烧杯中,发现烧杯内的红色固体明显增多,说明铁在置换铜,一段时间后过滤.滤液中一定含有的物质是硫酸镁和硫酸亚铁,可能有的物质就是硫酸铜,硫酸铜可能反应完了,也可能没反应完有剩余;
Ⅱ将实验一后①、②试管内的物质倒入烧杯中,发现烧杯内的红色固体明显增多,说明铁在置换铜,一段时间后过滤.滤渣中一定含有的物质是铜,可能有的物质就是铁,铁可能反应完了,也可能没反应完有剩余;由于铁能与盐酸反应生成氢气,所以取少量滤渣于试管中,向其中滴加稀盐酸,有气泡说明含有铁,否则没有铁;
故答案为:
(1)C(2)沙漠地区干燥,水分少
(3)3CO+Fe2O3
高温
.
2Fe+3CO2
(4)【实验一】Fe+CuSO4=FeSO4+Cu
【实验二】Ⅰ.BE
Ⅱ.取少量滤渣于试管中,向其中滴加稀盐酸,若有气泡产生,则滤渣为铁和铜的混合物,若无气泡产生则滤渣为铜.点评:
本题考点: 金属的物理性质及用途;金属的化学性质;铁的冶炼;金属锈蚀的条件及其防护;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查金属的各种性质,只要熟知相关内容,根据实验及文字说明进行细致的分析即可得正确答案.1年前查看全部
- 金属制品跟金属工艺品的区别
 洒家不认字1年前1
洒家不认字1年前1 -
 modellin 共回答了17个问题
modellin 共回答了17个问题 |采纳率88.2%所有用各种制造手段制成的金属器物统称金属制品,金属工艺品也属于金属制品的范畴,但金属工艺品仅指用金属制造的、具有一定艺术欣赏价值的、供人们欣赏、收藏、把玩或美化环境之用的金属物品.1年前查看全部
- (2007•顺义区二模)物质的性质决定物质的用途,下列金属制品的用途与其性质不存在决定关系的是( )
(2007•顺义区二模)物质的性质决定物质的用途,下列金属制品的用途与其性质不存在决定关系的是( )
a. 电线-延展性
电线-延展性
b. 刀具-硬度大
刀具-硬度大
c. 铜镜-金属光泽
铜镜-金属光泽
d. 炊具-导热性
炊具-导热性  linda86251年前1
linda86251年前1 -
 紫羽狼矢 共回答了19个问题
紫羽狼矢 共回答了19个问题 |采纳率73.7%解题思路:物质的性质在很大程度上决定物质的用途,分析物质的用途和性质是否一致,就要将题中所给出的物质的性质和用途联系起来进行分析、判定A、金属制成电线是因为其导电性,故A选项错误;
B、金属做成刀具主要是因为其硬度大,因为刀具是不断磨损的过程,硬度必须打,才能切断其他食物,故B选项正确;
C、做镜子应该是能映出人影,故应用其金属光泽,故C选项正确;
D、炊具能够把食物煮熟,故应用其导热性,故D选项正确.
故选A.点评:
本题考点: 金属的物理性质及用途.
考点点评: 题主要考查物质的性质和用途,解答时要掌握常见物质的性质,然后再根据物质的性质方面进行分析、判断,从而确定物质的用途.1年前查看全部
- (2013•柳州)使用下列金属制品时,主要利用金属导热性的是( )
(2013•柳州)使用下列金属制品时,主要利用金属导热性的是( )
A.
铁钳
B.
铁锅
C.
水龙头
D.
餐刀,汤匙 tsmith10271年前1
tsmith10271年前1 -
 维c小粒 共回答了18个问题
维c小粒 共回答了18个问题 |采纳率100%解题思路:根据金属的物理性质及用途分析解答.金属具有导热性、延展性、导电性等.A、铁钳利用了金属硬度大的性质;
B、因为铁能导热,所以可做成铁锅做饭;
C、水龙头利用了金属硬度大的性质;
D、餐刀、汤匙是利用金属的延展性.
故答案为:B.点评:
本题考点: 金属的物理性质及用途.
考点点评: 物质性质决定用途,用途能反映物质性质,能根据物质性质推测物质用途,也能根据用途推测物质的性质是解答本题关健.1年前查看全部
- 关于吸附细菌的材料哪种材料(如棉质、纸质、金属制品等等)的吸附细菌能力较强?哪种较弱?要生活中较常见的,最好差异明显,好
关于吸附细菌的材料
哪种材料(如棉质、纸质、金属制品等等)的吸附细菌能力较强?哪种较弱?要生活中较常见的,最好差异明显,好心的过路人帮帮忙a
除了我的举例子还有什么其他种类的材料?
哪种吸附细菌能力较弱?
有没有日常中常见的,能搞得到的? telyo1年前1
telyo1年前1 -
 帝俊 共回答了21个问题
帝俊 共回答了21个问题 |采纳率85.7%金属1年前查看全部
- (2008•长沙)(1)厨房中很多炊具是金属制品,请写出其中一种制炊具的金属的元素符号______.
(2008•长沙)(1)厨房中很多炊具是金属制品,请写出其中一种制炊具的金属的元素符号______.
(2)常用稀盐酸洗掉水壶中的水垢,水垢的主要成分是碳酸钙和氢氧化镁,请写出其中一个化学反应方程式______. feng_xinzi1年前1
feng_xinzi1年前1 -
 zh0127 共回答了30个问题
zh0127 共回答了30个问题 |采纳率93.3%解题思路:(1)根据元素符号的正确书写方法进行解答;
(2)根据书写反应方程式的书写步骤:写配注等,写出反应方程式即可.(1)根据元素符号的正确书写方法,金属的元素符号如:Fe(或A1);
故答案为:Fe(或A1);
(2)根据书写反应方程式的书写步骤:写配注等,盐酸洗掉水壶中的水垢的反应方程式为:
CaCO3+2HCl═CaCl2+H2O+CO2↑(或2HCl十Mg(OH)2=MgCl2+2HzO);
故答案为:CaCO3+2HCl═CaCl2+H2O+CO2↑(或2HCl十Mg(OH)2=MgCl2+2HzO).点评:
本题考点: 元素的符号及其意义;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查学生正确书写化学式及化学反应方程式的能力,是学习化学必须掌握的知识.1年前查看全部
- 下列生活中的各种金属制品,主要利用了金属的什么物理性质?
下列生活中的各种金属制品,主要利用了金属的什么物理性质?
(1)铜导线:______;
(2)铝锅:______;
(3)灯泡中的钨丝:______;
(4)金项链:______. persen1年前1
persen1年前1 -
 andeone3 共回答了23个问题
andeone3 共回答了23个问题 |采纳率95.7%解题思路:金属具有良好的导电性、导热性、延展性;钨的熔点很高.(1)铜做导线,主要是因为铜具有良好的导电性.
故填:导电性.
(2)铝用于制作铝锅,主要是因为铝具有良好的导热性.
故填:导热性.
(3)钨可以用作灯丝,主要是因为钨的熔点高.
故填:熔点高.
(4)金可以用作项链,主要是因为金具有良好的延展性.
故填:延展性.点评:
本题考点: 金属的物理性质及用途.
考点点评: 物质的组成和结构决定物质的性质,物质的性质决定物质的用途.1年前查看全部
- (1)下列说法中正确的是 . A.利用α射线可发现金属制品中的裂纹 B. 原子核中
(1)下列说法中正确的是 .
(2)一光电管的阴极 K 用截止频率为 ν 0 的金属钠制成,光电管阳极 A 和阴极 K 之间的正向电压为U,普朗克常量为 h ,电子的电荷量为 e .用频率为 ν 的紫外线照射阴极,有光电子逸出,光电子到达阳极的最大动能是 ;若在光电管阳极 A 和阴极 K 之间加反向电压,要使光电子都不能到达阳极,反向电压至少为 .A.利用α射线可发现金属制品中的裂纹 B. 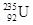 原子核中,质子间的库仑力能使它自发裂变
原子核中,质子间的库仑力能使它自发裂变C.在温度达到10 7 K时,  能与
能与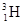 发生聚变,这个反应需要吸收能量
发生聚变,这个反应需要吸收能量D.一束C60分子通过双缝装置后会出现干涉图样,证明分子也会象光波一样表现出波动性
(3)1928年,德国物理学家玻特用α粒子轰击轻金属铍时,发现有一种贯穿能力很强的中性射线.查德威克测出了它的速度不到光速的十分之一,否定了是γ射线的看法,他用这种射线与氢核和氮核分别发生碰撞,求出了这种中性粒子的质量,从而发现了中子.
①请写出α粒子轰击铍核(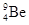 )得到中子的方程式.
)得到中子的方程式.
②若中子以速度v 0 与一质量为m N 的静止氮核发生碰撞,测得中子反向弹回的速率为v 1 ,氮核碰后的速率为v 2 ,则中子的质量m等于多少? barroom1年前1
barroom1年前1 -
 lxytcn 共回答了16个问题
lxytcn 共回答了16个问题 |采纳率93.8%1年前查看全部
- 铝是用途广泛的金属(1)对金属制品进行抗腐蚀处理,可延长其使用寿命.以下为铝材表面处理的一种方法: ①碱洗的目的是除去铝
铝是用途广泛的金属
(1)对金属制品进行抗腐蚀处理,可延长其使用寿命.以下为铝材表面处理的一种方法: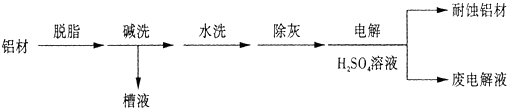
①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时候常有气泡冒出,原因是(用离子方程式表示)______.为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的______.
A.NH 3 B.CO 2 C.NaOHD.HNO 3
②以铝材为阳极,在H 2 SO 4 溶液中电解,铝材表面形成氧化膜,阳极电极反应式为______
______.取少量废电解液,加入NaHCO 3 ,溶液后产生气泡和白色沉淀,产生沉淀的离子方程式是______
(2)从铝土矿(主要成分是Al 2 O 3 ,含SiO 2 、Fe 2 O 3 、MgO等杂质)中提取两种工艺品的流程如下: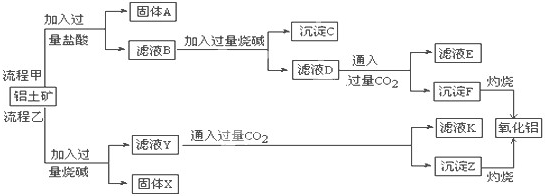
①流程甲加入盐酸后生成Al 3+ 的离子方程式为______.
②滤液E、K中溶质的主要成份是______(填化学式),写出该溶液的一种用途______. 斑玉1年前1
斑玉1年前1 -
 怪怪笨笨 共回答了16个问题
怪怪笨笨 共回答了16个问题 |采纳率93.8%(1)①铝能与强碱反应产生氢气,Al(OH) 3 具有两性,既能与强碱反应也能与强酸反应生成盐和水,碱洗槽液中有AlO 2 - ,故应通入CO 2 来回收Al(OH) 3 ,发生反应2AlO 2 - +3H 2 O+CO 2 ═2Al(OH) 3 ↓+CO 3 2- 或CO 2 +2H 2 O+AlO 2 - ═HCO 3 - +Al(OH) 3 ↓;若加HNO 3 ,生成的沉淀还会继续溶解,
故答案为:2Al+2OH - +2H 2 O═2AlO+3H 2 ↑;b;
②铝为阳极,会发生氧化反应,表面形成氧化膜,必须有水参加,所以电极反应式为:2Al+3H 2 O-6e - ═Al 2 O 3 +6H + ;加入NaHCO 3 溶液后产生气泡和白色沉淀,是由于废电解液中含有Al 3+ ,和HCO 3 - 发生了互促水解.3HCO 3 - +Al 3+ =3CO 2 ↑+Al(OH) 3 ↓;或HCO 3 - 与H + 反应使H + 浓度减小,产生Al(OH) 3 沉淀,
故答案为:2Al+3H 2 O-6e - ═Al 2 O 3 +6H + ;3HCO 3 - +Al 3+ =3CO 2 ↑+Al(OH) 3 ↓;
(2)Al 2 O 3 与盐酸反应生成氯化铝和水,离子方程式为Al 2 O 3 +6H + ═2Al 3+ +3H 2 O,
故答案为:Al 2 O 3 +6H + ═2Al 3+ +3H 2 O;
(3)根据工艺流程甲可知,固体A为SiO 2 ,滤液B含有氯化铝、氯化铁、氯化镁等,沉淀C为氢氧化铁、氢氧化镁,滤液D含有偏铝酸钠、氯化钠,所以向滤液D中通入过量二氧化碳,反应生成氢氧化铝沉淀与碳酸氢钠,滤液Y是铝土矿溶解在氢氧化钠溶液中,生成偏铝酸钠和硅酸钠,通入过量二氧化碳生成碳酸氢钠和硅酸沉淀,滤液K为碳酸氢钠溶液;碳酸氢钠可用于制纯碱或做发酵粉等,
故答案为:NaHCO 3 ;制纯碱或做发酵粉等.1年前查看全部
- 保护金属资源的有效途径有:防止金属制品的锈蚀;合理开采;回收利用;寻找金属的代用品等,以下材料的作用不是作金属代用品的是
保护金属资源的有效途径有:防止金属制品的锈蚀;合理开采;回收利用;寻找金属的代用品等,以下材料的作用不是作金属代用品的是( )
A.塑钢材料
B.聚乙烯塑料
C.尼龙 mumudejia1年前1
mumudejia1年前1 -
 TML_HI 共回答了20个问题
TML_HI 共回答了20个问题 |采纳率95%解题思路:只有具有金属性能的材料才能用作金属的替代品.A.塑钢材料,其物理性能如刚性、弹性、耐腐蚀,抗老化性能优异,通常用作是铜、锌、铝等有色金属的代用品;
B.聚乙烯塑料不可用作金属的替代品;
C.尼龙抗冲击,耐磨,可以制成齿轮替代金属制品.
故选B.点评:
本题考点: 金属资源的保护;新材料的开发与社会发展的密切关系.
考点点评: 要了解材料的性能才能正确解答此类试题.1年前查看全部
- 生产生活中的金属制品有哪些?他们的使用寿命为?废旧金属制品是如何处理的?
 chenguan1年前1
chenguan1年前1 -
 羽後 共回答了13个问题
羽後 共回答了13个问题 |采纳率76.9%铁锅,寿命10年,非金属回收再加工.
铝材,寿命50年,非金属回收再加工.
铜管,寿命50年,非金属回收再加工.
金属是日常生活和市场必不可少的材料,新型金属和合金层出不穷.吴王剑几千年出土仍然光亮.飞机航母新型合金非常高级.一时说不完.1年前查看全部
- 用酸可以清除金属制品表面的锈 除锈时能否将金属制品长时间浸在酸中,为什么
 天翼卡1年前2
天翼卡1年前2 -
 10朵郁金香 共回答了16个问题
10朵郁金香 共回答了16个问题 |采纳率87.5%不能,因为酸具有腐蚀性.浸泡时间过长,会腐蚀掉金属制品.1年前查看全部
- 人类的生产和生活都离不开金属(1)如图所示的金属制品中,利用金属导热性的是 _________ (填字母序号). (
人类的生产和生活都离不开金属
(1)如图所示的金属制品中,利用金属导热性的是 _________ (填字母序号).
(2)铝具有很好的抗腐蚀性能,用电解氧化铝的方法可以制取铝,氧化铝中铝元素和氧元素的质量比为 _________ .
(3)铁是应用最广泛的金属,工业上常以赤铁矿(主要成分Fe 2 O 3 )和一氧化碳为原料炼铁,该反应的化学方程式为 _________ .
(4)赤铜矿的主要成分是Cu 2 O,辉铜矿的主要成分是Cu 2 S,将赤铜矿与辉铜矿混合加热可得铜,请将反应的化学方程式补充完整:2Cu 2 O+Cu 2 S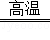 6Cu+ _________ .
6Cu+ _________ .
(5)某实验室废液中含有稀硫酸、硫酸亚铁和硫酸铜,若向其中加入一定量的锌,充分反应后过滤,向滤渣中加入盐酸,有气泡产生.则滤渣中一定含有的物质是 _________ ,滤液中一定含有的物质是 _________ . yc4091年前1
yc4091年前1 -
 2阿宴 共回答了25个问题
2阿宴 共回答了25个问题 |采纳率92%(1)B (2)9:8 (3)3CO+ Fe 2 O 3 高温 2Fe + 3CO 2
(4)SO 2 (5)Cu、Fe ZnSO 4
1年前查看全部
- 利用酸与金属氧化物的反应可以清除金属表面的锈,除锈时是否将金属制品长时间浸在酸中?为什么?
 sportzhu1年前1
sportzhu1年前1 -
 小鱼我爱你 共回答了16个问题
小鱼我爱你 共回答了16个问题 |采纳率93.8%当然不能,因为除锈用的是稀酸,也能与金属作用1年前查看全部
- 4、为了防止金属制品表面生锈,增加产品的美观程度.通常需要对金属表面进行以下工序 的处理,其正确
4、为了防止金属制品表面生锈,增加产品的美观程度.通常需要对金属表面进行以下工序 的处理,其正确
4、为了防止金属制品表面生锈,增加产品的美观程度.通常需要对金属表面进行以下工序 的处理,其正确的处理顺序是 --------------------------------------------( )
①用精细金刚砂纸打磨 ②喷涂油漆或镀层 ③清除毛刺和铁屑 ④用细锉锉平表面
如何排序 6b453e44aa0b09261年前1
6b453e44aa0b09261年前1 -
 丛中笑哈哈 共回答了18个问题
丛中笑哈哈 共回答了18个问题 |采纳率83.3%这个是表面处理的工序问题,先粗后细,再涂层,故顺序为:
④用细锉锉平表面
③清除毛刺和铁屑
①用精细金刚砂纸打磨
②喷涂油漆或镀层1年前查看全部
- 有什么办法能让金属制品防锈
 萍水相逢的他1年前1
萍水相逢的他1年前1 -
 秋日的尸雨 共回答了19个问题
秋日的尸雨 共回答了19个问题 |采纳率100%1采用不锈钢
2电镀
3涂油 (防氧化)
4原电池方法 牺牲活泼金属 例如 轮船的底部 要放一大块锌 防止腐蚀船底1年前查看全部
- 生活中许多物品看起来好像是金属制品,其实是用塑料仿制而成的,你能用简便的方
 wjm35851年前1
wjm35851年前1 -
 铿锵猫 共回答了18个问题
铿锵猫 共回答了18个问题 |采纳率83.3%可以轻轻的敲击,听声音可以辨别的1年前查看全部
- 每年因锈蚀而造成大量的金属制品报废,从保护金属环境的角度提出一条合理化建议
 lf05101年前1
lf05101年前1 -
 甜哥 共回答了13个问题
甜哥 共回答了13个问题 |采纳率92.3%涂上防锈漆、加入防腐蚀的金属,镀锌,将锈什么的还原1年前查看全部
- 为什么有太阳照射时,金属制品的温度比空气温度高,感觉很烫手;没太阳照射时金属制品温度比空气温度低(比如冬天),用手触摸感
为什么有太阳照射时,金属制品的温度比空气温度高,感觉很烫手;没太阳照射时金属制品温度比空气温度低(比如冬天),用手触摸感觉很凉?
 小小笑话1年前6
小小笑话1年前6 -
 月海风吟 共回答了16个问题
月海风吟 共回答了16个问题 |采纳率75%金属比热容比空气低 吸收相同的热量温度比空气高 还有就是空气不能直接吸收阳光热量 只能间接吸收阳光照到地面的热量1年前查看全部
大家在问
- 1设f(x)在x=3的某个领域内有定义
- 2阅读《醉翁亭记》选段,回答问题。
- 3春夜喜雨第五六句诗集中写了什么?
- 4求基团-CN(氰基)的分子式~难道真的是-C-N?不是吧`````
- 54+3高聚物改性沥青防水卷材表示什么意思?
- 6分别将100g钠镁铝分别与100ml0.1mol/L的硫酸溶液反应,所生成气体的量哪个最多,
- 7一个数的30%加上这个数与1.2的积等于5.25,这个数是多少?用算术法!
- 8定义在R上的函数f(x)满足f(x)=f(x+2),当x∈[-3,-1]时,f(x)=1-|x+2|,则有( )
- 9我心中的森林城市 作文
- 10虽然你像个刺猬一样保护自己,怕受伤害,难以靠近,但是我愿意手捧着刺猬保护你。 翻译成英文
- 11经济利益关系用英语怎么说?
- 12关于电场线和电场强度,下列说法正确的是( )
- 13请教一个无限网络电阻的计算问题请先看图: 第一幅:无穷正四边形网络http://www.***.org/bbs/at
- 14数学infinite limit的题!
- 15求解一道高数题.y=xcosx+sinx的奇偶性.