热化学方程式要不要写反应条件
 glory12022-10-04 11:39:541条回答
glory12022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 爱丁堡的风 共回答了23个问题
爱丁堡的风 共回答了23个问题 |采纳率91.3%- 不用不过别忘了物态变化和热量
- 1年前
相关推荐
- 已知热化学方程式C2H2(g)+[5/2]O2(g)=2CO2(g)+H2O(g)△H=-1256kJ/mol,下列说法
已知热化学方程式C2H2(g)+[5/2]O2(g)=2CO2(g)+H2O(g)△H=-1256kJ/mol,下列说法正确的是( )
A.乙炔的燃烧热为1256 kJ/mol
B.若转移10 mol电子,则消耗2.5 mol O2
C.该反应在给定条件下是一个熵增焓减的反应
D.若形成4 mol碳氧共用电子对,则放出的热量为2512 kJ 青快乐女孩1年前1
青快乐女孩1年前1 -
 xue38 共回答了16个问题
xue38 共回答了16个问题 |采纳率100%解题思路:A.通常条件下,1mol乙炔完全燃烧生成二氧化碳气体与液态水放出的热量为乙炔的燃烧热;
B.反应中乙炔中O元素化合价由0价降低为-2价,根据电子守恒守恒计算氧气的物质的量;
C.该反应在给定条件下,生成气体的物质的量减少,是一个熵减的过程;
D.CO2分子中含有4对碳氧共用电子对,形成4 mol碳氧共用电子对生成1molCO2,结合热化学方程式判断.A.通常条件下,1mol乙炔完全燃烧生成二氧化碳气体与液态水放出的热量为乙炔的燃烧热,由于水蒸气的能量比液态水高,故乙炔的燃烧热应大于1256 kJ/mol,故A错误;
B.反应中乙炔中O元素化合价由0价降低为-2价,根据电子守恒守恒可知,氧气的物质的量=[10mol/4]=2.5mol,故B正确;
C.该反应为放热反应,是焓减过程,在给定条件下,该反应生成气体的物质的量减少,是一个熵减的过程,故C错误;
D.CO2分子中含有4对碳氧共用电子对,形成4 mol碳氧共用电子对生成1molCO2,结合热化学方程式可知,放出的热量为[1256kJ/2]=628kJ,故D错误,
故选B.点评:
本题考点: 有关反应热的计算.
考点点评: 本题考查燃烧热、对热化学方程式的理解及有关计算,难度不大,注意根据概念把握燃烧热含义,侧重对基础知识的巩固.1年前查看全部
- 热化学方程式前的系数必须化简吗?
 13紫川1年前3
13紫川1年前3 -
 豆苗稀777 共回答了20个问题
豆苗稀777 共回答了20个问题 |采纳率90%一般而言是允许化学方程式的系数为分数,只是习惯意义上都选用整数.至于热化学方程式,那是完全可以的.
例如:H2(g) + 1/2O2(g) == H2O(l) △H = -Q KJ/mol
另外,热化学方程式的反应条件不用写.1年前查看全部
- 1、根据热化学方程式(在101kPa时)∶ S(s) + O2(g) = SO2(g) ΔH = -297.23kJ/m
1、根据热化学方程式(在101kPa时)∶ S(s) + O2(g) = SO2(g) ΔH = -297.23kJ/mol
分析下列说法中正确的是
A.1mol S燃烧放出的热量为297.23kJ
B.S(g) + O2(g) = SO2(g) 放出的热量大于297.23kJ
C.S(s) + O2(g) = SO2(s) 放出的热量小于297.23kJ
D.形成1mol SO2的化学键释放的能量小于断裂1mol S(s) 和1mol O2(g) 的化学键所吸收的能量
2.已知H+(aq)+OH-(aq)=H2O(l);△H=-57.3 kJ/mol.若向三份等体积、等物质的量浓度的NaOH溶液中分别加入:①稀醋酸;②浓硫酸;③稀硝酸至恰好完全反应,并将上述过程中放出的热量分别记为Ql、Q2、Q3.下列关系式中正确的是
A.Q1<Q3<Q2 B.Ql<Q2<Q3 C.Q1<Q2=Q3 D.Q1=Q2=Q3
特别是第二题 岁月胡同1年前3
岁月胡同1年前3 -
 五哥_mm 共回答了21个问题
五哥_mm 共回答了21个问题 |采纳率81%B硫固体变为气体要吸热,S(g) + O2(g) = SO2(g) 放出的热量大于297.23kJ
C同理,S(s) + O2(g) = SO2(s) 放出的热量大于297.23kJ ,而不是小于
D、正因为本反应是方热反应,形成1mol SO2的化学键释放的能量小大于断裂1mol S(s) 和1mol O2(g) 的化学键所吸收的能量 ,而不是小于
A说得太笼统,连个限制条件都没有,错
B对
中和热的条件就是稀强酸与稀强碱.
①稀醋酸为弱酸,电离出氢离子时吸热,反应时放热自然少
②浓硫酸溶于水放热,放热就多
③稀硝酸等于中和热
A1年前查看全部
- 下列说法正确的是( ) A.热化学方程式中,若没有注明温度和压强,则表示反应热是在标准状况下测得的数据 B.升高温度或
下列说法正确的是( ) A.热化学方程式中,若没有注明温度和压强,则表示反应热是在标准状况下测得的数据 B.升高温度或加入催化剂,可以改变化学反应的反应热 C.根据能量守恒定律,反应物的总能量一定等于生成物的总能量 D.生成物的总焓大于反应物的总焓时,反应吸热,△H>0  哎哟5201年前1
哎哟5201年前1 -
 both 共回答了20个问题
both 共回答了20个问题 |采纳率90%A、热化学方程式,不注明温度和压强,表示通常状况下;故A错误;
B、升高温度,可以改变化学反应的反应热,加入催化剂改变反应速率不改变化学平衡,不改变反应热,故B错误;
C、根据能量守恒定律,反应不是吸热就是放热,反应物的总能量一定不等于生成物的总能量,故C错误;
D、生成物的总焓大于反应物的总焓时,反应吸热,△H>0,故D正确;
故选D.1年前查看全部
- 下列热化学方程式表达正确的是(△H的绝对值均正确)( )
下列热化学方程式表达正确的是(△H的绝对值均正确)( )
A.C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g)△H=-1367.0 kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)△H=+57.3kJ/mol(中和热)
C.S(s)+O2(g)=SO2(g)△H=-269.8kJ/mol(反应热)
D.2NO2=O2+2NO△H=+116.2kJ/mol(反应热) 徐人1年前1
徐人1年前1 -
 清逸短发 共回答了16个问题
清逸短发 共回答了16个问题 |采纳率93.8%解题思路:A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;
B、中和热是强酸强碱的稀溶液完全反应生成1mol水放出的热量;
C、热化学方程式是标注物质聚集状态,反应放出的热量;
D、热化学方程式是标注物质聚集状态,反应放出的热量.A、C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g)△H=-1367.0 kJ/mol(燃烧热)反应中生成的氧化物水是气体,不是稳定氧化物,故A错误;
B、NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ/mol(中和热),故B错误;
C、S(s)+O2(g)=SO2(g)△H=-269.8kJ/mol(反应热),符合热化学方程式的书写,故C正确;
D、2NO2=O2+2NO△H=+116.2kJ/mol(反应热),未标注物质聚集状态,故D错误;
故选C.点评:
本题考点: 热化学方程式.
考点点评: 本题考查了燃烧热、中和热、热化学方程式的书写方法和判断,关键是概念的理解,题目较简单.1年前查看全部
- 下列两组热化学方程式中,有关△ H 的比较正确的是( )
下列两组热化学方程式中,有关△ H 的比较正确的是()
① CH 4 g)+2O 2 (g) ====CO 2 (g)+2H 2 O(g);△ H 1
CH 4 g)+2O 2 (g) ====CO 2 (g)+2H 2 O(l);△ H 2
② NaOH(aq) +H 2 SO 4 (浓)="===" Na 2 SO 4 (aq) +H 2 O(l) ;△ H 3
NaOH(aq) + CH 3 COOH (aq)="===" CH 3 COONa (aq) +H 2 O(l) ;△ H 4A.△ H 1 >△ H 2 ;△ H 3 >△ H 4 B.△ H 1 >△ H 2 ;△ H 3 <△ H 4 C.△ H 1 =△ H 2 ;△ H 3 <△ H 4 D.△ H 1 <△ H 2 ;△ H 3 >△ H 4  chanel_xiao51年前1
chanel_xiao51年前1 -
 研磨时光 共回答了27个问题
研磨时光 共回答了27个问题 |采纳率81.5%B
(中难)本题考查有关燃烧热中和热的计算,由于H 2 O(g)H 2 O(l)要放出热量,所以等物质的量的CH 4 g)燃烧,生成液态水时放出热量的数值(绝对值)要比生成气态水时大。等物质的量的NaOH与稀醋酸、浓H 2 SO 4 恰好反应生成等物质的量的水,若不考虑物质的溶解热和弱电解质电离吸热,应放出相同的热量。但在实际反应中。浓H 2 SO 4 溶于水时放热,使其总放出的热量增多;醋酸是弱酸,部分CH 3 COOH分子电离过程中要吸热,故中和时放热较少。放热越多,△ H 的值的绝对值越大,△ H 实际值越小。
错点警示:反应热的比较是个难点,比较△ H 的大小最容易出错。对于吸热反应,△ H >0,吸热越多,△ H 越大;但对于放热反应,△ H <0,即△ H 为负值,放热越多,△ H 反而越小。物质的三态变化要影响反应热:固体吸热eq o(sup 0( EMBED PBrush 液体吸热eq o(sup 0( EMBED PBrush 气体。1年前查看全部
- 下列热化学方程式或离子方程式中,正确的是( ) A.在CH4、02和KOH溶液组成的燃料电池中,负极反应式为:CH 4
下列热化学方程式或离子方程式中,正确的是( ) A.在CH4、02和KOH溶液组成的燃料电池中,负极反应式为:CH 4 -8e - +10OH - =CO 3 2- +7H 2 O B.在5000C、30Mpa条件下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH 3 (g),放热19.3kJ,其热化学方程式为:
N 2 (g)+3H 2 (g)
2NH 3 (g);△H=-38.6kJ/molC.乙烯的燃烧热为akJ/mol(a>0),则乙烯燃烧的热化学方程式可表示为:C 2 H 4 (g)+3O 2 (g)=2CO 2 (g)+2H 2 O(g););△H=-akJ/mol D.向苯酚钠(C6H5ONa)溶液中通入少量二氧化碳:C 6 H 5 O - +CO 2 +H 2 O→2C 6 H 5 OH+CO 3 2-  风影30001年前1
风影30001年前1 -
 印江新寨 共回答了22个问题
印江新寨 共回答了22个问题 |采纳率90.9%A、原电池负极发生氧化反应,甲烷在负极放电,在碱性条件下生成碳酸根离子与水,电极反应式为CH 4 -8e - +10OH - =CO 3 2- +7H 2 O,故A正确;B、0.5molN 2 和1.5molH 2 置于密闭容器中充分反应生成NH 3 (g)...1年前查看全部
- 在一定条件下,CH4 和CO的燃烧的热化学方程式分别为:
在一定条件下,CH4 和CO的燃烧的热化学方程式分别为:
CH4(g)+ 2O2(g )=2H2O(l)+ CO2(g) △H=-890 kJ/mol
2CO(g)+ O2(g )=2CO2(g)△H=-566 kJ/mol
一定量的CH4和CO的混合气体完全燃烧时,放出的热量为262.9 kJ,生成的CO2用过量的饱和石灰水完全吸收,可得到50 g白色沉淀.求混合气体中CH4 和CO的体积比. 欣笔1年前1
欣笔1年前1 -
 柳子慕雪 共回答了23个问题
柳子慕雪 共回答了23个问题 |采纳率91.3%设有CH4 X mol ,CO y mol .
由放出的热量得 890x+(566/2)y=262.9
有生成0.5mol CACO3知共含C 0.5mol
得 x+y=0.5
解得x=0.2 y=0.31年前查看全部
- 一道热化学方程式题,已知:C(S)+O2(G)=CO2(G) ►H=-393.5KJ/MOL H2(g)+0.5O2(g
一道热化学方程式题,
已知:C(S)+O2(G)=CO2(G) ►H=-393.5KJ/MOL H2(g)+0.5O2(g)=H2O(l) ►H=-241.8KJ/MOL
欲得到相同的热量,须分别燃烧固体碳和氢的质量比约为()
A2:3.25 B12:3.25 C1:1 D393.5:241.8 羽爵1年前2
羽爵1年前2 -
 Α_α 共回答了17个问题
Α_α 共回答了17个问题 |采纳率94.1%让焓变相同就行了 -393.5/(-241.8)=1.627 1.627*2=3.25(g) 碳的质量为12g,那就选B1年前查看全部
- 热化学方程式与燃烧热化学方程式有什么不一样
 zhang_hao1年前3
zhang_hao1年前3 -
 71年出生 共回答了19个问题
71年出生 共回答了19个问题 |采纳率94.7%热化学方程式表示反应过程能量变化的反应方程式,燃烧热表示1mol可燃物完全燃烧生成稳定的化合物的能量变化,是热化学方程式中的一种,只是强调1mol可燃物,而且生成稳定的化合物.1年前查看全部
- 机智的小伙伴们,请问热化学方程式要写条件吗?
 冰欺凌1年前7
冰欺凌1年前7 -
 O5O5O5 共回答了21个问题
O5O5O5 共回答了21个问题 |采纳率38.1%要1年前查看全部
- 下列各反应均为放热反应,同温同压下下列各热化学方程式中△H最小的是( )
下列各反应均为放热反应,同温同压下下列各热化学方程式中△H最小的是( )
A.2A(l)+B (l)═2C(g)△H1
B.2A(g)+B (g)═2C(g)△H2
C.2A(g)+B ( g )═2C(l)△H3
D.2A(l)+B (l)═2C(l)△H4 航灯1年前1
航灯1年前1 -
 帘外春风 共回答了24个问题
帘外春风 共回答了24个问题 |采纳率87.5%解题思路:反应物的总能量高于生成物的总能量,为放热反应,反应热符号为“-”,反应物的总能量越高,生成物的总能量越低,反应放出的热量越多,反应热越小,结合物质的状态进行判断,同一物质的能量g>l>s.各反应中对应物质的物质的量相同,同一物质的能量g>l>s,所以反应物的总能量为:B=C>A=D,生成物的能量为:A=B>C=D,反应为放热反应,反应物的总能量越高,生成物的总能量越低,反应放出的热量越多,故C放出的热量最多,反应热符号为“-”,反应放出的热量越多,反应热越小,故C的反应热最小,
故选C.点评:
本题考点: 热化学方程式.
考点点评: 本题考查物质能量、物质状态与反应热的关系,难度不大,注意根据能量守恒理解物质能量与反应热关系,注意反应热比较包含符号进行比较.1年前查看全部
- 在同温、同压下,下列各组热化学方程式中,△H1>△H2的是( )
在同温、同压下,下列各组热化学方程式中,△H1>△H2的是( )
A. 2H2(g)+O2(g)═2H2O(g)△H12H2(g)+O2(g)═2H2O(l)△H2
B. S(g)+O2(g)═SO2(g)△H1S(s)+O2(g)═SO2(g)△H2
C. C(s)+1/2O2(g)═CO(g)△H1C(s)+O2(g)═CO2(g)△H2
D. H2(g)+Cl2(g)═2HCl(g)△H1[1/2]H2(g)+[1/2]Cl2(g)═HCl(g)△H2 xiazhujun1年前1
xiazhujun1年前1 -
 祝梁 共回答了23个问题
祝梁 共回答了23个问题 |采纳率95.7%解题思路:A、液态水变为气态水的过程是吸热过程;
B、固体硫变为气态硫需要吸收热量;
C、碳单质完全燃烧放热多于不完全燃烧放的热.
D、化学反应方程式的系数加倍,焓变数值加倍.A、物质的燃烧反应是放热的,焓变是负值,气态水变为液态水的过程是放热的,故△H1>△H2,故A正确;
B、物质的燃烧反应是放热的,所以焓变是负值,固体硫变为气态硫需要吸收热量,所以△H1<△H2,故B错误;
C、碳单质完全燃烧生成二氧化碳放热多于不完全燃烧生成一氧化碳放的热,反映的焓变是负值,故△H1>△H2,故C正确;
D、化学反应方程式的系数加倍,焓变数值加倍,该化合反应是放热的,所以焓变值是负值,△H1=2△H2,△H1<△H2,故D错误;
故选:AC.点评:
本题考点: 反应热的大小比较.
考点点评: 本题考查了物质反应能量变化分析判断,主要是盖斯定律的应用,物质量不同、状态不同、产物不同,反应的能量变化不同,题目较简单.1年前查看全部
- H2还原NO生成水蒸汽的热化学方程式 对系数有要求吗
 情感在那1年前1
情感在那1年前1 -
 zhoushi8213 共回答了13个问题
zhoushi8213 共回答了13个问题 |采纳率84.6%有要求的
2H2(g)+2NO(g)===N2(g)+2H2O(g)+Q1年前查看全部
- 已知下列两个热化学方程式2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol;C3H8(g)+5O2(
已知下列两个热化学方程式2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol;C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2220.0kJ/mol;实验测得,5mol氢气和丙烷的混合气体完全燃烧时放热3847kJ,则混合气体中氢气与丙烷的体积比是( )
A.1:3
B.3:1
C.1:4
D.1:1 hnmytz11年前1
hnmytz11年前1 -
 3ad4who 共回答了18个问题
3ad4who 共回答了18个问题 |采纳率66.7%解题思路:先根据方程式求出H2和C3H8的燃烧热,设H2的物质的量为nmol,则C3H8的物质的量为5mol-n,根据放出的热量列方程式解答.设混合气中H2的物质的量为n,则C3H8的物质的量为5mol-n.根据题意,列方程为:
285.8kJ/mol×n+2220.0kJ/mol×(5mol-n)=3847kJ
解得 n=3.75mol;C3H8的物质的量为5mol-3.75mol=1.25mol.
所以混合气体中H2与C3H8的体积比即物质的量之比为3.75 mol:1.25 mol=3:1.
故选:B.点评:
本题考点: 有关反应热的计算.
考点点评: 以常规方法进行计算求解,思路直接,便于理解,但是由于一般需要列方程,步骤烦琐,计算量较大,因此可以选用十字交叉法,比较方便.1年前查看全部
- 已知氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(I) △H=-571.6kj/mo
已知氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(I) △H=-571.6kj/mo
试比较相同质量的H2和C3H8燃烧,产生的热量的比值约为 zwzwlf1年前0
zwzwlf1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 下列热化学方程式中,正确的是( ) A.甲烷的燃烧热ΔH为-890.3 kJ·mol -1 ,则甲烷燃烧的热化学方程式
下列热化学方程式中,正确的是( )
2Hg(l)+O 2 (g)A.甲烷的燃烧热ΔH为-890.3 kJ·mol -1 ,则甲烷燃烧的热化学方程式可表示为:CH 4 (g)+2O 2 (g)  CO 2 (g)+2H 2 O(g) ΔH="-890.3" kJ·mol -1
CO 2 (g)+2H 2 O(g) ΔH="-890.3" kJ·mol -1 B.含20.0 g的NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ 的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH 3 COOH(aq)  CH 3 COONa(aq)+H 2 O(l) ΔH="-57.4" kJ·mol -1
CH 3 COONa(aq)+H 2 O(l) ΔH="-57.4" kJ·mol -1 
C.上图是298 K、101 Pa时CO和H 2 合成CH 3 OH(g)的反应过程中能量变化的曲线图,则该反应的热化学方程式为:CO(g)+2H 2 (g)  CH 3 OH(g) ΔH="+91" kJ·mol -1
CH 3 OH(g) ΔH="+91" kJ·mol -1 D.已知:2Zn(s)+O 2 (g)  2ZnO(s) ΔH="-701.0" kJ/mol
2ZnO(s) ΔH="-701.0" kJ/mol 2HgO(s) ΔH="-181.6" kJ/mol
2HgO(s) ΔH="-181.6" kJ/mol
则Zn(s)+HgO(s) ZnO(s)+Hg(l) ΔH="-259.7" kJ·mol -1
ZnO(s)+Hg(l) ΔH="-259.7" kJ·mol -1  爬爬世界1年前1
爬爬世界1年前1 -
 映朝阳 共回答了27个问题
映朝阳 共回答了27个问题 |采纳率92.6%D
燃烧热是在一定条件下,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,水的稳定状态为液态,选项A不正确;醋酸是弱电解质,存在电离平衡,而电离是吸热的,所以选项B不正确;根据图像可知,反应物的总能量高于生成物的总能量,反应是放热反应,ΔH应小于0,选项C不正确;根据盖斯定律可知,选项D正确。1年前查看全部
- 化学反应可以讲一摩尔?热化学方程式焓变为什么单位是kj/mol,难道方程式还可以讲1mol反应?
 无花瓶1年前3
无花瓶1年前3 -
 小小虾米123 共回答了25个问题
小小虾米123 共回答了25个问题 |采纳率84%反应是不能用摩尔来度量的,这里的1摩尔是指反应物的量,热化学方程式中的焓变是指1摩尔某反应物发生该反应所产生的热效应,比较热效应需要反应物的物质的量相同,就如同比较密度可以比较一定体积的两种物质的质量1年前查看全部
- 白磷转化为红磷的热化学方程式燃烧3.1克白磷(P4)放出的热量比燃烧3.1克的红磷(P)多1.839千焦,则白磷转化为红
白磷转化为红磷的热化学方程式
燃烧3.1克白磷(P4)放出的热量比燃烧3.1克的红磷(P)多1.839千焦,则白磷转化为红林的热化学方程式为____________相同温度下,能量状态低的是______ hh本无奈1年前1
hh本无奈1年前1 -
 luanqinrong 共回答了10个问题
luanqinrong 共回答了10个问题 |采纳率100%P4(s)→4P(s)+18.39KJ 反应条件不用写
红磷的能量状态低1年前查看全部
- 已知热化学方程式 C(g)+O2(g)=CO2(g); △H=-393.5kJ/mol H2(g)+1/2O2(g)=h
已知热化学方程式 C(g)+O2(g)=CO2(g); △H=-393.5kJ/mol H2(g)+1/2O2(g)=h2o(g); △H=-28.58kJ/mol
试通过计算说明等质量的氢气和碳燃烧时产生热量的比 分众天下1年前2
分众天下1年前2 -
 mitang662000mita 共回答了15个问题
mitang662000mita 共回答了15个问题 |采纳率93.3%12g碳产生的热量是393.5KJ
2g氢气产生的热量是28.58KJ
那么等质量的热量比就是393.5/12:28.58/2
答案就自己算吧1年前查看全部
- 求甲醇完全燃烧的热化学方程式~~~~~~~~~~~~~~~~
 Iris10181年前2
Iris10181年前2 -
 清y玉 共回答了19个问题
清y玉 共回答了19个问题 |采纳率89.5%2CH3OH(l)+3O2(g)----->2CO2(g)+4H2O(g) ΔH=-137.2KJ/mol1年前查看全部
- 下列各组热化学方程式中,化学反应的△H前者大于后者的是( )
下列各组热化学方程式中,化学反应的△H前者大于后者的是( )
①C(s)+O 2 (g)═CO 2 (g);△H 1 C(s)+
O 2 (g)═CO(g);△H 21 2
②S(s)+O 2 (g)═SO 2 (g);△H 3 S(g)+O 2 (g)═SO 2 (g);△H 4
③H 2 (g)+
O 2 (g)═H 2 O(l);△H 5 2H 2 (g)+O 2 (g)═2H 2 O(l);△H 61 2
④CaCO 3 (s)═CaO(s)+CO 2 (g);△H 7 CaO(s)+H 2 O(l)═Ca(OH) 2 (s);△H 8 .A.① B.④ C.②③④ D.①②③  神神小梯子1年前1
神神小梯子1年前1 -
 _杨德记 共回答了13个问题
_杨德记 共回答了13个问题 |采纳率100%①都为放热反应,△H<0,前者完全反应,放出的热量多,则△H 1 <△H 2 ,故①错误;
②都为放热反应,△H<0,由于S(s)→S(g)吸热,则前者放出的热量少,则△H 3 >△H 4 ,故②正确;
③都为放热反应,△H<0,消耗的氢气越多,则放出的热量越多,则△H 5 >△H 6 ,故③正确;
④前者为吸热反应,△H 7 >0,后者为放热反应,△H 8 <0,则△H 7 >△H 8 ,故④正确.
故选C.1年前查看全部
- 能源是人类生存和发展的重要支柱,研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义,已知下列热化学方程式 ①
能源是人类生存和发展的重要支柱,研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义,已知下列热化学方程式
① H2(g)+O2(g)═H2O(g)△H═-242kJ/mol; ② 2H2(g)+O2(g)═2H2O(l)△H═-572kJ/mol; ③ C(s)+O2(g)═CO(g)△H═-110.5kJ/moL; ④ C(s)+O2(g)═CO2(g)△H═-393.5kJ/moL; ⑤ CO2(g)+2H2O(g)═CH4(g)+2O2(g)△H═+802kJ/moL
回答下列问题化学键 O=O C-C H-H O-O C-O O-H C-H 键能kJ/mol 497 348 436 142 351 463 414
(1)写出能表示H2燃烧热的热化学方程式H2(g)+[1/2]O2(g)═H2O(l)△H═-286kJ/molH2(g)+[1/2]O2(g)═H2O(l)△H═-286kJ/mol.
(2)已知C(s)+H2O(g)⇌H2(g)+CO(g)△H═______ kJ/moL;
(3)估算出C=O键能为______kJ/moL;
(4)CH4的燃烧热△H=-______ kJ/moL;
(5)25℃、101kPa下,某燃具中CH4的燃烧效率是90%(注:相当于10%的CH4未燃烧),水壶的热量利用率是70%,则用此燃具和水壶,烧开1L水所需要的CH4的物质的量为______mol[保留到小数点后2位;已知:c (H2O)═4.2J/(g•℃)]. jetkafi1年前1
jetkafi1年前1 -
 xuemei0525 共回答了20个问题
xuemei0525 共回答了20个问题 |采纳率90%解题思路:(1)依据燃烧热概念是1mol可燃物完全燃烧生成稳定氧化物的过程中放出的热量分析书写;
(2)依据热化学方程式①③结合盖斯定律计算得到所需热化学方程式;
(3)依据反应⑤的反应焓变,结合焓变=反应物键能总和-生成物键能总和;
(4)燃烧热概念是1mol可燃物完全燃烧生成稳定氧化物的过程中放出的热量,结合①②⑤热化学方程式和盖斯定律计算;
(5)根据题意求出的甲烷燃烧热计算CH4的燃烧效率是90%(注:相当于10%的CH4未燃烧),水壶的热量利用率是70%时放出的热量,再根据水烧开需要的热量计算需要甲烷的物质的量.(1)燃烧热概念是1mol可燃物完全燃烧生成稳定氧化物的过程中放出的热量,表示H2燃烧热的热化学方程式H2(g)+[1/2]O2(g)═H2O(l)△H═-286kJ/mol;
故答案为:H2(g)+[1/2]O2(g)═H2O(l)△H═-286kJ/mol;
(2)①H2(g)+O2(g)═H2O(g)△H═-242kJ/mol;③C(s)+O2(g)═CO(g)△H═-110.5kJ/moL;
依据热化学方程式结合盖斯定律计算③-①C(s)+H2O(g)⇌H2(g)+CO(g)△H═+131.5kJ/moL
故答案为:+131.5;
(3)CO2(g)+2H2O(g)═CH4(g)+2O2(g)△H═+802kJ/moL,设C=O键能为x,
反应焓变△H=反应物键能总和-生成物键能总和=2x+2×2×463KJ/mol-(4×414KJ/mol+2×497KJ/mol)=802KJ/mol
x=800KJ/mol;
故答案为:800;
(4)①H2(g)+[1/2]O2(g)═H2O(g)△H═-242kJ/mol;
②2H2(g)+O2(g)═2H2O(l)△H═-572kJ/mol;
③CO2(g)+2H2O(g)═CH4(g)+2O2(g)△H═+802kJ/moL
[①×2-②]-③,CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H═890KJ/mol;
故答案为:890;
(5)25℃、101kPa下,某燃具中CH4的燃烧效率是90%(注:相当于10%的CH4未燃烧),水壶的热量利用率是70%,则用此燃具和水壶,烧开1L水所需要的CH4的物质的量设为x,依据甲烷的燃烧热CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H═890KJ/mol,计算得到:
90%×890KJ/mol×70%=1000g×4.2×10-3KJ/g•℃×(100-25)℃×x
x=0.56
故答案为:0.56.点评:
本题考点: 热化学方程式;有关反应热的计算;反应热和焓变.
考点点评: 本题考查了热化学方程式书写方法和盖斯定律计算应用,键能和焓变的计算关系应用,水的热容计算判断,掌握基础是关键,题目难度中等.1年前查看全部
- 已知下列热化学方程式:Zn(s)+ O 2 (g)=ZnO(s) ΔH 1 =-351.1 kJ·mol -1 Hg(
已知下列热化学方程式:
Zn(s)+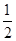 O 2 (g)=ZnO(s) ΔH 1 =-351.1 kJ·mol -1
O 2 (g)=ZnO(s) ΔH 1 =-351.1 kJ·mol -1
Hg(l)+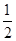 O 2 (g)=HgO(s) ΔH 2 =-90.7 kJ·mol -1
O 2 (g)=HgO(s) ΔH 2 =-90.7 kJ·mol -1
由此可知Zn(s)+HgO(s)=ZnO(s)+Hg(l) ΔH 3 ,其中ΔH 3 的值是 ( )A.-441.8 kJ·mol -1 B.-254.6 kJ·mol -1 C.-438.9 kJ·mol -1 D.-260.4 kJ·mol -1  ducklin1年前1
ducklin1年前1 -
 51天天 共回答了12个问题
51天天 共回答了12个问题 |采纳率91.7%D
1年前查看全部
- 1 g氢气在氧气中燃烧生成液态水,放出142.9 kJ热量,表示该反应的热化学方程式的是 [
1 g氢气在氧气中燃烧生成液态水,放出142.9 kJ热量,表示该反应的热化学方程式的是 [ ]
A.H 2 (g)+1/2O 2 (g)=H 2 O(l) ΔH=-285.8 kJ/mol
B.H 2 (g)+1/2O 2 (g)=H 2 O(g) ΔH=-285.8 kJ/mol
C.2H 2 (g)+O 2 (g)=2H 2 O(l) ΔH=-285.8 kJ/mol
D.H 2 (g)+1/2O 2 (g)=H 2 O ΔH=-285.8 kJ/mol 发狂的绵羊1年前1
发狂的绵羊1年前1 -
 lazakanf 共回答了15个问题
lazakanf 共回答了15个问题 |采纳率86.7%A1年前查看全部
- 已知下列两个热化学方程式:2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ•mol-1
已知下列两个热化学方程式:2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ•mol-1
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l);△H=-2220kJ•mol-1
根据上面两个热化学方程式,试回答下列问题:
(1)H2的燃烧热为______,C3H8的燃烧热为______.
(2)1mol H2和2mol C3H8组成的混合气体完全燃烧释放的热量为______.
(3)现有H2和C3H8的混合气体共5mol,完全燃烧时放热3847kJ,则在混合气体中H2和C3H8的体积比是______. 迷雾森林者1年前1
迷雾森林者1年前1 -
 没良心的医生 共回答了19个问题
没良心的医生 共回答了19个问题 |采纳率94.7%(1)因燃烧热在某一温度和压强下lmol某物质B完全燃烧生成稳定化合物时所释放出的热量,所以H2的燃烧热为285.8kJ•mol-1,C3H8的燃烧热为2220kJ•mol-1,
故答案为:285.8kJ•mol-1;2220kJ•mol-1;
(2)1mol H2和2mol C3H8组成的混合气体完全燃烧释放的热量为1mol×285.8kJ•mol-1+2mol×2220kJ•mol-1=4725.8kJ,故答案为:4725.8kJ;
(3)设混合气中H2的物质的量为x,则C3H8的物质的量为5mol-x.根据题意,列方程为:
285.8kJ/mol×x+2220.0kJ/mol×(5mol-x)=3847kJ
解得 x=3.75 mol;C3H8的物质的量为5mol-3.75mol=1.25mol.
所以混合气体中H2与C3H8的体积比即物质的量之比为3:1,故答案为:3:1.1年前查看全部
- 为什么热化学方程式中的化学计量数与△H成正比
为什么热化学方程式中的化学计量数与△H成正比
假如一个反应是放热反应,计量数越大,△H不是越小吗,这种情况下应该成反比啊
 yoke1191年前1
yoke1191年前1 -
 hnyclzp 共回答了17个问题
hnyclzp 共回答了17个问题 |采纳率94.1%我问你啊,y=kx裏面假设k是负数,那也就是随著x增大y减小,那是反比么?1年前查看全部
- 下列热化学方程式或离子方程式中,正确的是 [ ] A.25℃,101KP
下列热化学方程式或离子方程式中,正确的是 [ ]A.25℃,101KPa时,甲烷的燃烧热为890.3kJ·mol -1 ,则甲烷燃烧的热化学方程式可表示为:
CH 4 (g)+2O 2 (g)=CO 2 (g)+2H 2 O(l) △H=-890.3kJ·mol -1
B.500℃、30MPa下,将0.5mol N 2 和1.5molH 2 置于密闭的容器中充分反应生成NH 3 (g),放热19.3kJ,其热化学方程式为: △H=-38.6kJ·mol -1
△H=-38.6kJ·mol -1
C.氯化镁溶液与氨水反应:
D.100mL0.01mol/L稀NaOH溶液与100mL0.01mol/L稀醋酸反应,热化学方程式可表示为:
NaOH(aq)+CH 3 COOH(aq)=NaOOCCH 3 (aq)+H 2 O(l);△H=-57.3kJ/mol 蔚的天空1年前1
蔚的天空1年前1 -
 diasey 共回答了13个问题
diasey 共回答了13个问题 |采纳率92.3%A1年前查看全部
- 氧气(O2)和臭氧(O3)是氧元素的两种同素异形体,已知热化学方程式:4Al(s)+3O2(g)=2Al2O3(s)△H
氧气(O2)和臭氧(O3)是氧元素的两种同素异形体,已知热化学方程式:4Al(s)+3O2(g)=2Al2O3(s)△H1,4Al(s)+2O3(g)=2Al2O3(s)△H2 ,3O2(g)=2O3(g)△H3 则( )
A.△H2-△H1=△H3
B.△H1+△H2=△H3
C.△H1-△H2=△H3
D.△H2+△H1+△H3=0 瑞峰19771年前1
瑞峰19771年前1 -
 郑甦鸿 共回答了21个问题
郑甦鸿 共回答了21个问题 |采纳率90.5%解题思路:①4Al(s)+3O2(g)=2Al2O3(s)△H1,②4Al(s)+2O3(g)=2Al2O3(s)△H2 ,根据盖斯定律可知,反应①-②可得3O2(g)=2O3(g),以此来解答.①4Al(s)+3O2(g)=2Al2O3(s)△H1,
②4Al(s)+2O3(g)=2Al2O3(s)△H2 ,
根据盖斯定律可知,反应①-②可得3O2(g)=2O3(g),
所以△H3 =△H1-△H2,
故选C.点评:
本题考点: 用盖斯定律进行有关反应热的计算.
考点点评: 本题考查盖斯定律计算反应热,明确已知反应与目标反应的关系是解答本题的关键,题目较简单.1年前查看全部
- 标准状态下,热化学方程式中要标明温度和压强吗?Zn(s)+h2so4(aq)==znso4(aq)+h2(g) △H的值
标准状态下,热化学方程式中要标明温度和压强吗?Zn(s)+h2so4(aq)==znso4(aq)+h2(g) △H的值与反应物的用量无关,答案说是对的 why?
 偶就是某人的ee1年前4
偶就是某人的ee1年前4 -
 老黄猫 共回答了19个问题
老黄猫 共回答了19个问题 |采纳率89.5%既然是标准状态就不用标温度和压强.ΔH数值跟方程式的化学计量数相对应(如果在这个方程式的化学计量数前都加上二分之一,那么△H相应的也要乘以二分之一).而与反应物的用量无关.1年前查看全部
- 已知标准状况下,1lh2s气体完全燃烧生成液态水时放出akj的热量,写出硫化氢燃烧热的热化学方程式
 tt的羚羊1年前2
tt的羚羊1年前2 -
 咏真 共回答了27个问题
咏真 共回答了27个问题 |采纳率92.6%H2S(q)+3/2O2(q)=H2O(l)+SO2(q) ;ΔH=— 22.4a kJ/mol1年前查看全部
- 已知热化学方程式 C(g)+O2(g)=CO2(g); △H=-393.5kJ/mol H2(g)+1/2O2(g)=h
已知热化学方程式 C(g)+O2(g)=CO2(g); △H=-393.5kJ/mol H2(g)+1/2O2(g)=h2o(g); △H=-28.58kJ/mol
欲得到相同的热量,需分别燃烧固体碳和氢气的质量比为 cold-mountain1年前2
cold-mountain1年前2 -
 babaa 共回答了19个问题
babaa 共回答了19个问题 |采纳率78.9%H2(g)+1/2O2(g)=h2o(g); △H=-285.8kJ/mol
n(C)x393.5=n(H2)x285.8
n(c)/n(H2)=285.8/393.5
m(c)/m(H2)=285.8x12/393.5x2=4.36:11年前查看全部
- 氧化钙与水反应的热化学方程式
 夏子0011年前4
夏子0011年前4 -
 yuzhou1975 共回答了18个问题
yuzhou1975 共回答了18个问题 |采纳率100%热化学方程式?
CaO + H2O = Ca(OH)2 △H=-57.86kj/mol1年前查看全部
- 下列说法中错误的是( )A.在热化学方程式中无论反应物还是生成物必须标明聚集状态B.热化学方程式的化学计量数不能表示分
下列说法中错误的是( )
A.在热化学方程式中无论反应物还是生成物必须标明聚集状态
B.热化学方程式的化学计量数不能表示分子的个数
C.反应热指的是反应过程中放出的热量
D.所有的化学反应都伴随着能量的变化 蚊子飞飞1年前1
蚊子飞飞1年前1 -
 林天雨 共回答了14个问题
林天雨 共回答了14个问题 |采纳率92.9%解题思路:A、物质的聚集状态和反应能量变化有关,需要标注物质聚集状态;
B、热化学方程式中计量数只表示物质的量不能表示微粒数,所以可以用分数表示;
C、反应热是反应过程中吸收或放出的能量;
D、化学反应的实质是断裂旧化学键,形成新的化学键的过程,一定伴随能量变化.A、物质的聚集状态和反应能量变化有关,需要标注物质聚集状态,在热化学方程式中无论反应物还是生成物必须标明聚集状态,故A正确;
B、热化学方程式中计量数只表示物质的量不能表示微粒数,不能表示分子的个数,所以可以用分数表示,故B正确;
C、反应热是反应过程中吸收或放出的热量,故C错误;
D、化学反应的实质是断裂旧化学键,形成新的化学键的过程,一定伴随能量变化,所有的化学反应都伴随着能量的变化,故D正确;
故选C.点评:
本题考点: 热化学方程式;反应热和焓变.
考点点评: 本题考查了化学反应能量变化,反应焓变理解,热化学方程式的书写方法,掌握基础是关键,题目较简单.1年前查看全部
- 下列表述中正确的是( ) A.任何能使熵值增大的过程都能在常温下自发进行 B.已知热化学方程式2SO 2 (g)+O
下列表述中正确的是( ) A.任何能使熵值增大的过程都能在常温下自发进行 B.已知热化学方程式2SO 2 (g)+O 2 (g)⇌2SO 3 (g)△H=-QkJ•mol -1 (Q>0),则将2molSO 2 (g)和1molO 2 (g)置于一密闭容器中充分反应后放出QkJ的热量 C.化学平衡发生移动,平衡常数一定发生变化 D.等质量的硫蒸气和硫固体分别完全燃烧,前者放出热量多  isseymiyake81741年前1
isseymiyake81741年前1 -
 双面的人 共回答了16个问题
双面的人 共回答了16个问题 |采纳率100%A.使熵值增大的过程常温下不一定能进行,如水的分解,故A错误;
B.反应为可逆反应,不能完全反应,放出的热量小于Q kJ,故B错误;
C.化学平衡常数只受温度的影响,如温度不变,则平衡常数不变,故C错误;
D.气体变为固体放出热量,则等质量的硫蒸气和硫固体分别完全燃烧,前者放出热量多,故D正确.
故选D.1年前查看全部
- 下列热化学方程式或离子方程式中,正确的是( )
下列热化学方程式或离子方程式中,正确的是( )
A.甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1催化剂450℃、1MPa
B.450℃、1MPa下,将1mol SO2和0.5molO2置于密闭的容器中充分反应生成SO3(g),放热98.5kJ,其热化学方程式为:2SO2+O2(g)⇌2 SO3(g)△H=-98.5kJ•mol-1
C.氯化镁溶液与氨水反应:Mg2++2OH-=Mg(OH)2↓
D.用FeCl3溶液腐蚀铜箔:Cu+2Fe3+═2Fe2++Cu2+ 赫米1年前1
赫米1年前1 -
 coloneltao 共回答了12个问题
coloneltao 共回答了12个问题 |采纳率100%解题思路:A.燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量;
B.二氧化硫与氧气反应为可逆反应,结合热化学方程式的意义;
C.一水合氨为弱电解质,应保留化学式;
D.三氯化铁与铜反应生成氯化亚铁和氯化铜.A.水的状态为气态,产物为不是稳定氧化物,△H不代表燃烧热,故A错误;
B.1molSO2与0.5molO2完全,放出热量98.32kJ,而2SO2+O2(g)⇌2 SO3(g)△H=-98.5kJ•mol-1表示2mol二氧化硫与1mol氧气完全反应生成2mol三氧化硫放出热量为98.32kJ,故B错误;
C.氯化镁溶液与氨水反应,离子方程式:Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+,故C错误;
D.用FeCl3溶液腐蚀铜箔,离子方程式:Cu+2Fe3+═2Fe2++Cu2+,故D正确;
故选:D.点评:
本题考点: 燃烧热;离子方程式的书写;热化学方程式;金属的电化学腐蚀与防护.
考点点评: 本题为综合题,考查了燃烧热的定义、热化学方程式的意义、离子方程式的书写,明确燃烧热概念的内涵与外延、反应的实质是解题关键,题目难度不大.1年前查看全部
- 下列有关热化学方程式及其叙述正确的是 A.氢气的燃烧热为-285.5kJ/mo1,则水电解的热化学方程式为:
下列有关热化学方程式及其叙述正确的是
A.氢气的燃烧热为-285.5kJ/mo1,则水电解的热化学方程式为:
2H 2 O(1) =2H 2 (g)+O 2 (g);△H=+285.5KJ/mo1B.1mol甲烷完全燃烧生成CO 2 和H 2 O(1)时放出890kJ热量,它的热化学方程式为
1/2CH 4 (g)+O 2 (g)= 1/2CO 2 (g)+H 2 O(1);△H= 一445kJ/molC.已知2C(s)+O 2 (g)=2CO(g);△H= 一221kJ·mol -1 ,则C的燃烧热为一110.5kJ/mo1 D.HF与NaOH溶液反应:H + (aq)+OH — (aq)=H 2 O(1);△H= 一57.3kJ/mol  wangbindq1年前1
wangbindq1年前1 -
 ihihllby 共回答了12个问题
ihihllby 共回答了12个问题 |采纳率91.7%B
1年前查看全部
- 100 g C不完全燃烧产生1/3体积的CO和2/3体积的CO2,已知热化学方程式:
100 g C不完全燃烧产生1/3体积的CO和2/3体积的CO2,已知热化学方程式:
C(s)+ 1/2O2(g)= CO(g) △H = -110.35 KJ·mol—1
CO(g)+ 1/2O2(g)= CO2(g) △H = -282.5 KJ·mol—1
与等量碳完全燃烧相比,上述燃烧损失的热量为( )
A.392.9 KJ B.2489.44 KJ C.784.72 KJ D.327.43 KJ
求的是什么?没看懂题 han5221年前2
han5221年前2 -
 蓝逸520 共回答了19个问题
蓝逸520 共回答了19个问题 |采纳率68.4%求的是:33.33 g C 不完全燃烧得到的CO继续燃烧时可以获得的热量.1年前查看全部
- 已知下列两个热化学方程式2H 2 (g)+O 2 (g)=2H 2 O(1) △H=-571.6 kJ/mol
已知下列两个热化学方程式2H 2 (g)+O 2 (g)=2H 2 O(1) △H=-571.6 kJ/mol
C 3 H 8 (g)+5O 2 (g)=3CO 2 (g)+4H 2 O(1) △H=-2220.0 kJ/mol 实验测得,5mol氢气和丙烷的混合气体完全燃烧时放热3847kJ,则混合气体中氢气与丙烷的体积比是[ ]A.1:3
B.3:1
C.1:4
D.1:1 清雅淡泊1年前1
清雅淡泊1年前1 -
 QQ42126119 共回答了24个问题
QQ42126119 共回答了24个问题 |采纳率91.7%B1年前查看全部
- 已知下列两个热化学方程式:2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/molC3H8(g)+5O2(
已知下列两个热化学方程式:
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol
C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2220kJ/mol
根据上面两个热化学方程式,试完成下列各题:
(1)H2的燃烧热为______.
(2)1mol H2和2mol C3H8组成的混合气体完全燃烧释放的热量为______KJ. waq_12105294131年前1
waq_12105294131年前1 -
 smao1979 共回答了31个问题
smao1979 共回答了31个问题 |采纳率96.8%解题思路:(1)燃烧热是1mol可燃物完全燃烧生成稳定的氧化物放出的热量;
(2)先根据方程式求出H2和C3H8的燃烧热,然后根据物质的量、燃烧热、热量三者之间的关系求解.(1)燃烧热是1mol可燃物完全燃烧生成稳定的氧化物放出的热量,2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol,所以1mol氢气完全燃烧生成液态水放出的热量为285.8kJ,则氢气的燃烧热为285.8kJ/mol,
故答案为:285.8kJ/mol;
(2)已知氢气和丙烷燃烧热分别为:285.8kJ/mol、2220kJ/mol,
所以1mol 氢气和2mol丙烷的混合气完全燃烧时放热为285.8kJ/mol×1mol+2220kJ/mol×2=4725.8kJ,
故答案为:4725.8.点评:
本题考点: 反应热和焓变.
考点点评: 本题主要考查了热量的计算,抓住物质的量、燃烧热、热量三者之间的关系是解题的关键,题目难度不大.1年前查看全部
- 已知下列热化学方程式:Zn(S)+[1/2]O2(g)=ZnO(S)△H1;Hg(l)+[1/2]O2(g)=HgO(S
已知下列热化学方程式:
Zn(S)+[1/2]O2(g)=ZnO(S)△H1;Hg(l)+[1/2]O2(g)=HgO(S)△H2;
则Zn(S)+HgO(S)=Hg(l)+ZnO(S)△H值为( )
A.△H2-△H1
B.△H2+△H1
C.△H1-△H2
D.-△H1-△H2 sqklsm1年前1
sqklsm1年前1 -
 ylh1000 共回答了19个问题
ylh1000 共回答了19个问题 |采纳率78.9%解题思路:根据盖斯定律,利用已知方程式进行叠加,构造出目标反应式,关键在于设计反应过程,注意:(1)当反应式乘以或除以某数时,△H也应乘以或除以某数. (2)反应式进行加减运算时,△H也同样要进行加减运算,且要带“+”、“-”符号,即把△H看作一个整体进行运算.已知:①Zn(s)+1/2O2(g)=ZnO(s)△H1
②Hg(l)+1/2O2(g)=HgO(s)△H2;
根据盖斯定律,①-②得Zn(s)+HgO(s)=ZnO(s)+Hg(l),△H=△H1-△H2.
故选:C.点评:
本题考点: 用盖斯定律进行有关反应热的计算.
考点点评: 考查盖斯定律,难度中等,关键在于根据已知反应构造目标反应式.1年前查看全部
- 已知下列热化学方程式:①CaCO3(s)═CaO(s)+CO2(g)△H=177.7kJ②C(s)+H2O(s)═CO(
已知下列热化学方程式:
①CaCO3(s)═CaO(s)+CO2(g)△H=177.7kJ
②C(s)+H2O(s)═CO(g)+H2(g)△H=-131.3kJ/mol
③[1/2]H2SO4(l)+NaOH(l)═[1/2]Na2SO4(l)+H2O(l)△H=-57.3kJ/mol
④C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
⑤CO(g)+[1/2]O2(g)═CO2(g)△H=-283kJ/mol
⑥HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(l)△H=-57.3kJ/mol
⑦2H2(g)+O2(g)═2H2O(l)△H=-517.6kJ/mol
(1)上述热化学方程式中,不正确的有______,不正确的理由分别______.
(2)根据上述信息,写出C转化为CO的热化学方程式:C(s)+[1/2]O2(g)=CO(g)△H=-110.5KJ/molC(s)+[1/2]O2(g)=CO(g)△H=-110.5KJ/mol.
(3)上述反应中,表示燃烧热的热化学方程式有______;表示中和热的热化学方程式有______.(填序号)
(4)已知0.5mol甲烷与0.5mol水蒸气在t℃.p kPa时,完全反应生成一氧化碳和氢气,吸收了a kJ热量,该反应的热化学方程式是:______. lja12351年前1
lja12351年前1 -
 阳光道路 共回答了20个问题
阳光道路 共回答了20个问题 |采纳率95%解题思路:(1)根据热化学方程式的书写方法,需要注意△H为“-”表示放热反应,△H为“+”表示吸热反应.△H的单位一般为kJ•mol-1(kJ/mol);需要标注物质的聚集状态等;
(2)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(3)燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量;中和热是强酸与强碱的稀溶液发生中和反应生成1mol水时放出的热量;
(4)根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态来解答.(1)①CaCO3═CaO(s)+CO2(g)△H=177.7kJ,反应焓变单位为kJ/mol,故错误;
②C(s)+H2O(g)═CO+H2 △H=-131.3kJ/mol,水不是固体,故错误;
③[1/2]H2SO4(l)+NaOH(l)═[1/2]Na2SO4(l)+H2O(l)△H=-57.3kJ/mol,除水的状态其余状态为“aq”,故错误;
④C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol,符合热化学方程式的书写方法,故正确;
⑤CO(g)+[1/2]O2(g)═CO2(g)△H=-283kJ/mol,符合热化学方程式的书写方法,故正确;
⑥HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(l)△H=-57.3kJ/mol,符合热化学方程式的书写方法,故正确;
⑦2H2(g)+O2(g)═2H2O(l)△H=-517.6kJ/mol,符合热化学方程式的书写方法,故正确;
故答案为:①②③;①焓变单位为KJ/mol,②生成物的状态未标注,③除水的状态其余状态为“aq”;
(2)④C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
⑤CO(g)+[1/2]O2(g)═CO2(g)△H=-283kJ/mol
依据盖斯定律④-⑤得到C转化为CO的热化学方程式:C(s)+[1/2]O2(g)=CO(g)△H=-110.5KJ/mol;
故答案为:C(s)+[1/2]O2(g)=CO(g)△H=-110.5KJ/mol;
(3)燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,表示燃烧热的热化学方程式有④⑤;
中和热是强酸与强碱的稀溶液发生中和反应生成1mol水时放出的热量,表示中和热的热化学方程式有⑥,
故答案为:④⑤;⑥;
(3)甲烷和水蒸气之间的反应方程式为:CH4(g)+H2O(g)═CO(g)+3H2(g),0.5mol甲烷与0.5mol水蒸气在t℃、p kPa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量,所以1mol甲烷与1mol水蒸气在t℃、p kPa时,完全反应生成一氧化碳和氢气(合成气),吸收了2a kJ热量,
热化学方程式为:CH4(g)+H2O(g)═CO(g)+3H2(g),△H=+2akJ/mol;
故答案为:CH4(g)+H2O(g)═CO(g)+3H2(g),△H=+2akJ/mol;点评:
本题考点: 热化学方程式.
考点点评: 本题主要考查了热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比.同时还考查了反应热的计算,燃烧热、中和热概念理解应用,题目难度不大.1年前查看全部
- 按要求写热化学方程式:(1)、将煤转化为水煤气的主要反应为:C (s)+H2O(g)═CO(g)+H2(g).已知
按要求写热化学方程式:(1)、将煤转化为水煤气的主要反应为:C (s)+H2O(g)═CO(g)+H2(g).已知
按要求写热化学方程式:
(1)、将煤转化为水煤气的主要反应为:C (s)+H2O(g)═CO(g)+H2(g).已知:
C (s)+O2(g)═CO2(g)△H1=-393.5kJ/mol
H2(g)+[1/2]O2(g)═H2O(g)△H2=-242.0kJ/mol
CO(g)+[1/2]O2(g)═CO2(g)△H3=-283.0kJ/mol
写出制取水煤气的热化学方程式.______
(2)已知稀溶液中,1mol H2SO4与NaOH溶液恰好完全反应时,放出114.6kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式______.
(3)25℃、101kPa条件下充分燃烧一定量的丁烷(分子式为C4H10)气体放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25g白色沉淀,写出表示丁烷燃烧热的热化学方程式______
(4)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ/mol
②C(s)+O2(g)═CO2(g)△H2=-393.5kJ/mol
③H2(g)+[1/2]O2(g)═H2O(l)△H3=-285.8kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式______.
 stego111年前1
stego111年前1 -
 whsober 共回答了15个问题
whsober 共回答了15个问题 |采纳率93.3%(1)①C(s)+O2(g)=CO2(g)△H=-393.5 kJ/mol,
②CO(g)+[1/2]O2(g)=CO2(g)△H=-283.0 kJ/mol,
③H2(g)+[1/2]O2(g)=H2O(g)△H=-242.0kJ/mol,
根据盖斯定律,①-②-③得:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ/mol,
故答案为:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ/mol;
(2)中和热是指强酸、强碱生成1mol水放出的热量,1mol H2SO4与NaOH溶液恰好完全反应时,生成2mol水,放出114.6kJ热量,则生成1mol水时放出57.3kJ的热量,
所以H2SO4与NaOH反应的中和热化学方程式为:
[1/2]H2SO4(aq)+NaOH(aq)=[1/2]Na2SO4(aq)+H2O(l);△H=-57.3kJ/mol,
故答案为:[1/2]H2SO4(aq)+NaOH(aq)=[1/2]Na2SO4(aq)+H2O(l);△H=-57.3kJ/mol;
(2)n(CaCO3)=[25g/100g/mol]=0.25mol,
Ca(OH)2+CO2=CaCO3+H2O
1 1
0.25mol0.25mol
即丁烷燃烧生成的二氧化碳为0.25mol,
2C4H10+13O2=8CO2+10H2O
28
x 0.25mol
x=[1/16]mol,
因为燃烧[1/16]mol的丁烷放出的热量为Q,则丁烷的燃烧热为16Q,
所以表示丁烷燃烧热化学方程式为 C4H10(g)+[13/2]O2(g)=4CO2(g)+5H2O(l)△H=-16QkJ/mol,
故答案为:C4H10(g)+[13/2]O2(g)=4CO2(g)+5H2O(l)△H=-16QkJ/mol;
(3)已知:
①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ/mol,
②C(s)+O2(g)═CO2(g)△H2=-393.5kJ/mol,
③H2(g)+[1/2]O2(g)═H2O(l )△H3=-285.8kJ/mol,
利用盖斯定律将②×2+③×2-①可得:
2C(s)+2H2(g)+O2(g)=CH3COOH(l);△H=2×(-393.5kJ/mol)+2×(-285.8kJ/mol)-(-870.3kJ/mol)=-488.3kJ/mol,
所以热化学方程式为2C(s)+2H2(g)+O2(g)=CH3COOH(l);△H=-488.3kJ/mol,
故答案为:2C(s)+2H2(g)+O2(g)=CH3COOH(l);△H=-488.3kJ/mol.1年前查看全部
- 已知热化学方程式:H2O(g)=H2(g)+[1/2]O2(g)△H=+241.8kJ/molH2(g)+[1/2]O2
已知热化学方程式:
H2O(g)=H2(g)+[1/2]O2(g)△H=+241.8kJ/mol
H2(g)+[1/2]O2(g)=H2O(1)△H=-285.8kJ/mol
当1mol液态水变为水蒸气时,其热量变化是( )
A.吸热88kJ
B.吸热2.44KJ
C.放热44kJ
D.吸热44KJ 紫千19721年前1
紫千19721年前1 -
 发白如霜54 共回答了21个问题
发白如霜54 共回答了21个问题 |采纳率95.2%解题思路:依据热化学方程式和盖斯定律含义计算得到所需热化学方程式的焓变;①H2O(g)=H2(g)+[1/2]O2(g)△H=+241.8kJ/mol
②H2(g)+[1/2]O2(g)=H2O(1)△H=-285.8kJ/mol
依据盖斯定律②+①得到H2O(g)=H2O(1)△H=-44KJ/mol
当1mol液态水变为水蒸气时H2O(l)=H2O(g)△H=+44KJ/mol
当1mol液态水变为水蒸气时,其热量变化是吸热44KJ;
故选D.点评:
本题考点: 用盖斯定律进行有关反应热的计算.
考点点评: 本题考查了热化学方程式和盖斯定律的计算应用,理解实质是解题关键,题目较简单.1年前查看全部
- 已知热化学方程式2SO 2 (g)+O 2 (g)⇌2SO 3 (g)△H=-Q kJ•mol -1 (Q>0),则下列
已知热化学方程式2SO 2 (g)+O 2 (g)⇌2SO 3 (g)△H=-Q kJ•mol -1 (Q>0),则下列说法正确的是( ) A.单位时间内生成2molSO 2 ,同时生成1molO 2 ,说明反应达到平衡状态 B.将2molSO 2 (g)和1mol O 2 (g)置于一密闭容器中充分反应后放出Q kJ的热量 C.升高温度,正反应速率增大,逆反应速率减小,上述热化学方程式中的Q值减小 D.上述热化学反应方程式说明反应物的总键能小于生成物的总键能  极速光驱1年前1
极速光驱1年前1 -
 布衣tt 共回答了19个问题
布衣tt 共回答了19个问题 |采纳率84.2%A、化学反应中转化的物质的量之比等于化学计量数之比,不能作为判断是否达到化学平衡的依据,故A错误;
B、将2molSO 2 (g)和1molO 2 (g)置于一密闭容器中充分反应后,达到化学平衡,反应物不能全部转化,放出热量小于QkJ,故B错误;
C、升高温度,正反应速率增大,逆反应速率增大,上述热化学方程式中的Q值不变,故C错误;
D、放热反应中旧键断裂吸收的能量小于新键形成所放出的能量,即反应物的总键能小于生成物的总键能,故D正确;
故选:D;1年前查看全部
- 根据如图所示,写出反应的热化学方程式,并回答问题.
根据如图所示,写出反应的热化学方程式,并回答问题.
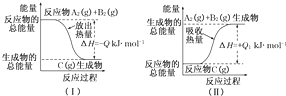
(1)反应过程(Ⅰ)的热化学方程式:______.
(2)反应过程(Ⅱ)的热化学方程式:______.
(3)Q与Q1的关系:Q______Q1(填“大于”“小于”或“等于”)
(4)已知下列反应的反应热为:
①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H=-870.3kJ•mol-1
②C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
③H2(g)+[1/2]O2(g)═H2O(l)△H=-285.8kJ•mol-1,试计算下列反应的反应热:2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H=______. tonton_sz11年前1
tonton_sz11年前1 -
 johnson1234 共回答了22个问题
johnson1234 共回答了22个问题 |采纳率90.9%解题思路:(1)依据图1分析可知反应物的总能量高于生成物的总能量,为放热反应,依据热化学方程式书写方法解答;
(2)依据图2分析可知反应物的总能量低于生成物的总能量,为吸热反应,依据热化学方程式书写方法解答;
(3)反应的焓变和反应物和生成物能量有关于变化过程无关,正反应和逆反应的焓变数值相同,符号相反;
(4)利用已知反应,据盖斯定律解答.(1)由图1可知反应物AB的能量高于生成物C的能量,反应是放热反应,热化学方程式书为,A2(g)+B2(g)=C(g)△H=-QKJ/mol,
故答案为:A2(g)+B2(g)=C(g)△H=-QKJ/mol;
(2)由图2可知反应物C的能量低于生成物AB的能量,反应是吸热反应,热化学方程式为C(g)=A2(g)+B2(g)△H=+Q1KJ/mol,
故答案为:C(g)=A2(g)+B2(g)△H=+Q1KJ/mol;
(3)反应的焓变和反应物和生成物能量有关于变化过程无关,正反应和逆反应的焓变数值相同,符号相反,故答案为:等于;
(4)已知①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ•mol-1
②C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
③H2(g)+[1/2]O2(g)═H2O(l)△H=-285.8kJ•mol-1
据盖斯定律,②×2+③×2-①得:
2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H=-488.3KJ/mol,
故答案为:-488.3 kJ•mol-1.点评:
本题考点: 热化学方程式.
考点点评: 本题考查了反应能量变化及其盖斯定律的应用,图象分析判断是解题关键,注意反应焓变只与始态和终态有关,与变化过程无关,题目较简单.1年前查看全部
- 下列依据热化学方程式得出的结论正确的是( ) A.已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 B
下列依据热化学方程式得出的结论正确的是( ) A.已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 B.已知C(s)+O 2 (g)═CO 2 (g)△H 1 C(s)+
O 2 (g)═CO(g)△H 2 ,则△H 2 >△H 11 2 C.已知2H 2 (g)+O 2 (g)═2H 2 O(g)△H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol D.已知NaOH(aq)+HCl(aq)═NaCl(aq)+H 2 O(l)△H=-57.3kJ/mol,则含20gNaOH的稀溶液与稀盐酸完全中和,中和热为28.65kJ/mol  啥都不懂BJ1年前1
啥都不懂BJ1年前1 -
 幸涛 共回答了23个问题
幸涛 共回答了23个问题 |采纳率82.6%A.已知C(石墨,s)═C(金刚石,s)△H>0,石墨能量小于金刚石,则金刚石比石墨活泼,石墨比金刚石稳定,故A错误;
B.己知2C(s)+2O 2 (g)═2CO 2 (g)△H 1 、2C(s)+O 2 (g)═2CO(g)△H 2 ,一氧化碳转化为二氧化碳是放热过程;焓变包含负号,则△H 1 <△H 2 ,故B正确;
C.氢气的燃烧热是值1mol氢气完全燃烧生成液态水放出的热量,单位是kJ/mol,气态水不是稳定氧化物,2H 2 (g)+O 2 (g)═2H 2 O(g)△H=-483.6kJ•mol -1 ,则燃烧热>
483.6KJ•mo l -1
2 =241.8kJ•mol -1 ,故C错误;
D.已知NaOH(aq)+HCl(aq)═NaCl(aq)+H 2 O(l)△H=-57.4 kJ•mol -1 ,中和热指1molNaOH和molHCl溶液发生中和反应生成1mol水时所放出的热量为57.4 kJ,则0.5molNaOH与强酸,中和热不变,中和热为△H=-57.4 kJ•mol -1 ,故D错误;
故选:B.1年前查看全部
- 13、已知两个热化学方程式:C(s)+O2(g)====CO2(g) ΔH=-9.5 kJ·mol-1 2H2(g)+O
13、已知两个热化学方程式:C(s)+O2(g)====CO2(g) ΔH=-9.5 kJ·mol-1 2H2(g)+O2(g)====2H2O(g) ΔH
13、已知两个热化学方程式:C(s)+O2(g)====CO2(g) ΔH=-9.5 kJ·mol-1
2H2(g)+O2(g)====2H2O(g) ΔH=-48.6 kJ·mol-1
现有炭粉和H2组成的悬浮气共0.2 mol,使其在O2中完全燃烧,共放出6.5 kJ的热量,则炭粉与H2的物质的量之比是( )
A.1∶1 B.1∶2 C.2∶3 D.3∶2 凝冬1年前2
凝冬1年前2 -
 net2knight 共回答了21个问题
net2knight 共回答了21个问题 |采纳率90.5%用盖斯定理解!
两个方程式以代数法相加,可得如下方程:
C(s)+2O2(g)+2H2(g)====CO2(g)+2H2O(g) ΔH=
-9.5-48.6=-58.1kJ·mol-1
又因为放出6.5 kJ的热量,且化学计量数与焓变(ΔH)成正比
所以得:6.5÷58.1约等于0.11
得新的方程式:0.11C(s)+0.22O2(g)+0.22H2(g)====0.11CO2(g)+0.22H2O(g) ΔH=
6.5kJ·mol-1
所以炭粉与H2的物质的量之比是1:2,选B
炭粉和H2组成的悬浮气共0.2 mol是多余条件1年前查看全部
- HCl+NaOH的热化学方程式帮我写HCl+NaOH=?的热化学方程式, 我主要看的是它们标的状态
 金岭1年前1
金岭1年前1 -
 七七八八的哦 共回答了25个问题
七七八八的哦 共回答了25个问题 |采纳率96%HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)
△H=-57.3KJ/mol1年前查看全部
大家在问
- 1子弹射入木块过程中系统动量是否守恒.为什么
- 2用气筒给自行车打气要费力,是因为要克服分子键的斥力. 这句话是错的,为什么?对的是什么?谢谢
- 3子弹射入靠墙木块动量是否守恒
- 4语文 【默写题】每当独自一人远离家乡,在人们欢度节日更加思念家乡的亲人时,你会吟诵“_______________,__
- 5动量研究中静止物块放在桌面上,一子弹射入,取物块与子弹为系统,结果我认为动量不守恒,因为物块收到...
- 6修路用石灰三合土,是用生石灰还是熟石灰?
- 7哲学有科学与非科学之分,请举例子说明分在那里?
- 8热化学反应方程式的书写是否需要写反应条件?
- 9在加油站常常会看到这样一条醒目的标语:“严禁用塑料桶装运汽油”,这是为什么?
- 10下面哪一个是正确的?1.用气筒给自行车打气要费力,是因为要克服分子间的斥力
- 11我可以把这些孩子教好用英语怎么说
- 12为什么当合力为0时,物体不能做匀速直线运动呢
- 13克隆某功能蛋白质的编码基因的方法,且不知其氨基酸序列?
- 14热化学反应方程式是否写反应条件
- 15左边一个采右边一个由念什么字?
