H-F 键长比H-Cl的大,偶极矩却比较小 为什么?
 dog-god2022-10-04 11:39:542条回答
dog-god2022-10-04 11:39:542条回答写反了 H-F 键长比H-Cl的短 偶极矩却大

已提交,审核后显示!提交回复
共2条回复
 莹莹KITTY 共回答了22个问题
莹莹KITTY 共回答了22个问题 |采纳率72.7%- 偶极矩=qr,虽然r小但是F的电负性比Cl大得多,也就是q大,这时电负性起主导,所以是F偶极距大,偶极距大小判断要同时考虑这两个变量
- 1年前
 halley2008 共回答了11个问题
halley2008 共回答了11个问题 |采纳率- 啊~看了标题震惊了一下。
因为F的电负性比Cl强很多,导致负电中心十分靠近F,而HCl虽然键长较长,但是由于Cl电负性不如F那么大,所以负电中心较为靠近中心。
而且别忽略了一个关键性的作用,氢键。比如有两个HF分子距离较近,那么A中F原子对B中H原子的氢键作用也会导致B中氢原子偏离理论位置,因此导致偶极矩变大。... - 1年前
相关推荐
- iC14与CCl4都是无色液体,分子形状相似.关于两者的说法正确的是 A.键长:C-C>Si-Si
iC14与CCl4都是无色液体,分子形状相似.关于两者的说法正确的是 A.键长:C-C>Si-Si
1.SiC14与CCl4都是无色液体,分子形状相似.关于两者的说法正确的是
A.键长:C-C>Si-Si B.公用电子对偏向程度:Si-Cl>C-Cl C.键能:Si-Cl>C-Cl D.沸点:CCl4>SiCl4
2.
下列实验方案能用来测定NaHCO3与NH4Cl固体混合物中NaHCO3的质量分数的是
A.ag混合物(充分加热)固体质量减轻bg
B.ag混合物(足量稀硫酸)加热蒸干得到固体bg
C.ag混合物(足量氢氧化钡溶液、过滤、洗涤、烘干)得到固体
D.ag混合物(足量浓盐酸、逸出气体用浓硫酸干燥后再用碱石灰吸收)碱石灰增重bg
B得到的硫酸铵受热分解,为什么不可以
C会生成氨水,不是就会和碳酸钡反应了吗 安1181231年前1
安1181231年前1 -
 心理恣询_ss 共回答了25个问题
心理恣询_ss 共回答了25个问题 |采纳率96%是SICl4和CCl4么 选B
原子半径CC,A加热生成碳酸钠和氯化钠混合物;B是硫酸钠和硫酸氢钠混合物,D中由于用浓盐酸HCl气体也会被碱石灰吸收
氨是碱性的,不会和碳酸钡反应.1年前查看全部
- 下列说法中正确的是( )A.分子中键能越大,键长越长,则分子越稳定B.sp3杂化轨道是由同一个原子中能量相近的s
下列说法中正确的是( )
A.分子中键能越大,键长越长,则分子越稳定
B.sp3杂化轨道是由同一个原子中能量相近的s 轨道和p轨道混合起来形成的一组能量相近的新轨道
C.PCl5分子中P原子和Cl原子最外层都满足8电子结构
D.用价层电子互斥理论预测H2S和BF3的立体结构,分别为V形和平面正三角形 伊风悠悠1年前1
伊风悠悠1年前1 -
 飞越零点 共回答了18个问题
飞越零点 共回答了18个问题 |采纳率94.4%解题思路:A、根据键能、键长与分子稳定性的关系分析;
B、能量不同的轨道杂化后变成能量相同的轨道;
C、PCl5中P元素化合价为+5价,P原子最外层电子数是5,5+5=10,则P原子不满足8电子结构;
D、价层电子对互斥理论认为:分子的立体构型是“价层电子对”相互排斥的结果.A、分子中键能越大,键越短,则分子越稳定,故A错误;
B、同一个原子中能量相近的s轨道和p轨道通过杂化可形成混合起来形成的一组能量相同的新轨道,杂化轨道数=孤电子对数+与之相连的原子数,故B正确;
C、PCl5中P元素化合价为+5价,P原子最外层电子数是5,5+5=10,则P原子不满足8电子结构,故C错误;
D、H2S分子的中心原子S原子上含有2个σ 键,中心原子上的孤电子对数=[1/2](a-xb)=[1/2](6-2×1)=2,所以硫化氢分子的VSEPR模型是四面体型,略去孤电子对后,实际上其空间构型是V型;
BF3分子的中心原子B原子上含有3个σ 键,中心原子上的孤电子对数=[1/2](a-xb)=[1/2](0-3×1)=0,所以BF3分子的VSEPR模型是平面三角型,中心原子上没有孤对电子,所以其空间构型就是平面三角形,故D正确.
故选:BD.点评:
本题考点: 键能、键长、键角及其应用;判断简单分子或离子的构型;原子轨道杂化方式及杂化类型判断.
考点点评: 本题考查了键参数、分子构型、原子轨道及其杂化的判断,根据价层电子对互斥理论确定其杂化方式即可,难度较大.1年前查看全部
- 为什么N2分子中的氮氮键长小于F2分子中氟氟键的键长
 2739993551年前1
2739993551年前1 -
 zzbaixiaoxue 共回答了26个问题
zzbaixiaoxue 共回答了26个问题 |采纳率88.5%氮氮是有三个键 一个Pi键 两个Seita(我不知怎么读)键 而氟氟键只有一个Pi键
同周期 三个键的要小于一键的1年前查看全部
- 结构化学中,点阵是指?说明 H2+的键长比 H2 长,而 O2+的键长比 O2 短的原因.
结构化学中,点阵是指?说明 H2+的键长比 H2 长,而 O2+的键长比 O2 短的原因.
具有1000ev动能的自由电子,假定此电子的速度的不确定度为速度的1%,问它的位置的不确定程度为多少? kekekeai1年前1
kekekeai1年前1 -
 plaingirl 共回答了17个问题
plaingirl 共回答了17个问题 |采纳率94.1%1、为集中反映晶体结构的周期性而引入的一个概念.首先考虑一张二维周期性结构的图像.可在图上任选一点 O作为原点.在图上就可以找到一系列与O点环境完全相同的点子,这一组无限多的点 构成点阵
2、
键级越大,键越稳定,键长越短.根据分子轨道理论,O2的分子轨道式是
KK(σ2s)2(σ*2s)2(σ2p)2(л2py)2(л2pz)2(л*2py)1(л*2pz)1
O2的键级=(8-4)/2=2.O2+的键级=2.5
O2+键级大,键长短.
H2+的键级=1/2,H2的键级=1
H2键级大,键长短.1年前查看全部
- 氢气分子中nc三键键长小于cc单键长,为什么
氢气分子中nc三键键长小于cc单键长,为什么
错了,是***气,(cn)2 sdfsdgdfht1年前1
sdfsdgdfht1年前1 -
 逝光星空下 共回答了17个问题
逝光星空下 共回答了17个问题 |采纳率88.2%N-C-C-N中四个原子在同一直线上,CN间为三键,一个P轨道形成CNsigama(希腊符号不会打,见谅)键,其他两个P轨道形成两个π键,两边的CN原子间的π键共轭,(大学中叫形成δ键)使中间的CC键长变短,同时使CC单键更稳定1年前查看全部
- 键能大小如何判断N2的化学性质比O2稳定用键能大小解释?氧的半径小于氮的半径,所以氧的键长小于氮的?这样判断为什么错了呢
键能大小如何判断
N2的化学性质比O2稳定用键能大小解释?氧的半径小于氮的半径,所以氧的键长小于氮的?这样判断为什么错了呢? kktelcom1年前2
kktelcom1年前2 -
 千年猫猫 共回答了18个问题
千年猫猫 共回答了18个问题 |采纳率88.9%因为N2的两个氮原子之间形成了三队共用电子对,也就是三键,键能大,要破坏的话需要吸收比氧气更大的能量,所以较稳定.
而氧原子的半径小于氮原子的半径,跟键长无关,只是因为氧原子的质子比氮原子多一个,吸引相同电子层的能力强一些,所以氧原子的半径小,无法因为判断键长.1年前查看全部
- 苯、乙烷、乙烯、乙炔分子中的碳碳键的键长分别为a、b、c、d,它们之间的大小顺序为( ) A.a>b>c>d B.b>
苯、乙烷、乙烯、乙炔分子中的碳碳键的键长分别为a、b、c、d,它们之间的大小顺序为( ) A.a>b>c>d B.b>a>c>d C.b>c>d>a D.b>c>a>d  小印第安loli1年前1
小印第安loli1年前1 -
 糖心草莓 共回答了15个问题
糖心草莓 共回答了15个问题 |采纳率86.7%分子中两个成键原子的核间平均距离叫做键长,键长越短,表示原子结合得越牢,化学键越强;以共价键结合的两原子的核间距离表示键长;一个双键的键长并不等于两个单键键长之和,同理一个三键的键并不等于一个单键的键长加一个双键的键长,键长的长短主要看成键轨道的重叠程度;乙烷、乙烯、乙炔它们除去生成碳-碳键外,乙烯、乙炔还有杂化轨道P电子云的侧面重叠,键长比乙烷都短一些;苯分子中苯碳原子间的键长介于单、双键之间,是一种特殊的键; 所以得到键长大小为:乙烷>苯分子>乙烯>乙炔,
苯、乙烷、乙烯、乙炔分子中的碳碳键的键长分别为a、b、c、d,它们之间的大小顺序为:b>a>c>d;
故选B.1年前查看全部
- 硫化氢的酸性为什么比氯化氢来的弱?硫氢键的键长不是比氯氢键来的长吗
硫化氢的酸性为什么比氯化氢来的弱?硫氢键的键长不是比氯氢键来的长吗
比较氢化物的酸性是看键长的长短吧?键长越长,越活泼,酸性越强? chenyuan3691年前1
chenyuan3691年前1 -
 bingo6199 共回答了16个问题
bingo6199 共回答了16个问题 |采纳率93.8%因为Cl的电负性远大于S,所以Cl-H键的极性也远大于H-S键,极性越大,断键越容易,酸性越强
键长不是比较酸性的唯一标准,要综合考虑,硫化氢和氯化氢不属于同族的氢化物,光看键长是不能说明问题的1年前查看全部
- 一道关于化学键长的问题图左是H2S键长为1.350A 图右是SF2键长为1.583A,请根据偶极矩的相对方向来说明此2分
一道关于化学键长的问题
图左是H2S键长为1.350A 图右是SF2键长为1.583A,请根据偶极矩的相对方向来说明此2分子键长为什么不同

 yepeng11年前2
yepeng11年前2 -
 狐眼浅笑 共回答了15个问题
狐眼浅笑 共回答了15个问题 |采纳率93.3%H S F三种元素的电负性依次增大,也就是吸引电子的能力依次增强,这样在硫化氢里面,由图受力分析,硫原子对上方氢原子的引力向左下,对下方氢原子的引力向左上,从而使偶极距方向向左,在氟化硫里面氟的引力起主导地位,所以上方氟原子对硫原子的引力右上,下方引力右下,这样合力向右.因此二者的偶极距不同,两分子键长不同.1年前查看全部
- 下列说法中正确的是( )A.元素的第一电离能:硫>磷B.元素的电负性:Na>Mg>AlC.碳碳键键长:乙烯>乙炔D.离
下列说法中正确的是( )
A.元素的第一电离能:硫>磷
B.元素的电负性:Na>Mg>Al
C.碳碳键键长:乙烯>乙炔
D.离子晶体的晶格能:氟化钠>氧化镁 3915358551年前1
3915358551年前1 -
 啊猪 共回答了23个问题
啊猪 共回答了23个问题 |采纳率91.3%解题思路:A.同一周期元素中,元素的第一电离能随着原子序数的增大而增大,但第VA族元素大于相邻元素;
B.同一周期元素中,元素的电负性随着原子序数的增大而增大;
C.通常来说,比较键长可以通过比较键能来确定,键能大小则可以通过物质的稳定性来确定;
D.晶格能与离子所带电荷成正比.A.同一周期元素中,元素的第一电离能随着原子序数的增大而增大,但第VA族元素大于相邻元素,S和P位于同一周期,且S位于第VIA族、P位于第VA族,所以第一电离能P>S,故A错误;
B.同一周期元素中,元素的电负性随着原子序数的增大而增大,所以电负性大小顺序是Na<Mg<Al,故B错误;
C.通常来说,比较键长可以通过比较键能来确定,乙炔的键能大于乙烯,则乙炔中碳碳键键长小于乙烯,故C正确;
D.晶格能与离子所带电荷成正比,氟化钠中离子所带电荷小于氧化镁,所以晶格能:氟化钠<氧化镁,故D错误;
故选C.点评:
本题考点: 元素电离能、电负性的含义及应用;晶格能的应用;键能、键长、键角及其应用.
考点点评: 本题考查了元素周期律、晶格能大小的判断等知识点,注意第一电离能规律中的异常现象,知道晶格能与离子所带电荷、离子半径的关系,难度不大.1年前查看全部
- 下列说法正确的是( )A.分子中键能越大,键长越长,则分子越稳定B.元素周期表中的ⅠA族和ⅦA族元素间可能形成共价键C
下列说法正确的是( )
A.分子中键能越大,键长越长,则分子越稳定
B.元素周期表中的ⅠA族和ⅦA族元素间可能形成共价键
C.水分子可表示为H-O-H,分子中键角为180°
D.H-O键键能为463kJ∕mol,即18gH2O分解成H2和O2时,吸收能量为2×463kJ onlyyyou1年前1
onlyyyou1年前1 -
 wayne_hsu1978 共回答了22个问题
wayne_hsu1978 共回答了22个问题 |采纳率95.5%解题思路:A.分子中键能、键长与分子稳定性的关系;
B.根据非金属与非金属能形成共价键;
C.水是V形分子,分子中键角为104.5°
D.反应中热量变化=反应物的总键能-生成物的总键能.A.分子中键能越大,键长越短,则分子越稳定,故A错误;
B.元素周期表中的ⅠA族中含有金属元素和非金属元素,ⅦA族元素是非金属元素,非金属与非金属能形成共价键,故B正确;
C.水是V形分子,分子中键角为104.5°,故C错误;
D.反应中热量变化=反应物的总键能-生成物的总键能,由于不知道H-H和O=O的键能,无法求出吸收的能量,故D错误;
故选B.点评:
本题考点: 键能、键长、键角及其应用.
考点点评: 本题涉及的知识点较多,但难度不大,根据所学知识即可完成.1年前查看全部
- 苯有几种键有一个在单双键之间的键 还有没有别的键 比如外面一层键 里面是那种单双键之间的键它们的键长那是一样的吗 是不是
苯有几种键
有一个在单双键之间的键 还有没有别的键 比如外面一层键 里面是那种单双键之间的键
它们的键长那是一样的吗 是不是最外层的就是单键 中间的单双之间键比外面的短 hhsde1年前4
hhsde1年前4 -
 对自己好点吧 共回答了16个问题
对自己好点吧 共回答了16个问题 |采纳率93.8%额.高考完记不清楚了,但是好像是大π键.
苯分子中的6个碳原子和6个氢原子都在同一平面里,其中碳碳键与碳碳键、碳碳键与碳氢键间的夹角均为120°,所以碳原子必须采用sP2杂化轨道,6个碳原子都以3个sP2杂化电子构成6个C—Cσ键和6个C—Hσ键;同时,每个碳原子以多余的1个p电子的电子云(垂直于通过各原子核的平面)彼此发生一定程度的重叠,均匀对称地分布在整个苯分子里,称为大π键.1年前查看全部
- 离子化合物,离子之间的距离是键长吗?
 厦宇天1年前1
厦宇天1年前1 -
 lalita 共回答了21个问题
lalita 共回答了21个问题 |采纳率95.2%离子化合物中没有键长的概念的!共价键中才谈论键长的!
但离子之间的距离越大,其离子之间的静电作用就越小!1年前查看全部
- 下列粒子所含的化学键的键长和键能完全相同的是
下列粒子所含的化学键的键长和键能完全相同的是
A.NH4+ B.Na2O2 C.HCO3- D.H2SO4
为什么答案是A?
答案确实是A kftom1年前4
kftom1年前4 -
 mifan 共回答了19个问题
mifan 共回答了19个问题 |采纳率100%B虽然是对称的,但一个是离子键,一对是共价键,且键长不等
答案是A,因为NH4+中有一个原子提供空轨道(一般为H)一个原子提供孤对电子而形成的配位键,N为sp3杂化,所以四个键的键长和键能完全相同.1年前查看全部
- 为什么N-F的键能大于F-F键,而键长却长于F-F键?
 leuis1年前2
leuis1年前2 -
 shuaile 共回答了14个问题
shuaile 共回答了14个问题 |采纳率92.9%共价键长主要取决于成键原子的半径.N的原子半径大于F,故N-F的键长长于F-F键.在F2中,由于键长短,两个F原子的孤对电子之间相互排斥,使键能减小,故N-F的键能大于F-F键.1年前查看全部
- 气态SO3分子中硫原子6个价电子均成键,3个S、O共价键键长都为153pm,冷却为固体时形成聚合分子.则关于气态SO3的
气态SO3分子中硫原子6个价电子均成键,3个S、O共价键键长都为153pm,冷却为固体时形成聚合分子.则关于气态SO3的叙述错误的是( )
A. 是非极性分子
B. 分子呈平面正三角形
C. 3个S、O键都是单键
D. 聚合时放出热量 我爱重邮1年前2
我爱重邮1年前2 -
 小闹闹 共回答了17个问题
小闹闹 共回答了17个问题 |采纳率88.2%解题思路:A.正负电荷重心重合的分子为非极性分子;
B.根据价电子对互斥理论确定该分子空间构型;
C.S的6个价电子均成键,氧一般都为-2价,所以为双键连接;
D.能量越小的物质越稳定,根据能量守恒判断.A.三氧化硫分子中价层电子对数是3且不含孤电子对,所以为平面三角形结构,正负电荷重心重合,为非极性分子,故A正确;
B.三氧化硫分子中价层电子对数是3且不含孤电子对,所以为平面三角形结构,故B正确;
C.三氧化硫分子中价层电子对数是3且不含孤电子对,且S的6个价电子均成键,所以为双键连接,故C错误;
D.三氧化硫气体的能量大于固态,能量越低越稳定,根据能量守恒知,三氧化硫聚合时放出能量,故D正确;
故选:C.点评:
本题考点: 化学键;判断简单分子或离子的构型;极性分子和非极性分子.
考点点评: 本题考查了化学键、分子空间构型、分子极性的判断,这些都是考试热点,明确分子空间构型的判断方法,为学习难点.1年前查看全部
- 有关萘分子中碳碳键键长的问题03年版高教版有机中,提到萘中的键长没有平均化.请问这是为什么哪?是因为每个成键原子的p轨电
有关萘分子中碳碳键键长的问题
03年版高教版有机中,提到萘中的键长没有平均化.
请问这是为什么哪?
是因为每个成键原子的p轨电子允许重叠的体积一定吗?
我想知道为什么共用碳的p轨重叠会导致闭合离域π键分布不均匀...... 鸭绿江小军1年前1
鸭绿江小军1年前1 -
 cuibuy 共回答了20个问题
cuibuy 共回答了20个问题 |采纳率100%萘的分子式为C10H8,是由两个苯环共用两个相邻的碳原子稠合而成,两个苯环处于同一平面上.萘分子中每个碳原子均以sp2杂化轨道与相邻的碳原子形成碳碳σ键,每个碳原子的p轨道互相平行,侧面重叠形成一个闭合共轭大π键,...1年前查看全部
- 为什么氧分子正离子的键长比氧气短而氮分子正离子的键长比氮气的长?
 魔法爵士1年前1
魔法爵士1年前1 -
 雪逸云 共回答了20个问题
雪逸云 共回答了20个问题 |采纳率100%氧气分子中2p轨道中的成键分子轨道有6个电子,反成键分子轨道有2个电子,键级为2;氧气分子离子中反成键分子轨道中电子减少,键级就变大,故其键长小.对于氮气它反成键分子轨道上没电子,形成正离子时失去成键分子轨道上的电子,键级变小,键长变长.1年前查看全部
- 化学竞赛难题如图是金属Cr硼化物的晶体结构,每四个B原子连接成平面四方形基团,B-B键的键长为1.68A,它们处于同一高
化学竞赛难题
如图是金属Cr硼化物的晶体结构,每四个B原子连接成平面四方形基团,B-B键的键长为1.68A,它们处于同一高度水平上,不同高度的四方形按图中所示的方式和上下八个平面四边形基团连接成三维骨架,四方形基团之间B-B键的键长为1.91A,如图中的双线所示.骨架中的大空穴放Cr原子.
请问每个Cr原子周围多少个B原子?
原题答案是20,请问为什么呀?
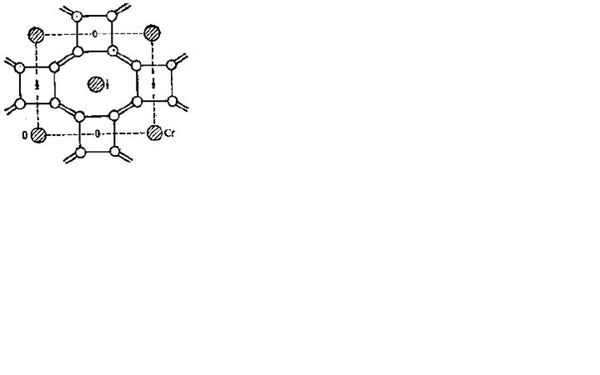
 引水站1年前1
引水站1年前1 -
 胡ANGEL 共回答了18个问题
胡ANGEL 共回答了18个问题 |采纳率94.4%12个吧,可能是答案错了 = =b
图看不清,有没有清楚一点的,表示平面的0、1、2很重要啊,题目说的云里雾里的.1年前查看全部
- 为什么苯环上碳碳键的键长相等,就能证明苯环结构不存在碳碳单键与碳碳双键的交替结构?
 心晴8心1年前1
心晴8心1年前1 -
 wangp0409 共回答了21个问题
wangp0409 共回答了21个问题 |采纳率95.2%因为碳碳单键和碳碳双键的键长不一样,而苯环上碳碳键的键长相等,所以是一种特殊键,而不是碳碳单键与碳碳双键的交替结构...1年前查看全部
- 氧气分子失去一个电子后,其键长如何变化?
 1837508681年前1
1837508681年前1 -
 lwy321 共回答了16个问题
lwy321 共回答了16个问题 |采纳率75%根据分子轨道理论,氧的电子排布是2s22p4,氧气分子的分子轨道在2p层的排布为(2p)2(π2p)4(π2p※)2,键级=(成键电子数-反键电子数)/2,失去一个电子,键级升高,键长变短1年前查看全部
- ①乙烷、②乙烯、③乙炔、④苯四种烃中,碳原子之间键长由长到短的顺序是( )
①乙烷、②乙烯、③乙炔、④苯四种烃中,碳原子之间键长由长到短的顺序是( )
A. ①>②>③>④
B. ②>①>③>④
C. ①>④>②>③
D. ④>③>②>① 三八乖乖1年前1
三八乖乖1年前1 -
 LIA39 共回答了19个问题
LIA39 共回答了19个问题 |采纳率68.4%解题思路:有机物中,单键键长>双键键长>三键键长,苯环中的化学键是介于单键和双键之间的特出化学键.①乙烷中的化学键是单键,②乙烯中的化学键是双键,③乙炔中的化学键是三键,④苯中的化学键是介于单键和双键之间的特殊键,所以键长顺序是①>④>②>③.
故选C.点评:
本题考点: 键能、键长、键角及其应用.
考点点评: 本题考查学生有机物中键长的大小比较规律:单键键长>双键键长>三键键长,注意苯环中的化学键是介于单键和双键之间的特出化学键.1年前查看全部
- 关于氢键和共价键熔沸点H2O>H2S,为什么要用氢键解释,共价键不行吗?键长确实是H2O比较短啊
 尾巴鱼1年前1
尾巴鱼1年前1 -
 furong020202 共回答了19个问题
furong020202 共回答了19个问题 |采纳率94.7%键长——分子稳定性
熔沸点是分子层次上的.
H2O,H2S都是分子.关于熔沸点,自然是氢键作用.1年前查看全部
- 偶极矩与键长的关系是?
 双鱼阿飞1年前1
双鱼阿飞1年前1 -
 酒仙剑 共回答了21个问题
酒仙剑 共回答了21个问题 |采纳率90.5%这个没有一个确定的关系吧,应该看是什么类型的分子,反正μ=q*d,即偶极矩等于偶极长乘以正负电荷重心的电量,对于双原子分子偶极长就是键长了,对于多原子分子就不一定了.1年前查看全部
- 晶体有哪些堆积方式 判断的依据是什么 然后键角键长之类的怎么算 还有哈 如果给你一个分子式
晶体有哪些堆积方式 判断的依据是什么 然后键角键长之类的怎么算 还有哈 如果给你一个分子式
要你推出它的晶体结构要怎么搞 本人化学奥赛 希望能拿个至少二等奖 希望用大学结构化学的方式来解答 希望长期合作 基本快乐1年前1
基本快乐1年前1 -
 octopus86 共回答了31个问题
octopus86 共回答了31个问题 |采纳率90.3%晶体的堆积方式有1、二维空间模型:a非密置层 配位数为4b密置层 配位数为62、三维空间模型 a简单立方堆积 相邻非密置层原子的原子核在同一直线上的堆积方式堆积方式有ABABAB.ABCABCABC.判断的话去做一个晶体衍射分析...1年前查看全部
- 化学键的键能,键角,键长都分别能判定物质的什么性质?
 青色小巫1年前2
青色小巫1年前2 -
 xxzzhh 共回答了18个问题
xxzzhh 共回答了18个问题 |采纳率88.9%键能:键的能量,能判断键的牢固成都,进而判断分子的稳定性.
键角:键之间的角度,可以判断键之间的位置关系,进而判断分子的空间构型.
键长:键的长度,与键能之间有一定的关系,键越长,则越容易断裂,键能就越小,键就越不牢固,所以,也可以判断分子的稳定性.
另外,与分子的形状之间也有一定的联系,如CH4与CCl4,后者的键长大一些,则后者分子半径大一些.1年前查看全部
- 下列碳碳键键长大小关系为1.乙烷2.乙烯3.乙炔4.苯要原因
 啊啊啊1231年前1
啊啊啊1231年前1 -
 zhonghaoyong 共回答了20个问题
zhonghaoyong 共回答了20个问题 |采纳率85%乙炔1年前查看全部
- 氮气分子失去一个电子后键长怎样变化啊
氮气分子失去一个电子后键长怎样变化啊
氮气离子化学式怎么写的? howard_1年前1
howard_1年前1 -
 qinsoli 共回答了8个问题
qinsoli 共回答了8个问题 |采纳率100%键长变长(主要原因是是一个电子,键级由3变到2.5)
N2+1年前查看全部
- 卤素与H反应形成的化合物,是不是卤素的非金属性越强键长就越短呢?
卤素与H反应形成的化合物,是不是卤素的非金属性越强键长就越短呢?
是不是键长越短越稳定?
键长与键能有什么联系吗? 荒凉的爱情1年前1
荒凉的爱情1年前1 -
 恋海情结 共回答了24个问题
恋海情结 共回答了24个问题 |采纳率91.7%键长不但和非金属性有关,还和共用电子对数有关,比如碳碳三键1年前查看全部
- 白磷分子中P-P键的键长和键能都相等吗?
 shenkaiyun7191年前4
shenkaiyun7191年前4 -
 Aprilsunlight 共回答了20个问题
Aprilsunlight 共回答了20个问题 |采纳率90%相等啊,白磷分子是正三棱锥型,键长和键能都相等1年前查看全部
- 化学中为什么金属半径越小键长就越短 键能_page_type=1
 紫夜深秋处1年前1
紫夜深秋处1年前1 -
 花花天子 共回答了13个问题
花花天子 共回答了13个问题 |采纳率84.6%键长=两个原子的半径之和-电子云交盖的部分
半径小当然键长就会短阿.1年前查看全部
- 化学键的键长是什么东西?它受什么影响
化学键的键长是什么东西?它受什么影响
有机物中的单键双键有什么区别?影响呢? 火柴、清酒、月1年前2
火柴、清酒、月1年前2 -
 aixueyou 共回答了18个问题
aixueyou 共回答了18个问题 |采纳率94.4%键长就是两个粒子通过化学键连接,化学键的长度.例如氧气分子由两个氧原子通过共价键连接.它受粒子的化学性质影响,键长越短,物质稳定性越强.例如氯化纳与氯化钾,钾金属性强于纳,与非金属离子结合更紧密,所以氯钾的键长更短,氯化钾更稳定.同主族原子非金属性越强,结合越紧密.
单键是通过两粒子共用一对电子形成的共价键,双键则是两对,C-C单键比双键稳定,C=C双键易发生加成反应和氧化反应,比如被高锰酸钾氧化从而高锰酸钾褪色1年前查看全部
- 金属原子与配位原子之间形成的配位键键长一般是在多少范围?
 小天使JOJO1年前1
小天使JOJO1年前1 -
 lxs8034067 共回答了20个问题
lxs8034067 共回答了20个问题 |采纳率100%0.25nm左右1年前查看全部
- HF,HCl,HBr,HI的键长大小比较
HF,HCl,HBr,HI的键长大小比较
一般情况下怎样判断键长大小? 感觉341年前1
感觉341年前1 -
 lanxiang01 共回答了16个问题
lanxiang01 共回答了16个问题 |采纳率75%就是看原子的半径大小
原子半径,同主族从上到下,逐渐增大.F1年前查看全部
- 求HCl HBr HI 的键长和热分解温度
求HCl HBr HI 的键长和热分解温度
HCl HBr HI 的键长和热分解温度
有加分 点击20061年前3
点击20061年前3 -
 xutopia 共回答了15个问题
xutopia 共回答了15个问题 |采纳率80%键长(l/pm)
H-Cl 127
H-Br 141
H-I 161
热分解温度 (°C)
H-Cl 1000
H-Br 600
H-I 3001年前查看全部
- 分子键的键长是由什么决定的
 霜絮1年前1
霜絮1年前1 -
 清末夏初 共回答了20个问题
清末夏初 共回答了20个问题 |采纳率85%分子中两个原子核间的平均距离称为键长.例如氢分子中两个氢原子的核间距为76pm,H—H的键长为76pm.一般键长越长,原子核间距离越大,键的强度越弱,键能越小.如H—F,H—Cl H—Br,H—I键长依次递增,键能依次递减,分子的热稳定性依次递减.键长与成键原子的半径和所形成的共用电子对等有关.1年前查看全部
- 为什么氮气分子的化学键键长比白磷分子的短?
 甜晨1年前5
甜晨1年前5 -
 mm神之爱 共回答了11个问题
mm神之爱 共回答了11个问题 |采纳率81.8%氮气中电子构型为氮氮三键,而白磷为空间正四面体型,为磷磷单键.形象一点讲,三键使两个磷之间的拉力更大,键长更短.不知道这样讲你可不可以帮助你理解,1年前查看全部
- 烷烃分子中碳碳单键的键长是
 言之有道1年前1
言之有道1年前1 -
 chenwen_gtr 共回答了16个问题
chenwen_gtr 共回答了16个问题 |采纳率87.5%碳碳单键的键长为1.54埃1年前查看全部
- 化学键的键长越长,物质越稳定吗键能和键长又是什么关系? HI比HCl酸性大 不是因为HI键长大 容易断裂出H+吗?
 独立自主21年前4
独立自主21年前4 -
 yaner0322 共回答了13个问题
yaner0322 共回答了13个问题 |采纳率100%键长越短,断裂需要的能量就越高,就越稳定1年前查看全部
- 键长 原子半径请问原子半径和键长的关系.为什么共价单键做比较键长时比较的是两原子的半径而不是电负性呢?原子半径不是不变得
键长 原子半径
请问原子半径和键长的关系.
为什么共价单键做比较键长时比较的是两原子的半径而不是电负性呢?
原子半径不是不变得吗?
而键长越大,键能越小.
这么说不成了,半径越大,电负性越小吗? 唐朝19841年前1
唐朝19841年前1 -
 dfnk 共回答了14个问题
dfnk 共回答了14个问题 |采纳率92.9%单键成键就是σ键,电子云顶端相交,相交幅度小,因而可以用原子半径粗略表示.
原子半径越大,电负性越小,这没问题啊.
只有σ键的键长能够用原子半径之和粗略地表示,其他种类的化学键电子云有的是从侧面相交,有的有偏转,有的是离域的,所以和原子半径的关系就不大了.1年前查看全部
- 氢氧化钙中离子键长主要是Ca与O之间的键长是多少!谢谢了!
 田田莲叶1年前2
田田莲叶1年前2 -
 yyc18731124 共回答了13个问题
yyc18731124 共回答了13个问题 |采纳率76.9%在氢氧化钙中,Ca-O键长约为2.36-2.37埃.
离子键也是有键长的,当然,离子键本质上是静电引力,没有方向性也没有饱和性,但这并不意味着没有键长,很多文献上报道离子化合物的几何结构用的都是“bond length”.不只是离子键,配位键、氢键甚至金属键也都有键长的说法,毕竟,键长是化学键的一个基本参数呢.1年前查看全部
- 甲烷乙烯稳定性今天上课老师讲键长越长,键能越低,越不稳定但是老师又说C—C 键长154 3键能32 C═C 键长134
甲烷乙烯稳定性
今天上课老师讲键长越长,键能越低,越不稳定
但是老师又说C—C 键长154 3键能32
C═C 键长134 键能611
按道理说,双键的乙烯应该比甲烷稳定啊,但是实际不然、 yaru-1201年前1
yaru-1201年前1 -
 何复生 共回答了20个问题
何复生 共回答了20个问题 |采纳率95%建议楼主好好演习下化学中的原子键之类的知识,其实本质说就是物理的引力之类的,解释的方法太多了,关於这题,一般老师会这样说,首先甲烷没有C—C 键是C-H 乙烯C═C 键没有C-H键能高,其实甲烷四面保护稳定性更好的1年前查看全部
- 化学键的极性对键能、键长有影响吗
化学键的极性对键能、键长有影响吗
在乙炔中,由于C呈sp杂化,电负性比较大,导致碳氢键极性大,从而使得端位氢容易异裂, 巴哈鱼1501年前3
巴哈鱼1501年前3 -
 trsss 共回答了15个问题
trsss 共回答了15个问题 |采纳率93.3%额,怎么说呢,这个问题其实没有谁影响谁的,因为一个化学键产生的同时,他的极性,键能,健长都是确定的,不存在谁影响谁.1年前查看全部
- 热稳定性与键长有关吗?
 kaolayu1年前1
kaolayu1年前1 -
 淡然笑傲江湖 共回答了6个问题
淡然笑傲江湖 共回答了6个问题 |采纳率100%有关.简单地说,键长越长,键能就越小,键越容易被打断,热稳定性就越差.相反,键长越短,键能就越大,键越不容易被打断,热稳定性就越好.
热稳定性反映的是化学键的强弱.1年前查看全部
- 苯分子中各键长相等吗?
 玫瑰绽放瞬间1年前1
玫瑰绽放瞬间1年前1 -
 tensin 共回答了21个问题
tensin 共回答了21个问题 |采纳率95.2%苯分子中碳与碳之间的键完全相同,键长相等.碳氢之间的键相等.但碳碳键与碳氢键不等.
碳碳键与碳氢键不等.1年前查看全部
- 为什么C==C双键键长比C一C单键短,键能小于C一C单键键能的两倍,其中双键里的一个键易断裂
 发生1年前2
发生1年前2 -
 wujunjia20 共回答了16个问题
wujunjia20 共回答了16个问题 |采纳率93.8%C一C单键是σ键,是电子云头对头重叠,较稳定.
双键中的另一个是π键,是电子云侧面重叠,不如σ键稳定.1年前查看全部
- 一般说来键长越短键能越长,但氟气的键能是157,氯气的键能是242.7,氟气的键长是141,氯气的键长是198请问为什么
一般说来键长越短键能越长,但
氟气的键能是157,氯气的键能是242.7,
氟气的键长是141,氯气的键长是198
请问为什么氟气的键能比滤器小但键长比氯气短? hycbat1年前1
hycbat1年前1 -
 蔚昊峰清湖B6 共回答了16个问题
蔚昊峰清湖B6 共回答了16个问题 |采纳率93.8%两个F原子离得太近 其电子对之间有了斥力冲抵了部分键能所以实测键能反而小1年前查看全部
- 为什么石墨中碳碳键键长比金刚石中的要短?
 anbooo1年前4
anbooo1年前4 -
 ss小熊 共回答了16个问题
ss小熊 共回答了16个问题 |采纳率93.8%石墨中的碳原子是sp2杂化,金刚石中的碳原子是sp3杂化原理基本如同楼上所说,但不必这么麻烦.石墨中碳碳之间由一根“西伽马”键和半根“派”键(其实是离域大派键)键合(引号中为发音,打不出希腊字母.),而金刚石中碳...1年前查看全部
大家在问
- 1老师,我想对你说 作文
- 2宾语从句改简单句 could you tell me when i should attend the opening
- 3作用在物体上的力越大、物体通过的距离越大,力做的功越多
- 4几分之一加几分之一等于十二分之一 4种 要不同的自然数
- 5(2013•泰州)如图中,长方形被两条直线分成四个小长方形,其中三个的面积分别是12平方米、8平方米、20平方米,求另一
- 6(-2x^3y^2)^3/(-1/2x^ny^2)=-mx^7y^p,求n,m,p的值
- 7已知s十t=1,3m一2n=9,则多项式(2s十9m)十[一(6n一2t)]的值为
- 8a=25 b=3 a的1999次方加b的2000次方末尾数是几
- 9今天遇到小学题,把我问住了4个2,应该是4乘以2还是2乘以4?
- 105^m=9,5^n=3,那么5^(m-n)等于多少?
- 11淘气从家去图书馆,去时每分走9米,回时没分走11米,来回的平均速度是多少?
- 12物质世界的演变是什么发展的结果?
- 13i have nothing in common with Kate
- 1442x+25x=134汗,托人问的,
- 15如图所示,质量为m的小球,从位于竖直平面内的圆弧形曲面上下滑,由于摩擦力的作用,小球从a到b运动速率增大,b到c速率恰好
