用高铁酸钠(Na 2 FeO 4 )对河水和湖水消毒是城市饮用水处理的新技术.已知反应:Fe 2 O 3 +3Na 2
 天空安静blue2022-10-04 11:39:541条回答
天空安静blue2022-10-04 11:39:541条回答 用高铁酸钠(Na 2 FeO 4 )对河水和湖水消毒是城市饮用水处理的新技术.已知反应:Fe 2 O 3 +3Na 2 O 2 =2Na 2 FeO 4 +Na 2 O.下列说法正确的是( )
|

已提交,审核后显示!提交回复
共1条回复
 君愿 共回答了11个问题
君愿 共回答了11个问题 |采纳率90.9%- A、反应Fe 2 O 3 +3Na 2 O 2 =2Na 2 FeO 4 +Na 2 O中,氧元素化合价降低,Na 2 O 2 是氧化剂,铁元素化合价升高,Fe 2 O 3 是还原剂,故A错误;
B、还原剂Fe 2 O 3 对应的产物Na 2 FeO 4 是氧化产物,氧化剂Na 2 O 2 对应的产物Na 2 FeO 4 和Na 2 O叫还原产物,所以Na 2 FeO 4 既是氧化产物又是还原产物,故B正确;
C、在反应Fe 2 O 3 +3Na 2 O 2 =2Na 2 FeO 4 +Na 2 O中,铁元素化合价共升高6价,所以反应过程转移的电子的量为6mol,消耗3molNa 2 O 2 ,故C错误;
D、根据化合价规则可知在Na 2 FeO 4 中Fe为+6价,居于铁元素的最高价,具有强氧化性,故D错误.
故选B. - 1年前
相关推荐
- 用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术.已知获得高铁酸钠的反应为:Fe2O3+mNa2O2=nN
用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术.已知获得高铁酸钠的反应为:Fe2O3+mNa2O2=nNa2FeO4+Na2O,下列说法中正确的是( )
A.Na2FeO4中,铁元素的化合价+6价
B.高铁酸钠中铁元素质量分数最大
C.化学计量数m=n
D.消毒的作用是除去水中可溶性杂质 寻宝青蛙1年前1
寻宝青蛙1年前1 -
 清洁内心 共回答了12个问题
清洁内心 共回答了12个问题 |采纳率100%解题思路:A、根据在化合物中元素化合价的代数和为零的原则进行分析判断.
B、根据化合物中元素的质量分数公式进行分析判断.
C、根据质量守恒定律:反应前后原子种类和数目均不变,进行分析判断.
D、根据消毒的作用进行分析判断.A、钠元素显+1价,氧元素显-2价,设Na2FeO4中铁元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+x+(-2)×4=0,则x=+6价,故选项说法正确.
B、高铁酸钠中钠原子的相对原子质量之和为23×2=46,铁原子的相对原子质量之和为56,氧原子的相对原子质量之和为16×4=64,氧元素的相对原子质量之和最大,则氧元素的质量分数最大,故选项说法错误.
C、根据质量守恒定律,反应前有2个铁原子,2n=2,则n=1;钠的原子个数为2×2+2=6个,2m=6,m=3;m与n不相等,故选项说法错误.
D、消毒的作用是除去有害细菌,不是除去水中可溶性杂质,故选项说法错误.
故选:A.点评:
本题考点: 有关元素化合价的计算;水的净化;元素的质量分数计算;化学方程式的配平.
考点点评: 本题难度不大,掌握利用化合价的原则计算指定元素的化合价的方法、质量守恒定律、有关化学式的计算等是正确解答本题的关键.1年前查看全部
- 用高铁酸钠(Na 2 FeO 4 )对河、湖水消毒是城市饮用水处理的新技术,已知反应Fe 2 O 3 +3Na 2 O
用高铁酸钠(Na 2 FeO 4 )对河、湖水消毒是城市饮用水处理的新技术,已知反应Fe 2 O 3 +3Na 2 O 2 =2Na 2 FeO 4 +Na 2 O,下列说法正确的是
A.Na 2 O 2 既是氧化剂又是还原剂 B.Fe 2 O 3 在反应中显氧化性 C.3 mol Na 2 O 2 发生反应,有12 mol电子转移 D.Na 2 FeO 4 能消毒杀菌是因其具有强氧化性  jjxjjx871271年前1
jjxjjx871271年前1 -
 着鞋唔着袜 共回答了18个问题
着鞋唔着袜 共回答了18个问题 |采纳率88.9%D
1年前查看全部
- 写出合成高铁酸钠的化学方程式请写出以NaClO、Fe(NO3)3、NaOH为原料合成高铁酸钠(Na2FeO4)的化学方程
写出合成高铁酸钠的化学方程式
请写出以NaClO、Fe(NO3)3、NaOH为原料合成高铁酸钠(Na2FeO4)的化学方程式(一步)并配平~
我是响应百度的号召才提了这个问题哦,哪位童鞋第一个写对, fireque1年前2
fireque1年前2 -
 einszwei 共回答了16个问题
einszwei 共回答了16个问题 |采纳率93.8%2Fe(NO3)3 + 3NaClO + 10NaOH = 2Na2FeO4 + 3NaCl + 6NaNO3 + 5H2O1年前查看全部
- 用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g•mol-1)等新型净水剂替代传统的净水剂Cl2对淡水
 用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g•mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g•mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是______>______>______.(填化学式)
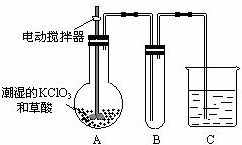
(2)二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸在60℃时反应制得.某学生用如图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置.请问:
①A部分还应添加温度控制装置,请你说出一种温度控制方法______,B部分还应补充什么装置______;
②C中的试剂为NaOH溶液,反应时生成氯酸钠和亚氯酸钠(NaClO2),发生该反应的离子方程式为______.若实验时需要450mL 4mol/L的NaOH溶液,则在精确配制时,需要称取NaOH的质量是______g,所使用的仪器除托盘天平、量筒、胶头滴管、玻璃棒外,还必须有:______. wujianglong1年前1
wujianglong1年前1 -
 qing_anita 共回答了18个问题
qing_anita 共回答了18个问题 |采纳率94.4%解题思路:(1)以单位质量的氧化剂所得到的电子数来表示消毒效率,设质量均为m,消毒效率分别为[m/67.5]×5、[m/166]×3、[m/71]×2×1;
(2)①二氧化氯的沸点低,A为ClO2的发生装置,应保持加热温度,B为ClO2的凝集装置,B装置应降低温度;
②C为尾气吸收装置,可选择碱来吸收尾气,发生氧化还原反应;配制450mL 4mol/L的NaOH溶液,应选择500mL容量瓶,结合m=cVM计算.(1)以单位质量的氧化剂所得到的电子数来表示消毒效率,设质量均为m,消毒效率分别为[m/67.5]×5、[m/166]×3、[m/71]×2×1,所以由大到小的顺序为ClO2>Cl2>Na2FeO4,故答案为:ClO2;Cl2;Na2FeO4;
(2)①二氧化氯的沸点低,A为ClO2的发生装置,则A应水浴加热,B为ClO2的凝集装置,B装置应补充(冰水)冷凝装置,故答案为:水浴加热;(冰水)冷凝;
②C为尾气吸收装置,可选择NaOH溶液来吸收尾气,发生氧化还原反应为2ClO2+2NaOH═NaClO2+NaClO3+H2O,离子反应为2ClO2+2OH-=ClO2-+ClO3-+H2O,配制450mL 4mol/L的NaOH溶液,还需要500mL容量瓶、烧杯,需要NaOH的质量为0.5L×4mol/L×40g/mol=80.0g,
故答案为:2ClO2+2OH-=ClO2-+ClO3-+H2O;80.0;500mL容量瓶、烧杯.点评:
本题考点: 制备实验方案的设计;氯气的化学性质;氯、溴、碘及其化合物的综合应用.
考点点评: 本题以氯及其化合物的性质考查氧化还原反应及物质的制备实验,把握习题中的信息及知识迁移应用为解答的关键,侧重学生综合应用能力及信息抽取和分析能力的考查,题目难度中等.1年前查看全部
- (2012•惠州模拟)用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术,制取Na2FeO4的反应为:Fe2
(2012•惠州模拟)用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术,制取Na2FeO4的反应为:Fe2O3+3Na2O2═2Na2FeO4+Na2O,下列说法不正确的是( )
A.Fe2O3是反应的还原剂
B.Na2O2既是氧化剂又是还原剂
C.Na2FeO4反应的氧化产物
D.Na2FeO4能消毒杀菌是因其具有强氧化性 pucca_huxianng1年前1
pucca_huxianng1年前1 -
 落叶de飘零 共回答了19个问题
落叶de飘零 共回答了19个问题 |采纳率89.5%解题思路:Fe2O3+3Na2O2═2Na2FeO4+Na2O中,Fe元素的化合价由+3价升高为+6价,过氧化钠中O元素的化合价由-1价降低为-2价,以此来解答.A.因Fe元素的化合价升高,则Fe2O3是反应的还原剂,故A正确;
B.过氧化钠中O元素的化合价降低,则Na2O2是氧化剂,故B错误;
C.Fe元素的化合价升高,则被氧化,所以Na2FeO4反应的氧化产物,故C正确;
D.Na2FeO4具有强氧化性,所以能消毒杀菌,故D正确;
故选:B.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高考高频考点,把握反应中元素的化合价变化为解答的关键,注意化合价与元素的性质关系,选项D为解答的难点,题目难度不大.1年前查看全部
- 在水的净化处理中,高铁酸钠(Na 2 FeO 4 )是一种新型高效的水处理剂.下列关于高铁酸钠的说法正确的是( ) A
在水的净化处理中,高铁酸钠(Na 2 FeO 4 )是一种新型高效的水处理剂.下列关于高铁酸钠的说法正确的是( ) A.高铁酸钠是氧化物 B.高铁酸钠中铁元素的化合价为+6价 C.高铁酸钠中钠、铁、氧三种元素的质量比为2:1:4 D.高铁酸钠是由2个钠元素、1个铁元素、4个氧元素组成的物质  林海一1年前1
林海一1年前1 -
 棒棒蛋蛋 共回答了17个问题
棒棒蛋蛋 共回答了17个问题 |采纳率100%A、氧化物由两种元素组成而高铁酸钠有三种元素组成,故此答案错误.
B、化合物中个元素化合价代数和为零,则有+1×2+铁的化合价+(-2)×4=0,即铁的化合价是+6价,故此答案正确.
C、高铁酸钠中钠、铁、氧三种元素的质量比为(23×2):56:(16×4)=23:28:32,故此答案错误.
D、元素不能用个数进行计数,故此答案错误.
故选B1年前查看全部
- 工业上可用如图原理来制备高铁酸钠(Na2FeO4),下列说法正确的是( )
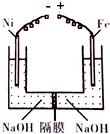 工业上可用如图原理来制备高铁酸钠(Na2FeO4),下列说法正确的是( )
工业上可用如图原理来制备高铁酸钠(Na2FeO4),下列说法正确的是( )
A.该装置实现了主要的能量转化:化学能→电能
B.Ni电极反应:4OH--4e-=2H2O+O2↑
C.装置右侧的OH-通过隔膜移向左侧
D.一段时间后,充分混合两端液体,溶液pH值会增小 耿寒1年前1
耿寒1年前1 -
 112286588 共回答了13个问题
112286588 共回答了13个问题 |采纳率92.3%解题思路:用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4),铁失电子生成高铁酸钠,则铁作阳极,镍作阴极,阳极上铁失电子发生氧化反应,电极方程式为Fe-6e-+8OH-═FeO42-+4H2O,阴极发生还原反应,电极方程式为2H2O+2e-=H2↑+2OH-,据此分析解答.A.该装置是将电能转化为化学能的装置,为电解池,故A错误;
B.镍电极上电极反应式为2H2O+2e-=H2↑+2OH-,故B错误;
C.装置左侧的OH-通过隔膜移向右,故C错误;
D.阳极电极反应式为Fe-6e-+8OH-═FeO42-+4H2O,阴极电极方程式为2H2O+2e-=H2↑+2OH-,当得失电子相等时,消耗氢氧根离子的物质的量大于生成氢氧根离子的物质的量,二者混合时,所以溶液的pH减小,故D正确;
故选D.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了电解原理,明确阴阳极上发生的反应是解本题关键,难点是电极反应式的书写,题目难度中等.1年前查看全部
- 在水的净化处理中,高铁酸钠(Na2FeO左)是一种新型高效的水处理剂.3列说法正确的是( )
在水的净化处理中,高铁酸钠(Na2FeO左)是一种新型高效的水处理剂.3列说法正确的是( )
A.高铁酸钠是氧化物
B.高铁酸钠是由2个钠元素、1个铁元素、4个氧元素组成的物质
C.高铁酸钠中铁元素的化合价为+4价
D.高铁酸钠中钠、铁、氧三种元素的原子个数比为2:1:4 deankung1年前1
deankung1年前1 -
 qaz965 共回答了18个问题
qaz965 共回答了18个问题 |采纳率94.4%解题思路:利用氧化物由两种元素组成,化学式表示的意义及化合物中个元素化合价代数和为零解决此题.A、氧化物由两种元素组成,而高铁酸钠有三种元素组成,故此答案错误.
4、元素不能用个数进行计数,故此答案错误.
二、化合物中各元素化合价代数和为零,钠显+地价,氧显-七价,因此高铁酸钠中铁元素的化合价为+6价,故此答案错误.
D、高铁酸钠中钠、铁、氧三种元素的原子个数比为七:地:三,故此答案正确.
故选:D.点评:
本题考点: 化学式的书写及意义;从组成上识别氧化物;有关元素化合价的计算.
考点点评: 此题是对化学式的意义及简单计算的考查,属基础性训练题是对化学式相关问题的强化与巩固.1年前查看全部
- 用高铁酸钠(Na2FeO4)对河水和湖水消毒是城市饮用水处理的新技术.已知反应:Fe2O3+3Na2O2=2Na2FeO
用高铁酸钠(Na2FeO4)对河水和湖水消毒是城市饮用水处理的新技术.已知反应:Fe2O3+3Na2O2=2Na2FeO4+Na2O.下列说法正确的是( )
A.Na2O2既是氧化剂又是还原剂
B.Na2FeO4对河水,湖水消毒的同时,还能起到净水的作用
C.3molNa2O2发生反应,有12mol电子转移
D.Na2FeO4具有较强的还原性,因而能对河水、湖水进行消毒杀菌
求解释B中的“起到净水的作用 ”
解析说FeO42-被还原成Fe3+,水解产生Fe(OH)3胶体可以使水中悬浮物凝聚沉降
讲一下是FeO42-与水反应生成Fe3+的吗?否则是怎样的? haoqq551年前1
haoqq551年前1 -
 傻笨熊 共回答了21个问题
傻笨熊 共回答了21个问题 |采纳率95.2%是FeO42-具有强氧化性,与水中的细菌病毒体反应(消毒过程:氧化细菌病毒体)被还原生成Fe3+,Fe3+水解产生Fe(OH)3胶体可以使水中悬浮物凝聚沉降1年前查看全部
- 在水的净化处理中,高铁酸钠(Na2FeO4)是一种新型高效的水处理剂.下列关于高铁酸钠的说法正确的是( )
在水的净化处理中,高铁酸钠(Na2FeO4)是一种新型高效的水处理剂.下列关于高铁酸钠的说法正确的是( )
A.高铁酸钠是氧化物
B.高铁酸钠中铁元素的化合价为+6价
C.高铁酸钠是一种新型的有机化合物
D.高铁酸钠是由2个钠元素、1个铁元素、4个氧元素组成的物质 注定要孤独1年前1
注定要孤独1年前1 -
 nvhai11nvhai 共回答了16个问题
nvhai11nvhai 共回答了16个问题 |采纳率93.8%解题思路:A、氧化物是指含有两种元素且其中一种是氧元素的化合物,由铁酸钠的化学式进行分析判断.
B、根据在化合物中正负化合价代数和为零,结合铁酸钠的化学式进行解答本题.
C、根据含有碳元素的化合物叫有机化合物,简称有机物,据此进行分析判断.
D、利用元素不能用个数进行计数解决此题.A、氧化物是由两种元素组成且含有氧元素的化合物,根据高铁酸钠(Na2Fe04),高铁酸钠由钠、铁、氧三种元素组成,不属于氧化物;故此答案错误.
B、钠元素显+1,氧元素显-2,设铁元素的化合价是x,根据在化合物中正负化合价代数和为零,可知高铁酸钠中铁元素的化合价:(+1)×2+x+(-2)×4=0,则x=+6,故此答案正确.
C、高铁酸钠(Na2Fe04)不含碳元素,不属于有机物,故此答案错误.
D、元素不能用个数进行计数,故此答案错误.
故选:B.点评:
本题考点: 化学式的书写及意义;从组成上识别氧化物;有机物与无机物的区别;有关元素化合价的计算.
考点点评: 本题难度不大,掌握氧化物的特征、有机物的特征、利用化合价的原则计算指定元素的化合价的方法是正确解答本题的关键.1年前查看全部
- 在水的净化处理中,高铁酸钠(Na2FeO4)是一种新型高效的水处理剂.下列关于高铁酸钠的说法正确的是( )
在水的净化处理中,高铁酸钠(Na2FeO4)是一种新型高效的水处理剂.下列关于高铁酸钠的说法正确的是( )
A. 高铁酸钠是氧化物
B. 高铁酸钠中铁元素的化合价为+6价
C. 高铁酸钠是一种新型的有机化合物
D. 高铁酸钠是由2个钠元素、1个铁元素、4个氧元素组成的物质 天使ww_58581年前1
天使ww_58581年前1 -
 骆驼ci 共回答了13个问题
骆驼ci 共回答了13个问题 |采纳率100%解题思路:A、氧化物是指含有两种元素且其中一种是氧元素的化合物,由铁酸钠的化学式进行分析判断.
B、根据在化合物中正负化合价代数和为零,结合铁酸钠的化学式进行解答本题.
C、根据含有碳元素的化合物叫有机化合物,简称有机物,据此进行分析判断.
D、利用元素不能用个数进行计数解决此题.A、氧化物是由两种元素组成且含有氧元素的化合物,根据高铁酸钠(Na2Fe04),高铁酸钠由钠、铁、氧三种元素组成,不属于氧化物;故此答案错误.B、钠元素显+1,氧元素显-2,设铁元素的化合价是x,根据在化合物中正负...
点评:
本题考点: 化学式的书写及意义;从组成上识别氧化物;有机物与无机物的区别;有关元素化合价的计算.
考点点评: 本题难度不大,掌握氧化物的特征、有机物的特征、利用化合价的原则计算指定元素的化合价的方法是正确解答本题的关键.1年前查看全部
- 用高铁酸钠(Na 2 FeO 4 )对河水、湖水消毒,是城市饮用水消毒的新技术。已知制备高铁酸钠的反应为Fe
用高铁酸钠(Na 2 FeO 4 )对河水、湖水消毒,是城市饮用水消毒的新技术。已知制备高铁酸钠的反应为Fe 2 O 3 +3Na 2 O 2 =2Na 2 FeO 4 +Na 2 O,下列说法正确的是
A.Na 2 O 2 既是氧化剂,又是还原剂 B.Fe 2 O 3 在反应中得到电子 C.3 mol Na 2 O 2 参加反应,转移的电子总数为12mol D.Na 2 FeO 4 能消毒杀菌,因其具有强氧化性  stevenshenxn1年前1
stevenshenxn1年前1 -
 bear7 共回答了16个问题
bear7 共回答了16个问题 |采纳率93.8%D
1年前查看全部
- (2012•石家庄一模)目前高铁酸钠(Na2FeO4)被广泛应用于水处理,具有高效、无毒的优点.
(2012•石家庄一模)目前高铁酸钠(Na2FeO4)被广泛应用于水处理,具有高效、无毒的优点.
(1)将Fe(OH)3与NaClO溶液混合,可制得Na2FeO4,完成并配平下列离子方程式
______Fe(OH)3+______ClO-+______=______FeO42-+______Cl-+______
(2)某地海水样品经Na2FeO4处理后,所含离子及其浓度如下表所示(H+和0H-未列出):
常温下,取一定量经Na2FeO4处理过的海水为原料制备精制食盐水和MgCl2•7H20,过程如下:离子 SO42- Mg2+ Fe3+ Na+ Cl- 浓度(mol/L) a 0.05 0.10 0.50 0.58 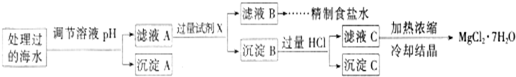
注:离子的浓度小于1.0×10-5mol/L,可认为该离子不存在;Ksp[Fe(OH)3]=1.0×10-38 Ksp[Mg(OH)2]=5.0×10-12;操作过程中溶液体积变化忽略不计.
①表格中的a______0.16 (填“<”、“>”或“=”).
②沉淀A的组成为______ (填化学式)
③加入的过量试剂X为______ (填化学式)
④加入过量HCl的作用为______. 玉猪儿1年前1
玉猪儿1年前1 -
 gao7331195 共回答了21个问题
gao7331195 共回答了21个问题 |采纳率95.2%解题思路:(1)反应中Fe(OH)3→FeO42-,Fe元素化合价由+3升高为+6价,总共升高3价,ClO-→Cl-,Cl元素化合价由+1价降低为-1价,总共降低2价,化合价升降最小公倍数为6,故Fe(OH)3系数为2,故ClO-系数为3,由元素守恒可知,FeO42-系数为2,Cl-系数为3,根据电荷守恒可知,反应物还有OH-,OH-系数为4,根据H元素、O元素守恒可知,生成物含有H2O,其系数为5.
(2)①由表中Mg2+、Fe3+的浓度及Ksp[Fe(OH)3、Ksp[Mg(OH)2]可知,该溶液呈酸性,再利用电荷守恒可知,2c(SO42-)+c(Cl-)+c(OH-)=2c(Mg2+)+3c(Fe3+)+c(Na+)+c(H+),据此判断.
②由工艺流程图可知,处理的海水调节PH值,目的是Fe3+将转化为Fe(OH)3,除去溶液中的Fe3+.
③由工艺流程图可知,加入的过量试剂X目的是使滤液A中的SO42-转化为沉淀,Mg2+转化为Mg(OH)2,用钡离子沉淀SO42-,氢氧根沉淀Mg2+,据此判断X.
④由工艺流程图可知,盐酸使Mg(OH)2全部溶解转化为MgCl2,在加热浓缩滤液C时Mg2+水解,抑制Mg2+水解.(1)反应中Fe(OH)3→FeO42-,Fe元素化合价由+3升高为+6价,总共升高3价,ClO-→Cl-,Cl元素化合价由+1价降低为-1价,总共降低2价,化合价升降最小公倍数为6,故Fe(OH)3系数为2,故ClO-系数为3,由元素守恒可知,FeO42-系数为2,Cl-系数为3,根据电荷守恒可知,反应物还有OH-,OH-系数为4,根据H元素、O元素守恒可知,生成物含有H2O,其系数为5,配平后的离子方程式为2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O.
故答案为:2、3、4OH-,2、3、5H2O.
(2)①由Ksp[Fe(OH)3、Ksp[Mg(OH)2]可知,Mg2+完全沉淀时c(OH-)=10-7mol/L,Fe3+完全沉淀时c(OH-)=10-11mol/L,由表中Mg2+、Fe3+的浓度可知,该溶液呈酸性,c(H+)>c(OH-),利用电荷守恒可知,2c(SO42-)+c(Cl-)+c(OH-)=2c(Mg2+)+3c(Fe3+)+c(Na+)+c(H+),即2a+0.58+c(OH-)=2×0.05+3×0.1+0.5+c(H+),整理2a=0.32+c(H+)-c(OH-),由于c(H+)>c(OH-),所以a>0.16.
故答案为:>.
②由工艺流程图可知,处理的海水调节PH值,目的是Fe3+将转化为Fe(OH)3,除去溶液中的Fe3+,故沉淀A的组成为Fe(OH)3.
故答案为:Fe(OH)3.
③由工艺流程图可知,加入的过量试剂X目的是使滤液A中的SO42-转化为沉淀,Mg2+转化为Mg(OH)2,用钡离子沉淀SO42-,氢氧根沉淀Mg2+,故试剂X为Ba(OH)2.
故答案为:Ba(OH)2.
④由工艺流程图可知,盐酸使Mg(OH)2全部溶解转化为MgCl2,在加热浓缩滤液C时Mg2+水解,可以抑制Mg2+水解.
故答案为:使Mg(OH)2全部溶解转化为MgCl2;在加热浓缩滤液C时抑制Mg2+水解.点评:
本题考点: 氧化还原反应方程式的配平;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 考查氧化还原反应、溶度积计算、沉淀转化、溶液的有关计算、对化学工艺流程的理解、物质的分离提纯等,难度中等,(2)①为易错点、难点,根据电荷守恒判断原理、判断溶液的酸碱性是关键.1年前查看全部
- 用高铁酸钠(Na2FeO4)是一种新型净水剂,主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH═nNa2
用高铁酸钠(Na2FeO4)是一种新型净水剂,主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH═nNa2FeO4+3X+5H2O.下列说法中正确的是( )
A.该反应中,铁元素的化合价没有改变
B.该反应中X的化学式为NaCl
C.该反应中化学计量数n=4
D.该反应属于置换反应 wyf9812211年前1
wyf9812211年前1 -
 一只鞋走世界 共回答了21个问题
一只鞋走世界 共回答了21个问题 |采纳率85.7%解题思路:A、根据在化合物中元素化合价的代数和为零的原则进行解答;B、根据质量守恒定律的实质,反应前后各元素的原子个数相等推断X的化学式;C、根据质量守恒定律的实质,反应前后各元素的原子个数相等推断n的值;D、根据置换反应的概念分析.A、该反应中,反应物Fe(OH)3中铁元素的化合价为+3价,生成物Na2FeO4中铁元素的化合价为+6价,故A说法错误;
B、因为反应前后各元素原子个数相等,X的化学式为NaCl,故B说法正确;
C、根据反应前Fe原子的数目为2,可得n=2,故C说法错误;
D、一种单质跟一种化合物起反应,生成另一种单质和另一种化合物的反应叫做置换反应.可见该反应不是置换反应,故D说法错误;
故选:B.点评:
本题考点: 物质的相互转化和制备;有关元素化合价的计算;反应类型的判定;质量守恒定律及其应用.
考点点评: 本题考查化合价原则、置换反应的定义以及质量守恒定律的内容,考查注重基础.1年前查看全部
- (2006•广安)高铁酸钠(Na2FeO4)是一种能氧化、杀菌、脱色、除臭的新型高效水处理剂.其中铁元素的化合价是(
(2006•广安)高铁酸钠(Na2FeO4)是一种能氧化、杀菌、脱色、除臭的新型高效水处理剂.其中铁元素的化合价是( )
A.+2价
B.十3价
C.+4价
D.+6价 hulihula20001年前1
hulihula20001年前1 -
 wzh_bird 共回答了19个问题
wzh_bird 共回答了19个问题 |采纳率84.2%解题思路:根据在化合物中正负化合价代数和为零,结合高铁酸钠(Na2FeO4)的化学式进行解答本题.根据在化合物中正负化合价代数和为零,钠元素显+1,氧元素显-2,设铁元素的化合价是x,可知高铁酸钠(Na2FeO4)中铁元素的化合价:(+1)×2+x+(-2)×4=0,则x=+6.
故选D.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题难度不大,考查学生利用化合价的原则计算指定元素的化合价的能力.1年前查看全部
- (1)铁元素与地壳中含量最多的元素组成化合物的化学式为_(写出一种即可).高铁酸钠(Na2EeO4)是一种新型高效的净水
(1)铁元素与地壳中含量最多的元素组成化合物的化学式为_(写出一种即可).高铁酸钠(Na2EeO4)是一种新型高效的净水刘,高铁酸钠中铁元素的化合价为_.(2)常见的食品脱氧刘多为无机铁系脱氧刘,其主要成分为活性炭粉.请将下列脱氧中的主要反应的化学方程式补充完整:4Ee(OH)2+O2+2_=4Fe(OH)3,此反应的基本类型是_.
 meilx1年前0
meilx1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2011•锦州模拟)用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g•mol-1)等新型净水剂替代传
 (2011•锦州模拟)用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g•mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
(2011•锦州模拟)用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g•mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是______>______>______.
(2)高铁酸钠之所以能净水,除它本身具有强氧化性外,另一个原因可能是:______.
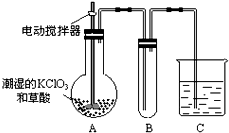
(3)二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59°C,沸点为11.0°C,易溶于水.ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60°C时反应制得.某学生用如图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置.请问:
①A部分还应添加温度控制(如水浴加热)装置,B部分还应补充什么装置______;
②C中应装的试剂为______.C中发生反应的化学方程式为:______. lueshuihongjing1年前1
lueshuihongjing1年前1 -
 无情ME 共回答了19个问题
无情ME 共回答了19个问题 |采纳率89.5%解题思路:(1)以单位质量的氧化剂所得到的电子数来表示消毒效率,设质量均为m,消毒效率分别为[m/67.5]×5、[m/166]×3、[m/71]×2×1;
(2)铁离子水解生成胶体,具有吸附性;
(3)①二氧化氯的沸点低,B为ClO2的凝集装置,B装置应降低温度;
②C为尾气吸收装置,可选择碱来吸收尾气,发生氧化还原反应.(1)以单位质量的氧化剂所得到的电子数来表示消毒效率,设质量均为m,ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率分别为[m/67.5]×5、[m/166]×3、[m/71]×2×1,所以由大到小的顺序为ClO2>Cl2>Na2FeO4,故答案为:ClO2;Cl2;Na2FeO4;
(2)高铁酸钠之所以能净水,除它本身具有强氧化性外,另一个原因可能是高铁酸钠的还原产物Fe3+能水解生成Fe(OH)3胶体,能吸附水中悬浮物,从而净水,
故答案为:高铁酸钠的还原产物Fe3+能水解生成Fe(OH)3胶体,能吸附水中悬浮物,从而净水;
(3)①二氧化氯的沸点低,B为ClO2的凝集装置,B装置应补充(冰水)冷凝装置,故答案为:(冰水)冷凝;
②C为尾气吸收装置,可选择NaOH溶液来吸收尾气,发生氧化还原反应为2ClO2+2NaOH═NaClO2+NaClO3+H2O,
故答案为:NaOH溶液;2ClO2+2NaOH═NaClO2+NaClO3+H2O(或其它合理答案).点评:
本题考点: 氯、溴、碘及其化合物的综合应用;铁的氧化物和氢氧化物.
考点点评: 本题以氯及其化合物的性质考查氧化还原反应及物质的制备实验,把握习题中的信息及知识迁移应用为解答的关键,侧重学生综合应用能力及信息抽取和分析能力的考查,题目难度中等.1年前查看全部
- (2013•盐城一模)用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术.已知获得高铁酸钠的反应为:Fe2O
(2013•盐城一模)用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术.已知获得高铁酸钠的反应为:Fe2O3+mNa2O2=nNa2FeO4+Na2O,下列说法中正确的是( )
A.Na2FeO4中,铁元素的化合价+6价
B.消毒的作用是除去水中可溶性杂质
C.化学计量数m=n
D.高铁酸钠中铁元素质量分数最大 清波11年前1
清波11年前1 -
 uwanna 共回答了17个问题
uwanna 共回答了17个问题 |采纳率88.2%解题思路:A、根据在化合物中元素化合价的代数和为零的原则进行分析判断.
B、根据消毒的作用进行分析判断.
C、根据质量守恒定律:反应前后原子种类和数目均不变,进行分析判断.
D、根据化合物中元素的质量分数=[相对原子质量×原子个数/相对分子质量]×100%,进行分析判断.A、钠元素显+1价,氧元素显-2价,设Na2FeO4中铁元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+x+(-2)×4=0,则x=+6价,故选项说法正确.
B、消毒的作用是除去有害细菌,不是除去水中可溶性杂质,故选项说法错误.
C、根据质量守恒定律,反应前有2个铁原子,2n=2,则n=2;钠的原子个数为2×2+2=6个,2m=6,m=3;m与n不相等,故选项说法错误.
D、高铁酸钠中钠原子的相对原子质量之和为23×2=46,铁原子的相对原子质量之和为56,氧原子的相对原子质量之和为16×4=64,氧元素的相对原子质量之和最大,则氧元素的质量分数最大,故选项说法错误.
故选A.点评:
本题考点: 化学方程式的配平;有关元素化合价的计算;元素的质量分数计算.
考点点评: 本题难度不大,掌握利用化合价的原则计算指定元素的化合价的方法、质量守恒定律、有关化学式的计算等是正确解答本题的关键.1年前查看全部
- 高铁酸钠(Na2FeO4)是一种绿色环保高效的饮水消毒剂.高铁酸钠中铁元素的化合价为
 scyber1年前1
scyber1年前1 -
 rainxing 共回答了18个问题
rainxing 共回答了18个问题 |采纳率88.9%+61年前查看全部
大家在问
- 1有7个学生,参加兴趣小组,每组3人,每两个小组之间最多可有1人相同,请问,最多一共可组成多少个兴趣小组?
- 2汽油和柴油是由一种物质提炼而成的吗?有什么本质的不同?
- 3口字旁一个句子读什么
- 4我想知道这个句子的成分,另外讲下这个句子的语法
- 5The population of China is larger than ______ of the United
- 6请仿照下面的文字写一段话,要求:另选话题,句式大致相同,想像丰富而合乎情理。
- 7收集有关自知之明的名言警句或优美的句子。
- 8(2009•咸宁)在光滑墙壁上用网兜把足球挂在A点,足球与墙壁的接触点为B.在图中画出球受到的重力G、悬绳对球的拉力F的
- 9急求英语小短文内容:介绍名人或者家乡(宁波)或者古迹
- 10《孟子·告子下》中的“人恒过,然后能改”里的 过 是什么意思 ?
- 11有关于写图书馆的英语短文带翻译的
- 12按不同的感情色彩,把下列词语分成两类:鞠躬尽瘁、垂头丧气、活泼机灵、穷凶极恶
- 13我要在付款之前先核对一下账单的英语怎么说
- 14精原细胞在有丝分裂后期染色体数为几条?
- 15英文翻译一下(用作标题):孔子正走向世界
