硝酸铝和氢氧化钠,铝粉反应加热,为什么生成物有氨气?
 lixuefu_0012022-10-04 11:39:541条回答
lixuefu_0012022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 兵法营销学 共回答了18个问题
兵法营销学 共回答了18个问题 |采纳率88.9%- AL+NO3- +OH-=AL+ +NH3+H2O
AL要失去电子形成正离子,同理N就要得到电子,电荷守恒 - 1年前
相关推荐
- 将铁粉和铜粉的混合物投入到硝酸银与硝酸铝的混合液中,充分反应后,过滤,在滤渣中滴入盐酸有气体产生.用方程表求上述反应.应
将铁粉和铜粉的混合物投入到硝酸银与硝酸铝的混合液中,充分反应后,过滤,在滤渣中滴入盐酸有气体产生.用方程表求上述反应.应该想到什么.
 大漠孤烟ld1年前2
大漠孤烟ld1年前2 -
 GB哥哥 共回答了26个问题
GB哥哥 共回答了26个问题 |采纳率88.5%尽管硝酸铝会发生一定程度的水解,而使溶液呈酸性,但酸性很弱,所以硝酸根的氧化性难以体现,而主要是银离子的氧化性,也就是发生置换反应;
由于反应完后,滤渣加入盐酸有气体放出,意味着铁还没有反应完,这样可以肯定铜也没有反应.
2Ag(+) + Fe = 2Ag + Fe(2+)
Fe + 2H(+) = Fe(2+) + H2
即全程只有Fe在反应.1年前查看全部
- 硝酸铝显色测黄酮吸光度为什么试液放置时间长了测的吸光度会大幅度降低
硝酸铝显色测黄酮吸光度为什么试液放置时间长了测的吸光度会大幅度降低
如一相同样本配完后15min后测得吸光度为0.426,放置12小时之后测得的吸光度就只有0.202了? 闪耀550936591年前1
闪耀550936591年前1 -
 lxiongjun 共回答了19个问题
lxiongjun 共回答了19个问题 |采纳率89.5%这是这种显色的化合物不稳定,大多数比色用的显色液都有一定的稳定时间,有的长可以几天,有的只有十几分钟,你讲的就是这种,你必须在稳定时间内快速测完,才能保证分析的准确度.1年前查看全部
- 在硝酸铜、硝酸铝和硝酸银的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体上滴加稀硫酸时有气泡产生.则反应后所得
在硝酸铜、硝酸铝和硝酸银的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体上滴加稀硫酸时有气泡产生.则反应后所得溶液中含有的金属离子有 ;反应后溶液的质量比原混合溶液的质量 (填“大”或“小”);有关反应的化学方程
 shxlong1881年前1
shxlong1881年前1 -
 太阳雨夜 共回答了12个问题
太阳雨夜 共回答了12个问题 |采纳率91.7%反应后所得溶液中含有的金属离子有(Fe2+与Al3+) ;反应后溶液的质量比原混合溶液的质量 (小);有关反应的化学方程(Fe+Cu(NO3)2=Fe(NO3)2+Cu、Fe+2AgNO3=Fe(NO3)2+2Ag、Fe+H2SO4=FeSO4+H2↑)
向滤出的固体上滴加稀硫酸时有气泡产生.说明Fe是过量的,Cu、Ag全部被置换,溶液中有的是Fe2+与Al3+,Al3+与Fe不反应,因为Al比Fe活泼.
反应后溶液质量减小,因为Fe与Cu2+、Ag+反应会导致溶液质量减小.
Fe+Cu(NO3)2=Fe(NO3)2+Cu
56 64 进入Fe 56,出来Cu 64,溶液质量减少64-56=8
Fe+2AgNO3=Fe(NO3)2+2Ag
56 216 进入Fe 56,出来Ag 216,溶液质量减少216-56=1601年前查看全部
- 盐酸和硝酸铝反应吗?
 she0211年前6
she0211年前6 -
 白筑 共回答了16个问题
白筑 共回答了16个问题 |采纳率81.3%记住“强酸制弱酸”,你的问题很容易就解决了.
HCI的酸性弱于HNO3,所以盐酸和硝酸铝是不会发生反应生成HNO3的.1年前查看全部
- 化学方程式,氯化银 氧化铁 氧化铜 硫酸钠 硫酸钙 碳酸钾 硝酸铝 硝酸钾
化学方程式,氯化银 氧化铁 氧化铜 硫酸钠 硫酸钙 碳酸钾 硝酸铝 硝酸钾
化学方程式,氯化银 氧化铁 氧化铜 硫酸钠 硫酸钙 碳酸钾 硝酸铝 硝酸钾 氢氧化镁 氢氧化钠 伤口的记录1年前1
伤口的记录1年前1 -
 鬼酷狼好 共回答了27个问题
鬼酷狼好 共回答了27个问题 |采纳率92.6%AgCl,Fe2O3,CuO,Na2SO4,CaSO4,K2CO3,Al(NO)3,KNO3,Mg(OH)2,NaOH.1年前查看全部
- 铜丝浸入硝酸铝溶液中会发生什么现象?
 道曰云1年前1
道曰云1年前1 -
 dod1986 共回答了18个问题
dod1986 共回答了18个问题 |采纳率88.9%不反应
没有现象1年前查看全部
- 加热蒸干硫酸铝,硫酸铁,硫酸铜,灼烧后分别得到?加热氯化铁,氯化铝,硝酸铝溶液,灼烧后分别得到?
 恒砂世界1年前4
恒砂世界1年前4 -
 strong505 共回答了20个问题
strong505 共回答了20个问题 |采纳率80%这个问题主要考察的是强酸弱碱盐的水解过程,以及对其所对应的酸的挥发性的认识.
加热蒸干硫酸盐,得到的还是各自的硫酸盐产物,并不会发生变化,而加热蒸干活动性比较弱的金属的氯化物或者硝酸盐然后灼烧,得到的往往是这种金属对应的氧化物.
即硫酸铝,硫酸铁,硫酸铜→还是硫酸铝,硫酸铁,硫酸铜
氯化铁,氯化铝,硝酸铝→氧化铁,氧化铝,氧化铝
原因如下:
硫酸盐、氯化物、硝酸盐对应的都是硫酸盐酸硝酸这些强酸,当与铝、铁、铜形成金属盐的时候,溶液中会存在水解平衡,我以M(n+)来表示任意带n个正电荷的金属阳离子,因为它们对应的是弱碱,发生可逆的水解反应:
M(n+)+nH2O←→M(OH)n+nH+
如果溶液中多余的阴离子为SO42-,硫酸是不挥发性酸,加热过程对这个反应没有影响.
如果溶液中多余的阴离子为Cl-或者NO3-,与H+结合形成的HCl和HNO3是挥发性酸,便会在加热过程中不断随着蒸汽逸出,H+浓度会下降,导致水解反应的平衡被打破,平衡继续朝右方向移动,使得水解反应不断进行下去,最终蒸干溶液时得到的是该金属的氢氧化物M(OH)n,然后灼烧使氢氧化物分解,变成金属氧化物 2Fe(OH)3—灼烧→Fe2O3+3H2O
2Al(OH)3—灼烧→Al2O3+3H2O
Cu(OH)2—灼烧→CuO+H2O1年前查看全部
- 氯化铁溶液于过量氨水反应的方程式 氨水与硝酸铝溶液反应的离子方程式 碳酸氢钙溶液与稀硫酸溶液反应的离
氯化铁溶液于过量氨水反应的方程式 氨水与硝酸铝溶液反应的离子方程式 碳酸氢钙溶液与稀硫酸溶液反应的离
铝与硫酸铜溶液反应的离子方程式
碳酸氢钠溶液与氢氧化钠溶液反应的离子方程式
明矾与过量NaOh溶液反应的离子方程式 461711871年前2
461711871年前2 -
 fish841022 共回答了22个问题
fish841022 共回答了22个问题 |采纳率95.5%Fe(3+) +3NH3 H2O==Fe(OH)3↓+3NH4(+)(抱歉,这里我也不知道会不会继续反应,生成络合物)
Al(3+)+3NH3 H2O=Al(OH)3↓+3NH4(+)
Ca(2+)+2HCO3(-)+2H(+)+SO4(2-)=CaSO4↓+2H2O+2CO2↑
铝与硫酸铜溶液反应比较复杂,主要包括以下几个部分
1)2Al + 3Cu2+=2Al3+ +3Cu
在置换出铜后,和铝构成原电池,加快了为本来中通常条件下几乎不进行的铝和水的反应
即2) 2Al+6H2O=2AL3+ +3H2↑ +3OH-
而3) 2OH-+Cu2+==Cu(OH)2↓
(如果更严格一点的话,Cu(OH)2会在反应的过程中分解,理由是反应产生大量的热)
HCO3(-)+OH(-)=H2O+CO2↑
考虑明矾的水溶液,反应为
Al(3+)+ 4OH(-)==AlO2(-)+2H2O1年前查看全部
- (12分)现有下列9种物质:碳酸钠、氧化铁、二氧化硫、铜、氯气、氢氧化钾、硫酸、一氧化碳、硝酸铝,请将上述物质按要求完成
(12分)现有下列9种物质:碳酸钠、氧化铁、二氧化硫、铜、氯气、氢氧化钾、硫酸、一氧化碳、硝酸铝,请将上述物质按要求完成下列问题:
(1)用相应化学式填写下列空白:
属于酸性氧化物的有_____________,属于碱性氧化物的有_____________,
属于盐的有__________________________________。(用相应化学式填空)
(2)按要求完成下列方程式:
① 盐与酸反应_________________________________,
② 氧化物与碱反应_________________________________,
③ 属于氧化还原反应的化合反应_______________________________,
④ 不属于四种基本反应类型的氧化还原反应_______________________________。 清澈子1年前1
清澈子1年前1 -
 mocbin 共回答了23个问题
mocbin 共回答了23个问题 |采纳率95.7%(1)SO 2 , Fe 2 O 3 , Na 2 CO 3 , Al(NO 3 ) 3 (每空1分)
(2) (每空2分)Na 2 CO 3 + 2H 2 SO 4 = Na 2 SO 4 + CO 2 ↑ + H 2 O Cu + Cl 2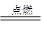 CuCl 2
CuCl 2
SO 2 + 2KOH = K 2 SO 3 + H 2 O 3CO+Fe 2 O 3 2Fe+3CO 2
2Fe+3CO 2
考查物质的分类、方程式的书写等
(1)能和碱反应生成盐和水的氧化物是酸性氧化物,所以SO 2 是酸性氧化物;能和酸反应生成盐和水的氧化物是碱性氧化物,所以Fe 2 O 3 是碱性氧化物;由酸根离子和金属阳离子或NH 4 + 构成的化合物是盐,因此Na 2 CO 3 , Al(NO 3 ) 3 都是盐。
(2)①硫酸和硫酸铝不反应,所以盐与酸反应的应该是硫酸和碳酸钠,方程式是Na 2 CO 3 + 2H 2 SO 4 = Na 2 SO 4 + CO 2 ↑ + H 2 O.
②氧化物与碱的反应只能是SO 2 和氢氧化钾,方程式是SO 2 + 2KOH = K 2 SO 3 + H 2 O。
③属于氧化还原反应的化合反应是铜和氯气,方程式是Cu + Cl 2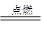 CuCl 2 。
CuCl 2 。
④不属于四种基本反应类型的氧化还原反应应该是CO还原氧化铁,即3CO+Fe 2 O 3 2Fe+3CO 2 。
1年前查看全部
2Fe+3CO 2 。
1年前查看全部
- (2012•铁岭)将一定质量的锌粉加入到硝酸铝、硝酸铜、硝酸银的混合溶液中,充分反应后过滤,所得滤渣中一定没有的物质是(
(2012•铁岭)将一定质量的锌粉加入到硝酸铝、硝酸铜、硝酸银的混合溶液中,充分反应后过滤,所得滤渣中一定没有的物质是( )
A.锌
B.铝
C.铜
D.银 baggio92851年前1
baggio92851年前1 -
 ericqian 共回答了25个问题
ericqian 共回答了25个问题 |采纳率84%解题思路:根据金属活动性顺序可知,这四金属的活动性强弱为:铝>锌>铜>银,当金属与其它金属的盐溶液发生置换反应时的规律是:位置在前的金属可以把位于其后的金属从其盐溶液中置换出来.因为位置在前的金属可以把位于其后的金属从其盐溶液中置换出来,锌的活动性位于铝之后,故活动性最强的铝一定不会被置换出来;
根据锌的质量的多少,可以依次置换出活动性最弱的银、铜,若锌过量,还有锌;因此滤渣中一定含有银,也可能是银和铜的混合物,也可能是银、铜、锌的混合物,但一定没有铝.
故选项为:B.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 题主要考查了对金属活动性顺序的灵活应用,只有活动性强的金属可以把活动性弱的金属从盐溶液中置换出来,并且置换的顺序是由弱到强,培养学生分析问题、解决问题的能力.1年前查看全部
- 用氨水可以分辨硝酸铝,硝酸银,
 llmboy4181年前2
llmboy4181年前2 -
 kubuku 共回答了24个问题
kubuku 共回答了24个问题 |采纳率75%硝酸铝+氨水-----------白色沉淀
硝酸银+氨水-----------先白色沉淀,后消失
硝酸钾+氨水----------无现象1年前查看全部
- 如何鉴别10种硝酸盐:硝酸银,硝酸汞,硝酸亚汞,硝酸铅,硝酸钠,硝酸镉,硝酸锌,硝酸铝,硝酸钾,硝酸锰.
 shweite1年前1
shweite1年前1 -
 乖乖男生 共回答了22个问题
乖乖男生 共回答了22个问题 |采纳率90.9%本题只能从鉴别金属离子着手,各取少量配成溶液待用.取适量溶液,分别加入氢氧化钠溶液,根据生成的沉淀颜色可判断出硝酸银、硝酸汞、硝酸亚汞、硝酸锰;硝酸钠和硝酸钾无现象,可利用焰色反应区分;其他为白色沉淀,继续加碱可溶的为硝酸锌和硝酸铝,二者可根据氢氧化物与氨水的反应再行区别;另外两个可根据金属硫化物的颜色来区别.1年前查看全部
- 镁+硝酸铝(11)溶液回答以下问题1.化学方程式2.离子方程式(若没有的话,请简述)3.可见变化(若可以的话请教我如何看
镁+硝酸铝(11)溶液
回答以下问题
1.化学方程式
2.离子方程式(若没有的话,请简述)
3.可见变化(若可以的话请教我如何看出它的变化) dfghjkfgghj1年前2
dfghjkfgghj1年前2 -
 林林_ 共回答了22个问题
林林_ 共回答了22个问题 |采纳率90.9%楼上的错了,镁不和水反应,镁把铝置换出来.
1,3Mg+2Al(NO3)3=3Mg(NO3)2+2Al
2,3Mg+2(Al3+)=3(Mg2-)+2Al
3,有白色金属析出(铝)1年前查看全部
- 急急急.铝和硫酸铜溶液反应,铜和硝酸铝反应,铜和硫酸银溶液反应祥细的实验现象,(生成甚麼不太重要)
 oo11111年前1
oo11111年前1 -
 福地之玉 共回答了21个问题
福地之玉 共回答了21个问题 |采纳率81%铝和硫酸铜溶液反应,溶液由蓝色变为无色,铝上有红色物质析出
铜和硝酸铝不反应,无现象
,铜和硫酸银溶液反应,溶液由无色变为蓝色,铜上有银白色物质析出1年前查看全部
- 在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,直至过量.下列表示氢氧化钠加入量(x)与溶液中沉淀的量(y)的关系
在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,直至过量.下列表示氢氧化钠加入量(x)与溶液中沉淀的量(y)的关系示意图中正确的是( )
A.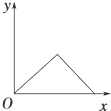
B.
C.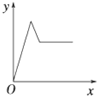
D.
 蛛儿1年前1
蛛儿1年前1 -
 梦幻阿姿 共回答了19个问题
梦幻阿姿 共回答了19个问题 |采纳率89.5%解题思路:在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,首先发生反应:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓,产生沉淀,随氢氧化钠溶液加入沉淀增大,当Al3+、Mg2+沉淀完全,沉淀最大,再加入氢氧化钠溶液,发生反应:Al(OH)3+OH-=AlO2-+2H2O,沉淀质量减小,最终沉淀为Mg(OH)2,再加入氢氧化钠溶液,沉淀质量不变,据此结合选项图象分析.
当Al3+沉淀完全时需加入6molOH-,即加入6molNaOH,生成Al(OH)32mol.
然后发生反应NH4++OH-=NH3・H2O;NH4+完全反应时需加入2molOH-,即加入2molNaOH,沉淀氢氧化铝的量不变.
最后继续滴加NaOH,2molAl(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,
当Al3+沉淀完全时需加入6molOH-,即加入6molNaOH,生成Al(OH)32mol.
然后发生反应NH4++OH-=NH3・H2O;NH4+完全反应时需加入2molOH-,即加入2molNaOH,沉淀氢氧化铝的量不变.
最后继续滴加NaOH,2molAl(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,直至过量.在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,首先发生反应:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓,产生沉淀,随氢氧化钠溶液加入沉淀增大,当Al3+、Mg2+沉淀完全,沉淀最大,再加入氢氧化钠溶液,发生反应:Al(OH)3+OH-=AlO2-+2H2O,沉淀质量减小,最终沉淀为Mg(OH)2,再加入氢氧化钠溶液,沉淀质量不变.
A、沉淀不能完全溶解,最终沉淀为Mg(OH)2,图象与实际不相符合,故A错误;
B、沉淀达最大量时,再加氢氧化钠溶液,氢氧化铝溶解,沉淀量减小,最后为定值,图象与实际不相符合,故B错误;
C、随氢氧化钠溶液加入沉淀增大,当Al3+、Mg2+沉淀完全,沉淀最大,再加入氢氧化钠溶液,发生反应:Al(OH)3+OH-=AlO2-+2H2O,沉淀质量减小,最后为定值,图象与实际相符合,故C正确;
D、当Al3+、Mg2+沉淀完全,沉淀最大,再加入氢氧化钠溶液,发生反应:Al(OH)3+OH-=AlO2-+2H2O,沉淀质量减小,最后为定值,图象与实际不相符合,故D错误.
故选:C.点评:
本题考点: 镁、铝的重要化合物.
考点点评: 考查化学反应图象、镁铝化合物的性质等,难度不大,清楚反应过程是关键,注意基础知识的掌握.1年前查看全部
- 在硝酸银和硝酸铝中加入锌粒,充分反应后过滤,所得的滤液中一定含有的溶质有哪些?可能含有的溶质有哪些?
在硝酸银和硝酸铝中加入锌粒,充分反应后过滤,所得的滤液中一定含有的溶质有哪些?可能含有的溶质有哪些?
请写出有关反应的化学方程式 我本有gg1年前2
我本有gg1年前2 -
 水草321 共回答了18个问题
水草321 共回答了18个问题 |采纳率100%所得的滤液中一定含有的溶质有硝酸铝和硝酸锌,可能有的溶质是硝酸银.
Zn+2AgNO3=Zn(NO3)2+2Ag1年前查看全部
- 硝酸铝与碳酸氢钠反应方程式
 fastdft1年前3
fastdft1年前3 -
 天使更爱美丽2 共回答了23个问题
天使更爱美丽2 共回答了23个问题 |采纳率100%Al(NO3)3+3NaHCO3==Al(OH)3+3CO2+3NaNO3
离子方程式
Al3+ + 3HCO3- == Al(OH)3+3CO21年前查看全部
- 在硝酸铜、硝酸铝和硝酸银的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体上滴加稀硫酸时有气
 桃依然1年前1
桃依然1年前1 -
 出三 共回答了22个问题
出三 共回答了22个问题 |采纳率86.4%如铁过量则有气泡1年前查看全部
- 请帮我写写硝酸钠,硝酸钙,硝酸镁,硝酸锌,硝酸铝,硝酸铜,硝酸铁,硝酸亚铁,硝酸铵 等化学式?
请帮我写写硝酸钠,硝酸钙,硝酸镁,硝酸锌,硝酸铝,硝酸铜,硝酸铁,硝酸亚铁,硝酸铵 等化学式?
不过 还有 硫酸钠,硫酸银,硫酸钙,硫酸镁,硫酸钡,硫酸铜,硫酸铁,硫酸亚铁;
麻烦了..谢谢 w326731年前1
w326731年前1 -
 爱薇儿 共回答了19个问题
爱薇儿 共回答了19个问题 |采纳率100%NaNO3
Ca(NO3)2
Mg(NO3)2
Zn(NO3)2
Al(NO3)3
Cu(NO3)2
Fe(NO3)3
Fe(NO3)2
NH4NO3
Na2SO4
Ag2SO4
CaSO4
MgSO4
BaSO4
CuSO4
Fe2(SO4)3
FeSO41年前查看全部
- 在黄酮提取过程中加入亚硝酸钠,硝酸铝,氢氧化钠的对照品是什么
在黄酮提取过程中加入亚硝酸钠,硝酸铝,氢氧化钠的对照品是什么
如果用水定容的话,空白会产生沉淀,而用乙醇的话就不会,为什么? fly829211年前1
fly829211年前1 -
 argentfox_BMW 共回答了13个问题
argentfox_BMW 共回答了13个问题 |采纳率100%如果用水定容的话,不会产生沉淀,我们最近做过这个实验.加入三种物质它会变色,本来是无色液体的,加入后会变成紫红色,偏红.1年前查看全部
- 硝酸铝的制备
 掌心温暖1年前2
掌心温暖1年前2 -
 buguanruhe 共回答了13个问题
buguanruhe 共回答了13个问题 |采纳率76.9%你要制备硝酸铝溶液、晶体还是无水盐?
溶液很简单,Al2O3与HNO3直接反应即可.
晶体也很简单,如上配制溶液后,浓缩冷却结晶即可.
无水盐很麻烦,晶体直接加热会水解.得用晶体和一些脱水剂共热才行,可用的脱水剂如SOCl2、乙酸酐等.1年前查看全部
- 在黄酮提取过程中加入硝酸铝的作用是什么
 单向逆行1年前1
单向逆行1年前1 -
 江上一舟 共回答了13个问题
江上一舟 共回答了13个问题 |采纳率100%硝酸铝络合分光光度法测定总黄酮的原理为:在中性或弱碱性及亚硝酸钠存在条件下,黄酮类化合物与铝盐生成螯和物,加入氢氧化钠溶液后显红橙色,在500波长处有吸收峰且符合定量分析的比尔定律,一般与芦丁标准系列比较定量.
如果细说,硝酸铝显色法是先用亚硝酸钠还原黄酮, 再加硝酸铝络合,最后加氢氧化钠溶液使黄酮类化合物开环,生成 2’羟基查耳酮而显色.它的显色原理发生在黄酮醇类成分邻位无取代的邻二酚羟基部位,不具有邻位无取代邻二酚羟基的黄酮醇类成分加入上述试剂时是不显色的.1年前查看全部
- 用化学用语表示:(1)5个磷原子______;硝酸铝______;最高价硫元素的氧化物______;不含金属元素的碱__
用化学用语表示:
(1)5个磷原子______;硝酸铝______;最高价硫元素的氧化物______;不含金属元素的碱______.
(2)根据下列要求写出相关的化学反应方程式:
双氧水和二氧化锰混合制氧气:______;
用烧碱溶液来吸收二氧化硫气体:______;
湿法炼铜:______;
用一氧化碳还原磁铁矿:______. lyxiaoK1年前1
lyxiaoK1年前1 -
 崇明岛主505 共回答了14个问题
崇明岛主505 共回答了14个问题 |采纳率92.9%(1)原子用元素符号表示,表示原子个数的数字要标在元素符号的前面,故5个磷原子可表示为:5P
根据化合价原则,硝酸铝可表示为:Al(NO 3 ) 3
最高价的硫元素显+6价,故其氧化物为:SO 3
不含金属元素的碱是氢氧化铵,一般以氨水的形式存在,其化学式为:NH 3 •H 2 O
(2)由题意知反应物、反应条件和生成物,其化学方程式为:2H 2 O 2
Mn O 2
.
2H 2 O+O 2 ↑;
用烧碱溶液来吸收二氧化硫气体,其反应物为氢氧化钠和二氧化硫,生成物为亚硫酸钠和水,其反应的化学方程式为:
SO 2 +2NaOH═Na 2 SO 3 +H 2 O
湿法炼铜就是用金属铁与铜的盐溶液反应,即铁与硫酸铜溶液(或氯化铜、硝酸铜溶液)反应,生成铜和硫酸亚铁(或氯化亚铁、硝酸亚铁).故答案为:Fe+CuSO 4 =FeSO 4 +Cu
磁铁矿的主要成分是四氧化三铁,四氧化三铁在高温下可和CO反应生成铁和二氧化碳.
所以答案为:Fe 3 O 4 +4CO
高温
.
3Fe+4CO 2
故答案为:
(1)5P;Al(NO 3 ) 3 ;SO 3 ;NH 3 •H 2 O
(2)2H 2 O 2
Mn O 2
.
2H 2 O+O 2 ↑;SO 2 +2NaOH═Na 2 SO 3 +H 2 O;Fe+CuSO 4 ═Cu+FeSO 4 ;
Fe 3 O 4 +4CO
高温
.
3Fe+4CO 21年前
61年前查看全部
- 碳酸的化学式碳酸亚硫酸磷酸盐酸硝酸钠硝酸银硝酸钙硝酸镁硝酸钡硝酸锌硝酸铝硝酸铜硝酸铁硝酸亚铁硫酸钾硫酸钠硫酸银硫酸钙硫酸
碳酸的化学式
碳酸
亚硫酸
磷酸
盐酸
硝酸钠
硝酸银
硝酸钙
硝酸镁
硝酸钡
硝酸锌
硝酸铝
硝酸铜
硝酸铁
硝酸亚铁
硫酸钾
硫酸钠
硫酸银
硫酸钙
硫酸镁
硫酸钡
硫酸锌
硫酸铝
硫酸铜
硫酸铁
硫酸亚铁
硫酸铵 拖把拖把1年前4
拖把拖把1年前4 -
 dengdeng000 共回答了15个问题
dengdeng000 共回答了15个问题 |采纳率93.3%碳酸 H2CO3
亚硫酸 H2SO3
磷酸 H3PO4
盐酸 HCl
硝酸钠 NaNO3
硝酸银 AgNO3
硝酸钙 Ca(NO3)2
硝酸镁 Mg(NO3)2
硝酸钡 Ba(NO3)2
硝酸锌 Zn(NO3)2
硝酸铝 Al(NO3)3
硝酸铜 Cu(NO3)2
硝酸铁 Fe(NO3)3
硝酸亚铁 Fe(NO3)2
硫酸钾 KNO3
硫酸钠 Na2SO4
硫酸银 Ag2SO4
硫酸钙 CaSO4
硫酸镁 MgSO4
硫酸钡 BaSO4
硫酸锌 ZnSO4
硫酸铝 Al2(SO4)3
硫酸铜 CuSO4
硫酸铁 Fe2(SO4)3
硫酸亚铁 FeSO4
硫酸铵 (NH3)2SO41年前查看全部
- 鉴别硝酸银、硝酸汞、硝酸铅、硝酸钠、硝酸镉、硝酸锌、硝酸铝、硝酸钾、硝酸锰
鉴别硝酸银、硝酸汞、硝酸铅、硝酸钠、硝酸镉、硝酸锌、硝酸铝、硝酸钾、硝酸锰
希望有人尽快回答我 清水苦莲1年前1
清水苦莲1年前1 -
 kitten20001216 共回答了20个问题
kitten20001216 共回答了20个问题 |采纳率100%利用焰色反应区分钠盐与钾盐,加入硫化钠,硝酸铝直接双水解,余下的利用硫化物的颜色及溶解性差异区分.具体反应自己查1年前查看全部
- 写出下列化学反应方程式和离子方程式1、硝酸铝溶液中加入过量氨水 2、在澄清石灰水中通入过量CO2
 bbf6cjmq1年前1
bbf6cjmq1年前1 -
 2004wang2004hui 共回答了20个问题
2004wang2004hui 共回答了20个问题 |采纳率90%Al(NO3 )3 + 3NH3·H2O = Al(OH)3 + 3NH4NO3
离子:Al3+ + 3NH3·H2O = Al(OH)3 + 3NH4+
Ca(OH)2 + 2CO2 = Ca(HCO3)2
离子式:OH- + CO2 =HCO3-
很高兴为您解答1年前查看全部
- 高一的化学题实验室制取AL(OH)3最好用A 硝酸铝和氢氧化钾溶液 B 硫酸铝和氢氧化钠溶液 C 氯化铝和氨水 D 氧化
高一的化学题
实验室制取AL(OH)3最好用A 硝酸铝和氢氧化钾溶液
B 硫酸铝和氢氧化钠溶液
C 氯化铝和氨水
D 氧化铝和水
要解释~! rickyzenglei1年前5
rickyzenglei1年前5 -
 chipi 共回答了19个问题
chipi 共回答了19个问题 |采纳率94.7%选C 不为什么,就是规定1年前查看全部
- 氯酸铜 氯酸铝 氯酸镁 硝酸铝 硝酸铜 硝酸钙 高锰酸钾等化学式..急
氯酸铜 氯酸铝 氯酸镁 硝酸铝 硝酸铜 硝酸钙 高锰酸钾等化学式..急
氯酸铜 氯酸铝 氯酸镁 硝酸铝 硝酸铜 硝酸钙 高锰酸钾 锰酸钾 硫酸 硫酸铜 硫酸铜晶体 硫酸铝.铁.钠.铵.钡.亚铁.钙.锌.(省略了硫酸2字)碳酸钙.镁.铝.钾.铁.铵.银.(略碳酸2字)磷酸 磷酸钙 磷酸铝 小苏打 碳酸铜.锌.铵.氢铵.钡.铝(略碳酸2字)磷酸钠.钾.铵(略磷酸2字) 急饿! 葡萄栖息1年前1
葡萄栖息1年前1 -
 啐溪礸 共回答了16个问题
啐溪礸 共回答了16个问题 |采纳率100%氯酸铜 CuCl2
氯酸铝 AlCl3
氯酸镁 MgCl2
硝酸铝 Al(NO3)3
硝酸铜 Cu(NO3)2
硝酸钙 Ca(NO3)2
高锰酸钾 KMnO4
锰酸钾 K2MnO4
硫酸 H2SO4
硫酸铜 CuSO4
硫酸铜晶体 CuSO4-5H2O
硫酸铝 Al2(SO4)3
硫酸铁 Fe2(SO4)3
硫酸钠 Na2SO4
硫酸铵 (NH4)2SO4
硫酸钡 BaSO4
硫酸亚铁 FeSO4
硫酸钙 CaSO4
硫酸锌 ZnSO4
碳酸钙 CaCO3
碳酸镁 MgCO3
碳酸铝 AL2(CO3)3
碳酸钾 K2CO3
碳酸铁 Fe2(CO3)3
碳酸铵 (NH4)2CO3
碳酸银 Ag2CO3
碳酸铜 CuCO3
碳酸锌 ZnCO3
碳酸氢铵 NH4HCO3
碳酸钡 BaCO3
磷酸 H3PO4
磷酸钙 Ca3(PO4)2
磷酸铝 AlPO4
磷酸钠 Na3PO4
磷酸钾 K3PO4
磷酸铵 (NH4)3PO4
小苏打 NaHCO31年前查看全部
- 氯化亚铁和硝酸铝的化学式?
 chriscelia1年前0
chriscelia1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 硝酸铝溶液中加入过量的氨水的离子方程式怎样
 wmj131年前1
wmj131年前1 -
 清风一席 共回答了18个问题
清风一席 共回答了18个问题 |采纳率88.9%Al3+ + 3NH3·H2O === Al(OH)3 ↓+ 3NH4+1年前查看全部
- 写出下列物质的化学式:氧化铝氯化铝氢氧化铝硫酸铝硝酸铝碳酸铝氯化钠氯化钾氯化镁氯化钙氯化铜氯化铵氧化钠氧化钾氧化镁氧化钙
写出下列物质的化学式:
氧化铝 氯化铝 氢氧化铝 硫酸铝 硝酸铝 碳酸铝 氯化钠 氯化钾 氯化镁 氯化钙 氯化铜 氯化铵 氧化钠 氧化钾 氧化镁 氧化钙 氧化钡 氧化汞 氢氧化钠 氢氧化钾 氢氧化镁 氢氧化钙 氢氧化铜 氢氧化铁 硝酸银 硝酸铜 硝酸镁 硝酸钙 硝酸铝 硝酸亚铁 硫酸钠 硫酸锌 硫酸镁 硫酸铜 硫酸钡 硫酸亚铁 碳酸钠 碳酸钾 碳酸钡 碳酸钙 碳酸铜 碳酸铵 氧化铁 氧化亚铁 氢氧化铁 氢氧化亚铁 硫酸铁 硫酸亚铁 二氧化碳 二氧化硫 二氧化锰 二氧化硅 四氧化三铁 五氧化二磷  bmmw181fn76c31年前1
bmmw181fn76c31年前1 -
 macrostru 共回答了21个问题
macrostru 共回答了21个问题 |采纳率90.5%解题思路:书写化学式的一般规律:先读后写 后读先写;金属前 非金属后;氧化物中氧在后,原子个数不能漏;含有两个或两个以上的原子团,书写时要添加括号,将原子团个数写在括号的右下角.
应用规则:化合物中,各元素正负化合价代数和为零.化合物化学式的写法是:正价在前,负价在后,十字交叉再约简,原子团个数不为1时要加括号.
故答案为:
氧化铝氯化铝氢氧化铝硫酸铝硝酸铝碳酸铝
Al2O3AlCl3Al(OH)3Al2(SO4)3Al(NO3)3Al2(CO3)3
氯化钠氯化钾氯化镁氯化钙氯化铜氯化铵
NaClKClMgCl2CaCl2CuCl2NH4Cl
氧化钠氧化钾氧化镁氧化钙氧化钡氧化汞
Na2OK2OMgOCaOBaOHgO
氢氧化钠氢氧化钾氢氧化镁氢氧化钙氢氧化铜氢氧化铁
NaOHKOHMg(OH)2Ca(OH)2Cu(OH)2Fe(OH)3
硝酸银硝酸铜硝酸镁硝酸钙硝酸铝硝酸亚铁
AgNO3Cu(NO3)2Mg(NO3)2Ca(NO3)2Al(NO3)3Fe(NO3)2
硫酸钠硫酸锌硫酸镁硫酸铜硫酸钡硫酸亚铁
Na2SO4ZnSO4MgSO4CuSO4BaSO4FeSO4
碳酸钠碳酸钾碳酸钡碳酸钙碳酸铜碳酸铵
Na2CO3K2CO3BaCO3CaCO3CuCO3(NH4)2CO3
氧化铁氧化亚铁氢氧化铁氢氧化亚铁硫酸铁硫酸亚铁
Fe2O3FeOFe(OH)3Fe(OH)2Fe2(SO4)3FeSO4
二氧化碳二氧化硫二氧化锰二氧化硅四氧化三铁五氧化二磷
CO2SO2MnO2SiO2Fe3O4P2O5点评:
本题考点: 化学式的书写及意义.
考点点评: 牢记书写化学式的一般规律和规则,遵循客观事实,多加练习.1年前查看全部
- 用硝酸铝制备氧化铝的化学方程式
 83呵呵虫1年前1
83呵呵虫1年前1 -
 落叶的美 共回答了18个问题
落叶的美 共回答了18个问题 |采纳率94.4%Al(NO3)3+3NH3·H2O=Al(OH)3↓+3NH4NO3
2Al(OH)3=△=Al2O3+3H2O1年前查看全部
- 下列碱和盐的反应能发生的是()A.氯化铜溶液中加入氢氧化铁 B.硝酸铝溶液中加入氨水C.氢氧化钾溶液中加入硫化铜 D.碳
下列碱和盐的反应能发生的是()
A.氯化铜溶液中加入氢氧化铁 B.硝酸铝溶液中加入氨水
C.氢氧化钾溶液中加入硫化铜 D.碳酸铵溶液中加入氢氧化钾 yt6664001年前5
yt6664001年前5 -
 myrega18_048 共回答了12个问题
myrega18_048 共回答了12个问题 |采纳率91.7%BD,A中氯化铜是弱碱性,氢氧化铁也是弱碱性,所以他们不反应.C中,CuS溶于酸而不能与碱反应.B中氨水加到硝酸铝中会使铝离子水解,D中碳酸铵中的铵根可以与氢氧根反应.所以选BD1年前查看全部
- 在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,直至过量。下列表示氢氧化钠加入量(X)与溶液中沉淀物的量(Y)的关
在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,直至过量。下列表示氢氧化钠加入量(X)与溶液中沉淀物的量(Y)的关系示意图中正确的是()

 第1001夜1年前1
第1001夜1年前1 -
 itisnonsense 共回答了10个问题
itisnonsense 共回答了10个问题 |采纳率100%1年前查看全部
- 不用任何试挤鉴别氢氧化钠,三氯化铁,硝酸银,硝酸铝,氯化镁,硝酸钠六种溶液
不用任何试挤鉴别氢氧化钠,三氯化铁,硝酸银,硝酸铝,氯化镁,硝酸钠六种溶液
如题. generalwg1年前2
generalwg1年前2 -
 路人乙b 共回答了7个问题
路人乙b 共回答了7个问题 |采纳率85.7%首先六种溶液中黄色溶液是三氯化铁,
然后将三氯化铁加入其它五种溶液中
有白色沉淀的是硝酸银(FeCl3+AgNO3==AgCl↓+Fe(NO3)3),
有红褐色沉淀的是氢氧化钠(FeCl3+3NaOH==Fe(OH)3↓+3NaCl).
再将硝酸银加入其余三种溶液,
有白色沉淀的是氯化镁(MgCl2+2AgNO3==2AgCl↓+Mg(NO3)2).
最后将氢氧化钠加入其余两种溶液中
那么有白色沉淀的是硝酸铝(Al(NO3)3+3NaOH=Al(OH)3↓+3NaNO3),
剩余的是硝酸钠.1年前查看全部
- 硝酸铝分解的化学方程式
 07621年前1
07621年前1 -
 yfgjbook 共回答了16个问题
yfgjbook 共回答了16个问题 |采纳率100%AlCl3,Al(SO4)3,KAl(SO4)2·12H2O,Al(NO3)3都能溶于水,溶于水电离出铝离子,水解产生Al(OH)3胶状物质,吸附水中悬浮杂质而有净水作用.
所以Al(NO3)3+3H2O===Al(OH)3+3HNO31年前查看全部
- 硝酸铝和过量的氢氧化钠溶液反应会怎样
 jiangfr7241年前3
jiangfr7241年前3 -
 业精于专 共回答了11个问题
业精于专 共回答了11个问题 |采纳率90.9%因为氢氧化钠溶液过量,与硝酸铝反应只能生成NaAlO2
化学方程式:Al(NO3)3 + 4NaOH(过量) = NaAlO2 + 3NaNO3 +2H2O
离子方程式:Al3+ + 4OH-=AlO2-+ 2H2O1年前查看全部
- 氯化钠.硫酸铜.盐酸.硝酸铝哪一个是不同的
 姜太公二世1年前4
姜太公二世1年前4 -
 我很很很蠢2 共回答了15个问题
我很很很蠢2 共回答了15个问题 |采纳率73.3%盐酸是酸,其他都是盐.
氯化钠是中性的,其他都是酸性的.
很纠结啊啊!1年前查看全部
- 下列物质有一项不同于其他项1.氯化钠、硫酸铜、盐酸、硝酸铝为什么
 moonriver07901年前1
moonriver07901年前1 -
 mint20003 共回答了22个问题
mint20003 共回答了22个问题 |采纳率72.7%盐酸,其他是盐.1年前查看全部
- 菊花中总黄酮提取中亚硝酸钠,硝酸铝,氢氧化钠的作用是什么
 ngxm1年前1
ngxm1年前1 -
 伤心的白衣天使 共回答了20个问题
伤心的白衣天使 共回答了20个问题 |采纳率100%如果用水定容的话,不会产生沉淀,我们最近做过这个实验.加入三种物质它会变色,本来是无色液体的,加入后会变成紫红色,偏红.1年前查看全部
- 硝酸铝和过量氢氧化钠不生成偏铝酸钠.
 i_m_no51年前1
i_m_no51年前1 -
 usa-jay 共回答了16个问题
usa-jay 共回答了16个问题 |采纳率93.8%题目是什么.1年前查看全部
- 菊花中总黄酮提取中亚硝酸钠,硝酸铝,氢氧化钠的作用是什么?不是现象,现象的话我也知道.
 沧海桑田1年前3
沧海桑田1年前3 -
 hlova1 共回答了15个问题
hlova1 共回答了15个问题 |采纳率100%亚硝酸钠合分光光度法测定总黄酮的原理为:在中性或弱碱性及亚硝酸钠存在条件下,黄酮类化合物与钠盐生成螯和物,加入氢氧化钠溶液后显红橙色,在500波长处有吸收峰且符合定量分析的比尔定律,一般与芦丁标准系列比较定量.如果细说,亚硝酸钠显色法是先用亚硝酸钠还原黄酮,再加亚硝酸钠络合,最后加氢氧化钠溶液使黄酮类化合物开环,生成 2’羟基查耳酮而显色.它的显色原理发生在黄酮醇类成分邻位无取代的邻二酚羟基部位,不具有邻位无取代邻二酚羟基的黄酮醇类成分加入上述试剂时是不显色的.1年前查看全部
- 分光光度法测定总黄酮是否一定加入亚硝酸钠 硝酸铝和氢氧化钠?
 勇敢的心ROCK1年前1
勇敢的心ROCK1年前1 -
 wusucces 共回答了16个问题
wusucces 共回答了16个问题 |采纳率81.3%必须 因为只有通过络合反应才能让总黄酮在分光光度计下产生一个稳定的吸收峰值1年前查看全部
- 硫酸铝和硝酸铝哪个和氢氧化钡反应生成的沉淀不完全消失,为什么会那样
 wish_her_happy1年前2
wish_her_happy1年前2 -
 绿玉杖痛打yy 共回答了16个问题
绿玉杖痛打yy 共回答了16个问题 |采纳率81.3%与硫酸铝生成的沉淀有硫酸钡和氢氧化铝,硫酸钡很稳定不发生变化,氢氧化铝不稳定;而与硝酸铝反应只产生氢氧化铝1年前查看全部
- 硝酸铝比色法中加入NaOH的作用?
 风雨泪1年前1
风雨泪1年前1 -
 chenchao557 共回答了21个问题
chenchao557 共回答了21个问题 |采纳率100%创造碱性环境啊……1年前查看全部
- 硝酸铝于烧碱反应生成什么?最高在和我解释下,烧碱过量又会生成什么…
 mfingk1年前1
mfingk1年前1 -
 我本善良1981 共回答了13个问题
我本善良1981 共回答了13个问题 |采纳率92.3%当加入少量烧碱时反应的离子方程式:Al3++3OH-=Al(OH)3(沉淀)如果继续加入烧碱:Al(OH)3+OH-=AlO2-+2H2O1年前查看全部
- 请问硝酸与铝的反应问题我想用铝和硝酸反应得到硝酸铝,请问应该用什么浓度的硝酸在多少度下反应才能得到尽可能多的硝酸铝?反应
请问硝酸与铝的反应问题
我想用铝和硝酸反应得到硝酸铝,请问应该用什么浓度的硝酸在多少度下反应才能得到尽可能多的硝酸铝?反应产物硝酸铝是不是全部都会跑到溶液里去?有没有可能有的铝原子既和硝酸根离子结合又和原来的铝结合住? faydehen1年前2
faydehen1年前2 -
 演戏的 共回答了17个问题
演戏的 共回答了17个问题 |采纳率100%稀硝酸,浓的会钝化~1年前查看全部
- 硝酸铝与氢氧化钾反应,铝离子全部转化为二氧化铝离子团是怎么发生的
硝酸铝与氢氧化钾反应,铝离子全部转化为二氧化铝离子团是怎么发生的
请写出化学反应方程式 第七度1年前1
第七度1年前1 -
 304826000 共回答了18个问题
304826000 共回答了18个问题 |采纳率83.3%Al(NO3)3+4KOH=KAlO2+3KNO3+2H2O1年前查看全部
- 下列离子方程式正确的是( )A.向烧碱溶液中滴加少量氯化铝溶液 Al3++4OH-=AlO2-+2H2OB.硝酸铝溶液
下列离子方程式正确的是( )
A.向烧碱溶液中滴加少量氯化铝溶液 Al3++4OH-=AlO2-+2H2O
B.硝酸铝溶液中加入过量氨水Al3++3NH3•H2O=Al(OH)3↓+3NH+4
C.氢氧化钡溶液和稀硫酸反应Ba2++SO42-=BaSO4↓
D.向酸性FeSO4溶液中滴入H2O2Fe2++H2O2+2H+=Fe3++2H2O 相约丹枫赴远冬1年前1
相约丹枫赴远冬1年前1 -
 剑客方无病 共回答了14个问题
剑客方无病 共回答了14个问题 |采纳率92.9%解题思路:A、烧碱过量,反应生成了偏铝酸根离子;
B、氨水碱性较弱,不能够溶解氢氧化铝,反应生成了氢氧化铝沉淀;
C、氢氧化钡与稀硫酸反应生成了硫酸钡沉淀和水,方程式中漏掉了水;
D、亚铁离子被双氧水氧化成了铁离子,离子方程式两边电荷不守恒.A、向烧碱溶液中滴加少量氯化铝溶液,氢氧根离子过量,反应生成了偏铝酸根离子,反应的离子方程式为:Az3++yO多-=AzO2-+2多2O,故A正确;
6、硝酸铝溶液中加入过量氨水,反应生成了氢氧化铝沉淀,反应的离子方程式为:Az3++3w多3•多2O=Az(O多)3↓+3w多y+,故6正确;
2、氢氧化钡溶液和稀硫酸反应,生成了硫酸钡沉淀和水,反应的离子方程式为:2多++SOy2-+6a2++2O多-=6aSOy↓+2多2O,故2错误;
上、向酸性六eSOy溶液中滴入多2O2,亚铁离子被氧化成铁离子,2六e2++多2O2+2多+=2六e3++2多2O,故上错误;
故选A6.点评:
本题考点: 离子方程式的书写.
考点点评: 本题考查了离子方程式的正误判断,题目难度中等,该题是高考中的高频题,侧重对学生能力的培养和训练,该题需要明确判断离子方程式常用方法(1)检查反应能否发生;(2)检查反应物、生成物是否正确;(3)检查各物质拆分是否正确;(4)检查是否符合守恒关系(如:质量守恒和电荷守恒等);(5)检查是否符合原化学方程式.1年前查看全部
大家在问
- 1关于付出才有回报的谚语和诗句
- 2已知x^2-4x+1=0;求(1)x^4-2x^3-8x^2+6x+2012 (2)5x^2-12x+2/x^2
- 3定义方程f(x)=f′(x)的实数根x0叫做函数f(x)的“新驻点”,若函数g(x)=2x,h(x)=lnx,φ(x)=
- 4图甲是果醋发酵装置.发酵初期不通气,溶液中有气泡产生;中期可以闻到酒香;后期接种醋酸菌,适当升高温度并通气,酒香逐渐变成
- 5浦东新区2013学年度第一学期期末质量测试初二物理
- 6There many interesting things to do in life(改为同意句)
- 7生活中,许多相关联的事物或普通的现象中也蕴含着一定的道理.以( )与( )为题,写一个故事或文章,体现出蕴含的道理.例如
- 8化简|2X-3|+|3X-5|-|5X+1|
- 9取少量的氯化铵晶体,放入试管中,在酒精灯火焰上微热,试管中出现白烟,试管口附近有白霜,白霜的成分是
- 101/2+1/6+1/12+1/20+……+1/56=?
- 11“你的目标是什么”用英文怎么讲Does the aim is that…?这个问句有没有错误?如果错了,那“你的目标是…
- 12一根电线,第一次用去2分之1后又用去2米,第二次用去剩下的2分之1后又用去2米,还剩下13米,
- 13一组对边平行而另一组对边相等的是等腰梯形,是对还是错?
- 14neither did I(改为同意句)限两个词
- 15在牛顿发现万有引力定律之后,测出引力常量的科学家是( )

