在电解食盐水之前,需要提纯食盐水.为了除去粗盐中的钙离子镁离子硫酸根离子及泥沙.要不同的方法!
 羊咩咩05262022-10-04 11:39:541条回答
羊咩咩05262022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 guan12 共回答了19个问题
guan12 共回答了19个问题 |采纳率94.7%- 先过滤除去泥沙,然后滴入氯化钡除去硫酸根离子,再加入氢氧化钠除去镁离子,最后通过碳酸钠出去钙离子.
既然要除去粗盐中的杂质,就不能引进其他的杂质,例如:氢氧化钾也可以除去镁离子,但除去后又要考虑除去钾离子.所以一般除去杂质不能引入其他杂质的. - 1年前
相关推荐
- 生活中用电解食盐水的方法制取消毒液运用了盐类的水解原理吗?
 爱慧娟1年前1
爱慧娟1年前1 -
 iowtg 共回答了24个问题
iowtg 共回答了24个问题 |采纳率87.5%不是1年前查看全部
- (12分)(1)右图为阳离子交换膜法电解饱和食盐水(滴有酚酞)原理示意图,E口产生H 2 ,电解食盐水的离子方程式为:
(12分)(1)右图为阳离子交换膜法电解饱和食盐水(滴有酚酞)原理示意图,E口产生H 2 ,电解食盐水的离子方程式为: ,溶液变红色的是: 区(填A或B)。
(2)电化腐蚀是钢铁发生腐蚀的主要原因,又可分为吸氧腐蚀和析氢腐蚀,发生吸氧腐蚀的电极反应式:负极 正极
(3)下图是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计
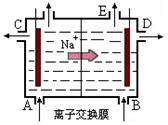
此装置中进行的反应是可逆反应,其反应方程式式为:AsO 4 3 - +2I - +H + AsO 3 3- +I 2 +H 2 O,向B杯中加入适量较浓的硫酸,发现G的指针向右偏移。此时A杯中的主要实验现象是 D电极上的电极反应式为
AsO 3 3- +I 2 +H 2 O,向B杯中加入适量较浓的硫酸,发现G的指针向右偏移。此时A杯中的主要实验现象是 D电极上的电极反应式为  悟真1年前1
悟真1年前1 -
 375545550 共回答了17个问题
375545550 共回答了17个问题 |采纳率94.1%1年前查看全部
- 某氯碱化工厂以电解食盐水产生化工原料氢氧化钠(反应原理为:2NaCl+2H2O 通电 .
某氯碱化工厂以电解食盐水产生化工原料氢氧化钠(反应原理为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑).若电解含氯化钠23.4t的食盐水,理论上可得到多少氢氧化钠?______.通电 . shbe20219651年前1
shbe20219651年前1 -
 王王王子 共回答了8个问题
王王王子 共回答了8个问题 |采纳率100%解题思路:由氯化钠的质量根据电解食盐水的化学方程式可以计算出生成氢氧化钠的质量.设理论上可得到氢氧化钠的质量为x.
2NaCl+2H2O
通电
.
2NaOH+H2↑+Cl2↑
117 80
23.4t x
[117/23.4t]=[80/x]
解得:x=16t
答:理论上可得到16t氢氧化钠.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题主要考查学生利用化学方程式进行计算的能力.解答时要注意解题的格式.1年前查看全部
- 工业制氯气是“电解食盐水”还是“电解饱和食盐水”?
 yxiaowen1年前1
yxiaowen1年前1 -
 369y1 共回答了16个问题
369y1 共回答了16个问题 |采纳率81.3%电解饱和食盐水.
如果电解的是不饱和食盐水,那么被电解的只是水,而并非氯化钠和水.1年前查看全部
- (10福建南安23.)(5分)某氯碱化工厂以电解食盐水产生化工原料氢氧化钠(反应原理为:2NaCl+2H 2 O 2Na
(10福建南安23.)(5分)某氯碱化工厂以电解食盐水产生化工原料氢氧化钠(反应原理为:2NaCl+2H 2 O
 2NaOH+H 2
2NaOH+H 2  +Cl 2
+Cl 2  )。若电解含氯化钠23.4t的食盐水,理论上可得到多少氢氧化钠?
)。若电解含氯化钠23.4t的食盐水,理论上可得到多少氢氧化钠? 等昵称1年前1
等昵称1年前1 -
 xq3382636 共回答了14个问题
xq3382636 共回答了14个问题 |采纳率92.9%1年前查看全部
- 某化工厂利用电解食盐水来生产下列产品,其中无法得到的是( ) A.NaOH B.H 2 SO 4 C.Cl 2 D.H
某化工厂利用电解食盐水来生产下列产品,其中无法得到的是( ) A.NaOH B.H 2 SO 4 C.Cl 2 D.H 2  无愧于心991年前1
无愧于心991年前1 -
 清34 共回答了24个问题
清34 共回答了24个问题 |采纳率87.5%食盐水的溶质是氯化钠,溶剂是水.含有钠元素、氯元素、氢元素和氧元素.根据质量守恒定律,在化学反应前后,元素的种类前后不变.所以反应后无法得到硫元素.
故选B1年前查看全部
- 请问:在电解食盐水的过程中,下列反应是怎样发生的?是交替进行还是有一定顺序?
请问:在电解食盐水的过程中,下列反应是怎样发生的?是交替进行还是有一定顺序?
2NaCl+2H2O 2NaOH+H2↑ +Cl2↑
Cl2+H2O==HCl +HclO
HClO== HCl+原生态氧
NaOH+Cl2 ==NaCl+NaHClO+H2O
HCl+NaOH ==NaCl++H2O 大红花花1年前3
大红花花1年前3 -
 红木老独 共回答了16个问题
红木老独 共回答了16个问题 |采纳率100%2NaCl+2H2O =2NaOH+H2↑ +Cl2↑
是这个 分步反应是
2(H+)+2e-=H2↑
2(Cl-)-2e-=Cl2↑1年前查看全部
- 为什么要用电解食盐水来制取Cl2而不是直接用电解熔融NaCl制取(还有Na单质呢..)
为什么要用电解食盐水来制取Cl2而不是直接用电解熔融NaCl制取(还有Na单质呢..)
不会是因为熔融NaCl比直接电解食盐水麻烦很多所以用了食盐水吧.. VISON0071年前1
VISON0071年前1 -
 langxj 共回答了23个问题
langxj 共回答了23个问题 |采纳率87%电解熔融氯化钠成本高1年前查看全部
- 在电解食盐水的过程中,下列反应是怎样发生的?是交替进行还是有一定顺序?
在电解食盐水的过程中,下列反应是怎样发生的?是交替进行还是有一定顺序?
0 - 离问题结束还有 14 天 1 小时
请问:在电解食盐水的过程中,下列反应是怎样发生的?是交替进行还是有一定顺序?
2NaCl+2H2O 2NaOH+H2↑ +Cl2↑
Cl2+H2O==HCl +HclO
HClO== HCl+原生态氧
NaOH+Cl2 ==NaCl+NaHClO+H2O
HCl+NaOH ==NaCl++H2O wangchangfu20081年前9
wangchangfu20081年前9 -
 闪若风 共回答了22个问题
闪若风 共回答了22个问题 |采纳率86.4%主要是这个反应:
2NaCl+2H2O 2NaOH+H2↑ +Cl2↑
其他的都可以忽略了.
NaOH+Cl2 ==NaCl+NaClO+H2O
这个反应也有时候被用于吸收氯气
Cl2+H2O==HCl +HclO
氯气溶于水只有一小部分反应
在用惰性电极电解饱和食盐水时
电解饱和食盐水:
2 NaCl + 2 H2O=电解=2 NaOH + Cl2↑+ H2↑
阳极产物:NaOH ,Cl2
阳极反应:2Cl--2e-=Cl2↑(氧化反应)
阴极产物:H2
阴极反应:2H++2e-=H2↑(还原反应)
离子方程式为
2Cl-+2H2O=Cl2+H2+2OH-
之后你所说的反应在电解时都不存在,因为如果有Cl2+H2O==HCl+HClO,电解时还会有2HClO=2HCl+O2 2HCl=H2+Cl2,如果有NaOH+Cl2 ==NaCl+NaClO+H2O和HCl+NaOH ==NaCl+H2O,还会有2NaCl+2H2O=2NaOH+H2+Cl2 ,所以这些反应不存在
2NaCl+2H2O (-电解->)2NaOH+H2↑ +Cl2↑ ---------(0)
Cl2+H2O==HCl +HClO -----------(1)
HClO== HCl+原生态氧 ------------(2)
NaOH+Cl2 ==NaCl+NaHClO+H2O --------(3)
HCl+NaOH ==NaCl++H2O -----------(4)
________________________________________
1.依据我自己对电解食盐水的试验和分析,以上这些反应都应该是
->同步且为瞬间化学反应.(1)(2)(3)(4)
->(1999年泽维尔因「用飞秒化学研究化学反应的过渡态」
->获得诺贝尔化学奖)(1飞秒=10-15秒)
2.电解作用-电流(电子移动)、水溶液之离子流动,应该都是
->化学反应过渡态的过程.(1)(2)
->Cl2+H2O==(>)HCl +HClO,PH值<4.0,反应式向右.
3.第(3)、(4)式系标准的化学「酸碱中和」反应.
4.不过我个人发现,电解超强酸水PH<2.7,
->实际上并无法测出「余氯」存在.
->因此判断,电解食盐水溶液最接近真实结果的反应式应该是
->2NaCl+2H2O -电解->(电极间中置离子膜)
=>【2NaOH+H2↑】(负极)+ 【HCl +HClO】(正极)
->我所采用的电解食盐水操作模式是电解槽电极板间有离子膜的...
->而且,是水流给水流动电解水溶液模式.再则,酸性离子水之PH值=2.2.3
->这样的试验结果,应该不同於传统电解食盐水的模式!
->请专业人士解析一下,酸性离子水中的内溶物?!...
5.超强酸性离子水(pH1年前查看全部
- 化学填空题,怎么填氯碱工业是利用电解食盐水生产--------为基础的工业体系2.电解前为除去mg2+ ca2+ so4
化学填空题,怎么填
氯碱工业是利用电解食盐水生产--------为基础的工业体系
2.电解前为除去mg2+ ca2+ so4 2-.加入试剂分别是-------,------,-------. 爆默1年前1
爆默1年前1 -
 随主意做事 共回答了19个问题
随主意做事 共回答了19个问题 |采纳率73.7%氯碱工业是利用电解食盐水生产【氯气】【烧碱】【氢气】为基础的工业体系
2. 电解前为除去mg2+ ca2+ so4 2-.加入试剂分别是氯化钡.氢氧化钠.碳酸钠.
除杂不引入新的杂质
加入Bacl2引进了Ba2+
所以用Na2co3除去1年前查看全部
- (2010•南安市质检)某氯碱化工厂以电解食盐水产生化工原料氢氧化钠(反应原理为:2NaCl+2H2O 通电&
(2010•南安市质检)某氯碱化工厂以电解食盐水产生化工原料氢氧化钠(反应原理为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑).若电解含氯化钠23.4t的食盐水,理论上可得到多少氢氧化钠?通电 . kuailejiuhao1年前1
kuailejiuhao1年前1 -
 小天的美容书 共回答了19个问题
小天的美容书 共回答了19个问题 |采纳率94.7%解题思路:由氯化钠的质量根据电解食盐水的化学方程式可以计算出生成氢氧化钠的质量.设理论上可得到氢氧化钠的质量为x.
2NaCl+2H2O
通电
.
2NaOH+H2↑+Cl2↑
117 80
23.4t x
[117/80]=[23.4t/x],x=16t
答:理论上可得到氢氧化钠的质量为16t.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题主要考查有关化学方程式的计算,难度较小.1年前查看全部
- 根据所学知识,回答下列问题:(1)写出电解食盐水的化学方程式,并用双线桥标出电子转移的方向和数目:______该反应中氧
根据所学知识,回答下列问题:
(1)写出电解食盐水的化学方程式,并用双线桥标出电子转移的方向和数目:______该反应中氧化剂为______,还原剂为______.
(2)漂白粉的有效成分是(填化学式)______.漂白粉溶于水后,受空气中的CO 2 作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程为______. coffeebook1年前1
coffeebook1年前1 -
 zcun 共回答了12个问题
zcun 共回答了12个问题 |采纳率100%1年前查看全部
- 电解食盐水和电解铝化钠溶液一样吗
 catkingsp81年前4
catkingsp81年前4 -
 蓝月亮弟弟 共回答了18个问题
蓝月亮弟弟 共回答了18个问题 |采纳率77.8%题目中的铝化钠,应该是氯化钠吧.
两者完全不一样.
电解氯化钠溶液的反应方程式:
2NaCl+2H2O=电解=2NaOH+2H2 ↑+2Cl2 ↑ 氯碱工业的反应,得到的产物是氢气、氯气和氢氧化钠.
电解氯化钠方程式:
2NaCl(熔融)=电解=2Na+ Cl2 ↑ 这是工业制取钠的反应,得到的产物是金属钠和氯气.1年前查看全部
- “盐泥”是粗盐提纯及电解食盐水过程中形成的工业“废料”.某工厂的盐泥含有NaCl(15~20%)、Mg(OH)2
“盐泥”是粗盐提纯及电解食盐水过程中形成的工业“废料”.某工厂的盐泥含有NaCl(15~20%)、Mg(OH)2
“盐泥”是粗盐提纯及电解食盐水过程中形成的工业“废料”.某工厂的盐泥含有NaCl(15~20%)、Mg(OH)2(15~20%)、CaCO3(5~10%)、BaSO4(30~40%)和不溶于酸的物质(10~15%),为了生产七水硫酸镁,设计了如图1工艺流程:
(1)电解食盐水前,为除去食盐水中的Mg2+、Ca2+、SO42-等杂质离子,下列试剂加入的先后顺序合理的是______(填序号).
A.碳酸钠、氢氧化钠、氯化钡B.碳酸钠、氯化钡、氢氧化钠
C.氢氧化钠、碳酸钠、氯化钡D.氯化钡、氢氧化钠、碳酸钠
(2)设食盐水中Mg2+的浓度为0.06mol?L-1,则加入氢氧化钠溶液后使溶液的pH≥______才会产生Mg(OH)2沉淀.(Ksp[Mg(OH)2]=6.0×10-12)
(3)反应器中发生两个转化,写出其中一个反应的化学方程式:______.
(4)三种化合物的溶解度(S)随温度变化曲线见图2,在过滤器中需要趁热过滤,其主要原因是______;
滤渣的主要成分有不溶于酸的物质、______和______.
(5)在蒸发浓缩器中通入高温水蒸汽并控制温度在100~110℃,蒸发结晶,此时析出的晶体主要是______.
(6)洗涤槽中洗涤晶体的目的是除去晶体表面的杂质,检验晶体表面的Cl-已洗涤干净的方法是______.
 zhaolufei1年前1
zhaolufei1年前1 -
 rabbitlaw 共回答了14个问题
rabbitlaw 共回答了14个问题 |采纳率71.4%(1)加入的钡离子可以由碳酸钠除去,故最后加碳酸钠,钡试剂与氢氧化钠先后都可,故加入试剂的顺序为先加NaOH,后加钡试剂,再加Na2CO3或先加钡试剂,后加NaOH,再加Na2CO3,所以D正确,
故答案为:D;
(2)根据氢氧化镁的溶度积表达式可知,c(OH-)2=
6.0×10?12
0.06=1×10-10,则:c(OH-)=
1×10?10=1×10-5mol/L,溶液中氢离子浓度为:1×10-9mol/L,溶液的pH=9.所以溶液的pH≥9时才出现氢氧化镁沉淀,
故答案为:9;
(3)盐泥中的碳酸钙、氢氧化镁分别与硫酸反应,反应的化学方程式为:CaCO3+H2SO4=CaSO4+H2O+CO2↑、Mg(OH)2+H2SO4=MgSO4+2H2O,
故答案为:CaCO3+H2SO4=CaSO4+H2O+CO2↑或Mg(OH)2+H2SO4=MgSO4+2H2O;
(4)在蒸发浓缩的过程中,温度大于40℃时随温度升高CaSO4?2H2O晶体溶解度降低,故会析出CaSO4?2H2O晶体,且应该趁热过滤,防止温度降低CaSO4?2H2O的溶解度变大,又重新溶解,不利于钙盐和镁盐的分离;同时温度降低硫酸镁晶体会析出,造成产量损失;滤渣的主要成分有不溶于酸的物质、盐泥中含有的硫酸钡,蒸发酒精出来的硫酸钙,
故答案为:温度较高时钙盐与镁盐分离更彻底(或高温下CaSO4?2H2O溶解度小);硫酸钡(BaSO4); 硫酸钙(CaSO4或CaSO4?2H2O);
(5)根据图象可知,在蒸发浓缩器中通入高温水蒸汽并控制温度在100~110℃蒸发结晶,CaSO4?2H2O的溶度积非常小,此时析出的晶体主要是:氯化钠,
故答案为:氯化钠(NaCl);
(6)滤液中的硫酸根离子会影响氯离子的干扰,应该先除去硫酸根离子,再检验氯离子,方法为:取最后洗涤液少许于试管中,滴加Ba(NO3)2溶液至不再产生沉淀,静置(1分),向上层清液滴加硝酸酸化的AgNO3溶液,无沉淀产生.
故答案为:取最后洗涤液少许于试管中,滴加Ba(NO3)2溶液至不再产生沉淀,静置,向上层清液滴加硝酸酸化的AgNO3溶液,无沉淀产生.1年前查看全部
- 工业上制取氯气大多采用电解食盐水的方法,以此为基础的工业称为“氯碱工业”,它是化工工业的一个重要支柱.电解氯化钠溶液时,
工业上制取氯气大多采用电解食盐水的方法,以此为基础的工业称为“氯碱工业”,它是化工工业的一个重要支柱.电解氯化钠溶液时,两电极上分别产生氯气和氢气,并在溶液中生成氯化钠,该反应的化学方程式为2NaCl+2H 2 O
2NaOH+Cl 2 ↑+H 2 ↑通电 .
某小型氯碱厂采用电解氯化钠溶液的方法生产氯气、氢气和氢氧化钠.该工厂平均每天生产80%的氢氧化钠15t.试问:
(1)该工厂平均每天至少需要多少吨的氯化钠?
(2)理论上,该工厂平均每天生产标准状况下的氯气的体积为多少升? 霸天龙1年前1
霸天龙1年前1 -
 天使的眼泪1103 共回答了15个问题
天使的眼泪1103 共回答了15个问题 |采纳率100%(1)设该工厂每天至少需要氯化钠的质量为x,可生产氯气的质量为y,则
2NaCl+2H 2 O
通电
.
2NaOH+H 2 ↑+Cl 2 ↑
117 80 71
x 80%×15t y
117
80 =
x
80%×15%
解得x=17.55t,
答:该工厂平均每天至少需要17.55吨的氯化钠;
(2)
80
71 =
80%×15t
y ,解得y=10.65t,
氯气的物质的量为
10.65×1 0 6
71g/mol =0.15×10 6 mol,
则该工厂平均每天生产标准状况下的氯气的体积为0.15×10 6 mol×22.4L/mol=3.36×10 6 L,
答:该工厂平均每天生产标准状况下的氯气的体积为3.36×10 6 L.1年前查看全部
- “盐泥”是粗盐提纯及电解食盐水过程中形成的工业“废料”.某工厂的盐泥含有NaCl(15~20%)、Mg(OH)2(15~
“盐泥”是粗盐提纯及电解食盐水过程中形成的工业“废料”.某工厂的盐泥含有NaCl(15~20%)、Mg(OH)2(15~20%)、CaCO3(5~10%)、BaSO4(30~40%)和不溶于酸的物质(10~15%),为了生产七水硫酸镁,设计了如图1工艺流程:

(1)电解食盐水前,为除去食盐水中的Mg2+、Ca2+、SO42-等杂质离子,下列试剂加入的先后顺序合理的是______(填序号).
A.碳酸钠、氢氧化钠、氯化钡B.碳酸钠、氯化钡、氢氧化钠
C.氢氧化钠、碳酸钠、氯化钡D.氯化钡、氢氧化钠、碳酸钠
(2)设食盐水中Mg2+的浓度为0.06mol•L-1,则加入氢氧化钠溶液后使溶液的pH≥______才会产生Mg(OH)2沉淀.(Ksp[Mg(OH)2]=6.0×10-12)
(3)反应器中发生两个转化,写出其中一个反应的化学方程式:______.
(4)三种化合物的溶解度(S)随温度变化曲线见图2,在过滤器中需要趁热过滤,其主要原因是______;
滤渣的主要成分有不溶于酸的物质、______和______.
(5)在蒸发浓缩器中通入高温水蒸汽并控制温度在100~110℃,蒸发结晶,此时析出的晶体主要是______.
(6)洗涤槽中洗涤晶体的目的是除去晶体表面的杂质,检验晶体表面的Cl-已洗涤干净的方法是______. saergwerherw1年前1
saergwerherw1年前1 -
 移花接木半步癫 共回答了20个问题
移花接木半步癫 共回答了20个问题 |采纳率90%解题思路:(1)根据除去钙离子用碳酸根离子进行沉淀,除去镁离子用氢氧根离子进行沉淀,除去硫酸根离子用钡离子沉淀,过量的钡离子需要用碳酸根离子除去进行分析;
(2)根据氢氧化镁的溶度积表达式计算出氢氧根离子浓度,再计算出溶液的pH;
(3)盐泥中的碳酸钙、氢氧化镁分别与稀硫酸反应;
(4)根据图2中温度对CaSO4•2H2O晶体的影响分析原因;滤渣中含有硫酸钡和硫酸钙等物质;
(5)根据温度对氯化钠、硫酸镁、硫酸钙晶体的影响判断析出的主要成分;
(6)检验氯离子通常使用硝酸银溶液,不过检验氯离子前需要除去干扰离子硫酸根离子.(1)加入的钡离子可以由碳酸钠除去,故最后加碳酸钠,钡试剂与氢氧化钠先后都可,故加入试剂的顺序为先加NaOH,后加钡试剂,再加Na2CO3或先加钡试剂,后加NaOH,再加Na2CO3,所以D正确,
故答案为:D;
(2)根据氢氧化镁的溶度积表达式可知,c(OH-)2=
6.0×10−12
0.06=1×10-10,则:c(OH-)=
1×10−10=1×10-5mol/L,溶液中氢离子浓度为:1×10-9mol/L,溶液的pH=9.所以溶液的pH≥9时才出现氢氧化镁沉淀,
故答案为:9;
(3)盐泥中的碳酸钙、氢氧化镁分别与硫酸反应,反应的化学方程式为:CaCO3+H2SO4=CaSO4+H2O+CO2↑、Mg(OH)2+H2SO4=MgSO4+2H2O,
故答案为:CaCO3+H2SO4=CaSO4+H2O+CO2↑或Mg(OH)2+H2SO4=MgSO4+2H2O;
(4)在蒸发浓缩的过程中,温度大于40℃时随温度升高CaSO4•2H2O晶体溶解度降低,故会析出CaSO4•2H2O晶体,且应该趁热过滤,防止温度降低CaSO4•2H2O的溶解度变大,又重新溶解,不利于钙盐和镁盐的分离;同时温度降低硫酸镁晶体会析出,造成产量损失;滤渣的主要成分有不溶于酸的物质、盐泥中含有的硫酸钡,蒸发酒精出来的硫酸钙,
故答案为:温度较高时钙盐与镁盐分离更彻底(或高温下CaSO4•2H2O溶解度小);硫酸钡(BaSO4); 硫酸钙(CaSO4或CaSO4•2H2O);
(5)根据图象可知,在蒸发浓缩器中通入高温水蒸汽并控制温度在100~110℃蒸发结晶,CaSO4•2H2O的溶度积非常小,此时析出的晶体主要是:氯化钠,
故答案为:氯化钠(NaCl);
(6)滤液中的硫酸根离子会影响氯离子的干扰,应该先除去硫酸根离子,再检验氯离子,方法为:取最后洗涤液少许于试管中,滴加Ba(NO3)2溶液至不再产生沉淀,静置(1分),向上层清液滴加硝酸酸化的AgNO3溶液,无沉淀产生.
故答案为:取最后洗涤液少许于试管中,滴加Ba(NO3)2溶液至不再产生沉淀,静置,向上层清液滴加硝酸酸化的AgNO3溶液,无沉淀产生.点评:
本题考点: 粗盐提纯.
考点点评: 本题主要考查了盐的性质、除杂的方法和原则,除去多种杂质时,要考虑加入试剂的顺序,为了保证将杂质除尽,所加试剂必须过量,因此为了不引进新的杂质,后面加入的试剂要能够除去前面所进入的过量试剂.1年前查看全部
- 电解食盐水的那个就是电解食盐水制作烧碱,氯气,氢气问题是说是在阴极处还是在阳极处生成烧碱,但我认为应该是阳极,因为烧碱的
电解食盐水的那个
就是电解食盐水制作烧碱,氯气,氢气
问题是说是在阴极处还是在阳极处生成烧碱,
但我认为应该是阳极,因为烧碱的关键应该在于有Na生成,NaCl会在阳极处分解,而Na会和未被电解的水反应
那么到底哪个对呢?为什么? sszspp1年前2
sszspp1年前2 -
 绝对零度001 共回答了16个问题
绝对零度001 共回答了16个问题 |采纳率81.3%Na+得电子变成Na.而阴极是指电路向外放出电子的地方.阴极放出电子给Na+,所以Na在阴极生成.Na和水反应,就有NaOH了.也可以考虑水和电线形成一个电路,Na+流向电源负极.1年前查看全部
- 请问,电解食盐水,怎样防止石墨电极脱落?
 wwnnyy5151年前1
wwnnyy5151年前1 -
 aa 共回答了15个问题
aa 共回答了15个问题 |采纳率100%你说的这个问题,是无法解决的,因为我已经经常做这个实验,开始的时候,就是用石墨电极做阳极的,问题就和楼主你遇到的一样,开始的时候没问题,但是实验进行久了,因为石墨长期泡在水里,开始溶解.产生这样的问题,是因为石墨电极,他看起来是一块致密的,但是其实它只是用一些东西和石墨粉混合之后,结合在一起而已,而且结合的程度也不高,所以就会溶解,这个问题是没有解决办法的,只能换别的材料做电极!
能用了做这实验阳极的材料不多,主要是因为氯气本来的腐蚀性已经极强了,还要加上电解,而且是阳极的情况下,能做阳极的材料极少,主要是铂,铱,铑这几个金属而已,就连黄金也不能,因为黄金也会快速溶解的!就这么多了,1年前查看全部
- 电解盐水水产生的绿色物质?我做电解食盐水的试验,正极使用的是铜线作电极,我知道如果电解食盐水在正极的金属铜会是失去电子而
电解盐水水产生的绿色物质?
我做电解食盐水的试验,正极使用的是铜线作电极,我知道如果电解食盐水在正极的金属铜会是失去电子而氧化,铜丝会变细,而产生了绿色的不容物质,但不知道绿色的是什么.
(用铁会有红褐色不容沉淀) self12101年前1
self12101年前1 -
 守候挚爱 共回答了20个问题
守候挚爱 共回答了20个问题 |采纳率100%阳极:Cu-2e-=Cu2+
阴极:2H++2e-=H2或者写成: 2H2O + 2e- = H2 + 2OH-
然后有:Cu2+ + 2OH- = Cu(OH)2(蓝色沉淀)
若用铁做阳极:Fe - 2e- = Fe2+
阴极:2H++2e-=H2或者写成: 2H2O + 2e- = H2 + 2OH-
然后有:Fe2+ + 2OH- = Fe(OH)2
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3(红褐色沉淀)1年前查看全部
- 在电解食盐水溶液,用去氯化钠1000g能生成氯气和氢气各多少克?
 文学青年19831年前1
文学青年19831年前1 -
 aa我还要 共回答了24个问题
aa我还要 共回答了24个问题 |采纳率91.7%2NaCl+2H2O=2NaOH+Cl2↑+H2↑
117 71 2
1000g x y
117/1000g=71/x=2/y
x=606.8g
y=17.1g1年前查看全部
- 某氯碱化工厂以电解食盐水产生化工原料氢氧化钠(反应原理为:2NaCl+2H2O 通电 .
某氯碱化工厂以电解食盐水产生化工原料氢氧化钠(反应原理为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑).若电解含氯化钠23.4t的食盐水,理论上可得到多少氢氧化钠?通电 . damon77041年前1
damon77041年前1 -
 liuxiang_9999 共回答了21个问题
liuxiang_9999 共回答了21个问题 |采纳率95.2%解题思路:由氯化钠的质量根据电解食盐水的化学方程式可以计算出生成氢氧化钠的质量.设理论上可得到氢氧化钠的质量为x.
2NaCl+2H2O
通电
.
2NaOH+H2↑+Cl2↑
117 80
23.4t x
[117/80]=[23.4t/x],x=16t
答:理论上可得到氢氧化钠的质量为16t.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题主要考查有关化学方程式的计算,难度较小.1年前查看全部
- 氯化钠是调味用的食盐的主要成分,也是重要的化工原料.电解食盐水可得氢氧化钠、氢气和氯气,写出电解食盐水的化学方程式2Na
氯化钠是调味用的食盐的主要成分,也是重要的化工原料.电解食盐水可得氢氧化钠、氢气和氯气,写出电解食盐水的化学方程式2NaCl+2H2O
2NaOH+H2↑+Cl2↑2NaCl+2H2O通电 .
2NaOH+H2↑+Cl2↑.通电 .
(1)海水中含有丰富的氯化钠,利用风吹日晒可以从海水中提取粗盐.风吹日晒的作用是有利于水分的蒸发有利于水分的蒸发;将含有较多杂质的粗盐溶解后,可通过过滤过滤操作除去其中的泥沙等不溶性杂质.
(2)某化学兴趣小组的同学在实验室用氢氧化钠溶液与稀盐酸做探究实验.为探究反应后溶液中溶质的可能组成,同学们作出了如下猜想:
①你认为甲、乙同学的猜想都合理吗?如有不合理的请说明理由.甲同学的猜想 可能只有氯化钠 乙同学的猜想 可能含有氯化钠、氢氧化钠和稀盐酸
②请你提出一个与甲、乙同学不同的猜想.你的猜想是可能含有氯化钠和稀盐酸可能含有氯化钠和稀盐酸.请设计简单的实验证明你的猜想成立.
(3)73g质量分数为20%的盐酸与127g氢氧化钠溶液恰好完全中和,试计算反应后所得溶液中溶质的质量分数. 錯步同行1年前1
錯步同行1年前1 -
 wodehelen 共回答了26个问题
wodehelen 共回答了26个问题 |采纳率88.5%电解食盐水的化学方程式为:2NaCl+2H2O
通电
.
2NaOH+H2↑+Cl2↑;
(1)从海水中提取粗盐,.风吹日晒有利于水分的蒸发;固体和液体的分离用过滤的方法;
(2)①乙不合理;因为反应后溶液中氢氧化钠和稀盐酸不能共存;②氢氧化钠溶液与稀盐酸反应,产物取决于反应物量的多少,当盐酸过量时,反应后溶液中溶质含有氯化钠和稀盐酸;
可以通过检验盐酸的存在来验证猜想:取少量反应后的溶液于试管中,滴加碳酸钠溶液,若有使石灰水变浑浊的气泡产生,则含有氯化钠和稀盐酸;
(3)HCl的质量:73g×20%=14.6g,设恰好完全反应后生成NaCl质量为x,
HCl+NaOH=NaCl+H2O
36.558.5
14.6g x
36.5
14.6g=
58.5
xx=23.4g
反应后总溶液质量为:73g+127g=200g
溶质的质量分数为:
23.4g
200g×100%=11.7.
答:反应后所得溶液溶质的质量分数为11.7%.1年前查看全部
- 工业上有电解食盐水的方法得到烧碱,同时放岀H2和氯气.(写出化学式)
 530hgf3211年前1
530hgf3211年前1 -
 bless_janey 共回答了23个问题
bless_janey 共回答了23个问题 |采纳率91.3%2NaCl + 2H2O===电解===2NaOH + H2 + Cl21年前查看全部
- (2012•烟台一模)氯碱工业常利用阳离子交换膜电解食盐水,下列说法不正确的是( )
(2012•烟台一模)氯碱工业常利用阳离子交换膜电解食盐水,下列说法不正确的是( )
A.随着电解的进行,c(NaCl)降低,需不断补充饱和食盐水
B.电解过程中采用增大阳极区溶液pH的方法,可以减少Cl2在水中的溶解量
C.阳离子交换膜的作用是阻止OH-移向阳极,以使氢氧化钠在阴极区富集
D.阳极表面用钛氧化物涂层处理,目的是降低电解产物Cl2对电极的腐蚀 xatvgy1年前1
xatvgy1年前1 -
 孔雀之家 共回答了17个问题
孔雀之家 共回答了17个问题 |采纳率94.1%解题思路:A.电解食盐水时,阳极发生氧化反应,消耗NaCl,则应在阳极补充NaCl;
B.增大阳极区溶液pH,会增大Cl2在水中的溶解量;
C.电解时,阳离子经过离子交换膜向阴极区移动;
D.Cl2具有强氧化性,能氧化电极材料.A.电解食盐水时,阳极发生氧化反应,消耗NaCl,则应在阳极补充NaCl,故A正确;
B.增大阳极区溶液pH,会增大Cl2在水中的溶解量,故B错误;
C.电解时,阳离子经过离子交换膜向阴极区移动,所以阳离子交换膜的作用是阻止OH-移向阳极,以使氢氧化钠在阴极区富集,故C正确;
D.Cl2具有强氧化性,能氧化电极材料,则阳极表面用钛氧化物涂层处理来保护电极材料,故D正确;
故选B.点评:
本题考点: 电解原理.
考点点评: 本题考查电解原理,侧重于氯碱工业的考查,注意把握题给信息,阳离子交换膜为解答该题的关键,注意审题,题目难度不大.1年前查看全部
- 电解制氢电解食盐水 可以制氢,但同时制出的氯多吗?怎么处理?(我在家里提取氢,但我可不想被毒死!)谁能帮我解决这个问题?
 long1631年前1
long1631年前1 -
 刘13会功 共回答了28个问题
刘13会功 共回答了28个问题 |采纳率78.6%关键是你怎么收集了
氢气这个东西这么便宜用得着用电么.
工业上把空气压缩 然后按照熔点不同提取出来的氢气 比你那个简陋实验设备制取出来的氢气要纯得多 而且很便宜 而且在一般在各种工厂都能用的到
主要是气焊用的 要比较好买到1年前查看全部
- 电解食盐水时的怪现象我在家自己用变压器(6V)电解食盐水,正极用导线连接碳棒(电池中拔出来的),负极就用普通电线,但是电
电解食盐水时的怪现象
我在家自己用变压器(6V)电解食盐水,正极用导线连接碳棒(电池中拔出来的),负极就用普通电线,
但是电解一定时间发现,碳棒变细了,食盐水中有大量黑色小颗粒沉积,连接碳棒的电线内芯全变黑了(原来可是闪亮的铜线)
请问
黑色小颗粒沉积是什么(碳粒?),为什么连接碳棒的电线内芯全变黑了(碳向上游走了?) 雪天好心情1年前4
雪天好心情1年前4 -
 rzy909 共回答了17个问题
rzy909 共回答了17个问题 |采纳率94.1%碳棒变细是因为在产生气泡的时候生成的气泡冲击了碳棒表面的物质,使其脱落.电线内芯变黑可能是氧化了,或生产电泳,或生成了铜的盐类1年前查看全部
- 根据所学知识,回答下列问题:(1)写出电解食盐水的化学方程式,并用双线桥标出电子转移的方向和数目:______该反应中氧
根据所学知识,回答下列问题:
(1)写出电解食盐水的化学方程式,并用双线桥标出电子转移的方向和数目:______该反应中氧化剂为______,还原剂为______.
(2)漂白粉的有效成分是(填化学式)______.漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程为______. lnsygx1年前1
lnsygx1年前1 -
 helingjiayou 共回答了26个问题
helingjiayou 共回答了26个问题 |采纳率88.5%解题思路:(1)电解食盐水时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时生成氢氧化钠;得电子化合价降低的物质是氧化剂,失电子化合价升高的物质是还原剂.
(2)漂白粉的有效成分是次氯酸钙;次氯酸钙和二氧化碳、水反应生成碳酸钙和次氯酸.(1)电解食盐水时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时生成氢氧化钠,
 ;得电子化合价降低的物质是水,所以水是氧化剂,失电子化合价升高的物质是氯化钠,所以氯化钠是还原剂.
;得电子化合价降低的物质是水,所以水是氧化剂,失电子化合价升高的物质是氯化钠,所以氯化钠是还原剂.
故答案为: ;水;氯化钠;
;水;氯化钠;
(2)漂白粉的有效成分是Ca(ClO)2;次氯酸钙和二氧化碳、水反应生成碳酸钙和次氯酸,反应方程式为
Ca(ClO)2+H2O+CO2═CaCO3↓+2HClO.
故答案为:Ca(ClO)2;Ca(ClO)2+H2O+CO2═CaCO3↓+2HClO.点评:
本题考点: 氧化还原反应;化学方程式的书写.
考点点评: 本题考查了电解食盐水的方程式、氧化剂和还原剂的判断等知识点,注意审题,次氯酸钙要求写化学式,不能写文字,属于易错点.1年前查看全部
- 工业上制取氯气大多采用电解食盐水的方法,以此为基础的工业称为“氯碱工业”,它是化工工业的一个重要支柱.电解氯化钠溶液时,
工业上制取氯气大多采用电解食盐水的方法,以此为基础的工业称为“氯碱工业”,它是化工工业的一个重要支柱.电解氯化钠溶液时,两电极上分别产生氯气和氢气,并在溶液中生成氯化钠,该反应的化学方程式为2NaCl+2H2O
2NaOH+Cl2↑+H2↑通电 .
某小型氯碱厂采用电解氯化钠溶液的方法生产氯气、氢气和氢氧化钠.该工厂平均每天生产80%的氢氧化钠15t.试问:
(1)该工厂平均每天至少需要多少吨的氯化钠?
(2)理论上,该工厂平均每天生产标准状况下的氯气的体积为多少升? weigy1年前1
weigy1年前1 -
 zxhyxcz 共回答了23个问题
zxhyxcz 共回答了23个问题 |采纳率87%解题思路:(1)根据化学反应方程式,将氢氧化钠的质量代入计算来求需要的氯化钠;
(2)先利用化学反应方程式,将氢氧化钠的质量代入计算氯气的质量,再计算其标准状况下的体积.(1)设该工厂每天至少需要氯化钠的质量为x,可生产氯气的质量为y,则
2NaCl+2H2O
通电
.
2NaOH+H2↑+Cl2↑
117 80 71
x 80%×15t y
[117/80]=[x/80%×15%]
解得x=17.55t,
答:该工厂平均每天至少需要17.55吨的氯化钠;
(2)[80/71]=[80%×15t/y],解得y=10.65t,
氯气的物质的量为
10.65×106
71g/mol=0.15×106mol,
则该工厂平均每天生产标准状况下的氯气的体积为0.15×106mol×22.4L/mol=3.36×106L,
答:该工厂平均每天生产标准状况下的氯气的体积为3.36×106L.点评:
本题考点: 电解原理;化学方程式的有关计算.
考点点评: 本题考查学生利用电解的化学反应方程式来计算,较简单,学生将氯化钠的质量代入化学反应方程式计算即可.1年前查看全部
- 用铜做电极电解食盐水的蓝色物是什么?
 huang82151年前3
huang82151年前3 -
 mm有ww 共回答了11个问题
mm有ww 共回答了11个问题 |采纳率100%氢氧化铜1年前查看全部
- 铜丝做电极,电解食盐水,生成黄色物质,是沉淀还是溶液,(四氯合铜离子和三氯合铜离子)还是氧化亚铜
 创意肿肩1年前1
创意肿肩1年前1 -
 帕格蒙形成 共回答了16个问题
帕格蒙形成 共回答了16个问题 |采纳率87.5%黄色沉淀因该是氧化亚铜,是一种红黄色的不溶于水的物质.
【因为氧化铜是黑色的,所以可以坚决地排除,因此最可能的还是氧化亚铜.】1年前查看全部
- 我用两个锌电极电解食盐水,结果生成了黄色沉淀,百度上说氢氧化锌是白色的,怎么生成的是黄的?
 山楂罐头1年前1
山楂罐头1年前1 -
 爱的香气 共回答了19个问题
爱的香气 共回答了19个问题 |采纳率94.7%确切地说,氢氧化锌是无定型白色粉末或浅黄色粉末.
因为稳定晶体是白色的,所以很多资料会直接写它是白色的.但是你试验生成的晶体可能颗粒极小,结构还没有达到稳定状态,所以会是浅黄色.如果你有兴趣把淡黄色粉末放置一段时间,或者加热促进变化,你就会发现它最终会变成白色.
很多物质都是这样的,我是化学系的,见过很多.比如说二氧化锰是黑色的,但是刚制出来很可能是棕色的,这个我自己做实验就遇到过.1年前查看全部
- 氯化钠是调味用的食盐的主要成分,也是重要的化工原料.电解食盐水可得氢氧化钠、氢气和氯气,写出电解食盐水的化学方程式2Na
氯化钠是调味用的食盐的主要成分,也是重要的化工原料.电解食盐水可得氢氧化钠、氢气和氯气,写出电解食盐水的化学方程式2NaCl+2H2O
2NaOH+H2↑+Cl2↑通电 .2NaCl+2H2O.
2NaOH+H2↑+Cl2↑通电 .
(1)海水中含有丰富的氯化钠,利用风吹日晒可以从海水中提取粗盐.风吹日晒的作用是______;将含有较多杂质的粗盐溶解后,可通过______操作除去其中的泥沙等不溶性杂质.
(2)某化学兴趣小组的同学在实验室用氢氧化钠溶液与稀盐酸做探究实验.为探究反应后溶液中溶质的可能组成,同学们作出了如下猜想:
①你认为甲、乙同学的猜想都合理吗?如有不合理的请说明理由.甲同学的猜想 可能只有氯化钠 乙同学的猜想 可能含有氯化钠、氢氧化钠和稀盐酸
②请你提出一个与甲、乙同学不同的猜想.你的猜想是______.请设计简单的实验证明你的猜想成立.
(3)73g质量分数为20%的盐酸与127g氢氧化钠溶液恰好完全中和,试计算反应后所得溶液中溶质的质量分数. frogs1年前1
frogs1年前1 -
 飞火流银 共回答了21个问题
飞火流银 共回答了21个问题 |采纳率85.7%解题思路:根据化学反应原理书写电解方程式;(1)根据晒盐的原理以及混合物分离的方法分析;
(2)对反应后溶液组成成分进行猜想时,可根据反应物恰好完全反应或反应物之一过量进行分析,判断出反应后溶液的可能组成;
(3)根据酸碱中和反应的原理,酸与碱完全反应所需的酸与碱的量相等来计算.电解食盐水的化学方程式为:2NaCl+2H2O
通电
.
2NaOH+H2↑+Cl2↑;
(1)从海水中提取粗盐,.风吹日晒有利于水分的蒸发;固体和液体的分离用过滤的方法;
(2)①乙不合理;因为反应后溶液中氢氧化钠和稀盐酸不能共存;②氢氧化钠溶液与稀盐酸反应,产物取决于反应物量的多少,当盐酸过量时,反应后溶液中溶质含有氯化钠和稀盐酸;
可以通过检验盐酸的存在来验证猜想:取少量反应后的溶液于试管中,滴加碳酸钠溶液,若有使石灰水变浑浊的气泡产生,则含有氯化钠和稀盐酸;
(3)HCl的质量:73g×20%=14.6g,设恰好完全反应后生成NaCl质量为x,
HCl+NaOH=NaCl+H2O
36.558.5
14.6g x
[36.5/14.6g=
58.5
x]x=23.4g
反应后总溶液质量为:73g+127g=200g
溶质的质量分数为:[23.4g/200g]×100%=11.7.
答:反应后所得溶液溶质的质量分数为11.7%.点评:
本题考点: 氯化钠与粗盐提纯;实验探究物质的组成成分以及含量;过滤的原理、方法及其应用;有关溶质质量分数的简单计算;根据化学反应方程式的计算.
考点点评: 本题是一道综合题,要求学生熟悉粗盐提纯的原理,若对反应后溶液组成成分进行猜想时,可根据反应物恰好完全反应或反应物之一过量进行分析,判断出反应后溶液的可能组成,并且要求学生熟练掌握酸碱中和反应的原理,并根据酸碱中和反应计算所需酸或碱的质量以及生成物的质量或质量分数.1年前查看全部
- 电解食盐水,化学方程式,现象
 陈韵竹1年前4
陈韵竹1年前4 -
 174872836 共回答了20个问题
174872836 共回答了20个问题 |采纳率85%2NaCl+2H2O=Cl2↑+H2 ↑+2NaOH
两极都有气泡,
阴极周围滴加酚酞变红1年前查看全部
- [化学-选修化学与技术]请回答氯碱的如下问题:(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品.理论上
[化学-选修化学与技术]
请回答氯碱的如下问题:
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品.理论上k=______(要求计算表达式和结果);
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用.精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______(填序号)
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过.
①图中X、Y分别是______、______(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小______;
②分别写出燃料电池B中正极、负极上发生的电极反应正极:______,负极:______;
③这样设计的主要节(电)能之处在于(写出2处)______、______. sdjnmds1年前1
sdjnmds1年前1 -
 wuqunfei 共回答了18个问题
wuqunfei 共回答了18个问题 |采纳率77.8%解题思路:(1)根据电解饱和食盐水的化学方程式2NaCl+2H2O
2NaOH+H2↑+Cl2↑,即可得到k=电解 .
=[71/80],以此计算;M(Cl2) 2M(NaOH)
(2)抓住除钡离子要放在除碳酸根离子前即可得到顺序关系:③①②;
(3)本题突破口在于B燃料电池这边,通空气一边为正极(还原反应),那么左边必然通H2,这样Y即为H2;再转到左边依据电解饱和食盐水的化学方程式可知唯一未知的X必然为Cl2;A中的NaOH进入燃料电池正极再出来,依据O2+4e-+2H2O=4OH-可知NaOH浓度增大.(1)电解饱和食盐水的化学方程式为2NaCl+2H2O
电解
.
2NaOH+H2↑+Cl2↑,则理论上k=
M(Cl2)
2M(NaOH)=[71/80]=1:1.13或0.89,
故答案为:
M(Cl2)
2M(NaOH)=[71/80]=1:1.13或0.89;
(2)应先加入过量BaCl2,除去SO42-,然后加过量Na2CO3,可除去Ca2+、Mg2+、Fe3+等,过滤后加入盐酸可除去Na2CO3,故答案为:③①②;
(3)①通空气一边为正极(还原反应),那么左边必然通H2,这样Y即为H2,则电解池左边应为阳极,生成Cl2,由于燃料电池正极发生O2+4e-+2H2O=4OH-,燃料电池中的离子膜只允许阳离子通过,而燃料电池中正极氧气得到电子产生OH-,所以反应后氢氧化钠的浓度升高,即a%小于b%,可知NaOH浓度增大,
故答案为:Cl2;H2;a%小于b%;
②燃料电池中正极氧气得电子发生还原反应,电极反应式为O2+4e-+2H2O=4OH-,负极氢气失电子发生氧化反应,电极反应式为H2-2e-+2OH-=2H2O,
故答案为:O2+4e-+2H2O=4OH-;H2-2e-+2OH-=2H2O;
③据装置特点及反应过程可知,这样设计的优点是燃料电池可以补充电解池消耗的电能;提高产出碱液的浓度;降低能耗等,
故答案为:燃料电池可以补充电解池消耗的电能;提高产出碱液的浓度.点评:
本题考点: 氯碱工业;原电池和电解池的工作原理;粗盐提纯.
考点点评: 本题前半部分基本就是氯碱工艺的再现,但后半部把原电池、电解的相关知识巧妙地融合在一起,使试题表现出了较好的创意,学习中要把氯碱工业的流程及教材电解饱和食盐水实验涉及到的各个知识点要理顺、理细,如饱和食盐水的精制、电解时的现象、电极产物检验、物质计算、电极反应式及电解反应的化学方程式书写等知识要清晰才行,避免一带而过、简单处理.1年前查看全部
- 用铁导线电解食盐水,产生了青绿色沉淀.为啥
用铁导线电解食盐水,产生了青绿色沉淀.为啥
沉淀也可能是黄绿色,告诉我化学方程式 yj652152821年前1
yj652152821年前1 -
 某人还是FH 共回答了17个问题
某人还是FH 共回答了17个问题 |采纳率82.4%负极:2Fe - 4e- =2Fe2+
正极:2H+ +2e- =H2
Fe2+与水中的OH-生成沉淀
Fe2+ + 2OH- =Fe(OH)2↓
还有铁单质,暂时不会有三价的Fe3+
因为Fe3+ + Fe=2Fe2+1年前查看全部
- 求电解食盐水发生的所有反应生成的Cl2会与水反应吗?
 冬瓜超大1年前1
冬瓜超大1年前1 -
 九月淡淡忧愁 共回答了23个问题
九月淡淡忧愁 共回答了23个问题 |采纳率100%用惰性电极:
2NaCl+2H2O=(通电)=2NaOH+Cl2+H2
用铜电极正极有副反应:
Cu-2e==Cu2+
发生1年前查看全部
- 吸氧腐蚀为什么是O2得电子而不是水电离的H+得电子?电解食盐水又是水电离的H+得电子而不是O2?
 Isabel20061年前2
Isabel20061年前2 -
 相约60年 共回答了14个问题
相约60年 共回答了14个问题 |采纳率64.3%得电子能力即氧化性大小,吸氧腐蚀中O2是比水电离的H+强得多的氧化剂,因此是正极O2得电子.请注意吸氧腐蚀是自发且缓慢进行的原电池反应,氧气有充足时间溶于水.而电解食盐水是从外界输入能量使得反应大量快速进行的电解池反应,此时就是强行要以水作为反应物之一,且水中根本来不及溶解那么多量的氧气,就以水作为得电子的氧化剂(阳极的反应物)了.1年前查看全部
- 在电解食盐水实验中为什么NaOH是阴极产物
 pineapplecf1年前1
pineapplecf1年前1 -
 crossrainbow1234 共回答了15个问题
crossrainbow1234 共回答了15个问题 |采纳率93.3%由于氢离子在 阴极上得到电子而生成氢气,破坏了附近的水的电离平衡,促进了水继续电离,结果阴极区因溶液中氢氧根浓度的增大而呈碱性1年前查看全部
- 根据质量守恒定理,电解食盐水不可能得到的物质是() A.H2 B.CI2 C.NaOH D.Na2SO4
 anjnelee1年前3
anjnelee1年前3 -
 济南玉米mm 共回答了26个问题
济南玉米mm 共回答了26个问题 |采纳率76.9%D.Na2SO4;
因为反应物没有硫元素.(根据质量守恒定律,反应前后元素的种类应该相同).1年前查看全部
- 用惰性电极电解食盐水产生氢气快还是氯气快
 天下与我1年前1
天下与我1年前1 -
 estellahoo 共回答了22个问题
estellahoo 共回答了22个问题 |采纳率95.5%产生的速度是相同的.不过由于氢气难溶于水,氯气能溶于水,所以看上去氯气产生的慢.1年前查看全部
- 为什么在家里 电解食盐水时会有黑色的物质?
 独来读网le1年前1
独来读网le1年前1 -
 史末 共回答了16个问题
史末 共回答了16个问题 |采纳率93.8%水里面有杂质··1年前查看全部
- 化学问题电解食盐水产生什么 我用的是铁丝只有负极冒气泡不像氢溶液变色浑浊有蓝色絮状物过滤得淡黄色溶液
 人家才5岁1年前4
人家才5岁1年前4 -
 520小丽 共回答了15个问题
520小丽 共回答了15个问题 |采纳率100%电解饱和食盐水是化工坐产中重要的氯碱工业,阳极产生氯气,阴极(与电源负极相连)产生氢气,电解液变为氢氧化钠溶液,当电极为惰性电极(石墨,金或铂)时才会在阳极生成氯气.用铁做阳极,会生成二价的亚铁离子,它与氢氧根反应生成白色沉淀,又迅速氧化成红褐色沉淀.对于你的实验,把电解液换成饱和的,再把阴极换成铜,阳极换成铜或石墨,淡黄色溶液应该是氯气溶于水之后形成的.按我的设想,理论上会有你期望的现象.1年前查看全部
- 某氯碱化工厂以电解食盐水产生化工原料氢氧化钠(反应原理为:2NaCl+2H 2 O 通电 . 2NaOH+H 2
某氯碱化工厂以电解食盐水产生化工原料氢氧化钠(反应原理为:2NaCl+2H 2 O
2NaOH+H 2 ↑+Cl 2 ↑).若电解含氯化钠23.4t的食盐水,理论上可得到多少氢氧化钠?通电 .  吃山楂的星星1年前1
吃山楂的星星1年前1 -
 8618535 共回答了17个问题
8618535 共回答了17个问题 |采纳率94.1%设理论上可得到氢氧化钠的质量为x.
2NaCl+2H 2 O
通电
.
2NaOH+H 2 ↑+Cl 2 ↑
117 80
23.4t x
117
80 =
23.4t
x ,x=16t
答:理论上可得到氢氧化钠的质量为16t.1年前查看全部
- 关于电解食盐水的我用铁丝作负极,碳棒作正极 发现电解后-极处水变浑浊,慢慢水变黑,水面上有一层恶心的红棕色漂浮物,下方水
关于电解食盐水的
我用铁丝作负极,碳棒作正极 发现电解后-极处水变浑浊,慢慢水变黑,水面上有一层恶心的红棕色漂浮物,下方水呈深绿色,好像都是絮状物.这是怎么会事?
为什么实验室中不会发生这种现象?如果我两极都用碳棒会怎么样?
还有漂浮在水面上的固体片状物是什么东西? 病毒性心肌炎1年前1
病毒性心肌炎1年前1 -
 bolindajia 共回答了19个问题
bolindajia 共回答了19个问题 |采纳率94.7%原电池称电极为正负极,电解槽称电极为阴阳极.正常情况下阳极:2Cl--2e-==Cl2↑阴极:2H++2e-==H2↑你说的是阴阳极反接则铁作阳极,阳极:Fe - 2e- === Fe2+阴极:2H+ + 2e- === H2 ↑ 总反应:Fe + 2H2O===Fe(OH)2↓+H2↑在空气中 Fe(OH)2会进一步反应4Fe(OH)2 + O2 +2H2O===4Fe(OH)31年前查看全部
- 电解食盐水为何不先生成Na 单质 而是与-oh反应
 饿狼居士正品1年前2
饿狼居士正品1年前2 -
 七潜 共回答了10个问题
七潜 共回答了10个问题 |采纳率90%因为Na单质特别活泼,电解NaCl后所生成的Na单质迅速和H2O反映,生成NaOH与O2.
从理论上来说,是先生成Na单质的.但是我们无法观察出.1年前查看全部
- 求电解食盐水反应的化学方程式:(可制取氢氧化钠、氯气、盐酸)
求电解食盐水反应的化学方程式:(可制取氢氧化钠、氯气、盐酸)
注意有盐酸的啊~ QIQI绮1年前3
QIQI绮1年前3 -
 阿飞甲 共回答了21个问题
阿飞甲 共回答了21个问题 |采纳率90.5%阴极:2(H+)+2e=H2↑
阳极:2(Cl-)-2e=Cl2↑
总反应:2NaCl+2H2O=(通电)=2NaOH+H2↑+Cl2↑
怎么可能有盐酸,盐酸与NaOH不能共存的1年前查看全部
- 为什么不采用电解食盐水的方法冶炼金属钠
 夏日的梦想1年前1
夏日的梦想1年前1 -
 生如冬草 共回答了16个问题
生如冬草 共回答了16个问题 |采纳率87.5%因为电解食盐水无法得到金属钠.
2NaCl+2H2O=通电=2NaOH+Cl2↑+H2↑
氯碱工业依据这个原理生产NaOH和Cl2.
制取金属钠的正确方法是电解熔融状态的氯化钠.
2NaCl(熔融)=通电=2Na+Cl2↑1年前查看全部
- 电解食盐水请问正,副两极分别电解出来的元素是什么?
 yfdsyx1年前2
yfdsyx1年前2 -
 i9uf78s367 共回答了22个问题
i9uf78s367 共回答了22个问题 |采纳率90.9%电解的时候石墨是阳极产生氯气,铁棒是阴极极,产生氢气?
为什么出来氯气而不是氧气?因为氯离子的放电能力大于氢氧根离子,所以氯离子失电子变为氯气.
饱和食盐水(NaCl溶液)中
NaCl发生电离
NaCl === Na+ + Cl-
水存在以下电离平衡
H2O === H+ + OH-
也就是说存在四种离子,阳离子有钠离子(Na+)和氢离子(H+),阴离子有氯离子(Cl-)和氢氧根离子(OH-).其中H+比Na+易得到电子,Cl-比OH-易失去电子,所以,在电解饱和食盐水的过程中,放电的离子是氢离子(H+)和氯离子(Cl-)
与电源正极相连的是阳极,阴离子在阳极放电
2Cl- - 2e → Cl2↑
与电源负极相连的是阴极,阳离子在阴极放电
2H+ + 2e → H2↑
既然H+是来自水的电离
H2O === H+ + OH-
氢离子的减少使水的电离向右进行,OH-在阴极大量增多
阴极总反应:2H2O + 2e → H2↑ + 2OH-
可以看到,OH-首先在阴极产生,所以关于电解饱和食盐水制氯气,通电一段时间后,与(负极)相连的电极周围的溶液能使酚酞变红1年前查看全部
- 我做电解食盐水实验,用10.5V的电压,阳极插入食盐水的是铅笔芯,阴极插入食盐水的是铜导线,发现两极都有气体产生,到后来
我做电解食盐水实验,用10.5V的电压,阳极插入食盐水的是铅笔芯,阴极插入食盐水的是铜导线,发现两极都有气体产生,到后来靠近阳极的盐水变黄(像尿一样),在后来我拿掉铅笔芯,阳极变成了铁导线,最后盐水又有点黑了,请问盐水为什么变黄,黑的东西是什么,阴极产生的是什么气体?
 时尚之都1年前1
时尚之都1年前1 -
 jccwp 共回答了20个问题
jccwp 共回答了20个问题 |采纳率85%电解食盐水,=阳极产生氯气,氯气能溶于水,所以靠近阳极附近溶液会变黄
阳极换成铁之后,阳极是铁变成亚铁离子,阴极产生氢气和氢氧化钠,
阳极的亚铁离子和先前产生的氯气以及阴极产生的氢氧化钠反应生成氢氧化铁,也可能是先生成氢氧化亚铁再转化成氢氧化铁,所以可能看到类似灰绿色到红褐色,至于黑色还真是不好说,你确定是黑色吗1年前查看全部
大家在问
- 1英语翻译英文翻译:搬新家了.每天起床都可以看窗外一大片风景,好美丽.保持好心情;love what u live.liv
- 2初一英语阅读理解题Life is not easy to most people,so when anything ha
- 3已知:A=2x平方+3kx-2x-1;B=-x平方+kx-1若2A+4B的值与X无关,求K的3次方
- 4英语祈使句怎么回答?
- 5为什么地形是横断山区立体农业主导因素
- 6几个数相乘,积的符号由负数的个数决定,这句话错在哪里?
- 7(2014•安次区一模)分类法是物理和化学学习的重要方法,下列说法正确的是( )
- 8水银的凝固点是-39℃,因此-40℃的水银呈()态,0℃的水银呈()态
- 9某市为了鼓励居民节约用电,采用分段计费的方法按月计算每户家庭的电费,月用电量不超过50度时,每度按
- 10甲有桌子若干张,乙有椅子若干把,如果乙用全部椅子换回数量相等的桌子,则需补给家320元,如果乙不补钱,就要少换回5张桌子
- 11怎样巧问妙答就是巧问妙答的方法
- 12依据句意,按正确的语序选择正确的一项 [ ] 通过自得其乐的游戏,使
- 13填带有看的意思的字,组成词语仰( ) 视( ) 望( ) 顾( ) 填带有跳的意思的字,组成词语 飞( ) 跃( ) 跨
- 14希望每一步都有解释~
- 15初一语文在《塞翁失马》中,“家富良马”一句中的“富”字是什么意思?请教各位高手.





