铵明矾与氢氧化钡的离子反应方程式
 齿屋齿足2022-10-04 11:39:541条回答
齿屋齿足2022-10-04 11:39:541条回答向铵明矾溶液中逐渐加入氢氧化钡溶液至中性,写出此时的离子方程式.

已提交,审核后显示!提交回复
共1条回复
 spyder 共回答了14个问题
spyder 共回答了14个问题 |采纳率78.6%- 铵明矾 (硫酸铝铵晶体) 分子式:NH4Al(SO4)2·12H2O
Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O - 1年前
相关推荐
- 铵明矾受热分解的逐步方程式
 hyflovelynn1年前2
hyflovelynn1年前2 -
 打B办一条狗 共回答了19个问题
打B办一条狗 共回答了19个问题 |采纳率94.7%已知氧化铝可由铝铵明矾NH4AL(So4)2加热制得,铝铵明矾受热分解的产物为6NH4AL(SO4)2 = 3Al2O3 + 2NH3 + 2N2 + 6SO2 + 6SO3 + 9H2O1年前查看全部
- 一道高中化学题铵明矾NH4Al(SO4)2*12H2O是一种重要的化工原料,加热时,固体残留率(a=剩余固体的质量/原始
一道高中化学题
铵明矾NH4Al(SO4)2*12H2O是一种重要的化工原料,加热时,固体残留率(a=剩余固体的质量/原始固体质量*100%)随温度的变化如图所示.
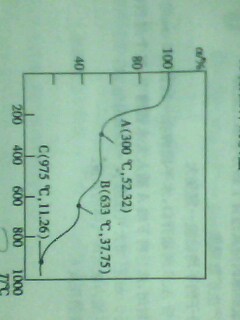
633℃时,剩余固体物质的化学式为————
答案是Al2(SO4)3.但不清楚为什么?麻烦高人讲解一下。 上下一色1年前2
上下一色1年前2 -
 qq1qq2qq3 共回答了17个问题
qq1qq2qq3 共回答了17个问题 |采纳率94.1%设NH4Al(SO4)2*12H2O1摩,受热第一步肯定是失水变成1MOLNH4Al(SO4)2即A,(据固体残留率知A处固体为237,与1MOLNH4Al(SO4)2质量相符)接着NH4Al(SO4)2=1/2Al2(SO4)3.+1/2(NH4)2SO4即B,(据固体残留率知B处固体为171,与1/2MOLAl2(SO4)3质量相等)最后是1/2Al2(SO4)3变成1/2AL2O3即C,(C处固体质量为51,与1/2MOLAL2O3质量相等)
此种题最重要知道物质受热都可能产生哪些物质,再由残留率求出质量与可能产生的物质质量比较1年前查看全部
- 边微热边铵明矾溶液中逐滴加入氢氧化钡溶液至中性,离子方程式是什么?继续滴加氢氧化钡的离子方程式是什
边微热边铵明矾溶液中逐滴加入氢氧化钡溶液至中性,离子方程式是什么?继续滴加氢氧化钡的离子方程式是什
RT
铵明矾[NH4Al(SO4)2·12H2O thismyname1年前1
thismyname1年前1 -
 dennieyuly 共回答了17个问题
dennieyuly 共回答了17个问题 |采纳率88.2%铵明矾的化学名称是十二水合硫酸铝铵(我按照明矾的名称瞎编的哈哈),它是由铝离子,铵根离子,硫酸根离子以及结晶水共同组成的白色晶体.明矾溶于水后,其水溶液中存在着铝离子,钾离子,硫酸根离子.所以滴加氢氧化钡的离子方程式是
Ba2+ + SO42- == BaSO4 向下箭头
Al3+ + OH- == Al(OH)3 向下箭头
NH4+ + OH- == H2O + NH3 向上箭头
当过量时,鉴于氢氧化铝的特殊性,会进一步反应
Al(OH)3 + OH- == AlO2- + 2H2O 那个是偏铝酸根相信你知道1年前查看全部
- 测定铵明矾组成的方法是:a.称取0.453 0 g铵明矾样品,高温灼烧,得Al2O3固体0.102 0 g;b.称取0.
测定铵明矾组成的方法是:
a.称取0.453 0 g铵明矾样品,高温灼烧,得Al2O3固体0.102 0 g;
b.称取0.453 0 g铵明矾样品,用适量蒸馏水溶解,再加入稍过量的BaCl2溶液,经陈化、过滤、灰化,得BaSO4 0.465 9 g.
c.称取0.453 0 g铵明矾样品,加入足量的NaOH溶液,加热,将产生的气体依次通过碱石灰和浓硫酸,浓硫酸增重0.017 0 g.
则铵明矾的化学式为________________.
 i2iie1年前1
i2iie1年前1 -
 妖妖的瓶子 共回答了20个问题
妖妖的瓶子 共回答了20个问题 |采纳率95%a.称取0.453 0 g铵明矾样品,高温灼烧,得Al2O3固体0.102 0 g;
n(Al3+)=0.1020*2/102=0.002mol
b.称取0.453 0 g铵明矾样品,用适量蒸馏水溶解,再加入稍过量的BaCl2溶液,经陈化、过滤、灰化,得BaSO4 0.465 9 g.
n(SO42-)=0.4659/233=0.002mol
c.称取0.453 0 g铵明矾样品,加入足量的NaOH溶液,加热,将产生的气体依次通过碱石灰和浓硫酸,浓硫酸增重0.017 0 g.
n(NH3)=n(NH4+)=0.0170/17=0.001mol
n(NH4+):n(Al3+):n(SO32-)=0.001:0.001:0.002=1:2:2
NH4Al2(SO4)2,化合价代数和不为0,计算结果不对.
a数据有问题,应该是0.0510g
a.称取0.453 0 g铵明矾样品,高温灼烧,得Al2O3固体0.051 0 g;
n(Al3+)=0.0510*2/102=0.001mol
b.称取0.453 0 g铵明矾样品,用适量蒸馏水溶解,再加入稍过量的BaCl2溶液,经陈化、过滤、灰化,得BaSO4 0.465 9 g.
n(SO42-)=0.4659/233=0.002mol
c.称取0.453 0 g铵明矾样品,加入足量的NaOH溶液,加热,将产生的气体依次通过碱石灰和浓硫酸,浓硫酸增重0.017 0 g.
n(NH3)=n(NH4+)=0.0170/17=0.001mol
n(NH4+):n(Al3+):n(SO32-)=0.001:0.001:0.002=1:1:2
再根据质量守恒,0.4530=m(NH4+)+m(Al3+)+m(SO42-)+m(H2o),可以算出m(H2O)=0.2160g,n(H2O)=0.2160/18=0.012mol,
则铵明矾的化学式为:NH4Al(SO4)2.12H2O.1年前查看全部
- 0.1mol•L-1 Ba(OH)2溶液与0.1mol•L-1的铵明矾[NH4Al(SO4)2]溶液等体积混合,反应后混
0.1mol•L-1 Ba(OH)2溶液与0.1mol•L-1的铵明矾[NH4Al(SO4)2]溶液等体积混合,反应后混合液各离子浓度大小比较合理的是( )
A.c(SO42-)>c(NH4+)>c(Al3+)>c(OH-)>c(H+)
B.c(SO42-)>c(NH4+)>c(Al3+)>c(H+)>c(OH-)
C.c(NH4+)>c(SO42-)>c(Al3+)>c(OH-)>c(H+)
D.c(SO42-)>c(Al3+)>c(NH4+)>c(H+)>c(OH-) laijinnbei1年前1
laijinnbei1年前1 -
 潜水d耗子 共回答了14个问题
潜水d耗子 共回答了14个问题 |采纳率100%解题思路:假设二者的体积都是1L,其浓度相等,所以二者的物质的量相等,二者混合时,硫酸根离子过量、铝离子过量,溶液只生成部分硫酸钡、氢氧化铝沉淀,溶液中存在铵根离子、铝离子和硫酸根离子.假设二者的体积都是1L,NH4Al(SO4)2的物质的量为0.1mol,n(SO42-)=0.2mol,n(Al3+)=0.1mol,n(NH4+)=0.1mol,n(Ba2+)=0.1mol,n(OH-)=0.2mol,
SO42-与Ba2+反应,Ba2+不足,SO42-剩余0.1mol,0.1molAl3+反应生成Al(OH)3消耗OH-的量为0.3mol,OH-不足,溶液中[1/15]molAl3+反应,生成[1/15]molAl(OH)3,溶液中剩余[1/30]molAl3+,溶液中NH4+不反应,此时溶液为硫酸铵、硫酸铝溶液,铵根离子、铝离子水解,溶液呈酸性,综上所述,溶液中有SO42-、NH4+、Al3+,且NH4+>Al3+,溶液中的溶质是硫酸铵和硫酸铝,为强酸弱碱盐,其溶液呈酸性,所以溶液中离子浓度大小顺序是c(SO42-)>c(NH4+)>c(Al3+)>c(H+)>c(OH-),故选B.点评:
本题考点: 离子浓度大小的比较;离子方程式的有关计算.
考点点评: 本题考查了离子浓度大小比较,明确溶液中的离子反应先后顺序及离子溶液中的溶质是解本题关键,再结合离子之间反应剩余物的多少及其性质解答,题目难度中等.1年前查看全部
- 同时制取铵明矾和硫酸铝可通过控制硫酸的用量调节两种产品的产量
同时制取铵明矾和硫酸铝可通过控制硫酸的用量调节两种产品的产量
1 以含a mol AL2O3的铝土矿为原料,设制得的产物中硫酸铝的物质的量为x mol 消耗H2SO4的物质的量为y mol 则求y与a 、x的函数关系_
答案为y=[2a(x+2)]/(x+1)
就是这样的…铵气等条件略去不干扰本题 aaq1年前1
aaq1年前1 -
 一瞬间的梦 共回答了18个问题
一瞬间的梦 共回答了18个问题 |采纳率100%我认为答案有问题,我的分析如下:
a mol Al2O3含Al 2a mol,x mol Al2(SO4)3含Al 2x mol,SO42- 3x mol
根据原子守恒
NH4Al(SO4)2含Al (2a-2x) mol,SO42- 2(2a-2x)mol
于是消耗H2SO4 y=3x+2(2a-2x)=4a-xmol1年前查看全部
- (2011•南京二模)铝土矿的主要成分为Al2O3.生产铵明矾[NH4Al(SO4)2•12H2O]和H2O2的工艺流程
(2011•南京二模)铝土矿的主要成分为Al2O3.生产铵明矾[NH4Al(SO4)2•12H2O]和H2O2的工艺流程图如下.

(1)流程图中X为______(填化学式)溶液.
(2)反应Ⅱ的离子方程式为______.
(3)“电解”时,用惰性材料作电极,则阴极反应可表示为______.
(4)反应Ⅵ的化学方程式为______.
(5)流程中可以循环使用的物质是______. 广东人011年前1
广东人011年前1 -
 0jackey2016 共回答了16个问题
0jackey2016 共回答了16个问题 |采纳率100%解题思路:(1)根据反应Ⅱ中通入的是CO2气体,可见反应所加X是碱溶液,而不是酸溶液.
(2)由工艺流程转化可知,反应Ⅱ为向含有AlO2-的反应Ⅰ的滤液中通入过量CO2气体,使AlO2-完全转化为Al(OH)3,在溶液中CO2、AlO2-、H2O反应生成Al(OH)3与HCO3-.
(3)电解时阴极是阳离子放电,发生还原反应,即H+放电产生氢气.
(4)由工艺流程转化可知,反应Ⅵ是H2O与(NH4)2S2O8反应产生H2O2和NH4HSO4.
(5)由工艺流程转化可知,Y为H2SO4,反应Ⅴ生成NH4HSO4,反应Ⅳ中NH4HSO4转化为铵明矾,反应Ⅵ也产生NH4HSO4,可见NH4HSO4可以在反应中循环使用.(1)根据反应Ⅱ中通入的是CO2气体,可见反应所加X是碱溶液,而不是酸溶液,X为NaOH溶液或其他强碱性溶液.
故答案为:NaOH.
(2)由工艺流程转化可知,反应Ⅱ为向含有AlO2-的反应Ⅰ的滤液中通入过量CO2气体,使AlO2-完全转化为Al(OH)3,在溶液中CO2、AlO2-、H2O反应生成Al(OH)3与HCO3-,反应离子方程式为CO2+AlO2-+2H2O=Al(OH)3+HCO3-.
故答案为:CO2+AlO2-+2H2O=Al(OH)3+HCO3-.
(3)电解时阴极是阳离子放电,发生还原反应,即H+放电产生氢气,电极反应式为2H++2e-=H2↑.
故答案为:2H++2e-=H2↑.
(4)由工艺流程转化可知,反应Ⅵ是H2O与(NH4)2S2O8反应产生H2O2和NH4HSO4,反应方程式为(NH4)2S2O8+2H2O=2NH4HSO4+H2O2.
故答案为:(NH4)2S2O8+2H2O=2NH4HSO4+H2O2.
(5)由工艺流程转化可知,Y为H2SO4,反应Ⅴ生成NH4HSO4,反应Ⅳ中NH4HSO4转化为铵明矾,反应Ⅵ也产生NH4HSO4,可见NH4HSO4可以在反应中循环使用.
故答案为:NH4HSO4.点评:
本题考点: 制备实验方案的设计;原电池和电解池的工作原理;无机物的推断.
考点点评: 考查学生对工艺流程的理解、阅读获取信息能力、方程式书写、电解池等,难度中等,需要学生具备阅读获取信息能力、综合运用知识、信息分析问题解决问题能力.1年前查看全部
- 钾明矾与铵明矾哪种更易溶于水请说出依据,
 白花花大胸脯王晟1年前2
白花花大胸脯王晟1年前2 -
 Sino_thinker 共回答了18个问题
Sino_thinker 共回答了18个问题 |采纳率94.4%在20度,1个标准大气压下,钾明矾在水中的溶解度约为5.90g.
铵明矾溶解度15g.1年前查看全部
- (2009•徐汇区二模)工业上以高岭土和硫酸、氨气为原料制取铵明矾[NH4Al(SO4)2•12H2O]和硫酸铝,反应原
(2009•徐汇区二模)工业上以高岭土和硫酸、氨气为原料制取铵明矾[NH4Al(SO4)2•12H2O]和硫酸铝,反应原理如下(忽略高岭土其他成分与硫酸的反应):
Al2O3+3H2SO4→Al2(SO4)3+3H2O…①
Al2(SO4)3+H2SO4+2NH3→2NH4Al(SO4)2 …②
(1)制取1000g铵明矾,需消耗氨气______L(标准状况);
(2)以1000Kg含氧化铝36%的高岭土为原料制取硫酸铝,需消耗质量分数98%的硫酸(密度1.84g/cm3)______L;
(3)某工厂欲同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量.
①若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,计算投料时氧化铝和硫酸的物质的量之比.
②以含a mol氧化铝的高岭土为原料,设制得的产物中硫酸铝的物质的量分数为x,试导出消耗硫酸的物质的量y与a、x的函数关系. pig25171年前1
pig25171年前1 -
 南北情未了 共回答了19个问题
南北情未了 共回答了19个问题 |采纳率78.9%解题思路:(1)根据反应的方程式计算消耗氨气的体积;
(2)根据反应方程式计算需要硫酸的质量,进而可计算溶液的体积;
(3)根据质量守恒定律列式计算①②.(1)n(NH4Al(SO4)2•12H2O)=[1000g/449g/mol]=2.23mol,
Al2(SO4)3+H2SO4+2NH3═2NH4Al(SO4)2
44.8L2mol
V 2.23mol
V=[44.8L×2.23mol/2mol]=49.95L,故答案为:49.95L;
(2)m(Al2O3)=1000Kg×36%=360Kg,
Al2O3+3H2SO4→Al2(SO4)3+3H2O
102g 294g
360Kg m(H2SO4)
m(H2SO4)=[360Kg×294g/102g]=1037.6Kg,
需消耗质量分数98%的硫酸为:
V=
1037.6Kg
98%
1.84Kg/L=575.4L,
故答案为:575.4L;
(3)①设制备的[NH4Al(SO4)2•12H2O和Al2(SO4)3的物质的量的物质的量各为1mol,从质量守恒的角度分析,则
n(Al)=1mol+2mol=3mol,n(SO42-)=2mol+3mol=5mol,
所以:n(Al2O3)=1.5mol,
n(H2SO4)=5mol,
n(Al2O3):n(H2SO4)=1.5mol:5mol=3:10,
答:投料时氧化铝和硫酸的物质的量之比为3:10;
②设产物中含有mmolNH4Al(SO4)2•12H2O,nmolAl2(SO4)3,
则:
m+2n=2a
n
m+n=x
y=2m+3n
解之得:
m=
2a(1−x)
x+1
n=
2ax
x+1
y=2m+3n=
2a(x+2)
x+1,
答:消耗硫酸的物质的量y与a、x的函数关系为y=
2a(x+2)
x+1.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查化学方程式的计算,题目难度中等,本题注意从质量守恒的角度解答.1年前查看全部
- 铝铵明矾受热分解方程式配平怎么配
铝铵明矾受热分解方程式配平怎么配
4NH4AL(So4)2=2NH3+2AL2O3+N2+5SO3+3SO2+5H2O
反应物和产物都是知道的.然后我知道N2和SO2前面的系数之比是1:3,接下去怎么配就不会了,找不到突破口, lighter91年前2
lighter91年前2 -
 小料理 共回答了20个问题
小料理 共回答了20个问题 |采纳率90%本题有多种配平方法.本题较难.
方法一:
利用得失电子数相等,设N2系数为x,则SO2系数的为3x;另设NH4Al(SO4)2系数为1.
则NH3的系数为(1-2x),SO3的系数为(2-3x),H2O的系数为(6x+1)/2,Al2O3系数为1/2.
即 NH4Al(SO4)2 = (1-2x) NH3 + 1/2 Al2O3 + x N2 + (2-3x) SO3 + 3x SO2 + (6x+1)/2 H2O
依据化学方程式中配平系数不能出现负数或零,从而得不等式:
①1-2x>0; ②2-3x>0; ③(6x+1)/2>0; ④ x>0
解得01年前查看全部
- (2012•奉贤区二模)铵明矾[NH4Al(SO4)2•12H2O]是一种复盐,向其溶液中逐滴加入Ba(OH)2溶液,可
(2012•奉贤区二模)铵明矾[NH4Al(SO4)2•12H2O]是一种复盐,向其溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是( )
A.NH4++Al3++5OH-→NH3•H2O+AlO2-+2H2O
B.NH4++Al3++2SO42-+2Ba2++5OH-→2BaSO4↓+NH3•H2O+AlO2-+2H2O
C.5NH4++5Al3++10SO42-+10Ba2++22OH-→10BaSO4↓+5NH3•H2O+2AlO2-+3Al(OH)3↓+4H2O
D.3NH4++4Al3++8SO42-+8Ba2++16OH-→8BaSO4↓+3NH3•H2O+3Al(OH)3↓+AlO2-+2H2O jinhai1年前1
jinhai1年前1 -
 dlq346734145 共回答了17个问题
dlq346734145 共回答了17个问题 |采纳率94.1%解题思路:铵明矾[NH4Al(SO4)2•12H2O]是一种复盐,向其溶液中逐滴加入Ba(OH)2溶液,硫酸根沉淀钡离子,同时氢氧根离子沉淀铝离子,随滴入的氢氧化钡增多,硫酸根离子全部沉淀,同时铝离子沉淀完全,过量的氢氧根离子和铵根离子结合生成一水合氨,氢氧化铝不能溶解在氨水中,继续滴入氢氧化钡,氢氧化铝沉淀溶解,依据离子反应顺序书写离子方程式判断;A、反应中氢氧化钡低显生成硫酸钡沉淀和氢氧化铝沉淀;故A错误;
B、NH4Al(SO4)2•12H2O和Ba(OH)2 按照1:2恰好反应生成硫酸钡沉淀、氢氧化铝沉淀、一水合氨,继续加入氢氧化钡0.5mol,氢氧化铝沉淀完全溶解,反应的离子方程式为:NH4++Al3++2SO42-+2Ba2++5OH-→2BaSO4↓+NH3•H2O+AlO2-+2H2O,故B正确;
C、NH4Al(SO4)2•12H2O和Ba(OH)2 按照5:10恰好反应生成硫酸钡沉淀、氢氧化铝沉淀、一水合氨,继续加入1molBa(OH)2,溶解2mol氢氧化铝沉淀,剩余氢氧化铝沉淀3mol,反应的离子方程式为:5NH4++5Al3++10SO42-+10Ba2++22OH-→10BaSO4↓+5NH3•H2O+2AlO2-+3Al(OH)3↓+4H2O;故C正确;
D、NH4Al(SO4)2•12H2O和Ba(OH)2 按照4:8恰好反应生成硫酸钡沉淀、氢氧化铝沉淀、一水合氨,无氢氧化铝沉淀溶解,故D错误;
故选BC.点评:
本题考点: 离子方程式的书写;镁、铝的重要化合物.
考点点评: 本题考查了离子方程式的书写方法和注意问题,离子反应顺序是解题关键,题目难度较大.1年前查看全部
- 能否用铵明矾制氨气硫酸铝铵+消石灰 ==加热==?
 感觉小笨猪1年前3
感觉小笨猪1年前3 -
 冰雪小思思 共回答了14个问题
冰雪小思思 共回答了14个问题 |采纳率100%你反了吧
工业上以高岭土和硫酸、氨气为原料制取铵明矾[NH4Al(SO4)2•12H2O]和硫酸铝,反应原理如下(忽略高岭土其他成分与硫酸的反应):
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O…………①
Al2(SO4)3 + H2SO4 + 2NH3 → 2NH4Al(SO4)2 …………②
实验室制取氨气:
①铵盐与碱加热制取氨气,常用NH4Cl与Ca(OH)2反应,固体与固体反应,试管要向下倾斜.
②在浓氨水中加碱或生石灰,因为氨水中存在下列平衡:
NH3+H2O NH3·H2O NH4++OH-加入碱平衡左移,同时放出大量的热促进氨水的挥发.
③加热浓氨水,加快氨水挥发.1年前查看全部
- 同时制取铵明矾和硫酸铝,可通过控制硫酸的用量调节两种产品的产量:1 若使制得的铵明矾和硫酸铝的量之比为1:1,则投料时铝
同时制取铵明矾和硫酸铝,可通过控制硫酸的用量调节两种产品的产量:1 若使制得的铵明矾和硫酸铝的量之比为1:1,则投料时铝土矿中的Al2O3和H4SO4的物质的量比为_
2 以含a mol Al2O3的铝土矿为原料,设制得的产物中硫酸铝的物质的量为x mol,消耗H2SO4的物质的量为y mol,则y与a、x的函数关系为_……求求大神了!
谢谢你…第一问对了,但是第二问的答案是y=[2a(x+2)]/(x+1) , 心神飞扬1年前1
心神飞扬1年前1 -
 一鸣惊人123 共回答了23个问题
一鸣惊人123 共回答了23个问题 |采纳率91.3%铵明矾中硫酸根和铝离子的比例为2:1,硫酸铝硫酸根和铝离子的比例为3:2,那么可以知道Al2O3和H2SO4的物质的量比为3:10
y=x/3 x1年前查看全部
- 铵明矾加氢氧化钠生成什么
 青天不二1年前1
青天不二1年前1 -
 Jun0921 共回答了20个问题
Jun0921 共回答了20个问题 |采纳率85%AlNH4(SO4)2·12H2O + 5NaOH = 2Na2SO4 + NaAlO2 + NH3 + 15H2O1年前查看全部
- 铵明矾+盐为什么变黄绿色铵明矾溶液+盐为什么变黄色(略带黄色)溶液变黄色(略带绿色),但是性能没变,是不是重金属超标,影
铵明矾+盐为什么变黄绿色
铵明矾溶液+盐为什么变黄色(略带黄色)
溶液变黄色(略带绿色),但是性能没变,是不是重金属超标,影响质量吗? 红泥花园1年前1
红泥花园1年前1 -
 山水居士2008 共回答了16个问题
山水居士2008 共回答了16个问题 |采纳率87.5%有杂质,还有一个重要的原因就是,铵明矾会水解产生胶体Al(OH)3,胶体具有很强的吸附能力并且胶体表面带有电荷,加入电解质(盐)可以中和胶体表面的电荷,而使胶体聚沉,聚沉的同时溶液的折光能力就有所变化,所以看起来略带黄色1年前查看全部
- 铝铵明矾[NH4Al(SO4)2 12H2O]受强热分解的产物为Al2O3,NH3,N2,SO3,SO2和H2O.写出铝
铝铵明矾[NH4Al(SO4)2 12H2O]受强热分解的产物为Al2O3,NH3,N2,SO3,SO2和H2O.写出铝铵明矾受强热分解
4[NH4Al(SO4)2.12H2O]→2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O↑
8[NH4Al(SO4)2.12H2O]→4Al2O3 + 6NH3↑+ N2↑+ 13SO3↑+ 3SO2↑+ 103H2O↑
哪个对? HttpServletReque1年前3
HttpServletReque1年前3 -
 mackywu 共回答了18个问题
mackywu 共回答了18个问题 |采纳率100%1年前查看全部
- 铵明矾NH4Al(SO4)2.12H2O 的合成方程式杂写
铵明矾NH4Al(SO4)2.12H2O 的合成方程式杂写
铵明矾的合成方程式杂写
有金太阳全国100所名校模拟一的理综答案的兄弟说下, 月亮在哭1年前1
月亮在哭1年前1 -
 pjy01096231 共回答了20个问题
pjy01096231 共回答了20个问题 |采纳率95%1、由硫酸铝溶液与硫酸铵溶液反应,并经冷却结晶、离心分离、洗涤和干燥制得.
Al2(SO4)4+(NH4)2SO4+12H2O→2NH4Al(SO4)2·12H2O1年前查看全部
大家在问
- 1y=ln[arctan1/(1+x)]的导数
- 2根据首字母提示,用正确的单词和词组,完成句子.
- 3主观和客观的意思书上写的什么主观上看,客观上看.越简单越好...
- 4设f(x)=x3,等差数列{an}中a3=7,a1+a2+a3=12,记Sn=f(三次根号(an+1)),令bn=anS
- 5王昌龄用什么诗句表白自己光明磊落的品质
- 6形容走路不稳跌跌撞撞样子()形容路途遥远() 形容山岭都是碧绿颜色() 形容永远苍翠欣欣向荣() 成语
- 7将 我父母和我经常去探望外公和外婆。 翻译为英语
- 8某工人三天做完一批零件,第一天做了84个,第二天做了余下的2/7,第三天和前两天做总数一样多,这批零件有几
- 9帮我翻译一下.I'd like to get this film developed谢!
- 10英语翻译“紫菱”紫色的菱角.可以这么理解.诗意一点.那如果要简短一点 就一个单词呢?我想做英文名
- 11阅读材料,完成后面的题。(10分)
- 12樱桃19颗,桃子23个如果把每种水果,平均分给八个小朋友嗯,怎么分请列出算式
- 13读图“非洲气候类型分布图”,完成以下小题。
- 14f(x)=4cosxsin(x+π/6)-1的最小周期与单调区间
- 15英语常识!there they their those these that this 有什么区别,分别在什么情况下使用

