候氏制碱法原料添加顺序,及有关方程式.
 maggiekk2022-10-04 11:39:542条回答
maggiekk2022-10-04 11:39:542条回答写出先加什么原料在加什么.

已提交,审核后显示!提交回复
共2条回复
 哈哈哈lala 共回答了20个问题
哈哈哈lala 共回答了20个问题 |采纳率100%- 氨气与水和二氧化碳反应生成一分子的碳酸氢铵,这是第一步.第二步是:碳酸氢铵与卤化钠反应生成一分子的卤化铵和碳酸氢钠沉淀,碳酸氢钠之所以沉淀是因为他的溶解度很小.
根据 NH4Cl 在常温时的溶解度比 NaCl 大,而在低温下却比 NaCl 溶解度小的原理,在 278K 283K(5 10 ℃ ) 时,向母液中加入食盐细粉,而使 NH4Cl 单独结晶析出供做氮肥.
(1)NH3+H2O+CO2=NH4HCO3(2)NH4HCO3+NaCl=NH4Cl+NaHCO3↓ - 1年前
 ygp12 共回答了9540个问题
ygp12 共回答了9540个问题 |采纳率0.2%- NH3,CO2,
NH3+H2O+CO2=NH4HCO3
NH4HCO3+NaCl=NH4Cl+NaHCO3↓ - 1年前
相关推荐
- 候氏制碱法的原理用方程式表示
 bh0npi1年前1
bh0npi1年前1 -
 难得糊涂吗 共回答了19个问题
难得糊涂吗 共回答了19个问题 |采纳率100%NH3+H2O+CO2=NH4HCO3(2)NH4HCO3+NaCl=NH4Cl+NaHCO3↓
不好意思,脚标不方便打字,只能这样了,不知你能否明白?
氨气与水和二氧化碳反应生成一分子的碳酸氢铵,这是第一步.第二步是:碳酸氢铵与卤化钠反应生成一分子的卤化铵和碳酸氢钠沉淀,碳酸氢钠之所以沉淀是因为他的溶解度很小.
根据 NH4Cl 在常温时的溶解度比 NaCl 大,而在低温下却比 NaCl 溶解度小的原理,在 278K 283K(5 10 ℃ ) 时,向母液中加入食盐细粉,而使 NH4Cl 单独结晶析出供做氮肥.
此法优点:保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高到 96 %; NH4Cl 可做氮肥;可与合成氨厂联合,使合成氨的原料气 CO 转化成 CO2 ,革除了 CaCO3 制 CO2 这一工序.
在知道里面搜到的.1年前查看全部
- [选修一化学与技术]联碱法(候氏制碱法)和氨碱法的生产流程简要表示如下图:
[选修一化学与技术]联碱法(候氏制碱法)和氨碱法的生产流程简要表示如下图:

(1)沉淀池中发生反应的化学方程式为______;
(2)X是______,Y是______ (填化学式);
(3)Z中除了溶解的氨气、食盐外,其它溶质还有______;排出液中的溶质除了氢氧化钙外,还有______;
(4)从理论上分析,在氨碱法生产过程中______ (填“需要”、“不需要”)补充氨气,从原料到产品,氨碱法总反应过程用化学方程式表示,可写为______;
(5)根据联碱法中从母液中提取氯化铵晶体的过程推测,所得结论正确是______;
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气目的是使氯化铵更多析出
c.加入食盐细粉目的是提高Na+的浓度,促进碳酸氢钠结晶析出
(6)联碱法中,每当通入NH3 44.8L(已折合成标准状况下)时可以得到纯碱100.0g则NH3的利用率为______.相比于氨碱法,指出联碱法的一项优点______• zzm09081年前1
zzm09081年前1 -
 熊熊狗 共回答了20个问题
熊熊狗 共回答了20个问题 |采纳率100%解题思路:(1)依据生产流程联碱法和氨碱法生产流程中沉淀池中发生的反应是氨气、二氧化碳、水、氯化钠反应生成碳酸氢钠晶体和氯化铵;
(2)联碱法生产流程图中分析循环Ⅱ中是碳酸氢钠分解生成的二氧化碳气体;氨碱法的生产流程中循环Ⅰ是氧化钙和水反应生成氢氧化钙与铵盐反应生成的氨气;
(3)联碱法母液主要是氯化铵、碳酸钠、碳酸氢钠、氯化钠;Z中除了溶解的氨气、食盐外,其它溶质还有氯化铵、碳酸钠;氨碱法排出液中的溶质除了氢氧化钙外,还有氢氧化钙和氯化铵反应生成的氯化钙,氯化钠;
(4)氨碱法生产过程中,母液中加入氧化钙反应生成氢氧化钙会和铵盐生成氨气,反应过程中氨气转化为铵盐,铵盐转化为氨气,氨气循环使用,不需要补充氨气;
NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;CaCO3═CaO+CO2↑;CaO+H2O═Ca(OH)2;Ca(OH)2+2NH4Cl═CaCl2+2NH3↑+2H2O;2NaHCO3═Na2CO3+H2O+CO2↑;
合并得到总化学方程式为:CaCO3+2NaCl═Na2CO3+CaCl2;
(5)向母液中通氨气作用有增大NH4+的浓度,使NH4Cl更多地析出和使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度;加入食盐细粉目的是提高Cl-的浓度,使氯化氨析出;
(6)依据联碱法反应的化学方程式计算,根据反应生成碳酸钠的质量计算实际消耗氨气的物质的量,得到氨气的利用率;综合分析两个过程的流程图和生成产物,及过程中循环利用的特征分析判断.(1)依据流程图分析可知,生产流程联碱法和氨碱法生产流程中沉淀池中发生的反应是氨气、二氧化碳、水、氯化钠反应生成碳酸氢钠晶体和氯化铵,所以反应的化学方程式为:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl,故答案为:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;
(2)联碱法生产流程图中分析循环Ⅱ中是碳酸氢钠分解生成的二氧化碳气体;氨碱法的生产流程中循环Ⅰ是氧化钙和水反应生成氢氧化钙,氢氧化钙与铵盐反应生成的氨气可以循环使用,故答案为:CO2;NH3;
(3)依据两个过程中的物质发生的反应分析,联碱法母液主要是氯化铵、碳酸钠、碳酸氢钠、氯化钠;Z中除了溶解的氨气、食盐外,其它溶质还有氯化铵、碳酸钠;氨碱法排出液中的溶质除了氢氧化钙外,还有氢氧化钙和氯化铵反应生成的氯化钙,氯化钠,故答案为:Na2CO3、NH4Cl;CaCl2、NaCl;
(4)从理论上分析,氨碱法生产过程中,母液中加入氧化钙反应生成氢氧化钙会和铵盐生成氨气,反应过程中氨气转化为铵盐,铵盐转化为氨气,氨气循环使用,不需要补充氨气;
NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;CaCO3═CaO+CO2↑;CaO+H2O═Ca(OH)2;Ca(OH)2+2NH4Cl═CaCl2+2NH3↑+2H2O;2NaHCO3═Na2CO3+H2O+CO2↑合并得到总化学方程式为:CaCO3+2NaCl═Na2CO3+CaCl2,故答案为:不需要;CaCO3+2NaCl═Na2CO3+CaCl2;
(5)联碱法中从母液中提取氯化铵晶体的过程中;
a、温时氯化铵的溶解度比氯化钠大,故a错误;
b、通氨气作用有增大NH4+的浓度,使NH4Cl更多地析出和使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度,故b正确;
c、加入食盐细粉目的是提高Cl-的浓度,促进氯化铵结晶析出,故c错误;
故答案为:b;
(6)联碱法中发生的反应为:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;2NaHCO3═Na2CO3+H2O+CO2↑;每当通入NH3 44.8L(已折合成标准状况下)物质的量为2mol;生产过程中得到纯碱100.0g,物质的量为[100g/106g/mol]=[50/53]mol;需要氨气的物质的量为[50/53×2=
100
53]mol;则NH3的利用率=
100
53mol
2mol×100%=94.3%;
联合制碱法与氨碱法比较,其最大的优点是使食盐的利用率提高到96%以上,应用同量的食盐比氨碱法生产更多的纯碱.另外它综合利用了氨厂的二氧化碳和碱厂的氯离子,同时,生产出两种可贵的产品--纯碱和氯化铵.将氨厂的废气二氧化碳,转变为碱厂的主要原料来制取纯碱,这样就节省了碱厂里用于制取二氧化碳的庞大的石灰窑;将碱厂的无用的成分氯离子(Cl-)来代替价格较高的硫酸固定氨厂里的氨,制取氮肥氯化铵.从而不再生成没有多大用处,又难于处理的氯化钙,减少了对环境的污染,并且大大降低了纯碱和氮肥的成本,充分体现了大规模联合生产的优越性,
故答案为:94.3%;不产生无用的CaCl2,提高了食盐的转化率.点评:
本题考点: 纯碱工业(侯氏制碱法);工业合成氨.
考点点评: 本题考查了联碱法和氨碱法生产流程的原理比较和物质分析判断,纯碱制备的条件应用和服产物的提纯析出,反应过程中反应的原理分析和物质来源是解题的关键,题目难度中等.1年前查看全部
- 用“候氏制碱法”制得的纯碱中常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的质量分数,小雯同学称取该样品5.6g加入到盛有
用“候氏制碱法”制得的纯碱中常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的质量分数,小雯同学称取该样品5.6g加入到盛有100g足量稀盐酸的烧杯中,完全反应后称得烧杯中的溶液质量为103.4g.
(1)求该反应中产生的二氧化碳的质量______;
(2)求该纯碱样品中碳酸钠的质量;
(3)求反应后所得溶液的溶质质量分数.(结果保留到小数点后两位) 小烟灰1年前1
小烟灰1年前1 -
 jiajiaflying 共回答了22个问题
jiajiaflying 共回答了22个问题 |采纳率86.4%解题思路:(1)二氧化碳的质量为反应前后烧杯中溶液质量的减少量.
(2)由二氧化碳的质量,根据碳酸钠和盐酸的化学方程式,列出比例式,可求出碳酸钠的质量.
(3)反应后所得溶液为氯化钠溶液,而样品中的氯化钠不与盐酸反应;至完全反应后,所得溶液为氯化钠溶液,其溶质氯化钠由两部分组成:一部分为原混合物质中的氯化钠,另一部分则是反应生成的氯化钠;
综上所述,所得溶液中溶质质量分数,则是原混合物中氯化钠与生成氯化钠质量总和与所得溶液的质量比.(1)生成CO2的质量为:反应前后烧杯中溶液质量之差,即(100g+5.6g)-103.4g=2.2g
答:生成CO2的质量为2.2g故答案为:2.2g
(2)设样品中Na2CO3的质量为x,生成NaCl的质量为y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
xy 2.2g
[106/x=
117
y=
44
2.2g]
解之得:x=5.3g; y=5.85g
答:该纯碱样品中碳酸钠的质量为5.3g
(3)所得溶液中NaCl的质量为原样品中氯化钠的质量与生成氯化钠的质量之和.
氯化钠的质量=5.85g+(5.6g-5.3g)=6.15g
NaCl%=氯化钠的质量反应后溶液的质量×100%=[6.15g/103.4g]×100%≈5.95%
答:反应后所得溶液中溶质的质量分数5.95%点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算;质量守恒定律及其应用.
考点点评: 本题主要考查学生运用化学方程式和溶质质量分数公式综合分析和解决实际问题的能力.1年前查看全部
- 求联合制碱法(候氏制碱法)化学式 好像是4个
 guilinmifen1年前2
guilinmifen1年前2 -
 riqi027 共回答了23个问题
riqi027 共回答了23个问题 |采纳率91.3%NH3+CO2+H20=NH4HCO3
NH4HCO3+NaCl(饱和食盐水)=NaHCO3(沉淀)+NH4Cl
2NaHCO3=加热=Na2CO3+H2O+CO2(气体)1年前查看全部
- (2010•南长区一模)用“候氏制碱法”制得的纯碱中常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的质量分数,小雯同学称取
(2010•南长区一模)用“候氏制碱法”制得的纯碱中常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的质量分数,小雯同学称取该样品5.6g加入到盛有100g足量稀盐酸的烧杯中,完全反应后称得烧杯中的溶液质量为103.4g.
(1)求该反应中产生的二氧化碳的质量______;
(2)求该纯碱样品中碳酸钠的质量;
(3)求反应后所得溶液的溶质质量分数.(结果保留到小数点后两位) qixiao30991年前1
qixiao30991年前1 -
 隔离屋嗰囝 共回答了19个问题
隔离屋嗰囝 共回答了19个问题 |采纳率78.9%解题思路:(1)二氧化碳的质量为反应前后烧杯中溶液质量的减少量.
(2)由二氧化碳的质量,根据碳酸钠和盐酸的化学方程式,列出比例式,可求出碳酸钠的质量.
(3)反应后所得溶液为氯化钠溶液,而样品中的氯化钠不与盐酸反应;至完全反应后,所得溶液为氯化钠溶液,其溶质氯化钠由两部分组成:一部分为原混合物质中的氯化钠,另一部分则是反应生成的氯化钠;
综上所述,所得溶液中溶质质量分数,则是原混合物中氯化钠与生成氯化钠质量总和与所得溶液的质量比.(1)生成CO2的质量为:反应前后烧杯中溶液质量之差,即(100g+5.6g)-103.4g=2.2g
答:生成CO2的质量为2.2g故答案为:2.2g
(2)设样品中Na2CO3的质量为x,生成NaCl的质量为y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
xy 2.2g
[106/x=
117
y=
44
2.2g]
解之得:x=5.3g; y=5.85g
答:该纯碱样品中碳酸钠的质量为5.3g
(3)所得溶液中NaCl的质量为原样品中氯化钠的质量与生成氯化钠的质量之和.
氯化钠的质量=5.85g+(5.6g-5.3g)=6.15g
NaCl%=氯化钠的质量反应后溶液的质量×100%=[6.15g/103.4g]×100%≈5.95%
答:反应后所得溶液中溶质的质量分数5.95%点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算;质量守恒定律及其应用.
考点点评: 本题主要考查学生运用化学方程式和溶质质量分数公式综合分析和解决实际问题的能力.1年前查看全部
- [选修一化学与技术]联碱法(候氏制碱法)和氨碱法的生产流程简要表示如下图:
[选修一化学与技术]联碱法(候氏制碱法)和氨碱法的生产流程简要表示如下图: 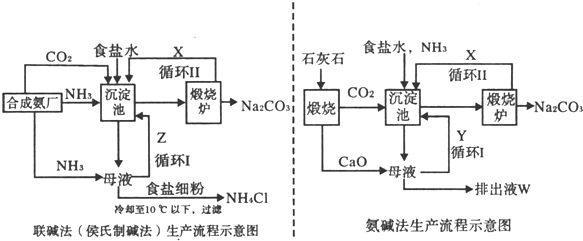
(1)沉淀池中发生反应的化学方程式为______;
(2)X是______,Y是______ (填化学式);
(3)Z中除了溶解的氨气、食盐外,其它溶质还有______;排出液中的溶质除了氢氧化钙外,还有______;
(4)从理论上分析,在氨碱法生产过程中______ (填“需要”、“不需要”)补充氨气,从原料到产品,氨碱法总反应过程用化学方程式表示,可写为______;
(5)根据联碱法中从母液中提取氯化铵晶体的过程推测,所得结论正确是______;
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气目的是使氯化铵更多析出
c.加入食盐细粉目的是提高Na + 的浓度,促进碳酸氢钠结晶析出
(6)联碱法中,每当通入NH 3 44.8L(巳折合成标准状况下)时可以得到纯碱100.0g则NH 3 的利用率为______.相比于氨碱法,指出联碱法的一项优点______• zhong8888801年前1
zhong8888801年前1 -
 蹒跚学步 共回答了18个问题
蹒跚学步 共回答了18个问题 |采纳率94.4%(1)依据流程图分析可知,生产流程联碱法和氨碱法生产流程中沉淀池中发生的反应是氨气、二氧化碳、水、氯化钠反应生成碳酸氢钠晶体和氯化铵,所以反应的化学方程式为:NaCl+NH 3 +CO 2 +H 2 O═NaHCO 3 ↓+NH 4 Cl,故答案为:NaCl+NH 3 +CO 2 +H 2 O═NaHCO 3 ↓+NH 4 Cl;
(2)联碱法生产流程图中分析循环Ⅱ中是碳酸氢钠分解生成的二氧化碳气体;氨碱法的生产流程中循环Ⅰ是氧化钙和水反应生成氢氧化钙,氢氧化钙与铵盐反应生成的氨气可以循环使用,故答案为:CO 2 ;NH 3 ;
(3)依据两个过程中的物质发生的反应分析,联碱法母液主要是氯化铵、碳酸钠、碳酸氢钠、氯化钠;Z中除了溶解的氨气、食盐外,其它溶质还有氯化铵、碳酸钠;氨碱法排出液中的溶质除了氢氧化钙外,还有氢氧化钙和氯化铵反应生成的氯化钙,氯化钠,故答案为:Na 2 CO 3 、NH 4 Cl;CaCl 2 、NaCl;
(4)从理论上分析,氨碱法生产过程中,母液中加入氧化钙反应生成氢氧化钙会和铵盐生成氨气,反应过程中氨气转化为铵盐,铵盐转化为氨气,氨气循环使用,不需要补充氨气;
NaCl+NH 3 +CO 2 +H 2 O═NaHCO 3 ↓+NH 4 Cl;CaCO 3 ═CaO+CO 2 ↑;CaO+H 2 O═Ca(OH) 2 ;Ca(OH) 2 +2NH 4 Cl═CaCl 2 +2NH 3 ↑+2H 2 O;2NaHCO 3 ═Na 2 CO 3 +H 2 O+CO 2 ↑合并得到总化学方程式为:CaCO 3 +2NaCl═Na 2 CO 3 +CaCl 2 ,故答案为:不需要;CaCO 3 +2NaCl═Na 2 CO 3 +CaCl 2 ;
(5)联碱法中从母液中提取氯化铵晶体的过程中;
a、温时氯化铵的溶解度比氯化钠大,故a错误;
b、通氨气作用有增大NH 4 + 的浓度,使NH 4 Cl更多地析出和使NaHCO 3 转化为Na 2 CO 3 ,提高析出的NH 4 Cl纯度,故b正确;
c、加入食盐细粉目的是提高Cl - 的浓度,促进氯化铵结晶析出,故c错误;
故答案为:b;
(6)联碱法中发生的反应为:NaCl+NH 3 +CO 2 +H 2 O═NaHCO 3 ↓+NH 4 Cl;2NaHCO 3 ═Na 2 CO 3 +H 2 O+CO 2 ↑;每当通入NH 3 44.8L(巳折合成标准状况下)物质的量为2mol;生产过程中得到纯碱100.0g,物质的量为
100g
106g/mol =
50
53 mol;需要氨气的物质的量为
50
53 ×2 =
100
53 mol;则NH 3 的利用率=
100
53 mol
2mol ×100%=94.3%;
联合制碱法与氨碱法比较,其最大的优点是使食盐的利用率提高到96%以上,应用同量的食盐比氨碱法生产更多的纯碱.另外它综合利用了氨厂的二氧化碳和碱厂的氯离子,同时,生产出两种可贵的产品--纯碱和氯化铵.将氨厂的废气二氧化碳,转变为碱厂的主要原料来制取纯碱,这样就节省了碱厂里用于制取二氧化碳的庞大的石灰窑;将碱厂的无用的成分氯离子(Cl - )来代替价格较高的硫酸固定氨厂里的氨,制取氮肥氯化铵.从而不再生成没有多大用处,又难于处理的氯化钙,减少了对环境的污染,并且大大降低了纯碱和氮肥的成本,充分体现了大规模联合生产的优越性,
故答案为:94.3%;不产生无用的CaCl 2 ,提高了食盐的转化率.1年前查看全部
- 用“候氏制碱法”制得的纯碱中常含有少量的氯化钠。为测定某纯碱样品中碳酸钠的质量分数,小雯同学称取该样品5.6g加入到盛有
用“候氏制碱法”制得的纯碱中常含有少量的氯化钠。为测定某纯碱样品中碳酸钠的质量分数,小雯同学称取该样品5.6g加入到盛有100g足量稀盐酸的烧杯中,完全反应后称得烧杯中的溶液质量为103.4g。求该纯碱样品中碳酸钠的质量分数。
 yourapple1年前1
yourapple1年前1 -
 古怪大 共回答了19个问题
古怪大 共回答了19个问题 |采纳率84.2%94.6%
1年前查看全部
- 下列叙述中不正确的是 A.静电除尘治理悬浮颗粒物污染,其依据是胶体的电泳原理 B.“候氏制碱法中”,在饱和的NaCl溶液
下列叙述中不正确的是
A.静电除尘治理悬浮颗粒物污染,其依据是胶体的电泳原理 B.“候氏制碱法中”,在饱和的NaCl溶液中先通入NH 3 ,再通入CO 2 C.水的离子积常数随温度的升高而增大,60℃时0.01mol/LNaOH 溶液PH =12 D.叠氮酸与醋酸的酸性相似,在NaN 3 的水溶液中存在离子浓度:c(Na + )> c(N 3 - )> c(OH - )> c(H + )  dljiang1年前1
dljiang1年前1 -
 肚腩哥哥 共回答了23个问题
肚腩哥哥 共回答了23个问题 |采纳率91.3%C
答案:C
A.正确,胶体中胶粒往往带电荷,静电除尘治理悬浮颗粒物污染,其依据是胶体的电泳原理。
B.正确,“候氏制碱法中”,在饱和的NaCl溶液中先通入NH 3 ,再通入CO 2 ,因为CO 2 溶解度小,先通CO 2 无法得到所需浓度的HCO 3 ―
C.不正确,水的离子积常数随温度的升高而增大,60℃时K W =10 ―12 ,0.01mol/LNaOH 溶液PH =10
D.正确,叠氮酸与醋酸的酸性相似,在NaN 3 的水溶液中N 3 ― 部分水解,存在离子浓度:c(Na + )> c(N 3 - )> c(OH - )> c(H + )1年前查看全部
- 候氏制碱法中为什么要先通氨气
 沫儿01年前2
沫儿01年前2 -
 陈敏邵昆 共回答了27个问题
陈敏邵昆 共回答了27个问题 |采纳率88.9%先通氨气,可以让更多的二氧化碳溶于水中1年前查看全部
- 候德榜的“候氏制碱法”的几个化学方程式是什么?
候德榜的“候氏制碱法”的几个化学方程式是什么?
制碱所用的起始原料是那些? xingkong051年前2
xingkong051年前2 -
 长得帅有个rr 共回答了19个问题
长得帅有个rr 共回答了19个问题 |采纳率94.7%NH3+CO2+H20+NaCl=NH4Cl+NaHCO3 (NaHCO3 因溶解度较小,故为沉淀,使反应得以进行)
2NaHCO3=Na2CO3+CO2+H2O ("="上应有加热的符号)1年前查看全部
大家在问
- 1某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应
- 2昱 怎么读?
- 3写一篇创造森林城市的征文600字
- 4Why not express your love to him?
- 5冰变成水最快的方法是加热吗?
- 6我打扫房间 作文
- 7forget about things that are over and done with
- 8下面是小明写给爷爷的一封信,请你选择4~6处用规定的符号(不必全使用)在原文上直接修改。(4分)
- 9作文地震中的父与子38个小时内,阿曼达和14个同学是怎样在废墟中活下来的
- 10乙烯的实验室制法里面说过要把温度保持在165~170之间,要是温度上升到170度以上会生成什么?
- 11在平行四边形ABCD中,对角线AC的垂直平分线交AD于点E,交BC于点F,已知平行四边形ABCD的周长为16
- 12若U=R,A={x|(1/2)^(x 2)(x 3)>1},B={x|log3(x-a)
- 13try his best 造句 5个带翻译
- 14我寄了一封挂号信区香港,邮局给我的回执,全部是英文!我看不懂香港那边到底有没有收到,麻烦帮我翻译一下.
- 15分别取若干毫升稀FeCl3溶液与稀KSCN 溶液混合,溶液呈血红色.限用FeCl3、KSCN、 KCl三种试剂,仪器不限
