(2014•平顶山二模)一辆有约30吨硝酸的罐车在某厂道路发生侧翻,硝酸泄露,散发出黄色烟雾,流到石灰石地面,发出嘶嘶声
 yuyukosu2022-10-04 11:39:541条回答
yuyukosu2022-10-04 11:39:541条回答 (2014•平顶山二模)一辆有约30吨硝酸的罐车在某厂道路发生侧翻,硝酸泄露,散发出黄色烟雾,流到石灰石地面,发出嘶嘶声,产生大量气泡,泄露出来的硝酸不断流进路边的排水沟,气味十分刺鼻.
(2014•平顶山二模)一辆有约30吨硝酸的罐车在某厂道路发生侧翻,硝酸泄露,散发出黄色烟雾,流到石灰石地面,发出嘶嘶声,产生大量气泡,泄露出来的硝酸不断流进路边的排水沟,气味十分刺鼻.(1)由题给信息可知,硝酸的物理性质是______(任写一条)
(2)硝酸见光后,除分解生成二氧化氮气体外,还生成水及占空气体积分数约21%的气体,实验室保存硝酸应密封,遮光保存在棕色瓶内,放在低温阴凉处,硝酸见光分解的化学方程式为
| ||
| ||
(3)为消除硝酸对环境的污染,对泄露的酸必须处理,经济上合理、对环境污染小的化学处理方法是______.

已提交,审核后显示!提交回复
共1条回复
 fvghuj 共回答了13个问题
fvghuj 共回答了13个问题 |采纳率76.9%- 解题思路:(1)物理性质是不需要通过化学变化表现出来的性质:物质的颜色、状态、熔点、沸点、密度、硬度、溶解性、挥发性、导电性、导热性等;根据酸可以和碳酸盐反应产生二氧化碳分析现象;
(2)根据题目的信息分析保存方法及反应的方程式;
(3)根据酸碱中和的原理分析处理方法.解;(1)物质的颜色、状态、熔点、沸点、密度、硬度、溶解性、挥发性、导电性、导热性都属于物理性质,由题干可知硝酸是无色液体,有挥发性属于物理性质;因为硝酸和碳酸钙反应产生二氧化碳,所以硝酸泄漏到石灰石地面发出嘶嘶声是产生的二氧化碳气体;
故答案为:无色液体,有挥发性;二氧化碳;
(2)由于硝酸见光易分解,所以保存时还要避光,可以保存在棕色瓶中;硝酸分解产生二氧化氮、水和占空气体积分数约21%的气体是氧气,因此反应的方程式为:4HNO3
光
.
2H2O+4NO2↑+O2↑;
故答案为:避光保存在棕色瓶内;4HNO3
光
.
2H2O+4NO2↑+O2↑;
(3)为消除硝酸对环境的污染,对泄露的酸必须处理,可以利用酸碱中和反应进行处理,而在经济上合理、对环境污染小的碱是熟石灰;
故答案为:向上面撒熟石灰.点评:
本题考点: 酸的化学性质;酸的物理性质及用途;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题是一道信息给与题,难度不大,依据题目的信息结合相关的知识分析即可,解答本题关键是要知道物理性质的判断方法,硝酸的保存方法,化学方程式的书写方法及酸碱中和的原理等. - 1年前
相关推荐
- (2013•平顶山二模)某一物体由若干相同的小正方体组成,其主视图和左视图分别如图所示,则该物体所含小正方体的个数最多有
 (2013•平顶山二模)某一物体由若干相同的小正方体组成,其主视图和左视图分别如图所示,则该物体所含小正方体的个数最多有( )
(2013•平顶山二模)某一物体由若干相同的小正方体组成,其主视图和左视图分别如图所示,则该物体所含小正方体的个数最多有( )
A.5个
B.6个
C.7个
D.8个 落地怕有瓦1年前1
落地怕有瓦1年前1 -
 zhanglei52 共回答了18个问题
zhanglei52 共回答了18个问题 |采纳率94.4%由主视图可得最底层小正方体的列数为3,由左视图可得最底层小正方体的行数为2,
∴最底层最多有3×2=6个正方体,
∵第二层只有1个正方体,
∴该物体所含小正方体的个数最多有7个.
故选C.1年前查看全部
- (2014•平顶山二模)如图中“”表示碳原子,“”表示氧原子
(2014•平顶山二模)如图中“
 ”表示碳原子,“
”表示碳原子,“ ”表示氧原子
”表示氧原子
其中表示混合物的是______(填图的编号),B与C反应生成D的化学方程式是2CO+O2
2CO2点燃 .2CO+O2.
2CO2点燃 . qj_827151年前1
qj_827151年前1 -
 chloe8282 共回答了22个问题
chloe8282 共回答了22个问题 |采纳率95.5%解题思路:由多种物质组成的物质为混合物,因此,表示混合物的微粒示意图中应含有多种构成不同的分子;利用构成不同的分子为不同种分子,由一种分子构成,属于纯净物,由不同原子构成,属于化合物,由同种原子构成,属于单质.B是氧气,C是一氧化碳,D是二氧化碳,根据一氧化碳和氧气反应生成二氧化碳,写出反应的方程式.A图示可知由三种分子构成,属于混合物;
B是氧气,C是一氧化碳,D是二氧化碳,根据一氧化碳和氧气反应生成二氧化碳,反应的方程式为:2CO+O2
点燃
.
2CO2
答案:A 2CO+O2
点燃
.
2CO2点评:
本题考点: 微粒观点及模型图的应用;纯净物和混合物的判别;书写化学方程式、文字表达式、电离方程式.
考点点评: 分子由原子构成,构成相同的分子为同种物质的分子,属于纯净物,构成不同的分子为不同种物质的分子,属于混合物.1年前查看全部
- 下列城市与其主要工业部门的组合,正确的是( ) A.郑州——钢铁工业 B.洛阳——电子工业 C.平顶山——煤炭工业 D
下列城市与其主要工业部门的组合,正确的是( )
A.郑州——钢铁工业 B.洛阳——电子工业 C.平顶山——煤炭工业 D.开封——石油工业  w哈哈哈1年前1
w哈哈哈1年前1 -
 冻结888 共回答了14个问题
冻结888 共回答了14个问题 |采纳率92.9%C
1年前查看全部
- (2014•平顶山二模)如图,已知,在平面直角坐标系内,点B的坐标为(6,8),过点B分别向x轴和y轴作垂线,垂足分别为
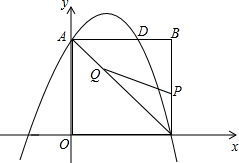 (2014•平顶山二模)如图,已知,在平面直角坐标系内,点B的坐标为(6,8),过点B分别向x轴和y轴作垂线,垂足分别为C、A,抛物线y=-[4/9]x2+bx+c经过A、C,与AB交于点D.
(2014•平顶山二模)如图,已知,在平面直角坐标系内,点B的坐标为(6,8),过点B分别向x轴和y轴作垂线,垂足分别为C、A,抛物线y=-[4/9]x2+bx+c经过A、C,与AB交于点D.
(1)求抛物线的函数解析式;
(2)点P为线段BC上一个动点(不与点C重合),点Q为线段AC上一个动点,AQ=CP,连接PQ,设CP=m,△CPQ的面积为S.
(3)①求S关于m的函数表达式,并求出m为何值时,S取得最大值;
②当S最大时,在抛物线y=-[4/9]x2+bx+c的对称轴l上,若存在点F,使得△DFQ为直角三角形,请直接写出所有符合条件的点F的坐标,若不存在,请说明理由. kldman1年前1
kldman1年前1 -
 suoshi1 共回答了22个问题
suoshi1 共回答了22个问题 |采纳率77.3%解题思路:(1)将A、C两点坐标代入抛物线y=-[4/9]x2+bx+c,即可求得抛物线的解析式;
(2)①先用m表示出QE的长度,进而求出三角形的面积S关于m的函数,配方后即可确定最大值;
②直接写出满足条件的F点的坐标即可,注意不要漏写.(1)∵点B的坐标为(6,8),过点B分别向x轴和y轴作垂线,垂足分别为C、A,
∴点A的坐标为(0,8),点C的坐标为(6,0),
∴将A、C两点坐标代入抛物线,得
c=8
−
4
9×36+6b+c=0,
解得:
b=
4
3
c=8,
∴抛物线的解析式为y=-[4/9]x2+[4/3]x+8;
(2)①∵OA=8,OC=6 ,
,
∴AC═10,
过点Q作QE⊥BC与E点,则sin∠ACB=[QE/QC]=[AB/AC]=[3/5],
∴[QE/10−m]=[3/5],
∴QE=[3/5](10-m),
∴S=[1/2]•CP•QE=[1/2]m×[3/5](10-m)=-[3/10]m2+3m=-[3/10](m-5)2+[15/2],
∴当m=5时,有最大面积;
②在抛物线对称轴l上存在点F,使△FDQ为直角三角形,
∵抛物线的解析式为y=-[4/9]x2+[4/3]x+8的对称轴为x=[3/2],
D的坐标为(3,8),Q(3,4),
当∠FDQ=90°时,F1([3/2],8),
当∠FQD=90°时,则F2([3/2],4),
当∠DFQ=90°时,设F([3/2],n),
则FD2+FQ2=DQ2,
即[9/4]+(8-n)2+[9/4]+(n-4)2=16,
解得:n=6±
7
2,
∴F3([3/2],6+
7
2),F4([3/2],6-
7
2),
满足条件的点F共有四个,坐标分别为
F1([3/2],8),F2([3/2],4),F3([3/2],6+
7
2),F4([3/2],6-
7
2).点评:
本题考点: 二次函数综合题.
考点点评: 本题是二次函数的综合题,其中涉及到的知识点有抛物线的解析式的求法抛物线的最值等知识点,是各地中考的热点和难点,解题时注意数形结合数学思想的运用,同学们要加强训练,属于中档题.1年前查看全部
- (2013•平顶山)某溶液中含有大量的下列离子:Fe3+、SO42-、Al3+和M离子,且这四种离子Fe3+、SO42-
(2013•平顶山)某溶液中含有大量的下列离子:Fe3+、SO42-、Al3+和M离子,且这四种离子Fe3+、SO42-、Al3+和M的物质的量之比为2:4:1:1,则M离子可能为下列中的( )
A.Na+
B.I-
C.S2-
D.Cl- 楚小虫1年前1
楚小虫1年前1 -
 xiaoyao2220 共回答了16个问题
xiaoyao2220 共回答了16个问题 |采纳率81.3%解题思路:根据电荷守恒判断M离子,并根据离子能否大量共存判断可能存在的离子.根据题目条件和电荷守恒可知:3n(Fe3+)+3n(Al3+)=2n(SO42-)+n(M),即:2×3+3×1=2×4+M,M=1,M应带有1个单位的负电荷,又碘离子不能与铁离子大量共存,所以M只能为选项中的氯离子.
故选D.点评:
本题考点: 离子共存问题.
考点点评: 本题考查离子共存问题,本题的关键为根据电荷守恒判断离子的种类.1年前查看全部
- (2010•平顶山模拟)短周期元素X、Y、Z的离子具有相同的核外电子排布,离子半径Y大于Z,Y与Z可形成常见的离子化合物
(2010•平顶山模拟)短周期元素X、Y、Z的离子具有相同的核外电子排布,离子半径Y大于Z,Y与Z可形成常见的离子化合物,原子半径X大于Z,则下列说法中不正确的是( )
A.原子序数一定是Z>X>Y
B.X、Z两种元素的单质的沸点一定是Z>X
C.Z的最高价氧化物一定能溶于X、Y的最高价氧化物的水化物
D.工业上获得X、Z单质的方法主要是电解 妖精七七DJ1年前1
妖精七七DJ1年前1 -
 世纪冷清秋儿 共回答了17个问题
世纪冷清秋儿 共回答了17个问题 |采纳率88.2%解题思路:短周期元素X、Y、Z的离子具有相同的核外电子排布,则可能为O2-、F-、Na+、Mg2+、Al3+等离子,由题目可知y、z中有一为金属,一为非金属,已知离子半径Y大于Z,故Y为非金属,在上一周期,又原子半径X大于Z,故X在Z的前面,为金属,Z可能是镁或铝,以此解答该题.短周期元素X、Y、Z的离子具有相同的核外电子排布,则可能为O2-、F-、Na+、Mg2+、Al3+等离子,由题目可知y、z中有一为金属,一为非金属,已知离子半径Y大于Z,故Y为非金属,在上一周期,又原子半径X大于Z,故X在Z的前面,为金属,Z可能是镁或铝,
A、X在Y、Z的上一周期,X、Z在同一周期,X在Z的前面,所以原子序数一定是Z>X>Y,故A正确;
B、X为非金属,在常温下为气体,Z在常温下为固体,则X、Z两种元素的单质的沸点一定是Z>X,故B正确;
C、X为O、F无最高价氧化物,如Z为Mg元素,则不能溶于NaOH溶液,故C错误;
D、Mg、Al都为活泼金属,工业冶炼常用电解方法,故D正确.
故选C.点评:
本题考点: 原子结构与元素周期律的关系.
考点点评: 本题考查原子结构与元素周期律的关系,题目难度不大,正确推断元素的种类是解答本题的关键,要正确把握元素周期律的递变规律.1年前查看全部
- (2009•平顶山一模)有一根粗铝条含铁和硅两种杂质.取等质量的样品分别投入足量的稀盐酸和足量的稀氢氧化钠溶液中,放出等
(2009•平顶山一模)有一根粗铝条含铁和硅两种杂质.取等质量的样品分别投入足量的稀盐酸和足量的稀氢氧化钠溶液中,放出等量的H2,则该粗铝中铁和硅的关系正确的是:( )
①物质的量之比为2:1;②物质的量之比为3:1; ③质量之比为2:1;④质量之比为4:1.
A.②④
B.②③
C.①④
D.只有④ 子楼梦盼1年前1
子楼梦盼1年前1 -
 rr之泪 共回答了19个问题
rr之泪 共回答了19个问题 |采纳率68.4%解题思路:粗铝条投入盐酸中发生反应:2Al+6HCl═2AlCl3+3H2↑、Fe+2HCl═FeCl2+H2↑,盐酸足量,Fe、Al完全反应.粗铝条投入氢氧化钠溶液中发生反应:Si+2NaOH+H2O═Na2SiO3+2H2↑,2Al+2NaOH+2H2O═2NaAlO2+3H2↑,由于氢氧化钠溶液足量,Al、Si完全反应,由方程式可知,相同物质的量的Al与盐酸、氢氧化钠溶液溶液产生的氢气的物质的量相等,两过程产生的氢气的物质的量相等,则Fe与盐酸产生的氢气等于Si与氢氧化钠溶液反应生成的氢气,据此计算判断.由应2Al+6HCl═2AlCl3+3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑可知,相同物质的量的Al与盐酸、氢氧化钠溶液溶液产生的氢气的物质的量相等,
等质量的样品分别投入足量的稀盐酸和氢氧化钠溶液中,充分反应后都放出等量的氢气,则反应Fe+2HCl═FeCl2+H2↑、Si+2NaOH+H2O═Na2SiO3+2H2↑中生成的氢气相同,
若都生成2molH2,则n(Fe)=2mol,n(Si)=1mol,故粗铝中铁和硅的物质的量比为2mol:1mol=2:1,铁和硅的质量之比为2mol×56g/mol:1mol×28g/mol=4:1,
故选C.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查Al、Fe、Si的化学性质阳极混合的有关计算等,根据发生的化学反应判断Fe与盐酸产生的氢气等于Si与氢氧化钠溶液反应生成的氢气是解题的关键,难度中等.1年前查看全部
- (2011•平顶山一模)假如你是空气质量观察站的人员,发现一些建筑物外墙的石灰石正不断剥蚀.请根据这一情况,探究石灰石不
(2011•平顶山一模)假如你是空气质量观察站的人员,发现一些建筑物外墙的石灰石正不断剥蚀.请根据这一情况,探究石灰石不断剥蚀的原因,完成下列3小题.
(1)你假设产生这一现象的原因是什么?
答:______;
(2)你作出上述假设的根据是什么?
答:______;
(3)作为空气质量观察员,你打算设计怎样的实验方案证明你的假设?
答:____________. 躲在ww里的猫1年前1
躲在ww里的猫1年前1 -
 tagc2bw 共回答了17个问题
tagc2bw 共回答了17个问题 |采纳率82.4%解题思路:石灰石的主要成分是碳酸钙,碳酸钙能和显酸性的物质反应.例如二氧化硫、二氧化氮等物质溶于水时能生成亚硫酸或硫酸、硝酸等物质,这些物质能和碳酸钙反应从而腐蚀石灰石.(1)石灰石正不断剥蚀,说明石灰石和其它物质发生了反应,石灰石和显酸性的物质反应.故填:建筑物所在地的空气中含有大量的酸性气体.
(2)酸性气体溶于水能和碳酸钙反应.故填:酸性气体能与石灰石反应,大量的酸性气体能显著地腐蚀石灰石.
(3)证明方法是:提取建筑物所在地的空气样品;将适量的空气样品通入蒸馏水中;用pH试纸测通入空气样品后的蒸馏水的pH和未通入空气样品的蒸馏水的pH,并进行比较.点评:
本题考点: 酸雨的产生、危害及防治;溶液的酸碱性测定;碳酸钠、碳酸氢钠与碳酸钙.
考点点评: 解答本题要充分理解石灰石的性质方面的知识,只有这样才能对相关方面的问题做出正确的判断.1年前查看全部
- (2014•平顶山二模)根据下列装置图1,回答有关问题:
(2014•平顶山二模)根据下列装置图1,回答有关问题:
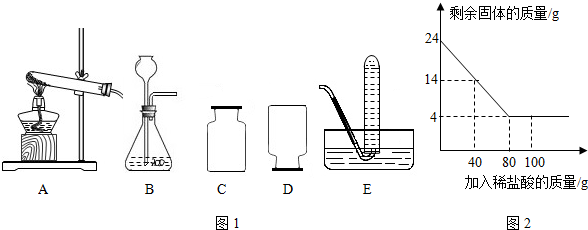
(1)用高锰酸钾制取氧气的化学方程式为2KMnO4
K2MnO4+MnO2+O2↑△ .2KMnO4.若选择A作该反应的发生装置,则装置A中的试管口还要
K2MnO4+MnO2+O2↑△ .
放一团______,且试管口略微向下倾斜,原因是______.
(2)实验室制取某气体时,即可用D也可用E装置收集,由此推测该气体所具有的物理性质是______(填序号).
a.该气体的密度大于空气 b.该气体难溶于水 c.该气体的密度小于空气
(3)实验室制取CO2有以下主要步骤:①连接好装置;②______;③向试管中小心放入几小块石灰石;④向试管中小心注入适量稀盐酸;⑤收集产生的气体;⑥用燃烧的木条检验收集瓶是否收集满CO2.
(4)若要用装置E收集CO2气体,要将水换成温水,其理由是______.
(5)某化学兴趣小组为了测定当地的石灰石中CaCO3的质量分数,他们做了如下实验:取24g样品放入烧杯中,向其中逐渐加入100克一定质量分数的稀盐酸(杂质不溶于水也不与酸反应),所用盐酸的质量分数与剩余固体的质量关系如图2所示,请根据图中的数据进行计算:
(a)石灰石样品中CaCO3的质量为______克.
(b)24克石灰石样品与盐酸充分反应后最多产生多少克二氧化碳?(请根据化学方程式写出完整的计算步骤) 我是cc不信是猪1年前1
我是cc不信是猪1年前1 -
 完全不好笑 共回答了23个问题
完全不好笑 共回答了23个问题 |采纳率95.7%解题思路:制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热,加热高锰酸钾时,试管口要放一团棉花,是为了防止高锰酸钾粉末进入导管.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.实验室制取CO2,是在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集.实验室制取某气体时,即可用D也可用E装置收集,由此推测该气体所具有的物理性质是:该气体难溶于水,该气体的密度小于空气;实验室制取CO2的首要主要步骤是:连接好装置,检查装置的气密性;若要用装置E收集CO2气体,要将水换成温水,其理由是:气体的溶解度随温度的升高而减小,所以CO2气体在温水中的溶解度较小.由图象可知:石灰石样品中CaCO3的质量=24g-4g=20g;然后根据化学式的计算求二氧化碳的质量.(1)如果用高锰酸钾或氯酸钾制氧气就需要加热,加热高锰酸钾时,试管口要放一团棉花,是为了防止高锰酸钾粉末进入导管;试管口略微向下倾斜,原因是:防止冷凝水倒流使试管炸裂;故答案为:2KMnO4
△
.
K2MnO4+MnO2+O2↑棉花防止冷凝水倒流使试管炸裂
(2)实验室制取某气体时,即可用D也可用E装置收集,由此推测该气体所具有的物理性质是:该气体难溶于水,该气体的密度小于空气;故答案为:bc
(3)实验室制取CO2的首要主要步骤是:连接好装置,检查装置的气密性;故答案为:检查装置的气密性
(4)若要用装置E收集CO2气体,要将水换成温水,其理由是:气体的溶解度随温度的升高而减小,所以CO2气体在温水中的溶解度较小;故答案为:气体的溶解度随温度的升高而减小,所以CO2气体在温水中的溶解度较小 (或降低CO2在水中的溶解度)
(5)由图象可知:石灰石样品中CaCO3的质量=24g-4g=20g;故答案为:(a)20
(b)设产生CO2的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
10044
20gx
[100/44=
20g
x]x=8.8g
答:产生CO2的质量为8.8g
故答案为:(b)8.8g;点评:
本题考点: 常用气体的发生装置和收集装置与选取方法;实验室制取氧气的反应原理;制取二氧化碳的操作步骤和注意点;根据化学反应方程式的计算.
考点点评: 本考点主要考查了气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写、注意事项和有关的计算等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.1年前查看全部
- (2009•平顶山一模)A、B、C、D、E是原子序数依次增大的五种短周期元素.A原子的电子层数与它的核外电子总数相同,A
(2009•平顶山一模)A、B、C、D、E是原子序数依次增大的五种短周期元素.A原子的电子层数与它的核外电子总数相同,A与C、B与D分别为同主族,B和C的最外层电子数之和与E的最外层电子数相同.A与E形成的化合物化学式为AE,其分子中含18个电子.请回答下列问题:
(1)A元素单质的化学式为______,D元素的原子结构示意图为______.
(2)由A、B、C三种元素形成的化合物的电子式为______,这种化合物形成的晶体中所含的化学键类型有______.
(3)A2B的沸点高于A2D,其原因是______.
(4)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1:1:1,在25℃时,将该盐溶于水,测得溶液pH>7,理由是______(用离子方程式表示);将该盐溶液在空气中露置一段时间后(充分光照,不考虑水分的挥发),溶液的pH近似为7,则该过程的总反应方程式为______. happytears_19811年前1
happytears_19811年前1 -
 海狗油 共回答了17个问题
海狗油 共回答了17个问题 |采纳率94.1%解题思路:A、B、C、D、E是原子序数依次增大的五种短周期元素,A原子的电子层数与它的核外电子总数相同,则A为氢元素;A与E形成的化合物化学式为AE,其分子中含18个电子,故E为氯元素;A与C同主族,处于ⅠA族,B和C的最外层电子数之和与E的最外层电子数相同,则B的最外层电子数为7-1=6,处于ⅥA族,B与D为同主族,原子序数B小于D,则B为氧元素,D为硫元素;C原子序数大于氧元素,C与氢元素为同主族,故C为钠元素,据此解答.A、B、C、D、E是原子序数依次增大的五种短周期元素,A原子的电子层数与它的核外电子总数相同,则A为氢元素;A与E形成的化合物化学式为AE,其分子中含18个电子,故E为氯元素;A与C同主族,处于ⅠA族,B和C的最外层电子数之和与E的最外层电子数相同,则B的最外层电子数为7-1=6,处于ⅥA族,B与D为同主族,原子序数B小于D,则B为氧元素,D为硫元素;C原子序数大于氧元素,C与氢元素为同主族,故C为钠元素,
(1)A元素单质的化学式为H2,D为硫元素,其原子结构示意图为 ,故答案为:H2;
,故答案为:H2; ;
;
(2)由A、B、C三种元素形成的化合物为NaOH,氢氧化钠是离子化合物,由钠离子与氢氧根离子构成,电子式为 .晶体中钠离子与氢氧根离子之间形成离子键,氢氧根离子中氢原子与氧原子之间形成共价键,
.晶体中钠离子与氢氧根离子之间形成离子键,氢氧根离子中氢原子与氧原子之间形成共价键,
故答案为: ;离子键、共价键;
;离子键、共价键;
(3)H2O分子之间存在氢键,其沸点高于H2S,故答案为:H2O分子之间存在氢键;
(4)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1:1:1,该盐为NaClO,次氯酸钠属于强碱弱酸盐,在溶液中ClO-发生水ClO-+H2O⇌HClO+OH-,使溶液呈碱性,溶液pH>7;
将该盐溶液在空气中露置一段时间后(充分光照,不考虑水分的挥发),HClO分解为HCl与氧气,HCl与氢氧化钠反应生成NaCl,故最终溶液几乎为NaCl溶液,溶液的pH近似为7,则该过程的总反应方程式为2NaClO=2NaCl+O2↑,
故答案为:ClO-+H2O⇌HClO+OH-;2NaClO=2NaCl+O2↑.点评:
本题考点: 位置结构性质的相互关系应用.
考点点评: 本题考查结构性质位置关系应用,涉及元素推断及元素化合物性质、常用化学用语、盐类水解等,推断元素是解题关键,难度中等.1年前查看全部
- (2011•平顶山一模)一种“环保石头纸”在2010年的两会上以便签、文件袋等形式首次亮相.“环保石头纸”的主要成份为碳
(2011•平顶山一模)一种“环保石头纸”在2010年的两会上以便签、文件袋等形式首次亮相.“环保石头纸”的主要成份为碳酸钙,假定其它成份不参与化学反应,请写出(1)(2)中反应的化学方程式并回答(3)中的有关问题.
(1)用高温烘烤这种“环保石头纸”CaCO3
CaO+CO2↑高温 .CaCO3.
CaO+CO2↑高温 .
(2)将这种“环保石头纸”投入稀盐酸中______.
(3)若推广这种“石头纸”,可以减少树木的砍伐.过度砍伐树木带来的后果是什么?(写出一种) majjei1年前1
majjei1年前1 -
 回不去了HARELUY 共回答了17个问题
回不去了HARELUY 共回答了17个问题 |采纳率88.2%解题思路:碳酸钙高温分解能生成氧化钙和二氧化碳,能与盐酸反应生成氯化钙、二氧化碳和水,过度砍伐树木将会导致水土流失.(1)碳酸钙高温能分解生成氧化钙和二氧化碳,所以本题答案为:CaCO3
高温
.
CaO+CO2↑;
(2)碳酸钙能与盐酸反应生成氯化钙、水和二氧化碳,所以本题答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(3)过度砍伐树木将会导致水土流失,所以本题答案为:水土流失.点评:
本题考点: 碳酸钙、生石灰、熟石灰之间的转化;碳酸钠、碳酸氢钠与碳酸钙;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了碳酸钙的有关性质,完成此题,可以依据已有的知识进行.1年前查看全部
- (2011•平顶山一模)下面是某学生对课本中图表资料的使用情况,其中不正确的是( )
(2011•平顶山一模)下面是某学生对课本中图表资料的使用情况,其中不正确的是( )
A.根据元素周期表可以判断元素在自然界的含量
B.根据金属活动性顺序表,判断金属能否置换出稀硫酸中的氢
C.根据溶解度曲线图,判断某物质在一定温度下的的溶解度
D.根据酸、碱、盐的溶解性表,判断某些复分解反应能否进行 长发男人1年前1
长发男人1年前1 -
 亚平宁之风 共回答了15个问题
亚平宁之风 共回答了15个问题 |采纳率100%解题思路:A、根据元素在自然界的含量是通过计算得出来的,进行解答;
B、根据金属活动顺序可以作为金属能否在溶液中发生置换反应的一种判断依据,进行解答;
C、溶解度曲线可以查出某物质在一定温度时的溶解度,进行解答;
D、在化学反应中,生成物中有沉淀或气体或有水生成时,复分解才可以进行,来解答本题.A、根据元素在自然界的含量是通过计算的出来的,所以根据元素周期表不能判断元素在自然界的含量;故A错误;
B、根据金属活动顺序可以作为金属能否在溶液中发生置换反应的一种判断依据,位于氢前面的金属能置换出盐酸、稀硫酸中的氢,故B正确;
C、溶解度曲线可以查出某物质在一定温度时的溶解度,所以根据溶解度曲线图能判断某物质在一定温度下的溶解度;故C正确;
D、在化学反应中,生成物中有沉淀或气体或有水生成时,复分解才可以进行,所以根据酸、碱、盐的溶解性表能判断某些复分解反应能否进行;故D正确;
故选A.点评:
本题考点: 元素周期表的特点及其应用;固体溶解度曲线及其作用;金属活动性顺序及其应用;酸碱盐的溶解性.
考点点评: 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.1年前查看全部
- (2013•平顶山一模)选择一种试剂(适量)除去下列括号中的杂质(填化学式):
(2013•平顶山一模)选择一种试剂(适量)除去下列括号中的杂质(填化学式):
(1)铜粉(锌粉)______
(2)盐酸(硫酸)______. gg代伟1年前1
gg代伟1年前1 -
 123qqok 共回答了16个问题
123qqok 共回答了16个问题 |采纳率93.8%解题思路:根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.(1)根据金属活动性顺序,铁能和酸反应,铜和酸不反应,故可用盐酸或稀硫酸除去铁,然后过滤即可,能除去杂质且没有引入新的杂质,符合除杂原则.
(2)要除去盐酸中的硫酸,实质就是除去硫酸根离子,可利用氯化钡溶液与硫酸反应生成硫酸钡沉淀和盐酸,然后过滤即可,能除去杂质且没有引入新的杂质,符合除杂原则.
故答案为:(1)稀HCl或H2SO4;(2)BaCl2.点评:
本题考点: 物质除杂或净化的探究.
考点点评: 物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.1年前查看全部
- (2011•平顶山二模)“尾气催化转换器”将汽车尾气中的有毒气体转变为无毒气体.其微观过程如图所示,其中不同的圆球代表不
(2011•平顶山二模)“尾气催化转换器”将汽车尾气中的有毒气体转变为无毒气体.其微观过程如图所示,其中不同的圆球代表不同的原子.下列说法中正确的是( )

A.反应后分子个数变少了
B.反应后原子个数变少了
C.生成物全部是化合物
D.参加反应的两种分子个数比为3:2 娃哈哈kj1061年前1
娃哈哈kj1061年前1 -
 icbczl 共回答了20个问题
icbczl 共回答了20个问题 |采纳率80%解题思路:解答本题关键要了解:在化学反应中,分子变成原子,原子重新组合成新分子,再结合图示所给的信息分析解决即可.根据题目所给示意图可知:
A、参加反应的有四个分子,反应后就三个分子,故选项正确;
B、反应前后原子的种类不变.原子个数也不会改变,分子的种类一定改变,故选项错误.
C、生成物种是两种化合物与一种单质,故选项错误.
D、反应后有一个分子没有参加反应,即参加反应的两种分子均为2个,其个数比为1:1,故选项错误;
故选A.点评:
本题考点: 微粒观点及模型图的应用.
考点点评: 本题通过微观反应图示考查化学反应的微观实质以及物质的结构知识.1年前查看全部
- (2011•平顶山一模)规范的实验操作是获得实验成功的重要保证.下图所示的实验操作正确的是( )
(2011•平顶山一模)规范的实验操作是获得实验成功的重要保证.下图所示的实验操作正确的是( )
A.
点燃酒精灯
B.
取用块状固体
C.
加热液体
D.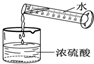
稀释浓硫酸 zxjlang1年前1
zxjlang1年前1 -
 印记的光 共回答了25个问题
印记的光 共回答了25个问题 |采纳率92%解题思路:A、使用酒精灯时要注意“两查、两禁、一不可”.
B、根据向试管中粉末状固体药品的方法进行分析判断.
C、根据给试管中的液体加热的方法进行分析判断.
D、根据浓硫酸的稀释方法进行分析判断.A、使用酒精灯时要注意“两查、两禁、一不可”,禁止用一酒精灯去引燃另一酒精灯,图中所示操作错误.
B、取用粉末状药品,试管横放,用药匙或纸槽把药品送到试管底部,图中所示操作正确.
C、给试管中的液体加热时,用酒精灯的外焰加热试管里的液体,且液体体积不能超过试管容积的[1/3],图中液体超过试管容积的[1/3],、试管夹没有夹在距离试管口[1/4]~[1/3]处,图中所示操作错误.
D、稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散;一定不能把水注入浓硫酸中;图中所示操作错误.
故选:B.点评:
本题考点: 加热器皿-酒精灯;固体药品的取用;给试管里的液体加热;浓硫酸的性质及浓硫酸的稀释.
考点点评: 本题难度不大,熟悉各种仪器的用途及使用注意事项、常见化学实验基本操作的注意事项是解答此类试题的关键.1年前查看全部
- (2014•平顶山二模)重力灯是英国的里弗斯设计的一款概念环保灯,如图所示.设计师为这款灯找到了“可再生能源”,它就是通
 (2014•平顶山二模)重力灯是英国的里弗斯设计的一款概念环保灯,如图所示.设计师为这款灯找到了“可再生能源”,它就是通过一定的装置将重力势能转化为电能.已知重物质量为20kg,每次被举高2cm,LED灯的额定功率为1w.(g取10N/kg)
(2014•平顶山二模)重力灯是英国的里弗斯设计的一款概念环保灯,如图所示.设计师为这款灯找到了“可再生能源”,它就是通过一定的装置将重力势能转化为电能.已知重物质量为20kg,每次被举高2cm,LED灯的额定功率为1w.(g取10N/kg)
(1)重物每被举高一次,人至少对重物做多少J的功?
(2)重物重力做的功有50%转化为电能,每举高一次重物能使该灯正常照明多长时间?
(3)你认为该环保灯设计上还可以有哪些改进?(写出一项即可) kille1年前1
kille1年前1 -
 oo阳光-Fly 共回答了15个问题
oo阳光-Fly 共回答了15个问题 |采纳率86.7%解题思路:(1)在举高的过程中,人对重物做的功其实就是克服重物的重力做功,已知质量可以计算出重物的重力,又知举高的高度,根据W=Gh计算做的功;
(2)根据重物重力做的功与电能之间的关系得到电能的大小,又知LED灯的功率,利用P=[W/t]变形计算时间.
(3)可以通过添加储能装置,从而起到节约、环保的特点.(1)因为G=mg=20kg×10N/kg=200N,所以人对重物的功W=Gh=200N×0.02m=4J.
(2)转化成的电能:W电=η×W=50%×4J=2J.
由P=[W/t]可得,t=
W电
P=[4J/1W]=4s;
(3)如可以添加电能存储装置,做到健身时存储能量以供照明使用等.
答:(1)重物每被举高一次,人至少对重物做了4J的功;
(2)每举高一次重物能使该灯正常照明4s;
(3)可以添加电能存储装置,做到健身时存储能量以供照明使用.点评:
本题考点: 功的计算;电功率与电能、时间的关系.
考点点评: 本题考查功的计算、电功率与电能、时间的关系,属于常见题型,熟练掌握相关的公式是解题的关键.1年前查看全部
- (2013•平顶山二模)学校篮球集训队11名队员进行定点投篮训练,11名队员在1分钟内投进篮筐的球数分别为9、6、9、7
(2013•平顶山二模)学校篮球集训队11名队员进行定点投篮训练,11名队员在1分钟内投进篮筐的球数分别为9、6、9、7、8、9、12、10、9、10、10,这组数据的中位数是______.
 beanzheng1年前1
beanzheng1年前1 -
 jinianbei001 共回答了20个问题
jinianbei001 共回答了20个问题 |采纳率100%解题思路:根据中位数的定义进行解答,先把这组数据从小到大排列起来,找出最中间的数即可.把这组数据从小到大排列为:
6、7、8、9、9、9、9、10、10、10、12,
处于中间位置的数是9,
则这组数据的中位数是9;
故答案为:9.点评:
本题考点: 中位数.
考点点评: 此题考查了中位数,掌握中位数的定义是解题的关键,中位数是将一组数据从小到大(或从大到小)重新排列后,最中间的那个数(最中间两个数的平均数),叫做这组数据的中位数,1年前查看全部
- (2013•平顶山)下列说法正确的是( )
(2013•平顶山)下列说法正确的是( )
A.4.2g丙烯中所含的共价键数目为0.6×6.02×1023
B.含1molH2SO4的浓硫酸与足量铜反应转移的电子总数为6.02×1023
C.相同条件下,1LCO和H2的混合气体完全燃烧消耗0.5LO2
D.相同物质的量OH-和CH3+含有相同数目的电子 石门一雄1年前1
石门一雄1年前1 -
 kk回避 共回答了23个问题
kk回避 共回答了23个问题 |采纳率87%解题思路:A、4.2g丙烯的物质的量是0.1mol,1分子丙烯中含有9个共价键;
B、由于浓硫酸不会完全反应,转移电子数小于0.5mol;
C、相同条件,气体摩尔体积相等,CO和H2消耗氧气的体积比都是1:1;
D、OH-中含有10个电子,CH3+中含有8个电子.A、丙烯分子中含有9个共价键,4.2g丙烯物质的量是0.1mol,含有0.9mol共价键,数目为0.9×6.02×1023,故A错误;
B、随着反应的进行,浓硫酸浓度减小,变成稀硫酸后,不再与铜反应,故1mol浓硫酸与铜反应,被还原的物质的量小于0.5mol,电子总数小于6.02×1023,故B错误;
C、条件相同,气体摩尔体积相等,一氧化碳和氢气消耗氧气的体积比都是1:1的,故1LCO和H2的混合气体完全燃烧消耗0.5LO2,故C正确;
D、由于氢氧根中含有10个电子,CH3+含有8个电子,故同物质的量的二者含有的电子数不同,故D错误;
故选C.点评:
本题考点: 阿伏加德罗常数.
考点点评: 本题通过阿伏伽德罗常数,考查了共价键数目、浓硫酸与铜的反应等知识,难度中等.1年前查看全部
- (2012•平顶山二模)根据图所示,按要求回答问题:
(2012•平顶山二模)根据图所示,按要求回答问题:
(1)图中仪器a的名称是______.
(2)实验室制取氧气所选用的发生装置是______(填序号,下同);
(3)实验室制取二氧化碳时,收集装置是______. jgokok1年前1
jgokok1年前1 -
 lawstudy 共回答了15个问题
lawstudy 共回答了15个问题 |采纳率73.3%解题思路:制取装置包括加热和不需加热两种,如果用双氧水制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.实验室制取CO2,是在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法.(1)集气瓶是常用的收集气体的仪器,故答案为:集气瓶
(2)制取装置包括加热和不需加热两种,如果用双氧水制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热,故答案为:A或B
(3)二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法,故答案为:D点评:
本题考点: 常用气体的发生装置和收集装置与选取方法.
考点点评: 本题考查的是气体的制取装置和收集装置的选择,气体的制取装置的选择与反应物的状态和反应的条件有关;收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在选择题和实验题中.1年前查看全部
- (2013•平顶山二模)下列各数中是负数的是( )
(2013•平顶山二模)下列各数中是负数的是( )
A.|-3|
B.(-3)-1
C.-(-3)
D.(-3)0 songwei4537111年前1
songwei4537111年前1 -
 忘忧草6 共回答了16个问题
忘忧草6 共回答了16个问题 |采纳率100%解题思路:根据绝对值、负整数指数幂、相反数、零指数幂分别进行计算即可.A、|-3|=3,故此选项错误;
B、(-3)-1=-[1/3],故此选项正确;
C、-(-3)=3,故此选项错误;
D、(-3)0=1,故此选项错误;
故选:B.点评:
本题考点: 负整数指数幂;相反数;绝对值;零指数幂.
考点点评: 此题主要考查了绝对值、负整数指数幂、相反数、零指数幂,关键是熟练掌握各知识点的运算公式.1年前查看全部
- (2008•平顶山模拟)下列说法中正确的是( )
(2008•平顶山模拟)下列说法中正确的是( )
①氯气具有漂白性,可以使干燥的有色布条褪色;②过氧化钠是淡黄色粉末,可以用在呼吸面具中做供氧剂;③二氧化硫具有较强的还原性,不能用浓硫酸干燥;④SiO2俗名硅石,化学性质稳定,不跟任何酸碱反应;⑤NH3极易溶于水,其水溶液显碱性;⑥Al(OH)3是两性氢氧化物,能溶于任何酸或碱.
A.仅①②③
B.仅④⑥
C.仅②⑤
D.仅②③⑤ 天生乖宝宝1年前1
天生乖宝宝1年前1 -
 闲逛01 共回答了17个问题
闲逛01 共回答了17个问题 |采纳率82.4%解题思路:①氯气不具有漂白性,具有漂白性的是氯气和水反应生成的次氯酸;
②过氧化钠是淡黄色粉末,过氧化钠因能与CO2反应生成氧气,故可作为呼吸面具中的氧气的来源;
③同种元素相邻化合价间不发生氧化还原反应,二氧化硫不能被浓硫酸氧化;
④二氧化硅能与氢氟酸反应;
⑤氨气极易溶于水,它的水溶液叫氨水,呈碱性;
⑥能和强酸、强碱反应生成盐和水的氢氧化物是两性氢氧化物.①氯气不具有漂白性,不能直接使有色布条褪色,必须是使湿润的有色布条褪色,具有漂白性的是次氯酸,故①错误;
②过氧化钠是淡黄色粉末,过氧化钠因能与CO2反应生成氧气,可以用在呼吸面具中做供氧剂,故②正确;
③二氧化硫具有较强的还原性,但同种元素相邻价态间不发生氧化还原反应,所以能用浓硫酸干燥,故③错误;
④SiO2俗名硅石,化学性质稳定,但能与氢氟酸反应,故④错误;
⑤NH3极易溶于水,其水溶液显碱性,故⑤正确;
⑥Al(OH)3是两性氢氧化物,能溶于强酸或强碱,但不溶于弱酸弱碱,故⑥错误;
故选:C.点评:
本题考点: 氯气的化学性质;硅和二氧化硅;钠的重要化合物;两性氧化物和两性氢氧化物.
考点点评: 本题考查了物质化学性质的应用,特别注意同种元素相邻价态不发生氧化还原反应,氯气不具有漂白性,具有漂白性的是氯气和水反应生成的次氯酸.1年前查看全部
- (2013•平顶山二模)如图所示,在3×3的正方形网格中已有两个小正方形被涂黑,再将图中其余小正方形任意涂黑一个,使整个
 (2013•平顶山二模)如图所示,在3×3的正方形网格中已有两个小正方形被涂黑,再将图中其余小正方形任意涂黑一个,使整个图案构成一个轴对称图形的办法有( )
(2013•平顶山二模)如图所示,在3×3的正方形网格中已有两个小正方形被涂黑,再将图中其余小正方形任意涂黑一个,使整个图案构成一个轴对称图形的办法有( )
A.3种
B.4种
C.5种
D.6种 mahuilai1年前0
mahuilai1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2012•平顶山二模)如图所示为大型超市的自动扶梯.一人站在扶梯的水平台面上随扶梯一起匀速上升,则该人受力个数为___
 (2012•平顶山二模)如图所示为大型超市的自动扶梯.一人站在扶梯的水平台面上随扶梯一起匀速上升,则该人受力个数为______.从扶梯底端到顶端的过程中,人的机械能______(填“增加”、“不变”或“减少”).
(2012•平顶山二模)如图所示为大型超市的自动扶梯.一人站在扶梯的水平台面上随扶梯一起匀速上升,则该人受力个数为______.从扶梯底端到顶端的过程中,人的机械能______(填“增加”、“不变”或“减少”).  挣扎19771年前1
挣扎19771年前1 -
 everyuyu 共回答了19个问题
everyuyu 共回答了19个问题 |采纳率84.2%解题思路:根据物体运动状态判断物体的受力情况是关键;物体处于匀速直线运动状态时,受到平衡力的作用,分析准确哪个力和哪个力是平衡力很关键;机械能包括动能和势能,抓住影响动能和势能的因素可分析出能量的变化情况.(1)人站在扶梯的水平台面上随扶梯一起匀速上升,受到平衡力的作用,在水平方向上不受力,在竖直方向上受到的重力和支持力是一对平衡力;故人共受到两个力的作用;
(2)机械能包括动能和势能,人随扶梯匀速上升的过程中,质量不变,速度不变,故动能不变;而人的高度在变大,故重力势能增大;所以机械能增加;
故答案为:(1)两个;(2)增加.点评:
本题考点: 机械能;二力平衡条件的应用;力与运动的关系.
考点点评: 物体的运动状态和受力有着密切的联系,在分析受力情况时,抓住物体运动状态,不要多加力,也不要漏掉力;机械能包括动能和势能;动能的大小与质量和速度有关;重力势能大小与质量和高度有关.1年前查看全部
- (2005•平顶山一模)已知x>y>z,在一定温度下,mg水中最多能溶解yg硝酸钾就形成饱和溶液,现加入zg硝酸钾充分溶
(2005•平顶山一模)已知x>y>z,在一定温度下,mg水中最多能溶解yg硝酸钾就形成饱和溶液,现加入zg硝酸钾充分溶解得到的是______溶液.若加入xg硝酸钾充分溶解得到的是______溶液.(以上填“饱和”或“不饱和”)
 城市猎人BG1年前1
城市猎人BG1年前1 -
 土豆20 共回答了21个问题
土豆20 共回答了21个问题 |采纳率85.7%解题思路:根据饱和溶液可以知道:在一定温度下,在一定量的溶剂里,不能再溶解某物质的溶液称为这种物质的饱和溶液,所以我们判断溶液是否饱和只要看能否继续溶解溶质即可.根据题意可知:在一定温度下,mg水中最多能溶解yg硝酸钾就形成饱和溶液,而y>z,所以若加入zg硝酸钾得到的不是饱和溶液,又因为x>y,根据题意mg水中最多溶解yg硝酸钾,所以可以判断xg硝酸钾不能完全溶解,所以此时得到是饱和溶液,并且硝酸钾有剩余.
故答案为:不饱和;饱和.点评:
本题考点: 饱和溶液和不饱和溶液.
考点点评: 熟练掌握饱和溶液和不饱和溶液的定义,并能够根据饱和溶液和不饱和溶液的定义来判断溶液是否达到饱和状态.1年前查看全部
- (2009•平顶山一模)下列实验操作中,先后顺序正确的是( )
(2009•平顶山一模)下列实验操作中,先后顺序正确的是( )
A.稀释浓硫酸时,先在烧杯中加入一定体积的浓硫酸,后注入蒸馏水
B.为测定硫酸铜晶体的结晶水含量,称量时,先称取一定量的晶体,后放入坩埚
C.为检验酸性溶液中的Cl-和SO42-,先加氯化钡溶液,滤去沉淀后再加硝酸银溶液
D.在制取干燥纯净的氯气时,先使氯气通过水(或饱和食盐水),后通过浓硫酸 gucpiao1年前1
gucpiao1年前1 -
 爱莲老猫 共回答了13个问题
爱莲老猫 共回答了13个问题 |采纳率92.3%解题思路:A、根据稀释浓硫酸时是将浓硫酸倒入水中,并用玻璃棒不断搅拌,使产生的热量迅速扩散分析.
B、称量时,先称取坩埚的质量,再称坩埚和晶体的质量;
C、先加氯化钡溶液,会引入了氯离子;
D、在制取干燥纯净的氯气时,先除去氯化氢,后除去水蒸气.A、浓硫酸密度比水大,易溶于水,溶于水时放出大量的热,如果把水倒入浓硫酸中,水会浮在水面上,且放出的热会使水沸腾,从而造成酸液飞溅的现象出现,因而稀释浓硫酸时是将浓硫酸倒入水中,并用玻璃棒不断搅拌,使...
点评:
本题考点: 硫酸铜晶体中结晶水含量的测定;常见阴离子的检验;气体的净化和干燥.
考点点评: 本题属常规型实验考查题,该题难度不大,注意常见的实验操作要注意的事项即可解答,平时要注意积累总结.1年前查看全部
- (2013•平顶山一模)碳和碳的化合物是自然界中重要的物质,请回答下列问题:
(2013•平顶山一模)碳和碳的化合物是自然界中重要的物质,请回答下列问题:
(1)金刚石和石墨的物理性质有很大的差异,其原因是什么?______.
(2)NaHCO3俗称小苏打,举出NaHCO3在生活中的一种用途.______. yueding5201年前1
yueding5201年前1 -
 月光罄人 共回答了18个问题
月光罄人 共回答了18个问题 |采纳率100%解题思路:(1)根据物质结构决定物质的性质分析,金刚石的碳原子排列是空间网状结构,石墨的碳原子排列是层状结构;
(2)根据常见物质的用途分析回答.(1)由于金刚石的碳原子排列是空间网状结构,石墨的碳原子排列是层状结构,金刚石、石墨的内部碳原子的排列方式不同,导致二种物质物理性质差异很大;
(2)NaHCO3俗称小苏打,在生活中的用途较多,例如:做糕点、治疗胃酸过多、制汽水、灭火、洗涤剂等.
故答为:(1)碳原子排列方式不同;(2)做糕点.点评:
本题考点: 碳元素组成的单质;碳酸钠、碳酸氢钠与碳酸钙.
考点点评: 本题所考查的知识都是课本的基础知识,难度不大,应加强基础知识的学习.1年前查看全部
- (2013•平顶山二模)随着经济水平的不断提高,小汽车越来越多地走进了我市普通家庭.下表为小军家小汽车的相关数据:
(2013•平顶山二模)随着经济水平的不断提高,小汽车越来越多地走进了我市普通家庭.下表为小军家小汽车的相关数据:
(1)汽车发动机是汽油机,从能源可否再生角度来看,汽油是______能源;发动机工作时,______冲程将内能转化为机械能.总质量:1600kg 额定功率:100kW 车轮与地面的总接触面积:8.0×10-2m2 水箱容量:5L
(2)该车静止在水平地面上时,对地面的压强为多少Pa?(g=10N/kg)(c水=4.2×103J/(kg•℃))
(3)综合油耗表示以经济速度在相应路面上每行驶100km所消耗的燃油体积,是衡量汽车发动机效率的重要标志之一,假若该车在高速公路路面上以60kW的功率、100km/h的速度匀速行驶1h,消耗汽油10L,求此时小汽车发动机的效率.(汽油密度ρ汽油=0.71×103kg/m3.汽油热值q汽油=4.6×107J/kg)
(4)结合生活经验和所学知识,请你就如何降低汽车油耗提一点建议. qdlove5201年前1
qdlove5201年前1 -
 jdknknlf145 共回答了20个问题
jdknknlf145 共回答了20个问题 |采纳率95%(1)汽车发动机是汽油机,从能源可否再生角度来看,汽油是不可再生能源;发动机工作时,做功冲程将内能转化为机械能.
(2)该车静止在水平地面上时,压力等于重力,即F=G=mg=1600kg×10N/kg=1.6×104N
对地面的压强为p=[F/S]=
1.6×104N
8.0×10−2m2=2.0×105Pa.
(3)∵ρ=[m/V],
∴10L汽油的质量为m=ρ汽油×V=0.71×103kg/m3×0.01m3=7.1kg
这些汽油完全燃烧放出的热量为Q放=m•q汽油=7.1kg×4.6×107J/kg=3.266×108J
∵P=[W/t],
∴汽车在这1h内做的功为W=Pt=6×104W×3600s=2.16×108J
小汽车发动机的效率η=[W/Q]×100%=
2.16×108J
3.266×108J×100%≈66%.
(4)开车时不开窗、少开空调、避免平凡换挡等.
答:
(1)汽车发动机是汽油机,从能源可否再生角度来看,汽油是不可再生能源;发动机工作时,做功冲程将内能转化为机械能;
(2)该车静止在水平地面上时,对地面的压强为2.0×105Pa.
(3)小汽车发动机的效率66%.
(4)要降低汽车油耗,在开车时不开窗.1年前查看全部
- (2011•平顶山二模)科学家发现“土卫六”表面遍布“湖海河流”,这些“湖海河流”中的液体并非水,而是液态甲烷和液态乙烷
(2011•平顶山二模)科学家发现“土卫六”表面遍布“湖海河流”,这些“湖海河流”中的液体并非水,而是液态甲烷和液态乙烷(C2H6).甲烷和乙烷均属于( )
A.酸
B.碱
C.盐
D.有机物 ysj2391年前1
ysj2391年前1 -
 支队就 共回答了20个问题
支队就 共回答了20个问题 |采纳率90%解题思路:有机物通常指含碳元素的化合物,但一些简单的含碳化合物,如一氧化碳、二氧化碳、碳酸盐、金属碳化物、氰化物等除外.多数有机化合物主要含有碳、氢两种元素,此外也常含有氧、氮、硫、卤素、磷等.甲烷和乙烷都是含有碳元素的化合物,属于有机物.
故选D.点评:
本题考点: 有机物与无机物的区别;常见的氧化物、酸、碱和盐的判别.
考点点评: 解答本题要充分理解物质的分类方法方面的知识,只有这样才能对各种物质进行正确的分类.1年前查看全部
- (2009•平顶山一模)现有一定量含有Na2O杂质的Na2O2试样,用如图的实验装置测定Na2O2试样的纯度.(可供选用
(2009•平顶山一模)现有一定量含有Na2O杂质的Na2O2试样,用如图的实验装置测定Na2O2试样的纯度.(可供选用的反应物只有CaCO3固体、6mol/L盐酸、6mol/L硫酸和蒸馏水)回答下列问题:

(1)实验前必须检查装置的气密性.仪器连接好后,在______中加适量的水,关闭A中分液漏斗阀门后微热试管,若看到______说明装置气密性好.
(2)装置A中液体试剂选用盐酸而不用硫酸,理由是______.
(3)装置B的作用是______;装置C的作用是______;装置E中碱石灰的作用是______.
(4)装置D中发生反应的化学方程式是:______.
(5)若开始时测得样品的质量为2.0g,反应结束后测得气体体积为224mL(标准状况),则Na2O2试样的纯度为______. malice53541年前1
malice53541年前1 -
 hanxisuyu 共回答了16个问题
hanxisuyu 共回答了16个问题 |采纳率100%解题思路:(1)先在装置F中进入适量水,关闭A中分液漏斗的阀门,对装置A中的试管加热,根据F中长导管液面变化判断装置的气密性;
(2)根据实验原理装置A采用的是碳酸钙和盐酸反应生成二氧化碳,根据碳酸钙和硫酸反应的情况来回答;
(3)获得的二氧化碳气体中含有氯化氢气体,可以用饱和碳酸氢钠来除去,浓硫酸具有吸水性,碱石灰可以吸收二氧化碳;
(4)根据氧化钠和过氧化钠的性质写出过氧化钠、氧化钠与二氧化碳反应的化学方程式;
(5)根据氧气的量和过氧化钠量的关系来获得过氧化钠质量,进而计算过氧化钠的纯度.(1)检验该装置气密性方法为:连接好装置,在F中进入适量水,关闭装置A中分液漏斗阀门,若F中长导管水面上升,停止加热后水面下降,说明气密性良好,
故答案为:F(或G);F中长导管水面上升,停止加热后水面下降(若填G则是A加热后G中导管口有气泡冒出);
(2)装置A是碳酸钙和盐酸反应生成二氧化碳,碳酸钙和硫酸反应时,生成的硫酸钙是微溶于水的,会覆盖在碳酸钙的表面,使反应不能持续,所以用盐酸而不用硫酸来反应,
故答案为:硫酸与CaCO3固体反应生成CaSO4微溶于水,会覆盖在CaCO3固体表面,使反应不能持续;
(3)碳酸钙和盐酸反应生成的二氧化碳气体中含有氯化氢气体,可以用饱和碳酸氢钠来除去,浓硫酸具有吸水性,可以将二氧化碳干燥,装置E中碱石灰的作用是吸收二氧化碳,防止对氧气的体积测量造成干扰,
故答案为:除去气体中的HCl;干燥气体;吸收装置D中反应剩余的CO2;
(4)装置D中氧化钠、过氧化钠分别与二氧化碳发生反应,反应的化学方程式分别为:2Na2O2+2CO2=2Na2CO3+O2,Na2O+CO2=Na2CO3,
故答案为:2Na2O2+2CO2=2Na2CO3+O2、Na2O+CO2=Na2CO3;
(5)根据反应2Na2O2+2CO2=2Na2CO3+O2,反应结束后测得气体体积为224mL(标准状况),生成的氧气的物质的量为:n(O2)=
224×10−3L
22.4L/mol=0.01mol,过氧化钠的物质的量为:n(Na2O2)=2n(O2)=0.02mol,
过氧化钠的纯度为:ω(Na2O2)=[0.02mol×78g/mol/2.0g]×100%=78%,
故答案为:78%.点评:
本题考点: 探究物质的组成或测量物质的含量.
考点点评: 本题考查了探究过氧化钠中氧化钠的含量的方法,题目难度中等,试题综合性强,侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力,试题重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力.1年前查看全部
- (2011•平顶山二模)马尔氏盐A为浅蓝绿色结晶,是一种重要的化学试剂,可用作聚合催化剂.A的溶液具有以下转化关系:回答
(2011•平顶山二模)马尔氏盐A为浅蓝绿色结晶,是一种重要的化学试剂,可用作聚合催化剂.A的溶液具有以下转化关系:回答下列问题:

(1)白色沉淀C的化学式为______,无色气体E的电子式为______.
(2)由D转化成为F的化学反应方程式为______.
(3)称取一定量A的晶体,经测定其结晶水含量约为27.6%.将其完全溶于水配成溶液,经过上述转化最多可得到的C和F的物质的量之比为2:1.由此可确定A的化学式为______.
(4)上述转化关系中,若用稀硝酸代替稀盐酸,______(填“能”或“不能”)通过该转化关系确定A的组成,理由是______.要准确称出C的质量,需要重复进行干燥、冷却、称量的操作,目的是______.
(5)A的标准溶液,常用于标定高锰酸钾溶液等.请写出在高锰酸钾溶液中滴加A的标准溶液时,所发生的离子反应方程式,并标明电子转移情况.______. 0莜莜01年前1
0莜莜01年前1 -
 lbc2003 共回答了21个问题
lbc2003 共回答了21个问题 |采纳率85.7%解题思路:马尔氏盐A为浅蓝绿色结晶,A即和酸反应也可以和碱反应,与碱反应生成白色沉淀和使湿润的红色石蕊试纸变蓝的气体是氨气,说明A中含铵根离子;白色沉淀在空气中放置生成红褐色沉淀,说明是氢氧化铁;所以D为氢氧化亚铁;说明A含有亚铁离子,A和足量盐酸反应得到澄清溶液B,加入氯化钡溶液生成白色沉淀,说明A中含有硫酸根离子.A即和酸反应也可以和碱反应,与碱反应生成白色沉淀和使湿润的红色石蕊试纸变蓝的气体是氨气,说明A中含铵根离子;白色沉淀在空气中放置生成红褐色沉淀,说明是氢氧化铁;所以D为氢氧化亚铁;说明A含有亚铁离子,A和足量盐酸反应得到澄清溶液B,加入氯化钡溶液生成白色沉淀,说明A中含有硫酸根离子;马尔氏盐A为浅蓝绿色结晶则含有的离子为铵根离子、亚铁离子、硫酸根离子;推断出物质分别为:A、含有铵根离子、亚铁离子、硫酸根离子;B、含硫酸根离子的溶液,C、BaSO4;D、4Fe(OH)2 E、NH3 F、Fe(OH)3
(1)依据推断白色沉淀C为:BaSO4,无色气体E是氨气,氨气的电子式为: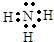 ;故答案为:BaSO4
;故答案为:BaSO4 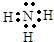 ;
;
(2)D是Fe(OH)2转化成为FFe(OH)3的化学反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)称取一定量A的晶体,经测定其结晶水含量约为27.6%.将其完全溶于水配成溶液,经过上述转化最多可得到的BaSO4和Fe(OH)3的物质的量之比为2:1.说明A中含硫酸根离子子和亚铁离子2:1,依据化合物化合价代数和为0,则铵根离子:亚铁离子:硫酸根离子=2:1:2,(NH4)2Fe(SO4)2 ,设马尔氏盐A化学式为:(NH4)2Fe(SO4)2 •xH2O,A的晶体,经测定其结晶水含量约为27.6%,
xH2O
(NH4)2Fe(SO4)2•xH2O×100%=27.6%,x=6;所以A的化学式为:(NH4)2Fe(SO4)2 •6H2O;故答案为:(NH4)2Fe(SO4)2 •6H2O;
(4)若用稀硝酸代替稀盐酸,硝酸具有强氧化性,不能确定铁元素的存在状态,不能通过该转化关系确定A的组成,因为不能确定它是硫酸盐还是亚硫酸盐;要准确称出C(BaSO4)的质量,需要重复进行干燥、冷却、称量的操作,目的是彻底除去C(BaSO4)表面的水分;
故答案为:不能;因为不能确定它是硫酸盐还是亚硫酸盐;目的是彻底除去C(BaSO4)表面的水分;
(5)高锰酸钾溶液中滴加A(:(NH4)2Fe(SO4)2 •6H2O)的标准溶液时,高锰酸钾溶液氧化A中的 亚铁离子发生氧化还原反应,反应的离子方程式为: +8H+=5Fe3++Mn2++4H2O,
+8H+=5Fe3++Mn2++4H2O,
故答案为: +8H+=5Fe3++Mn2++4H2O.
+8H+=5Fe3++Mn2++4H2O.点评:
本题考点: 无机物的推断;铁的氧化物和氢氧化物.
考点点评: 本题考查了物质转化关系,物质性质的应用,主要考查铁及其化合物的性质判断和性质应用,物质化学式的确定方法,氧化还原反应的电子转移表示方法,实验注意问题的熟练掌握,题目较难.1年前查看全部
- (2005•平顶山一模)下列装置是证明质量守恒定律的实验,将装置内的物质混合或接触,变化前后容器中物质总质量不相等的是(
(2005•平顶山一模)下列装置是证明质量守恒定律的实验,将装置内的物质混合或接触,变化前后容器中物质总质量不相等的是( )
A.
B.
C.
D.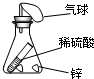
 许勤利1年前1
许勤利1年前1 -
 szzhjd 共回答了29个问题
szzhjd 共回答了29个问题 |采纳率82.8%解题思路:运用试验中所选装置是否密封、若为敞口容器看反应中是否有气体生成解答.A、反应装置是密闭容器,故反应前后容器中物质的总质量不变,故A不能选.
B、装置虽是敞口装置,但氯化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠,没有生成气体故反应前后容器中物质的总质量相等,故B不能选.
C、反应装置是敞口装置,稀盐酸和石灰石反应生成氯化钙、水和二氧化碳,生成的气体跑到空气中去了,故反应后容器中的物质总质量减小,故C符合题意.
D、装置是密闭装置,稀硫酸和金属锌反应虽生成氢气,但氢气不会跑到空气中去,被储存在装置和气球中,故D反应前后物质质量相等,不能选.
所以选C点评:
本题考点: 质量守恒定律的实验探究.
考点点评: 本题通过实验对质量守恒定律进行了考查,考查了实验装置和化学反应,分清装置和反应的实质即可准确快速解答.1年前查看全部
- (2014•平顶山二模)如图,把“笑脸”放在平面直角坐标系中,已知左眼A的坐标是(-2,3),嘴唇C点的坐标为(-1,1
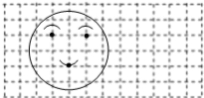 (2014•平顶山二模)如图,把“笑脸”放在平面直角坐标系中,已知左眼A的坐标是(-2,3),嘴唇C点的坐标为(-1,1),则将此“QQ”笑脸向右平移3个单位后,右眼B的坐标是( )
(2014•平顶山二模)如图,把“笑脸”放在平面直角坐标系中,已知左眼A的坐标是(-2,3),嘴唇C点的坐标为(-1,1),则将此“QQ”笑脸向右平移3个单位后,右眼B的坐标是( )
A.(3,3)
B.(-3,3)
C.(0,3)
D.(3,-3) 海边小娴1年前1
海边小娴1年前1 -
 迫不及待已经存在 共回答了17个问题
迫不及待已经存在 共回答了17个问题 |采纳率88.2%解题思路:首先根据左眼坐标可得右眼坐标,再根据平移方法可得平移后右眼B的坐标是(0+3,3).∵左眼A的坐标是(-2,3),
∴右眼的坐标是(0,3),
∴笑脸向右平移3个单位后,右眼B的坐标是(0+3,3),
即(3,3),
故选:A.点评:
本题考点: 坐标与图形变化-平移.
考点点评: 本题考查了坐标系中点、线段的平移规律,在平面直角坐标系中,图形的平移与图形上某点的平移相同.平移中点的变化规律是:横坐标右移加,左移减;纵坐标上移加,下移减.1年前查看全部
- (2010•平顶山模拟)航天飞行器座舱内空气更新过程如下图所示:
(2010•平顶山模拟)航天飞行器座舱内空气更新过程如下图所示:
(1)Ⅱ是CO2和H2的反应装置,该反应的化学方程式为______.
(2)从装置Ⅰ、Ⅱ、Ⅲ可看出,O2的来源是CO2和H2O,宇航员每天消耗28mol O2,呼出23mol CO2,则宇航员每天呼出的气体中含H2O______mol.
(3)以下是另一种将CO2转化为O2的实验设想:上述设想优点是:①吸收航天器中宇航员排出的二氧化碳气体同时产生氧气以供呼吸;②______.
(4)某同学根据Mg与CO2反应原理,推测钠也应能在CO2中燃烧.为了确定其生成产物并进行实验论证,请你参与以下研究过程.该同学按实验要求,用下列装置进行实验(已知PdCl2溶液能被CO还原得到黑色的Pd),请完成下列问题:
①若装置6中有黑色沉淀,装置4中的残留固体(只有一种物质)加盐酸有能使石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为:______.
②若装置6中溶液无明显现象,装置4中残留固体(有两种物质)加盐酸有能使石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为:______.
③指导老师认为,不仅要检验残留固体中是否有碳酸钠还要检验其中是否有氧化钠和碳,当确认钠充分反应后,请你设计一个简单实验,验证装置4中得到的残留固体中是否含有碳:______.
 Raggi_liu1年前1
Raggi_liu1年前1 -
 vipggm 共回答了28个问题
vipggm 共回答了28个问题 |采纳率89.3%解题思路:(1)依据图示可知,反应物为二氧化碳和氢气,生成物为碳和水,以此书写化学方程式;
(2)根据氧元素守恒计算,通过图示可以看出这一更新过程中元素在整个变化中的质量并没有改变,则有呼出的氧元素的质量等于消耗氧元素的质量;
(3)②反应后生成Mg和Cl2可以循环利用;
(4)①由题意可知,装置4中的残留固体(只有一种物质)加盐酸有能使石灰水变浑浊的气体放出,说明生成碳酸钠,装置6中有黑色沉淀,说明PdCl2溶液能被CO还原得到黑色的Pd,所以反应物为碳酸钠和CO;
②装置4中残留固体(有两种物质)加盐酸有能使石灰水变浑浊的气体放出,其中一种固体为碳酸钠,另一种固体为C;
③根据C不溶于水分析.(1)依据图示可知,反应物为二氧化碳和氢气,生成物为碳和水,故反应的化学方程式为2H2+CO2=2H2O+C,
故答案为:2H2+CO2=2H2O+C;
(2)根据氧元素守恒计算,通过图示可以看出这一更新过程中元素在整个变化中的质量并没有改变,则有呼出的氧元素的质量等于消耗氧元素的质量,消耗氧气的物质的量为28mol,即n(O)=56mol,23molCO2中含有n(O)=46mol,则需要水的物质的量为56-46=10mol,故答案为:10;
(3)②另一种将CO2转化为O2的实验设想.将Mg条在CO2中点燃生成MgO和C.加稀盐酸MgO被溶解生成MgCl2•6H2O和H2O.H2O被Cl2氧化生成HCl和O2;MgCl2•6H2O在HCl存在下转化为MgCl2,最后电解MgCl2制取Mg和Cl2.可以循环利用,
故答案为:生成的Mg和Cl2可以循环利用;
(4)①由题意可知,装置4中的残留固体(只有一种物质)加盐酸有能使石灰水变浑浊的气体放出,说明生成碳酸钠,装置6中有黑色沉淀,说明PdCl2溶液能被CO还原得到黑色的Pd,所以反应物为碳酸钠和CO,反应的化学方程式为
2Na+2CO2=Na2CO3+CO,故答案为:2Na+2CO2=Na2CO3+CO;
②装置4中残留固体(有两种物质)加盐酸有能使石灰水变浑浊的气体放出,其中一种固体为碳酸钠,另一种固体为C,反应的方程式为4Na+3CO2=2Na2CO3+C,故答案为:4Na+3CO2=2Na2CO3+C;
③根据C不溶于水分析,将4中固体加足量水,有不溶黑色固体,则生成物中有C,
故答案为:将4中固体加足量水,有不溶黑色固体,则生成物中有C.点评:
本题考点: 碳族元素简介;碱金属及其化合物的性质实验.
考点点评: 该题联系学生感兴趣的实际新知识,有助于学生能力的考查,必须活学活用才能解好这类有新意的试题.1年前查看全部
- (2010•平顶山二模)已知m,l是两条不同的直线,α、β是两个不同的平面,给出下列命题:①若l⊥α,m∥α,则l⊥m;
(2010•平顶山二模)已知m,l是两条不同的直线,α、β是两个不同的平面,给出下列命题:①若l⊥α,m∥α,则l⊥m;②若m∥l,m⊂α,则l∥α;③若α⊥β,m⊂α,l⊂β,则m⊥l;④若m⊥l,m⊂α,l⊂β,则α⊥β其中正确命题的个数为( )
A.1
B.2
C.3
D.4 ffff88881年前1
ffff88881年前1 -
 a_chlwq 共回答了14个问题
a_chlwq 共回答了14个问题 |采纳率85.7%解题思路:本题中四个命题有两个研究线线之间的位置关系,一个研究线面的位置关系,一个研究面面的垂直关系,故可以利用相关的平面定理与性质进行判断找出正确的命题个数.对于①,若l⊥α,m∥α,则l⊥m是正确的;
对于②,若m∥l,m⊂α,则l∥α不正确,因为l可能在α内;
对于③,α⊥β,m⊂α,l⊂β,则m⊥l不正确,此两线可能是平行的;
对于④,m⊥l,m⊂α,l⊂β,则α⊥β,不正确,一个面内的线垂直于另一个面内的线,不能保证两个平面垂直.
综上知,四个命题中只有①是正确的
故选A点评:
本题考点: 平面的基本性质及推论;命题的真假判断与应用.
考点点评: 本题考查综合利用平面的中的判定定理及性质定理判断线线之间的位置关系与线面,面面之间的位置关系,属于知识的灵活运用题,有一定的综合性.1年前查看全部
- (2012•平顶山一模)下图是用来表示物质间发生化学变化的模型示意图,图中“、”分别表示两种不同元素的原子.能用该示意图
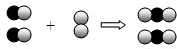 (2012•平顶山一模)下图是用来表示物质间发生化学变化的模型示意图,图中“
(2012•平顶山一模)下图是用来表示物质间发生化学变化的模型示意图,图中“ 、
、 ”分别表示两种不同元素的原子.能用该示意图表示的反应是( )
”分别表示两种不同元素的原子.能用该示意图表示的反应是( )
A.2H2+O2
2H2O点燃 .
B.H2+Cl2
2HCl点燃 .
C.2CO+O2
2CO2点燃 .
D.2H2O
2H2↑+O2↑点燃 . ghtrj58j4y1年前1
ghtrj58j4y1年前1 -
 蟀呆了 共回答了19个问题
蟀呆了 共回答了19个问题 |采纳率73.7%解题思路:发生化学变化的模型示意图,表示2个由不同原子构成的化合物分子与1个由同种原子构成的单质的分子发生反应,生成2个由不同种原子构成的化合物分子据此回答问题即可;A、该反应中是两种单质反应生成一种化合物,与图示反应不一致,故错误;
B、该反应中是两种单质反应生成一种化合物,与图示反应不一致,故错误;
C、该反应是化合物一氧化碳的2个分子与一个氧气分子生成两个二氧化碳分子,与图示反应一致,故正确;
D、该反应的反应物是一种生成物是两种,与图示反应不一致,故错误;
故选C.点评:
本题考点: 微粒观点及模型图的应用.
考点点评: 分子由原子构成,构成相同的分子为同种物质的分子,由不同种原子构成的分子为化合物的分子,由同种原子构成的分子为单质的分子.1年前查看全部
- (2009•平顶山一模)关于非金属元素N、O、C、P的叙述中正确的是( )
(2009•平顶山一模)关于非金属元素N、O、C、P的叙述中正确的是( )
A.N2、C和P在一定条件下分别与足量的O2反应△H都小于零
B.N2、C和P每种元素仅生成一种氧化物
C.气态氢化物的稳定性为PH3>CH4>NH3>H2O
D.原子半径大小比较为P>C>N>O pgy88971年前1
pgy88971年前1 -
 woniujiasu 共回答了23个问题
woniujiasu 共回答了23个问题 |采纳率73.9%解题思路:A.燃烧反应为放热反应;
B.N2、C和P的氧化物有多种;
C.非金属性越强,气态氢化物越稳定;
D.电子层越多,半径越大;同周期,原子序数大的原子半径小.A.C和P在一定条件下分别与足量的O2反应,为燃烧反应,△H都小于零,但N2与足量的O2反应为吸热反应,故A错误;
B.N2、C和P的氧化物有多种,如C生成CO、CO2两种氧化物,故B错误;
C.非金属性O>N>P>C,则气态氢化物的稳定性为H2O>NH3>PH3>CH4,故C错误;
D.电子层越多,半径越大;同周期,原子序数大的原子半径小,则原子半径大小比较为P>C>N>O,故D正确;
故选D.点评:
本题考点: 非金属在元素周期表中的位置及其性质递变的规律;微粒半径大小的比较.
考点点评: 本题考查较综合,涉及焓变、氧化物、非金属性比较、原子半径比较,把握规律性知识的总结和应用为解答的关键,注重基础知识的考查,题目难度不大.1年前查看全部
- (2005•平顶山一模)空气中的二氧化碳含量增大,会产生“温室效应”.为了减少大气中的二氧化碳含量,下列措施可行的是(
(2005•平顶山一模)空气中的二氧化碳含量增大,会产生“温室效应”.为了减少大气中的二氧化碳含量,下列措施可行的是( )
A.开展植树造林,增大绿化面积
B.限制汽车工业的发展
C.用石灰水吸收空气中的二氧化碳
D.禁止燃烧煤 lxh151年前1
lxh151年前1 -
 bigdogcomcn 共回答了27个问题
bigdogcomcn 共回答了27个问题 |采纳率70.4%解题思路:任何物质都有其两面性,既有利也有弊,CO2也不例外,大气中CO2含量的增大,易使地球变暖,海平面上升,陆地面积减少,产生“温室效应”.为了减少大气中CO2的含量可以,开展植树造林,促进光合作用;改变能源结构,发展太阳能,水能等;发展节能型交通工具,少用化石燃料.A、CO2是光合作用的重要原料,开展植树造林,增大绿化面积,会有效的利用二氧化碳,故A可行;
B、可以发展节能型燃料,限制汽车工业的发展不可行,故B不可行;
C、用石灰水吸收空气中的二氧化碳,效果不好,石灰水浓度很小,吸收二氧化碳的量很小,故C不可行;
D、煤是不可再生资源,可以有计划的开采和利用,而不是禁止燃烧煤,故D不可行;
故选A.点评:
本题考点: 二氧化碳对环境的影响;自然界中的碳循环.
考点点评: 此题主要考查二氧化碳对环境的影响:易使地球变暖,海平面上升,陆地面积减少,产生“温室效应”,应该增强环保意识.1年前查看全部
- (2008•平顶山模拟)、某学习生小组为探究乙酸、碳酸和硅酸的酸性强弱并证明乙酸为弱酸,进行下述实验.
(2008•平顶山模拟)、某学习生小组为探究乙酸、碳酸和硅酸的酸性强弱并证明乙酸为弱酸,进行下述实验.
Ⅰ.探究乙酸、碳酸和硅酸的酸性强弱关系,该小组设计了如实验装置(夹持仪器已略去).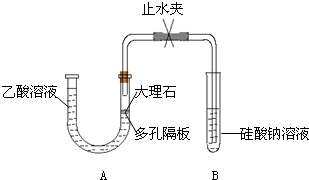
(1)实验前如何检查装置A的气密性?______;
(2)装置A中反应产生的气体通入试管B溶液中,有白色胶状沉淀生成,说明碳酸酸性比硅酸强.
有学生认为B中的实验现象不足以证明碳酸的酸性比硅酸强,理由是:
a、乙酸易挥发,乙酸气体随CO2气体进入试管B的溶液中,和硅酸钠溶液反应生成沉淀.
b、该复分解反应生成的硅酸是难溶固体,不能说明是因为生成弱酸而发生反应.
为了证明碳酸能和硅酸钠反应生成硅酸沉淀,下列方法中可行是______(填序号).
①在仪器A、B之间连接盛有足量饱和NaHCO3溶液的洗气瓶
②在仪器A、B之间连接装有足量碱石灰的干燥管
③在仪器A、B之间连接盛有足量饱和Na2CO3溶液的洗气瓶
④用碳酸钠粉末代替大理石进行实验
下列能够说明碳酸比硅酸酸性强的事实是______(填序号).
①相同温度时,碳酸的溶解度比硅酸的溶解度大
②碳酸比硅酸易分解
③相同温度下,相同物质的量浓度的Na2CO3和Na2SiO3溶液,Na2CO3溶液的pH比Na2SiO3溶液的pH小
④常温下,CO2是气体,SiO2是固体
Ⅱ.证明乙酸为弱酸.
现有常温下pH=3的乙酸溶液、蒸馏水、石蕊试液及pH试纸,用最简便的实验方法证明乙酸为弱酸:______
______. 付笛生1年前1
付笛生1年前1 -
 郁闷级了 共回答了15个问题
郁闷级了 共回答了15个问题 |采纳率93.3%解题思路:(1)依据装置压强和液面变化分析判断装置气密性;
(2)要防止醋酸干扰实验,在气体和硅酸钠溶液反应前将其除去,可选用饱和的碳酸氢钠溶液除去醋酸且又不引进新的杂质气体;证明碳酸酸性强于硅酸,的事实是碳酸可以制备硅酸,电离沉淀大于硅酸,或碳酸盐溶液的PH小于硅酸盐等;
(3)证明乙酸为弱酸需证明溶液中存在电离平衡,依据提供的试剂可以对溶液稀释测定溶液PH的变化分析判断是否存在电离平衡分析设计;(1)依据装置分析,止水夹关闭后使U形管内液面产生液面差,若一段时间液面不变证明气密性完好,
故答案为:仪器连接好后,将止水夹夹紧,在A中加入水使U型管左右两边管中产生液面差,一段时间后,U型管中左右两边管中的液面未发生变化;
(2)证明碳酸能和硅酸钠反应生成硅酸沉淀,为避免醋酸的干扰需要在AB间增加一个吸收醋酸的装置,试剂选择应为和醋酸反应,但不能和二氧化碳反应,
①在仪器A、B之间连接盛有足量饱和NaHCO3溶液的洗气瓶,可以除去醋酸,进行试验验证,故①符合;
②在仪器A、B之间连接装有足量碱石灰的干燥管,碱石灰也可以吸收二氧化碳,故②不符合;
③在仪器A、B之间连接盛有足量饱和Na2CO3溶液的洗气瓶,碳酸钠溶液也可以吸收二氧化碳,不能进行验证试验,故③不符合;
④用碳酸钠粉末代替大理石进行实验,反应速率过快,不易控制,故④不符合;
能够说明碳酸比硅酸酸性强的事实是碳酸可以制备硅酸,电离沉淀大于硅酸,或碳酸盐溶液的PH小于硅酸盐等;
①相同温度时,碳酸的溶解度比硅酸的溶解度大,不能说明酸的电离沉淀大小,故①不符合;
②碳酸比硅酸易分解,是稳定性的判断和酸的强弱无关,故②不符合;
③相同温度下,相同物质的量浓度的Na2CO3和Na2SiO3溶液,Na2CO3溶液的pH比Na2SiO3溶液的pH小,说明水解程度小对应酸的酸性强,故③符合;
④常温下,CO2是气体,SiO2是固体是状态的不同,与酸性强弱无关,故④不符合;
故答案为:①;③;
(3)明乙酸为弱酸需证明溶液中存在电离平衡,依据提供的试剂可以对溶液稀释测定溶液PH的变化,实验步骤为:取pH=3的乙酸溶液加入蒸馏水稀释100倍,用pH试纸测定溶液的pH小于5,
故答案为:取pH=3的乙酸溶液加入蒸馏水稀释100倍,用pH试纸测定溶液的pH小于5;点评:
本题考点: 性质实验方案的设计;弱电解质在水溶液中的电离平衡.
考点点评: 本题考查了物质性质的实验设计和实验验证方法的分析判断,掌握实验基本操作,物质性质的应用是解题关键,题目难度中等.1年前查看全部
- 下列句子中,加粗成语使用不恰当的一项是 [ ] A.平顶山学
下列句子中,加粗成语使用不恰当的一项是 [ ]A.平顶山学院几百名学生晚上只能在教学楼里的水泥地上打地铺一事被曝光后,学校非但不道歉,反而 振振有词 :这是学生和学校为教育大众化共同负出的代价。
B.尽管腾讯和奇虎 信誓旦旦 地说自己是“为了用户利益”是“为了你好”,但所谓的“为了你好”实质上却是以企业价值代替顾客的价值。
C.《歌舞青春》节目从一开场便把观众带入一场狂欢派对中,观众不仅不必 正襟危坐 ,更可以肆意地打起节拍、吹起口哨与台上热舞的演员相呼应。
D.月饼是高脂肪、高热量食品,过多食用会增加人体肠胃负担,所以吃月饼一定要 浅尝辄止 ,绝对不能用它来代替正常的饮食。 皮不皮1年前1
皮不皮1年前1 -
 天齐幽梦 共回答了25个问题
天齐幽梦 共回答了25个问题 |采纳率100%D1年前查看全部
- 2010平顶山九年级学苑新报数学报纸12期答案
 樱花淡1年前1
樱花淡1年前1 -
 conjike 共回答了16个问题
conjike 共回答了16个问题 |采纳率87.5%杯具.我有 给你答案吧 你先写本上 上学后再抄到报纸上 一定要采纳!要不然白打这么多了
选择1A 2B 3D 4C 5A 6C 7CD 8C 9D 10A 11AD
填空12.(1)2NaOH+SO2=Na2SO3+H2O
(2)2NO+2CO=催化剂2CO2+N2
13.(1)① ③ ④
(2)2H2O=通电2H2(气体符号)+O2(气体符号)
Ca(OH)2+CaCI2=Ca(OH)2沉淀符号+CaCI2
选③
14.(1)B E
(2)2NaOH+CO2=Na2CO3+H2O
15.方法一:加入碳酸钠溶液 实验现象及结论:若产生气泡则是稀盐酸,若无明显现象则是硫酸纳溶液
方法二:加入锌粒 实验现象及结论:若锌粒溶解则是稀盐酸,若无明显现象则是硫酸纳溶液
(2)用玻璃棒分别蘸取两种样品放在酒精灯上加热,若玻璃棒上出现白色固体则为硫酸钠溶液,没有则为稀盐酸
16.计算题(1)这是个画曲线图的 你等着自己画吧 很简单
∵氢氧化钠溶液体积=10mL
∴氢氧化钠质量=10g
设盐酸质量为x
HCI+NaOH=NaCI+H2O
36.5 40
x 10g×4% x=0.365g
∴盐酸溶质质量分数=0.365g除以10g乘以100%=3.65%
答:盐酸溶质质量分数为3.65%
好不容易打完了
你先设置我最佳答案后,我百度Hii教你.1年前查看全部
- (2011•平顶山二模)一种由甲醇和氧气以及强碱做电解质溶液的新型二次电池,其电量较大,一次充电可使用较长时间.其电池总
(2011•平顶山二模)一种由甲醇和氧气以及强碱做电解质溶液的新型二次电池,其电量较大,一次充电可使用较长时间.其电池总反应为:2CO32-+6H2O
 2CH3OH+3O2+4OH-,则下列说法正确的是( )
2CH3OH+3O2+4OH-,则下列说法正确的是( )
A.放电时负极的电极反应为:2CH3OH+4OH--12e-=2CO32-+6H2O
B.充电时电解质溶液的pH逐渐减小
C.放电时正极的电极反应可表示为:O2+4H++4e-=2H2O
D.充电时每生成1molCH3OH转移6mol电子 uglyming1年前1
uglyming1年前1 -
 xianhaiping 共回答了23个问题
xianhaiping 共回答了23个问题 |采纳率82.6%解题思路:根据电池总反应2CO32-+6H2O 2CH3OH+3O2+4OH-,可知放电时,甲醇被氧化,为原电池的负极,电极反应为CH3OH+8OH--6e-=CO32-+6H2O,通入氧气的一极为原电池的正极,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,充电是放电的逆反应,可根据总反应式判断溶液的PH和转移的电子的物质的量.
2CH3OH+3O2+4OH-,可知放电时,甲醇被氧化,为原电池的负极,电极反应为CH3OH+8OH--6e-=CO32-+6H2O,通入氧气的一极为原电池的正极,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,充电是放电的逆反应,可根据总反应式判断溶液的PH和转移的电子的物质的量.
A、放电时,甲醇被氧化,为原电池的负极,电极反应为CH3OH+8OH--6e-=CO32-+6H2O,故A错误;
B、充电时在阴极上生成OH-离子,并消耗水,溶液的PH增大,故B错误;
C、因强碱做电解质溶液,放电时,通入氧气的一极为原电池的正极,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,故C错误;
D、根据总反应式可知,每生成1molCH3OH时,C元素的化合价有+6价降低到-2价,转移6mol电子,故D正确.
故选D.点评:
本题考点: 化学电源新型电池;电极反应和电池反应方程式.
考点点评: 本题考查化学电源知识,题目难度中等,注意从总反应式判断两极上的变化和电极反应式的书写.1年前查看全部
- (2011•平顶山二模)A、B、C、D、E五种前四周期元素,原子序数依次增大.已知D元素原子核外的M层上有3个单电子存在
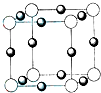 (2011•平顶山二模)A、B、C、D、E五种前四周期元素,原子序数依次增大.已知D元素原子核外的M层上有3个单电子存在.在周期表中,B、E与D同主族,A、C分别与B、D处于相邻位置.回答下列问题:
(2011•平顶山二模)A、B、C、D、E五种前四周期元素,原子序数依次增大.已知D元素原子核外的M层上有3个单电子存在.在周期表中,B、E与D同主族,A、C分别与B、D处于相邻位置.回答下列问题:
(1)元素E的元素符号为______,最高正价为______,最外层电子构型为______;
(2)C的常见氯化物中,C元素的杂化类型为______,A元素在其含氧酸根离子中的杂化类型为______,A、C两元素所形成化合物的晶体类型是______;
(3)D的氢化物的立体结构呈______型,该氢化物比元素B的氢化物沸点低的原因是______.
(4)元素B的离子(B3-)与某金属离子(X+)形成化合物的晶胞结构如图所示.则晶胞中顶点上的小球应代表______(填“B3-”或“X+”). fox_godspeed1年前1
fox_godspeed1年前1 -
 咸菜525 共回答了15个问题
咸菜525 共回答了15个问题 |采纳率100%解题思路:D元素原子核外的M层上有3个单电子,应为P元素,为第ⅤA族Ⅳ元素,在周期表中,B、E与D同主族,且原子序数E大于B,则B为N元素,E为As元素,A、C分别与B、D处于相邻位置,且A、B、C、D、E五种前四周期元素,原子序数依次增大,则A为C元素,C为Si元素,以此解答该题.D元素原子核外的M层上有3个单电子,应为P元素,为第ⅤA族Ⅳ元素,在周期表中,B、E与D同主族,且原子序数E大于B,则B为N元素,E为As元素,A、C分别与B、D处于相邻位置,且A、B、C、D、E五种前四周期元素,原子序数依次增大,则A为C元素,C为Si元素,
(1)E为As元素,最外层电子数为5,最高化合价为+5价,最外层电子构型为4s24p3,故答案为:As;+5;4s24p3;
(2)C的常见氯化物SiCl4,Si的价层电子对为4,无孤电子对,杂化类型为sp3,A元素在其含氧酸根离子为CO32-,C原子形成3个δ键,孤电子对为[4+2−2×3/2= 0,则价层电子对为3,所以杂化类型为sp2,A、C两元素所形成化合物SiC,为原子晶体,故答案为:sp3;sp2;原子晶体;
(3)D的氢化物为PH3,分子中P与O形成3个δ键,孤电子对数位
5−3×1
2= 1,价层电子对为4,则分子的立体构型为三角锥形,因NH3中含有氢键,则PH3沸点低于NH3,
故答案为:三角锥;B元素的氢化物之间存在有氢键;
(4)根据化合价可知,元素B的离子(B3-)与某金属离子(X+)形成化合物应为X3B,晶胞中的离子有两种物质,位于顶点的离子数为:8×
1
8]=1,位于面心的离子数目为:6×
1
2=3,
由化学式可知,位于顶点的离子为B3-,故答案为:B3-.点评:
本题考点: 位置结构性质的相互关系应用;原子核外电子排布;晶体的类型与物质熔点、硬度、导电性等的关系;晶胞的计算;原子轨道杂化方式及杂化类型判断.
考点点评: 本题考查元素的推断,较为综合,涉及杂化类型、分子构型以及晶胞的计算等问题,题目难度较大,注意正确推断元素的种类为解答本题的关键.1年前查看全部
- (2013•平顶山三模)下面化简正确的是( )
(2013•平顶山三模)下面化简正确的是( )
A.[2a+1/2a+1]=0
B.
=-1(a−b)2 (b−a)2
C.[6−2x/−x+3]=2
D.
=x+yx2+y2 x+y  晴茜绮梦1年前1
晴茜绮梦1年前1 -
 我爱的tt不爱我 共回答了21个问题
我爱的tt不爱我 共回答了21个问题 |采纳率100%解题思路:分式的基本性质是分式的分子、分母同时乘以或除以同一个非0的数或式子,分式的值不变.据此作答.A、分子分母中同时除以2a+1,分子、分母都变成1,故式子的值是1.错误;
B、(a-b)2=(b-a)2,因而分式的值是1.错误;
C、分子、分母同时除以-x+3,正确;
D、x2+y2≠(x+y)2,错误.
故选C点评:
本题考点: 约分.
考点点评: 解答此类题一定要熟练掌握分式的基本性质.1年前查看全部
- (2011•平顶山二模)气焊和气割都需要用到乙炔.乙炔俗称电石气(化学式为C2H2),是一种无色无味的气体,密度比空气略
(2011•平顶山二模)气焊和气割都需要用到乙炔.乙炔俗称电石气(化学式为C2H2),是一种无色无味的气体,密度比空气略小,难溶于水.实验室常用块状固体碳化钙与水反应制备乙炔,该反应比二氧化锰催化过氧化氢分解更加剧烈.请回答:

(1)写出乙炔的物理性质.
(2)从下图选择实验室制备乙炔所用仪器的最佳组合是______和______(填序号). 大对头1年前1
大对头1年前1 -
 顺便说说可以吧 共回答了19个问题
顺便说说可以吧 共回答了19个问题 |采纳率89.5%解题思路:本题是根据学生已经学习过氧气和二氧化碳的实验室制备,在此基础上结合题中给出乙炔的物理性质和制取反应信息,让同学们自选最佳的组合,体现对气体制取方法的理解和应用.(1)物理性质是不需要通过化学变化表现出来的性质.根据题给信息可知,乙炔俗称电石气(化学式为C2H2),是一种无色无味的气体,密度比空气略小,难溶于水,都是物理性质.
故答案为:无色无味的气体,或密度比空气略小,难溶于水;
(2)根据题给信息可知,制取乙炔反应为固体和液体不需加热的反应,且生成的气体不易溶于水、密度比空气小,制备与制二氧化碳的反应物状态和条件相同,故制备的最佳组合应用能控制反应速度的装置A,收集可选D与E,但该题要求最佳的收集方法(即最纯净的气体),所以应选E排水法进行收集.
故选A;E.点评:
本题考点: 气体制取装置的探究;化学性质与物理性质的差别及应用.
考点点评: 本题综合考查了学生的基本实验能力,涉及装置选择、连接、实验基本操作.重点考查学生对药品的选择、发生装置的选用等方面的能力,掌握知识的程度、深度和广度.1年前查看全部
- (2005•平顶山一模)把下列错误操作可能造成的后果填在横线上.
(2005•平顶山一模)把下列错误操作可能造成的后果填在横线上.
(1)配制的硫酸铜溶液在铁制容器中保存______;
(2)配制一定溶质质量分数的稀盐酸,用量筒量取一定量浓盐酸,面对刻度线仰视读数______;
(3)取用过药品的药匙,没用纸擦拭______;
(4)氢气还原氧化铜实验,当看到黑色粉末全部变为红色固体时即停止通氢气______. overcome200001年前1
overcome200001年前1 -
 ydo97343rte 共回答了19个问题
ydo97343rte 共回答了19个问题 |采纳率84.2%解题思路:(1)根据铁和铜的活泼性判断;
(2)用量筒正确读数判断;
(3)用药匙取用药品方法判断;
(4)实验没有没有做到“熄灭灯后再停氢”;(1)因为铁能与硫酸铜反应生成铜,故答案为:铁制容器被腐蚀
(2)用量筒取水时仰视读数,所读取数据小于所量取水的实际体积,故答案为:所配稀盐酸质量分数偏大
(3)药匙取用一种固体粉末后未经擦拭又去取用另一种药品会污染药品,所以 用药匙取用药品时,一定要擦净,故答案为:污染药品.
(4)停止实验时务必先熄灭酒精灯,过一会儿待试管冷却后再停止通氢气,否则,空气将进入试管,这样还原出来的铜又和空气中的氧气在受热的条件下,发生氧化反应,重新生成氧化铜,故答案为:红色固体可能重新变黑点评:
本题考点: 实验数据处理或者误差分析的探究;实验操作注意事项的探究;一定溶质质量分数的溶液的配制;金属活动性顺序及其应用;碳、一氧化碳、氢气还原氧化铜实验.
考点点评: 了解实验数据处理或者误差分析的探究方法以及了解一些实验操作的注意事项才能正确的进行实验操作.1年前查看全部
- (2013•平顶山二模)如图,B是线段AC的中点,过点C的直线l与AC成50°的角,在直线l上取一点P,使得∠APB=3
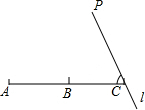 (2013•平顶山二模)如图,B是线段AC的中点,过点C的直线l与AC成50°的角,在直线l上取一点P,使得∠APB=30°,则满足条件的点P的个数是( )
(2013•平顶山二模)如图,B是线段AC的中点,过点C的直线l与AC成50°的角,在直线l上取一点P,使得∠APB=30°,则满足条件的点P的个数是( )
A.1个
B.2个
C.3个
D.无数个 落日红颜1年前0
落日红颜1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2013•平顶山)下列解释实验事实的反应方程式不正确的是( )
(2013•平顶山)下列解释实验事实的反应方程式不正确的是( )
A.盛放烧碱的试剂瓶不能用玻璃塞:SiO2+2NaOH=Na2SiO3+H2O
B.用烧碱溶液吸收氯气:Cl2+2OH-=Cl-+ClO-+H2O
C.用KSCN溶液检验Fe3+:Fe3++3SCN-⇌Fe(SCN)3
D.酸性KI淀粉溶液久置后变蓝:4I-+O2+2H2O=2I2+4OH- wdakui1年前1
wdakui1年前1 -
 风中无脚鸟 共回答了14个问题
风中无脚鸟 共回答了14个问题 |采纳率92.9%解题思路:A.反应生成硅酸钠,具有粘合性;
B.反应生成氯化钠和次氯酸钠、水;
C.结合生成络离子,溶液为血红色;
D.发生氧化还原反应,酸性溶液中不会生成OH-.A.SiO2+2NaOH=Na2SiO3+H2O,反应生成硅酸钠,具有粘合性,则盛放烧碱的试剂瓶不能用玻璃塞,故A正确;
B.氯气有毒,用碱吸收,反应生成氯化钠和次氯酸钠、水,离子反应为Cl2+2OH-=Cl-+ClO-+H2O,故B正确;
C.Fe3++3SCN-⇌Fe(SCN)3,结合生成络离子,溶液为血红色,则用KSCN溶液检验Fe3+,故C正确;
D.发生氧化还原反应,酸性溶液中不会生成OH-,则酸性KI淀粉溶液久置后变蓝的离子反应为4I-+O2+4H+=2I2+2H2O,故D错误;
故选D.点评:
本题考点: 离子方程式的书写.
考点点评: 本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,注意D中的氧化还原为解答的难点,题目难度不大.1年前查看全部
- (2014•平顶山二模)比-5大3的数是______.
 为你飘落的枫叶1年前1
为你飘落的枫叶1年前1 -
 jun329 共回答了11个问题
jun329 共回答了11个问题 |采纳率90.9%解题思路:比-5大3的数是-5+3,根据有理数的加法法则即可求解.-5+3=-2.
故答案是:-2.点评:
本题考点: 有理数的加法.
考点点评: 本题考查了有理数加法运算,首先判断两个加数的符号:是同号还是异号,是否有0,从而确定用哪一条法则.在应用过程中,要牢记“先符号,后绝对值”.1年前查看全部
- (2055•平顶山一模)为除去Na2SO4溶液中含有的杂质Na2CO十,应选用的试剂是______,若选用盐酸来除Na2
(2055•平顶山一模)为除去Na2SO4溶液中含有的杂质Na2CO十,应选用的试剂是______,若选用盐酸来除Na2CO十,则又会引入的新杂质是______.
 oyzlboy1年前1
oyzlboy1年前1 -
 纯净水一滴9 共回答了23个问题
纯净水一滴9 共回答了23个问题 |采纳率91.3%解题思路:除去硫酸钠中的碳酸钠,实质就是除去碳酸根离子,根据碳酸根能和酸反应生成气体的性质,可以用酸除去,但不能带入新的杂质.用硫酸除去碳酸钠,生成硫酸钠、水和v氧化碳,不会在溶液中带入新的杂质,若用盐酸除去碳酸钠,会生成新的杂质氯化钠,故不能用盐酸.
故答案为:H2SO4,Na十l.点评:
本题考点: 物质除杂或净化的探究.
考点点评: 进行物质除杂时,要根据物质的性质进行,要求选用的除杂试剂反应后不能产生新的杂质且不能与原物质反应.1年前查看全部
大家在问
- 1else的用法whose else‘s who’s else who else‘s的区别 whe
- 2老人与海鸥的深厚感情真是感人.如果海鸥会说还回收些什么.150字以上
- 3把一个圆柱沿地面直径纵切为两半后,增加的一个面的面积是10㎝²,原来的圆柱的侧面积是()cm²
- 4I hung the picture on the wall ____ can be seen well.A.where
- 5还可以想象它们当时在黏稠的松脂里怎样挣扎,因为它们的腿的四周显出好几圈黑色的圆环.
- 6That's a surprise怎么读
- 7怎么学好英语?我小学时英语学得很好,一上初中刚开始还行,到现在就...
- 8如图所示,在圆⊙O内有折线OABC,其中OA=8,AB=12,∠A=∠B=60°,则BC的长为( )
- 9I ,d like to [climb mountains}?对画括号的部分提问
- 10写一写“最”字成语 最短的季节------( )
- 11赞妈妈儿童诗
- 12MY DAY英语作文my day字数:70关于户外活动的.
- 13荧光物质对人体有害吗我有一个小公仔,是荧光的,由于之前开着灯照着,晚上熄灯后,会亮一会儿,请问对人体有害吗
- 14(2013•保定一模)京广高速铁路客运专线于2012年12月26日全线贯通.结合图完成11--12题.
- 15用字母wjr造句想纹身 用wjr这三个字母造一句有意义的英文句子 比如gl good luck
