Na3AlF6,也就是冰晶石的成分,是叫六氟铝酸钠还是六氟铝三钠?
 wangyaopin2022-10-04 11:39:541条回答
wangyaopin2022-10-04 11:39:541条回答老师的普通话不标准.

已提交,审核后显示!提交回复
共1条回复
 WMWXY2007 共回答了22个问题
WMWXY2007 共回答了22个问题 |采纳率90.9%- 正确的命名方法是:六氟合铝酸钠.也可以叫“六氟铝酸钠”.
一般没有叫“六氟铝三钠”的.因为这是一种盐,应该是“×酸×” - 1年前
相关推荐
- (2013•广东模拟)铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得.铝土矿的主要
(2013•广东模拟)铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得.铝土矿的主要成分是Al2O3和SiO2及其它不溶于NaOH溶液的杂质.从铝土矿中提炼Al2O3的流程如下:
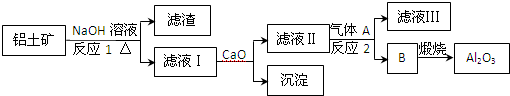
回答下列问题:
(1)写出反应1的化学方程式______;
(2)滤液Ⅰ中加入CaO生成的沉淀是______,反应2的离子方程式为______;
(3)电解制铝的化学方程式是2Al2O3(熔融)
4Al+3O2↑通电 .冰晶石 2Al2O3(熔融),以石墨为电极,阳极产生的混合气体的成分是______.
4Al+3O2↑通电 .冰晶石  清溪流茗1年前1
清溪流茗1年前1 -
 ljs555 共回答了20个问题
ljs555 共回答了20个问题 |采纳率100%解题思路:(1)二氧化硅与氢氧化钠反应生成硅酸钠与水;氧化铝与氢氧化钠反应生成偏铝酸钠与水;
(2)滤液Ⅰ中含有硅酸钠、偏铝酸钠,加入CaO,生成氢氧化钙,氢氧化钙与硅酸钠反应生成硅酸钙沉淀;
由工艺流程可知,B为氢氧化铝,故气体A为二氧化碳,滤液Ⅱ主要是偏铝酸钠,偏铝酸钠溶液通入二氧化碳,生成氢氧化铝与碳酸钠;
(3)电解熔融的氧化铝生成铝与氧气;阳极生成氧气,部分氧气可以石墨反应生成二氧化碳、CO.(1)二氧化硅与氢氧化钠反应生成硅酸钠与水,反应方程式为:2NaOH+SiO2═Na2SiO3+H2O,氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应方程式为:2NaOH+Al2O3═2NaAlO2+H2O,
故答案为:2NaOH+SiO2═Na2SiO3+H2O、2NaOH+Al2O3═2NaAlO2+H2O;
(2)滤液Ⅰ中含有硅酸钠、偏铝酸钠,加入CaO,生成氢氧化钙,氢氧化钙与硅酸钠反应生成硅酸钙沉淀;
由工艺流程可知,B为氢氧化铝,故气体A为二氧化碳,滤液Ⅱ主要是偏铝酸钠,偏铝酸钠溶液通入二氧化碳,生成氢氧化铝与碳酸钠,反应方程式为:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32-,
故答案为:CaSiO3;2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32-;
(3)电解熔融的氧化铝生成铝与氧气,反应方程式为:2Al2O3(熔融)
通电
.
冰晶石4Al+3O2↑,阳极生成氧气,部分氧气可以石墨反应生成二氧化碳、CO,故阳极气体有O2、CO2(或CO)
故答案为:2Al2O3(熔融)
通电
.
冰晶石4Al+3O2↑;O2、CO2(或CO).点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查化学工艺流程、无机物推断、电解原理等,题目难度中等,理解工艺流程是解题的关键,需要学生基本扎实的据此与运用知识分析解决问题的能力.1年前查看全部
- 冰晶石(Na3AlF6)晶体中存在哪些化学键?
冰晶石(Na3AlF6)晶体中存在哪些化学键?
有离子键和配位键.
①配位键是不是存在Al和F间,为什么他们间不是离子键?
②这里的配位键是极性共价键吧,能说极性共价键都是配位键吗?
③当时在做这道题时,我同学说,离子键在化合物中只存在一处,他据此认为na与al间是离子健后,al与f间就是共价键了,这种推断成立吗?
④Al2Cl3是共价化合物而Al2O3是离子化合物的本质原因是什么?是电负性的差别吗?
劳驾了!如果能让我清楚明白, angellee661年前2
angellee661年前2 -
 毛毛虫想飞 共回答了18个问题
毛毛虫想飞 共回答了18个问题 |采纳率94.4%高中阶段对物构的要求非常低,只要了解些皮毛就行,若要细细追究一些问题的根本原因就显得很复杂,没必要.毕竟高中生不是专业研究化学的,还要兼固其它学科,你只要按我下面的话去理解去记就行.
①判断此题中冰晶石是不是配合物?配位键于何处?可这样思考.首先,材料中有提到冰晶石又名六氟合铝酸钠,这就提示我们:氟和铝间是配位键了,因为这是配合物的命名规则.其次,你可曾记得,冰晶石在电解铝工业中的作用?熔融冰晶石能溶解氧化铝,作其助熔剂,使熔点降低加快反应速率,也就是催化剂的作用.高中物构书中又曾提到:配合物在生产生活中的重要作用之一是催化剂.这又是一条线索暗示我们:它是配合物有配位键.最后,现在已知冰晶石中有配位键,那么,明显六个氟是配位体提供孤电子对,可是在钠与铝间谁才是中心原子提供空轨道呢?虽然他们貌似都有条件,但是配位键是共价键的一种,形成共价键的两元素要满足电负性差值小于1.7,所以在这道题中只要判断钠与铝的电负性谁更大更接近氟,又因为铝的非金属性大于钠,所以铝电负性更大.总结:冰晶石是以3个钠离子为外界,六氟合铝为内界的配合物,其中,6个氟作为配位体提供孤电子对,铝为中心原子提供空轨道.
②这里的配位键是极性共价键,原因是铝与氟间电负性存在差值,电子对偏向氟.不能说极性共价键都是配位键,因为配位健是由提供空轨道的原子或离子与提供孤电子对的原子或离子间所形成的,形成极性键的未必符合此条件,像氯化氢,氯与氢间是极性键,但氯与氢他们是各带一个电来结合形程的,不存在空轨道与孤电子对.此外,可以说配位键都是极性键 ,因为电子总是偏向一方.
③这种推断有些荒谬,不过若已知其为配合物,通过这样来判断内外界还是可以的.
④氧化铝是离子化合物,氯化铝是共价化合物,这些都可以通过计算元素间的电负性差值得出.高中阶段知识较浅显不谈太多本质原因,你可以认为其原因就是电负性差值造成的.
再次强调,以上判断方法适用于高中,并非真理.
楼上有一误人子弟的地方,我来更正下,只要是电解质,共价和离子形的化合物都能在水溶液中导电,如氯化氢是共价化合物但水溶液中可导电,所以说区别他们的方法看是否导电是错的,应该说在熔融状态下能否导电可以作为判断的依据,共价化合物在熔融下不导电而离子化合物可以.1年前查看全部
- 电解氧化铝用冰晶石Na3AlF6催化的原理是什么
 dantanglie1年前2
dantanglie1年前2 -
 阳光冷冷 共回答了30个问题
阳光冷冷 共回答了30个问题 |采纳率93.3%不是催化,是让Al2O3溶解在其中1年前查看全部
- 怎样区分络盐和复盐?如Na3AlF6,为什么说它是络盐而不是复盐呢?
 bib3slp1年前1
bib3slp1年前1 -
 sony20000 共回答了11个问题
sony20000 共回答了11个问题 |采纳率90.9%主要看溶液中有几种离子:
复盐一般溶液中有多于一种的阴离子或阳离子,如 KAlSO4
溶液中K和AL 两种不同的离子
而络盐是指溶液中只有一种阴离子,也只有一种阳离子,但阴离子或阳离子是以络合物的形式存在的.如 Na3AlF6,溶液中只有Na 和ALF6两种离子
而AlF6是络合物,所以是络盐1年前查看全部
- 答案是Na+ 怎么看的 这儿学得不好 冰晶石化学式:Na3AlF6
答案是Na+ 怎么看的 这儿学得不好 冰晶石化学式:Na3AlF6
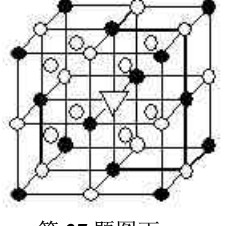

(O位于大立方体的12条棱的中点)白球和黑球那分别是怎么 说只由两种微粒构成 那两种微粒又是什么 工8301年前1
工8301年前1 -
 cpa42 共回答了22个问题
cpa42 共回答了22个问题 |采纳率95.5%黑球为AlF6八面体,白球和三角全为Na+1年前查看全部
- 在冰晶石(Na3AlF6)晶胞中含有的原子数与食盐晶胞中含有的原子数之比为
在冰晶石(na3alf6)晶胞中含有的原子数与食盐晶胞中含有的原子数之比为
.组成晶体的质点(分子、原子、离子)以确定的位置在空间作有规则排列,具有一定几何形状的空间格子,称为晶格,晶格中***晶体结构特征的最小重复单位称为晶胞.在冰晶石(na3alf6)晶胞中,alf63-占据的位置相当于nacl晶胞中c1-占据的位置,则冰晶石晶胞中含有的原子数与食盐晶胞中含有的原子数之比为
a.2:1 b.3:2 c.5:2 d.5:1
为什么? awood9991年前1
awood9991年前1 -
 胡zz芳 共回答了21个问题
胡zz芳 共回答了21个问题 |采纳率90.5%答案是D?
不是的话叫我一下1年前查看全部
- (2011•常州三模)如图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的1
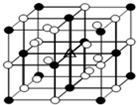 (2011•常州三模)如图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心.则下列说法正确的是( )
(2011•常州三模)如图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心.则下列说法正确的是( )
A.冰晶石的名称是六氟合铝(Ⅲ)化钠
B.该物质中存在离子键和共价键
C.大立方体的体心处△代表的是Al3+
D.该物质是电解冶炼铝的还原剂 蛐蛐和蝈蝈1年前1
蛐蛐和蝈蝈1年前1 -
 txf1127 共回答了21个问题
txf1127 共回答了21个问题 |采纳率95.2%解题思路:本题根据常见的钠盐为离子化合物,可以判断有离子键,[AlF6]3- 为六氟合铝(Ⅲ)酸根离子,物质的名称是六氟合铝(Ⅲ)酸钠,晶胞中的均为原子,不是离子,铝离子只有氧化性,没有还原性,为氧化剂.A.Na3AlF6中[AlF6]3-,为六氟合铝(Ⅲ)酸根离子,故冰晶石的名称是六氟合铝(Ⅲ)酸钠,故A错误;
B.六氟合铝(Ⅲ)酸根离子中含有共价键,故该物质中存在离子键和共价键,故B正确;
C.大立方体的体心处△代表的是Na+,故C错误;
D.该物质中铝元素的化合价为+3,已经为最高价,具有氧化性,为氧化剂,故D错误;
故选B.点评:
本题考点: 晶胞的计算.
考点点评: 本题考查了酸根离子的命名及钠盐的命名,钠盐一般为离子化合物,晶胞中的点表示原子,铝离子为氧化剂等知识点.1年前查看全部
- 铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得.
铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得.
①铝土矿的主要成分是Al2O3和SiO3等.从铝土矿中提炼Al2O3的流程如下: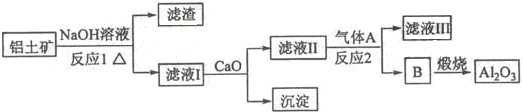
②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下: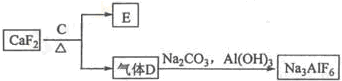
回答下列问题;
(1)写出反应l的化学方程式______
(2)滤液,I中加入Ca0生成的沉淀是______,反应2的离子方程式为______.
(3)电解制铝的化学方程式是2Al2O3(熔融)
4Al+3O2↑通电 .冰晶石 2Al2O3(熔融)
4Al+3O2↑通电 .冰晶石
(4)C为浓硫酸,则气体D是______,写出由D制备冰晶石的化学方程式:______. 我不是WUZI1年前1
我不是WUZI1年前1 -
 怎么说爱 共回答了13个问题
怎么说爱 共回答了13个问题 |采纳率92.3%解题思路:①铝土矿的主要成分是Al2O3和SiO2等,加入氢氧化钠溶液氧化铝溶解,过滤得到滤液偏铝酸钠溶液,二氧化硅溶解生成硅酸钠溶液,加入氧化钙生成氢氧化钙,和硅酸钠反应生成硅酸钙沉淀,过滤得到偏铝酸钠溶液,通入过量二氧化碳得到氢氧化铝沉淀煅烧得到氧化铝;
②氟化钙和浓硫酸加热反应生成氟化氢气体和硫酸钙,氟化氢和碳酸钠、氢氧化铝反应生成冰晶石六氟合铝酸钠;
(1)二氧化硅与氢氧化钠反应生成硅酸钠与水;氧化铝与氢氧化钠反应生成偏铝酸钠与水;
(2)滤液Ⅰ中含有硅酸钠、偏铝酸钠,加入CaO,生成氢氧化钙,氢氧化钙与硅酸钠反应生成硅酸钙沉淀;
由工艺流程可知,B为氢氧化铝,故气体A为二氧化碳,滤液Ⅱ主要是偏铝酸钠,偏铝酸钠溶液通入二氧化碳,生成氢氧化铝与碳酸钠;
(3)由工艺流程可知,气体D含有F元素,应是HF,故C为浓硫酸;根据元素守恒,可知HF与碳酸钠、氢氧化铝反应生成冰晶石,同时生成二氧化碳、水;
(4)电解熔融的氧化铝生成铝与氧气;阳极生成氧气,部分氧气可以石墨反应生成二氧化碳、CO.(1)二氧化硅与氢氧化钠反应生成硅酸钠与水,反应方程式为:2NaOH+SiO2=Na2SiO3+H2O,氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应方程式为:2NaOH+Al2O3=2NaAlO2+H2O,
故答案为:2NaOH+SiO2=Na2SiO3+H2O、2NaOH+Al2O3=2NaAlO2+H2O;
(2)滤液Ⅰ中含有硅酸钠、偏铝酸钠,加入CaO,生成氢氧化钙,氢氧化钙与硅酸钠反应生成硅酸钙沉淀;由工艺流程可知,B为氢氧化铝,故气体A为二氧化碳,滤液Ⅱ主要是偏铝酸钠,偏铝酸钠溶液通入二氧化碳,生成氢氧化铝与碳酸钠,反应方程式为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,
故答案为:CaSiO3;2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-;
(3)电解熔融的氧化铝生成铝与氧气,反应方程式为:2Al2O3(熔融)
通电
.
冰晶石4Al+3O2↑;故答案为:2Al2O3(熔融)
通电
.
冰晶石4Al+3O2↑;
(4)由工艺流程可知,气体D含有F元素,应是HF,故C为浓硫酸;根据元素守恒,可知HF与碳酸钠、氢氧化铝反应生成冰晶石,同时生成二氧化碳、水,反应方程式为:12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O,
故答案为:HF;12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查化学工艺流程、无机物推断、常用化学用语等,题目难度中等,理解工艺流程是解题的关键,(4)中HF的制备是中学中比较陌生的知识,现在基本不涉及,是难点、易错点,需要学生基本扎实的据此与运用知识分析解决问题的能力.1年前查看全部
- 冰晶石(化学式为Na3AlF6)的结构单元如右图所示,已知冰晶石熔融时电离方程式为Na3AlF6 =3Na+ + AlF
冰晶石(化学式为Na3AlF6)的结构单元如右图所示,已知冰晶石熔融时电离方程式为Na3AlF6 =3Na+ + AlF6
④在晶体结构中○的数目:棱中点取其,体心点取其1,则○共有:12×+8×1=12.这个不是应该等于11么 怎么算的 柳大山1年前1
柳大山1年前1 -
 不想告诉你太多 共回答了18个问题
不想告诉你太多 共回答了18个问题 |采纳率77.8%1从电离方程式看出,Al元素和F元素均以整体的形式出现.
2从晶体结构看,由于阴、阳一定是交替结构,所以,一定是阳离子.
3在晶体结构中○的数目:棱中点取其,体心点取其1,则○共有:12×+8×1=12.1年前查看全部
- (2011•上海)工业上制取冰晶石(Na3AlF6)的化学方程式如下:2Al(OH)3+12HF+3Na2CO3=2Na
(2011•上海)工业上制取冰晶石(Na3AlF6)的化学方程式如下:2Al(OH)3+12HF+3Na2CO3=2Na3AlF6+3CO2↑+9H2O
根据题意完成下列填空:
(1)在上述反应的反应物和生成物中,属于非极性分子的电子式______,属于弱酸的电离方程式______.
(2)反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属性强弱的是______(选填编号).
a.气态氢化物的稳定性b.最高价氧化物对应水化物的酸性
c.单质与氢气反应的难易d.单质与同浓度酸发生反应的快慢
(3)反应物中某些元素处于同一周期.它们最高价氧化物对应的水化物之间发生反应的离子方程式为______.
(4)Na2CO3俗称纯碱,属于______晶体.工业上制取纯碱的原料是______. uu突醒1年前0
uu突醒1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 晶体中的相关计算1.12g石墨中含有碳碳键的个数为多少NA?2.在冰晶石(Na3AlF6)晶胞中,AlF6离子占据的位置
晶体中的相关计算
1.12g石墨中含有碳碳键的个数为多少NA?
2.在冰晶石(Na3AlF6)晶胞中,AlF6离子占据的位置相当于NaCl晶胞中Cl离子占据的位置,则冰晶石晶胞中含有的原子数与食盐晶胞中含有的原子数之比为多少?
(希望有比较详细的文字叙述)
第一题是1.5NA,我已经知道原因了,但是第二题的答案应该是3:2,可我不知道为什么. 爱恋春光1年前3
爱恋春光1年前3 -
 yilang211 共回答了17个问题
yilang211 共回答了17个问题 |采纳率88.2%1、石墨中每个碳原子以3个共价键和周围碳原子结合,考虑到边沿的忽略不计和电子对的共用,12克即1摩尔石墨含碳碳键为1.5N(阿伏伽德罗常数)个;
2、氯化钠晶胞含8个原子.冰晶石结构与此相当,AlF6 3-离子占据的位置相当于NaCl晶胞中Cl离子占据的位置,即每个晶胞含有四个AlF6^-3离子,而且还含有3x4=12个钠离子,所以一共含40个原子.这样,冰晶石晶胞中含有的原子数与食盐晶胞中含有的原子数之比为40:8=5:1.1年前查看全部
- 工业上以Al2O3和冰晶石Na3AlF6为原料化学方程式
工业上以Al2O3和冰晶石Na3AlF6为原料化学方程式
在通电条件下电解熔融氧化铝制取金属铝 liangzhi1111年前1
liangzhi1111年前1 -
 gugong0727 共回答了16个问题
gugong0727 共回答了16个问题 |采纳率75%2Al2O3=4Al+3O2 条件电解加冰晶石.1年前查看全部
- 为何氧化铝(Al2O3)中添加冰晶石(Na3AlF6)后其熔点温度会降低?
为何氧化铝(Al2O3)中添加冰晶石(Na3AlF6)后其熔点温度会降低?
从微观将原因讲清楚点,
可以从冰晶石(Na3AlF6)的微观结构上讲下为何它有这些特性吗,谢啦各路大虾 . lihuaqiye1年前1
lihuaqiye1年前1 -
 junho 共回答了17个问题
junho 共回答了17个问题 |采纳率82.4%把电流通到熔融的金属盐中,可以使金属的离子在阴极上沉积下来,从而使金属离子分离出来.因为氧化铝的熔点很高(2050℃),必须物色一种能够溶解氧化铝而又能降低其熔点的材料,偶然发现了冰晶石(Na3AlF6).冰晶石一氧化铝熔盐的熔点仅在930℃~1000℃之间,冰晶石在电解温度下不被分解,并有足够的流动性.这样就有利于电解的进行.
用碳作坩埚衬里,又将碳作为阴极,防止电流使坩埚中的二氧化硅分解游离出硅
氟化钠是离子化合物,电力产生氟离子,由于氟离子电负性大,所以在电解时氧优先于氟被氧化,所以反应是不会有F2生成;同理,由于铝优先于钠被还原,所以也无钠生成.注意:氧化铝是离子晶体,氟离子极大的电负性减弱了氧化铝中的离子键,所以熔点降低
够明白了吧,熔点与构成物质的微粒间的作用力成正比,既然熔点改变,那么肯定是微粒间作用力受外来微粒作用,找到这个外来微粒自然明白了
好累,但愿你理解,上帝保佑,阿门!1年前查看全部
- 冰晶石(化学式为Na3AlF6)的结构单元如右图所示,已知冰晶石熔融时电离方程式为Na3AlF6 =3Na+ + AlF
冰晶石(化学式为Na3AlF6)的结构单元如右图所示,已知冰晶石熔融时电离方程式为Na3AlF6 =3Na+ + AlF6
●位于大立方体顶点和面心
○位于大立方体的12条棱的中点和8个小立方体的体心
那么大立方体的体心处▽所代表的微粒是
A.Na+ B.Al3+
C.F— D.AlF6— elhb_huang1年前1
elhb_huang1年前1 -
 强哆哆 共回答了24个问题
强哆哆 共回答了24个问题 |采纳率91.7%:①从电离方程式看出,Al元素和F元素均以整体的形式出现.
②从晶体结构看,由于阴、阳一定是交替结构,所以,一定是阳离子.
③在晶体结构中·的数目:顶点取其,面心取其,则共有:8×+6×=4.
④在晶体结构中○的数目:棱中点取其,体心点取其1,则○共有:12×+8×1=12.
⑤由于·的数目∶○的数目=1∶3,故·是,○是Na+.
答案:A1年前查看全部
- 6 HF +3 NaAlO2 -> Na3AlF6 +3 H2O + AL2O3 在这条方程式中,需要多少 NaAlO2
6 HF +3 NaAlO2 -> Na3AlF6 +3 H2O + AL2O3 在这条方程式中,需要多少 NaAlO2 才能配制出 1kg Na3AlF6?
 星光vv1年前7
星光vv1年前7 -
 marvellily 共回答了18个问题
marvellily 共回答了18个问题 |采纳率88.9%Al3+ NH4+ + 5OH- = AlO2- + NH3 + 3H2O1年前查看全部
- 铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得.铝土矿的主要成分是
铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得.铝土矿的主要成分是
Al2O3和SiO2等.从铝土矿中提炼Al2O3的流程如下: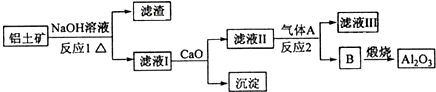
已知:CaO+Na2SiO3+H2O→CaSiO3↓+2NaOH
完成下列填空:
(1)写出流程中反应1的化学方程式______,
(2)流程中反应2的离子方程式为______. 4576246851年前1
4576246851年前1 -
 yunyunly 共回答了14个问题
yunyunly 共回答了14个问题 |采纳率78.6%解题思路:(1)铝土矿的主要成分是Al2O3和SiO2等,与NaOH反应分别为:Al2O3+2NaOH=2NaAlO2+H2O;SiO2+2NaOH=Na2SiO3+H2O;
(2)反应1的滤液中含有NaAlO2和Na2SiO3加入CaO,Na2SiO3变为CaSiO3沉淀,故滤液Ⅱ中的溶质为NaAlO2,通入A生成B,B煅烧生成Al2O3,故B为Al(OH)3,气体A应该为CO2,发生反应为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.(1)铝土矿的主要成分是Al2O3和SiO2等,与NaOH反应:Al2O3+2NaOH=2NaAlO2+H2O;SiO2+2NaOH=Na2SiO3+H2O;
故答案为:Al2O3+2NaOH=2NaAlO2+H2O;SiO2+2NaOH=Na2SiO3+H2O;
(2)反应1的滤液中含有NaAlO2和Na2SiO3加入CaO,Na2SiO3变为CaSiO3沉淀,故滤液Ⅱ中的溶质为NaAlO2,通入A生成B,B煅烧生成Al2O3,故B为Al(OH)3,反应Ⅱ为:NaAlO2生成Al(OH)3的反应,故气体A应该为CO2,发生反应为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-;
故答案为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.点评:
本题考点: 镁、铝的重要化合物.
考点点评: 本题考查化学工艺流程、无机物推断等,化合物的性质是解题的关键.1年前查看全部
大家在问
- 1x的3倍加上6.2与8的积,和是84.1.
- 2在1,3,7,8,15,17,24这些数中,质数有______,合数有______,奇数有______,
- 3He asked what ___ (annoy) me.
- 4阐述水对植物形态和分布的影响
- 5Unit 2 Where's the post office
- 6有白孔雀吗
- 7已知x+y=0.5,x y都是正实数 ; 求z=x^(-1)+4*y^(-1)的最小值
- 8一个长方形的体积与一个正方体的体积相等,已知正方形的棱长为4分米,长方体的高为1米,长方体的表面积是多
- 9黑龙江省都有哪些气候类型
- 10解二元一次方程组3(x+y)-4(x-y)=42分之x+y+6分之x-y=1
- 11初三物理电功率部分的计算题应该怎么算啊?
- 12英语翻译Sometime,you just have to pretend that you are happy jus
- 13绿色植物的同化作用除了光合作用外,还有什么?
- 14假如英语课上老师要求同桌之间交换修改作文, 请你修改你同桌的以下作文。文中共有10处语言错误, 每句中最多有两处;每处错
- 15读“新疆地形图”,回答问题:(1)新疆“三山夹两盆”的地形,图中的ABC指的“三山“,其中A为______、B为____
