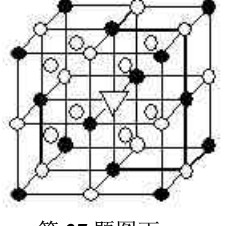
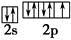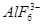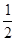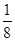冰晶石(化学式为Na3AlF6)的结构单元如右图所示,已知冰晶石熔融时电离方程式为Na3AlF6 =3Na+ + AlF
 elhb_huang2022-10-04 11:39:541条回答
elhb_huang2022-10-04 11:39:541条回答●位于大立方体顶点和面心
○位于大立方体的12条棱的中点和8个小立方体的体心
那么大立方体的体心处▽所代表的微粒是
A.Na+ B.Al3+
C.F— D.AlF6—

已提交,审核后显示!提交回复
共1条回复
 强哆哆 共回答了24个问题
强哆哆 共回答了24个问题 |采纳率91.7%- :①从电离方程式看出,Al元素和F元素均以整体的形式出现.
②从晶体结构看,由于阴、阳一定是交替结构,所以,一定是阳离子.
③在晶体结构中·的数目:顶点取其,面心取其,则共有:8×+6×=4.
④在晶体结构中○的数目:棱中点取其,体心点取其1,则○共有:12×+8×1=12.
⑤由于·的数目∶○的数目=1∶3,故·是,○是Na+.
答案:A - 1年前
相关推荐
- 冰晶石是什么(化学式)为什么可以用于Al2O3的电解,并且可以降低Al2O3的沸点.快递哦,
 explode11年前2
explode11年前2 -
 xhyx01 共回答了18个问题
xhyx01 共回答了18个问题 |采纳率94.4%冰晶石(Cryolite)一种矿物,六氟铝酸钠(Na3AlF6),白色单斜晶系(109摄氏度),微溶于水,能溶于氧化铝,在电解铝工业作助熔剂、制造乳白色玻璃和搪瓷的遮光剂.
冰晶石作溶剂,将氧化铝溶解,然后电解.冰晶石在这里起了关键作用,它解决了氧化铝熔点高(达2 050 ℃)、又不导电、无法单独电解的困难.氧化铝溶入冰晶石之后就可以在的温度(940 ℃~980 ℃)下进行电解.冰晶石还有其他妙用,它在熔融状态时比铝轻,电解得到的铝沉于槽底,冰晶石浮于其上,起着防止铝被空气氧化的作用.1年前查看全部
- 工业上冶炼铝时需用到一种熔剂冰晶石(Na 3 AlF 6 ),工业制冰晶石的化学方程式为:2Al(OH) 3 +
工业上冶炼铝时需用到一种熔剂冰晶石(Na 3 AlF 6 ),工业制冰晶石的化学方程式为:2Al(OH) 3 + 12HF+ 3Na 2 CO 3 =2Na 3 AlF 6 + 3CO 2 ↑+ 9H 2 O 根据题意完成下列填空:
(1)写出工业冶炼铝时阳极电极反应式______________。
(2)在上述反应的反应物和生成物中,属于酸性氧化物的化合物的电子式________。
(3)反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属强弱的是_________(选填编号)。
a.气态氢化物的稳定性
b.最高价氧化物对应水化物的酸性
c.单质与氢气反应的难易
d.单质与同浓度酸发生反应的快慢
(4)反应物中某些元素处于同一周期。它们最高价氧化物对应的水化物之间发生反应的离子方程式为_____________________。 花枝妖妖1年前0
花枝妖妖1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 冰晶石是什么?冶炼铝要用到氧化铝和冰晶石,是怎么反应的?
 lifemil1年前1
lifemil1年前1 -
 knightsmily 共回答了16个问题
knightsmily 共回答了16个问题 |采纳率87.5%冰晶石,分子式Na3AlF6,主要用作铝电解的助熔剂,也用作橡胶、砂轮的耐磨填充剂、搪瓷的乳白剂、玻璃的遮光剂和金属熔剂等.1年前查看全部
- 明矾、铜绿、冰晶石、胆矾、电解石、生石膏、熟石膏的化学式各是什么?
 Volts1年前6
Volts1年前6 -
 良药一剂 共回答了19个问题
良药一剂 共回答了19个问题 |采纳率84.2%明矾 KAl(SO4)2·12H2O
铜绿 Cu2(OH)2CO3
冰晶石 Na3AlF6
胆矾 CuSO4·5H2O
电解石 CaC2
生石膏 CaSO4·2H2O
熟石膏 2CaSO4·H2O1年前查看全部
- 冰晶石在冶炼金属的过程中能起什么作用?
 chenbaikan1年前3
chenbaikan1年前3 -
 了_了 共回答了18个问题
了_了 共回答了18个问题 |采纳率94.4%电解氧化铝时加冰晶石可作溶剂,帮助降低熔融温度,节约电能1年前查看全部
- 工业上制取冰晶石(Na 3 AlF 6 )的化学方程式如下:
工业上制取冰晶石(Na 3 AlF 6 )的化学方程式如下:
2Al(OH) 3 +12HF+3Na 2 CO 3 =2Na 3 AlF 6 +3CO 2 ↑+9H 2 O。根据题意完成下列填空:
⑴在上述反应的反应物和生成物中,CO 2 的电子式 ,属于弱酸的电离方程式 。若0.1mol∙L - 1 的该弱酸溶液的pH为a,则该弱酸的电离度为 (用a表示)
⑵反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属性强弱的是 (选填编号)。
a.气态氢化物的稳定性 b.最高价氧化物对应水化物的酸性
c.单质与氢气反应的难易 d.单质与同浓度酸发生反应的快慢
⑶反应物中某些元素处于同一周期。它们最高价氧化物对应的水化物之间发生反应的离子方程式为 。
⑷Na 2 CO 3 俗称纯碱,属于 晶体。工业上制取纯碱的原料是 。
⑸F 2 能溶于NaOH溶液中生成OF 2 ,写出该反应的化学方程式并配平
 赵丰年-1年前0
赵丰年-1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 电解氧化铝用冰晶石Na3AlF6催化的原理是什么
 dantanglie1年前2
dantanglie1年前2 -
 阳光冷冷 共回答了30个问题
阳光冷冷 共回答了30个问题 |采纳率93.3%不是催化,是让Al2O3溶解在其中1年前查看全部
- 【化学与技术】工业上制取铝的流程如下:注:冰晶石的作用是使E在较低温度下熔化.(1)试写出下列物质的化学式:A_____
【化学与技术】
工业上制取铝的流程如下:
注:冰晶石的作用是使E在较低温度下熔化.
(1)试写出下列物质的化学式:A______,B______,C______,D______,E______.
(2)在用此法制取铝时,分析铝土矿和赤泥(提取Al2O3之后的残渣)所得数据如下:
试求制取1t Al2O3所需铝土矿和苛性钠的质量.(写过程)Al2O3 Fe2O3 Na2O 铝土矿 55% 16% 0% 赤泥 15% 48% 8%  tytetyou1年前1
tytetyou1年前1 -
 vklibing 共回答了18个问题
vklibing 共回答了18个问题 |采纳率83.3%解题思路:(1)铝土矿的成分中,只有氧化铝可以和氢氧化钠之间发生反应生成偏铝酸钠溶液,向其中通入二氧化碳会生成氢氧化铝和碳酸钠溶液,氢氧化铝易分解为氧化铝和水,电解熔融的氧化铝可以得到金属铝和氧气,所以A是氢氧化钠,B是二氧化碳,C是碳酸钠或是碳酸氢钠,D是氢氧化铝,E是氧化铝;
(2)根据元素守恒结合物质的质量进行计算即可.(1)铝土矿的成分中,只有氧化铝可以和氢氧化钠之间发生反应生成偏铝酸钠溶液,向其中通入二氧化碳会生成氢氧化铝和碳酸钠溶液,氢氧化铝易分解为氧化铝和水,电解熔融的氧化铝可以得到金属铝和氧气,所以A是氢氧化钠,B是二氧化碳,C是碳酸钠或是碳酸氢钠,D是氢氧化铝,E是氧化铝,
故答案为:NaOH;NaAlO2;NaHCO3或Na2CO3;Al(OH)3;Al2O3;
(2)铝土矿中,氧化铝的质量分数是55%,所以1tAl2O3所需铝土矿的质量m=[1t/55%]≈1.8t,氧化铝和氢氧化钠之间的反应:Al2O3+2NaOH=2NaAlO2+H2O,所以1tAl2O3所需氢氧化钠的质量m=0.78t,
答:铝土矿中,氧化铝的质量分数是55%,所以1tAl2O3所需铝土矿的质量m=[1t/55%]≈1.8t,氧化铝和氢氧化钠之间的反应:Al2O3+2NaOH=2NaAlO2+H2O,所以1tAl2O3所需氢氧化钠的质量m=0.78t.点评:
本题考点: 镁、铝的重要化合物;金属冶炼的一般原理.
考点点评: 本题考查学生金属铝以及化合物的性质知识,注意知识的归纳和整理是解题关键,难度不大.1年前查看全部
- 冰晶石的中心原子是铝原子还是铝离子
冰晶石的中心原子是铝原子还是铝离子
如题:铝离子具有空轨道.根据中心原子的定义,应该中心原子是铝离子啊,可我们老师讲的是铝原子.而且中心原子也可以是离子的呀.疑惑了. 温柔小猫猫1年前1
温柔小猫猫1年前1 -
 空山雅士 共回答了17个问题
空山雅士 共回答了17个问题 |采纳率88.2%冰晶石的阴离子是六氟合铝酸根离子,整体是个配离子,中心铝与配体氟形成配位键,Al-F键属共价键,因此中心的铝是原子.你所谓的铝离子,可以认为是在配离子形成前的情况,但一旦配合后,是没有铝离子存在的.1年前查看全部
- 单冰晶石(四氟铝酸钠)的性质?如题
 青山的云1年前1
青山的云1年前1 -
 jingpeihu 共回答了16个问题
jingpeihu 共回答了16个问题 |采纳率100%目前我们能得到的四氟铝酸钠NaAlF4(SAF)多为生产多晶硅的副产品,其中的杂质含量多不是所宣传的那么低,硅、钾、钠等都比较高,直接用于电解铝还是不行,必须经过处理后才能应用.
四氟铝酸钠NaAlF4(SAF)
由于四氟化硅的充分反应而产生硅烷,因此SAF中硅的含量保持非常低的水平(1年前查看全部
- 答案是Na+ 怎么看的 这儿学得不好 冰晶石化学式:Na3AlF6
答案是Na+ 怎么看的 这儿学得不好 冰晶石化学式:Na3AlF6

(O位于大立方体的12条棱的中点)白球和黑球那分别是怎么 说只由两种微粒构成 那两种微粒又是什么 工8301年前1
工8301年前1 -
 cpa42 共回答了22个问题
cpa42 共回答了22个问题 |采纳率95.5%黑球为AlF6八面体,白球和三角全为Na+1年前查看全部
- (2014•晋中模拟)在电解炼铝过程中加入冰晶石(用“A”)代替,可起到降低Al2O3熔点的作用.冰晶石的生产原理为2A
(2014•晋中模拟)在电解炼铝过程中加入冰晶石(用“A”)代替,可起到降低Al2O3熔点的作用.冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3═2A+3CO2↑+9H2O.根据题意完成下列填空:
(1)冰晶石的化学式为______,含有离子键、______等化学键
(2)生成物中含有10个电子的分子空间构型为______,中心原子的杂化方式为______
(3)反应物中电负性最大的元素为______(填元素符号),写出其原子最外层的电子排布图______
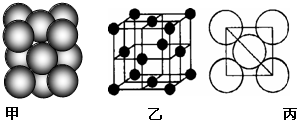
(4)Al单质的晶体中原子堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置的平面图如图丙所示.若已知Al的原子半径为d,NA代表阿伏加德罗常数.Al的相对原子质量为M.则一个晶胞中Al的原子个数为______;Al晶体的密度为M 4
d3NA2 (用字母表示)M 4
d3NA2  爱犹添翼1年前1
爱犹添翼1年前1 -
 weitiger 共回答了16个问题
weitiger 共回答了16个问题 |采纳率93.8%解题思路:(1)冰晶石是六氟合铝酸钠,化学式Na3AlF6;六氟合铝(Ⅲ)酸根离子中含有配位键;
(2)根据方程式可知生成物10电子的物质是水,依据水分子的空间构型解答;
(3)元素非金属性越强电负性越大,依据F最外层电子排布可画出电子排布图;
(4)依据Al单质的晶体中原子堆积方式图解答.(1)冰晶石的化学式为Na3AlF6,Na+与AlF之间为离子键,而AlF是以配位键形成的;
故答案为:Na3AlF6;配位键;
(2)生成物中10电子分子是H2O,氧原子采取sp3杂化,由于氧原子外含有两对孤对电子,故分子结构为V形;
故答案为:V形; sp3;
(3)F是电负性最大的元素,其最外层电子排布图为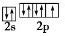 ;
;
故答案为:F; ;
;
(4)铝晶胞的原子处于晶胞顶点和面心,故一个晶胞含有的Al原子数目为6×[1/2]+8×[1/8]=4;设Al晶胞的边长为a,则有:2a2=(4d)2,a=2
2d,Al晶胞的体积为V=16
2d3 ,故Al晶体的密度为
M
4
2d3NA.
故答案为:4;
M
4
2d3NA.点评:
本题考点: 化学键;元素电离能、电负性的含义及应用;判断简单分子或离子的构型;晶胞的计算;原子轨道杂化方式及杂化类型判断.
考点点评: 本题考查了化学键,电负性、分子的空间构型,原子轨道的杂化方式、晶胞的计算,题目综合性强,难度大,看清晶胞的示意图是晶胞计算的解题关键.1年前查看全部
- 2AL2O3==(通电,冰晶石)4Al+3O2↑ 如果加工一个铝锅需要1KG铝,至少需要电解多少千克的氧化铝(AL2O3
2AL2O3==(通电,冰晶石)4Al+3O2↑ 如果加工一个铝锅需要1KG铝,至少需要电解多少千克的氧化铝(AL2O3)
2AL2O3==(通电,冰晶石)4Al+3O2↑ 如果加工一个铝锅需要1KG铝,至少需要电解多少千克的氧化铝(AL2O3)才能制成这个铝锅 xbear5201年前2
xbear5201年前2 -
 想你念你爱你 共回答了24个问题
想你念你爱你 共回答了24个问题 |采纳率95.8%2AL2O3==(通电,冰晶石)4Al+3O2↑
204 108
x 1Kg
x=1.89Kg
至少需要电解1.89千克的氧化铝(AL2O3)才能制成这个铝锅1年前查看全部
- 工业冶炼铝,是将铝土矿加工提纯成为纯净氧化铝进行电解制取铝的:2Al2O3=4Al+3O2,其中冰晶石是助溶剂,使熔点很
工业冶炼铝,是将铝土矿加工提纯成为纯净氧化铝进行电解制取铝的:2Al2O3=4Al+3O2,其中冰晶石是助溶剂,使熔点很高的氧化铝降低熔点.求:理论上制取10吨铝,需消耗多少吨氧化铝?
 vv的心跳1年前1
vv的心跳1年前1 -
 chutianying 共回答了18个问题
chutianying 共回答了18个问题 |采纳率94.4%2Al2O3=4Al+3O2↑
204 108
m(Al2O3) 10t
m(Al2O3)=18.9t1年前查看全部
- 电解氧化铝 冰晶石 的电极反应怎么写
电解氧化铝 冰晶石 的电极反应怎么写
总反应呢?冰晶石的作用呢? bolebo1年前1
bolebo1年前1 -
 123456psl 共回答了19个问题
123456psl 共回答了19个问题 |采纳率100%冰晶石(Cryolite)一种矿物,六氟铝酸钠(Na3AlF6),白色单斜晶系(109摄氏度),微溶于水,能溶于氧化铝,在电解铝工业作助熔剂、制造乳白色玻璃和搪瓷的遮光剂. 冰晶石是一种卤化物矿物,为钠铝氟化物.颜色从无色透明到白色之间,也有淡棕、淡红、砖红色.1年前查看全部
- 在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al 2 O 3 熔点的作用。冰晶石的生产原理为2Al(OH) 3
在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al 2 O 3 熔点的作用。冰晶石的生产原理为2Al(OH) 3 +12HF+3Na 2 CO 3 =2Al+3CO 2 ↑+9H 2 O。根据题意完成下列填空:
(1)冰晶石的化学式为 ,含有离子键、 等化学键。
(2)生成物中含有10个电子的分子是 (写分子式),该分子的空间构型为 ,中心原子的杂化方式为 。
(3)反应物中电负性最大的元素为 (填元素符号),写出其原子最外层的电子排布图: 。
(4)Al单质的晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。
若已知Al的原子半径为d,N A 代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为 ;Al晶体的密度为 (用字母表示)。 乡村老妖1年前1
乡村老妖1年前1 -
 babslhf 共回答了21个问题
babslhf 共回答了21个问题 |采纳率95.2%1年前查看全部
- 在冰晶石(Na3AlF6)晶胞中含有的原子数与食盐晶胞中含有的原子数之比为
在冰晶石(na3alf6)晶胞中含有的原子数与食盐晶胞中含有的原子数之比为
.组成晶体的质点(分子、原子、离子)以确定的位置在空间作有规则排列,具有一定几何形状的空间格子,称为晶格,晶格中***晶体结构特征的最小重复单位称为晶胞.在冰晶石(na3alf6)晶胞中,alf63-占据的位置相当于nacl晶胞中c1-占据的位置,则冰晶石晶胞中含有的原子数与食盐晶胞中含有的原子数之比为
a.2:1 b.3:2 c.5:2 d.5:1
为什么? awood9991年前1
awood9991年前1 -
 胡zz芳 共回答了21个问题
胡zz芳 共回答了21个问题 |采纳率90.5%答案是D?
不是的话叫我一下1年前查看全部
- (2011•常州三模)如图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的1
 (2011•常州三模)如图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心.则下列说法正确的是( )
(2011•常州三模)如图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心.则下列说法正确的是( )
A.冰晶石的名称是六氟合铝(Ⅲ)化钠
B.该物质中存在离子键和共价键
C.大立方体的体心处△代表的是Al3+
D.该物质是电解冶炼铝的还原剂 蛐蛐和蝈蝈1年前1
蛐蛐和蝈蝈1年前1 -
 txf1127 共回答了21个问题
txf1127 共回答了21个问题 |采纳率95.2%解题思路:本题根据常见的钠盐为离子化合物,可以判断有离子键,[AlF6]3- 为六氟合铝(Ⅲ)酸根离子,物质的名称是六氟合铝(Ⅲ)酸钠,晶胞中的均为原子,不是离子,铝离子只有氧化性,没有还原性,为氧化剂.A.Na3AlF6中[AlF6]3-,为六氟合铝(Ⅲ)酸根离子,故冰晶石的名称是六氟合铝(Ⅲ)酸钠,故A错误;
B.六氟合铝(Ⅲ)酸根离子中含有共价键,故该物质中存在离子键和共价键,故B正确;
C.大立方体的体心处△代表的是Na+,故C错误;
D.该物质中铝元素的化合价为+3,已经为最高价,具有氧化性,为氧化剂,故D错误;
故选B.点评:
本题考点: 晶胞的计算.
考点点评: 本题考查了酸根离子的命名及钠盐的命名,钠盐一般为离子化合物,晶胞中的点表示原子,铝离子为氧化剂等知识点.1年前查看全部
- 冶炼铝,把氧化铝加入液态冰晶石中成为熔融体,是一个什么样的反应?
冶炼铝,把氧化铝加入液态冰晶石中成为熔融体,是一个什么样的反应?
冶炼铝,把氧化铝加入液态冰晶石中成为熔融体后电解是什么一回事? gg方便面1年前1
gg方便面1年前1 -
 爱我是你的事 共回答了17个问题
爱我是你的事 共回答了17个问题 |采纳率94.1%把电流通到熔融的金属盐中,可以使金属的离子在阴极上沉积下来,从而使金属离子分离出来.因为氧化铝的熔点很高(2050℃),必须物色一种能够溶解氧化铝而又能降低其熔点的材料,偶然发现了冰晶石(Na3AlF6).冰晶石一氧化铝熔盐的熔点仅在930℃~1000℃之间,冰晶石在电解温度下不被分解,并有足够的流动性.这样就有利于电解的进行.
用碳作坩埚衬里,又将碳作为阴极,防止电流使坩埚中的二氧化硅分解游离出硅.1年前查看全部
- 铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得.
铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得.
①铝土矿的主要成分是Al2O3和SiO3等.从铝土矿中提炼Al2O3的流程如下: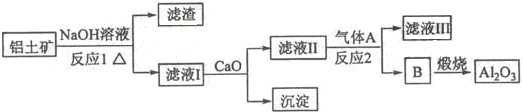
②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下: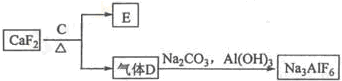
回答下列问题;
(1)写出反应l的化学方程式______
(2)滤液,I中加入Ca0生成的沉淀是______,反应2的离子方程式为______.
(3)电解制铝的化学方程式是2Al2O3(熔融)
4Al+3O2↑通电 .冰晶石 2Al2O3(熔融)
4Al+3O2↑通电 .冰晶石
(4)C为浓硫酸,则气体D是______,写出由D制备冰晶石的化学方程式:______. 我不是WUZI1年前1
我不是WUZI1年前1 -
 怎么说爱 共回答了13个问题
怎么说爱 共回答了13个问题 |采纳率92.3%解题思路:①铝土矿的主要成分是Al2O3和SiO2等,加入氢氧化钠溶液氧化铝溶解,过滤得到滤液偏铝酸钠溶液,二氧化硅溶解生成硅酸钠溶液,加入氧化钙生成氢氧化钙,和硅酸钠反应生成硅酸钙沉淀,过滤得到偏铝酸钠溶液,通入过量二氧化碳得到氢氧化铝沉淀煅烧得到氧化铝;
②氟化钙和浓硫酸加热反应生成氟化氢气体和硫酸钙,氟化氢和碳酸钠、氢氧化铝反应生成冰晶石六氟合铝酸钠;
(1)二氧化硅与氢氧化钠反应生成硅酸钠与水;氧化铝与氢氧化钠反应生成偏铝酸钠与水;
(2)滤液Ⅰ中含有硅酸钠、偏铝酸钠,加入CaO,生成氢氧化钙,氢氧化钙与硅酸钠反应生成硅酸钙沉淀;
由工艺流程可知,B为氢氧化铝,故气体A为二氧化碳,滤液Ⅱ主要是偏铝酸钠,偏铝酸钠溶液通入二氧化碳,生成氢氧化铝与碳酸钠;
(3)由工艺流程可知,气体D含有F元素,应是HF,故C为浓硫酸;根据元素守恒,可知HF与碳酸钠、氢氧化铝反应生成冰晶石,同时生成二氧化碳、水;
(4)电解熔融的氧化铝生成铝与氧气;阳极生成氧气,部分氧气可以石墨反应生成二氧化碳、CO.(1)二氧化硅与氢氧化钠反应生成硅酸钠与水,反应方程式为:2NaOH+SiO2=Na2SiO3+H2O,氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应方程式为:2NaOH+Al2O3=2NaAlO2+H2O,
故答案为:2NaOH+SiO2=Na2SiO3+H2O、2NaOH+Al2O3=2NaAlO2+H2O;
(2)滤液Ⅰ中含有硅酸钠、偏铝酸钠,加入CaO,生成氢氧化钙,氢氧化钙与硅酸钠反应生成硅酸钙沉淀;由工艺流程可知,B为氢氧化铝,故气体A为二氧化碳,滤液Ⅱ主要是偏铝酸钠,偏铝酸钠溶液通入二氧化碳,生成氢氧化铝与碳酸钠,反应方程式为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,
故答案为:CaSiO3;2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-;
(3)电解熔融的氧化铝生成铝与氧气,反应方程式为:2Al2O3(熔融)
通电
.
冰晶石4Al+3O2↑;故答案为:2Al2O3(熔融)
通电
.
冰晶石4Al+3O2↑;
(4)由工艺流程可知,气体D含有F元素,应是HF,故C为浓硫酸;根据元素守恒,可知HF与碳酸钠、氢氧化铝反应生成冰晶石,同时生成二氧化碳、水,反应方程式为:12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O,
故答案为:HF;12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查化学工艺流程、无机物推断、常用化学用语等,题目难度中等,理解工艺流程是解题的关键,(4)中HF的制备是中学中比较陌生的知识,现在基本不涉及,是难点、易错点,需要学生基本扎实的据此与运用知识分析解决问题的能力.1年前查看全部
- 电解氧化铝用的冰晶石,即六氟合铝酸钠,能溶于水吗?为什么?
 多愁善感的小娟1年前1
多愁善感的小娟1年前1 -
 cjwnj 共回答了14个问题
cjwnj 共回答了14个问题 |采纳率100%微溶于水,水溶液呈酸性.1年前查看全部
- 电解的Al2O3和冰晶石Na3AIF6在950°C时生产出Al,通过24小时电解16100安培的电流的混合物,会得到多少
电解的Al2O3和冰晶石Na3AIF6在950°C时生产出Al,通过24小时电解16100安培的电流的混合物,会得到多少千克的Al?
 看护草原的狼1年前1
看护草原的狼1年前1 -
 uu天使 共回答了14个问题
uu天使 共回答了14个问题 |采纳率100%2Al2O3===4Al+3O2↑ 转移电子(条件:电解)
108g 12个
m(Al) 24h×3600s/h×16100A÷(1.60×10^-19C)
解得:
m(Al) =7.8246×10^28g=7.8246×10^25kg
注:你提供的电流是不是有错误!1年前查看全部
- 冰晶石(化学式为Na3AlF6)的结构单元如右图所示,已知冰晶石熔融时电离方程式为Na3AlF6 =3Na+ + AlF
冰晶石(化学式为Na3AlF6)的结构单元如右图所示,已知冰晶石熔融时电离方程式为Na3AlF6 =3Na+ + AlF6
④在晶体结构中○的数目:棱中点取其,体心点取其1,则○共有:12×+8×1=12.这个不是应该等于11么 怎么算的 柳大山1年前1
柳大山1年前1 -
 不想告诉你太多 共回答了18个问题
不想告诉你太多 共回答了18个问题 |采纳率77.8%1从电离方程式看出,Al元素和F元素均以整体的形式出现.
2从晶体结构看,由于阴、阳一定是交替结构,所以,一定是阳离子.
3在晶体结构中○的数目:棱中点取其,体心点取其1,则○共有:12×+8×1=12.1年前查看全部
- (2014•四川模拟)在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用.冰晶石的生产原理为2A
(2014•四川模拟)在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用.冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3═2A+3CO2↑+9H2O.根据题意完成下列填空:
(1)冰晶石的化学式为______,含有离子键、______等化学键.
(2)生成物中含有10个电子的分子是______(写分子式),该分子的空间构型为______,中心原子的杂化方式为______.
(3)反应物中电负性最大的元素为______(填元素符号),写出其原子最外层的电子排布图______.
(4)冰晶石由两种微粒构成,冰晶石的晶胞结构如图甲所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是______(填微粒符号).
(5)Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示: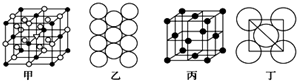
若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为______个; Al晶体的密度为M 4
d3NA2 (用字母表示).M 4
d3NA2  蛤蟆口1年前1
蛤蟆口1年前1 -
 谷春晖 共回答了20个问题
谷春晖 共回答了20个问题 |采纳率95%解题思路:(1)冰晶石的成分是Na3AlF6,该物质中含有离子键和配位键;
(2)H2O中含有10个电子,根据价层电子对互斥理论确定水分子构型和O原子杂化方式;
(3)元素的非金属性越强,其电负性越强;F原子核外最外层上s、p能级,s、p能级上电子分别是2、5;
(4)利用均摊法确定其化学式,再根据化学式中离子判断该微粒;
(5)利用均摊法计算Al原子个数,该晶胞棱长=
=2(4d)2 2
d,所以晶胞的体积=(22
d)3,2
根据ρ=[m/V]计算晶胞密度.(1)冰晶石的成分是Na3AlF6,该物质中Na+和AlF6-之间存在离子键,Al原子和F原子之间存在配位键,故答案为:Na3AlF6;离子键和配位键;
(2)H2O中含有10个电子,水分子中含有2个共价单键和2个孤电子对,所以其空间构型为V形,O原子采用杂化,故答案为:H2O;V形;sp3;
(3)元素的非金属性越强,其电负性越强,所以电负性最强的是F元素;F原子核外最外层上s、p能级,s、p能级上电子分别是2、5,其最外层轨道表示式为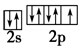 ,故答案为:F;
,故答案为:F; ;
;
(4)●的个数=8×
1
8+6×
1
2=4,○个数=12×[1/4]+8=11,要使两种离子的个数之比为1:3,则大立方体的体心处所代表的微粒是Na+,故答案为:Na+;
(5)该晶胞中Al原子个数=8×
1
8+6×
1
2=4,该晶胞棱长=
(4d)2
2=2
2d,所以晶胞的体积=(2
2d)3,
ρ=[m/V]=
M
NA×4
(2
2d)3=
M
4点评:
本题考点: 晶胞的计算;离子化合物的结构特征与性质;判断简单分子或离子的构型;原子轨道杂化方式及杂化类型判断.
考点点评: 本题涉及晶胞的计算、化学键的判断、原子杂化方式等知识点,利用均摊法、价层电子对互斥理论等知识点来分析解答,难点是晶胞的计算,注意(5)中棱长不是Al原子直径,为易错点.1年前查看全部
- Na3AlF6,也就是冰晶石的成分,是叫六氟铝酸钠还是六氟铝三钠?
Na3AlF6,也就是冰晶石的成分,是叫六氟铝酸钠还是六氟铝三钠?
老师的普通话不标准. wangyaopin1年前1
wangyaopin1年前1 -
 WMWXY2007 共回答了22个问题
WMWXY2007 共回答了22个问题 |采纳率90.9%正确的命名方法是:六氟合铝酸钠.也可以叫“六氟铝酸钠”.
一般没有叫“六氟铝三钠”的.因为这是一种盐,应该是“×酸×”1年前查看全部
- (2011•上海)工业上制取冰晶石(Na3AlF6)的化学方程式如下:2Al(OH)3+12HF+3Na2CO3=2Na
(2011•上海)工业上制取冰晶石(Na3AlF6)的化学方程式如下:2Al(OH)3+12HF+3Na2CO3=2Na3AlF6+3CO2↑+9H2O
根据题意完成下列填空:
(1)在上述反应的反应物和生成物中,属于非极性分子的电子式______,属于弱酸的电离方程式______.
(2)反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属性强弱的是______(选填编号).
a.气态氢化物的稳定性b.最高价氧化物对应水化物的酸性
c.单质与氢气反应的难易d.单质与同浓度酸发生反应的快慢
(3)反应物中某些元素处于同一周期.它们最高价氧化物对应的水化物之间发生反应的离子方程式为______.
(4)Na2CO3俗称纯碱,属于______晶体.工业上制取纯碱的原料是______. uu突醒1年前0
uu突醒1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 冰晶石是什么?
 kouaihui1年前3
kouaihui1年前3 -
 为何有雨 共回答了20个问题
为何有雨 共回答了20个问题 |采纳率95%冰晶石一种矿物,六氟铝酸钠(Na3AlF6),白色单斜晶系(109摄氏度),微溶于水,熔融的冰晶石能溶解氧化铝,在电解铝工业作助熔剂、制造乳白色玻璃和搪瓷的遮光剂.1年前查看全部
- 晶体中的相关计算1.12g石墨中含有碳碳键的个数为多少NA?2.在冰晶石(Na3AlF6)晶胞中,AlF6离子占据的位置
晶体中的相关计算
1.12g石墨中含有碳碳键的个数为多少NA?
2.在冰晶石(Na3AlF6)晶胞中,AlF6离子占据的位置相当于NaCl晶胞中Cl离子占据的位置,则冰晶石晶胞中含有的原子数与食盐晶胞中含有的原子数之比为多少?
(希望有比较详细的文字叙述)
第一题是1.5NA,我已经知道原因了,但是第二题的答案应该是3:2,可我不知道为什么. 爱恋春光1年前3
爱恋春光1年前3 -
 yilang211 共回答了17个问题
yilang211 共回答了17个问题 |采纳率88.2%1、石墨中每个碳原子以3个共价键和周围碳原子结合,考虑到边沿的忽略不计和电子对的共用,12克即1摩尔石墨含碳碳键为1.5N(阿伏伽德罗常数)个;
2、氯化钠晶胞含8个原子.冰晶石结构与此相当,AlF6 3-离子占据的位置相当于NaCl晶胞中Cl离子占据的位置,即每个晶胞含有四个AlF6^-3离子,而且还含有3x4=12个钠离子,所以一共含40个原子.这样,冰晶石晶胞中含有的原子数与食盐晶胞中含有的原子数之比为40:8=5:1.1年前查看全部
- 冰晶石的化学性质冰晶石在高温下分解成什么,具体反应方程式是什么有什么化学性质,能不能被碳还原.二氧化硅和碳还有冰晶石在一
冰晶石的化学性质
冰晶石在高温下分解成什么,具体反应方程式是什么
有什么化学性质,能不能被碳还原.
二氧化硅和碳还有冰晶石在一块怎么反应 liaolabc1年前4
liaolabc1年前4 -
 男人海洋119 共回答了22个问题
男人海洋119 共回答了22个问题 |采纳率86.4%太不容易了,这么多分的有这么细,又不像汉字那样好发,给的分有那么低,哎,不容易啊 !
一 、物质与氧气的反应:
(1)单质与氧气的反应:
1. 镁在空气中燃烧:2Mg + O2 点燃 2MgO
2. 铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O4
3. 铜在空气中受热:2Cu + O2 加热 2CuO
4. 铝在空气中燃烧:4Al + 3O2 点燃 2Al2O3
5. 氢气中空气中燃烧:2H2 + O2 点燃 2H2O
6. 红磷在空气中燃烧:4P + 5O2 点燃 2P2O5
7. 硫粉在空气中燃烧: S + O2 点燃 SO2
8. 碳在氧气中充分燃烧:C + O2 点燃 CO2
9. 碳在氧气中不充分燃烧:2C + O2 点燃 2CO
(2)化合物与氧气的反应:
10. 一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO2
11. 甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O
12. 酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O
13. 葡萄糖缓慢氧化:C6H12O6+6O2点燃6CO2 + 6H2O
二.几个分解反应:
14. 水在直流电的作用下分2H2O 通电 2H2↑+ O2 ↑
15. 加热碱式碳酸铜:Cu2(OH)2CO3 加热 2CuO + H2O + CO2↑
16. 利用过氧化氢和二氧化锰的混合物制氧气
MnO2
2 H2O2 = 2H2O+ O2 ↑
17. 加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 + O2↑
18. 碳酸不稳定而分H2CO3 = H2O + CO2↑
19. 高温煅烧石灰石:CaCO3 高温 CaO + CO2↑
20. 加热碳酸氢铵:NH4HNO3加热H2O + CO2↑+NH3↑
三.几个氧化还原反应:
21. 氢气还原氧化铜:H2 + CuO 加热 Cu + H2O
22. 木炭还原氧化铜:C+ 2CuO 高温 2Cu + CO2↑
23. 焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe + 3CO2↑
24. 焦炭还原四氧化三铁:2C+ Fe3O4 高温 3Fe + 2CO2↑
25. 一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO2
26. 一氧化碳还原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO2
27. 一氧化碳还原四氧化三铁:4CO+ Fe3O4 高温 3Fe + 4CO2
四.单质、氧化物、酸、碱、盐的相互关系
(1)金属单质 + 酸 -------- 盐 + 氢气 (置换反应)
28. 锌和稀硫酸反应:Zn + H2SO4 === ZnSO4 + H2↑
29. 铁和稀硫酸反应:Fe + H2SO4 === FeSO4 + H2↑
30. 镁和稀硫酸反应:Mg + H2SO4 === MgSO4 + H2↑
31. 铝和稀硫酸反应:2Al + 3H2SO4 === Al2(SO4)3 + 3H2↑
32. 锌和稀盐酸反应:Zn + 2HCl === ZnCl2 + H2↑
33. 铁和稀盐酸反应:Fe + 2HCl === FeCl2 + H2↑
34. 镁和稀盐酸反应:Mg+ 2HCl === MgCl2 + H2↑
35. 铝和稀盐酸反应:2Al + 6HCl === 2AlCl3 + 3H2↑
(2)金属单质 + 盐(溶液) ---另一种金属 + 另一种盐
36. 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu
37. 锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu
38. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg
(3)碱性氧化物 +酸 -------- 盐 + 水
39. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O
40. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O
41. 氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O
42. 氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O
43. 氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O
44. 氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O
(4)酸性氧化物 +碱 -------- 盐 + 水
43.苛性钠暴露在空气中变质:2NaOH + CO2 = Na2CO3 + H2O
44.苛性钠吸收二氧化硫气体:2NaOH + SO2 = Na2SO3 + H2O
45.苛性钠吸收三氧化硫气体:2NaOH + SO3 = Na2SO4 + H2O
46.消石灰放在空气中变质:Ca(OH)2 + CO2 == CaCO3 ↓+ H2O
47. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 == CaSO3 ↓+ H2O
(5)酸 + 碱 -------- 盐 + 水
48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O
49. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O
50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 == CuCl2 + 2H2O
51. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 = CaCl2 + 2H2O
52. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 = FeCl3 + 3H2O
53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 = AlCl3 + 3H2O
54.硫酸和烧碱反应:H2SO4 + 2NaOH = Na2SO4 + 2H2O
55.硫酸和氢氧化钾反应:H2SO4 + 2KOH = K2SO4 + 2H2O
56.硫酸和氢氧化铜:H2SO4 + Cu(OH)2 = CuSO4 + 2H2O
57. 硫酸和氢氧化铁:3H2SO4 + 2Fe(OH)3= Fe2(SO4)3 + 6H2O
58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O
59.氨水和硫酸反应:2NH3·H2O+H2SO4==(NH4)2SO4+2H2O
(6)酸 + 盐 -------- 另一种酸 + 另一种盐
59.大理石与稀盐酸:CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
60.(灭火器原理): Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
61.碳酸镁与稀盐酸: MgCO3 + 2HCl = MgCl2 + H2O + CO2↑
62.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓ + HNO3
63.硫酸和碳酸钠:Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑
64.硫酸和氯化钡溶液:H2SO4 + BaCl2 = BaSO4 ↓+ 2HCl
(7)碱 + 盐 -------- 另一种碱 + 另一种盐
65氢氧化钠与硫酸铜:2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4
66氢氧化钠与氯化铁:3NaOH + FeCl3 = Fe(OH)3↓ + 3NaCl
67.氢氧化钠与氯化镁:2NaOH + MgCl2 = Mg(OH)2↓ + 2NaCl
68. 氢氧化钠与氯化铜:2NaOH + CuCl2 = Cu(OH)2↓ + 2NaCl
69. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 = CaCO3↓+ 2NaOH
(8)盐 + 盐 ----- 两种新盐
70.氯化钠和硝酸银:NaCl + AgNO3 = AgCl↓ + NaNO3
71.硫酸钠和氯化钡:Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
五.其它反应:
72.二氧化碳溶解于水:CO2 + H2O === H2CO3
73.生石灰溶于水:CaO + H2O === Ca(OH)2
74.氧化钠溶于水:Na2O + H2O ==== 2NaOH
75.三氧化硫溶于水:SO3 + H2O ==== H2SO4
76. 硫酸铜晶体受热分CuSO4·5H2O 加热 CuSO4 + 5H2O
77.无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4·5H2O
78.光合作用:6CO2 + 6H2O光照C6H12O6+6O21年前查看全部
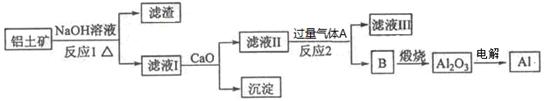
- 铝是一种应用广泛的金属,工业上用Al 2 O 3 和冰晶石(Na 3 AlF 6 )混合熔融电解制得。铝土矿的主要成分是
铝是一种应用广泛的金属,工业上用Al 2 O 3 和冰晶石(Na 3 AlF 6 )混合熔融电解制得。铝土矿的主要成分是Al 2 O 3 ,含有杂质SiO 2 、Fe 2 O 3 、MgO。工业上从铝土矿中提炼Al 2 O 3 并制取铝的流程如下:
请回答下列问题:
(1)铝与NaOH溶液反应的离子方程式为 。
(2)图中涉及分离溶液与沉淀的玻璃仪器有烧杯、玻璃棒、_________。
(3)反应1涉及的化学方程式有 、 。滤液Ⅰ中加入CaO生成的沉淀是 _ (填化学式)。
(4)向滤液Ⅱ中通入气体A为 ,生成沉淀B的离子方程式为 。 cao2nima1年前1
cao2nima1年前1 -
 恋蓝日记 共回答了16个问题
恋蓝日记 共回答了16个问题 |采纳率93.8%(1)2Al+2H 2 O+2OH-=2AlO 2 -+3H 2 ↑ (2)漏斗
(3)Al 2 O 3 +2NaOH=2NaAlO 2 +H 2 O SiO 2 +2NaOH=Na 2 SiO 3 +H 2 O CaSiO 3
(4)CO 2 AlO 2 — +2H 2 O+CO 2 =Al(OH) 3 ↓+HCO 3 —
1年前查看全部
- 工业上以Al2O3和冰晶石Na3AlF6为原料化学方程式
工业上以Al2O3和冰晶石Na3AlF6为原料化学方程式
在通电条件下电解熔融氧化铝制取金属铝 liangzhi1111年前1
liangzhi1111年前1 -
 gugong0727 共回答了16个问题
gugong0727 共回答了16个问题 |采纳率75%2Al2O3=4Al+3O2 条件电解加冰晶石.1年前查看全部
- 冰晶石的结构是什么样的啊题目的叙述:冰晶石的晶胞是以大阴离子AlF6^3-构成的面心立方晶格,Na^+可以看作是填充在晶
冰晶石的结构是什么样的啊
题目的叙述:
冰晶石的晶胞是以大阴离子AlF6^3-构成的面心立方晶格,Na^+可以看作是填充在晶格的空隙中.已知密度2.95g/cm^3,Al-F键长181pm
计算Al-Al最短距离.答案551pm
我看过题以后搞不懂结构到底是什么样的,题中说Na在八面体空隙和四面体空隙,晶胞内含4个[Na3AlF6]单元,我想问Al、F都处在晶胞什么位置呢? 早起晚睡的猫1年前1
早起晚睡的猫1年前1 -
 ff儿都是冷个的 共回答了22个问题
ff儿都是冷个的 共回答了22个问题 |采纳率100%(把阴离子AlF6^3-看成是一个“球”.AlF6^3-是面心立方晶格的晶格点.)
V=m/d=4x210/(2.95x6.022x10^23)=47.28x10^-23 cm^3 = 47.28x10^7 pm^3
晶格参数:a=7.79x10^2 pm
面心对角线长= 1101.67 pm = 2(Al-Al)
(因为,阴离子AlF6^3-“球”只有在这个方向上有接触)
所以,(Al-Al)=1101.67/2=550.8 =551 pm1年前查看全部
- 炼铝时,把氧化铝加入液态冰晶石中,成为熔融体后电解.原理是什么,为什么对了?
 zwpost1年前1
zwpost1年前1 -
 悠悠啥 共回答了12个问题
悠悠啥 共回答了12个问题 |采纳率66.7%混合物的熔点降低,并且冰晶石在氧化铝电解的时候不会被电解1年前查看全部
- 铝是一种应用广泛的金属,工业上用Al 2 O 3 和冰晶石(Na 3 AlF 6 )混合熔融电解制得。
铝是一种应用广泛的金属,工业上用Al 2 O 3 和冰晶石(Na 3 AlF 6 )混合熔融电解制得。
①铝土矿的主要成分是Al 2 O 3 和SiO 2 等。从铝土矿中提炼Al 2 O 3 的流程如下: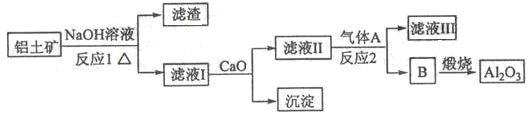
②以萤石(CaF 2 )和纯碱为原料制备冰晶石的流程如下:
回答下列问题:
(1)写出反应1的化学方程式 ;
(2)滤液Ⅰ中加入CaO生成的沉淀是 ,反应2的离子方程式为 ;
(3)E可作为建筑材料,化合物C是 ,写出由D制备冰晶石的化学方程式 ;
(4)电解制铝的化学方程式是 ,以石墨为电极,阳极产生的混合气体的成分是 。 电光幻影0071年前1
电光幻影0071年前1 -
 ym_bluetear 共回答了10个问题
ym_bluetear 共回答了10个问题 |采纳率90%1年前查看全部
- 一道电解的化学题工业使用冰晶石电解三氧化二铝,以石墨作做阴阳极,Al2O3和冰晶石的熔融混合物作电解液,由于阳极生成的氧
一道电解的化学题
工业使用冰晶石电解三氧化二铝,以石墨作做阴阳极,Al2O3和冰晶石的熔融混合物作电解液,由于阳极生成的氧气全部与石墨电极反应生成CO和CO2气体,因此在电解过程中,碳电极需要不断补充
电极反应为:
阳极 4Al3++12e-==4Al
阴极 6O2-==3O2+12e-
问工业生产中,生产1吨铝阳极损失0.6吨的石墨.石墨被氧化的产物是什么?质量为多少?
请分析下过程 最爱布老虎1年前1
最爱布老虎1年前1 -
 徐怀若谷 共回答了24个问题
徐怀若谷 共回答了24个问题 |采纳率87.5%本题可以用得失电子守恒来解.
首先观察反应,第一步Al3+得到电子,O2-失去电子,其实就是在Al2O3内部发生氧化还原反应, 第二步,产生的O2又氧化石墨,可见,第二步中O2又转变为O2-,这样一来,整一个反应可以视为Al3+氧化C,
接下来列式:
石墨被氧化的产物可能为CO或CO2,因此设产生CO的部分C为xmol;产生CO2的为ymol
(Al)=(10^6/27),电子转移就是10^6/27)×3mol
2x+4y=(10^6/27)×3
12(x+y)=6×10^5
解得 x=(4×10^5)/9 y=(5×10^4)/9
因此,氧化产物为CO和CO2,
m(CO)=1.244t m(CO2)=0.244t1年前查看全部
- 为何氧化铝(Al2O3)中添加冰晶石(Na3AlF6)后其熔点温度会降低?
为何氧化铝(Al2O3)中添加冰晶石(Na3AlF6)后其熔点温度会降低?
从微观将原因讲清楚点,
可以从冰晶石(Na3AlF6)的微观结构上讲下为何它有这些特性吗,谢啦各路大虾 . lihuaqiye1年前1
lihuaqiye1年前1 -
 junho 共回答了17个问题
junho 共回答了17个问题 |采纳率82.4%把电流通到熔融的金属盐中,可以使金属的离子在阴极上沉积下来,从而使金属离子分离出来.因为氧化铝的熔点很高(2050℃),必须物色一种能够溶解氧化铝而又能降低其熔点的材料,偶然发现了冰晶石(Na3AlF6).冰晶石一氧化铝熔盐的熔点仅在930℃~1000℃之间,冰晶石在电解温度下不被分解,并有足够的流动性.这样就有利于电解的进行.
用碳作坩埚衬里,又将碳作为阴极,防止电流使坩埚中的二氧化硅分解游离出硅
氟化钠是离子化合物,电力产生氟离子,由于氟离子电负性大,所以在电解时氧优先于氟被氧化,所以反应是不会有F2生成;同理,由于铝优先于钠被还原,所以也无钠生成.注意:氧化铝是离子晶体,氟离子极大的电负性减弱了氧化铝中的离子键,所以熔点降低
够明白了吧,熔点与构成物质的微粒间的作用力成正比,既然熔点改变,那么肯定是微粒间作用力受外来微粒作用,找到这个外来微粒自然明白了
好累,但愿你理解,上帝保佑,阿门!1年前查看全部
- 铝热反应加冰晶石的作用
 童眼颜vv1年前3
童眼颜vv1年前3 -
 dclq 共回答了19个问题
dclq 共回答了19个问题 |采纳率100%助熔剂
就像食盐溶于水是一个道理,冰晶石是溶剂,而氧化铝是溶质.氧化铝的的电解不是是真正意义上的“熔融电解”,其实,熔融的是冰晶石,氧化铝只是分散质,分散于液态的冰晶石中而已,熔液中的阴离子是复杂的原子团,并非简单氧离子.1年前查看全部
- 冰晶石的化学式Na3ALF3 其中氟元素的化合价为?
 lakebogg1年前2
lakebogg1年前2 -
 caogen_caogen 共回答了14个问题
caogen_caogen 共回答了14个问题 |采纳率71.4%亲,冰晶石的化学式是Na3AlF6诶
记住在化合物中F的价态永远都是-1价,没有特例1年前查看全部
- 通过电解铝反应来制取铝 制取1吨纯铝需要多少冰晶石?
通过电解铝反应来制取铝 制取1吨纯铝需要多少冰晶石?
主要的反应 反应方程式是什么?还有计算过程 甲零1年前3
甲零1年前3 -
 zhugy99 共回答了13个问题
zhugy99 共回答了13个问题 |采纳率92.3%每生产一吨电解铝约消耗冰晶石11.2公斤(kg)1年前查看全部
- 为何氧化铝中添加冰晶石后其熔点温度会降低?
 清翼1年前1
清翼1年前1 -
 木子李和陈 共回答了17个问题
木子李和陈 共回答了17个问题 |采纳率88.2%冰晶石作溶剂,将氧化铝溶解,然后电解Na+、\[AlF6\]3-夹杂在Al2O3晶体中减弱了Al3+、O2-之间的离子键强度1年前查看全部
- 请问电解铝过程中使用哪些氟盐?(除冰晶石)
请问电解铝过程中使用哪些氟盐?(除冰晶石)
请问电解铝用到哪些氟盐(除冰晶石)? lihailian1年前2
lihailian1年前2 -
 jhadfui 共回答了14个问题
jhadfui 共回答了14个问题 |采纳率92.9%还有氟化钠1年前查看全部
- 与氧化铝混合能降低其熔点的冰晶石的化学成份是什么?反应原理是什么?
 你是够1年前1
你是够1年前1 -
 lostamy 共回答了16个问题
lostamy 共回答了16个问题 |采纳率93.8%冰晶石Na3AlF6,它的熔点较低,在一千度左右,氧化铝在两千左右.熔融状态的冰晶石会有F-离子产生,它的电负性很大,倾向于吸收电子,会改变氧化铝晶体内部的静电吸引,使他们的离子结合变弱.离子型化合物的熔点是和正负离子的静电吸引密切相关的,吸引力越强,晶体堆积越密集,熔点越高,当静电吸引变弱时,熔点也就相应变低了.1年前查看全部
- 冰晶石为什么可以降低氧化铝的熔点?
 日夜日夜夜日夜日1年前3
日夜日夜夜日夜日1年前3 -
 mancychen 共回答了24个问题
mancychen 共回答了24个问题 |采纳率100%冰晶石(Cryolite)一种矿物,六氟铝酸钠(Na3AlF6),白色单斜晶系(109摄氏度),微溶于水,熔融的冰晶石能溶解氧化铝,在电解铝工业作助熔剂、制造乳白色玻璃和搪瓷的遮光剂.1年前查看全部
- 在高中化学的某一个实验中用到了冰晶石,是什么实验,并说明其作用
 Johnmi1年前4
Johnmi1年前4 -
 997512 共回答了13个问题
997512 共回答了13个问题 |采纳率100%炼铝的反应,作用是降低氧化铝的熔点
因为氯化铝是共价化合物,没法电解1年前查看全部
- 电解冰晶石和AL2O3的熔融混合物,其中冰晶石的作用是什么?
 mic747eal1年前1
mic747eal1年前1 -
 fengzi2000877 共回答了23个问题
fengzi2000877 共回答了23个问题 |采纳率91.3%冰晶石:Na3AlF6
做电解AL2O3时的助熔剂,降低能源消耗.1年前查看全部
- 熔点降低原理 化学竞赛高中化学竞赛中讲到熔点降低原理,比如电解时加入冰晶石(六氟合铝酸钠)以及电解绿化锂时加入氯化钾等,
熔点降低原理 化学竞赛
高中化学竞赛中讲到熔点降低原理,比如电解时加入冰晶石(六氟合铝酸钠)以及电解绿化锂时加入氯化钾等,具体原理是什么?
希望详尽的回答,好的追加分,谢谢!
溶剂的液态化学势与蒸气压成正比关系吗?如果成此关系的话,蒸气压又与温度成正比,那么要重新达到平衡应该升高温度才对呀,为什么反而降低了呢? 年归1年前3
年归1年前3 -
 slren 共回答了14个问题
slren 共回答了14个问题 |采纳率92.9%在纯物质的正常凝固点(熔点)温度下,固液两相平衡共存,纯物质在两相的化学势相等.而对于溶液而言,若溶质只溶解于液态溶剂而不溶解与固态溶剂时,少量溶质的存在使溶液的蒸汽压降低,且使溶液中溶剂的化学势小于固态纯溶剂的化学势,固态纯溶剂因此熔融进入溶液中,从而改变溶液的浓度.同时固态溶剂熔融时吸热,使体系的温度下降,直至某一温度时,固态纯溶剂与溶液才达到两相平衡.这个平衡温度称为溶液的凝固点,显然它低于纯溶剂的正常凝固点.
这是从化学势的角度来解释凝固点(熔点)的降低,不知道你能不能理解.1年前查看全部
- 铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得.铝土矿的主要成分是
铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得.铝土矿的主要成分是
Al2O3和SiO2等.从铝土矿中提炼Al2O3的流程如下: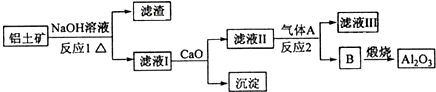
已知:CaO+Na2SiO3+H2O→CaSiO3↓+2NaOH
完成下列填空:
(1)写出流程中反应1的化学方程式______,
(2)流程中反应2的离子方程式为______. 4576246851年前1
4576246851年前1 -
 yunyunly 共回答了14个问题
yunyunly 共回答了14个问题 |采纳率78.6%解题思路:(1)铝土矿的主要成分是Al2O3和SiO2等,与NaOH反应分别为:Al2O3+2NaOH=2NaAlO2+H2O;SiO2+2NaOH=Na2SiO3+H2O;
(2)反应1的滤液中含有NaAlO2和Na2SiO3加入CaO,Na2SiO3变为CaSiO3沉淀,故滤液Ⅱ中的溶质为NaAlO2,通入A生成B,B煅烧生成Al2O3,故B为Al(OH)3,气体A应该为CO2,发生反应为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.(1)铝土矿的主要成分是Al2O3和SiO2等,与NaOH反应:Al2O3+2NaOH=2NaAlO2+H2O;SiO2+2NaOH=Na2SiO3+H2O;
故答案为:Al2O3+2NaOH=2NaAlO2+H2O;SiO2+2NaOH=Na2SiO3+H2O;
(2)反应1的滤液中含有NaAlO2和Na2SiO3加入CaO,Na2SiO3变为CaSiO3沉淀,故滤液Ⅱ中的溶质为NaAlO2,通入A生成B,B煅烧生成Al2O3,故B为Al(OH)3,反应Ⅱ为:NaAlO2生成Al(OH)3的反应,故气体A应该为CO2,发生反应为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-;
故答案为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.点评:
本题考点: 镁、铝的重要化合物.
考点点评: 本题考查化学工艺流程、无机物推断等,化合物的性质是解题的关键.1年前查看全部
- 为何冰晶石可以使高熔点的Al2O3熔融并电解?
为何冰晶石可以使高熔点的Al2O3熔融并电解?
冰晶石不是在高温时易分解吗? 因帅被判8天1年前1
因帅被判8天1年前1 -
 superwonan 共回答了25个问题
superwonan 共回答了25个问题 |采纳率92%他是降低Al2O3的熔点,Al2O3的熔点很高,为了在工业生产中节约成本,才加冰晶石,冰晶石在高温下是易分解,但分解时的温度比冰晶石和Al2O3的混合物的熔点高,电解时形成阳极泥沉淀1年前查看全部
- 冶炼铝时,冰晶石起什么作用?
 wangweis471年前1
wangweis471年前1 -
 天陨星 共回答了27个问题
天陨星 共回答了27个问题 |采纳率81.5%三氧化二铝熔点很高,用冰晶石作助熔剂1年前查看全部
大家在问
- 1今年大象和小象年龄和是55岁,若干年以前,当大象的只有小象现在这么大时,小象年龄恰好是大象年龄的一半.
- 2用exciting、busy、difficult、dangerous、fun、boring这6个形容词作12个句子,每个
- 3三角形的三边长为a,b,c,且 3(a²+b²+c²)=(a+b+c)² 问这个
- 4一个瓶子能正好装满150ml水,那么150ml既是瓶子的()又是水的()
- 5what is wrong with you 的中文意思
- 6读了人和大佛这篇短文,你想到了哪些相关的谚语
- 7一定温度下,向amol/lNaOH溶液中通入足量的二氧化碳,为什么加热反应后的溶液,pH会升高?
- 8解方程x-12分之2x+1=1-4分之3x-2
- 9一道初中物理题一光源发出的一束光从地面上竖直向上投射到和它垂直的平面镜上,平面镜与地面距离为3m,如果把平面镜绕水平轴转
- 10黄土高原出现严重水土流失的原因?
- 11仿写句子 少年是朝阳,是晨露,是美好的春天.______是______________
- 12---Don't forget to lock the door!的回答
- 13奥运五环,每个外圆的半径都是8厘米,每个内圆的半径都是6厘米,两圆每个相交处的面积大约是4平方厘米,这个图形的面积是多少
- 14《夜书所见》和《九月九日忆山东兄弟》都是什么季的情景
- 15有100个球 一次最多拿5个 最少拿一个小A先拿 小B后拿 谁能拿到最后一个就赢