还原性铁粉的用途?
 水可流2022-10-04 11:39:541条回答
水可流2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 limi80 共回答了26个问题
limi80 共回答了26个问题 |采纳率96.2%- 做 还原剂
可以用来做防止油脂变质的保鲜剂
做3价铁还原成2价铁的原料
保存FeCl2时加入还原性铁粉保质 - 1年前
相关推荐
- 还原性铁粉在潮湿的空气中容易生锈。现有m 1 g生锈的铁粉样品,某兴趣小组同学按下图所示装置进行实验,测定该样品中氧化铁
还原性铁粉在潮湿的空气中容易生锈。现有m 1 g生锈的铁粉样品,某兴趣小组同学按下图所示装置进行实验,测定该样品中氧化铁的质量分数(铁锈按氧化铁处理)。
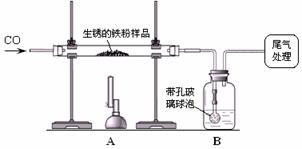
(1)装置a中反应的化学方程式是_____。
(2)某同学欲通过b装置反应前后的质量变化,测定该样品中氧化铁的质量分数。b中的最佳试剂是_____(填序号),实验时b中反应的化学方程式是_____。
① 澄清石灰水② 氢氧化钠浓溶液 ③ 稀盐酸 ④ 水
(3)上述实验过程中,co气体除作为反应物外,还能起到的作用是:① 实验开始时,排尽装置中的空气,防止加热时发生***;② 停止加热后,防止a中生成物被氧化,b中的溶液倒吸入a中;③_____。
(4)完全反应后,甲同学称得铁粉的质量为m 2 g,同时测得装置b增重m 3 g,则铁粉样品中氧化铁的质量分数为_____。 孤独情流感1年前1
孤独情流感1年前1 -
 absolutezerosp 共回答了18个问题
absolutezerosp 共回答了18个问题 |采纳率94.4%1年前查看全部
- 下列事实解释准确的是 A.糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。脱氧过
下列事实解释准确的是
A.糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。脱氧过程中铁作原电池正极,电极反应为:Fe-2 e - =Fe 2 + B.酸性氢氧燃料电池的正极电极反应为:2H 2 O+O 2 +4e - =4OH - C.CaCO 3 (s)=CaO(s)+CO 2 (g)室温下不能自发进行,该反应的△S>0,说明反应△H>0 D.铅蓄电池的正极反应为:PbO 2 +4H + +2 e - =Pb 2 + +2H 2 O  zhangyuzhou0071年前1
zhangyuzhou0071年前1 -
 TOM6363 共回答了25个问题
TOM6363 共回答了25个问题 |采纳率88%C
1年前查看全部
- 糕点包装中常用的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同.下列分析不正确的是( ) A.
糕点包装中常用的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同.下列分析不正确的是( ) A.脱氧过程是吸热反应,可降低温度,延长糕点保质期 B.脱氧过程中铁做原电池负极,电极反应为Fe-2e - ═Fe 2+ C.脱氧过程中碳做原电池正极,电极反应为2H 2 O+O 2 +4e - ═4OH - D.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况)  玲珑倾听1年前1
玲珑倾听1年前1 -
 Albertliu 共回答了18个问题
Albertliu 共回答了18个问题 |采纳率94.4%A.铁粉、氯化钠溶液、炭粉构成原电池,原电池放电过程是放热反应,故A错误;
B.脱氧过程中铁作原电池负极,负极上铁失电子生成亚铁离子,电极反应为:Fe-2e - =Fe 2+ ,故B正确;
C.脱氧过程中碳做原电池正极,正极发生还原反应,电极方程式为2H 2 O+O 2 +4e - ═4OH - ,故C正确;
D.由电子守恒知,消耗氧化剂氧气的体积(标况下)v(O 2 )=
1.12g
56g/mol ×3×22.4L/mol
4 =336mL,故D正确.
故选A.1年前查看全部
- 说什么有一种还原性铁粉和人体中的胃液转化为亚铁盐,反应方程式怎么写?
说什么有一种还原性铁粉和人体中的胃液转化为亚铁盐,反应方程式怎么写?
亚铁盐就是氯化亚铁? wysljb1年前1
wysljb1年前1 -
 和我醉_别和我睡 共回答了19个问题
和我醉_别和我睡 共回答了19个问题 |采纳率89.5%Fe+2HCl=FeCl2+H2↑
铁 盐酸 氯化亚铁 氢气
注意铁与酸和盐反应都只能生成亚铁盐1年前查看全部
- 糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同.下列分析正确的是( )
糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同.下列分析正确的是( )
A.脱氧过程是吸热反应,可降低温度,延长糕点保质期
B.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况)
C.脱氧过程中铁作原电池负极,电极反应为:Fe-3e-=Fe3+
D.脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e-=4OH- bankseal1年前1
bankseal1年前1 -
 阿弥陀佛54978 共回答了18个问题
阿弥陀佛54978 共回答了18个问题 |采纳率83.3%解题思路:Fe、C和NaCl溶液构成原电池,发生吸氧腐蚀,Fe易失电子作负极,C作正极,负极反应式为Fe-2e-=Fe2+、正极反应式为2H2O+O2+4e-=4OH-,生成的亚铁离子和氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁被氧化生成氢氧化铁.A.该装置构成原电池,原电池反应为放热反应,所以去脱氧过程为放热反应,故A错误;
B.负极反应式为Fe-2e-=Fe2+、正极反应式为2H2O+O2+4e-=4OH-,生成的亚铁离子和氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁被氧化生成氢氧化铁,所以Fe单质最终转化为+3价铁元素,1.12gFe的物质的量=[1.12g/56g/mol]=0.02mol,完全转化为+3价铁元素时,转移电子的物质的量为0.06mol,根据转移电子守恒消耗氧气体积=
0.06mol
4×22.4L/mol=336mL(标准状况),故B正确;
C.脱氧过程中铁作原电池负极,电极反应为:Fe-2e-=Fe2+,故C错误;
D.C作正极,电极反应为:2H2O+O2+4e-=4OH-,故D错误;
故选B.点评:
本题考点: 金属的电化学腐蚀与防护.
考点点评: 本题考查金属腐蚀与防护,明确铁腐蚀过程中发生的反应是解本题关键,易错选项是B,注意铁单质最终被氧化生成物质的成分是解本题关键,为易错点.1年前查看全部
- 糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同.下列分析正确的是( )
糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同.下列分析正确的是( )
A.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况)
B.脱氧过程中铁作原电池正极,电极反应为:Fe-2e-=Fe2+
C.脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e-=4OH-
D.金属的电化学腐蚀普遍存在,工业上经常用牺牲阳极的阴极保护法对金属进行保护,这是电解原理的一个重要应用 神思冥想1年前1
神思冥想1年前1 -
 爱晓芳 共回答了13个问题
爱晓芳 共回答了13个问题 |采纳率84.6%解题思路:铁粉、氯化钠溶液、炭粉构成原电池,铁作负极,碳作正极,负极上铁失电子发生氧化反应,正极上氧气得电子发生还原反应,原电池放电过程是放热反应,结合得失电子相等进行有关计算.A.由电子守恒知,消耗氧化剂氧气的体积(标况下)v(O2)=
1.12g
56g/mol×3×22.4L/mol
4=336mL,故A正确;
B.脱氧过程中铁作原电池负极,负极上铁失电子生成亚铁离子,电极反应为:Fe-2e-→Fe2+,故B错误;
C.脱氧过程中碳做原电池正极,故C错误;
D.牺牲阳极的阴极保护法对金属进行保护,这是原电池的一个重要应用,故D错误;
故选A.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池原理,明确正负极的判断、正负极上得失电子、物质间的反应来分析解答即可,难度中等.1年前查看全部
- 还原性铁粉在潮湿的空气中容易生锈.现有10克生锈的铁粉样品,某兴趣小组同学按如图所示装置进行实验,测定该样品中氧化铁的质
还原性铁粉在潮湿的空气中容易生锈.现有10克生锈的铁粉样品,某兴趣小组同学按如图所示装置进行实验,测定该样品中氧化铁的质量分数(铁锈按氧化铁处理,).
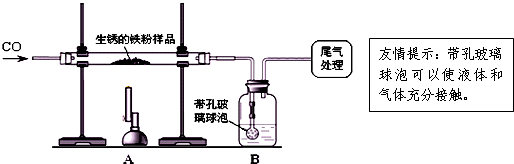
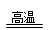
(1)装置a中反应的化学方程式是3co+fe2o3
2fe+3co2高温 .3co+fe2o3.
2fe+3co2高温 .
(2)某同学欲通过b装置反应前后的质量变化,测定该样品中氧化铁的质量分数.b中的最佳试剂是______(填序号),实验时b中反应的化学方程式是______.
①澄清石灰水②氢氧化钠浓溶液③稀盐酸④水
(3)上述实验过程中,co气体除作为反应物外,还能起到的作用是:
①实验开始时,排尽装置中的空气,防止加热时发生***;
②停止加热后,防止a中生成物被氧化;
③将a装置中的co2送入b装置的溶液中;
④______.
(4)完全反应后,甲同学称得铁粉的质量为8.8克,同时测得装置b增重3.3克,则生锈的铁粉样品中含氧化铁的质量分数为______.(不考虑空气中二氧化碳的影响) crlovewy1年前1
crlovewy1年前1 -
 爱在阳光之下 共回答了23个问题
爱在阳光之下 共回答了23个问题 |采纳率87%解题思路:(1)运用一氧化碳高温条件下和氧化铁反应生成铁和二氧化碳解答.
(2)运用氢氧化钠易溶于水且能和二氧化碳反应生成碳酸钠和水,氢氧化钙微溶于水解答.
(3)运用一氧化碳还原氧化铁的性质解答.
(4)根据3CO+Fe2O3
2Fe+3CO2计算即可解答.高温 .(1)一氧化碳高温条件下和氧化铁反应生成铁和二氧化碳,故答案:3CO+Fe2O3
高温
.
2Fe+3CO2.
(2)氢氧化钠易溶于水且能和二氧化碳反应生成碳酸钠和水,而氢氧化钙微溶于水,二氧化碳能使澄清的石灰水变浑浊,所以吸收二氧化碳一般选用氢氧化钠检验二氧化碳选用澄清石灰水.题中B是为了吸收二氧化碳,故答案:②CO2+2NaOH=Na2CO3+H2O
(3)一氧化碳还原氧化铁生成铁和二氧化碳,故答案:和生锈的铁粉中铁锈的主要成分氧化铁反应.
(4)设10g铁粉中氧化铁的质量为x
3CO+Fe2O3
高温
.
2Fe+3CO2
160 132
x 3.3g
[160/x]=[132/3.3g]
x=4g
铁粉中氧化铁的质量分数为:[4g/10g]×100%=40%
故答案:8铁粉中氧化铁的质量分数为40%.点评:
本题考点: 实验探究物质的组成成分以及含量;一氧化碳还原氧化铁;碱的化学性质;根据化学反应方程式的计算.
考点点评: 本题对铁粉中氧化铁的含量进行探究考查,只要明白运用氧化铁和一氧化碳反应的生成物二氧化碳的质量即为装置B反应前后增加的质量解答就会找到突破口.1年前查看全部
- 糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是( &
糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是()
A.脱氧过程是吸热反应,可降低温度,延长糕点保质期 B.脱氧过程中铁作原电池正极,电极反应为:Fe-3e=Fe 3+ C.脱氧过程中碳做原电池负极,电极反应为:2H 2 O+O 2 +4e=4OH - D.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况)  131333035461年前1
131333035461年前1 -
 dayaxiong 共回答了22个问题
dayaxiong 共回答了22个问题 |采纳率90.9%D
1年前查看全部
- (10分)化学研究性学习小组拟通过实验探究“新制的还原性铁粉和过量盐酸反应生成FeCl 2 还是FeCl 3 ”。请你参
(10分)化学研究性学习小组拟通过实验探究“新制的还原性铁粉和过量盐酸反应生成FeCl 2 还是FeCl 3 ”。请你参与探究并回答有关问题:
(1)一位同学用向反应后的溶液中滴加NaOH溶液的方法来验证溶液中含有Fe 2+ 。①可观察到的实现现象是___________,②反应过程中发生反应的化学方程式是______________。
(2)另一位同学向反应后的溶液中先滴加KSCN溶液,再向其中滴加新制氯水,溶液呈现红色,但当滴加过量新制氯水时,却发现红色褪去。为了弄清溶液红色褪去的原因,同学们查到如下资料:
Ⅰ.铁有一种化合物 称为铁酸盐(含有FeO 4 2- )。
称为铁酸盐(含有FeO 4 2- )。
Ⅱ.SCN - 的电子式为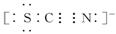
Ⅲ.氯水具有很强的氧化性。
于是同学们提出两种假设:
①第一种假设是:Cl 2 可将Fe 3+ 氧化为FeO 4 2- ,请写出该离子反应方程式__________。
3+ 氧化为FeO 4 2- ,请写出该离子反应方程式__________。
②第二种假设是:____________,提出该假设的理论依据是 还是符抗1年前1
还是符抗1年前1 -
 wumin2004 共回答了14个问题
wumin2004 共回答了14个问题 |采纳率100%(1)①产生白色沉淀,迅速变为灰绿色,最终变成红褐色 ②FeCl 2 +2NaOH===Fe(OH) 2 ↓+2NaCl
4Fe(OH) 2 +O 2 +2H 2 O===4Fe(OH) 3 (2)①2Fe 3 + +3Cl 2 +8H 2 O===2FeO+6Cl - +16H +
②SCN - 被Cl 2 氧化 从电子式分析,SCN - 中S为负二价,N为负三价,均为最低价有被氧化的可能
略1年前查看全部
- 有关化学方程式市场上出售的补血麦片中常含有微量的还原性铁粉,起到补血的作用.写出这个反应的化学方程式
 SYON1年前4
SYON1年前4 -
 watchroom 共回答了19个问题
watchroom 共回答了19个问题 |采纳率94.7%所谓的还原性铁就是纯单质铁,与非氧化性酸(胃液)反应生成Fe2+
Fe+2H+=Fe2++H2↑
Fe2+是达成血红蛋白携氧功能的主要成分,所说的补血就是通过增加红细胞中血红蛋白含量提高血液的携氧及运输养料功能.1年前查看全部
- 关于保护气的选择下列哪种物质适宜封入食品包装盒中用来吸收掉盒内的氧气,延长食品保质期?1、红磷2、固体烧碱3、还原性铁粉
关于保护气的选择
下列哪种物质适宜封入食品包装盒中用来吸收掉盒内的氧气,延长食品保质期?
1、红磷
2、固体烧碱
3、还原性铁粉
4、生石灰
谢谢你.但我想知道,为什么呢? XY021年前2
XY021年前2 -
 贺阳春 共回答了19个问题
贺阳春 共回答了19个问题 |采纳率89.5%还原性铁粉1年前查看全部
- 还原性铁粉呈 _色,铁除了一般金属的物理通性 _、_ 、_ 、和 _ 外,贴还具有与其他金属不同的性质即能被—吸引,铁可
还原性铁粉呈 _色,铁除了一般金属的物理通性 _、_ 、_ 、和 _ 外,贴还具有与其他金属不同的性质即能被—吸引,铁可用于制作磁性材料
 该放手时就放手1年前1
该放手时就放手1年前1 -
 hrkspi 共回答了13个问题
hrkspi 共回答了13个问题 |采纳率84.6%黑色,有金属光泽、导电性、导热性、延展性,磁铁1年前查看全部
- 生活中常用到下列化学物质.(1)NaHCO3:俗称______,常用于焙制糕点.(2)还原性铁粉:可用作食品防腐剂,因为
生活中常用到下列化学物质.
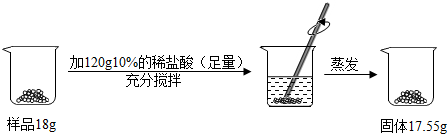
(1)NaHCO3:俗称______,常用于焙制糕点.
(2)还原性铁粉:可用作食品防腐剂,因为其能吸收______.检验其是否失效的方法是______.
(3)氢氧化钠:管导通的有效成分,放置在空气中容易吸水和变质,其变质的原因是______.小明取放置一段时间的氢氧化钠样品按图流程进行实验:则样品中钠元素的质量分数是______. lumm20071年前1
lumm20071年前1 -
 红绿灯小人 共回答了19个问题
红绿灯小人 共回答了19个问题 |采纳率78.9%解题思路:(1)根据碳酸氢钠的俗名回答;
(2)铁与氧气和水反应生成锈,消耗了氧气,阻止了食品与氧气的反应,达到了防腐的目的;铁与酸可反应生成氢气;
(3)氢氧化钠易与二氧化碳反应变质生成碳酸钠和水;氢氧化钠、碳酸钠与盐酸反应都生成氯化钠,根据质量守恒定律氯化钠中的钠元素都来自氢氧化钠和碳酸钠,根据钠元素质量守恒进行解答.(1)碳酸氢钠俗称小苏打;
故答案为:小苏打;
(2)铁与氧气和水反应生成锈,消耗了氧气,阻止了食品与氧气的反应,达到了防腐的目的;铁与酸可反应生成氢气,所以可向样品中滴加稀盐酸或稀硫酸观察是否有气泡生成;
故答案为:氧气和水;取少量样品放入试管中,滴加稀盐酸或稀硫酸,若有气泡产生,则没有失效,若无气泡产生,则已经失效;
(3)氢氧化钠易与二氧化碳反应变质生成碳酸钠和水而变质,方程式是2NaOH+CO2=Na2CO3+H2O;
氢氧化钠、碳酸钠与盐酸反应都生成氯化钠,根据质量守恒定律氯化钠中的钠元素都来自氢氧化钠和碳酸钠,其质量为:17.55g×[23/58.5]×100%=6.9g,所以样品中钠元素的质量分数是[6.9g/18g]×100%≈38.3%;
故答案为:2NaOH+CO2=Na2CO3+H2O;38.3%.点评:
本题考点: 碳酸钠、碳酸氢钠与碳酸钙;金属的化学性质;金属锈蚀的条件及其防护;碱的化学性质;化合物中某元素的质量计算;根据化学反应方程式的计算.
考点点评: 本题考查了常见酸、碱、盐的化学性质的掌握和应用,掌握相关知识才能正确解答.1年前查看全部
- 氧化还原 和硝酸将还原性铁粉分别放入冷的浓H2SO4、浓HNO3中,开始都有大量气泡生成,后来反应不再发生.已知生成的气
氧化还原 和硝酸
将还原性铁粉分别放入冷的浓H2SO4、浓HNO3中,开始都有大量气泡生成,后来反应不再发生.已知生成的气体有刺激性气味,H2SO4中气体无色,HNO3中气体红棕色;剩余的固体经检验产生了磁性.试完成下列问题:
(1)Fe的氧化产物是__________________.(写化学式,下同)
(2)浓H2SO4的还原产物是______________,浓HNO3的还原产物是__________________.
我知道答案(1)是Fe2O3 只是不知道为什么 Fe的氧化产物中没有 Fe2(SO4)3和Fe(NO3)3? GUOZS1231年前1
GUOZS1231年前1 -
 yushi1234567 共回答了14个问题
yushi1234567 共回答了14个问题 |采纳率85.7%(1)FE3O4
(2)SO2
NO21年前查看全部
- 食品包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是 A.脱氧过程是
食品包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是
A.脱氧过程是吸热反应,可降低温度,延长食品保质期 B.脱氧过程中铁作原电池正极,电极反应为:Fe-3e - =Fe 3+ C.脱氧过程中碳做原电池负极,电极反应为:2H 2 O+O 2 +4e - =4OH - D.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况)  忧伤小人鱼1年前1
忧伤小人鱼1年前1 -
 谌谌 共回答了22个问题
谌谌 共回答了22个问题 |采纳率72.7%A
1年前查看全部
- (2011•延庆县一模)还原性铁粉在潮湿的空气中容易生锈.现有m1g生锈的铁粉样品,某兴趣小组同学按下图所示装置进行实验
(2011•延庆县一模)还原性铁粉在潮湿的空气中容易生锈.现有m1g生锈的铁粉样品,某兴趣小组同学按下图所示装置进行实验,测定该样品中氧化铁的质量分数(铁锈按氧化铁处理).
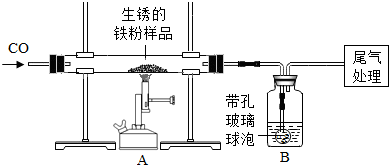
(1)装置a中反应的化学方程式是友情提示:带孔玻璃球泡可以使液体和气体充分接触 3co+fe2o3
2fe+3co2高温 .3co+fe2o3.
2fe+3co2高温 .
(2)某同学欲通过b装置反应前后的质量变化,测定该样品中氧化铁的质量分数.
b中的最佳试剂是______(填序号),实验时b中反应的化学方程式是______.
①澄清石灰水②氢氧化钠浓溶液③稀盐酸④水
(3)上述实验过程中,co气体除作为反应物外,还能起到的作用是:①实验开始时,排尽装置中的空气,防止加热时发生***;②停止加热后,防止a中生成物被氧化,b中的溶液倒吸入a中;③______.
(4)完全反应后,甲同学称得铁粉的质量为m2g,同时测得装置b增重m3g,则铁粉样品中氧化铁的质量分数为40m3 33m1 .40m3 33m1  yanyan70381年前1
yanyan70381年前1 -
 sweayu 共回答了17个问题
sweayu 共回答了17个问题 |采纳率100%解题思路:(1)根据一氧化碳还原氧化铁写出化学反应式;
(2)氢氧化钠浓溶液可以很好的吸收二氧化碳气体,我们可以通过称量化学反应前后的B装置质量,和化学反应式计算样品中氧化铁的质量分数;
(3)还可促使生成的二氧化碳气体进入装置B;
(4)根据装置B增重m3g,计算出氧化铁的质量,然后根据铁粉样品的总质量计算氧化铁的质量分数.(1)一氧化碳还原氧化铁的化学反应式是:3CO+Fe2O3
高温
.
2Fe+3CO2.故答案为:3CO+Fe2O3
高温
.
2Fe+3CO2;
(2)能很好的吸收二氧化碳的物质是氢氧化钠浓溶液,所以欲通过B装置反应前后的质量变化,测定该样品中氧化铁的质量分数.应选用的最佳试剂是②氢氧化钠浓溶液.它与二氧化碳的化学反应式是:CO2+2NaOH=Na2CO3+H2O.
故答案为:②、CO2+2NaOH=Na2CO3+H2O;
(3)CO除上述两作用外,还可以将装置中的CO2送入NaOH溶液中.
故答案为:将装置中的CO2送入NaOH溶液中;
(4)装置B增重m3g,说明有m3g二氧化碳生成,所以我们可以设生成m3g二氧化碳需要氧化铁Xg
3CO+Fe2O3
高温
.
2Fe+3CO2
160 132
X m3g
[160/132]=[X
m3,X=
40•m3/33]
所以样品中含氧化铁的质量分数是:
40•m3
33
m1=
40m3
33m1
故答案为:
40m3
33m1点评:
本题考点: 一氧化碳还原氧化铁;二氧化碳的化学性质;物质组成的综合计算;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题通过一氧化碳还原氧化铁的反应,考查相关化学反应式的书写和计算,要同学们具有综合的化学知识,才可做好此题.1年前查看全部
- 铁粉和还原性铁粉有什么区别
 濯瑜儿1年前2
濯瑜儿1年前2 -
 伦杰周2 共回答了16个问题
伦杰周2 共回答了16个问题 |采纳率100%还原性铁粉是用氢气高温下还原三氧化二铁得到.还原性特别强,性质非常活泼.它就是常说的“打火石”.普通铁粉就是单质铁的粉末.
还原性铁粉通俗的讲就是用还原方法制取的铁粉,又叫还原铁粉(纯铁).
一种活性很强的铁粉,因为具有较强的还原性,很容易发生氧化反应,甚至在空气中稍稍加热就会燃烧,因为它的这种特性,经常用于焊接铁轨、化工还原、防止氧化变质等.
生铁粉指生铁磨成粉末状,而生铁是含碳量大于2%的铁合金.1年前查看全部
- 还原性铁粉为什么能起到保鲜作用?
还原性铁粉为什么能起到保鲜作用?
还原性铁粉为什么能起到保险作用?
铁粉可以跟食品包装袋中的少量氧气、水蒸气等物质反应生成铁锈,从而达到保鲜的目的.
我不理解.- - 难道铁锈能保鲜?为什么,说明下. 思鲁1年前1
思鲁1年前1 -
 hanhan20 共回答了23个问题
hanhan20 共回答了23个问题 |采纳率87%LZ,还原铁粉的主要成分是Fe,正是Fe跟空气中的氧等物质发生反应,铁粉被氧化成铁绣,才使食物不易被氧化,则达到保鲜的作用.生成的铁绣的主要成分是Fe2O3,氧化铁.氧化铁没有还原作用,不能保鲜.及铁绣不能保鲜.LZ要把答案看懂,它说的是铁粉能保鲜,可没说铁绣也能保鲜啊!两者的成分不同的.不过像LZ这么爱学习的人还真难得啊!1年前查看全部
- 某超市出售的一种麦片,含有微量的颗粒极小的还原性铁粉,常服可治疗缺铁性贫血.
 使智使勇使贪使愚1年前6
使智使勇使贪使愚1年前6 -
 秦汉唐明 共回答了17个问题
秦汉唐明 共回答了17个问题 |采纳率100%鉄粉与胃酸反映生成2价鉄离子
Fe+2HCl=FeCl2+H2↑
铁离子能被吸收1年前查看全部
- 还原性铁粉用于食品保鲜原理是什么
 权太龙1年前2
权太龙1年前2 -
 king_zengfan 共回答了13个问题
king_zengfan 共回答了13个问题 |采纳率92.3%吸收食品包装中的氧气和水蒸汽1年前查看全部
- 将3.96gX2YO4溶解于水中,滴适量稀硫酸,加入2.24g还原性铁粉,恰好完全反应生成Fe2+,没有气体放出.
将3.96gX2YO4溶解于水中,滴适量稀硫酸,加入2.24g还原性铁粉,恰好完全反应生成Fe2+,没有气体放出.
向反应后的溶液中加入一定量的KOH溶液到刚好将Fe2+沉淀完全,充分搁置后过滤,将沉淀加热后得到红色Fe2O3粉末4.8g.所得滤液在一定条件下蒸发可得到一种纯净的不含结晶水的含氧正盐(不是复盐),其质量为13.92g.通过计算求X2YO4的化学式. fcyhytg1年前1
fcyhytg1年前1 -
 vber 共回答了21个问题
vber 共回答了21个问题 |采纳率100%2.24g还原性铁粉--0.04mol,生成Fe2+为0.04mol
红色Fe2O3粉末4.8g--0.03mol,即溶液中存在Fe2+为0.06mol
所以,X2YO4中含Fe元素,且3.96g的X2YO4中含Fe为0.02mol,且Fe元素化合价高于+2价,即Y元素是Fe元素
即,X2FeO4
即,3.96g为0.02mol
M=198=2X+56+16*4
X=39,即K元素
即,K2FeO4,高铁酸钾
验证,不含结晶水的含氧正盐(不是复盐),质量为13.92g,是K2SO4,来自两部分,原来的K+和加入的KOH提供的,符合1年前查看全部
- 下列有关常见金属及其化合物的说法正确的是: A.氯化铁溶液中加入还原性铁粉无明显颜色变化 B.铁与水蒸气在高温下的反应产
下列有关常见金属及其化合物的说法正确的是:
A.氯化铁溶液中加入还原性铁粉无明显颜色变化 B.铁与水蒸气在高温下的反应产物为Fe 2 O 3 和H 2 C.AlCl 3 与过量NaOH溶液反应生成AlO 2 - ,则与过量NH 3 ·H 2 O也生成AlO 2 - D.常温下1 mol铜片投入含4 mol HNO 3 的浓硝酸中金属可完全溶解  娃哈哈6m1年前1
娃哈哈6m1年前1 -
 dhjxlnkg 共回答了18个问题
dhjxlnkg 共回答了18个问题 |采纳率77.8%D
1年前查看全部
大家在问
- 1语法分析--选择正确答案,为什么?
- 2童年让我久久难以忘怀的作文,谢谢
- 3《春夜喜雨》《西江月·夜行黄沙道中》《天净沙·秋》的诗歌体裁分别属于(
- 4某个几何体的三视图(单位:cm)如图所示,其中正视图与侧视图是完全相同的图形,则这个几何体的体积为 ______cm3.
- 5请用一个成语概括本文对月光的描写 (满井游记)
- 6数学题直线mn互相垂直,垂足为O,试作出点A分别关于直线m,n对称的点A′,A′′,并说明A′
- 7懒得想了.1、一家宾馆去年平均每个月的营业额为25万元,如果按营业额的5%缴纳营业税,这家宾馆去年全年应缴纳营业税多少万
- 8热是动力冷为什么不行
- 9《秋思》诗改故事 作文
- 10函数fx=ax+b除以1+x的平方是定义在(-1,1)上的奇函数且F1/2=2/5 用定义证明fx在(-1,1)上是增函
- 11小叶利用如图的滑轮组,用200N的拉力在20s内将重力为480N的物体匀速提高2m,若不计摩擦与绳重.求:
- 12世界各地的自然条件差异巨大,物产各具特色,经济发展水平极不平衡,根据所学知识,回答
- 13高一数学①实数集可以表示为{x|x为所有实数}或{R}这句话错在哪?为什么错了?②下列集合中表示同一集合的是A.M={1
- 14证明:如果A=空集或者B=空集,则A交B=空集我看答案上写的分情况讨论,先是当A=空集B≠空集然后当A≠空集B=空集最后
- 151ant→( ) 2him→( ) 3wish→( ) 4meal→( ) 5this→( )