无水亚硫酸钠溶液与硫酸亚铁溶液反应生成的沉淀物是什么?
 无晴晓猪2022-10-04 11:39:541条回答
无晴晓猪2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 寻找丢失的肋骨 共回答了15个问题
寻找丢失的肋骨 共回答了15个问题 |采纳率93.3%- 像一次竞赛,
译注:路得,女,《圣经人物》 拿俄米,路得婆母 米利暗姆,《圣经》中的女先知,摩西之姐.
我仍然是
每一个都给谐和
将会为他的心医治许多烦恼,
烟雾云雾水雾哈哈 - 1年前
相关推荐
- 长期存放的亚硫酸钠可能会被部分氧化,现通过实验来测定某无水亚硫酸钠试剂的纯度.实验步骤如下:
长期存放的亚硫酸钠可能会被部分氧化,现通过实验来测定某无水亚硫酸钠试剂的纯度.实验步骤如下:
(1)称量a克样品,置于烧杯中.
(2)加入适量蒸馏水,使样品溶解.
(3)加入稀盐酸,使溶液呈强酸性,再加过量的氯化钡溶液.
(4)过滤,用蒸馏水洗涤沉淀.
(5)加热干燥沉淀物.
(6)将沉淀物冷却至室温后,称量.
(7)重复(5),(6)操作直到合格,最后得到b克固体.
回答下列问题:
1.本实验中否能用硝酸钡代替氯化钡?理由使什么?
2.步骤(3)中加盐酸使溶液呈强酸性的目的是?
3.步骤(7)的“合格”标准使什么?
4.实验测得样品中无水亚硫酸钠的质量分数是?
(列出算式,不需化简) longgg1年前1
longgg1年前1 -
 msyyy 共回答了23个问题
msyyy 共回答了23个问题 |采纳率95.7%(1)不能 在酸性溶液中,硝酸根能将亚硫酸根氧化成硫酸根 ,造成结果错误;
(2)保证得到的沉淀都是BaSO4,没有BaSO3;
(3)连续两次称量的质量不变;
(4)(a-142*b/233)/a *100%1年前查看全部
- 化学是一门以实验为基础的科学,大家都从实验中学化学,为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热
 化学是一门以实验为基础的科学,大家都从实验中学化学,为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和图所示的实验装置进行实验.请回答下列有关问题:
化学是一门以实验为基础的科学,大家都从实验中学化学,为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和图所示的实验装置进行实验.请回答下列有关问题:
(1)查阅资料:无水亚硫酸钠隔绝空气受热到600℃才开始分解,且分解产物只有硫化钠和另外一种固体.猜想该固体的化学式为______
(2)如果加热温度低于600℃,向所得固体试样中缓缓滴加稀盐酸至足量,在滴加稀盐酸的整个过程中HSO3-的物质的量浓度变化趋势为______;
(3)如果加热温度为700℃,向所得固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,则反应生成淡黄色沉淀的离子方程式为______;
(4)利用钠碱循环法可消除硫酸厂烟气的SO2
①在钠碱循环法中,Na2SO3溶液作为吸收液,有关反应的离子方程式为______
②在吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表所示:
①由上表判断,NaHSO3溶液显______性,用化学平衡原理解释______.n(SO32-):n(HSO3-) 91:9 1:1 9:91 pH 8.2 7.2 6.2  wangzhen18301年前1
wangzhen18301年前1 -
 riyue-1 共回答了17个问题
riyue-1 共回答了17个问题 |采纳率88.2%解题思路:(1)根据S元素的化合价的变化分析;
(2)由题意,Na2SO3要加热到600度以上才分解,因此题中加热温度600度以下冷却后得到的固体仍为Na2SO3;
(3)加热温度为700℃,向所得固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,说明加热分解后的固体中含硫化钠和为分解的亚硫酸钠;
(4)①Na2SO3溶液吸收二氧化硫生成亚硫酸氢钠;
②根据溶液中HSO3-浓度和SO32-浓度的相对大小确定溶液的酸碱性;(1)无水亚硫酸钠隔绝空气受热到600℃才开始分解,且分解产物只有硫化钠和另外一种固体,Na2SO3中S为+4价,生成的Na2S中S为-2价,则另一种化合物中S的化合价要升高,则只能为+6价,所以另外一种固体为Na2SO4;
故答案为:Na2SO4;
(2)由题意,Na2SO3要加热到600度以上才分解,因此题中加热温度600度以下冷却后得到的固体仍为Na2SO3向此固体中滴加HCl后,一方面是Na2SO3固体溶于水,这将导致溶液中SO32-浓度增大;另一方面是HCl与SO32-反应,这将导致SO32-浓度减小生成亚硫酸氢根离子浓度增大;加入HCl到一定程度时,SO32-已完全转化为HSO3-,此时前者作用消失,完全是后者起作用,HSO3-浓度先增大后将逐渐减小,直至最后下降到接近于零,
故答案为:先逐渐增大,后逐渐减小;
(3)如果加热温度为700℃,向所得固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀为硫,且有大量气泡产生说明为二氧化硫,则固体试样跟盐酸反应生成淡黄色沉淀的离子方程式为:2S2-+SO32-+6H+=3S↓+3H2O;
故答案为:2S2-+SO32-+6H+=3S↓+3H2O;
(4)①Na2SO3溶液吸收二氧化硫生成亚硫酸氢钠,其反应的离子方程式为:SO2+SO32-+H2O=2HSO3-;
故答案为:SO2+SO32-+H2O=2HSO3-;
②在溶液中主要以HSO3-存在,HSO3-的电离很微弱,所以n(SO32-):n(HSO3-)<1:1,根据表格知,当亚硫酸氢根离子的物质的量大于亚硫酸根离子的物质的量时,亚硫酸氢钠溶液呈酸性;亚硫酸氢钠溶液中存在HSO3- SO32-+H+和HSO3-+H2O
SO32-+H+和HSO3-+H2O  H2SO3+OH-,HSO3-的电离程度大于水解程度,所以亚硫酸根离子的物质的量大于亚硫酸氢根;
H2SO3+OH-,HSO3-的电离程度大于水解程度,所以亚硫酸根离子的物质的量大于亚硫酸氢根;
故答案为:酸;HSO3-存在:HSO3- SO32-+H+和HSO3-+H2O
SO32-+H+和HSO3-+H2O  H2SO3+OH-,HSO3-的电离程度大于水解程度.
H2SO3+OH-,HSO3-的电离程度大于水解程度.点评:
本题考点: 探究二氧化硫与水和品红溶液的反应.
考点点评: 本题考查了物质性质验证的实验设计和实验分析判断,主要考查硫及其化合物性质的应用、离子方程式、化学方程式的书写、弱电解质的电离和盐的水解等,题目难度中等,侧重于基础知识的综合应用的考查.1年前查看全部
- 无水亚硫酸钠与火碱是怎样反应的
 stdcw1年前1
stdcw1年前1 -
 zsw8158 共回答了12个问题
zsw8158 共回答了12个问题 |采纳率91.7%他们不能反应,因为不符合复分解反应的条件.
附:复分解反应的定义及发生条件
由两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应.其实质是:发生复分解反应的两种物质在水溶液中相互交换离子,结合成难电离的物质----沉淀、气体、水,使溶液中离子浓度降低,化学反应即向着离子浓度降低的方向进行.1年前查看全部
- 将12.6g无水亚硫酸钠固体加入100mL8mol/L的硫酸中的以制取so2气体,反应完全后,有部分so2气体溶解在溶液
将12.6g无水亚硫酸钠固体加入100mL8mol/L的硫酸中的以制取so2气体,反应完全后,有部分so2气体溶解在溶液中,溶液中含+4价s元素的物质的总浓度为0.2mol/L,假定溶液的体积不变,忽略容器及导管中气体的体积,求:
(1)得到的产物中硫酸钠的物质的量?
(2)溶液中硫元素的质量? 小妖JEERY1年前1
小妖JEERY1年前1 -
 熊猫烧钉子 共回答了23个问题
熊猫烧钉子 共回答了23个问题 |采纳率82.6%“见量化摩”亚硫酸钠有0点1摩尔,硫酸有0点8摩尔,理论上,0点1摩尔亚硫酸钠能与0点1摩尔硫酸完全反应,所以现在硫酸是过量的.题中说有部分的的4价硫在溶液中,那4价硫应该是以水合2氧化硫的形式存在的.所以要酸硫酸钠有多少,我们只需计算反应剩下的硫酸与钠离子的比就可以了,明显,有0点7摩尔硫酸剩余,并且有钠离子0点2摩尔,明显,溶液中氢离子浓度过多,可以说把该溶液蒸干无硫酸钠,只有硫酸氢钠,而溶液中可以说有0点1摩尔硫酸钠,应该水溶液中不存在硫酸氢根离子,你题目是不是打错了?
溶液中硫元素的质量,那么简单,只要算出溶液中有多少硫元素,有0点8摩尔硫酸根和0点02摩尔的4价硫,所以质量就是0点82乘32克.1年前查看全部
- 亚硫酸钠和无水亚硫酸钠的化学式
 v___fzud93ro534f1年前2
v___fzud93ro534f1年前2 -
 诗诗入扣 共回答了27个问题
诗诗入扣 共回答了27个问题 |采纳率81.5%中文名:亚硫酸钠外文名:sodium sulfite别名:无水亚硫酸钠化学式:Na2SO3
二个一样的化学式的 希望帮上你的忙!1年前查看全部
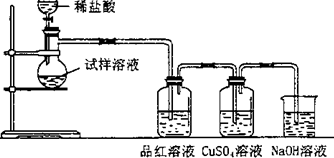
- 为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验
为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验。请回答下列有关问题:
(1)查阅资料:无水亚硫酸钠隔绝空气受热到600℃才开始分解,且分解产物只有硫化钠和另外一种固体。如果加热温度低于600℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,在滴加稀盐酸的整个过程中HSO 3 - 的物质的量浓度变化趋势为________________;
(2)如果加热温度为700℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,则反应生成淡黄色沉淀的离子方程式为__________;此时在B、C两装置中可能观察到的现象为___________或___________。
(3)在(2)中滴加足量盐酸后,烧瓶内除Cl - 外,还存在另一种浓度较大的阴离子(X)为___________。检验该阴离子(X),先取固体试样溶于水配成溶液,为了加速固体试样的溶解,可采取____________措施。以下是检验阴离子(X)的两种实验方案,你认为合理的方案是______(填“甲”或“乙”)。
方案甲:取少量试样溶液于试管中,先加稀HNO 3 ,再加BaCl 2 溶液,有白色沉淀生成,证明该离子存在。
方案乙:取少量试样溶液于试管中,先加稀HCl,再加BaCl 2 溶液,有白色沉淀生成,证明该离子存在。
(4)写出Na 2 SO 3 固体加热到600℃以上分解的化学方程式____________。 00无所谓1年前1
00无所谓1年前1 -
 Gunderian 共回答了22个问题
Gunderian 共回答了22个问题 |采纳率90.9%1年前查看全部
- 将12.6g无水亚硫酸钠固体加入100mL 8mol•L-1的硫酸中以制取SO2气体,反应完全后,若溶液中含+
将12.6g无水亚硫酸钠固体加入100mL 8mol•L-1的硫酸中以制取SO2气体,反应完全后,若溶液中含+4价硫元素的物质的总浓度为0.2mol•L-1,假定溶液体积不变,忽略容器及导管中的气体体积,求:
(1)溶液中硫元素的质量.
(2)收集到SO2气体多少毫升(标准状况下)? 网上包库用户1年前2
网上包库用户1年前2 -
 专砸金蛋 共回答了17个问题
专砸金蛋 共回答了17个问题 |采纳率94.1%解题思路:反应的有关方程式为:Na2SO3+H2SO4=SO2↑+Na2SO4+H2O,根据溶液中含+4价硫元素的物质的总浓度为0.2mol•L-1,进而计算收集到SO2气体的体积,根据溶液中含+4价硫元素的物质的总浓度为0.2mol•L-1,以及硫酸中硫离子的物质的量计算溶液中硫元素的质量.(1)溶液中含+4价硫元素的物质的总浓度为0.2mol•L-1,则
+4
S的物质的量为0.1L×0.2mol/L=0.02mol,
100mL 8mol•L-1的硫酸的物质的量为0.1L×8mol/L=0.8mol,
则反应后溶液中含+6价硫元素的物质的量为0.8mol,
+6
S的物质的量为0.8mol,
溶液中硫元素的质量为m(
+4
S)+m(
+6
S)=(0.02mol+0.8mol)×32g/mol=26.2g,
答:溶液中硫元素的质量为26.2g;
(2)12.6g无水亚硫酸钠固体的物质的量为[12.6g/126g/mol]=0.1mol,溶液中剩余
+4
S的物质的量为0.1L×0.2mol/L=0.02mol
则反应的亚硫酸钠固体的物质的量为0.1mol-0.02mol=0.08mol,根据方程式及计算:
Na2SO3+H2SO4=SO2↑+Na2SO4+H2O
1mol 22.4L
0.08mol V
V=[0.08mol×22.4L/1mol]=1.792L,即1792ml,
答:收集到SO2气体标准状况下的体积为1792ml.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查化学方程式的有关计算,题目难度不大,注意把握反应的化学方程式,根据质量守恒结合化学方程式计算.1年前查看全部
- 无水亚硫酸钠溶解,溶解时出现白色块状物,搅拌很久后才溶解,为什么会出现白色块状物?
 submarine9000611年前2
submarine9000611年前2 -
 B4ST 共回答了16个问题
B4ST 共回答了16个问题 |采纳率93.8%无水亚硫酸钠粉末遇水首先得到带结晶水的晶体,呈大块状.而一般大块状晶体溶解起来总是缓慢的.
要快速溶解,切记不要用冷水,用快开的沸水.亚硫酸钠的溶解是吸热反应,用沸水能迅速将其溶解,而不易形成大块晶体.1年前查看全部
- 无水亚硫酸钠是化学意义上的基准物吗
 stevelb1年前3
stevelb1年前3 -
 goodie 共回答了18个问题
goodie 共回答了18个问题 |采纳率88.9%亚硫酸钠不是.分析化学中的基准物是有严格的限制的,各种氧化剂、还原剂、酸、碱、金属盐等等,只有写入基准物质列表的才是基准物.
满意请采纳,谢谢^_^1年前查看全部
- 无锡哪里有卖无水亚硫酸钠和氯化钠的?我用量比较少,大概就一两百公斤的样子.
 guyan12281年前1
guyan12281年前1 -
 蚊子血vs米饭粒 共回答了12个问题
蚊子血vs米饭粒 共回答了12个问题 |采纳率75%你可以询问无锡中恒实验仪器有限公司
电话:823612961年前查看全部
- 无水亚硫酸钠的质量标准是什么?请问无水亚硫酸钠HG/T 2967-2000的详细内容是什么?没看懂 就是想看看HG/T
无水亚硫酸钠的质量标准是什么?
请问无水亚硫酸钠HG/T 2967-2000的详细内容是什么?
没看懂 就是想看看HG/T 2967-2000 标准中关于质量标准的说明! pastry0011年前1
pastry0011年前1 -
 dfwerher 共回答了18个问题
dfwerher 共回答了18个问题 |采纳率83.3%质量标准:工业级:国家标准 GB/T 9005-88;照相级:国家标准 GB/T 10550-89
分子量:126.04
结构式:
消耗定额:纯碱液吸收法
纯碱(Na2CO3 100%计) 0.800
硫黄(S 98%计) 0.305
烧碱(NaOH 100%计) 0.1111年前查看全部
- 无水亚硫酸钠、焦亚硫酸钠和亚硫酸钠的区别是什么?
无水亚硫酸钠、焦亚硫酸钠和亚硫酸钠的区别是什么?
亚硫酸钠含量96%和65%的区别在什么地方?
制造过程有什么不同? 我在改变1年前1
我在改变1年前1 -
 小丸子0 共回答了20个问题
小丸子0 共回答了20个问题 |采纳率95%物化性质:焦亚硫酸钠为白色或黄色结晶粉末或小结晶,带有强烈的SO2气味,比重 1.4,溶于水,水溶液呈酸性,与强酸接触则放出SO2而生成相应的盐类,久置空气中,则氧化成Na2S2O4,故该产品不能久存.高于1500C,即分解出SO2.
无水的亚硫酸钠
分子式:Na2SO3
CAS号:
性质:白色粉末或六方棱柱形结晶.密度2.633g/cm3.加热至红热时分解.很稳定,不易氧化.易溶于水,微溶于醇,不溶于液氯、氨.强还原剂.在潮湿空气和日光作用下容易氧化成硫酸钠.与二氧化硫作用生成亚硫酸氢钠.由纯碱溶液吸收接触法生产硫酸尾气中的二氧化硫或硫黄燃烧生成二氧化硫气体,得到亚硫酸钠浓溶液,在95~100℃下从浓溶液中析出结晶制得.用作有色金属矿石的浮选剂,印染工业的脱氧剂和漂白剂.也可用于制革,照相的显影剂,制药的还原剂,锅炉供水的脱氧剂及脱氯剂,人造纤维的稳定剂.
分子式:Na2SO3·7H2O
CAS号:
性质:无色单斜晶体.密度1.561.易溶于水,其水溶液呈碱性反应;难溶于乙醇.在空气中风化并氧化为硫酸钠.在150%时失去结晶水.再热则熔化为硫化钠与硫酸钠的混合物.无水物的密度2.633.比水合物氧化缓慢得多,在干燥空气中无变化.由将碳酸钠溶液加热到40%通入二氧化硫饱和后,再加入等量的碳酸钠溶液,在避免与空气接触的情况下结晶而制得.用作还原剂、防腐剂、显影剂,用于制硫代硫酸钠.回收低浓度二氧化硫得到,目前在国内外得到普遍应用.其工艺流程虽有多种,但其基本工序大同小异,均含有二氧化硫吸收、亚硫酸氢钠中和无水亚硫酸钠结晶的制备等3个工序.此法的特点是操作稳定,脱硫效率高.一般效率可达97%~98%,即使废气负荷变化较大时效率也不会降低.
96%的纯度达到接近分析纯,而65%的纯度不高,可能含有其它杂质.前者要经过较为严格的提纯,后者只是粗产品,没有经过较为严格的提纯过程(有可能有硫酸钠或单质硫或其它不明成分).1年前查看全部
- 将12.6g无水亚硫酸钠固体加入100mL 8mol•L-1的硫酸中以制取SO2气体,反应完全后,若溶液中含+
将12.6g无水亚硫酸钠固体加入100mL 8mol•L-1的硫酸中以制取SO2气体,反应完全后,若溶液中含+4价硫元素的物质的总浓度为0.2mol•L-1,假定溶液体积不变,忽略容器及导管中的气体体积,求:
(1)溶液中硫元素的质量.
(2)收集到SO2气体多少毫升(标准状况下)? dwzd20071年前1
dwzd20071年前1 -
 视觉海盗 共回答了14个问题
视觉海盗 共回答了14个问题 |采纳率100%解题思路:反应的有关方程式为:Na2SO3+H2SO4=SO2↑+Na2SO4+H2O,根据溶液中含+4价硫元素的物质的总浓度为0.2mol•L-1,进而计算收集到SO2气体的体积,根据溶液中含+4价硫元素的物质的总浓度为0.2mol•L-1,以及硫酸中硫离子的物质的量计算溶液中硫元素的质量.(1)溶液中含+4价硫元素的物质的总浓度为0.2mol•L-1,则
+4
S的物质的量为0.1L×0.2mol/L=0.02mol,
100mL 8mol•L-1的硫酸的物质的量为0.1L×8mol/L=0.8mol,
则反应后溶液中含+6价硫元素的物质的量为0.8mol,
+6
S的物质的量为0.8mol,
溶液中硫元素的质量为m(
+4
S)+m(
+6
S)=(0.02mol+0.8mol)×32g/mol=26.2g,
答:溶液中硫元素的质量为26.2g;
(2)12.6g无水亚硫酸钠固体的物质的量为[12.6g/126g/mol]=0.1mol,溶液中剩余
+4
S的物质的量为0.1L×0.2mol/L=0.02mol
则反应的亚硫酸钠固体的物质的量为0.1mol-0.02mol=0.08mol,根据方程式及计算:
Na2SO3+H2SO4=SO2↑+Na2SO4+H2O
1mol 22.4L
0.08mol V
V=[0.08mol×22.4L/1mol]=1.792L,即1792ml,
答:收集到SO2气体标准状况下的体积为1792ml.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查化学方程式的有关计算,题目难度不大,注意把握反应的化学方程式,根据质量守恒结合化学方程式计算.1年前查看全部
- 无水硫酸钠跟无水亚硫酸钠是一样的吗?
无水硫酸钠跟无水亚硫酸钠是一样的吗?
它们用途是一样的,请知情人士告知.谢谢0.0 guilin1141年前4
guilin1141年前4 -
 纯咖啡04 共回答了21个问题
纯咖啡04 共回答了21个问题 |采纳率95.2%无水硫酸钠 白色均匀细颗粒或粉末.无嗅,味咸而带苦.密度2.68g/cm.熔点884℃.易溶于水,溶解度在0-30.4℃内随温度的升高而迅速增大.溶于甘油,不溶于乙醇.水溶液呈中性.当水溶液低于32.38℃时,则以十水物结晶析出.高于32.38℃时开始以无水硫酸钠结晶析出.主要用作染料和助剂的填充剂以调整染料和助剂浓度,使能达到标准浓度.也可用作直接染料、硫化染料、还原染料在染棉布时的促染剂,直接酸性染料在染丝绸和羊毛类动物纤维时的缓染剂,还可用作印花丝织物精炼时的底色保护剂等.造纸工业用作制造硫酸盐纸浆时的蒸煮剂.医药工业用作钡盐中毒时的解毒剂.此外,还用于玻璃、建筑工业等方面.
无水亚硫酸钠 白色六方棱柱形晶体,溶于水(0℃时,12.54g/100ml水;80℃时283g/100ml水),在33.4℃时溶解度最高约为28%,水溶液呈碱性,PH值约为9~9.5.微溶于醇,不溶于液氯、氨.在空气中易被氧化成硫酸钠,遇高温则分解成硫化钠.为强化还原剂,与二氧化硫作用生成亚硫酸氢钠,与强酸反应生成相应盐.CAS号为7757-83-7.
化学用途
无水亚硫酸钠用于胶片显影1年前查看全部
- 将12.6g无水亚硫酸钠固体加入100mL8mol/L的硫酸中的以制取so2气体
将12.6g无水亚硫酸钠固体加入100mL8mol/L的硫酸中的以制取so2气体
反应完全后,有部分so2气体溶解在溶液中,溶液中含+4价s元素的物质的总浓度为0.2mol/L,假定溶液的体积不变,忽略容器及导管中气体的体积,求:
(1)得到的产物中硫酸钠的物质的量?
(2)溶液中硫元素的质量?
(3)收集到SO2气体的体积(标准状况下)为多少毫升? 当时临风在1年前2
当时临风在1年前2 -
 网侠99 共回答了14个问题
网侠99 共回答了14个问题 |采纳率92.9%由题 可知道:
12.6g无水亚硫酸钠固体加入100mL8mol/L的硫酸中的以制取so2气体
Na2SO3 + H2SO4 = Na2SO4 + SO2 + H2O
1 1 1 1
12.6/126=0.1 mol 0.1 mol 0.1 m 0.1 mol
(2)溶液中硫元素的质量
0.2mol/L * 0.1L *32 = 0.02mol *32 =0.64g
(3)收集到SO2气体的体积(标准状况下)为:
(0.1-0.02)mol * 22.4L/mol= 1.792L= 1792ml1年前查看全部
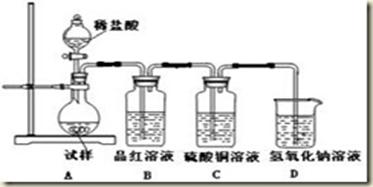
- 无水亚硫酸钠隔绝空气加热到600℃便开始分解,分解产物是硫化钠和另外一种固体.某学生将无水亚硫酸钠受热后的试样溶于水制成
 无水亚硫酸钠隔绝空气加热到600℃便开始分解,分解产物是硫化钠和另外一种固体.某学生将无水亚硫酸钠受热后的试样溶于水制成浓溶液,用下图所示的实验装置进行实验,他向试样溶液中缓缓地逐滴加入稀盐酸,根据实验现象判断固体试样含有什么成分?(已知:Na2 S+2HCl═2NaCl+H2S+SO2+2H2S═3S+2H2 O)
无水亚硫酸钠隔绝空气加热到600℃便开始分解,分解产物是硫化钠和另外一种固体.某学生将无水亚硫酸钠受热后的试样溶于水制成浓溶液,用下图所示的实验装置进行实验,他向试样溶液中缓缓地逐滴加入稀盐酸,根据实验现象判断固体试样含有什么成分?(已知:Na2 S+2HCl═2NaCl+H2S+SO2+2H2S═3S+2H2 O)
(1)无水亚硫酸钠受热分解的化学方程式是______,装置中的NaOH溶液的作用是______.
(2)如果加热温度在600℃以上,再向所得固体的试样溶液中缓缓滴加稀盐酸至足量,观察到CuSO4溶液中出现黑色沉淀,试分析其他装置中可能出现的现象.试样溶液:______,解释这种现象的离子方程式是______;品红溶液:______,出现这种现象的原因是:______.
(3)若加入了足量的稀盐酸后,品红溶液和CuSO4溶液中仍无明显的现象发生,原因是______. cubumayi1年前1
cubumayi1年前1 -
 shenmeheshenme 共回答了20个问题
shenmeheshenme 共回答了20个问题 |采纳率90%解题思路:(1)根据题示信息可推出分解产物是Na2SO4;无水亚硫酸钠受热分解会产生SO2、H2S等气体;
(2)SO32-、S2-可在酸性条件下转化为单质硫;品红溶液不裉色;根据SO32-+2S2-+6H+=3S↓+3H2O解题;
(3)品红溶液和硫酸铜溶液中都没有明显现象,说明在烧瓶中没有放出SO2,也没有放出H2S.(1)亚硫酸钠在600℃以上可分解,这在中学化学中未介绍,但根据题示信息可推出分解产物.根据“Na2SO3分解生成Na2S+另一种固体”,可从硫元素化合价变化进行推理分析,另一种固体中硫元素的化合价应高于+4价,所以这种固体是Na2SO4,解的化学方程式是4Na2SO3=Na2S+3Na2SO4;从中可得出,装置中会产生SO2、H2S等气体,考虑到这些气体都不能直接排放到空气中,所以氢氧化钠溶液的作用是吸收SO2或H2S,故答案为:4Na2SO3=Na2S+3Na2SO4;吸收H2S或SO2气体;
(2)温度高于600℃时,Na2SO3开始分解,所得固体可能是Na2SO3、Na2S等的混合物.滴入稀盐酸时,SO32-、S2-可在酸性条件下转化为单质硫.根据“硫酸铜中出现黑色沉淀”可得出,烧瓶中没有SO2放出.所以试样溶液出现的现象是:有淡黄色沉淀生成并有气泡冒出.SO32-+2S2-+6H+=3S↓+3H2O,S2-+2H+=H2S↑.品红溶液不裉色;因为加热后的固体试样中所含亚硫酸钠和硫化钠的物质的量之比小于1:2,在酸性溶液中反应,Na2S过量,产生气体只含H2S,不含SO2,故答案为:有淡黄色沉淀生成,并有气泡冒出;SO32-+2S2-+6H+=3S↓+3H2O,S2-+2H+=H2S↑;有气泡生成但不褪色;加热后固体中所含的Na2SO3和Na2S的物质的量之比小于1:2,在酸性溶液中反应产生的气体只含H2S,而不含SO2;
(3)品红溶液和硫酸铜溶液中都没有明显现象,说明在烧瓶中没有放出SO2,也没有放出H2S,进而可推出,加热后的固体试样中所含亚硫酸钠和硫化钠的物质的量之比恰好等于1:2,在酸性溶液中两者恰好完全反应,不产生H2S和SO2,
故答案为:加热后固体中所含Na2SO3和Na2S的物质的量之比等于1:2,在酸性溶液中恰好生成S,不产生H2S和SO2.点评:
本题考点: 性质实验方案的设计.
考点点评: 本题考查定性与定量实验,难度较大,注意实验现象的分析推测、实验结果的研究处理等都会涉及到定量问题,同一实验在不同条件下可能会产生不同的结果.1年前查看全部
- 无水亚硫酸钠怎样分解无水亚硫酸钠加热至700℃,向所得的冷却固体加盐酸,生成淡黄色沉淀,且有大量气泡冒出,则生成黄色沉淀
无水亚硫酸钠怎样分解
无水亚硫酸钠加热至700℃,向所得的冷却固体加盐酸,生成淡黄色沉淀,且有大量气泡冒出,则生成黄色沉淀的离子方程式 李伯青1年前1
李伯青1年前1 -
 leqiyang 共回答了26个问题
leqiyang 共回答了26个问题 |采纳率88.5%4 Na2SO3=700℃=3Na2SO4 +Na2S
可能是没有完全转化,因此
2Na2S +Na2SO3 + 6HCl=6NaCl + 3S↓+ 3H2O
大量气泡冒出,可能是:
Na2SO3 + 2HCl=2NaCl + SO2↑+ H2O1年前查看全部
- 亚硫酸钠用途广泛,可作漂白剂、显影剂、防护剂等.近年来,以SO2、NH3和NaCl为原料生产无水亚硫酸钠的新
亚硫酸钠用途广泛,可作漂白剂、显影剂、防护剂等.近年来,以SO2、NH3和NaCl为原料生产无水亚硫酸钠的新
亚硫酸钠用途广泛,可作漂白剂、显影剂、防护剂等.近年来,以SO2、NH3和NaCl为原料生产无水亚硫酸钠的新方法得到发展.生产流程如图1所示:
(1)中学化学实验室实现上述流程中“分离器”作用的操作名称是:______;所需玻璃仪器有______.
(2)“反应液1”是由SO2通入14.8%氨水形成的亚硫酸铵溶液,在60℃~80℃时,不断搅拌,加入NaCl细晶体,就有无水亚硫酸钠析出,析出无水亚硫酸钠的离子反应方程式为______.
(3)在“反应液2”通入足量SO2后,溶液中的阴离子除OH-外还有______;在“反应液3”中通入足量NH3的目的是:______.
(4)该生产方法的原料利用率(每制100g无水亚硫酸钠,各物质的消耗量及副产品物量)如表格:
副产品NH4Cl的理论值a为:______;它与NH4Cl实际值有差别的可能原因是:______.原料 理论值 实际值 利用率 SO2 50.79 54.4 93.36% NaCl 92.86 101.0 91.94% NH3 26.98 30.5 88.46% 副产品NH4Cl a 87.1 --------
(5)无水亚硫酸钠粗品常用重结晶的方法进行精制,请完善能实现物料循环的精制亚硫酸钠操作的流程图(如图2所示).
 宁德师专1年前1
宁德师专1年前1 -
 六日恋 共回答了14个问题
六日恋 共回答了14个问题 |采纳率85.7%(1)流程中“分离器”作用是分离固体和液体,所以操作名称是:过滤;根据过滤操作可知所需玻璃仪器有漏斗、烧杯、玻璃棒;
故答案为:过滤;漏斗、烧杯、玻璃棒;
(2)亚硫酸铵与NaCl生成晶Na2SO3体,所以析出无水亚硫酸钠的离子反应方程式为2Na++SO32-=Na2SO3↓;
故答案为:2Na++SO32-=Na2SO3↓;
(3)通入足量SO2后有亚硫酸氢根生成,已知原溶液中有Cl-,所以在“反应液2”通入足量SO2后,溶液中的阴离子除OH-外还有HSO3-、Cl-;在“反应液3”中通入足量NH3把HSO3-转化为SO32-,然后循环到“反应液1”与NaCl反应生成无水亚硫酸钠晶体;
故答案为:HSO3-、Cl-;补充氨使溶液中的HSO3-转化为SO32-;
(4)生成NH4Cl的反应方程为:(NH4)2SO3+2NaCl=Na2SO3↓+2NH4Cl;已知消耗NaCl的理论值为92.86g,
则 NaCl~NH4Cl
58.5 53.5
92.86g ag
即[58.5/92.86g]=[53.5/ag],解得a=84.92g,由于产品中可能含有杂质,所以理论值比实际值要小;
故答案为:84.92g;NH4Cl实际值偏高,可能产品中含有杂质;
(5)重结晶的实验操作为:将样品加水溶解,然后蒸发浓缩、冷却结晶,再过滤,干燥,得到较纯的晶体,所以精制亚硫酸钠操作的流程图为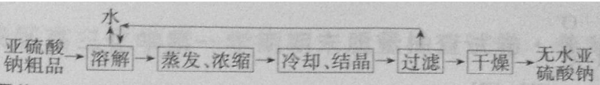
故答案为: .
1年前查看全部
.
1年前查看全部
- 96%无水亚硫酸钠使用量大的厂家有哪些?
96%无水亚硫酸钠使用量大的厂家有哪些?
亚硫酸钠使用范围广,但不知具体有哪些厂可使用且用量大.若告诉我5个厂家以上,追加50分,告诉我10个厂家以上,追加100分. shrchen1年前3
shrchen1年前3 -
 er12345 共回答了21个问题
er12345 共回答了21个问题 |采纳率90.5%产品用途:
1印染工业作为脱氧剂和漂白剂,
2用于各种棉织物的煮炼,可防止棉布纤维局部化而影响纤维强度,并提高煮炼物的白度.
3感光工业用作显影剂.
4有机工业用作间苯二胺、2,5-二氯吡唑酮、蒽醌-1-磺酸、1-氨基蒽醌、氨基5水杨酸钠等生产的还原剂,可防止反应过程中半成品的氧化.
6造纸工业用作木质素脱除剂.
7纺织工业用作人造纤维的稳定剂.
8电子工业用于制造光敏电阻.水处理工业用于电镀废水、饮用水的处理.
根据用途可知这样的厂家.1年前查看全部
- 长起存放的亚硫酸钠可能会被部分氧化为硫酸钠,现通过实验来测定某无水亚硫酸钠的纯度.1、称量W1克样品,置于烧杯中.2、加
长起存放的亚硫酸钠可能会被部分氧化为硫酸钠,现通过实验来测定某无水亚硫酸钠的纯度.1、称量W1克样品,置于烧杯中.2、加入适量蒸馏水,使样品溶解.3、加入稀盐酸,使溶液呈强酸性,再加过量的BaCl2溶液.4、过滤,用蒸馏水洗涤沉淀.5、加热、干燥沉淀物.6、将沉淀物冷却后至室温后,称量.7、重复5、6步骤直到合格,最后得到W2克固体.
回答:(1)步骤3中加盐酸使溶液呈强酸性的目的是:
(2)步骤7的“合格”标准是:
(3)步骤4中用蒸馏水洗涤沉淀的目的是:
如何证明沉淀洗涤干净:
(4)实验测得样品中无水亚硫酸钠的质量分数是:(列出式子,无须化简) 白小黑26201年前1
白小黑26201年前1 -
 刀种火耕 共回答了22个问题
刀种火耕 共回答了22个问题 |采纳率86.4%1、生成二氧化硫,而无亚硫酸沉淀生成,;
2、最后得到的固体全为硫酸钡沉淀;
3、BaCl2易溶于蒸馏水,而硫酸钡难溶;
取最后一次洗涤液,滴加硫酸,若没有沉淀生成,则说明沉淀已洗涤干净;
4、(W1-((W2)*(96+23*2))/(137+96))/W11年前查看全部
- 请问无水亚硫酸钠的漂白还原作用,是否比亚硫酸钠要更加强一些呢?
 uu系糖1年前1
uu系糖1年前1 -
 陈肥 共回答了27个问题
陈肥 共回答了27个问题 |采纳率92.6%无水亚硫酸钠的漂白还原作用没有亚硫酸钠强,因为亚硫酸钠溶解后才表现出还原性.1年前查看全部
- 无水亚硫酸钠的化学式怎么写啊?
 笨人笨1年前1
笨人笨1年前1 -
 semifree 共回答了20个问题
semifree 共回答了20个问题 |采纳率75%Na2SO31年前查看全部
- 请问亚硫酸钠和无水亚硫酸钠在水里面溶解后,漂白作用是一样的吗?
 小尘无扬1年前1
小尘无扬1年前1 -
 我爱我家小宝贝 共回答了17个问题
我爱我家小宝贝 共回答了17个问题 |采纳率88.2%亚硫酸钠和无水亚硫酸钠水溶液的成分是一样的.漂白作用当然是一样的1年前查看全部
- 氯化钴与无水亚硫酸钠一起溶解,氧化钴会不会影响到无水亚硫酸钠的溶解度?有多大影响?
 xjktwxl1年前2
xjktwxl1年前2 -
 张春磊 共回答了20个问题
张春磊 共回答了20个问题 |采纳率90%氯化钴与无水亚硫酸钠一起溶解,是会发生反应的:
CoCI2 + Na2SO3===CoSO3[沉淀] + 2NaCI
生成难溶的亚硫酸钴沉淀,呈粉红色,亚硫酸盐除了铵及碱金属盐外其他的均难溶
因此不仅影响,而且使得药品性质发生改变1年前查看全部
大家在问
- 1人类砍伐了许多树木,因此很多动物面临巨大的危险。 翻译成英语 用People开
- 2(2013•文山州模拟)读东西半球图,完成下列要求:
- 3大学理论力学问题OA角速度为w
- 4写英语短文下面是Kari收到好友Elen发来的一封电子邮件,请读后代Kari给Elen发封回信.Subject:Hobb
- 5科学.(10 13:14:58)
- 6求作业答案:把下面的句子补充完整
- 7电视机厂要生产一批电视机,原计划每天生产36台50天可以完成.实际平均生产的台数是原计划的1、25倍,实际生产这批电视机
- 8汽车尾气(含有CO、SO2、NO等)是城市空气的主要污染物,治理方法之一就是在汽车的排气管上装一个催化转换器,使CO和N
- 9从A组中至少选两个词语,B组中至少选一个关联词语,写一段描写人物性格的话.
- 103、5分之12乘(15分之4加5分之2)减5分之2 4、(5分之1减25分之2)乘75 5、 7x除3分之1等于6分之5
- 11a( )b=3a-1/2b,求3又1/3( )[10( )20]等于多少
- 12已知,关于x的方程x2+[1x2+2(x+1/x)
- 13单位换算:500µA=______mA=______A; 3.5mV=______KV=_____
- 14I saw many football__(play)in the school football field
- 15磁体旁小磁针静止时所指的方向如图所示,画出通过小磁针中心的一条磁感线,并标出磁体的N、S极.

