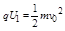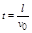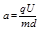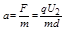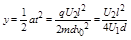向一价金属碘化物中加AgNO3溶液,到沉淀完全,生成硝酸盐质量是原碘化物质量,求原硝酸银质量分数
 jiang21132022-10-04 11:39:541条回答
jiang21132022-10-04 11:39:541条回答向一价金属的碘化物中逐滴滴加硝酸银溶液,直到沉淀完全为止,已知生成的硝酸盐溶液质量等于原碘化物溶液的质量,求原硝酸银溶液的质量分数?
为什么求原硝酸银溶液的质量分数要用 m 硝酸银的分子质量/m碘化银的分子质量 求质量分数不是溶质的分数除以溶液的分数吗?.、

已提交,审核后显示!提交回复
共1条回复
 tt公子 共回答了18个问题
tt公子 共回答了18个问题 |采纳率88.9%- 首先,把化学反应方程式写出来.假设这种一价金属是Na,NaI +AgNO3 ==NaNO3 +AgI 沉淀 生成的NaNO3溶液质量等于原NaI 溶液的质量,AgI是沉淀,所以这时溶液的质量就是NaNO3溶液的质量,得到AgNO3 溶液质量 == AgI 沉淀质量,原硝酸银溶液的质量分数= m 硝酸银/m硝酸银溶液 =m 硝酸银/mAgI 沉淀,为什么是分子质量,是因为物质的量之比等于物质的系数比,从化学反应方程式我们可以知道AgNO3和AgI 的系数比=它们的物质的量之比=1,意思是它们的物质的量相等.原硝酸银溶液的质量分数=m AgNO3/mAgI 沉淀=M*n(AgNO3)/M*n(AgI)=M(AgNO3)/M(AgI) 注:或者知道它们物质的量相等时我们一般可以用假设的方法,假设它们物质的量都等于1mol,这样也可以.
- 1年前
相关推荐
- 正二价镁离子半径与负一价氯离子半径比较
 说心事1年前3
说心事1年前3 -
 断翅v笨鸟 共回答了14个问题
断翅v笨鸟 共回答了14个问题 |采纳率85.7%原子半径:Mg > Cl
镁原子失去2个电子,变成镁离子,电子层比氯离子,少了一个,离子半径变小
离子半径:Mg 2+< Cl-1年前查看全部
- 丁硼烷结构我不明白的地方:丁烷是C4H10,硼比碳少一价,怎么还是B4H10?描述清楚一些啊,谢
 b1nm1年前1
b1nm1年前1 -
 东方抽水 共回答了19个问题
东方抽水 共回答了19个问题 |采纳率94.7%这可是大学无机化学的内容了.那么就我以B4H10(乙硼烷)的结构为例:,H,H,H,|,H,H,,⌒B⌒,/,B,|,B,,/,∪B∪,,H,H,|,H,H,H其分子中桥键如:第四排的B与第三B相连中间还夹着一个H第四排和第五排都存在桥键所以所以使...1年前查看全部
- 您好?我想问的是,写氯化钠的化学式时为什么只选氯元素的负一价?氯元素有几个化合价呀!
 elei11年前3
elei11年前3 -
 lw1q2w3e4r5t 共回答了18个问题
lw1q2w3e4r5t 共回答了18个问题 |采纳率100%因为钠只有+1价,所以在氯化钠中,氯为-1价.氯还可以为+5价1年前查看全部
- LI-AL/FES电池是一种正在开发的车在电池,该电池正极的电极反应式为2LI(正一价)+FES+2e(负一价)===L
LI-AL/FES电池是一种正在开发的车在电池,该电池正极的电极反应式为2LI(正一价)+FES+2e(负一价)===LI2S+FE 正确的是..( )
A.LI-AL在电池中作为负极材料,该材料中LI里的化合价为正一价
B.该电池总反应式为2LI+FES===LI2S+FE
C.负极的电极反应式为AL—3e(负一价)===AL(正三价)
D.FES在正极发生氧化反应
求 ...全 rl19341年前2
rl19341年前2 -
 阿英_2007 共回答了18个问题
阿英_2007 共回答了18个问题 |采纳率88.9%1、化学变化:生成了其它物质的变化
2、物理变化:没有生成其它物质的变化
3、物理性质:不需要发生化学变化就表现出来的性质
(如:颜色、状态、密度、气味、熔点、沸点、硬度、水溶性等)
4、化学性质:物质在化学变化中表现出来的性质
(如:可燃性、助燃性、氧化性、还原性、酸碱性、稳定性等)
5、纯净物:由一种物质组成
6、混合物:由两种或两种以上纯净物组成,各物质都保持原来的性质
7、元素:具有相同核电荷数(即质子数)的一类原子的总称
8、原子:是在化学变化中的最小粒子,在化学变化中不可再分
9、分子:是保持物质化学性质的最小粒子,在化学变化中可以再分
10、单质:由同种元素组成的纯净物
11、化合物:由不同种元素组成的纯净物
12、氧化物:由两种元素组成的化合物中,其中有一种元素是氧元素
13、化学式:用元素符号来表示物质组成的式子
14、相对原子质量:以一种碳原子的质量的1/12作为标准,其它原子的质量跟它比较所得的值
某原子的相对原子质量=
相对原子质量 ≈ 质子数 + 中子数 (因为原子的质量主要集中在原子核)
15、相对分子质量:化学式中各原子的相对原子质量的总和
16、离子:带有电荷的原子或原子团
17、原子的结构:
原子、离子的关系:
注:在离子里,核电荷数 = 质子数 ≠ 核外电子数
18、四种化学反应基本类型:
①化合反应: 由两种或两种以上物质生成一种物质的反应
如:A + B = AB
②分解反应:由一种物质生成两种或两种以上其它物质的反应
如:AB = A + B
③置换反应:由一种单质和一种化合物起反应,生成另一种单质和另一种化合物的反应
如:A + BC = AC + B
④复分解反应:由两种化合物相互交换成分,生成另外两种化合物的反应
如:AB + CD = AD + CB
19、还原反应:在反应中,含氧化合物的氧被夺去的反应(不属于化学的基本反应类型)
氧化反应:物质跟氧发生的化学反应(不属于化学的基本反应类型)
缓慢氧化:进行得很慢的,甚至不容易察觉的氧化反应
自燃:由缓慢氧化而引起的自发燃烧
20、催化剂:在化学变化里能改变其它物质的化学反应速率,而本身的质量和化学性在化学变化前后都没有变化的物质(注:2H2O2 === 2H2O + O2 ↑ 此反应MnO2是催化剂)
21、质量守恒定律:参加化学反应的各物质的质量总和,等于反应后生成物质的质量总和.
(反应的前后,原子的数目、种类、质量都不变;元素的种类也不变)
22、溶液:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物
溶液的组成:溶剂和溶质.(溶质可以是固体、液体或气体;固、气溶于液体时,固、气是溶质,液体是溶剂;两种液体互相溶解时,量多的一种是溶剂,量少的是溶质;当溶液中有水存在时,不论水的量有多少,我们习惯上都把水当成溶剂,其它为溶质.)
23、固体溶解度:在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量,就叫做这种物质在这种溶剂里的溶解度
24、酸:电离时生成的阳离子全部都是氢离子的化合物
如:HCl==H+ + Cl -
HNO3==H+ + NO3-
H2SO4==2H+ + SO42-
碱:电离时生成的阴离子全部都是氢氧根离子的化合物
如:KOH==K+ + OH -
NaOH==Na+ + OH -
Ba(OH)2==Ba2+ + 2OH -
盐:电离时生成金属离子和酸根离子的化合物
如:KNO3==K+ + NO3-
Na2SO4==2Na+ + SO42-
BaCl2==Ba2+ + 2Cl -
25、酸性氧化物(属于非金属氧化物):凡能跟碱起反应,生成盐和水的氧化物
碱性氧化物(属于金属氧化物):凡能跟酸起反应,生成盐和水的氧化物
26、结晶水合物:含有结晶水的物质(如:Na2CO3 .10H2O、CuSO4 . 5H2O)
27、潮某物质能吸收空气里的水分而变潮的现象
风化:结晶水合物在常温下放在干燥的空气里,
能逐渐失去结晶水而成为粉末的现象
28、燃烧:可燃物跟氧气发生的一种发光发热的剧烈的氧化反应
燃烧的条件:①可燃物;②氧气(或空气);③可燃物的温度要达到着火点.
基本知识、理论:
1、空气的成分:氮气占78%, 氧气占21%, 稀有气体占0.94%,
二氧化碳占0.03%,其它气体与杂质占0.03%
2、主要的空气污染物:NO2 、CO、SO2、H2S、NO等物质
3、其它常见气体的化学式:NH3(氨气)、CO(一氧化碳)、CO2(二氧化碳)、CH4(甲烷)、
SO2(二氧化硫)、SO3(三氧化硫)、NO(一氧化氮)、
NO2(二氧化氮)、H2S(硫化氢)、HCl(氯化氢)
4、常见的酸根或离子:SO42-(硫酸根)、NO3-(硝酸根)、CO32-(碳酸根)、ClO3-(氯酸)、
MnO4-(高锰酸根)、MnO42-(锰酸根)、PO43-(磷酸根)、Cl-(氯离子)、
HCO3-(碳酸氢根)、HSO4-(硫酸氢根)、HPO42-(磷酸氢根)、
H2PO4-(磷酸二氢根)、OH-(氢氧根)、HS-(硫氢根)、S2-(硫离子)、
NH4+(铵根或铵离子)、K+(钾离子)、Ca2+(钙离子)、Na+(钠离子)、
Mg2+(镁离子)、Al3+(铝离子)、Zn2+(锌离子)、Fe2+(亚铁离子)、
Fe3+(铁离子)、Cu2+(铜离子)、Ag+(银离子)、Ba2+(钡离子)
各元素或原子团的化合价与上面离子的电荷数相对应:课本P80
一价钾钠氢和银,二价钙镁钡和锌;
一二铜汞二三铁,三价铝来四价硅.(氧-2,氯化物中的氯为 -1,氟-1,溴为-1)
(单质中,元素的化合价为0 ;在化合物里,各元素的化合价的代数和为0)
5、化学式和化合价:
(1)化学式的意义:①宏观意义:a.表示一种物质;
b.表示该物质的元素组成;
②微观意义:a.表示该物质的一个分子;
b.表示该物质的分子构成;
③量的意义:a.表示物质的一个分子中各原子个数比;
b.表示组成物质的各元素质量比.
(2)单质化学式的读写
①直接用元素符号表示的:a.金属单质.如:钾K 铜Cu 银Ag 等;
b.固态非金属.如:碳C 硫S 磷P 等
c.稀有气体.如:氦(气)He 氖(气)Ne 氩(气)Ar等
②多原子构成分子的单质:其分子由几个同种原子构成的就在元素符号右下角写几.
如:每个氧气分子是由2个氧原子构成,则氧气的化学式为O2
双原子分子单质化学式:O2(氧气)、N2(氮气) 、H2(氢气)
F2(氟气)、Cl2(氯气)、Br2(液态溴)
多原子分子单质化学式:臭氧O3等
(3)化合物化学式的读写:先读的后写,后写的先读
①两种元素组成的化合物:读成“某化某”,如:MgO(氧化镁)、NaCl(氯化钠)
②酸根与金属元素组成的化合物:读成“某酸某”,如:KMnO4(高锰酸钾)、K2MnO4(锰酸钾)
MgSO4(硫酸镁)、CaCO3(碳酸钙)
(4)根据化学式判断元素化合价,根据元素化合价写出化合物的化学式:
①判断元素化合价的依据是:化合物中正负化合价代数和为零.
②根据元素化合价写化学式的步骤:
a.按元素化合价正左负右写出元素符号并标出化合价;
b.看元素化合价是否有约数,并约成最简比;
c.交叉对调把已约成最简比的化合价写在元素符号的右下角.
6、课本P73. 要记住这27种元素及符号和名称.
核外电子排布:1-20号元素(要记住元素的名称及原子结构示意图)
排布规律:①每层最多排2n2个电子(n表示层数)
②最外层电子数不超过8个(最外层为第一层不超过2个)
③先排满内层再排外层
注:元素的化学性质取决于最外层电子数
金属元素 原子的最外层电子数< 4,易失电子,化学性质活泼.
非金属元素 原子的最外层电子数≥ 4,易得电子,化学性质活泼.
稀有气体元素 原子的最外层有8个电子(He有2个),结构稳定,性质稳定.
7、书写化学方程式的原则:①以客观事实为依据; ②遵循质量守恒定律
书写化学方程式的步骤:“写”、“配”、“注”“等”.
8、酸碱度的表示方法——PH值
说明:(1)PH值=7,溶液呈中性;PH值7,溶液呈碱性.
(2)PH值越接近0,酸性越强;PH值越接近14,碱性越强;PH值越接近7,溶液的酸、碱性就越弱,越接近中性.
9、金属活动性顺序表:
(钾、钙、钠、镁、铝、锌、铁、锡、铅、氢、铜、汞、银、铂、金)
说明:(1)越左金属活动性就越强,左边的金属可以从右边金属的盐溶液中置换出该金属出来
(2)排在氢左边的金属,可以从酸中置换出氢气;排在氢右边的则不能.
(3)钾、钙、钠三种金属比较活泼,它们直接跟溶液中的水发生反应置换出氢气1年前查看全部
- 核外有10个电子的二价阳离子是什么?核外有18个电子的负一价阴离子.
 xiao55201年前1
xiao55201年前1 -
 泥泞留痕2 共回答了23个问题
泥泞留痕2 共回答了23个问题 |采纳率82.6%即失去2个电子还有10个,则原核外有10+2个电子,所以是镁.得到一个电子核外变成18个电子,则原核外有18-1个电子,是氯1年前查看全部
- 一秒钟内共有n个二价正离子和m个一价负离子通过面积为0.1平方米的某面积,求这个截面的电流强度?(求详解
 lao6tou1年前1
lao6tou1年前1 -
 76149174 共回答了14个问题
76149174 共回答了14个问题 |采纳率92.9%如果同向,电流是:[(2n-m)/0.1]/6.25*10^18=(2n-m)*1.6*10^(-18)
如果反向,同理可得电流是:
(2n+m)*1.6*10^(-18)1年前查看全部
- 3个硫酸根离子恰好将2个(XO4)负一价离子还原,则X元素在还原产物中的化合价是多少?
3个硫酸根离子恰好将2个(XO4)负一价离子还原,则X元素在还原产物中的化合价是多少?
如题. PS:“(XO4)负一价”里面4是下标. 题目简略过程高一的我能看懂. 鞠躬,谢谢.
 yuwenyao_20001年前1
yuwenyao_20001年前1 -
 lanjiaguang2008 共回答了16个问题
lanjiaguang2008 共回答了16个问题 |采纳率87.5%根据得失电子守恒可得出+2价1年前查看全部
- 氢元素为什么只显一价有时显正一价,有时显负一价,是跟电子数有关吗?
 41000181年前3
41000181年前3 -
 ryan_zyw 共回答了18个问题
ryan_zyw 共回答了18个问题 |采纳率94.4%因为它最外层(只有一层电子)电子只有一个,失去就显正一价,而最内层电子最多为2个,所以得到电子是只得1个就显负一价了.1年前查看全部
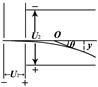
- (2010•天津模拟)如图所示,真空中有一个固定的点电荷,电荷量为+Q,虚线表示该点电荷电场中的等势面.两个一价离子M、
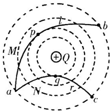 (2010•天津模拟)如图所示,真空中有一个固定的点电荷,电荷量为+Q,虚线表示该点电荷电场中的等势面.两个一价离子M、N(不计重力和它们之间的电场力)先后从a点以相同的速率v0射入该电场,运动轨迹分别为曲线a→b和a→c,其中b、c两点在同一等势面上,p、q分别是它们离固定点电荷最近的位置.下列说法中正确的是( )
(2010•天津模拟)如图所示,真空中有一个固定的点电荷,电荷量为+Q,虚线表示该点电荷电场中的等势面.两个一价离子M、N(不计重力和它们之间的电场力)先后从a点以相同的速率v0射入该电场,运动轨迹分别为曲线a→b和a→c,其中b、c两点在同一等势面上,p、q分别是它们离固定点电荷最近的位置.下列说法中正确的是( )
A.M、N都是正离子
B.M在p点的速率小于N在q点的速率
C.M从a→b的电势能先减小后增大
D.M从p→b过程电场力做的功等于N从a→q过程电场力做的功 yjy01111年前1
yjy01111年前1 -
 转基因人类 共回答了13个问题
转基因人类 共回答了13个问题 |采纳率76.9%解题思路:根据轨迹判定电荷N受到中心电荷的斥力,而电荷M受到中心电荷的引力,可知两粒子在从a向b、c运动过程中电场力做功情况.根据abc三点在同一等势面上,可判定从a到b和从a到c过程中电场力所做的总功为零.A、由图可知电荷N受到中心电荷+Q的斥力,而电荷M受到中心电荷+Q的引力,故两粒子的电性一定不同.由于中心电荷为正电,则M一定是负离子,N一定是正离子,故A错误;
B、由图可判定M电荷在运动过程中,电场力做正功,导致动能增加;而N电荷在运动过程中,电场力做负功,导致动能减小.所以在p点的速率一定大于N在q点的速率,故B错误;
C、电场力对M离子先做正功后做负功,则M从a→b的电势能先减小后增大.故C正确.
D、由图可知:p、b间电势差小于a、q间电势差,根据电场力做功W=Uq知,M从p→b过程电场力做的功小于N从a→q过程电场力做的功.故D错误.
故选C点评:
本题考点: 电势能;物体做曲线运动的条件;动能定理的应用.
考点点评: 根据轨迹判定“电荷N受到中心电荷的斥力,而电荷M受到中心电荷的引力”是解决本题的突破口.1年前查看全部
- 某电解池,如果在1s内共有5×1018个二价正离子和1×1019个一价负离子通过面积为0.1m2的某截面,那么通过这个截
某电解池,如果在1s内共有5×1018个二价正离子和1×1019个一价负离子通过面积为0.1m2的某截面,那么通过这个截面的电流是( )
A. 0
B. 0.8A
C. 1.6A
D. 3.2A shww0428851年前2
shww0428851年前2 -
 我来深圳干吗 共回答了25个问题
我来深圳干吗 共回答了25个问题 |采纳率88%解题思路:由题计算出1s内通过截面正离子与负离子电量绝对值之和,根据电流的定义式求解电流.一价离子所带电量大小为e=1.6×10-19C.由题,1s内通过截面正离子的电量为q1=2n1e,负离子的电量绝对值为q2=n2e,则电流为I=
q1+q2
t=
(2n1+n2)e
t,将n1=5×1018个,n2=1×1019个,e=1.6×10-19C代入解得,I=3.2A
故选D点评:
本题考点: 电流、电压概念.
考点点评: 本题是电流定义式的应用,关键确定通过导体截面的电量,当电流由正负离子向相反方向定向移动形成时,电量等于正离子与负离子电量绝对值之和.1年前查看全部
- 老师说过氧化钠是钠离子和过氧根离子组成的 过氧根离子是负一价为什么还需要两个钠离子 这样子的话电子数就没办法为零啦
 xiaoqin19921年前1
xiaoqin19921年前1 -
 sun198385 共回答了18个问题
sun198385 共回答了18个问题 |采纳率94.4%1年前查看全部
- 如图所示,真空中有一个固定的点电荷,电荷量为+Q.图中的虚线表示该点电荷形成的电场中的等势面.有两个一价离子M、N(不计
如图所示,真空中有一个固定的点电荷,电荷量为+Q.图中的虚线表示该点电荷形成的电场中的等势面.有两个一价离子M、N(不计重力,也不计它们之间的电场力)先后从a点以相同的速率v0射入该电场,运动轨迹分别为曲线apb和aqc,其中p、q分别是它们离固定点电荷最近的位置.以下说法正确的是( )
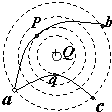 A. M是负离子,N是正离子
A. M是负离子,N是正离子
B. a→p→b过程中电场力先做负功再做正功
C. M在b点的速率大于N在c的速率
D. M从p→b过程中电势能的增量小于N从a→q电势能的增量 hyb6661年前2
hyb6661年前2 -
 5203000 共回答了18个问题
5203000 共回答了18个问题 |采纳率83.3%解题思路:根据轨迹判定电荷N受到中心电荷的斥力,而电荷M受到中心电荷的引力,可知两粒子在从a向b、c运动过程中电场力做功情况.根据abc三点在同一等势面上,可判定从a到b和从a到c过程中电场力所做的总功为零.A、由图可知电荷N受到中心电荷的斥力,而电荷M受到中心电荷的引力,故两粒子的电性一定不同.由于中心电荷为正电,则M一定是负离子,N一定是正离子,故A正确;
B、由图可判定M电荷在a→p→b运动过程中,先是动力,后是阻力,则电场力先做正功,后做负功,故B错误;
C、由于abc三点在同一等势面上,故粒子M在从a向b运动过程中电场力所做的总功为0,N粒子在从a向c运动过程中电场力所做的总功为0.由于两粒子以相同的速率从a点飞入电场故两粒子的分别经过b、c两点时的速率一定相等.故C错误.
D、由图可知q点离正电荷更近一些,N粒子在从a向q运动过程中电场力做负功的值大于粒子M在从p向b运动过程中电场力做负功的值,故M从p→b过程电势能的增量一定小于N从a→q电势能的增量.故D正确.
故选:AD.点评:
本题考点: 等势面;电势能.
考点点评: 根据轨迹判定“电荷N受到中心电荷的斥力,而电荷M受到中心电荷的引力”是解决本题的突破口.1年前查看全部
- H O S 三种元素可形成甲、乙两种粒子,它们均为负一价双原子阴离子且甲有18个电子,乙有10个电子,则%
H O S 三种元素可形成甲、乙两种粒子,它们均为负一价双原子阴离子且甲有18个电子,乙有10个电子,则%
RT
RT:H O S 三种元素可形成甲、乙两种粒子,它们均为负一价双原子阴离子且甲有18个电子,乙有10个电子,则甲和乙反应的离子方程式 abcdefg9871年前4
abcdefg9871年前4 -
 aoeitlaetjo 共回答了17个问题
aoeitlaetjo 共回答了17个问题 |采纳率94.1%知道了是负一价阴离子,且为双原子,就可知,这甲、乙两种粒子分别是HS根和OH根.
为什么这么说?负一价,说明两个粒子都是多一个电子,除去这个多余的电子,那甲、乙两种粒子就成为不带电的双原子组合,一种组合的双原子带17个电子,另一个组合带9个电子,至此,这更象一道数学题了!
H 带一个电子,S带16个电子,O带8个电子
显然这两个组合是HS和OH组合,再加上一个负一价符号,就出来了!
方程式:HS- + OH- =H20 +S 2-1年前查看全部
- 钾钠银氢正一价,钙镁钡锌正二价;铝是正三氧负二,氯负一价最常见;硫有负二正四六,
钾钠银氢正一价,钙镁钡锌正二价;铝是正三氧负二,氯负一价最常见;硫有负二正四六,
正二正三铁可变;正一二铜二四碳,单质零价永不变;
其它元素有变价,先死后活来计算.
只解释最后一句就行了:其它元素有变价,先死后活来计算。 missph1年前3
missph1年前3 -
 danielcai303 共回答了17个问题
danielcai303 共回答了17个问题 |采纳率82.4%这个公式用来解释化合价常见价态,用于确定某一个物质中元素的比例,确定相应的化学式1年前查看全部
- 疑难解答——羟基羟基是中性的吗?如果是,那为什么又说是一价原子团?(我才刚念完初中,麻烦解释得清楚些,不甚感激!)
 fsdaf54d4d541年前5
fsdaf54d4d541年前5 -
 wxdwxd2006 共回答了17个问题
wxdwxd2006 共回答了17个问题 |采纳率100%羟基和氢氧根离子的概念是不同的.
氢氧根离子写作OH-,带有1个单元负电荷.氢氧根离子核外总电子数为10.
羟基写作-OH,其中“-”表示半个共价键,他的意思是,一个羟基能够和另一个原子生成一个共价键,所以称为一价原子团.羟基中,氢原子和氧原子形成一个共价键,氧原子还有未成对电子.羟基不带电,核外总电子数为9.1年前查看全部
- 把下列离子方程式改写为化学方程式SO2+2OH负一价====SO3负二价+H2O
 sukaling1年前1
sukaling1年前1 -
 yan13784787913 共回答了22个问题
yan13784787913 共回答了22个问题 |采纳率68.2%2MOH+SO2(少量)=M2SO3+H2O
M代表碱金属离子,如Na+,K+等1年前查看全部
- 谁来帮我解一道物理题?急用!某电解池,如果在1S内共有5乘以10的18次方个二价正离子和1乘以10的19次方个一价负离子
谁来帮我解一道物理题?急用!
某电解池,如果在1S内共有5乘以10的18次方个二价正离子和1乘以10的19次方个一价负离子通过某截面,那么通过这截面的电流是?
用什么知识解决?什么公式?这是高中题不要用大学知识解决!) 爱你没一天1年前1
爱你没一天1年前1 -
 武猪脸cc 共回答了14个问题
武猪脸cc 共回答了14个问题 |采纳率85.7%I=Q/t=(Q正-Q负)/t=(N正*e-N负*(-e))/t=((N正+N负)*e/t=((5*10^18*2+1*10^19)*1.6*10^-19/1)A=3.2A
N是离子个数,e是电子/质子电量.大小是1.6*10^-191年前查看全部
- 工业盐酸中因含有正3价Fe而呈黄色.若某工业盐酸中一价H、负一价Cl的个数比为91:94
工业盐酸中因含有正3价Fe而呈黄色.若某工业盐酸中一价H、负一价Cl的个数比为91:94
工业盐酸中因含有正3价Fe而呈黄色.若某工业盐酸中一价H、负一价Cl的个数比为91:94,则该盐酸中三价Fe和负一价Cl的个数比为? 桃子呼呼1年前1
桃子呼呼1年前1 -
 cbowroad 共回答了13个问题
cbowroad 共回答了13个问题 |采纳率92.3%∵一价H、负一价Cl的个数比为91:94
设有91x个H+和94x个Cl-,则91个H+带有91个单位的正电荷;94个Cl-带有94个单位的负电荷;由于溶液呈电中性,所以剩下的94-91=3个单位的正电荷由Fe3+承担,由于铁+3价,所以只需一个,
因此可得三价Fe和负一价Cl的个数比1:941年前查看全部
- )A、B、C、D、E五种短周期元素的原子序数依次增大.元素A的负一价离子具有和稀有气体He一样的结构,元素B的最外层电子
)A、B、C、D、E五种短周期元素的原子序数依次增大.元素A的负一价离子具有和稀有气体He一样的结构,元素B的最外层电子数是内层电子总数的2倍,元素C是短周期元素中原子半径最大的主族元素,元素D在地壳中的含量位于第二位,元素E的单质是黄绿色气体.请回答下列问题:
(1)在周期表中,元素B位于第 周期第族;A与C形成的离子化合物的化学式为;
A与C形成的离子化合物与水反应的化学方程式为.
(2)C形成的简单离子的离子结构示意图为.
(3)D、E元素形成的化合物可与水反应生成一种沉淀和一种气体,试写出该反应的化学方程式:.
(4)B的单质能与NaOH溶液反应,写出反应的离子方程式:. 大kk袍1年前0
大kk袍1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 如图所示,一价氢离子和二价氦离子(不考虑二者间的相互作用),从静止开始经过同一加速电场加速,垂直打入偏转电场中,则它们(
如图所示,一价氢离子和二价氦离子(不考虑二者间的相互作用),从静止开始经过同一加速电场加速,垂直打入偏转电场中,则它们( ) A.同时离开偏转电场,但出射点的位置不同 B.同时离开偏转电场,出射点的位置相同 C.先后离开偏转电场,但出射点的位置相同 D.先后离开偏转电场,且出射点的位置不同 
 轮子上的人1年前1
轮子上的人1年前1 -
 江南_万事 共回答了16个问题
江南_万事 共回答了16个问题 |采纳率87.5%设加速电压为U 1 ,偏转电压为U 2 ,偏转极板的长度为L,板间距离为d.
在加速电场中,由动能定理得:qU 1 =
1
2 m v 0 2 得,加速获得的速度为v 0 =
2q U 1
m ,两种粒子在偏转电场中,水平方向做速度为v 0 的匀速直线运动,由于两种粒子的比荷不同,则v 0 不同,所以两粒子在偏转电场中运动的时间不同.两种粒子在加速电场中的加速度不同,位移相同,则运动的时间也不同,所以两粒子是先后离开偏转电场.
在偏转电场中的偏转位移y=
1
2 a t 2 =
1
2 ?
q U 2
md
L 2
v 0 2 =
U 2 L 2
4d U 1 ,与电荷的电量和质量无关.知出射点的位置相同.故C正确,A、B、D错误.
故选C.1年前查看全部
- 电解质溶液中电解质溶液中有n个一价正离子
电解质溶液中电解质溶液中有n个一价正离子
若电解质溶液中有n个一价正离子和n个一价负离子反向移动,则负价离子也为电流的形成作出了贡献,则在t秒内电解质中的电流为2ne/t.
但是若题目说:在t秒内,有n个一价正离子回到负极,则电解质溶液中的电流是多少?
(答案说是ne/t)
若是某探测器因射线照射其内部气体电离,t秒内有n个二价正离子到阴极,2n个电子到阳极,则此探测器中电流为?(答案说是4ne/t) tianfangke1年前2
tianfangke1年前2 -
 kimiko0519 共回答了22个问题
kimiko0519 共回答了22个问题 |采纳率100%可以用转化法,把负电看为不带电,相应的,正电荷的量要增加.比如说,n个一价正离子和n个一价负离子反向移动,相当于没有负电,而2n个正电在移动.但是要注意方向,负电和正电的方向相反才能增加,相同就减少了.1年前查看全部
- 有四种物质的量浓度相等、且都由一价阳离子A+和B+及一价阴离子X-和Y-组成的盐溶液.据测定常温下AX和BY溶液的pH=
有四种物质的量浓度相等、且都由一价阳离子A+和B+及一价阴离子X-和Y-组成的盐溶液.据测定常温下AX和BY溶液的pH=7,AY溶液的pH>7,BX溶液的pH<7,由此判断不水解的盐是( )
A.BX
B.AX
C.AY
D.BY feiyunsong1年前1
feiyunsong1年前1 -
 阿_萌 共回答了28个问题
阿_萌 共回答了28个问题 |采纳率92.9%解题思路:AY溶液的PH>7,显碱性,说明A相对于Y为强碱性物质,Y相对于A来说属弱酸性物质;同理BX溶液的pH<7,X为强酸性物质,B为弱碱性物质;不能水解,意味着是由强酸和强碱组成的物质,组成只有一种,即AX;AY溶液的PH>7,显碱性,说明A相对于Y为强碱性物质,Y相对于A来说属弱酸性物质;同理BX溶液的pH<7,X为强酸性物质,B为弱碱性物质;据测定常温下AX和BY溶液的pH=7,说明BY是弱离子写成的弱酸弱碱盐且水解程度相同,溶液呈中性,AX为强酸强碱盐不能水解,由强酸和强碱组成的物质,组成只有一种,即AX;
故选B.点评:
本题考点: 盐类水解的原理.
考点点评: 本题考查盐类水解的规律应用,溶液酸碱性的判断能水解离子的分析是解题关键,题目难度中等.1年前查看全部
- 一道高中化学概念理解题.为什么碳化钙里碳的化合价为负一价?
 2708191年前1
2708191年前1 -
 smartbaby1113 共回答了17个问题
smartbaby1113 共回答了17个问题 |采纳率94.1%钙的金属性很强,只能是正2价的1年前查看全部
- 氢氧根化学键的问题.氢氧根不是通过共价键而生成的吗?怎么会显负一价?它是离子化合物还是共价化合物?
 永远抹不去的伤痕1年前3
永远抹不去的伤痕1年前3 -
 yy与无双 共回答了11个问题
yy与无双 共回答了11个问题 |采纳率72.7%氢氧根是通过共价键结合在一起的,氧的最外层电子数为6,氢的最外层电子数为1,它们通过共用电子对结合在一起,但还缺少一个电子,氧要达到8电子结构,所以从外界得到一个电子,整个离子团就带一个单位的负电荷.1年前查看全部
- 一价烷烃基结构简式是什么啊 什么叫一价烷烃基
 renzhankk1年前2
renzhankk1年前2 -
 christoph_sun 共回答了9个问题
christoph_sun 共回答了9个问题 |采纳率77.8%-CH3就是一价烷烃基1年前查看全部
- 如图所示,一价氢离子和二价氦离子(不考虑二者间的相互作用),从静止开始经过同一加速电场加速,垂直打入偏转电场中,则它们(
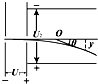 如图所示,一价氢离子和二价氦离子(不考虑二者间的相互作用),从静止开始经过同一加速电场加速,垂直打入偏转电场中,则它们( )
如图所示,一价氢离子和二价氦离子(不考虑二者间的相互作用),从静止开始经过同一加速电场加速,垂直打入偏转电场中,则它们( )
A.同时离开偏转电场,但出射点的位置不同
B.同时离开偏转电场,出射点的位置相同
C.先后离开偏转电场,但出射点的位置相同
D.先后离开偏转电场,且出射点的位置不同 junlong5211年前1
junlong5211年前1 -
 梦幻现在 共回答了20个问题
梦幻现在 共回答了20个问题 |采纳率85%设加速电压为U1,偏转电压为U2,偏转极板的长度为L,板间距离为d.
在加速电场中,由动能定理得:qU1=
1
2mv02得,加速获得的速度为v0=
2qU1
m,两种粒子在偏转电场中,水平方向做速度为v0的匀速直线运动,由于两种粒子的比荷不同,则v0不同,所以两粒子在偏转电场中运动的时间不同.两种粒子在加速电场中的加速度不同,位移相同,则运动的时间也不同,所以两粒子是先后离开偏转电场.
在偏转电场中的偏转位移y=
1
2at2=
1
2•
qU2
md
L2
v02=
U2L2
4dU1,与电荷的电量和质量无关.知出射点的位置相同.故C正确,A、B、D错误.
故选C.1年前查看全部
- Y和Z两种元素可以形成4核42个电子的负一价阴离子.
 再见蓝鸟1年前1
再见蓝鸟1年前1 -
 冰-雪-儿 共回答了23个问题
冰-雪-儿 共回答了23个问题 |采纳率73.9%4个原子1年前查看全部
- sihcl3的化合价问题SiHCl3中硅是几价的?氢是几价的?如果氢是负一价是否是因为硅的金属性太强?
 传说中的尤太人1年前2
传说中的尤太人1年前2 -
 chen0324 共回答了15个问题
chen0324 共回答了15个问题 |采纳率93.3%氢只有和碱金属化合时是-1价,这里是+1价,而Cl是-1价,硅是+2价.
化合价是高中问题,在大学化学中是只谈氧化数而不谈化合价的.1年前查看全部
- 钾离子和氯离子(负一价)哪个半径大?为什么?
 solgen1年前1
solgen1年前1 -
 秋林就是迷人 共回答了17个问题
秋林就是迷人 共回答了17个问题 |采纳率94.1%氯离子大,核外电子数相同,钾离子质子数多,对核外电子的引力大,所以半径比氯离子小1年前查看全部
- 为什么氢元素可以形成一价氢离子不是要核外2个电子才能稳定吗.
 wpym5d8rc65061年前2
wpym5d8rc65061年前2 -
 易水萧 共回答了15个问题
易水萧 共回答了15个问题 |采纳率86.7%你理解错了,不只是2e- 8e-结构才稳定,还有0 ,6 ,10等电子也是稳定结构,如H- (NaH)是0e-稳定结构,BF3中B就是6e-稳定结构,PCl5中P是10e-稳定结构.
氢元素中的氢原子最外层有一个电子,它可以得一个电子或共用一对电子达到2e-稳定结构;也可以失去一个电子达到0e-稳定结构,所以氢离子有:H- 和H+.1年前查看全部
- 向一价金属的碘化物向一价金属碘化物中加AgNO3溶液,到沉淀完全,生成硝酸盐质量是原碘化物质量,求原硝酸银质量分数 为什
向一价金属的碘化物
向一价金属碘化物中加AgNO3溶液,到沉淀完全,生成硝酸盐质量是原碘化物质量,求原硝酸银质量分数 为什么是两分子量之比?、 yutaiyuan1年前1
yutaiyuan1年前1 -
 舞青云 共回答了18个问题
舞青云 共回答了18个问题 |采纳率100%溶液质量就是:108+127(沉淀的质量)
溶质质量就是:108+62(产生沉淀需要的溶质)1年前查看全部
- 某电解池,如果在1s内共有5×1018个二价正离子和1×1019个一价负离子通过面积为0.1m2的某截面,那么通过这个截
某电解池,如果在1s内共有5×1018个二价正离子和1×1019个一价负离子通过面积为0.1m2的某截面,那么通过这个截面的电流是
请详细分析具体原因
即电解池为何这样算的具体原因 xhanz1年前1
xhanz1年前1 -
 带刺的蚂蚁 共回答了15个问题
带刺的蚂蚁 共回答了15个问题 |采纳率93.3%解析:根据公式I=Q/t,可以运算
Q=(5×10^18+1×10^19)*1.6×10^-19=2.4库
t=1s,所以I=2.4安1年前查看全部
- 请教负一价碘离子是什么颜色?
 易寅1年前1
易寅1年前1 -
 言弈 共回答了16个问题
言弈 共回答了16个问题 |采纳率93.8%无色.加碘食盐中加有KI,你看看不是没颜色么!有时KI会被氧化生成碘单质,使食盐发黄.1年前查看全部
- 银氨的化学式有问题啊银氨的化学式是 Ag(NH3)2OH那如果银是+1价, NH3是+1价 OH是负一价那总的化合价是+
银氨的化学式有问题啊
银氨的化学式是 Ag(NH3)2OH
那如果银是+1价, NH3是+1价 OH是负一价
那总的化合价是+2不对了啊 怎么回事?
 lchy8881年前1
lchy8881年前1 -
 蜻蜓咬尾巴 共回答了17个问题
蜻蜓咬尾巴 共回答了17个问题 |采纳率94.1%NH3 是化合物,不显价态的.为01年前查看全部
- 双氧水中为什么氧元素显负一价?
 维嘉思U21年前2
维嘉思U21年前2 -
 angeryhuang 共回答了10个问题
angeryhuang 共回答了10个问题 |采纳率100%首先,LZ的问题表述有点问题,双氧水是过氧化氢(H2O2)的水溶液,是混合物.
H2O2分子结构式:H-O-O-H(实际是空间折线形分子).
H和O元素结合,共价键中电子对偏向O,因此H+1价,O-1价.
过氧键O-O是非极性键,电子对不偏向任何一方,对化合价的贡献是0.
2个H都为+1价,2个O都为-1价.因此总体来看,平均价态H为+1价,O为-1价.
====
[原创回答团]1年前查看全部
- 过氧化氢中的氧元素为何显示负一价?
过氧化氢中的氧元素为何显示负一价?
我们都知道,在学习化学变化时,要用到化学方程式和化学式.
一般我们所写的化学式中氧元素通常显示负二价,
但为什么在过氧化氢中氧元素显示的是负一价? 海外游客之傲视1年前1
海外游客之傲视1年前1 -
 zxp633696 共回答了17个问题
zxp633696 共回答了17个问题 |采纳率94.1%过氧根是一个整体 他们一起显负二价 一般不拆开看的...1年前查看全部
- 为什么双氧中氧元素是负一价?
 埃芬1年前4
埃芬1年前4 -
 seatlenight 共回答了20个问题
seatlenight 共回答了20个问题 |采纳率85%不是氧元素为-1价,而是过氧离子为-2价(O2^2-),两个氧原子呈共价态,对外显-2价.还有超氧离子是-1价(O2^-),你能说氧元素呈-0.5价吗?1年前查看全部
- 1mol FeCl3能电离生成3价铁离子物质的量为多少?负一价Cl离子物质的量为多少?
 失魂的公主1年前4
失魂的公主1年前4 -
 ji168 共回答了15个问题
ji168 共回答了15个问题 |采纳率93.3%1mol FeCl3能电离生成3价铁离子物质的量为1mol?负一价Cl离子物质的量为3mol?1年前查看全部
- 如右图所示,一价氢离子和二价氦离子(不考虑二者间的相互作用),从静止开始经过同一加速电场加速,垂直打入偏转电场中,则它们
如右图所示,一价氢离子和二价氦离子(不考虑二者间的相互作用),从静止开始经过同一加速电场加速,垂直打入偏转电场中,则它们()

A.同时离开偏转电场,但出射点的位置不同 B.同时离开偏转电场,出射点的位置相同 C.先后离开偏转电场,但出射点的位置相同 D.先后离开偏转电场,且出射点的位置不同  stonegyy1年前1
stonegyy1年前1 -
 冰随风飘 共回答了14个问题
冰随风飘 共回答了14个问题 |采纳率85.7%1年前查看全部
- NH4HCO3 NaHCO3 Na2CO3三种溶液中负一价阴离子的浓度由大到小的顺序为?
NH4HCO3 NaHCO3 Na2CO3三种溶液中负一价阴离子的浓度由大到小的顺序为?
氢氧根除外. duckweed9151年前1
duckweed9151年前1 -
 makeliuma 共回答了21个问题
makeliuma 共回答了21个问题 |采纳率95.2%碳酸氢根 NaHCO3>NH4HCO3>Na2CO3
首先前两种物质HCO3-是主要的,Na2CO3主要含CO3 2-
NH4+ 会促进HCO3-水解
所以
碳酸氢根 NaHCO3>NH4HCO3>Na2CO31年前查看全部
- 在S(负二价) Fe(正三价 )Fe(正二价) Mg (正二价)S CL(负一价) H(正一价) SO2 Fe HCL
在S(负二价) Fe(正三价 )Fe(正二价) Mg (正二价)S CL(负一价) H(正一价) SO2 Fe HCL
在S(负二价) Fe(正三价 )Fe(正二价) Mg (正二价) S CL(负一价) H(正一价) SO2 Fe HCL 十个粒子中只有氧化性的是 只有还原性的是?既有氧化性又有还原性的是? 兰色知更鸟1年前1
兰色知更鸟1年前1 -
 缺点很多 共回答了23个问题
缺点很多 共回答了23个问题 |采纳率100%失电子的显示还原性,的电子的显示氧化性.
只有氧化性就是说不能再失去电子,只有还原性就是说不能再得到电子,呈现最高价态.既有氧化性又有还原性就是既能再得到电子,也还能再失去电子,呈现最低价态.
所以答案是:
只有氧化性的:Fe(正三价 )Mg (正二价)H(正一价)
只有还原性的:S(负二价) CL(负一价)
既有氧化性又有还原性的是:Fe(正二价 S SO2 Fe HCL1年前查看全部
- 某一电解池,如果在1秒内共有5×10^18个二价正离子和1×10^19个一价负离子通过某一横截面,则通过这个截面的电流强
某一电解池,如果在1秒内共有5×10^18个二价正离子和1×10^19个一价负离子通过某一横截面,则通过这个截面的电流强度是( )
 tiki为乐1年前2
tiki为乐1年前2 -
 tq0bv95 共回答了23个问题
tq0bv95 共回答了23个问题 |采纳率82.6%I=Q/T,其中Q=【5×10^18×2+1×10^19】×e,《e是每个电子的电量,我忘了》.
一楼的,两种电荷的方向当然是相反,因是电解池.1年前查看全部
- 向一价金属碘化物中加AgNO3溶液,到沉淀完全,生成硝酸盐质量是原碘化物质量,求原硝酸银质量分数
向一价金属碘化物中加AgNO3溶液,到沉淀完全,生成硝酸盐质量是原碘化物质量,求原硝酸银质量分数
向一价金属的碘化物中逐滴滴加硝酸银溶液,直到沉淀完全为止,已知生成的硝酸盐溶液质量等于原碘化物溶液的质量,求原硝酸银溶液的质量分数? oo下1年前1
oo下1年前1 -
 嗅-嗅 共回答了15个问题
嗅-嗅 共回答了15个问题 |采纳率93.3%设未知金属为X
化学式为:XI+AgNO3=AgI(沉淀)+XNO3
则:XI溶液+AgNO3溶液-AgI=XNO3溶液
因为XI溶液=XNO3溶液,所以推出AgNO3溶液=AgI
所以AgNO3溶液中AgNO3的质量分数为:
170除以235=72.3%1年前查看全部
- 化学价的口诀,请看看有没有错?正一价:K Na Ag H NH-负一价:F Cl Br OH- NO-正二价:Ga Mg
化学价的口诀,请看看有没有错?
正一价:K Na Ag H NH-
负一价:F Cl Br OH- NO-
正二价:Ga Mg Ba Zn
负二价:O S SO- CO-
3Al 4Si 5N P 1、2Cu 2、3Fe 2、4碳 我几乎背这个口诀背了三年了,可是今天突然被指有错误,帮我纠正一下. 一缕相思谁能懂1年前3
一缕相思谁能懂1年前3 -
 korla99l 共回答了18个问题
korla99l 共回答了18个问题 |采纳率94.4%ms没有错啊,当然,肯定是有遗漏的
比如说S,也是+4.+6.-2
别听别人胡说,这个是对的,而且很多中学不要求掌握的告诉你了也会混
那个人也不知道Fe也可以是+6价吧,况且你知道了也没用
以后会学到的,就等以后再记,现在学这些绝对够了1年前查看全部
- 如图所示,真空中有一个固定的点电荷,电荷量为+Q,虚线表示该点电荷电场中的等势面.两个一价离子M、N(不计重力和它们之间
如图所示,真空中有一个固定的点电荷,电荷量为+Q,虚线表示该点电荷电场中的等势面.两个一价离子M、N(不计重力和它们之间的电场力)先后从a点以相同的速率v 0 射入该电场,运动轨迹分别为曲线a→b和a→c,其中b、c两点在同一等势面上,p、q分别是它们离固定点电荷最近的位置.下列说法中正确的是( ) A.M、N都是正离子 B.M在p点的速率小于N在q点的速率 C.M从a→b的电势能先减小后增大 D.M从p→b过程电场力做的功等于N从a→q过程电场力做的功 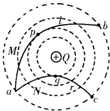
 爱在生vv边缘1年前1
爱在生vv边缘1年前1 -
 只要rr不要快乐 共回答了24个问题
只要rr不要快乐 共回答了24个问题 |采纳率95.8%A、由图可知电荷N受到中心电荷+Q的斥力,而电荷M受到中心电荷+Q的引力,故两粒子的电性一定不同.由于中心电荷为正电,则M一定是负离子,N一定是正离子,故A错误;
B、由图可判定M电荷在运动过程中,电场力做正功,导致动能增加;而N电荷在运动过程中,电场力做负功,导致动能减小.所以在p点的速率一定大于N在q点的速率,故B错误;
C、电场力对M离子先做正功后做负功,则M从a→b的电势能先减小后增大.故C正确.
D、由图可知:p、b间电势差小于a、q间电势差,根据电场力做功W=Uq知,M从p→b过程电场力做的功小于N从a→q过程电场力做的功.故D错误.
故选C1年前查看全部
- 甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,戊的负一价阴离子与丙的阳离
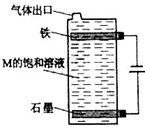 甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,戊的负一价阴离子与丙的阳离子差8个电子.甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1mol/L的Y溶液pH>1;丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐L也能与Z的水溶液反应生成盐;丙、戊可组成化合物M.请回答下列问题:
甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,戊的负一价阴离子与丙的阳离子差8个电子.甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1mol/L的Y溶液pH>1;丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐L也能与Z的水溶液反应生成盐;丙、戊可组成化合物M.请回答下列问题:
(1)戊离子的结构示意图为______.
(2)写出由甲乙两元素形成的化合物中,既含有极性键又含有非极性键的物质的结构式______;该物质与空气在碱性条件下可构成燃料电池,该电池放电时,负极的反应式为______.
(3)戊的单质与X反应生成的Y和Z的物质的量之比为2:4,反应中被氧化的物质与被还原的物质的物质的量之比为______.
(4)写出少量Z的稀溶液滴入过量L的稀溶液中发生反应的离子方程式:______.
(5)按如图电解M的饱和溶液,写出该电解池中发生反应的总反应方程式:NaCl+H2O
NaClO+H2↑电解 .NaCl+H2O.将充分电解后所得溶液逐滴加入到酚酞试液中,观察到得现象是______.
NaClO+H2↑电解 . longyan1111年前1
longyan1111年前1 -
 zxcdxj 共回答了13个问题
zxcdxj 共回答了13个问题 |采纳率92.3%甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝,则X为NH3,甲为H,乙为N;甲、丙处于同一主族,结合原子序数可知,丙为Na;戊的负一价阴离子与丙的阳离子差8个电子,戊的负一价阴离子核外电子数为18,则戊为Cl;氯气与氨气反应生成氮气,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1mol/L的Y溶液pH>1,则Y为NH4Cl、Z为HCl;丁的单质既能与丙(Na)元素最高价氧化物的水化物的溶液反应生成盐L,也能与Z(HCl)的水溶液反应生成盐N,丁为两性金属,则丁为Al元素,故L为NaAlO2;丙、戊组成化合物M为NaCl,用石墨作阳极、铁作阴极,电解氯化钠水溶液,生成氢气、氯气与氢氧化钠,氯气与氢氧化钠反应生成氯化钠与次氯酸钠,
(1)Cl-的结构示意图为: ,故答案为:
,故答案为: ;
;
(2)H、N两元素形成的化合物中,既含有极性键又含有非极性键的物质为N2H4,其结构式为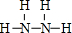 ,负极反应氧化反应,N2H4在负极失去电子,碱性条件下生成氮气与水,负极电极反应式为N2H4+4OH--4e-=N2↑+2H2O,
,负极反应氧化反应,N2H4在负极失去电子,碱性条件下生成氮气与水,负极电极反应式为N2H4+4OH--4e-=N2↑+2H2O,
故答案为: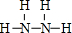 ;N2H4+4OH--4e-=N2↑+2H2O;
;N2H4+4OH--4e-=N2↑+2H2O;
(3)氯气与氨气反应生成的NH4Cl和HCl的物质的量之比为2:4,则NH3与Cl2反应的化学方程式:4NH3+3Cl2═N2+2NH4Cl+4HCl,在反应中氨气做还原剂,氯气做氧化剂,被氧化的物质氨气只占反应掉的一半,被氧化的物质氨气与被还原的物质氯气物质的量之比=2:3,
故答案为:2:3;
(4)将少量的盐酸滴入过量NaAlO2溶液中发生反应的离子方程式为AlO2-+H++H2O═Al(OH)3↓,
故答案为:AlO2-+H++H2O═Al(OH)3↓;
(5)电解饱和氯化钠溶液,反应的方程式为:2NaCl+2H2O
电解
.
2NaOH+Cl2↑+H2↑,同时发生反应Cl2+2NaOH=NaCl+NaClO+H2O,故该电解池中发生反应的总反应方程式为:NaCl+H2O
电解
.
NaClO+H2↑,电解后得到NaClO溶液,显碱性,且具有强氧化性,滴入酚酞溶液中,观察到溶液变红后褪色,
故答案为:NaCl+H2O
电解
.
NaClO+H2↑;溶液变红后褪色.1年前查看全部
- 请看图中第7题,着重分析一下负一价(OCN)的电子式,电子偏向问题,
 4919633171年前2
4919633171年前2 -
 hhqidi 共回答了22个问题
hhqidi 共回答了22个问题 |采纳率86.4%-O-C≡N异氰酸根.CNO 周期表顺序,因此,非金属性 O>N>C 氮显负价,文中说都满足8电子稳定结构,所以C成4个键,氮3个,氧2个(包括一个电子),所以有,C+4价,N-3价,氧-2价.
一分子反应物中,N失3个电子,氯气整体得2个电子.因此,6×2÷3=4 C正解1年前查看全部
- 如图所示,一束具有各种速率的两种一价铜离子,质量数分别为63和65,水平地经小孔S进入有匀强电场E和匀强磁场D的区域.电
如图所示,一束具有各种速率的两种一价铜离子,质量数分别为63和65,水平地经小孔S进入有匀强电场E和匀强磁场D的区域.电场的方向向下,磁场的方向垂直于纸面向里.只有些轨迹不发生偏折的离子才能通过另一小孔S'.为了把从S'射出的两种铜离子分开,再让它们进入另一方向垂直纸面向外的匀强磁场B'中,使两种离子分别沿不同半径的圆形轨道运动.试分别求出两种离子的轨道半径.题中各已知量如下: E=1.00×10^5V/m, B=0.4T, B'=0.5T, 质量数为63的铜离子质量m1=63×1.66×10^-27kg, 质量数为65的铜离子质量m2=65×1.66×10^-27kg

 可乐与茶1年前1
可乐与茶1年前1 -
 fengling722 共回答了24个问题
fengling722 共回答了24个问题 |采纳率91.7%(1)设铜离子的电量为e,以速度v进入小孔S后,受到的力有电场力F1=Ee,方向向下洛仑兹力F2=evB,方向向上重力可忽略不计,只有当F1=F2时,铜离子才能匀速无偏折地穿出小孔S'.因此,从小孔S'穿出的铜离子必须满足的条件是e...1年前查看全部
- 分别为一价和两价的静止铜离子,经过同一电场加速后,在垂直经过同一偏转电场,然后落到一光屏上.图略,离子重力不计.A 离子
分别为一价和两价的静止铜离子,经过同一电场加速后,在垂直经过同一偏转电场,然后落到一光屏上.图略,离子重力不计.A 离子经加速电场时,二价铜离子受到电场力的冲量大.B 在偏转电场中电场力对两种离子做功一样多.C 两种铜离子打在屏上速度一样大.D 两种铜离子打在屏上的两个不同点.选择?理由?
 oqbydxm1年前1
oqbydxm1年前1 -
 88212853 共回答了15个问题
88212853 共回答了15个问题 |采纳率93.3%A对 .二价离子受力大,距离相同,FS大,做功大,动能大,速度大,MV大,由冲量定理,冲量大
D要看情况.可以计算(字数限制不能细说)电场中偏转距离相同.所以,如屏紧挨偏转电场边沿,D不对,否则对
楼上想当然1年前查看全部
大家在问
- 1下列家用电器工作时主要利用电流热效应的是( ) A.电动机 B..电饭煲 C.电热水壶 D.电话机
- 2大战鲨鱼群(1) 作文
- 3劈山筑路的意思.(简短)词面意思+深入意思
- 4我的池塘有3-5米水深 冬天水面结冰 鱼会因为缺氧死亡么 鱼的密度不是很大
- 5______up,John!The Kettle"s boiling.
- 6His father seldom goes shopping, _______? A.is he B.doesn’t
- 7如图所示是一种特殊的游戏装置,CD是一段位于竖直平面内的轨道,CD间的高度为h1=3m,末端D处的切线方向水平,一个小孩
- 8求分式在和时有意义、 2x²-4x+2.5分之3xy (2x-3)²+y²+y+4分之1
- 9一个九位数,它最高位上的数既是奇数,又是合数,千万位与千位上的数都是最小的合数,百万位与百位上都是最小的质数,其余各位都
- 10a few days later,their white coats are lost to take on the s
- 11(2010•大庆)课外活动中,同学们玩起来以二氧化碳为主题的“化学反应接龙”游戏.游戏的规则为:用前一个反应的一种生成物
- 12二氧化碳与氧化铁二氧化碳为什么不能与氧化铁反应?二氧化碳呈酸性啊?酸不是可以与金属氧化物反应吗?
- 13How many times per days do the hour and minutes hards of a c
- 144根火柴棒拼一个正方形12根拼4个,24根拼9个,问第n个正方形要几根火柴
- 15猫和老鼠 作文