定容时必须使凹液面最低处与刻度线相切,若俯视会使结果偏高,仰视会使结果偏低,为什么呐?
 **11202022-10-04 11:39:543条回答
**11202022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 上海残暴妹1号 共回答了22个问题
上海残暴妹1号 共回答了22个问题 |采纳率90.9%- 俯视时,液面还没到刻度线时 你的眼睛就认为已经到刻度线了,导致水加少了,因此浓度就偏高
仰视恰好相反,液面已经到刻度线上了,你眼睛才告诉你刚好到刻度线,导致水加多了,浓度偏低. - 1年前
 想看瓷娃娃 共回答了2个问题
想看瓷娃娃 共回答了2个问题 |采纳率- 你想啊 定容是你把液体都倒好了 相当于读数 保持眼睛、刻线、凹液面三点一线 画一下 俯视 低下头看 也就是眼睛在上面 和凹液面一连 刻度在实际可读上面 就偏高了 你试试看
- 1年前
 kevintxe 共回答了99个问题
kevintxe 共回答了99个问题 |采纳率- 俯视和仰视看到的都是远离的那个液面,定容的用的是容量瓶,俯视是,看到远的线是,刻度点在溶液上方,实际溶液体积不足,仰视是,读数在溶液下方,体积偏大
- 1年前
相关推荐
- 洗涤烧杯后摇匀?然后定容?定容后再摇匀?
洗涤烧杯后摇匀?然后定容?定容后再摇匀?
如果说定容后摇匀是为了让溶液混合均匀,
那为什么在洗涤烧杯后,也就是在定容前也要摇匀?
定容摇匀后不可再加蒸馏水,会使浓度偏小.
那定容前的一次摇匀不影响吗?为什么?
) 冰夜香飞1年前3
冰夜香飞1年前3 -
 pp1112 共回答了11个问题
pp1112 共回答了11个问题 |采纳率90.9%配置一定浓度的物质需要5步
计算.称量.溶解.转移.定容
其中转移和定容后都需要摇匀
目的都是使溶液混合均匀1年前查看全部
- 关于定容时仰视刻度线
 coffee5321年前3
coffee5321年前3 -
 puntwong 共回答了22个问题
puntwong 共回答了22个问题 |采纳率95.5%容量瓶中定容时,我们要把水加到刻度线,所以视线应该先找到刻度线(A处),然后加水到我们认为到A的地方(其实真实液面已经超过刻度线了),所以里面溶液体积变大,浓度偏小.1年前查看全部
- 定容后为什么液面低于刻度线为什么不可以加溶液
定容后为什么液面低于刻度线为什么不可以加溶液
如题, fzdw1年前3
fzdw1年前3 -
 isisme 共回答了19个问题
isisme 共回答了19个问题 |采纳率89.5%定容后的体积已经达到要求,摇匀后由于少量液体附着在容量瓶刻度线上部的瓶颈处,会导致液体液面低于刻度线,此时因为摇匀前后体积不变,都达到了容量瓶规定的体积,所以不能再加水进去,否则会变稀1年前查看全部
- 为什么配制NaoH溶液时,定容摇匀后液面会下降?
 m_cicy1年前2
m_cicy1年前2 -
 阿水之水漫漫 共回答了27个问题
阿水之水漫漫 共回答了27个问题 |采纳率88.9%有部分液体挂在容量瓶颈部刻度线以上的部分,静止一会就好了1年前查看全部
- 关于用容量瓶定容稀硫酸的问题向容量瓶中注入少量蒸馏水,检查是否漏水根据计算,用量筒量取一定体积的浓硫酸将浓硫酸沿烧杯壁慢
关于用容量瓶定容稀硫酸的问题
向容量瓶中注入少量蒸馏水,检查是否漏水
根据计算,用量筒量取一定体积的浓硫酸
将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
用已冷却的稀硫酸注入已检查不漏水的容量瓶中
用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次
继续往容量瓶中小心的加蒸馏水.使液面接近刻度线1-2cm
用胶头滴管滴加蒸馏水,使溶液凹面恰好与刻度相切
盖上容量瓶塞子,振荡摇匀
以上是正确的步骤 但是 定容时是将水向稀硫酸里滴 NJXJ1年前2
NJXJ1年前2 -
 叫我晗子好不好 共回答了5个问题
叫我晗子好不好 共回答了5个问题 |采纳率100%浓硫酸在稀释时,要放出大量的热.而稀硫酸在稀释时,放出的热量比较少,不会有危险.1年前查看全部
- 容量瓶:定容后加盖摇匀,分装入用蒸馏水洗净的试剂瓶中,为什么溶液浓度偏低?
 gr02131年前1
gr02131年前1 -
 我就是mm别猜 共回答了20个问题
我就是mm别猜 共回答了20个问题 |采纳率85%有可能是试剂瓶中的蒸馏水没有干1年前查看全部
- 0.1%酚酞配制时用什么定容?是用水还是95%乙醇定容?
 woaihlp1年前1
woaihlp1年前1 -
 lovecctv2007 共回答了17个问题
lovecctv2007 共回答了17个问题 |采纳率100%95%乙醇溶解定溶1年前查看全部
- 高效液相色谱仪流动相为0.005mol/l的硫酸,这里的硫酸是不是只是调PH?配制的时候要精确到用容量瓶定容吗?
 callme952081年前2
callme952081年前2 -
 520rich 共回答了12个问题
520rich 共回答了12个问题 |采纳率83.3%不可能单独用硫酸做流动相吧,应该是流动相添加硫酸吧,调节酸度影响出峰时间,还有就是抑制酸性物质水解,另外用紫外检测时,有助于提高信噪比.1年前查看全部
- 加速固体溶解 稍加热并不断搅拌 在未降至室温时 立即将溶液转移至容量瓶中定容 这对所配溶液浓度有何影响
 柳痕歆1年前1
柳痕歆1年前1 -
 davidwang424 共回答了27个问题
davidwang424 共回答了27个问题 |采纳率96.3%容量瓶是有规格的.除了容积以外请注意应该还标有25℃的字样.这就要求我们所配制的溶液温度应该为室温.
其次,容量瓶属于量入式仪器,刻度线标有多少体积,则溶液加至刻度线就认为是多少体积.(即使定容完以后盖上盖子上下倒置摇匀后体积不到刻度线也不能再加水).高于室温的溶液,根据“热胀冷缩”原理,冷却至室温后体积会小于刻度线(但这个和室温时摇匀溶液体积减小不同).所以会倒置溶液浓度增大.1年前查看全部
- 某温度下的密闭定容容器中发生反应2M(g)+ N(g)=2E(g),若起始时充入2molE,达到平衡时气体的压强比起始时
某温度下的密闭定容容器中发生反应2M(g)+ N(g)=2E(g),若起始时充入2molE,达到平衡时气体的压强比起始时增大了20%
百分之二十是怎么算出来的? 心无香1年前1
心无香1年前1 -
 ff到 共回答了15个问题
ff到 共回答了15个问题 |采纳率93.3%这是条件,是给你的条件,不是算出来的.该条件可推导出E 分解了40%.1年前查看全部
- 一定温度下 在某定容容器中 当下列哪个物理量不在变化时,能表明反应A{S}+2B{g}可逆符号C{g}+D已经达到平衡状
一定温度下 在某定容容器中 当下列哪个物理量不在变化时,能表明反应A{S}+2B{g}可逆符号C{g}+D已经达到平衡状态 A混合气体的压强 B 混合气体密度 CB的 物质的量浓度D 气体的总物质的量
 julay1年前1
julay1年前1 -
 zojcqdaz 共回答了21个问题
zojcqdaz 共回答了21个问题 |采纳率90.5%C
理由:D的状态不知
若为气态,则压强不会变,密度不变,气体总物质的量不变
选C1年前查看全部
- 为什么在使用容量瓶时 浓硫酸溶解后未冷却至室温即进行定容所配置溶液浓度偏高?
 华仔61501年前1
华仔61501年前1 -
 ywolf123 共回答了17个问题
ywolf123 共回答了17个问题 |采纳率88.2%浓硫酸溶解后未冷却就定容使液体容积相对偏小(液体热胀冷缩),所以
所配置溶液浓度偏高1年前查看全部
- 如何标定氯化锌标准溶液称取13.07g锌粒,用少量盐酸溶解后定容至1000ml.现在不知道怎样标定氯化锌标准溶液浓度?请
如何标定氯化锌标准溶液
称取13.07g锌粒,用少量盐酸溶解后定容至1000ml.现在不知道怎样标定氯化锌标准溶液浓度?请知道的告诉答案!
是不是跟用锌标标定EDTA一样啊?只是是反推而已?还请给出相应的计算公式! mimi10081年前1
mimi10081年前1 -
 我是鸡蛋我怕谁 共回答了21个问题
我是鸡蛋我怕谁 共回答了21个问题 |采纳率90.5%用已知浓度的EDTA二钠标准溶液标定就可以了(浓度和你要标定的氯化锌大致相同)1年前查看全部
- 定容后摇匀静止,发现凹液面低于刻度线,此时应该怎么办
 月风2191年前1
月风2191年前1 -
 大饼uu 共回答了19个问题
大饼uu 共回答了19个问题 |采纳率94.7%应该直接转移到细口试剂瓶中.
已经定容过了啊,说明此时容量瓶中的溶液浓度是正确的,至于低于刻度线可能是溶液残留在橡皮塞与瓶口的缝隙之中了吧,不影响浓度啊~1年前查看全部
- 用18mol/L浓硫酸配制100mL1.0mol/L的稀硫酸:计算、量取、洗涤、定容、摇匀并转入制定容器中等.
用18mol/L浓硫酸配制100mL1.0mol/L的稀硫酸:计算、量取、洗涤、定容、摇匀并转入制定容器中等.
下列有关叙述中正确的是
A 应计算出所需浓硫酸质量,然后用天平准确称量
B 应计算出所需浓硫酸体积,然后用100mL量筒准确量取
C 应计算出所需浓硫酸体积,然后用10mL量筒准确量取
D 用200mL的容量瓶来定容
(此题只有一个答案正确) 33幸福1201年前3
33幸福1201年前3 -
 落寂落离 共回答了21个问题
落寂落离 共回答了21个问题 |采纳率85.7%根据C2V2=C1V1计算出需要的18mol/L浓硫酸的体积,用量筒量取,然后再用100ml容量瓶来定容.根据计算,选c1年前查看全部
- 配制NaCl溶液时,定容前为什么要摇匀呢
 wangchao313538121年前1
wangchao313538121年前1 -
 minglicong 共回答了14个问题
minglicong 共回答了14个问题 |采纳率92.9%使得NaCL充分溶解于蒸馏水.望楼主采纳!
防止未溶解的NaCL晶体残留在容积壁上 造成误差!1年前查看全部
- 在做氨氮的测定时取100ml水样蒸馏,取溜出液定容至250ml,从这250ml里取50ml测定吸光度,稀释倍数怎么算?
 心静如高山1年前1
心静如高山1年前1 -
 7彩波板糖 共回答了20个问题
7彩波板糖 共回答了20个问题 |采纳率90%0.2倍 100ml水样中的氨氮全部溶解在250ml中的溜出液中,50/250=0.2倍,实际上50ml中所含氨氮的量相当于实际水样100ml*0.2=20ml所含的量,测定吸光度后求出氨氮的质量,再除以20ml,便是浓度,表示为mg/l.1年前查看全部
- 对于反应:PCl5=PCl3+Cl2,在定容和定压的条件下分别加入等量的反应物反应.请问PCl5的转化率谁大谁小,为什么
对于反应:PCl5=PCl3+Cl2,在定容和定压的条件下分别加入等量的反应物反应.请问PCl5的转化率谁大谁小,为什么?
 cameron1986121年前6
cameron1986121年前6 -
 花裙子单单 共回答了20个问题
花裙子单单 共回答了20个问题 |采纳率100%定压情况下PCl5转化率大.和定容相比,在定压情况下各物质的浓度下降的更快(体积增加相当于减压反应向体积增大的方向移动),根据平衡移动原理,反应正向移动,PCl5转化率增大.1年前查看全部
- 已知:H2(g)+I2(g)⇌2HI(g);△H<0.有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol,
已知:H2(g)+I2(g)⇌2HI(g);△H<0.有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI 0.2mol,相同温度下分别达到平衡.欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
A. 甲、乙提高相同温度
B. 甲中加入0.1 mol He,乙不变
C. 甲降低温度,乙不变
D. 甲增加0.1 mol H2,乙增加0.1 mol I2 tctga1年前1
tctga1年前1 -
 ix6hlo 共回答了22个问题
ix6hlo 共回答了22个问题 |采纳率100%解题思路:同容积的定容密封容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI0.2mol,由于乙按化学计量数转化到左边,可以得到H2和I2各0.1mol,故此时甲和乙建立的平衡是等效的,欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取措施使平衡向正反应移动,但不能降低HI的浓度,然后结合影响化学平衡移动的因素来回答.相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI0.2mol,此时甲和乙建立的平衡是等效的,
A、甲、乙提高相同温度,平衡均逆向移动,HI的平衡浓度均减小,故A错误;
B、甲中加人0.1molHe,在定容密封容器中,平衡不会移动,故B错误;
C、甲降低温度,平衡正向移动,甲中HI的平衡浓度增大,乙不变,故C正确;
D、甲中增加0.1molH2,乙增加0.1molI2,结果还是等效的,故D错误;
故选C.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查学生影响化学平衡移动的因素和等效平衡知识,难度中等,注意理解等效平衡规律.1年前查看全部
- 下列实验操作正确的是( ) A.加入盐酸以除去硫酸钠中的少量碳酸钠杂质 B.配制溶液定容时,用胶头滴管滴加蒸馏水至溶液
下列实验操作正确的是( ) A.加入盐酸以除去硫酸钠中的少量碳酸钠杂质 B.配制溶液定容时,用胶头滴管滴加蒸馏水至溶液凹液面最低点与刻度线相切 C.用分液漏斗分离液体时,先放出下层液体后,再放出上层液体 D.萃取时,将酒精和碘化钾溶液放入分液漏斗中静置  我不是小uu1年前1
我不是小uu1年前1 -
 wiwm236500 共回答了24个问题
wiwm236500 共回答了24个问题 |采纳率83.3%A.加入盐酸能除去硫酸钠中的少量碳酸钠,但却引入NaCl无法达到除杂的目的,故A错误;
B.应滴加蒸馏水至溶液凹液面最低点与刻度线相切,故B正确;
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出,一避免两种液体相互污染,故C错误;
D.酒精能与水互溶不分层,故D错误.
故选B.1年前查看全部
- 定容时俯视刻度线,为什么会使体积偏低
 _catherine_1年前1
_catherine_1年前1 -
 飓风之翼 共回答了16个问题
飓风之翼 共回答了16个问题 |采纳率87.5%这是一个概念问题
定容是我们在取的时候就已经知道要取多少,即,在看的时候,会以视线为准
那么,我们的视线会在实际线的上方,即取的少了1年前查看全部
- 在某定容密闭容器中建立下列平衡3A(g)+B(g)=双箭头=2C(g)+D(g)
在某定容密闭容器中建立下列平衡3A(g)+B(g)=双箭头=2C(g)+D(g)
在上述反应中如果加入一定量的B,体系颜色加深,则有颜色的物质可能是 dudu_lan1年前1
dudu_lan1年前1 -
 钻石王老七 共回答了22个问题
钻石王老七 共回答了22个问题 |采纳率86.4%B,C,D都可能1年前查看全部
- 用容量瓶定容时俯视溶液的凹液面会造成瓶内溶液浓度偏大还是偏小?
 Laohoua1年前4
Laohoua1年前4 -
 世纪之树 共回答了15个问题
世纪之树 共回答了15个问题 |采纳率86.7%偏大1年前查看全部
- 某定容基元反应的热效应为100KJ mol,则该正反应的实验活化能Ea的数值如何呢?
某定容基元反应的热效应为100KJ mol,则该正反应的实验活化能Ea的数值如何呢?
如果反应热效应为-100kj mol 则Ea的数值有将如何呢?
放热反应Ea不确定,怎么理解呢》? 蓝月亮Oo1年前1
蓝月亮Oo1年前1 -
 seattle的雨 共回答了20个问题
seattle的雨 共回答了20个问题 |采纳率80%活化能系数有公式的 和阿伦你无私公式形式比较像
化学反应工程或则物理化学书上都有吧.1年前查看全部
- 气体做体积功是只有气体体积改变,其他的像压强什么的都不变吗? 计算定容过程反应热的时候体积保持不
气体做体积功是只有气体体积改变,其他的像压强什么的都不变吗? 计算定容过程反应热的时候体积保持不
气体做体积功是只有气体体积改变,其他的像压强什么的都不变吗? 计算定容过程反应热的时候体积保持不变为什么还做体积功了啊? snowky1年前1
snowky1年前1 -
 saturnine2005 共回答了16个问题
saturnine2005 共回答了16个问题 |采纳率68.8%气体体积变化时,温度和压强一般也变化.定容过程因为体积不变,所以做功为零.1年前查看全部
- 取10毫升溶液,稀释50倍.是取10毫升溶液用500毫升容量瓶定容就行了对吧?
 lujia_12181年前4
lujia_12181年前4 -
 jinandewj 共回答了19个问题
jinandewj 共回答了19个问题 |采纳率89.5%是的
因为设原溶液的浓度时C
那么取得10毫升,物质的量为0.01C
取10毫升溶液用500毫升容量瓶定容浓度为0.01C/0.5=0.02C
所以浓度比是C:0.02C=501年前查看全部
- 食品中亚硝酸盐的测定方法如果测定结果很高应该怎么做?是稀释样品定容液还是减少取样量扩大定容体积?
 dlwxyn1年前1
dlwxyn1年前1 -
 王小虫 共回答了15个问题
王小虫 共回答了15个问题 |采纳率93.3%个人觉得还是要选后者,因为稀释样品定容液的话不能排除定容的容量瓶是否有污染,当然这个最省事,呵呵,日常工作中也有人这么做.
减少称样量相当于你重新对样品做了复查,不像上面(那是没有对样品复查的,是不符合规范要求的).
所有超标的样品都应该复查而不仅仅是把原来的制备液拿来稀释一下就做.1年前查看全部
- O用20ml18.4mol/L的浓硫酸和铜共热,一段时间后使反应混合物冷却,滤去多余的铜,将滤液加水,定容到100ml
O用20ml18.4mol/L的浓硫酸和铜共热,一段时间后使反应混合物冷却,滤去多余的铜,将滤液加水,定容到100ml
用20ml18.4mol/L的浓硫酸和铜共热,一段时间后使反应混合物冷却,滤去多余的铜,将滤液加水,定容到100ml,所得SO42-浓度为3.18mol/L.求1.产生的SO2的体积(标况)2.溶解的铜的物质的量3.定容后溶液中氢离子的量浓度 愤怒的老gg1年前1
愤怒的老gg1年前1 -
 有砼则刚 共回答了19个问题
有砼则刚 共回答了19个问题 |采纳率78.9%SO2的物质的量=18.4X0.02-3.18X0.1=0.05mol
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
1 2 1 1
0.05 0.1 0.05 0.05
1.产生的SO2的体积(标况)=0.05X22.4=1.12L
2.溶解的铜的物质的量=0.05mol
剩余硫酸物质的量=18.4X0.02-0.1=0.268mol
3.定容后溶液中氢离子的量浓度=2X0.268/0.1=5.36mol/L1年前查看全部
- 质量分数30%的过氧化氢稀释100倍应去过氧化氢和蒸馏水体积多少,1000容量瓶定容,密度1.46
 y2sky1年前1
y2sky1年前1 -
 bucuoba 共回答了21个问题
bucuoba 共回答了21个问题 |采纳率95.2%10ml过氧化氢和990ml水1年前查看全部
- 1.质量m1=2.0g的二氧化碳气体和m2=3.0g的氮气的混合物,均视为理想气体,求混合气体的定容摩尔热容和定压摩尔热
1.质量m1=2.0g的二氧化碳气体和m2=3.0g的氮气的混合物,均视为理想气体,求混合气体的定容摩尔热容和定压摩尔热容
2.如图 字太多了.

 wuwell1年前3
wuwell1年前3 -
 霹雳啪啦勇 共回答了14个问题
霹雳啪啦勇 共回答了14个问题 |采纳率92.9%(1)251J(2)放热,293J(3)1年前查看全部
- 在一定温度下的定容密闭容器中,发生反应A(s)+2B(g)⇌C(g)+D(g),当下列物理量不再变化时,表明反应已达平衡
在一定温度下的定容密闭容器中,发生反应A(s)+2B(g)⇌C(g)+D(g),当下列物理量不再变化时,表明反应已达平衡的是( )
①混合气体的压强
②混合气体的密度
③混合气体的平均相对分子质量
④气体总物质的量.
A.①②
B.②③
C.②
D.③ 卓越11111年前1
卓越11111年前1 -
 深圳情缘 共回答了15个问题
深圳情缘 共回答了15个问题 |采纳率86.7%解题思路:根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.①混合气体的压强,反应前后是化学计量数相等的可逆反应,从反应开始到平衡,压强始终相等,故①错误;
②因为A为因体,只要未平衡,混合气体的质量就在变,混合气体的密度也在变,如果不变,说明已达平衡状态,故②正确;
③反应前后是化学计量数相等的可逆反应,而混合气体的质量未平衡时是变化的,混合气体的平均相对分子质量不再变化,说明已达平衡状态,故③正确;
④反应前后是化学计量数相等的可逆反应,从反应开始到平衡,气体总物质的量始终相等,故④错误;
故选B.点评:
本题考点: 化学平衡状态的判断.
考点点评: 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等.1年前查看全部
- 凯氏定氮仪测全氮,把消煮液定容到100ml,测定时是不是把滴定酸的倍数乘以5?
凯氏定氮仪测全氮,把消煮液定容到100ml,测定时是不是把滴定酸的倍数乘以5?
如果取20ml tdwwdz1年前1
tdwwdz1年前1 -
 宝贝蝶 共回答了26个问题
宝贝蝶 共回答了26个问题 |采纳率88.5%对的,您这样等于稀释倍数是五,计算的时候要乘以五1年前查看全部
- 一道大学热力学题目=w=有2KG理想气体,初态时温度t1=204℃,压力p1=0.32MPa,经可逆定容加热,终温t2=
一道大学热力学题目
=w=
有2KG理想气体,初态时温度t1=204℃,压力p1=0.32MPa,经可逆定容加热,终温t2=323℃,求过程中工质的△U △H △S
工质取定值比热,k=1.4 Cp=1005J/kg.K 甜甜ee婆1年前1
甜甜ee婆1年前1 -
 gatus 共回答了17个问题
gatus 共回答了17个问题 |采纳率100%因为等容,所以W=0
因为Q=△U+W,所以Q=△U=Cv△T,其中Cv=Cp/k
△H=Cp*△T
△S=Cv*ln(T2/T1)+Rg*ln(V2/V1) 其中Rg=Cp-Cv.因为等容,所以V2/V1=0
代数即可~最后要记得乘质量啊~1年前查看全部
- 摩尔浓度,1mol/L溶液配制假设配制NaCl溶液,5.85g,用100mL容量瓶定容配出来的是不是1mol/L
 goldenlife1年前1
goldenlife1年前1 -
 有爱真 共回答了22个问题
有爱真 共回答了22个问题 |采纳率77.3%是
c=(5.85/58.5) / 0.1 = 1mol/L1年前查看全部
- 在一定温度下的定容密闭容器中,下列情况能表明可逆反应:H2(g)+I2(g)⇌2HI(g)已达平衡的是( )
在一定温度下的定容密闭容器中,下列情况能表明可逆反应:H2(g)+I2(g)⇌2HI(g)已达平衡的是( )
A.H2的生成速率与I2的生成速率相等
B.反应容器内的压强不随时间的变化而变化
C.H2、I2、HI的浓度相等
D.若单位时间内生成n mol H2的同时生成2n mol HI 350341年前1
350341年前1 -
 cc心已冷 共回答了17个问题
cc心已冷 共回答了17个问题 |采纳率88.2%解题思路:当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量不变,注意该反应是一个反应前后气体体积不变的化学反应,所以不能用压强判断平衡.A.H2的生成速率与I2的生成速率都是正速率,不能作为判断是否达到化学平衡状态的依据,故A错误;
B.反应前后气体的体积不变,故混合气体的压强始终不变,所以压强不再变化不能作为判断是否达到化学平衡状态的依据,故B错误;
C.平衡时各物质的物质的量浓度是否相同取决于物质的起始浓度和转化率,H2、I2、HI的浓度相等不能作为判断是否达到平衡状态的依据,故C错误;
D.单位时间内生成n mol H2表示逆速率,2n mol HI表示正速率,二者的速率比等于计量数比,所以反应达到平衡状态,故D正确,
故选D.点评:
本题考点: 化学平衡状态的判断.
考点点评: 本题考查化学平衡状态的判断,题目难度不大,明确只有当反应前后改变的物理量不变时,可逆反应才达到平衡状态.1年前查看全部
- 已知1摩尔氢气和1摩尔碘气可逆生成2摩尔碘化氢气体正反应为放热反应,有相同容积的的定容密闭容器甲和乙,
已知1摩尔氢气和1摩尔碘气可逆生成2摩尔碘化氢气体正反应为放热反应,有相同容积的的定容密闭容器甲和乙,
甲中加入氢气和碘气各0.1摩尔,乙中加入碘化氢0.2摩尔,相同温度下分别达到平衡.欲使用甲中碘化氢的浓度大于乙中碘化氢的平衡浓度,应采取的措施是
A:甲、乙提高相同的温度
B:甲中加入0.1摩尔氦,乙不变
C:甲降低温度,乙不变
D:甲增加0.1摩尔氢气,以增加0.1摩尔碘气 ede00801年前2
ede00801年前2 -
 伊典儿 共回答了16个问题
伊典儿 共回答了16个问题 |采纳率93.8%这两个容器内的反应是等效的 写写方程式就知道了
C 正反应吸热 升温向正反应方向移动 HI变多 C对
这样A就错了
B 加压对反应没影响
D 加了之后对平衡的影响是一样的 所以还是等效的 加H2和加I2是一样的1年前查看全部
- 在一定温度下的定容密闭容器中,发生反应:A(s)+2B(g)⇌fC(g)+D(g),能表明反应已达平衡状态的是( )
在一定温度下的定容密闭容器中,发生反应:A(s)+2B(g)⇌fC(g)+D(g),能表明反应已达平衡状态的是( ) A.混合气体的压强不变 B.混合气体的密度不变 C.单位时间内生成nmolC的同时生成nmolD D.气体总物质的量不变  lx23324571年前1
lx23324571年前1 -
 我就不相信 共回答了17个问题
我就不相信 共回答了17个问题 |采纳率94.1%A、混合气体的压强不变时,对于反应前后气体体积不变的反应无意义,即f=1时,不成立,故A错误;
B、混合气体的密度 ρ=
m
V ,反应前后质量不守恒,分子变,而定容密闭容器中,体积不变,即分母不变,所以当密度不变时,达到了平衡状态,故B正确;
C、单位时间内生成nmolC的同时生成nmolD,只表明反应正向进行,不能体现正逆反应速率相等,故C错误;
D、对于反应前后气体体积不变的反应,不管反应是否平衡,总物质的量均不变,故D错误.
故选B.1年前查看全部
- 在一定温度下的定容密闭容器中,当下列物理量不再变化时,表明反应:
在一定温度下的定容密闭容器中,当下列物理量不再变化时,表明反应:
A(s)+2B(g)=(可逆符号)C(g)+D(g)已达平衡的是:
A.混合气体的压强 B.混合气体的密度
C.B的物质的量浓度 D.气体总物质的量
B为什么也是对的? 狼鸡添牙1年前3
狼鸡添牙1年前3 -
 rr丑丑 共回答了19个问题
rr丑丑 共回答了19个问题 |采纳率84.2%应该选b,c.由于这个反应的反应物和生成物中的气体的物质的量相等,所以无论是否达到化学平衡,混合气体的物质的量都不改变,所以在定容的容器中,丈压强不会发生变化.a就被排除了.而这个反应根椐质量守恒定律,如反应向左进行,就混合气体的质量减少,向右则增大.因为体积不变,所以密度会随着反应发生改变.所以b是正确的.对c来说,B的物质的量的浓度不发生改变,而混合气体的体积不变,所以B的物质的量不会发生变化,显然此时达到了化学平衡.d前面已分析了,不能说明此时已达到化学平衡1年前查看全部
- 配制一定物质的量浓度当定容时,液面不小心超出刻度线,可不可以将溶液混匀后倒出,再倒入使其凹液面与刻度线相平(假设倒入可以
配制一定物质的量浓度
当定容时,液面不小心超出刻度线,可不可以将溶液混匀后倒出,再倒入使其凹液面与刻度线相平(假设倒入可以没过刻度线) asleep1年前1
asleep1年前1 -
 Angway_82 共回答了26个问题
Angway_82 共回答了26个问题 |采纳率84.6%不可以,超过刻度线,就是体积偏大,浓度偏小,混合均匀后,溶液浓度与体积无关,再到回后的浓度和没有倒出前是一样的,都是浓度偏小1年前查看全部
- 求滴定度有苯酚(M=94.11g/mol)样品0.2400克,用NaOH溶液溶解后,定容至250ml.取这试液25ml,
求滴定度
有苯酚(M=94.11g/mol)样品0.2400克,用NaOH溶液溶解后,定容至250ml.取这试液25ml,加入KBrO3和KBr混合溶液25ml,反应完成后再加过量的KI及5mlHCl,析出的碘用0.108mol/L的Na2S2O3溶液滴定至终点,用去27.82ml.另取25mlKBrO3和KBr混合溶液做空白试验,用去上述Na2S2O3溶液40.6ml.求(1):0.1mol/LNa2S2O3标准溶液对苯酚的滴定度.
(2):计算苯酚的百分含量.
基础不好,希望详解,看懂后可以追加分. 贰壹玖玖1年前1
贰壹玖玖1年前1 -
 真_小囡 共回答了16个问题
真_小囡 共回答了16个问题 |采纳率93.8%彼此关系为:苯酚--KBrO3--3Br2--3I2--6Na2S2O3
c(1/6KBrO3)=0.108*40.6/25.00=0.1754mol/L
T=(0.108*94.11/6)/1000)=1.694*10-3g/mL
苯酚的百分含量
=[(0.1754*0.025-0.108*0.02782)*(1/6)*94.11]/[0.2400*(25/250)]
=0.902=90.2%
其实也可不求c(1/6KBrO3)
苯酚的百分含量
=[0.108(0.0406-0.02782)*(1/6)*94.11]/[0.2400*(25/250)]
=0.902=90.2%1年前查看全部
- 在一定条件下的定容容器中,当下列物理量不再发生变化时,表明反应
在一定条件下的定容容器中,当下列物理量不再发生变化时,表明反应 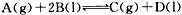
已达平衡状态的是[ ]A.混合气体的压强
B.混合气体的密度
C.B的物质的量浓度
D.气体的总物质的量 liqingsi1年前1
liqingsi1年前1 -
 男人中的rr 共回答了14个问题
男人中的rr 共回答了14个问题 |采纳率78.6%BC1年前查看全部
- 亚硝酸盐的测定就为什么加入对氨基苯磺酸溶液后要混匀静置3-5 min?反应液定容后为什么要放置15 min?样液
 香香公主心1年前1
香香公主心1年前1 -
 说话不清的鱼 共回答了25个问题
说话不清的鱼 共回答了25个问题 |采纳率92%【PPT】甲基橙的制备
文件格式:PPT/Microsoft Powerpoint - HTML版
进一步练习过滤,洗涤,重结晶等基本操作.甲基橙:甲基橙是酸碱指示剂,它是由对氨基苯磺酸重氮盐与N,N-二甲基苯胺的醋酸盐,在弱酸性介质中偶合得到的.偶合首先得到的是亮红色的酸式甲基橙,称为酸性黄,在碱中酸性黄转变为橙黄色的钠盐...
a href="http://210.43.24.24/syjx/hxsy/yj/19.ppt"210.43.24.24/syjx/hxsy/yj/19.ppt/a 203K 2008-5-291年前查看全部
- 在配制生理盐水时,若用台秤称取Nacl,而用容量瓶定容,此操作是否正确?为什么?
 lbhnumber1年前1
lbhnumber1年前1 -
 qq210 共回答了22个问题
qq210 共回答了22个问题 |采纳率95.5%不对,因为称取Nacl在台称上垫纸,溶液用量筒1年前查看全部
- 盐36.5%盐酸是质量分数,那1%溴酚蓝,1克用无水乙醇定容到100毫升,还能算质量分数吗
 zhihui07941年前1
zhihui07941年前1 -
 494153295 共回答了16个问题
494153295 共回答了16个问题 |采纳率75%可以,质量分数:1/81,总质量为1+0.8X100=811年前查看全部
- 已知密度求定容摩尔热容某种理想气体在标准状态下的密度是0.0894千克每立方米求该气体的定体摩尔热容和定压摩尔热容
 carefreeprodigal1年前1
carefreeprodigal1年前1 -
 bratty 共回答了18个问题
bratty 共回答了18个问题 |采纳率88.9%M=ρV=0.0894*22.4=2为H2
双原子分子Cv=2.5R=20.785J/(mol*K)
Cp=Cv+R=29.1J/(mol*K)1年前查看全部
- 总氮的测定,采用碱性过硫酸钾紫外分光光度计测定,取待测液2ml到100ml容量瓶定容,
总氮的测定,采用碱性过硫酸钾紫外分光光度计测定,取待测液2ml到100ml容量瓶定容,
取稀释液于50ml比色管定容至25ml再加入25ml碱性过硫酸钾,请问稀释倍数是多少呢? billsoflading1年前1
billsoflading1年前1 -
 辰令 共回答了12个问题
辰令 共回答了12个问题 |采纳率83.3%2ml 到100ml 稀释50倍
25ml到 50ml 稀释2倍
加在一起就是50*2=100倍1年前查看全部
- 解释以下现象:未洗涤烧杯和玻璃棒2次~3次.(mB偏小,cB偏低)在定容时加水超过刻度线,再用胶头滴管吸出多余部分。(V
解释以下现象:
未洗涤烧杯和玻璃棒2次~3次.(mB偏小,cB偏低)在定容时加水超过刻度线,再用胶头滴管吸出
多余部分。(V偏大,cB偏低) mfxs0071年前3
mfxs0071年前3 -
 lili8502 共回答了16个问题
lili8502 共回答了16个问题 |采纳率87.5%未洗涤烧杯、玻棒的上面残留有溶质,所以溶质质量偏小,浓度偏低.
定容时超过刻度线的那部分溶液中也含有溶质,吸出后溶质浓度偏低,V偏大.1年前查看全部
- 实验室配制溶液的问题.未冷却至室温就将溶液转移到容量瓶并定容.会有什么结果,为什么?
 西部传奇1年前1
西部传奇1年前1 -
 池洼胜治 共回答了9个问题
池洼胜治 共回答了9个问题 |采纳率88.9%导致溶液体积小于预期体积.原因是,高温情况下存在体积膨胀现象1年前查看全部
- 题目中的一句话:配制盐酸定容时,仰视容量瓶刻度线.请问:盐酸定容是什么?
题目中的一句话:配制盐酸定容时,仰视容量瓶刻度线.请问:盐酸定容是什么?
我刚***,讲得通俗易懂点 slumpliang1年前1
slumpliang1年前1 -
 二环路外 共回答了24个问题
二环路外 共回答了24个问题 |采纳率83.3%不是【盐酸定容】,没有这种说法,应该是【定容】
正确断句:配制盐酸||定容时
高中要接触一种新的仪器——容量瓶
容量瓶是为配制准确的一定物质的量浓度的溶液用的精确仪器
使用过程如下:
①使用前检查瓶塞处是否漏水.向容量瓶内加少量水,塞好瓶塞,用食指顶住瓶塞,用另一只手的五指托住瓶底,把瓶倒立过来,如不漏水,正立,把瓶塞旋转180度后塞紧,再倒立若不漏水,方可使用.
②把准确称量好的固体溶质放在烧杯中,用少量溶剂溶解.然后把溶液沿玻璃棒转移到容量瓶里.为保证溶质能全部转移到容量瓶中,要用溶剂多次洗涤烧杯,并把洗涤溶液全部转移到容量瓶里.
③向容量瓶内加入的液体液面离标线1~2厘米左右时,应改用滴管小心滴加,最后使液体的弯月面(凹液面)与刻度线正好相切.
④盖紧瓶塞,用倒转和摇动的方法使瓶内的液体混合均匀
【【其中,步骤③的过程叫做定容】】
希望我的回答对你有帮助,采纳吧O(∩_∩)O!1年前查看全部
大家在问
- 1(2012•通辽)小光同学学习做饭的过程中,经常加热油和水,他猜想①油的沸点比水高;②油的比热容比水小.
- 2关于文言文《小儿不畏虎》的一些问题
- 3已知硫酸锰(MnSO 4 )和过硫酸钾(K 2 S 2 O 8 )两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸
- 4她早饭经常吃什么?用英语怎么说
- 5上个星期六农民带领我们参观了农场(翻译为英文)
- 6突然停电了 英语怎么说?"当我正在上网的时候,突然停电了." 2.麻烦再给翻译一句:我们应当合理安排上网时间..
- 7一个圆柱体底面周长是6.28分米高是2分米体积是?
- 8四个男子和一个木箱阅读答案
- 90乘以AB向量等于0吗?
- 10填空题2,
- 11(2009•白下区一模)生物进化的规律是:由单细胞到多细胞,由低等到高等,由简单到复杂,由水生到陆生.______.(判
- 12海上日出 450字
- 13二氧化硅和氢氧化钠的反应中二氧化硅为什么不拆
- 14用所给词的适当形式填空 I want —(think ) about art?
- 15圆O1和圆O2外切于点C,直线AB分别切圆O1、圆O2于A、B,圆O2的半径为1,AB=2根号2 ,则圆O1的半径为多少
