1.将适量CO2气体通入下列溶液中,不会产生沉淀的是
 牛牛08102022-10-04 11:39:541条回答
牛牛08102022-10-04 11:39:541条回答A、饱和碳酸钠溶液 B、氯化钙溶液 C.硅酸钠溶液 D.次氯酸钙溶液
2.能说明CL的非金属性比S的非金属性强的是
A.向硫化氢水溶液中通入氯气可得到固体硫
B.氯气与铁反应生成氯化铁,硫与铁反应生成硫化亚铁
C.与镁反应时,氯得到1个电子,硫得到2个

已提交,审核后显示!提交回复
共1条回复
 岳芳静 共回答了25个问题
岳芳静 共回答了25个问题 |采纳率92%- 1选B
A中,CO2加碳酸钠生成碳酸氢钠,但碳酸氢钠的溶解度小于碳酸钠,所以在饱和碳酸钠中会有白色沉淀.
B中,不会生成碳酸钙,因为写下方程式后发现,弱酸不能制强酸,反应不发生.
C中,碳酸的酸性大于硅酸,所以生产硅酸沉淀.
D中,碳酸酸性大于次氯酸,生成碳酸钙沉淀.
2选AB
判断物质非金属性强弱的方法:
1与H化合的难易程度(即得电子的难易)
2H化物的稳定程度
3最高价氧化物的水化物的酸性强弱
A中,是氧化物的氧化性大于氧化产物
B很明显
C中,得电子的个数并不能表示难易程度 - 1年前
相关推荐
- 如图是某种加钙食盐(在加碘食盐中掺适量的食用碳酸钙)包装标签上的部分文字.某同学为了测定此盐中的钙元素含量是否符合标签所
 如图是某种加钙食盐(在加碘食盐中掺适量的食用碳酸钙)包装标签上的部分文字.某同学为了测定此盐中的钙元素含量是否符合标签所示,取10g这种盐于烧杯中,加入足量稀盐酸,待完全反应后,烧杯中质量减少了0.132g.请通过计算判断此标签中钙的含量是否属实?
如图是某种加钙食盐(在加碘食盐中掺适量的食用碳酸钙)包装标签上的部分文字.某同学为了测定此盐中的钙元素含量是否符合标签所示,取10g这种盐于烧杯中,加入足量稀盐酸,待完全反应后,烧杯中质量减少了0.132g.请通过计算判断此标签中钙的含量是否属实?  lugm1年前1
lugm1年前1 -
 实话难实说 共回答了17个问题
实话难实说 共回答了17个问题 |采纳率94.1%解题思路:碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,根据二氧化碳的质量及其反应的化学方程式可以计算碳酸钙的质量、钙元素的质量.根据质量守恒定律可知,反应前后烧杯内质量减少的就是生成的二氧化碳质量,所以二氧化碳的质量为0.132g.
设参加反应碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 0.132g
[100/x=
44
0.132g]
x=0.3g
10g此加钙食盐中钙元素的质量为:0.3g×[40/100]×100%=0.12g;
所以此加钙食盐中钙元素的质量分数=[0.12g/10g]×100%=1.2%,钙元素的含量在0.5%到1.3%之间,所以此标签中钙的含量属实
答:此标签中钙的含量属实.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题主要考查学生运用化学方程式进行计算和推断的能力,比较简单,解答时要注意规范性.1年前查看全部
- 28-7/ 一定量盐酸与过量的铁粉反应,为减缓反应速率,但不影响生成H2的总量,可向盐酸中加入适量()?
28-7/ 一定量盐酸与过量的铁粉反应,为减缓反应速率,但不影响生成H2的总量,可向盐酸中加入适量()?
(A)NaOH(s)
(B)H2O
(C)K2CO3(s)
(D)CH3COONa(s)
答案是B&D.
为什么B&D对,而D选项都却不对?
请详细说明每个选项并写出详细过程.
为什么B&D对 bjboy9111年前2
bjboy9111年前2 -
 蜀山逍遥 共回答了16个问题
蜀山逍遥 共回答了16个问题 |采纳率93.8%A消耗盐酸,使H2减少
B降低c(H+),减缓反应速率但不影响生成H2的总量.
C消耗盐酸,使H2减少
D将强酸变为弱酸,降低c(H+),减缓反应速率但不影响生成H2的总量.
CD的区别在于C变为CO2逸出.
答案为BD1年前查看全部
- 底面半径为R的圆柱形量筒中装有适量的水。若放入一个半径为r的实心铁球,球被水淹没后,水面恰好升高r,则R/r=?
 独行客lcd1年前0
独行客lcd1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 向m克镁铝混合物中加入适量稀硫酸,恰好完全反应生成b升气体,相反应后溶液中加入C摩每升的氢氧化钾V毫升
向m克镁铝混合物中加入适量稀硫酸,恰好完全反应生成b升气体,相反应后溶液中加入C摩每升的氢氧化钾V毫升
使金属离子完全沉淀得到沉淀n克,灼烧沉淀得到固体p克则不正确的是:Ac=1000b/11.2v B p=m+vc/125 C n=m+17vc D5m/3 zhaoxu821年前2
zhaoxu821年前2 -
 大已启动 共回答了18个问题
大已启动 共回答了18个问题 |采纳率94.4%设混合物中含有xmolMg和ymolAl,
根据和酸反应时的得失电子守恒得
2x+3y=b/11.2……①
和碱反应生成沉淀的化学式为Mg(OH)2和Al(OH)3,
根据电荷守恒可得n(KOH)=2x+3y=cV/1000……②,
由①②可得c = 1000b/(11.2V),A正确.
`
沉淀经灼烧后所得固体成分是MgO和Al2O3,
根据电荷守恒得混合物中n(O)=x+3y/2,
由①可得n(O)=cV/2000,
由此可得固体的质量p= m+m(O) =m+16n(O)/2000,
代入数据可知选项B正确.
`
从金属到氢氧化物增加的质量就是KOH中的OH-
消耗KOH物质的量=cV*0.001
那么质量增加=cV*0.001*17
那么n=m+0.017cV,因此C错误
`
选项D可用极值法讨论,
若mg全为Mg,则p=5m/3,
若mg全为Al,p=17m/9,
由此可知选项D正确.
·
选择C1年前查看全部
- 1.向20℃的饱和澄清石灰水(甲溶液)中投入适量的氧化钙粉末,充分反应,下列说法错误的是( )
1.向20℃的饱和澄清石灰水(甲溶液)中投入适量的氧化钙粉末,充分反应,下列说法错误的是( )
A.溶液温度未冷却到20℃时,溶液一定是饱和溶液
B.溶液温度未冷却到20℃时,溶质质量分数比甲溶液大
C.溶液温度恢复到20℃时,溶液质量比甲溶液小
D.溶液温度恢复到20℃时,溶液的溶质质量分数和甲溶液的相等
2.一包由NaCl、KNO、CaCO三种白色固体组成的混合物,欲将其一一分离开来,应采用的操作步骤(或方法)是_______________
3.如果将100g溶质质量分数为20%的硝酸钾溶液稀释成溶质质量分数为10%的硝酸钾溶液,需加入水的质量为______
4.现有100g溶质质量分数为10%的食盐溶液,若使溶液的溶质质量分数增加一倍,下列操作中正确的是( )
A.加入食盐12.5g
B.加入水50g
C.蒸发掉水50g
D.加入100g溶质质量分数为10%的食盐溶液 ghostgu1年前1
ghostgu1年前1 -
 陈永彬 共回答了22个问题
陈永彬 共回答了22个问题 |采纳率81.8%楼上第1题、第2题做错了,不然我也不需要做了.
1,B
A.对,分析:加入氧化钙后,它与原溶液中的水反应,生成氢氧化钙,同时放热,而氢氧化钙的溶解度随温度的升高而降低,所以,此时的溶液一定是此高温下的饱和溶液.
B.错,分析:同前,高一点的温度时,溶解度小些,溶质的质量分数小.
C.对,分析:由于溶液中有溶质和溶剂减少,故溶液质量减少.
D.对,分析:只要是20℃时的饱和溶液,溶质的质量分数就应该相等.
2,首先,加足量的水溶解,过滤,分离出碳酸钙;加热此溶液,制成高温下的饱和溶液,降温,得到的晶体是硝酸钾KNO3,蒸发溶液,得氯化钠NaCl.
3,100克 100克*20%=(100+X)*10% 解出可.
4,AC
100克*10%+X=(100+X)*20% X=12.5克
100克*10%=(100-Y)*20% Y=50克1年前查看全部
- 向氧化铜和铁粉的混合物中,加入适量的稀硫酸,充分反应后过滤.用化学用语填空.
向氧化铜和铁粉的混合物中,加入适量的稀硫酸,充分反应后过滤.用化学用语填空.
1吕出的不溶物中肯定含有一种金属,该金属的化学式
2滤液中必定含有的金属离子的符号为
3标出滤液中一定含有 的溶质中阴离子的化合价为 wangyibinqh1年前2
wangyibinqh1年前2 -
 mupiu 共回答了21个问题
mupiu 共回答了21个问题 |采纳率85.7%Fe
Cu 2+
SO4 2-1年前查看全部
- 将重为4N,体积为0.0006m³的物体投入一装有适量水的溢水杯中,溢出水300g,若不计水的阻力,
将重为4N,体积为0.0006m³的物体投入一装有适量水的溢水杯中,溢出水300g,若不计水的阻力,
物体静止时,物体漂浮,F浮=4N,但根据阿基米德原理F浮=G排.所以应该是3N 球球111年前4
球球111年前4 -
 zz凯 共回答了16个问题
zz凯 共回答了16个问题 |采纳率87.5%装有适量水的溢水杯谁不知满还是未满,300g不是排开的全部水1年前查看全部
- 如图,在一个标准大气压下,某同学将冰块放人空易拉罐中并加入适量的盐,用筷子搅拌大约半分钟,测得易拉罐中冰与盐水混合物的温
如图,在一个标准大气压下,某同学将冰块放人空易拉罐中并加入适量的盐,用筷子搅拌大约半分钟,测得易拉罐中冰与盐水混合物的温度低于0℃,实验时易拉罐的底部有白霜生成.对于这一实验和现象的分析,正确的是(
A.盐使冰的熔点低于 0℃,白霜的生成是凝华现象
B.盐使冰的熔点高于 0℃,白霜的生成是凝华现象
C.盐使冰的熔点低于 0℃,白霜的生成是凝固现象
D.盐使冰的熔点高于 0℃,白霜的生成是凝固现象
)请详细解答哦------- 何时结束1年前1
何时结束1年前1 -
 weila21 共回答了20个问题
weila21 共回答了20个问题 |采纳率100%选A,首先,温度低于0度,有水生成,而冰的溶点是0度,说明盐把冰的溶点降低了,其次,有白霜生成,白霜属于固体,白霜是由晚拉罐的空气直接生成的,物体由气态直接变成固态叫凝华,故选A.(此题出的也不算严密,用筷子搅拌也算是给冰作了功,作功能使物体的温度升高,从而化成水,水把盐溶解,变成盐水,可以说是盐把水的凝固点降到了0度以下.)1年前查看全部
- 物质的量 试题 在物质的量浓度相同的两种一元弱酸钠盐溶液中分别通入适量的二氧化碳,发生如下反应
物质的量 试题 在物质的量浓度相同的两种一元弱酸钠盐溶液中分别通入适量的二氧化碳,发生如下反应
在物质的量浓度相同的两种一元弱酸钠盐溶液中分别通入适量的二氧化碳,发生如下反应:NaR+CO2+H2O===HR+NaHCO3 ; 2NaR’+CO2+H2O====2HR’+Na2CO3
把HR和HR’在水中电离出氢离子的能力做比较,则( )
A.HR较强 B.HR’较强
我知道得氢能力大就酸性小.我们老师说的是hr和na2co3不共存的问题,希望能从这个角度来告诉我一下,或者其他角度,20号11点前给出详细解答的给分, _wing__1年前1
_wing__1年前1 -
 尖叫的风筝 共回答了20个问题
尖叫的风筝 共回答了20个问题 |采纳率100%A
HR酸性强
HR+Na2CO3--->NaR+NaHCO3
而HR'没有这个反应1年前查看全部
- 热水瓶内胆的壁上沉积的水垢(主要成分是碳酸钙和氢氧化钙).可以加入适量的盐酸把它除掉.说明去水垢的原理.(写出化学方程式
热水瓶内胆的壁上沉积的水垢(主要成分是碳酸钙和氢氧化钙).可以加入适量的盐酸把它除掉.说明去水垢的原理.(写出化学方程式)
人的胃液理含有少量的***帮助消化.胃酸过多的病人常服用胃舒平(主要成分是氢氧化铝)或内服墨鱼骨粉(主要成分是碳酸钙)进行治疗.其原理可分别用化学方程式表为______________________________________ 帝高阳苗裔1年前4
帝高阳苗裔1年前4 -
 butterfly1 共回答了13个问题
butterfly1 共回答了13个问题 |采纳率100%CaCO3+2HCl==CaCl2+H2O+CO2(气体符号)
Ca(OH)2+2HCl==CaCl2+2H2O
Al(OH)3+3HCl==AlCl3+3H2O
CaCO3+2HCl==CaCl2+H2O+CO2(气体符号)
热水瓶内胆的壁上沉积的水垢一般用醋酸啊 !1年前查看全部
- (2009•威海)下面是小方设计的“测食用油密度”的实验方案:用天平测出空烧杯的质量m1,向烧杯内倒入适量食用油,再测出
(2009•威海)下面是小方设计的“测食用油密度”的实验方案:用天平测出空烧杯的质量m1,向烧杯内倒入适量食用油,再测出烧杯和食用油的总质量m2,然后把烧杯内的食用油全部倒入量筒内,读出量筒内食用油的体积为V1,根据他的设计,回答下面的问题:
(1)按该实验方案进行测量,食用油密度的表达式是ρ=m2−m1 V1 ρ=,上述实验方案存在的问题是误差较大,试分析产生误差较大的主要原因______.m2−m1 V1
(2)请你将上述实验方案进行改进并补充填写实验内容于下表,并将图中实验的数据及测量结果填入表中对应的下一行.
烧杯和食用油的总质量/g 33.3 
 knifedz1年前1
knifedz1年前1 -
 庄子装孙子 共回答了20个问题
庄子装孙子 共回答了20个问题 |采纳率85%解题思路:(1)从小方的设计方案中找出质量与体积,根据密度公式写出表达式;小方的方案中“把烧杯内的食用油全部倒入量筒内”会使的液体不能全部倒入量筒内,从而使密度出现很大的误差;
(2)改进其测量方法使的质量与体积都是准确的,并将所测量的量从图中读出填入表中.(1)小方的方案中:空瓶质量m1;瓶与油的质量m2;量筒中油的体积V1;所以密度ρ=
m2−m1
V1;
(2)改进方案:
①用天平测出烧杯和食用油的总质量m1;
②将适量的油倒入量筒中测出其体积V;
③用天平测出烧杯和剩余油的总质量m2;
④计算倒出油的质量m=m1-m2;
⑤计算食用测量的密度ρ=
m1−m2
V;
根据图中数据填入表中,并计算油的密度.
故答案为:
(1)ρ=
m2−m1
V1;实验中未能将所有液体倒入到量筒中,导致所测油的体积偏小而使密度偏大;
(2)如下表
烧杯和食用油的总质量m1/g 烧杯和剩余油的总质量m2/g 倒出油的质量m/g 倒出油的体积V/cm3 油的密度ρ/g•cm-3
33.3 17.3 16 20 0.8点评:
本题考点: 液体密度的测量.
考点点评: 考查液体密度的测量,实验中会存在误差,小方的方案中误差的主要来源是测量方法不科学,可以改进;
本题中比较难的问题是实验表格的设计,应将所测量的物理量名称及单位填写正确.1年前查看全部
- 车用乙醇汽油是在汽油中加入适量的乙醇而形成的混合燃料.使用这种汽油不但不影响汽车的行驶性能,而且可减少有害气体的排放,这
车用乙醇汽油是在汽油中加入适量的乙醇而形成的混合燃料.使用这种汽油不但不影响汽车的行驶性能,而且可减少有害气体的排放,这对解决***粮食转化,促进农业生产良性循环具有十分重要的意义.根据上述报道回答:
(1)乙醇能代替汽油作为燃料,是因为乙醇中含有______元素和______元素;
(2)燃烧乙醇比燃烧汽油减少了对大气的污染,这是因为乙醇中不含有______元素和______元素;
(3)乙醇主要是粮食中的淀粉等转化而成的,淀粉是绿色植物通过光合作用由水和二氧化碳两种物质转化而成的.植物光合作用可简单表示为:水+二氧化碳
淀粉+氧气.由此判断:淀粉中一定含有______元素和______元素.叶绿体 光  lj79_621年前1
lj79_621年前1 -
 fxx84 共回答了14个问题
fxx84 共回答了14个问题 |采纳率85.7%(1)乙醇能代替汽油作为燃料,是因为乙醇中含有碳元素和氢元素.
故填:碳;氢.
(2)因为乙醇中不含有硫元素和氮元素,燃烧时不能产生二氧化硫、氮氧化物,减少了对大气的污染.
故填:硫;氮.
(3)由水+二氧化碳
叶绿体
光 淀粉+氧气可知,水中的氢元素和二氧化碳中的碳元素转化到了淀粉中,所以淀粉中一定含有碳元素和氢元素,是否含有氧元素无法确定.
故填:碳;氢.1年前查看全部
- 现有一包固体粉末,可能是CaCO3、Na2CO3、Na2SO4、CuSO4、NaCl中的一种或几种,为确定其组成,取适量
现有一包固体粉末,可能是CaCO3、Na2CO3、Na2SO4、CuSO4、NaCl中的一种或几种,为确定其组成,取适量试样进行下列实验.请根据实验现象判断:
(1)取试样溶于水,得到无色澄清溶液,则此固体粉末中一定没有______.
(2)取上述溶液适量,滴加过量的BaCl2溶液,出现白色沉淀,再加入过量的稀硝酸,沉淀部分消失并产生气泡.则此固体粉末中一定有______.
(3)取步骤(2)实验后的上层清液,加入稀硝酸、硝酸银溶液,出现白色沉淀,由此该同学得出此固体粉末中一定含有NaCl,你认为此结论是否正确______(填“是”或“否”).
(4)对于是否含有NaCl,你认为应对步骤(2)作如何改进______(若步骤(3)填“是”,此空不作答).
(5)写出上述反应的任意一个化学方程式:______. 小志1191年前1
小志1191年前1 -
 alpha100 共回答了15个问题
alpha100 共回答了15个问题 |采纳率93.3%解题思路:(1)溶于水得到无色澄清溶液,说明原试样中无溶于水后显颜色的物质、无不溶于水的物质,排除CaCO3、CuSO4;
(2)滴加过量的BaCl2溶液,出现白色沉淀,白色沉淀可能是碳酸钡或硫酸钡;再根据“加入过量的稀硝酸,沉淀部分消失并产生气泡”沉淀消失产生气泡的是碳酸根,沉淀不能溶解于稀硝酸的是硫酸钡,判断固体中一定有Na2CO3、Na2SO4可以据此解答;
(3)步骤(2)中已经引入了氯离子,故本小题加入稀硝酸、硝酸银溶液出现白色沉淀,只能确定清液中含氯离子,不能判断原溶液中一定含NaCl,可以据此解答;
(4)要确定是否含NaCl,应该排除氯离子的干扰,所以在步骤(2)中不能引入氯离子,可以据此解答;
(5)根据上述分析可以写出任意一个反应的化学方程式.(1)原试剂中CaCO3不溶于水,CuSO4溶于水得到蓝色溶液,根据题中信息可以判断原固体粉末中一定不含CaCO3和CuSO4这两种物质;
(2)根据实验操作及物质的相互反应现象可以知道,滴加过量的BaCl2溶液,出现白色沉淀,白色沉淀可能是碳酸钡或硫酸钡;再根据“加入过量的稀硝酸,沉淀部分消失并产生气泡”沉淀消失产生气泡的是碳酸根,沉淀不能溶解于稀硝酸的是硫酸钡,判断固体中一定有Na2CO3、Na2SO4可以据此解答;
(3)步骤(2)中已经引入了氯离子,加入稀硝酸、硝酸银溶液出现白色沉淀,只能确定清液中含氯离子,不能判断原溶液中一定含NaCl;
(4)要确定是否含NaCl,应该排除氯离子的干扰,所以在步骤(2)中不能引入氯离子,可将BaCl2溶液换成Ba(NO3)2溶液或Ba(OH)2溶液;
(5)根据上述解答可以知道,所发生的其中一个反应为碳酸钠和氯化钡的反应,该反应的化学方程式为:Na2CO3+BaCl2═BaCO3↓+2NaCl.
故答案为:
(1)CaCO3、CuSO4;
(2)Na2CO3、Na2SO4;
(3)否;
(4)将BaCl2溶液换成Ba(NO3)2溶液或Ba(OH)2溶液;
(5)Na2CO3+BaCl2═BaCO3↓+2NaCl.点评:
本题考点: 物质的鉴别、推断.
考点点评: 本题属于实验探究题,较难,解此类试题时要熟记常见物质的特殊反应现象,如鉴别硫酸根离子用钡离子、鉴别氯离子用银离子、碳酸根与酸反应产生气体等.1年前查看全部
- 弹簧测力计下挂一个密度大于水的物块,如图甲所示.水平桌面上的容器中盛有适量的水,将物块浸没在水中,如图乙所示,则物块浸没
弹簧测力计下挂一个密度大于水的物块,如图甲所示.水平桌面上的容器中盛有适量的水,将物块浸没在水中,如图乙所示,则物块浸没在水中后,下列说法错误的是( )
 A. 弹簧测测力计的示数变小
A. 弹簧测测力计的示数变小
B. 水对容器底的压强变大
C. 桌面受到的压强变大
D. 桌面受到的压力不变 不会睡的鱼1年前3
不会睡的鱼1年前3 -
 david5518 共回答了15个问题
david5518 共回答了15个问题 |采纳率93.3%解题思路:(1)将物块浸没在水中,由于物块受到水的浮力,弹簧测力计的示数将变小;(2)物块浸没在水后,排开了一定体积的水,使水的深度增加,根据液体压强公式p=ρgh判断水对容器底部的压强变化;(3)物块浸没在水中,物块受到水的浮力,水受到物块的反作用力,桌面受到的压力等于容器和水的总重加上物块对水的反作用力,据此分析桌面受到的压力变化;而受力面积不变,根据p=FS确定桌面受到的压强变化.A、甲图,F拉=G;乙图,将物块浸没在水中,由于物块受到水的浮力,弹簧测力计的示数F′=G-F浮,所以弹簧测力计的示数将变小,故A正确;
B、物块浸没在水中后,水的深度h增加,由p=ρgh可知水对容器底部的压强变大,故B正确;
CD、物块未浸没在水中时,桌面受到的压力F=G水+G容器;物块浸没在水中后,物块受到水的浮力,水受到物块的反作用力F物,桌面受到的压力F′=G水+G容器+F物,可见桌面受到的压力变大;而受力面积不变,由p=[F/S]可知桌面受到的压强变大,故C正确、D不正确.
故选D.点评:
本题考点: 阿基米德原理;压强的大小及其计算;液体的压强的特点.
考点点评: 本题考查了学生对液体压强公式、压强定义式、浮力的了解与掌握,会对物块进行正确的受力分析是本题的关键.1年前查看全部
- 为什么除去碳酸钠溶液中的碳酸氢钠用适量的氢氧化钠
为什么除去碳酸钠溶液中的碳酸氢钠用适量的氢氧化钠
为什么不用过量 vbcc661年前1
vbcc661年前1 -
 妖怪0号 共回答了15个问题
妖怪0号 共回答了15个问题 |采纳率100%除杂质的要求是在除去杂质的同时不能带入新的杂质.因此除去碳酸钠溶液中的碳酸氢钠用适量的氢氧化钠,可以让适量的氢氧化钠与杂质碳酸氢钠刚好完全反应,生成碳酸钠和水,不会带入新的杂质,如果用过量的氢氧化钠,在...1年前查看全部
- (2012•泸州)如图所示,水平桌面上放置有甲、乙两个完全相同的圆柱形烧杯,分别装入适量的密度不同但质量相等的盐水,将同
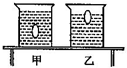 (2012•泸州)如图所示,水平桌面上放置有甲、乙两个完全相同的圆柱形烧杯,分别装入适量的密度不同但质量相等的盐水,将同一个鸡蛋先后放入甲、乙两个烧杯中,鸡蛋在甲烧杯中处于悬浮状态,在乙烧杯中处于漂浮状态.下列判断正确的是( )
(2012•泸州)如图所示,水平桌面上放置有甲、乙两个完全相同的圆柱形烧杯,分别装入适量的密度不同但质量相等的盐水,将同一个鸡蛋先后放入甲、乙两个烧杯中,鸡蛋在甲烧杯中处于悬浮状态,在乙烧杯中处于漂浮状态.下列判断正确的是( )
A.甲杯中盐水密度为ρ甲,乙杯中盐水密度为ρ乙,则ρ甲>ρ乙
B.鸡蛋在甲、乙两烧杯中受到的浮力分别为F浮和
,则F浮>F ′浮F ′浮
C.放入鸡蛋后,甲、乙两烧杯对桌面的压力分别为F甲和F乙,则F甲>F乙
D.放入鸡蛋后,甲、乙两烧杯底部受到的压强分别为P甲和P乙,则P甲=P乙 爱情gg在坟墓1年前1
爱情gg在坟墓1年前1 -
 冰雪西湖 共回答了15个问题
冰雪西湖 共回答了15个问题 |采纳率66.7%解题思路:(1)同一只鸡蛋无论漂浮或悬浮,其浮力都等于排开盐水的重,也等于自身的重力;在浮力相同时,排开的液体体积越大,说明液体的密度是越小的.
(2)水平面上物体的压力和自身的重力相等,据此可知甲、乙两烧杯对桌面的压力关系.
(3)粗细均匀容器底部受到的压力等于液体的重力和漂浮(或悬浮)物体的重力之和,根据p=[F/S]判断甲、乙两烧杯底部受到的压强关系.(1)因为鸡蛋在甲中悬浮、乙中漂浮,所以浮力都等于自身的重力,即鸡蛋在甲、乙两烧杯中受到的浮力相等,故B不正确;
根据F浮=ρ液gV排可知,在浮力相同时,甲杯中的V排大,所以ρ液小,故A不正确;
(2)因甲、乙两个烧杯完全相同,装入密度不同但质量相等的盐水,且鸡蛋一样,
根据水平面上物体的压力和自身的重力相等和G=mg可知,放入鸡蛋后甲、乙两烧杯对桌面的压力相等,故C不正确;
(3)烧杯粗细均匀,装入密度不同但质量相等的盐水,且鸡蛋一样,所以甲、乙两烧杯底部受到的压力相等,
因两烧杯底面积S相同,根据p=[F/S]可知,两只杯子底部受到液体的压强相同,故D正确.
故选D.点评:
本题考点: 液体的压强的计算;阿基米德原理;物体的浮沉条件及其应用.
考点点评: 本题考查了物体浮沉条件、阿基米德原理、压力和压强大小的比较等,综合性强,难度较大;解题时要注意压强公式的正确选择.1年前查看全部
- 底面积为S1的圆柱形容器内盛有适量密度为ρ的液体,在滑轮组的下方,悬挂一底面积为S2的圆柱形物体A,此物
 sd92003581年前1
sd92003581年前1 -
 暗黑灵 共回答了12个问题
暗黑灵 共回答了12个问题 |采纳率91.7%题目的其余部分是不是这样的:“此物体部分浸入液体中,如图所示.当绳的自由端被向上拉动距离s时(物体下表面一直保持在液体中),定滑轮对天花板的拉力变化量为多少?”
如果是的话,可以这样分析:
设图中物体浸入液体的深度为h,则F=(G物-F浮+G动)/3=(G物+G动-ρgS2h)/3,
这时定滑轮对天花板的拉力:F拉=2F,
即 F拉=2(G物+G动-ρgS2h)/3……①
当绳的自由端被向上拉动距离s时,物体上升h'=s/3,这时容器内液面下降了Δh,由于物体下表面一直保持在液体中,所以应有:Δh(S1-S2)=S2h',
即Δh=sS2/[3(S1-S2)];
这时绳子自由端的拉力F'拉=(G物-F'浮+G动)/3=[G物+G动-ρgS2(h-Δh)]/3
∴定滑轮对天花板的拉力:F'拉=2F',
即 F'拉=2[G物+G动-ρgS2(h-Δh)]/3……②
②-①,得定滑轮对天花板的拉力变化量为:
F'拉-F拉=2ρgS2Δh/3=2ρg(S2)²s/[9(S1-S2)]1年前查看全部
- 取a g Na2O2与Al粉组成的混合物,放入适量的水中,固体完全溶解,在标况下放出气体体积为V L,则V的取值范
 lg00001年前1
lg00001年前1 -
 qiyueleilei 共回答了18个问题
qiyueleilei 共回答了18个问题 |采纳率88.9%设Na2O2 物质的量为xmol ,Al 物质的量为ymol
2Na2O2 + 2H2O === 4NaOH + O2↑ 2Al+2NaOH+2H2O === 2NaAlO2 + 3H2↑
相同质量的Al比Na2O2 产生的气体要多,所以当Al越多气体越多,但是固体完全溶解,因此当Al与Na2O2产生的NaOH恰好反应时气体最多.此时
78x+27y=a y=2x V=(x/2+3y/2)*22.4
相反,Al越少气体越少,当Al为0时,产生的气体最少,此时
V=22.4*x/2=22.4*a/2*78
需要注意是最大值可以取到,而最小值却不能取到.1年前查看全部
- 要除去碳粉中的氧化铜加适量盐酸搅拌过滤可以吗?如不行怎么半
 chen51chen1年前3
chen51chen1年前3 -
 jh8779 共回答了17个问题
jh8779 共回答了17个问题 |采纳率88.2%可以.
C不与盐酸反应,CuO+2HCl=CuCl2+H2O反应生成的CuCl2溶于水,过滤即可.1年前查看全部
- (1)某同学把一只生鸡蛋,放在盛有生石灰的烧杯中,再加入适量的水,看到有许多水蒸汽冒出,一段时间后,该同学猜想:鸡蛋变熟
(1)某同学把一只生鸡蛋,放在盛有生石灰的烧杯中,再加入适量的水,看到有许多水蒸汽冒出,一段时间后,该同学猜想:鸡蛋变熟了.请你分析,该同学的想法是否合理?______(选填“合理”或“不合理”).这个实验说明了生石灰与水反应时______(选填“吸收”或“放出”)热量,反应的化学方程式为______.
(2)钢铁的生产和使用是人类文明进步的一个重要标志.每年世界上钢铁的产量很高,但钢铁的锈蚀也给人类带来了巨大的损失.铁在空气中锈蚀,实际上是铁跟______、______ 等物质相互作用的结果.试举两种减缓钢铁锈蚀的方法:①______、②______. 小他_ii1年前1
小他_ii1年前1 -
 潇染 共回答了17个问题
潇染 共回答了17个问题 |采纳率94.1%解题思路:(1)生石灰的主要成分是氧化钙,具有吸水性常用作干燥剂,可与水反应生成氢氧化钙,同时放出大量的热;
(2)了解铁锈蚀的条件;防护的方法有刷油漆、涂油、烧涂搪瓷等方法防锈.(1)生石灰的成分为氧化钙,可与水反应生成氢氧化钙,同时放出大量的热,所以该同学猜测生石灰溶于水可将鸡蛋变熟的猜测是合理的,反应的方程式是:CaO+H2O═Ca(OH)2;
(2)铁在空气中锈蚀,是因为铁与空气中的氧气和水共同作用的结果;可用刷油漆、涂油等方法减缓钢铁锈蚀;
故答案为:(1)合理;放热;CaO+H2O═Ca(OH)2;
(2)氧气;水;刷油漆;涂油.点评:
本题考点: 生石灰的性质与用途;金属锈蚀的条件及其防护;物质发生化学变化时的能量变化;书写化学方程式、文字表达式、电离方程式.
考点点评: 生石灰与水发生反应时放出大量的热,可以在有的变化中充分利用起生石灰溶于水放出的热量,达到节约资源的目的;铁生锈是与氧气和水共同作用的结果,本题重在考查身边化学,更加贴近生活和生产,考查学生对知识的掌握和运用,可以使学生感受到“生活处处有化学”.1年前查看全部
- (2011•西宁)将适量的橡皮泥黏在铅笔的一端(能使铅笔竖直浮在液体中),这就制成了一个很有用的土仪器.将它分别放在盛有
 (2011•西宁)将适量的橡皮泥黏在铅笔的一端(能使铅笔竖直浮在液体中),这就制成了一个很有用的土仪器.将它分别放在盛有不同液体的杯中,静止时的情景如图所示.对于这个土仪器所运用的知识或用途,下列说法不正确的是( )
(2011•西宁)将适量的橡皮泥黏在铅笔的一端(能使铅笔竖直浮在液体中),这就制成了一个很有用的土仪器.将它分别放在盛有不同液体的杯中,静止时的情景如图所示.对于这个土仪器所运用的知识或用途,下列说法不正确的是( )
A.运用了二力平衡的知识
B.运用了物体的漂浮条件
C.用它可以比较不同液体密度的大小
D.用它直接可以测出液体密度的大小 illusion30001年前1
illusion30001年前1 -
 mengxinghun 共回答了6个问题
mengxinghun 共回答了6个问题 |采纳率83.3%解题思路:从图中可以看出,物体在不同液体中,浸入的深度不同,但始终漂浮,所以浮力相等,等于自身的重力,根据公式F浮=ρgV排可以比较液体密度的大小.物体在液体中漂浮,浮力等于重力,故A、B正确,不符合题意;
从图中可以看出,仪器在三种液体中排开液体的体积大小,根据公式F浮=ρgV排可以比较三种液体密度的大小,但无法直接读出液体密度的大小,故C正确,不符合题意;D错误,符合题意.
故选D.点评:
本题考点: 浮力的利用;二力平衡条件的应用;物体的浮沉条件及其应用.
考点点评: 本题考查二力平衡条件的应用和物体的漂浮条件以及浮力公式的应用,关键知道影响浮力大小的因素是液体的密度和物体排开液体的体积,还要知道物体漂浮时浮力等于自身重力.1年前查看全部
- (2010•青岛模拟)目前,生产自来水常使用适量的氯气,因为:Cl2+H2O=HCl+HClO,HClO有漂白作用,还能
(2010•青岛模拟)目前,生产自来水常使用适量的氯气,因为:Cl2+H2O=HCl+HClO,HClO有漂白作用,还能用于消毒杀菌.而新型净水剂高铁酸钠(Na2FeO4)效果更好,且对人体无害.则下列说法错误的是( )
A.氯气与水发生的反应属于置换反应
B.HClO中氯元素的化合价为+1价
C.用自来水养鱼需要先晒上一段时间
D.Na2FeO4中高铁酸根(FeO4)的化合价为-2价 哭的女人1年前1
哭的女人1年前1 -
 9909077 共回答了17个问题
9909077 共回答了17个问题 |采纳率100%解题思路:本题利用HClO和Na2FeO4的化学式及在化合物中H、0、Na等元素的化合价根据正负化合价的代数和为0来分析Cl元素和FeO4的化合价,利用化学反应Cl2+H2O=HCl+HClO来分析反应类型及用自来水养鱼需要先晒的原因.A、因只有氯气为单质,单质与化合物反应生成单质与化合物的反应属于置换反应,则反应Cl2+H2O=HCl+HClO不属于置换反应,则A说法错误,故A正确.
B、HClO中,H为+1价,O为-2价,则由正负化合价的代数和为0,Cl元素的化合价为+1价,则B说法正确,故B错误;
C、自来水中含有氯气,HClO能用于消毒杀菌,阳光照射可使HClO分解,减小氯气的含量,增大氧气的含量,则用自来水养鱼需要先晒上一段时间,说法正确,故C错误;
D、Na2FeO4中,Na元素为+1价,则高铁酸根(FeO4)的化合价为-2价,说法正确,故D错误;
故选A.点评:
本题考点: 有关元素化合价的计算;常见元素与常见原子团的化合价;化合价规律和原则;置换反应及其应用.
考点点评: 本题考查化合价及化学反应,学生正确把握化学式在解题中的重要作用,了解化学与生活的紧密联系.1年前查看全部
- 天平(无砝码,无游码)一个量杯,一条细绳,一些细沙及适量水(Þ水=1克/立方厘米)求测小石块密度
天平(无砝码,无游码)一个量杯,一条细绳,一些细沙及适量水(Þ水=1克/立方厘米)求测小石块密度
要求(1)实验步骤(详细)及测量的物理量
(2)推出用所测物理量表达矿石密度的表达式 巨蟹啊蹦1年前1
巨蟹啊蹦1年前1 -
 chianren910 共回答了19个问题
chianren910 共回答了19个问题 |采纳率84.2%(1)将量杯放在天平右盘,往左盘加细沙,直到天平平衡.
(2)将小石块(视石块大小,若太小,则多放几块)放入左盘,向右盘量杯中加水,直到两边平衡.
(3)读出量杯中水的体积V1.水的质量即小石块的质量,所以m(石)=m(水)=Þ(水)*V1.
(4)将刚才称量的小石块放入量杯中,再读出水的体积V2,则小石块体积V(石)=V2-V1.
小石块密度=m(石)/V(石)=Þ(水)*V1/(V2-V1)1年前查看全部
- 在硫酸铜溶液中加入适量的氢氧化钠溶液后再滴入适量甲醛溶液,加热,可观察现象是..
在硫酸铜溶液中加入适量的氢氧化钠溶液后再滴入适量甲醛溶液,加热,可观察现象是..
1.蓝色氢氧化铜沉淀
2.红色氧化铜沉淀.
3.加热后现象是什麽?
是最后加热后的现象..加氢氧化钠和甲醛现象都知道了..我要的是加热可观察到的现象 heavybright1年前1
heavybright1年前1 -
 my780307 共回答了19个问题
my780307 共回答了19个问题 |采纳率94.7%产生砖红色Cu2O(氧化亚铜)沉淀.
因为硫酸铜溶液中加入适量的氢氧化钠生成新制氢氧化铜(蓝色),它可以把甲醛氧化为甲酸,自己被还原为Cu2O.
2Cu(OH)2+CH2O(甲醛)=HCOOH(甲酸)+Cu2O(砖红色)↓+2H2O1年前查看全部
- 制取溴乙烷,反应中加入适量的水,除了溶解HBr ,其作用还有什么
 清渡枫紫1年前1
清渡枫紫1年前1 -
 wanglongxin9 共回答了21个问题
wanglongxin9 共回答了21个问题 |采纳率95.2%稀释浓硫酸.太浓的硫酸会将乙醇氧化为乙酸.1年前查看全部
- (2013•上海模拟)PbO2在酸性溶液中能将Mn2+氧化成MnO4-,本身被还原为Pb2+.取一支试管,加入适量PbO
(2013•上海模拟)PbO2在酸性溶液中能将Mn2+氧化成MnO4-,本身被还原为Pb2+.取一支试管,加入适量PbO2固体和适量的稀H2SO4后滴入2mL 1mol/L MnSO4溶液.下列说法错误的是( )
A.充分振荡后静置,溶液颜色变为紫色
B.上述实验中不能用盐酸代替硫酸
C.在酸性条件下,PbO2的氧化性比MnO4-的氧化性强
D.若上述实验完全反应,消耗PbO2的物质的量为0.01mol 静公主1241年前1
静公主1241年前1 -
 nature4 共回答了25个问题
nature4 共回答了25个问题 |采纳率80%解题思路:PbO2和稀H2SO4及 MnSO4溶液发生反应的离子方程式为:5PbO2+4H++2Mn2+=2MnO4-+5Pb2++2H2O,
A.充分振荡后静置,发生氧化还原反应生成高锰酸根离子,高锰酸根离子为紫色;
B.用盐酸代替硫酸,氯离子会被PbO2氧化;
C.氧化剂的氧化性大于氧化产物;
D.根据锰离子的物质的量结合离子方程式进行计算.PbO2和稀H2SO4及 MnSO4溶液发生反应的离子方程式为:5PbO2+4H++2Mn2+=2MnO4-+5Pb2++2H2O,A.充分振荡后静置,发生氧化还原反应生成高锰酸根离子,溶液颜色变为紫色,故A正确;B.用盐酸代替硫酸,氯离子会被Pb...
点评:
本题考点: 氧化性、还原性强弱的比较.
考点点评: 本题考查氧化还原反应的相关知识,难度不大,要注意氧化剂的氧化性大于氧化产物的氧化性.1年前查看全部
- (2013•湖北)小强同学用三支试管,分别取适量的稀盐酸、澄清石灰水、碳酸钠溶液,进行相关实验探究.
(2013•湖北)小强同学用三支试管,分别取适量的稀盐酸、澄清石灰水、碳酸钠溶液,进行相关实验探究.
小强把三支试管中的溶液同时倒入一只烧杯中,发现有气泡产生,最终有白色沉淀生成且溶液显红色;
把烧杯中的混合物进行过滤,得到滤液,滤液中一定不含A(答案).
(选填答案:A、稀盐酸 B、澄清石灰水 C、碳酸钠溶液
我的理解:有气泡说明盐酸和碳酸钠反应,同时说明盐酸和氢氧化钙反应完了(因为中和反应优先)所以没有氢氧化钙了,溶液显红色,说明无盐酸,所以我觉得应选A和B 月半明1年前1
月半明1年前1 -
 雨思丝 共回答了17个问题
雨思丝 共回答了17个问题 |采纳率94.1%碱 A 现象:有白色沉淀生成且红色不消失;
因为(红色消失)无法证明NaOH存在.1年前查看全部
- 碘水中加入适量的CCl4,振荡静置后,上层是什么颜色?
 如影N随风1年前2
如影N随风1年前2 -
 狼or虫 共回答了18个问题
狼or虫 共回答了18个问题 |采纳率77.8%先是淡黄,完全萃取后上层变为水无色.1年前查看全部
- 在玻璃板上滴些水,然后把一搪瓷盘放在上面,并往盘中放适量的干冰,过一会儿,玻璃板和搪瓷盘就会粘合,这是因为干冰在( )过
在玻璃板上滴些水,然后把一搪瓷盘放在上面,并往盘中放适量的干冰,过一会儿,玻璃板和搪瓷盘就会粘合,这是因为干冰在( )过程中,需要从周围物体( ),使玻璃上的水的温度( )直到( )
 cbgjn1年前1
cbgjn1年前1 -
 小猫856 共回答了17个问题
小猫856 共回答了17个问题 |采纳率94.1%升华 吸热 降低 结晶1年前查看全部
- 粉末状态试样A是由等物质的量的MgO和Fe2O3组成混合物.进行如下实验:(1)取适量A进行铝热反应,产物中有单质B生成
粉末状态试样A是由等物质的量的MgO和Fe2O3组成混合物.进行如下实验:(1)取适量A进行铝热反应,产物中有单质B生成;(2)另取20 g A全部溶于0,15,L 6.0 m0l
 dillon41151年前1
dillon41151年前1 -
 舞蝶小精灵 共回答了21个问题
舞蝶小精灵 共回答了21个问题 |采纳率100%步骤一:MgO、Fe2O3铝热反应后产物为:MgO、Fe、Al2O3,故单质B为Fe.
步骤二:20g的A中两种物质的物质的量相等,可推断出两者皆为0.1mol;
0.15L 6mol/L 的盐酸中,HCl物质的量:0.90mol
反应后有0.1molMgCl2,0.2molFeCl3,0.1molHCl.
步骤三、四:根据步骤四,得到步骤三反应后产物中不含Fe3+,只有Fe,Fe2+,可推断出:
单质B(Fe)先与溶液C余下的0.1mol盐酸反应,
2Fe+6HCl=2FeCl3+3H2(上升符号)
0.1 a 0.05 (为了方便计算,先用a代替)
得到0.05mol氢气,氯化铁,然后
所有氯化铁与铁反应:
2FeCl3+Fe=3FeCl2a+0.2 0.35因此反应完毕,n(Mg2+)=0.1mol n(Fe2+)=0.35mol1年前查看全部
- 量筒 但无砝码 测密度 急有一个已调平的自制带托盘的等臂杠杆,两只完全相同的烧杯,一只量筒,一支滴管,细线,适量的水,如
量筒 但无砝码 测密度 急
有一个已调平的自制带托盘的等臂杠杆,两只完全相同的烧杯,一只量筒,一支滴管,细线,适量的水,如何测小石块密度? lkhf2301年前1
lkhf2301年前1 -
 mybiao 共回答了15个问题
mybiao 共回答了15个问题 |采纳率93.3%1.用天平测出小石块的质量m
2.在量筒中倒入适量的水加下体积v1
3.把小石块用细线系着慢慢放入量筒中几下体积v2
小石块的密度表达式就是m/v2-v11年前查看全部
- 小明在纸叠的小船中加入适量的水,用酒精灯加热纸船下面,纸船却安然无恙.纸船未燃烧的原因是( ) A.纸船不是可燃物 B
小明在纸叠的小船中加入适量的水,用酒精灯加热纸船下面,纸船却安然无恙.纸船未燃烧的原因是( ) A.纸船不是可燃物 B.未与氧气接触 C.未达到着火点 D.纸船既未与氧气接触,也未达到着火点  半糖mm女生1年前1
半糖mm女生1年前1 -
 三个人De烟火 共回答了11个问题
三个人De烟火 共回答了11个问题 |采纳率81.8%A、纸船是可燃物,故A说法错误;
B、纸船与氧气接触,故B说法错误;
C、温度没有达到纸船的着火点,所以纸船不会燃烧;故C说法正确;
D、纸船既与氧气接触,也达到着火点,故D说法错误.
故选C.1年前查看全部
- 在一个试管中放入一些鸡毛,再倒入适量的浓氢氧化钠溶液,然后加热,现象是
在一个试管中放入一些鸡毛,再倒入适量的浓氢氧化钠溶液,然后加热,现象是
如果不慎将碱液沾到皮肤上应如何处理 vivianok1年前3
vivianok1年前3 -
 吉祥之旅 共回答了14个问题
吉祥之旅 共回答了14个问题 |采纳率92.9%蛋白质水解
干布擦去后用大量清水冲洗1年前查看全部
- 硫酸与锌粉反应为减缓反应速率50g质量分数为32%硫酸溶液与锌粉反应,为减缓反应速率,又不影响生成氢气总质量,应加入适量
硫酸与锌粉反应为减缓反应速率
50g质量分数为32%硫酸溶液与锌粉反应,为减缓反应速率,又不影响生成氢气总质量,应加入适量的
氢氧化钾溶液 氯化钾溶液 碳酸钾溶液 水 (可多选 望大家指教) 脂猪侠5461年前1
脂猪侠5461年前1 -
 阿飞歪传 共回答了26个问题
阿飞歪传 共回答了26个问题 |采纳率96.2%水肯定可以,氯化钾也行相当于水.氢氧化钾不行会中和硫酸,碳酸钾类似会产生CO2减少氢离子.1年前查看全部
- 用一架天平,一只空瓶和适量纯水测定牛奶的密度,应测量哪些物理量
 隐于山林1年前1
隐于山林1年前1 -
 ygufds 共回答了12个问题
ygufds 共回答了12个问题 |采纳率91.7%先用天平测出空瓶质量,往瓶中倒满水,用天平测出水和瓶的总质量,减去空瓶质量得到一瓶水的质量,再通过水的密度为1克每立方厘米计算空瓶容积V,再倒满牛奶,用天平称出总质量,减空瓶质量得到牛奶的质量m,用m除以V就得出了牛奶密度1年前查看全部
- 蒸馒头时在发好的面中要加入适量纯碱(NaCO3)以中和发酵后生成的酸性物质,你认为用碱面好还是用碱溶液好?说明其中的原因
蒸馒头时在发好的面中要加入适量纯碱(NaCO3)以中和发酵后生成的酸性物质,你认为用碱面好还是用碱溶液好?说明其中的原因.
 SH6204021年前3
SH6204021年前3 -
 子萧敛 共回答了15个问题
子萧敛 共回答了15个问题 |采纳率86.7%这需要视情况而定,面比较干就用纯碱碱液,适中或略软就用纯碱粉末.不过纯碱(Na2CO3!)需要研得很细,否则就有可能因没揉匀而出现斑斑点点的黄块,这样就有些不如小苏打(NaHCO3).1年前查看全部
- (2012•闵行区二模)硫酸铜是一种应用广泛的化工原料.实验室中可将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使
(2012•闵行区二模)硫酸铜是一种应用广泛的化工原料.实验室中可将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1所示).

(1)配制质量分数20%的硫酸需要100mL 98%的浓硫酸(密度为1.84g/cm3)和______mL蒸馏水.配制所需仪器除烧杯、量筒、胶头滴管外,还需要的仪器有______.
(2)图1中烧瓶中发生的离子反应方程式为______.
(3)图2是图1的改进装置,其优点有:①______;②______.
为符合绿色化学的要求,某研究性学习小组进行了如下设计:
方案1:以空气为氧化剂.将铜粉在某仪器A中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应.反应后,过滤、蒸发、结晶等,用少量95%的酒精淋洗后晾干,得CuSO4•5H2O晶体.
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应.向反应液中加Fe2(SO4)3,即发生反应.反应完全后向其中先后加入物质甲、物质乙,取样检验后,过滤、蒸发、结晶,滤渣可循环使用.[已知Fe(OH)2、Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为9.6、3.7和6.4.]
(4)方案l中的A仅器名称是______.晶体采用酒精淋洗的优点是______.
(5)方案2中物质甲可以是______(选填答案编号,下同),物质乙可以是______.
a.Cub.CuCO3c.CuOd.氨水e.氯水f.双氧水
取样检验是为了确认Fe3+是否除净.有同学设计了以下两种方法:
方法①:取样于试管→滴加KSCN溶液;方法②:径向层析→喷KSCN溶液
指出你认为不合理的方法及存在的问题______.
(6)用铜粉制硫酸铜,上述方案1、方案2都不是十分理想,一种更符合绿色化学理念的是在氧气存在时用热稀硫酸与铜粉反应,其化学方程式是2Cu+O2+2H2SO4
2CuSO4+2H2O△ .2Cu+O2+2H2SO4.
2CuSO4+2H2O△ . kjh19821年前1
kjh19821年前1 -
 天堂衣 共回答了23个问题
天堂衣 共回答了23个问题 |采纳率91.3%解题思路:(1)根据配制溶液前后溶质的质量不变计算,浓硫酸配制稀硫酸注意利用玻璃棒不断搅拌;
(2)烧瓶中发生Cu与稀硝酸的氧化还原反应;
(3)图2中中间的装置可防止倒吸,并发生氮的氧化物与水的反应;
(4)由铜粉在某仪器A中反复灼烧,使铜与空气充分反应生成氧化铜分析;酒精与水互溶,除去晶体中的水并减少晶体溶解;
(5)加入的甲为氧化剂,能氧化亚铁离子;物质乙起调节pH的作用并除杂;确认Fe3+是否除净应注意铜离子的颜色造成的干扰;
(6)在氧气存在时用热稀硫酸与铜粉反应生成硫酸铜,以此书写化学反应方程式.(1)配制质量分数20%的硫酸需要100mL 98%的浓硫酸(密度为1.84g/cm3),设需要水xmL,
由配制溶液前后溶质的质量不变,则[100×1.84×98%/100×1.84+x×1]×100%=20%,解得x=717.6,浓硫酸稀释放出大量的热,应利用玻璃棒不断搅拌,
故答案为:717.6;玻璃棒;
(2)烧瓶中发生Cu与稀硝酸的氧化还原反应,离子反应为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(3)由装置比较可知,装置2中多出的装置能①溶液不导管不直接接触,防止倒吸,②NO与氧气及碱反应,使有害气体能被完全吸收,故答案为:防止倒吸;有害气体能被完全吸收;
(4)由铜粉在某仪器A中反复灼烧,使铜与空气充分反应生成氧化铜,则A为坩埚,酒精与水互溶,除去晶体中的水并减少晶体溶解,则晶体采用酒精淋洗的优点是酒精与水互溶且极易挥发,减少晶体溶解,
故答案为:坩埚;酒精与水互溶且极易挥发,减少晶体溶解;
(5)由方案可知,Cu与Fe2(SO4)3反应,应除去亚铁离子,则加入f将亚铁离子氧化为铁离子,再利用bc促进铁离子水解转化为沉淀而除去,确认Fe3+是否除净的方法①中Cu2+的蓝色对检验有干扰,故答案为:f;bc;方法①中Cu2+的蓝色对检验有干扰;
(6)在氧气存在时用热稀硫酸与铜粉反应生成硫酸铜,该化学反应为2Cu+O2+2H2SO4
△
.
2CuSO4+2H2O,故答案为:2Cu+O2+2H2SO4
△
.
2CuSO4+2H2O.点评:
本题考点: 制备实验方案的设计;硝酸的化学性质;铜金属及其重要化合物的主要性质;配制一定物质的量浓度的溶液.
考点点评: 本题考查硫酸铜制备实验方案的设计,明确装置的作用及发生的氧化还原反应是解答本题的关键,注意除杂的方法及物质的成分、性质的差异、盐类水解的知识来解答,综合性较强,题目难度较大.1年前查看全部
- 20摄氏度,饱和石灰水(甲溶液)加入适量氧化钙粉末,充分反应.
20摄氏度,饱和石灰水(甲溶液)加入适量氧化钙粉末,充分反应.
溶液未恢复到20摄氏度时,为什么溶质质量分数比甲溶液小呢, chenoon1年前1
chenoon1年前1 -
 zhangzhi 共回答了15个问题
zhangzhi 共回答了15个问题 |采纳率80%因为氢氧化钙的溶解度的变化规律是“随温度的升高而下降”
但加入氧化钙反应后消耗了水(与其反应)而且增加了溶质
显然是饱和的,又因为温度高于20度,溶解度随温度的升高而下降
所以溶质质量分数比甲溶液小1年前查看全部
- 在测定食用油密度的实验中 A 称出空玻璃杯的质量为30gB在玻璃被中倒入适量的食用油,称出他们的质量为74.4gC称出玻
在测定食用油密度的实验中
A 称出空玻璃杯的质量为30g
B在玻璃被中倒入适量的食用油,称出他们的质量为74.4g
C称出玻璃杯和杯中剩余食用油质量为40g
D把天平放在水平桌面上,调节天平平衡
E把玻璃杯中的一部分食用油倒入量筒,读出食用油的体积40立方厘米
(1)请将以上实验步骤中必要步骤选出,并排序
(2)根据数据,算出食用油的密度 余波荡漾1年前1
余波荡漾1年前1 -
 johnhackett 共回答了20个问题
johnhackett 共回答了20个问题 |采纳率85%1.排列顺序 D B E C
2.量筒里油的质量是 74.4g-40g=34.4g
量筒里油的体积是40立方厘米
油的密度=质量/体积=34.4g/40=0.86g/立方厘米.
好好学习吧,这道物理题不是难题.考察的是密度的测量,上课认真听讲的话,这种类型的题目是不会有问题的,
加油!1年前查看全部
- 下列各项中括号里的物质是除去杂质所用的药品(适量),其中错误的是( ) A.NaCl混有Na 2 CO 3 (盐酸)
下列各项中括号里的物质是除去杂质所用的药品(适量),其中错误的是( ) A.NaCl混有Na 2 CO 3 (盐酸) B.铁粉中混有铜粉(盐酸) C.H 2 中混有HCl(NaOH溶液) D.硫酸亚铁溶液中混有硫酸铜(铁粉)  暮残小声1年前1
暮残小声1年前1 -
 LinLinaa 共回答了29个问题
LinLinaa 共回答了29个问题 |采纳率93.1%A、碳酸钠和盐酸反应会生成氯化钠、水和二氧化碳,加热蒸发后只剩下氯化钠,故A错误,
B、盐酸会与铁反应而不与铜反应,混合物中加盐酸,没有除去杂质,除去了主要物质,故B正确,
C、氢氧化钠会将氯化氢吸收,而不会与氢气反应,最后剩下了氢气,故C错误,
D、铁和硫酸铜反应置换出铜,过滤后,就剩下了硫酸亚铁,故D错误,
故选B.1年前查看全部
- (2013•百色)如图所示,水平桌面上的容器内装有适量的水,小明把重为2.7N的物体A悬挂在测力计下并将物体A放入水中,
 (2013•百色)如图所示,水平桌面上的容器内装有适量的水,小明把重为2.7N的物体A悬挂在测力计下并将物体A放入水中,当物体A全部浸没在水中时,测力计示数为1.7N,求:
(2013•百色)如图所示,水平桌面上的容器内装有适量的水,小明把重为2.7N的物体A悬挂在测力计下并将物体A放入水中,当物体A全部浸没在水中时,测力计示数为1.7N,求:
(1)物体A全部浸没在水中受到的浮力是多少?
(2)物体A的体积是多少?(水的密度ρ水=1×103kg/m3)
(3)物体A的密度是多少? 游乐儿_虫虫1年前0
游乐儿_虫虫1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 一道初2上学期的物理题如图所示,密闭容器内有适量的水,如果容器倒过来放置,则水对容器底的压力、压强A.压强变小,压力变大
一道初2上学期的物理题
如图所示,密闭容器内有适量的水,如果容器倒过来放置,则水对容器底的压力、压强
A.压强变小,压力变大
B.压强变大,压力变小
C.压力、压强都不变
D.压力、压强都变大
———
/
/ ∷∷水
/∷ 水 ∷∷
———————
说明理由啊
图片弄不好,是一个梯形容器,里面有大概一半水,上小下大. liuzimin1年前1
liuzimin1年前1 -
 刚才刚才 共回答了22个问题
刚才刚才 共回答了22个问题 |采纳率81.8%选B
因为容器倒过来水高度上升,根据P=ρgh,ρ、g不变,h增大,所以压强P变大.
又因为容器底受到的压力等于容器底上方水的重力,容器倒过来后上大下小,水的一部分重力被容器壁分摊,所以底部受到压力小于实际水的重力,与倒过来前恰恰相反,所以低部受到压力变小.所以选B1年前查看全部
- 取健康人的血液若干毫升,加入抗凝剂后静置,再取上清液于试管中并加入适量胰岛素溶液,一段时间内试管液体中的葡萄糖含量(
取健康人的血液若干毫升,加入抗凝剂后静置,再取上清液于试管中并加入适量胰岛素溶液,一段时间内试管液体中的葡萄糖含量( )
A. 逐渐减少
B. 基本不变
C. 不断增加
D. 先增后减 doom121年前1
doom121年前1 -
 依然小魔星 共回答了14个问题
依然小魔星 共回答了14个问题 |采纳率92.9%解题思路:激素是信息分子,能够传递调节代谢信息的作用,激素必须与靶细胞或靶器官结合后才能发挥作用.胰岛素能够促进血糖的去路,具有降低血糖的作用.人的血浆中没有细胞.胰岛素是人体内唯一降低血糖的激素,能够促进血糖的去路,具有降低血糖的作用,其作用的靶细胞几乎是全身的细胞,没有活细胞胰岛素的生理作用无法得到体现,所以取上清液于试管中并加入适量胰岛素溶液,一段时间内试管液体中的葡萄糖含量基本不变.
故选:B.点评:
本题考点: 体温调节、水盐调节、血糖调节
考点点评: 本题主要考查血糖的调节和激素作用的发挥调节,意在强化学生对相关知识点的识记与理解.1年前查看全部
- 大量酸洒到桌子上,可加适量什么中和,然后水洗.大量碱洒到桌子上,可加适量什么中和,然后水洗?
 jimaodilaoshu1年前2
jimaodilaoshu1年前2 -
 dj-dl 共回答了20个问题
dj-dl 共回答了20个问题 |采纳率95%小苏打 就是碳酸氢钠 这样反应也不是很剧烈 也能够中和 价格也较为便宜 苏打的话也可以 就是冒泡多些 反应剧烈些 碱的话加硼酸或者醋酸1年前查看全部
- 气压计:在一只玻璃瓶中装入适量水,瓶口加一只塞子,塞子中扎一小孔,插入一根玻璃管
气压计:在一只玻璃瓶中装入适量水,瓶口加一只塞子,塞子中扎一小孔,插入一根玻璃管
1这个土“气压————高度计”的工作原理是什么?
2当持着这个“气压————高度计”从一楼走到五楼时,玻璃管内水柱是上升还是下降?
3你认为这个“气压————高度计”在制作和使用时应注意什么问题? 流浪人07551年前1
流浪人07551年前1 -
 jacky5110 共回答了21个问题
jacky5110 共回答了21个问题 |采纳率95.2%1、原理是:p内=p水柱+p大气压=pgh+p大气压
2、一楼到五楼,p大气压变小,瓶内变化不大,所以p水柱必须变大,上升
3、应注意;该气压高度计受温度影响(因温度影响瓶内气体气压),制作时气密性要好,玻璃管要细等1年前查看全部
- 在一个玻璃瓶中装适量水,用棍子敲打瓶外壁,则水越多,音调越高,水越少,音调越低;但用嘴向瓶里吹气时,水越多,音调越低,水
在一个玻璃瓶中装适量水,用棍子敲打瓶外壁,则水越多,音调越高,水越少,音调越低;但用嘴向瓶里吹气时,水越多,音调越低,水越少,音调越高.
 龙山圣殿骑士1年前4
龙山圣殿骑士1年前4 -
 俩说相声的 共回答了26个问题
俩说相声的 共回答了26个问题 |采纳率92.3%这个问题实际上比较简单
关键是你知不知道音调与什么因素有关
从课本上可以知道与频率有关
以琴弦为例:弦越细、越紧、越短,其振动的频率就会越高,音调也就越高
这种题型有三类(先判断声源,再判断如何变化):
1.敲击瓶子 声源是瓶子和水 水越多 声源越长 音调越低
2.灌水 声源是空气柱 水越多 空气柱越短 音调越高
3.吹气 声源是空气柱 水越多 空气柱越短 音调越高
所以你上面说的是错误的.1年前查看全部
- 弱酸HA,电离方程HA=H++a-,向溶液中加入适量NAA固体,平衡将?怎样移动?c(A-)和c(OH-)的变化?
 ltm36939131年前1
ltm36939131年前1 -
 手拉着手 共回答了20个问题
手拉着手 共回答了20个问题 |采纳率95%因为有电离平衡存在: HA =H+ + A-
加入NaA固体,NaA = Na+ + A- (完全电离) 增大了A-的浓度,平衡向左移动.根据勒夏特里原理,平衡移动只能减弱A-的增大,但不能改变A-增大的趋势,最终A-浓度变大.
而上述平衡左移结果造成H+的浓度减小, 而在水溶液中,C(H+) * C(OH-) =K(常数),因此,C(OH-)=K / C(H+)是增大的.1年前查看全部
- doc某无色气体X,可能含有CO2、SO2、HCl、HBr中的一种或几种.将X通过适量的氯水时,
 serenehe1年前3
serenehe1年前3 -
 qq1019 共回答了21个问题
qq1019 共回答了21个问题 |采纳率90.5%CO2没反应
SO2使氯水褪色
HCL没反应
HBR使氯水变色,产生HCL和BR2,使溶液呈橙色1年前查看全部
- 1、下端封闭上端开口的玻璃管竖直放置着,玻璃管中装有适量的水.在把玻璃管由竖直放置逐渐变为倾斜放置的过程中,水对玻璃管底
1、下端封闭上端开口的玻璃管竖直放置着,玻璃管中装有适量的水.在把玻璃管由竖直放置逐渐变为倾斜放置的过程中,水对玻璃管底部的压强 ( )
A.逐渐变大.B.逐渐变小.C.不变.D.无法确定.
2、医生给病人吊注生理盐水时,将盐水瓶的位置提高一些,这样做用的主要物理知识是什么?
3、你看到过油库里的储油罐吗?它浑身银白,直径很大,高度低矮,一个人都像:“矮胖子”一样,为什么储油罐要设计成这种形状呢? 我该下注吗1年前5
我该下注吗1年前5 -
 dd回来我的儿子 共回答了22个问题
dd回来我的儿子 共回答了22个问题 |采纳率90.9%B.逐渐变小.
相同液体中,h越大,压强越大.
矮胖形一方面比较安全,重心低,倾倒困难,底部液体压强也小;一方面相同的容积,这种形状也比较节省材料(比起长条形).1年前查看全部
大家在问
- 1下列实验过程中,始终无明显现象的是 &
- 2一个圆锥形容器的底面半径是10cm,高是15cm.用它盛满水,然后将水全部倒入长25cm,宽5cm的长方体容器内,水面高
- 3两年前他还小不能上学上周二我考试不及格去年叔叔把我从沈阳接走两个小时前司机把我送回家哦
- 4如果x=5,y=2是二元一次方程3mx-2y-1=0的解,则m=?
- 5给老师的一封信六年级600字(不在教师节)
- 6隋炀帝杨广是不是比秦二世胡亥强太多了?
- 7已知方程4x^2-2(k+1)x+k=0的两根恰好是一个直角三角形的两个锐角的余弦,...
- 8已知:四边形ABCD中,角B=角D=90度,角A=120度.AB=12,CD=10倍根号3,求ADD的长?
- 9已知Sn是等比数列{an}的前n项和,设公比为q,且S3,S9,S6成等差数列.
- 10如图,在三角形ABC中,角B的平分线与角C的外角平分线相交于D,若角A=80°,则角D为
- 11有A克浓度为百分之15的硝酸钠溶液,若想将其浓度变为百分之30,可在用的方法是A蒸发掉溶剂1/2,B蒸发掉A/2
- 12在氢气还原氧化铜的试验中,先通入氢气一会儿的目的是
- 13学校图书馆有科幻书和漫画书共272本,科幻书的本数是漫画书的3倍.科幻书和漫画书各有多少本?
- 14把5分之4、0·9、4分之5 、8分之9,案从小到大的顺序排
- 15高中几何:求点A(-2,1,2)到平面3x-2y+5z+10=0的距离.
