粉末状态试样A是由等物质的量的MgO和Fe2O3组成混合物.进行如下实验:(1)取适量A进行铝热反应,产物中有单质B生成
 dillon41152022-10-04 11:39:541条回答
dillon41152022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 舞蝶小精灵 共回答了21个问题
舞蝶小精灵 共回答了21个问题 |采纳率100%- 步骤一:MgO、Fe2O3铝热反应后产物为:MgO、Fe、Al2O3,故单质B为Fe.
步骤二:20g的A中两种物质的物质的量相等,可推断出两者皆为0.1mol;
0.15L 6mol/L 的盐酸中,HCl物质的量:0.90mol
反应后有0.1molMgCl2,0.2molFeCl3,0.1molHCl.
步骤三、四:根据步骤四,得到步骤三反应后产物中不含Fe3+,只有Fe,Fe2+,可推断出:
单质B(Fe)先与溶液C余下的0.1mol盐酸反应,
2Fe+6HCl=2FeCl3+3H2(上升符号)
0.1 a 0.05 (为了方便计算,先用a代替)
得到0.05mol氢气,氯化铁,然后
所有氯化铁与铁反应:
2FeCl3+Fe=3FeCl2a+0.2 0.35因此反应完毕,n(Mg2+)=0.1mol n(Fe2+)=0.35mol - 1年前
相关推荐
- 1、某铁的氧化物粉末可能含有FeO、Fe 2 O 3 中的一种或两种.某兴趣小组同学利用以下装置测定铁的氧化物的组成,请
1、某铁的氧化物粉末可能含有FeO、Fe 2 O 3 中的一种或两种.某兴趣小组同学利用以下装置测定铁的氧化物的组成,请回答下列问题:(已知 ) (1)装置甲的作用是 .(2)装置丁中的实验现象是 .(3)若丙中铁的氧化物的化学式为Fe x O y ,则丙中反应的化学方程式为 .若丙中铁的氧化物质量为3.92g,且完全反应,丁中生成沉淀的质量为13.79g,试确定该氧化物中x:y= ,该固体粉末的组成为 .就做第三题 (3)Fe x O y +yCO=(△)xFe + yCO 2 5∶7 nFeO∶nFe 2 O 3 =1∶2 最后一个瓶中放的溶液时氢氧化钡
 小欣1161年前1
小欣1161年前1 -
 dadaniya1 共回答了13个问题
dadaniya1 共回答了13个问题 |采纳率84.6%(1)装置甲的作用是吸收CO2. H2C2O4通过浓H2SO4的强氧化作用反应会生成CO和CO2,用甲装置吸收CO2,剩下的CO去还原铁的氧化物. (2)装置丁中的实验现象是变浑浊,产生白色沉淀.CO通过还原铁的氧化物会产生CO2, CO2+Ba(OH)2=BaCO3↓+H2O (3)CO2+Ba(OH)2=BaCO3↓+H2O 44 197 X 13.79 可以求出X等于3.08,及还原产生的CO2有3.08g. Fe x O y +yCO=(△)xFe + yCO 2 56x+16y 44y 3.92 3.08 求出X:Y=5:7 设FeO和Fe 2 O 3 各有a,b份,可以列出a+2b=5和a+3b=7两个算式.解得a=1,b=2所以FeO∶Fe 2 O 3 =1∶21年前查看全部
- 某同学将浑浊的湖水样品倒入烧杯中,先加入白色粉末搅拌溶解,静置一会后,用下列图1所示的装置进行过滤,请问:
 某同学将浑浊的湖水样品倒入烧杯中,先加入白色粉末搅拌溶解,静置一会后,用下列图1所示的装置进行过滤,请问:
某同学将浑浊的湖水样品倒入烧杯中,先加入白色粉末搅拌溶解,静置一会后,用下列图1所示的装置进行过滤,请问:
(1)白色粉末的名称是______.
(2)如图中还缺少的一种仪器,该仪器的作用是______.
(3)过滤后发现,滤液仍浑浊,可能的原因是______.(一种即可)
(4)改进后过滤,得到了澄清透明的水,这种水是______(填纯净物、混合物)
(5)他按图2将该水电解:______(填甲或乙)试管里产生的是氧气. admy1年前1
admy1年前1 -
 来了3 共回答了21个问题
来了3 共回答了21个问题 |采纳率95.2%解题思路:根据已有的知识进行分析,净化水时可以加入明矾;根据过滤操作的仪器以及过滤操作注意事项进行分析;电解水时产生的氧气体积较小,据此解答.(1)加入的白色粉末是明矾,故填:明矾;
(2)过滤操作中需要使用玻璃棒进行引流,故填:引流;
(3)过滤后的滤液仍然浑浊,可能是滤纸破损,也可能是液面高于滤纸边缘,还可能是仪器本身不干净,故填:滤纸破损;
(4)过滤得到的水中仍然含有可溶性杂质,是混合物,故填:混合物;
(5)观察图示可以看出,乙管内得到的气体体积较小,是氧气,故填:乙.点评:
本题考点: 水的净化;过滤的原理、方法及其应用;电解水实验.
考点点评: 本题考查了净水以及电解水的知识,完成此题,可以依据已有的知识进行.1年前查看全部
- (2008•常德)某化学实验室有一瓶黑色固体粉末X(X是纯净物),因试剂瓶标签破损无法确定其成分.为此小军进行了以下实验
(2008•常德)某化学实验室有一瓶黑色固体粉末X(X是纯净物),因试剂瓶标签破损无法确定其成分.为此小军进行了以下实验,请你参与他的探究:
(一)探究X的成分
【猜想与假设】物质X可能是______;
【实验设计与实施】取两份等量的X样品,进行实验一、实验二: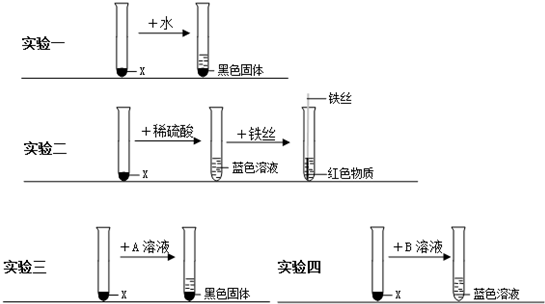
【实验分析与结论】
①从“实验一”小军得出X的物理性质是:______;
②从“实验二”小军推断出X的化学式是______;
③“实验二”中向蓝色溶液插入铁丝发生反应的化学方程式是______.
(二)探究X与稀硫酸的反应
(1)稀硫酸中含有H2O、H+、SO42-等粒子,其中属于分子的有______;属于离子的有______;
(2)小军分析“实验一、二”后认为:可能是稀硫酸中的H+或SO42-使X溶解.
为确定稀硫酸中何种粒子使X溶解,他继续设计了实验三、实验四进行探究:
“实验三”中的A可能是______(填化学式,下同),“实验四”中的B可能是______;
(3)小军通过上述实验证明:稀硫酸中的______(填离子符号)才能使X溶解;
(4)某同学建议小军:要确定稀硫酸中何种粒子使X溶解,只需进行实验一、二、三即可.你是否同意该同学的观点?______(填“同意”或“不同意”) handgun1年前1
handgun1年前1 -
 zfj25 共回答了18个问题
zfj25 共回答了18个问题 |采纳率88.9%(一)【猜想与假设】初中化学实验室常见的黑色粉末有CuO、MnO2、Fe3O4、铁粉、炭粉等,根据以实验知,能和硫酸等物质反应,可猜想为氧化铜,故答案为:CuO【实验分析与结论】①从“实验一”可知,X不溶于水,故答案...1年前查看全部
- 放NaOH溶液的试剂瓶口有白色粉末,小刚取少量白色粉末,滴加稀盐酸,有气体生成.则认为是Na2CO3.
放NaOH溶液的试剂瓶口有白色粉末,小刚取少量白色粉末,滴加稀盐酸,有气体生成.则认为是Na2CO3.
判断小刚的结论是否正确,并简述理由. 半日花年1年前1
半日花年1年前1 -
 poolo1983 共回答了23个问题
poolo1983 共回答了23个问题 |采纳率69.6%对
NaOH吸收空气中CO2得到Na2CO3.1年前查看全部
- (2011•梧州模拟)已知甲、乙为两种黑色粉末,丙是一种红色固体,丁为一种蓝色溶液的溶质,A是一种能使澄清石灰水变浑浊的
 (2011•梧州模拟)已知甲、乙为两种黑色粉末,丙是一种红色固体,丁为一种蓝色溶液的溶质,A是一种能使澄清石灰水变浑浊的气体,它们的相互转化关系如图所示.请用正确的化学式填空:
(2011•梧州模拟)已知甲、乙为两种黑色粉末,丙是一种红色固体,丁为一种蓝色溶液的溶质,A是一种能使澄清石灰水变浑浊的气体,它们的相互转化关系如图所示.请用正确的化学式填空:
A是______,甲是______,丙是______,丁是______. koppen1年前1
koppen1年前1 -
 非琉璃 共回答了23个问题
非琉璃 共回答了23个问题 |采纳率91.3%解题思路:由于甲乙反应能够生成能使澄清石灰水变浑浊的气体A和红色的固体,可以猜测甲乙是碳和氧化铜,而甲能够与稀硫酸反应,故甲是氧化铜,以此为突破口分析解答即可;由于甲乙反应能够生成能使澄清石灰水变浑浊的气体A(二氧化碳)和红色的固体(铜),可以猜测甲乙是碳和氧化铜中的一种,而甲能够与稀硫酸反应,故甲是氧化铜,丁为一种蓝色溶液的溶质则丁是硫酸铜,硫酸铜溶液能够与铁发生置换反应生成铜和硫酸亚铁,故A是CO2;甲是CuO;丙是Cu;丁是CuSO4;
故答案为:CO2;CuO;Cu;CuSO4;点评:
本题考点: 物质的鉴别、推断.
考点点评: 本题为推断题,根据题给条件和物质的化学特性找准突破口,然后顺藤摸瓜完成解答.1年前查看全部
- 在100mL稀盐酸中假如混合均匀的NaHCO3和KHCO3固体粉末,充分反应后使气体全部逸出.图示是假如粉末的质量与产生
在100mL稀盐酸中假如混合均匀的NaHCO3和KHCO3固体粉末,充分反应后使气体全部逸出.图示是假如粉末的质量与产生CO2(该状况下,气体的密度为1.964g/L)体积的关系.请计算
(1)该盐酸中HCl的质量.
(2)若该盐酸为120mL时,加入粉末为58.5g,产生CO2体积为yL.试写出粉末质量x(g)与产生那个CO2体积y(L)之间的关系
(3)若粉末质量为xg,该盐酸体积为140ml,产生的CO2体积为yL.试着写出粉末质量x(g)与产生co2体积y(L)之间的关系
将第二问改为若该盐酸为120mL时,加入粉末为58.5g,求产生CO2的体积

 兰江离1年前2
兰江离1年前2 -
 wqfjim 共回答了14个问题
wqfjim 共回答了14个问题 |采纳率85.7%(1)m(HCl)=11.2*1.964*36.5/44=18.25g
(2)y=11.2x/45(1年前查看全部
- 小雨同学将浑浊的湖水样品倒入烧杯中,先加入明矾粉末搅拌溶解,静置一会儿,采用如图所示装置进行过滤,请回答过滤后仍然浑浊的
 小雨同学将浑浊的湖水样品倒入烧杯中,先加入明矾粉末搅拌溶解,静置一会儿,采用如图所示装置进行过滤,请回答过滤后仍然浑浊的原因是什么?(至少写出三条)
小雨同学将浑浊的湖水样品倒入烧杯中,先加入明矾粉末搅拌溶解,静置一会儿,采用如图所示装置进行过滤,请回答过滤后仍然浑浊的原因是什么?(至少写出三条)  步履无需匆匆1年前1
步履无需匆匆1年前1 -
 janesn 共回答了15个问题
janesn 共回答了15个问题 |采纳率80%解题思路:根据过滤(“一贴、二低、三靠”的原则)操作的注意事项进行分析解答即可.过滤后滤液仍浑浊,可能原因是滤纸破损(会使得液体中的不溶物进入下面的烧杯,从而使得滤液浑浊)、液面高于滤纸边缘(会使部分液体未经过滤纸的过滤直接流下,该操作会使滤液仍然浑浊)或盛接滤液的烧杯不干净等.
故答案为:(1)滤纸破损;(2)液面高于滤纸边缘;(3)仪器不干净.
故答案为:(1)滤纸破损;(2)滤液边缘高于滤纸边缘;(3)盛接滤液的烧杯不干净.点评:
本题考点: 过滤的原理、方法及其应用.
考点点评: 本题难度不大,掌握过滤操作(“一贴、二低、三靠”的原则)的注意事项等即可正确解答本题.1年前查看全部
- 实验装置如图,B中的固体物质可能是碳酸钙或锌或两者的混合物,D中的黑色粉末可能是炭粉或氧化铜或两者的混合物,向A中加入稀
实验装置如图,B中的固体物质可能是碳酸钙或锌或两者的混合物,D中的黑色粉末可能是炭粉或氧化铜或两者的混合物,向A中加入稀盐酸,点燃酒精灯(或对D加强热),根据实验现象回答:

(1)如果G中出现白色浑浊,H处导出的气体不可燃,U型管中的白色硫酸铜无明显现象,则在B中反应的方程式______,D中放入的粉末是______.
(2)如果U型管中的无水硫酸铜变为蓝色,G中的石灰水仍澄清,H处导出的气体可以点燃,则B中反应的方程式______,D中放入的粉末是______.
(3)如果U型管中的无水硫酸铜变为蓝色,G中的石灰水变浑浊,H处导出的气体可以点燃,则B和D中的固体物质分别可能是:(有几种填几种,可以不填满)
B中①______,D中①______
B中②______,D中②______
B中③______,D中③______. 加3分1年前1
加3分1年前1 -
 clppcb 共回答了22个问题
clppcb 共回答了22个问题 |采纳率95.5%解题思路:(1)根据G中出现白色浑浊,H处导出的气体不可燃,U型管中的白色硫酸铜无明显现象,可知产物有二氧化碳,没有可燃性气体及水的产生进行分析;
(2)根据U型管中的无水硫酸铜变为蓝色,G中的石灰水仍澄清,H处导出的气体可以点燃,可知有水和可燃性气体的产生,没有二氧化碳的产生进行解答;
(3)根据U型管中的无水硫酸铜变为蓝色,G中的石灰水变浑浊,H处导出的气体可以点燃,说明有水、二氧化碳和可燃性气体的产生进行解答.(1)实验现象G中出现白色浑浊,说明有二氧化碳生成;U型管中的白色硫酸铜无明显现象,H处导出的气体不可燃,说明没有水生成,即没有氢气,装置B中盛放的固体物质应是碳酸钙,而没有金属锌,反应的方程式为:2HCl+CaCO3=CaCl2+CO2↑+H2O;装置D玻璃管内盛放的黑色粉末是氧化铜;
(2)装置G中的石灰水仍澄清可知没有二氧化碳生成;U型管中的无水硫酸铜变为蓝色,说明有水的生成,因而有氢气产生,因而装置B盛放的固体物质是锌,其中发生反应的化学方程式是:2HCl+Zn=ZnCl2+H2↑;装置D玻璃管内盛放的黑色粉末是氧化铜;
(3)U型管中的无水硫酸铜变为蓝色,说明有水生成,则水是氢气和氧化铜反应生成的,说明装置B中一定含有锌,装置D玻璃管内一定含有氧化铜;G中的石灰水变浑浊,可能是碳酸钙和盐酸反应产生的,也可能是碳和氧化铜反应产生的;因此,若B中没有碳酸钙,则D中一定含有碳;若B中含有碳酸钙,则D中可能含有碳;故可能的组合是:①Zn;CuO、C;②Zn、CaCO3;CuO;③Zn、CaCO3;CuO、C.
故答案为:(1)2HCl+CaCO3=CaCl2+CO2↑+H2O; 氧化铜;
(2)2HCl+Zn=ZnCl2+H2↑; 氧化铜;
(3)①Zn;CuO、C;②Zn、CaCO3;CuO;③Zn、CaCO3;CuO、C.点评:
本题考点: 物质的鉴别、推断;酸的化学性质;碳的化学性质;书写化学方程式、文字表达式、电离方程式;氢气的化学性质与燃烧实验.
考点点评: 此题是一道实验探究综合题,解题的关键是对根据实验的现象及实验目的原理结合物质的性质据此分析,得出结论,难度较大.1年前查看全部
- (2011年浙江丽水,37题)氢气还原氧化铜实验得到的固体粉末为氧化铜和铜的混合物,科学兴趣小组的同学对该粉末中单质铜含
(2011年浙江丽水,37题)氢气还原氧化铜实验得到的固体粉末为氧化铜和铜的混合物,科学兴趣小组的同学对该粉末中单质铜含量进行测定,三组同学各取10克粉末样品置于烧杯中,然后加入不同质量的稀硫酸,充分反应后,对烧杯中剩余固体进行称量,实验数据记录如下:
组别编号 样品质量(克) 加入稀硫酸质量(克) 剩余固体质量(克) 1 10 20 8.4 2 10 30 8 3 10 40 8
(1)分析表中数据可知,第2组实验中的剩余固体是 。(写出物质名称或符号)
(2)样品中单质铜的质量分数为 。
(3)加入的稀硫酸溶质质量分数是多少?(写出计算过程) xinlong12171年前0
xinlong12171年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 有关硫酸铜晶体的问题我们说硫酸铜晶体中是由离子构成的,是不是因为其中含有水分子?无水硫酸铜和硫酸铜粉末是同一种东西吗?是
有关硫酸铜晶体的问题
我们说硫酸铜晶体中是由离子构成的,是不是因为其中含有水分子?
无水硫酸铜和硫酸铜粉末是同一种东西吗?是由离子构成还是由原子构成的? 忘记爱情1231年前3
忘记爱情1231年前3 -
 20103326 共回答了16个问题
20103326 共回答了16个问题 |采纳率87.5%硫酸铜内有阴阳离子的强烈相互作用,有离子键,所以说是由离子构成的.
无水硫酸铜可以说就是硫酸铜粉末,是由离子构成的.
事实上,强碱,大部分的盐和活泼金属氧化物都是由离子构成的.1年前查看全部
- “火立熄”是一种新型的家用灭火用品.“火立熄”接触到火焰3~5秒后炸开,释放的粉末覆盖在可燃物上,同时放出不可燃气体,使
“火立熄”是一种新型的家用灭火用品.“火立熄”接触到火焰3~5秒后炸开,释放的粉末覆盖在可燃物上,同时放出不可燃气体,使火焰熄灭.其灭火原理是( ) A.清除可燃物 B.使可燃物与氧气隔绝 C.降低了可燃物的着火点 D.使温度降低到着火点以下  dfbggfhnjg1年前1
dfbggfhnjg1年前1 -
 胡桃夹梓 共回答了13个问题
胡桃夹梓 共回答了13个问题 |采纳率84.6%.“火立熄”接触到火焰3-5秒后炸开,释放的粉末覆盖在燃烧物上,这样就使可燃物与氧气隔绝,使火焰熄灭.
故选B.1年前查看全部
- 教材中有一个演示实验:用脱脂棉包住约0.2 g Na 2 O 2 粉末,置于石棉网上,可观察到脱脂棉燃烧起来。
教材中有一个演示实验:用脱脂棉包住约0.2 g Na 2 O 2 粉末,置于石棉网上,可观察到脱脂棉燃烧起来。
(1)由实验现象能得出的有关Na 2 O 2 与水反应的结论是:a.有氧气生成;b._____________。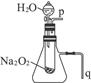
(2)某研究性学习小组拟用如右图所示装置进行实验,以证明上述结论。
①用以验证结论a的实验方法及现象是_____________________________________________。
②用以验证结论b的实验方法及现象是_____________________________________________。 ll51年前1
ll51年前1 -
 mfdyw 共回答了19个问题
mfdyw 共回答了19个问题 |采纳率94.7%(1)该反应是放热反应
(2)①将带火星的木条靠近导管口p处,木条复燃 ②将导管q放入水中,反应过程中导管口有气泡冒出
(1)脱脂棉燃烧的条件:一是有氧气(空气),二是达到其着火点,所以结论b应是该反应是放热反应。
(2)产生的O 2 必定从p口逸出,所以可用带火星的木条在此处检验;反应放热必使试管外锥形瓶内的空气膨胀,故可在q处验证。1年前查看全部
- 现有一包固体粉末,其中可能含有碳酸钙、硫酸钠、碳酸钠、硫酸铜与氯化钠,进行如下实验1溶于水得无色...
现有一包固体粉末,其中可能含有碳酸钙、硫酸钠、碳酸钠、硫酸铜与氯化钠,进行如下实验1溶于水得无色...
现有一包固体粉末,其中可能含有碳酸钙、硫酸钠、碳酸钠、硫酸铜与氯化钠,进行如下实验1溶于水得无色溶液,2向溶液中加氯化钡溶液生成白色沉淀,在加盐酸沉淀消失,跟据上述实验现象推断(1)一定不存在的物质有?(2)一定存在的物质有?(3)可能存在的物质有 liuge0141年前5
liuge0141年前5 -
 rainmanp 共回答了21个问题
rainmanp 共回答了21个问题 |采纳率81%溶于水得无色溶液,没有碳酸钙(沉淀)和硫酸铜(蓝色)
加氯化钡生成白色沉淀,加盐酸沉淀消失,沉淀是BaCO3,没有硫酸根.有碳酸钠,无硫酸钠.
一定有碳酸钠,一定无碳酸钙、硫酸铜与硫酸钠,可能有氯化钠1年前查看全部
- 废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.
废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.
(1)写出工业上制备印刷电路板原理的离子方程式:______
(2)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是______(填字母).
A.热裂解形成燃油B.露天焚烧
C.作为有机复合建筑材料的原料D.直接填埋
(3)用H 2 O 2 和H 2 SO 4 的混合溶液可溶出印刷电路板金属粉末中的铜.
写出在H 2 SO 4 溶液中Cu与H 2 O 2 反应生成Cu 2+ 和H 2 O的离子方程式______.
(4)控制其他条件相同,印刷电路板的金属粉末用10% H 2 O 2 和3.0mol•L -1 H 2 SO 4 的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表).
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______.温度(℃) 20 30 40 50 60 70 80 铜平均溶解速率(×10 -3 mol•L -1 •min -1 ) 7.34 8.01 9.25 7.98 7.24 6.73 5.76
(5)在提纯后的CuSO 4 溶液中加入一定量的Na 2 SO 3 和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是______. 天行罪星1年前1
天行罪星1年前1 -
 妫子 共回答了21个问题
妫子 共回答了21个问题 |采纳率90.5%(1)金属铜可以和氧化性的三价铁之间发生氧化还原反应,其离子方程式为:Cu+2Fe 3+ =Cu 2+ +2Fe 2+ ,故答案为:Cu+2Fe 3+ =Cu 2+ +2Fe 2+ ;
(2)露天焚烧会产生污染环境的气体,直接填埋时会引起水体和土壤的污染,故选:BD;
(3)金属铜在酸性环境下和双氧水的反应为:Cu+H 2 O 2 +2H + =Cu 2+ +2H 2 O,故答案为:Cu+H 2 O 2 +2H + =Cu 2+ +2H 2 O;
(4)根据测得不同温度下铜的平均溶解速率的数据,会发现随着温度的升高,铜的平均溶解速率,当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,因为双氧水受热易分解,导致金属铜的反应速率减慢,故答案为:H 2 O 2 分解速率加快;
(5)根据题干信息,可知发生的反应为2Cu 2+ +SO 3 2- +2Cl - H 2 O
△
.
2CuCl↓+SO 4 2- +2H + ,故答案为:2Cu 2+ +SO 3 2- +2Cl - +H 2 O
△
.
2CuCl↓+SO 4 2- +2H + .1年前查看全部
- 提取指纹用的那个粉末是什么成分?
提取指纹用的那个粉末是什么成分?
我看那些***用啥子粉末一喷,指纹就现出来了,我想就是问一下,这种粉末是什么,成分是什么? 西门子0071年前1
西门子0071年前1 -
 kent_2006 共回答了16个问题
kent_2006 共回答了16个问题 |采纳率87.5%原始一点的是用碘蒸气来熏
现代一点的还有用激光等物理方法
个人还听说用硝酸银1年前查看全部
- 13.9g XSO4•nH2O晶体,完全失水后,剩余7.6g粉末,若X的原子量为结晶水分子数的8倍,则X的原子
13.9g XSO4•nH2O晶体,完全失水后,剩余7.6g粉末,若X的原子量为结晶水分子数的8倍,则X的原子量为( )
A. 23
B. 27
C. 40
D. 56 好好点1年前4
好好点1年前4 -
 inb3tv 共回答了25个问题
inb3tv 共回答了25个问题 |采纳率84%解题思路:13.9g XSO4•nH2O晶体,完全失水后,剩余7.6g粉末,则水的质量为13.9g-7.6g=6.3g,利用组成中的质量可知,XSO4与水的物质的量之比为1:n,以此来计算解答.13.9g XSO4•nH2O晶体,完全失水后,剩余7.6g粉末,则水的质量为13.9g-7.6g=6.3g,
若X的原子量为结晶水分子数的8倍,
XSO4与水的物质的量之比为1:n,
则
7.6g
n×8+96:
6.3
18=1:n,
解得n=7,
则X的相对原子质量为7×8=56,
故选D.点评:
本题考点: 相对原子质量及其计算.
考点点评: 本题考查相对原子质量的计算,明确定组成是解答本题的关键,题目难度不大,但计算较繁琐.1年前查看全部
- 将木炭和氧化铜的粉末混合物30g,加热一段时间后冷却,称得剩余固体25.6g
将木炭和氧化铜的粉末混合物30g,加热一段时间后冷却,称得剩余固体25.6g
生成了多少克CO2?
生成了多少克Cu?
有多少克氧化铜参加了反应? hummerbaby1年前2
hummerbaby1年前2 -
 依依0289 共回答了14个问题
依依0289 共回答了14个问题 |采纳率100%CO2:30-25.6=4.4
根据2化学方程式算出Cu,CuO,就可以了啊.1年前查看全部
- 一包粉末可能含有K + 、Fe 3+ 、Al 3+ 、Cl - 、SO 4 2- 、CO 3 2- 中的若干种,现进行以
一包粉末可能含有K + 、Fe 3+ 、Al 3+ 、Cl - 、SO 4 2- 、CO 3 2- 中的若干种,现进行以下实验:
(1)取少量固体,加入稀硝酸搅拌,固体全部溶解,没有气体放出;
(2)向(1)所得溶液中加入一定量Ba(OH) 2 (强碱)溶液,生成有色沉淀,过滤后在滤液中加入稀硝酸酸化,然后滴入AgNO 3 溶液,有白色沉淀生成;
(3)取(2)中的有色沉淀加入足量的稀盐酸后,沉淀全部溶解;
(4)重新取少量固体加入适量蒸馏水搅拌后,固体全部溶解,得到澄清溶液;
(5)向(4)所得的溶液中加入氨水使溶液呈碱性,有沉淀生成,过滤。往得到的沉淀中加入过量的
NaOH溶液,沉淀减少。
根据上述实验,这包粉末中一定不含有的离子是____________,肯定含有的离子是____________,不能确定是否含有的离子是____________,可通过____________(填实验方法)来进一步确定该离子。 lang9961年前1
lang9961年前1 -
 江和子 共回答了23个问题
江和子 共回答了23个问题 |采纳率100%CO 3 2- 、SO 4 2- ;Cl - 、Al 3+ 、Fe 3+ ;K + ;焰色反应1年前查看全部
- 人们发现,用氯化钯(PdCl2)溶液可检验CO对大气污染情况.CO和PbCl2溶液反应(水参加反应)生成黑色金属钯粉末、
人们发现,用氯化钯(PdCl2)溶液可检验CO对大气污染情况.CO和PbCl2溶液反应(水参加反应)生成黑色金属钯粉末、二氧化碳和氯化氢,反应的化学方程式为:PdCl2+H2O+CO=Pd↓+CO2+2HCl.现将50L空气(密度为1.29g/L)通过足量的PbCl2溶液,将过滤得到的固体干燥,称其质量为0.106g,求所测定空气中一氧化碳的质量分数是多少?
106怎么出来的?是钯的相对原子质量么?
做题时不知道钯的相对原子质量, 梧桐烟雨1年前1
梧桐烟雨1年前1 -
 揭盘手36 共回答了25个问题
揭盘手36 共回答了25个问题 |采纳率88%106是钯的分子量(即相对原子质量)
像这些一般都要死记的,题中一般不会给出元素分子量.
所以,该背还得背.加油1年前查看全部
- (2012•湘潭)有一包固体粉末样品,含有Na2CO3、CaCO3、Zn三种物质.为进一步确定其组成,某实验小组进行了以
(2012•湘潭)有一包固体粉末样品,含有Na2CO3、CaCO3、Zn三种物质.为进一步确定其组成,某实验小组进行了以下探究活动.
【思考与交流】
(1)上述物质中,能溶于水的是______(填化学式).
(2)它们均能与盐酸反应,写出锌与盐酸反应的化学方程式______.
【活动与探究】
经过讨论,他们设计并完成了下列实验:
(3)用托盘天平(1g以下用游码)称取37.7g样品.称量时砝码应置于______(填“左”或“右”)盘,则所称固体的实际质量为______g.
(4)往37.7g样品中加入足量稀盐酸,可观察到产生大量气体,其组成为氢气和______(填化学式.注意:少量氯化氢和水蒸气忽略不计);将所得气体缓慢通入足量氢氧化钠溶液中,待反应完全后,称得该溶液增重13.2g;再将剩余气体通过足量灼热氧化铜粉末,充分反应后冷却称重,发现该粉末反应后比反应前减轻1.6g.
【分析与总结】
(5)上述过程中氧化铜粉末减轻1.6g是由于氢气与氧化铜反应所致,该反应的化学方程式为CuO+H2
Cu+H2O△ .CuO+H2,由此可推知反应中氢气的质量为______g.
Cu+H2O△ .
(6)根据以上数据计算并确定37.7g样品中三种物质的质量. 孤云自闲1年前1
孤云自闲1年前1 -
 tellnothing 共回答了15个问题
tellnothing 共回答了15个问题 |采纳率86.7%解题思路:(1)碳酸钙、锌不溶于水,碳酸钠易溶于水;
(2)根据反应物、生成物及其质量守恒定律可以书写化学方程式;
(3)用天平称量时,要注意的是应该左物右砝;
(4)碳酸钠、碳酸钙和稀盐酸反应都能够生成二氧化碳气体;
(5)通过计算可以确定物质的组成情况.(1)上述物质中,能溶于水的是碳酸钠,化学式是Na2CO3.
故填:Na2CO3.
(2)锌与盐酸反应能生成氯化锌和氢气,反应的化学方程式为:Zn+2HCl═ZnCl2+H2↑.
故填:Zn+2HCl═ZnCl2+H2↑.
(3)称量时砝码应置于右盘,则所称固体的实际质量为37.7g.
故填:右;37.7.
(4)往37.7g样品中加入足量稀盐酸,可观察到产生大量气体,其组成为氢气和二氧化碳,二氧化碳的化学式是CO2.
故填:CO2.
(5)氧化铜和氢气在加热条件下反应能生成铜和水,反应的化学方程式为:CuO+H2
△
.
Cu+H2O.
故填:CuO+H2
△
.
Cu+H2O.
由氧化铜和氢气反应的化学方程式可知,当参加反应的氢气的质量是2份时,固体质量减少的是16份,
设氢气的质量为X,
则有:2:16=X:1.6g,
X=0.2g.
故填:0.2.
(6)设锌的质量为Y,
Zn+2HCl═ZnCl2+H2↑,
65 2
Y 0.2g
[65/2]=[Y/0.2g],
Y=6.5g,
将所得气体缓慢通入足量氢氧化钠溶液中,待反应完全后,称得该溶液增重13.2g,说明生成的二氧化碳的质量是13.2g,
碳酸钙和碳酸钠的质量和为:37.7g-6.5g=31.2g,
设碳酸钙的质量为m,生成二氧化碳的质量为n,
CaCO3+2HCl=CaCl2+H2O+CO2↑,Na2CO3+2HCl=2NaCl+H2O+CO2↑,
1004410644
mn31.2g-m13.2g-n
[100/44]=[m/n],[106/44]=[31.2g−m/13.2g−n],
m=10g,n=4.4g,
碳酸钠的质量为:31.2g-10g=21.2g,
碳酸钠、碳酸钙、锌的质量分别为21.2g、10g、6.5g.点评:
本题考点: 实验探究物质的组成成分以及含量;称量器-托盘天平;酸的化学性质;酸碱盐的溶解性;书写化学方程式、文字表达式、电离方程式;根据化学反应方程式的计算.
考点点评: 差量法在计算中经常遇到,要掌握差量法计算的技巧,并且能够熟练运用,对解答计算方面的题目帮助很大.1年前查看全部
- 已知A为黑色粉末,B为单质,D为红色单质.A、B、C、D、E五种物质之间的转化关系如图所示.
已知A为黑色粉末,B为单质,D为红色单质.A、B、C、D、E五种物质之间的转化关系如图所示.

请回答:
(1)写出下列物质的化学式:A:______ C:______
(2)写一种由B元素组成的单质的名称:______;
(3)写出下列反应的化学方程式:反应①为2CuO+C
2Cu+CO2↑高温 .2CuO+C;反应②为______.
2Cu+CO2↑高温 . q_cede25zs1_7b51年前1
q_cede25zs1_7b51年前1 -
 seka0707 共回答了17个问题
seka0707 共回答了17个问题 |采纳率100%解题思路:本题的解题突破口为D是红色单质,则D可能是铜,A能与单质B反应生成铜,且生成的C能与澄清石灰水反应,则C可能是二氧化碳,故A是氧化铜,B是碳,E是碳酸钙.D是红色单质,则D可能是铜,A能与单质B反应生成铜,且生成的C能与澄清石灰水反应,则C可能是二氧化碳,故A是氧化铜,B是碳,E是碳酸钙,带入框图,推断合理;
(1)A是氧化铜,C是二氧化碳,故填:CuO,CO2;
(2)B是碳,组成单质可以是金刚石、石墨等;
(3)反应①是氧化铜与碳加热反应生成铜和二氧化碳,方程式为:2CuO+C
高温
.
2Cu+CO2↑反应②是二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,方程式为:Ca(OH)2+CO2═CaCO3↓+H2O.故答案为:(1)CuO;CO2;(2)金刚石或石墨或C60;(3)2CuO+C
高温
.
2Cu+CO2↑;Ca(OH)2+CO2═CaCO3↓+H2O;点评:
本题考点: 物质的鉴别、推断.
考点点评: 本题为框图式物质推断题,完成此题,关键是找准解题突破口,直接得出有关物质的化学式,然后顺推或逆推得出有关物质的化学式.1年前查看全部
- (2013•嘉兴二模)固体粉末X中可能含有FeO、Fe2O3、MnO2、K2SiO3、K2SO3、KAlO2、MgCl2
(2013•嘉兴二模)固体粉末X中可能含有FeO、Fe2O3、MnO2、K2SiO3、K2SO3、KAlO2、MgCl2、K2CO3、NaNO2中的若干种.为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如下:
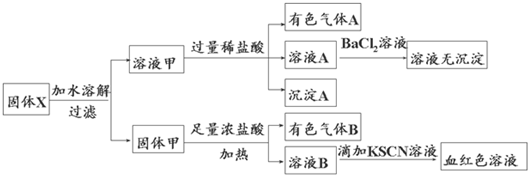
根据上述实验,以下说法正确的是( )
A. 溶液甲中一定含有K2SiO3、NaNO2、可能含有KAlO2、K2CO3
B. 由于在溶液甲中加入足量稀盐酸后再加入BaCl2溶液,因此无法判断溶液中是否有K2SO3
C. 气体A和气体B一定均为纯净物
D. 原混合物中一定含有Fe2O3 饵刀1年前4
饵刀1年前4 -
 梦血 共回答了18个问题
梦血 共回答了18个问题 |采纳率88.9%解题思路:有色气体A应为NO2,可能含有CO2气体,说明一定含有NaNO2,固体甲与浓盐酸反应生成有色气体B,B应为Cl2,则应含有MnO2,沉淀A应为H2SiO3,说明含有K2SiO3,则一定不含有MgCl2,溶液B加KSCN溶液呈血红色,说明含有Fe3+,则固体中可能含有FeO、Fe2O3,Fe2+可被氯气氧化生成Fe3+,以此解答该题.有色气体A应为NO2,可能含有CO2、SO2等气体,说明一定含有NaNO2,固体甲与浓盐酸反应生成有色气体B,B应为Cl2,则应含有MnO2,沉淀A应为H2SiO3,说明含有K2SiO3,则一定不含有MgCl2,溶液B加KSCN溶液呈血红色,说明含有Fe3+,则固体中可能含有FeO、Fe2O3,Fe2+可被氯气氧化生成Fe3+,
A.有以上分析可知一定含有K2SiO3、NaNO2,可能含有K2CO3,也可能含有KAlO2,加入过量盐酸生成AlCl3,与以上物质不反应,不能确定,故A正确;
B.因含有NaNO2,如含有K2SO3,二者在酸性条件下发生氧化还原反应生成SO42-,加入氯化钡生成硫酸钡沉淀,加入足量稀盐酸后再加入BaCl2溶液没有沉淀,则一定不含有K2SO3,故B错误;
C.有色气体A应为NO2,可能含有CO2气体,而浓盐酸易挥发,生成的氯气中一定含有HCl气体,故C错误;
D.溶液B加KSCN溶液呈血红色,说明含有Fe3+,则固体中可能含有FeO、Fe2O3,Fe2+可被氯气氧化生成Fe3+,故D错误.
故选A.点评:
本题考点: 物质的检验和鉴别的实验方案设计;物质的检验和鉴别的基本方法选择及应用.
考点点评: 本题考查物质的检验和鉴别的实验方案的设计,侧重于元素化合物知识的综合运用,题目难度中等,注意把握反应的现象,根据现象结合物质的性质进行判断,易错点为B和D,注意体会.1年前查看全部
- 区分四氧化铁是否纯净物?有一包粉末!主要成为四氧化三铁,怎么检验是否含有氧化亚铁
 delta37471年前1
delta37471年前1 -
 fgdjkgfdkj32432n 共回答了20个问题
fgdjkgfdkj32432n 共回答了20个问题 |采纳率90%四氧化三铁有磁性,而氧化亚铁没有磁性
用磁铁吸引这些粉末,如果粉末全部被吸到磁铁上,则是四氧化三铁纯净物,如果有少量粉末不能被磁铁吸引,则不是纯净物1年前查看全部
- 现将16.0g镁和铜的混和物粉末放入烧杯中 再将200.0g的稀硫酸分四次加入到该烧杯中 充分反映后 测得剩余固体质量的
现将16.0g镁和铜的混和物粉末放入烧杯中 再将200.0g的稀硫酸分四次加入到该烧杯中 充分反映后 测得剩余固体质量的数据记录如下 1.混和物的质量 2.用h2so4中溶质的质量分数 数据的图片在网页里 http://pic.wenwen.soso.com/p/20110516/20110516222447-1188045196.jpg
 可以盼望1年前1
可以盼望1年前1 -
 cjycdy 共回答了17个问题
cjycdy 共回答了17个问题 |采纳率88.2%(1)8.4g (2) 19.6%
(3)设需要98%的浓硫酸的体积为x
x*1.84g/cm3*98%=200.0g*19.6% x=21.7cm3
答:需要98%的浓硫酸的体积为21.7cm3
应该是这样做 当时我是这样做的 对了~~1年前查看全部
- 有一包白色粉末可能由NaSO4 CaCO3 BaCl2 NaCl中的一种或集中组成
有一包白色粉末可能由NaSO4 CaCO3 BaCl2 NaCl中的一种或集中组成
做实验有如下现象 1 将少量白色粉末放入足量水中 搅拌 静置 过滤 得到白色固体和滤液 2 向所得固体中加入稀硝酸 固体溶解并有气体放出 问:向所得滤液中加入稀硝酸 有白色沉淀产生 试推断:该粉末一定含有()和() 一定不含有()可能含有() sunday1more1年前1
sunday1more1年前1 -
 jijilolo 共回答了16个问题
jijilolo 共回答了16个问题 |采纳率93.8%一定有Caco3 Bacl2 可能有NaCl 一定没有Na2SO41年前查看全部
- (2010•镇江)现有一包固体粉末,可能是CaCO3、Na2CO3、Na2SO4、CuSO4、NaCl中的一种或几种,为
(2010•镇江)现有一包固体粉末,可能是CaCO3、Na2CO3、Na2SO4、CuSO4、NaCl中的一种或几种,为确定其组成,取适量试样进行下列实验.请根据实验现象判断:
(1)取试样溶于水,得到无色澄清溶液,则此固体粉末中一定没有______、______.
(2)取上述溶液适量,滴加过量的BaCl2溶液,出现白色沉淀,再加入过量的稀硝酸,沉淀部分消失并产生气泡.则此固体粉末中一定有______、______.
(3)取步骤(2)实验后的上层清液,加入稀硝酸、硝酸银溶液,出现白色沉淀,由此该同学得出此固体粉末中一定含有NaCl,你认为此结论是否正确______(填“是”或“否”).
(4)对于是否含有NaCl,你认为应对步骤(2)作如何改进______(若步骤(3)填“是”,此空不作答). nancyyun1年前1
nancyyun1年前1 -
 熟悉的ll 共回答了21个问题
熟悉的ll 共回答了21个问题 |采纳率81%(1)原溶液中CaCO3不溶于水,CuSO4为蓝色固体,所以原固体粉末中一定不含这两种物质;
(2)根据实验操作及物质的相互反应现象,可知固体中一定有Na2CO3、Na2SO4;
(3)加入稀硝酸、硝酸银溶液出现白色沉淀,只能确定清液中含氯离子,不能判断原溶液中一定含NaCl;
(4)在步骤(2)中就不能引入了氯离子,可将BaCl2溶液换成Ba(NO3)2溶液或Ba(OH)2溶液;
故答案为:(1)CaCO3、CuSO4(2)Na2CO3、Na2SO4(3)否 (4)将BaCl2溶液换成Ba(NO3)2溶液或Ba(OH)2溶液1年前查看全部
- 20摄氏度,饱和石灰水(甲溶液)加入适量氧化钙粉末,充分反应.
20摄氏度,饱和石灰水(甲溶液)加入适量氧化钙粉末,充分反应.
溶液未恢复到20摄氏度时,为什么溶质质量分数比甲溶液小呢, chenoon1年前1
chenoon1年前1 -
 zhangzhi 共回答了15个问题
zhangzhi 共回答了15个问题 |采纳率80%因为氢氧化钙的溶解度的变化规律是“随温度的升高而下降”
但加入氧化钙反应后消耗了水(与其反应)而且增加了溶质
显然是饱和的,又因为温度高于20度,溶解度随温度的升高而下降
所以溶质质量分数比甲溶液小1年前查看全部
- 小玙从月饼包装袋中取出标有“脱氧剂”的小包,她好奇地打开封口,发现小包里的粉末为灰黑色粉末,还有少量的红色和白色粉末.
小玙从月饼包装袋中取出标有“脱氧剂”的小包,她好奇地打开封口,发现小包里的粉末为灰黑色粉末,还有少量的红色和白色粉末.
【提出问题】该固体中黑色和红色粉末分别是什么?
【收集资料】a.铁系脱氧剂是以铁粉为主,活性炭及少量氯化钠等为辅的化学成分,使用一段时间后,铁粉与空气接触而生锈;
b.正常条件下,氯化钠与铁粉不会反应的,它能加速铁粉吸氧.
【提出猜想】A.黑色粉末可能是氧化铜,红色粉末可能是铜;
B.黑色粉末可能是铁粉,红色粉末可能是氧化铁;
小莉认为猜想A不正确,理由是______;
【设计并验证】
【应用并扩展】由于铁氧化会放热,所以铁系脱氧剂还可做“取暖片”中发热剂,推测脱氧剂和发热剂成分中氯化钠的作用是______.实验步骤 现象 结论 把脱氧剂粉末倒在滤纸上,用磁铁充分接触脱氧剂粉末 磁铁吸了部分黑色粉末
脱氧剂中含有______将剩余固体放入小试管中,加入足量______,振荡,过滤 红色固体消失,滤液呈
黄色红色固体是Fe 2 O 3 相关反应的化学方程式:______
 sun99991年前1
sun99991年前1 -
 shi576 共回答了10个问题
shi576 共回答了10个问题 |采纳率100%【提出猜想】:根据收集资料中提到的有关脱氧剂成分可知,脱氧剂中没有铜,故A不正确;
【设计并验证】磁铁吸了部分黑色粉末,说明脱氧剂中有铁,吸后的部分剩余物为氧化铁,硫酸和氧化铁物反应生成硫酸铁和水,硫酸铁溶液呈黄色,该反应的化学方程式为Fe 2 O 3 +3H 2 SO 4 ═Fe 2 (SO 4 ) 3 +3H 2 O;
【应用与扩展】:脱氧剂和发热剂需接触到空气才会发热,原因是铁要与水、氧气等物质共同作用才会生锈.因此发热剂成分中氯化钠的作用是加速铁粉生锈,更快地放出热量.
故答案为:【猜想】脱氧剂成分中没有铜元素的物质(或不符合质量守恒定律,其它答案合理均可)
【设计并实验】铁粉稀硫酸Fe 2 O 3 +3H 2 SO 4 ═Fe 2 (SO 4 ) 3 +3H 2 O
【应用与扩展】加速铁粉生锈,更快地放出热量1年前查看全部
- 有下列大种盐的固体粉末:氯化钠、氯化铁、硝酸银、硝酸钠、碳酸钙,从中分别取样,两两混合为一组,加入蒸馏水,能够e到无色透
有下列大种盐的固体粉末:氯化钠、氯化铁、硝酸银、硝酸钠、碳酸钙,从中分别取样,两两混合为一组,加入蒸馏水,能够e到无色透明溶液的,最多有( )
A. 2组
B. 3组
C. 4组
D. 5组 gy8efhsb1年前1
gy8efhsb1年前1 -
 亦霖 共回答了14个问题
亦霖 共回答了14个问题 |采纳率107.1%解题思路:若物质之间相互交换成分,能结合成沉淀的则不能得到透明的溶液;本题还要注意能得到无色透明溶液,不能含有明显有颜色的铜离子、铁离子和亚铁离子等.物质加到水中得到无色澄清溶液,说明彼此之间不能生成沉淀,且不存在有色离子.
氯化铁加入蒸馏水形成g溶液呈黄色,不能形成无色透明溶液;氯化钠与硝酸银溶液反应生成氯化银白色沉淀,碳酸钙不溶于水,加入蒸馏水,均能够得到无色透明溶液.
氯化钠与硝酸钠、硝酸银与硝酸钠之间不反应,符合无色透明g要求.
故选:v.点评:
本题考点: 离子或物质的共存问题.
考点点评: 本题难度不是很大,对于能否得到无色透明的溶液,要注意彼此之间不能生成沉淀,还要注意特定离子的颜色.1年前查看全部
- t摄氏度,硫化铜的饱和溶液中加入5克硫酸铜粉末,容剂怎么样?溶质怎么样?溶液怎么样?说出理由
 梦到无梦1年前1
梦到无梦1年前1 -
 ss倾向 共回答了16个问题
ss倾向 共回答了16个问题 |采纳率100%硫酸铜和水结合生成五水硫酸铜,溶液中水减少,所以溶剂减少,部分硫化铜析出,所以溶质减少,总溶液减少.1年前查看全部
- 有难度.一种黑色粉末A,加入盐酸后,粉末溶解得到浅绿色溶液,且有气体放出.将气体通入硫酸铜溶液产生黑色沉淀.在浅绿色溶液
有难度.
一种黑色粉末A,加入盐酸后,粉末溶解得到浅绿色溶液,且有气体放出.将气体通入硫酸铜溶液产生黑色沉淀.在浅绿色溶液中滴入氯水,溶液转为棕黄色,写出以上实验中各步反应的化学方程式. 我是真真1年前5
我是真真1年前5 -
 applede3233 共回答了13个问题
applede3233 共回答了13个问题 |采纳率92.3%FeS+2HCL=FeCL2+H2S(气体)
H2S+CuSO4=CuS(沉淀)+H2SO4
2FeCL2+CL2=2FeCL31年前查看全部
- 向水中加入碳酸钙粉末能得到溶液吗?若能,那么该溶液是无色溶液吗?
 一品鲜1年前1
一品鲜1年前1 -
 danceing82 共回答了14个问题
danceing82 共回答了14个问题 |采纳率100%主要看你的碳酸钙的量加多少了,因为碳酸钙也有溶解度的,只是较小而已,如果是微量则行,超过一定量则不能为溶液1年前查看全部
- 化 学 无色液体a与黑色粉末b混合,生成无色气体c和无色液体d,淡黄色粉末e在c中燃烧生成刺激性气
化 学 无色液体a与黑色粉末b混合,生成无色气体c和无色液体d,淡黄色粉末e在c中燃烧生成刺激性气
化
学
无色液体a与黑色粉末b混合,生成无色气体c和无色液体d,淡黄色粉末e在c中燃烧生成刺激性气味气体f,这些字母名称是? rtttuytytytyty1年前2
rtttuytytytyty1年前2 -
 2007yexin 共回答了37个问题
2007yexin 共回答了37个问题 |采纳率91.9%a过氧化氢,b二氧化锰,c氧气,d水,e硫,f二氧化硫1年前查看全部
- 溶质,溶剂,在硫酸铜饱和溶液中,加入少量白色硫酸铜粉末,可能出现下列现象:1.有兰色晶体析出2.饱和溶液中的溶质减小3.
溶质,溶剂,
在硫酸铜饱和溶液中,加入少量白色硫酸铜粉末,可能出现下列现象:1.有兰色晶体析出2.饱和溶液中的溶质减小3.饱和溶液中的溶质增加4.饱和溶液中的溶剂减小5.饱和溶液中的溶剂增加6.饱和溶液的总质量不变.以下判断正确的一组是:
A,1.2.4
B:1.3.5
C:3.4.6
D:2.5.6 巴山劲松21年前1
巴山劲松21年前1 -
 redmapleleaf 共回答了25个问题
redmapleleaf 共回答了25个问题 |采纳率92%A 1、2、4
白色粉末是CuSO4,加水后变成五水硫酸铜(CuSO4·5H2O),水减少所以溶剂减少,溶剂减少所以蓝色晶体析出,蓝色晶体析出所以溶质减少,1年前查看全部
- 原化学未知粉末,经测试中心化验检测得到化学成分含灼减43.55%氧化钙55.79%的有机物可能是什么化学物质?
原化学未知粉末,经测试中心化验检测得到化学成分含灼减43.55%氧化钙55.79%的有机物可能是什么化学物质?
有可能是碳酸钙吗? dodo1233211年前2
dodo1233211年前2 -
 zhonglinwa 共回答了20个问题
zhonglinwa 共回答了20个问题 |采纳率80%不可能,碳酸钙不是有机物,也不是碱石灰
含灼减?
如果想获得确切答案就要解释一下题目1年前查看全部
- 1.下列完全反应后,所得溶液质量比反应前溶液的总质量增加的是 A.铜丝放入硝酸银溶液中B.碳酸钠粉末足量的
1.下列完全反应后,所得溶液质量比反应前溶液的总质量增加的是 A.铜丝放入硝酸银溶液中B.碳酸钠粉末足量的
稀盐酸中C.氢氧化钠溶液与稀盐酸混合D.氢氧化钙溶液与碳酸钠溶液混合
这类题怎么做,我一直都不会
快速 丫头和猪1年前2
丫头和猪1年前2 -
 sohuzj 共回答了16个问题
sohuzj 共回答了16个问题 |采纳率93.8%A.铜丝放入硝酸银溶液中
产物变成了硝酸铜,质量减少
B.碳酸钠粉末足量的稀盐酸中
碳酸钠与盐酸反应,生成氯化钠和CO2、水,Na2CO3进入溶液,只放出CO2,质量增加.
C.氢氧化钠溶液与稀盐酸混合
溶液质量没变化
D.氢氧化钙溶液与碳酸钠溶液混合
有沉淀,质量减少.
B是正确的1年前查看全部
- 标况下,将20L,CO2和CO的混合气体通过足量的NA2O2粉末,充分反应后,在相同情况下气体体积减少至16L,原混合其
标况下,将20L,CO2和CO的混合气体通过足量的NA2O2粉末,充分反应后,在相同情况下气体体积减少至16L,原混合其中CO的体积是?
答案是12L.可是, 水木白1年前2
水木白1年前2 -
 错了就过了 共回答了21个问题
错了就过了 共回答了21个问题 |采纳率90.5%设二氧化碳体积x L
2 CO2+2 Na2O2=2 Na2CO3+O2
2 1
x x/2
减少的体积是x/2 L =16
x=81年前查看全部
- 一种白色粉末由碳酸氢钠和碳酸钠混合而成,称取混合物4.42g,加热至恒重,将放出的气体通过过量的石灰水,得白色沉淀2g,
一种白色粉末由碳酸氢钠和碳酸钠混合而成,称取混合物4.42g,加热至恒重,将放出的气体通过过量的石灰水,得白色沉淀2g,加热后的残渣与某浓度盐酸30mL恰好完全作用,求(1)原混合物中碳酸氢钠的质量;(2)盐酸的物质的量浓度.
 绿岛孤舟1年前2
绿岛孤舟1年前2 -
 不回头的天使 共回答了16个问题
不回头的天使 共回答了16个问题 |采纳率100%CO2~2NaHCO3~CaCO3~2HCl 168 100 73 x 2g y x=3.36g,y=1.46g=0.02mol 碳酸氢钠3.36g 碳酸钠1.06g,即0.01mol Na2CO3~2HCl 0.01mol~0.02mol 所以碳酸钠消耗盐酸0.02mol,碳酸钙消耗盐酸0.02mol C=0.04/0.03=1.3mol/L 2:2NaHCO3(加热)====Na2CO3+H2O+CO2 CO2+Ca(OH)2====CaCO3+H2O 列式先算出CO2的质量为0.88克,再由CO2的质量算出NaHCO3的质量为3.36克 CaCO3+2HCl====CaCl2+CO2+H2O 列式算出HCl的物质的量为0.04mol,然后再算物质的量浓度0.04/0.03约为1.3mol/L1年前查看全部
- 2012;曲阜市模拟)一包白色粉末,由CuSO4,CaCO3,BaCl2,Na2SO4,NaOH中两种或两种以上的物质混
2012;曲阜市模拟)一包白色粉末,由CuSO4,CaCO3,BaCl2,Na2SO4,NaOH中两种或两种以上的物质混合而成,为
2012•曲阜市模拟)一包白色粉末,由CuSO4、CaCO3、BaCl2、Na2SO4、NaOH中两种或两种以上的物质混合而成,为探究其组成,进行如下实验:
(1)取少量白色粉末,向其中加入足量的水,充分搅拌后过滤,得到白色沉淀和无色滤液,则原白色粉末中一定不含有
CuSO4
为什么 是不是其他颜色的溶液和无色溶液反应 都会生成其他颜色的生成物?是不是如果反应物中如果有非无色的那它无论与什么东西反应生成物质都有非白色的东西? 首席牛人的tt11年前1
首席牛人的tt11年前1 -
 52032z32 共回答了12个问题
52032z32 共回答了12个问题 |采纳率75%原白色粉末中一定不含有CuSO4,是因为二价铜离子是蓝色的,至于你后面的问题那个不是绝对的1年前查看全部
- 2012•曲阜市模拟)一包白色粉末,由CuSO4、CaCO3、BaCl2、Na2SO4、NaOH中两种或两种
2012•曲阜市模拟)一包白色粉末,由CuSO4、CaCO3、BaCl2、Na2SO4、NaOH中两种或两种以上的物质混合而成,为探究其组成,进行如下实验:
(1)取少量白色粉末,向其中加入足量的水,充分搅拌后过滤,得到白色沉淀和无色滤液,则原白色粉末中一定不含有
CuSO4
为什么 是不是其他颜色的溶液和无色溶液反应 都会生成其他颜色的生成物?虽然这里的cuso4与bacl2反应生成了蓝绿色的cucl2不符合题意
但有没有本身是其他颜色的溶液与另一种溶液反应 生成的生成物又符合题意是白色沉淀和无色溶液 那选不选他? yuanilyl1年前1
yuanilyl1年前1 -
 孟涛 共回答了17个问题
孟涛 共回答了17个问题 |采纳率94.1%cuso4与bacl2反应生成了蓝绿色的cucl2?有个物质吗?
CuSO4与水反应生成五水硫酸铜,蓝色是五水硫酸铜的颜色.
我是在看不到你问的什么意思了,最好去看看应该初中化学开始的时候,每个离子都有自己特定的颜色 .1年前查看全部
- 将Cu与CuO固体混合物粉末放入烧杯中,当加入100克稀硫酸时,CuO与H2SO4好完全反应,过滤后所得溶液的质量为10
将Cu与CuO固体混合物粉末放入烧杯中,当加入100克稀硫酸时,CuO与H2SO4好完全反应,过滤后所得溶液的质量为108克,(不考虑过滤过程中溶液质量的损失).请分析并计算
(1)反应后溶液增加的质量为参加反应▁▁▁的质量.
(2)稀硫酸中含H2SO4的质量分数. 逍遥灵子1年前1
逍遥灵子1年前1 -
 aiya3602 共回答了19个问题
aiya3602 共回答了19个问题 |采纳率89.5%(1)cuo
(2)9.8%
因为反应后的物质没有气体等会溢出的东西,故增加的即为cuo质量
因为刚好完全反应,故列出反应式即可求得h2so4有9.8g1年前查看全部
- 有一个包粉末,可能由氯化钠、硫酸铁、氯化镁、硝酸钠、碳酸钠中的一种或几种组成.
有一个包粉末,可能由氯化钠、硫酸铁、氯化镁、硝酸钠、碳酸钠中的一种或几种组成.
现做下列实验:①取少量粉末,加水溶解得无色透明溶液;②在上述溶液里,加氢氧化钠溶液,无明显变化;③另取少量固体,加稀盐酸,无明显变化.
根据上述实验,试回答:
(1)从实验①推断,不可能存在______(填化学式),原因是_________.
从实验②推断,不可能存在______(填化学式),原因是_________.
从实验③推断,不可能存在______(填化学式),原因是_________.
(2)根据上述实验,可得出初步结论,该粉末中可能含有_________.
(3)若该白色粉末只有一种物质,要证明是什么物质,则需取少量原粉末,装入试管
再加入少量水溶解,然后加入_____试剂,根据____________现象进行判断. 王佳年12041年前3
王佳年12041年前3 -
 小蛋113 共回答了13个问题
小蛋113 共回答了13个问题 |采纳率84.6%①取少量粉末,加水溶解得无色透明溶液;--------没有Fe2(SO4)3,它的溶液是黄色的,另外注意MgCl2与Na2CO3不能共存
②在上述溶液里,加氢氧化钠溶液,无明显变化;-----------没有MgCl2
③另取少量固体,加稀盐酸,无明显变化.----------没有Na2CO3
可能存在NaCl、NaNO3中的1种或2种
(1)从实验①推断,不可能存在___Fe2(SO4)3___(填化学式),原因是____它的溶液显黄色_____.
从实验②推断,不可能存在___MgCl2___(填化学式),原因是_____会与NaOH生成Mg(OH)2白色沉淀____.
从实验③推断,不可能存在___Na2CO3___(填化学式),原因是____会与盐酸反应生成CO2气体_____.
(2)根据上述实验,可得出初步结论,该粉末中可能含有____NaCl和NaNO3中的1种或者2种_____.
(3)若该白色粉末只有一种物质,要证明是什么物质,则需取少量原粉末,装入试管
再加入少量水溶解,然后加入__AgNO3溶液___试剂,根据_____有无白色沉淀_______现象进行判断.1年前查看全部
- 在一定温度下,将一包白色无水硫酸铜粉末投入到150g蒸馏水中,充分搅拌,过滤,得到一定质量的蓝色晶体和84g滤液,若此温
在一定温度下,将一包白色无水硫酸铜粉末投入到150g蒸馏水中,充分搅拌,过滤,得到一定质量的蓝色晶体和84g滤液,若此温度下无水硫酸铜的溶解度为40g,则此包无水硫酸铜的质量是多少?
 默儿爱李强1年前3
默儿爱李强1年前3 -
 光看不回帖 共回答了20个问题
光看不回帖 共回答了20个问题 |采纳率90%解题思路:根据饱和溶液中质量分数不变和溶解度计算出剩余饱和溶液中溶质和溶剂的质量,根据硫酸铜晶体组成计算晶体中溶质的质量,两者之和为此包无水硫酸铜的质量.把无水硫酸铜粉末加入150g蒸馏水中,得到一定量的蓝色晶体CuSO4•5H20,剩余溶液仍然是饱和溶液,设剩余溶液中的溶质为xg,
则[40g/100g+40g]=[xg/84g]得:x=24
结晶水的质量=150g-(84g-24g)=90g,设结晶中硫酸铜的质量为yg
CuSO4~5H20
160 90
yg90g
[160/90]=[yg/90g]
y=160,此包无水硫酸铜的质量为=160g+24g=184g.
答:此包无水硫酸铜的质量是184g.点评:
本题考点: 溶液中溶质的质量分数及相关计算.
考点点评: 本题考查质量守恒定律,质量分数的计算,解题时注意守恒思想的运用.1年前查看全部
- 现有化合物A和三种单质B、C、D,通常状况下,A、D是无色气体,B是红色非金属,C是黑色粉末,现在进行下列实验:1 在D
现有化合物A和三种单质B、C、D,通常状况下,A、D是无色气体,B是红色非金属,C是黑色粉末,现在进行下列实验:1 在D中点燃B,生成一中白色的固体物质;2 在高温下炙热的C与A反应,生成一中无色气体;3 C在D中燃烧时在一定条件下可得到一种和2 的生成物相同的无色气体.
根据以上实验,推断这四种物质(用化学式回答):
A__________B____________C___________D___________. 金陵童话1年前1
金陵童话1年前1 -
 aa一世 共回答了8个问题
aa一世 共回答了8个问题 |采纳率62.5%A______CO2____B______P______C______C_____D_______O2____.1年前查看全部
- 判断物质种类一包白色粉末,可能有氯化银,碳酸钠,氢氧化镁,氯化钡,硫酸钠,硝酸钾.1.将少许粉末放入水中,过滤,静置,得
判断物质种类
一包白色粉末,可能有氯化银,碳酸钠,氢氧化镁,氯化钡,硫酸钠,硝酸钾.
1.将少许粉末放入水中,过滤,静置,得白色沉淀.
2.向沉淀中加入硝酸,全部溶解,无气体产生.
3.向其中加入硝酸银溶液,有白色沉淀,加入足量稀硝酸,不溶解.
粉末中一定含---,一定没-----,可能有-----
一定要说为什么啊! situer001年前1
situer001年前1 -
 永远君儿 共回答了15个问题
永远君儿 共回答了15个问题 |采纳率93.3%一定含氯化钡,硫酸钠 ;一定没碳酸钠;可能有硝酸钾,氢氧化镁,氯化银.
条件一:能说明必定有氯化钡——因为氯化银,氢氧化镁不溶于水被过滤后还是有沉淀则是硫酸钡或碳酸钡.再由条件二可知不是碳酸钡因为没有气体.条件三可得白色沉淀是氯化银——氯化钡和硝酸银反应.希望能看懂!1年前查看全部
- 关于化学推断题类型的几道题1.白色的粉末A,加入B后变成蓝色溶液.向期中加入试剂C,生成白色沉淀硫酸钡,过滤后滤液中加入
关于化学推断题类型的几道题
1.白色的粉末A,加入B后变成蓝色溶液.向期中加入试剂C,生成白色沉淀硫酸钡,过滤后滤液中加入试剂D,得到蓝色沉淀E.再次过滤,滤液是氯化钠溶液.根据以上现象判断A__ B__ C__ D__E__
2.A、B、C、D、E都是无色气体,F是无色液体,他们之间有如下反应关系:
(1)A+B→点燃→F
(2)A+Cl2→点燃→C;将C通入F,能使石蕊试剂变红
(3)B+D→点燃→E;将E通入澄清石灰水,能使石灰水变浑浊
试判断(化学式表示)
A___ B___ C___ D__ E___ F___ ddf6201年前3
ddf6201年前3 -
 jinxb 共回答了22个问题
jinxb 共回答了22个问题 |采纳率86.4%1.白色的粉末A,加入B后变成蓝色溶液.向期中加入试剂C,生成白色沉淀硫酸钡,过滤后滤液中加入试剂D,得到蓝色沉淀E.再次过滤,滤液是氯化钠溶液.根据以上现象判断
A__ CuSO4
B__ H2O
C__ BaCl2
D__NaOH
E__Cu(OH)2
2.A、B、C、D、E都是无色气体,F是无色液体,他们之间有如下反应关系:
(1)A+B→点燃→F
(2)A+Cl2→点燃→C;将C通入F,能使石蕊试剂变红
(3)B+D→点燃→E;将E通入澄清石灰水,能使石灰水变浑浊
试判断(化学式表示)
A___ H2
B___O2
C___ HCl
D__ CO
E___ CO2
F___H2O1年前查看全部
- 将一定质量的锌,氧化铁,氧化铜的混合粉末放入含有0.22molHCl中,充分反应后生成448mlH2(标准状况),残留
将一定质量的锌,氧化铁,氧化铜的混合粉末放入含有0.22molHCl中,充分反应后生成448mlH2(标准状况),残留
固体0.64g.过滤,滤液中无Cu2+.滤液中还有0.04molHCl.那么原混合物中Zn的质量为多少克? jlzh1年前2
jlzh1年前2 -
 卖精来上网 共回答了26个问题
卖精来上网 共回答了26个问题 |采纳率96.2%解;固体0.64g为铜,物质的量为0.01mol,氧化铜的物质的量为0.01mol.耗HCl 0.02mol
448mlH2(标准状况),物质的量为0.02mol,耗HCl 0.04mol.滤液中还有0.04molHCl.
所以氧化铁耗HCl 为0.22-0.02-0.04-0.04=0.12mol.发生反应如下:
Fe2O3+6HCl=2FeCl3+3H2O 2FeCl3+Zn=2FeCl2+ZnCl2
6mol 2mol 2mol 1mol
0.12mol 0.04mol 0.04mol 0.02mol
CuO +2HCl = CuCl2+H2O CuCl2 + Zn= ZnCl2+Cu
0.01mol 0.01mol 0.01mol 0.01mol
Zn+2HCl = ZnCl2+ H2
0.02mol 0.02mol
所以共消耗锌的物质的量为0.02mol+0.01mol+0.02mol =0.05mol
原混合物中Zn的质量为;0.05mol乘以65=3.25克1年前查看全部
- 下图是用绿色粉末A制取红色金属H的两种流程,其中白色固体Fe(Cao)是一种常见的建筑材料,固体乙是目前用途最广,产量最
下图是用绿色粉末A制取红色金属H的两种流程,其中白色固体Fe(Cao)是一种常见的建筑材料,固体乙是目前用途最广,产量最高的金属.

 想长翅膀的猪1年前2
想长翅膀的猪1年前2 -
 tttjuan 共回答了19个问题
tttjuan 共回答了19个问题 |采纳率100%1、固体乙是目前用途最广,产量最高的金属.可判断乙=Fe.
2、由绿色粉末A及红色固体H,可判断是碱式碳酸铜:A=Cu2(OH)2CO3
3、Cu2(OH)2CO3+盐酸可知:分解出二氧化碳气体,故知道D=CO2,蓝色液体是CuCl2
4、CuCl2+乙(Fe)置换出来纯铜Cu,故知道H=Cu.
5、白色固体(Cao)是一种常见的建筑材料可知,固体E=CaCO3,碳酸钙.
6、碳酸钙加热生成氧化钙和二氧化碳,故知道固体F=CaO、气体D=CO2.
7、CO2+焦炭=CO一氧化碳,煤气反应,故知道气体G=CO.
8、绿色粉末A碱式碳酸铜加热,生成CuO+H2O+气体D(CO2):Cu2(OH)2CO3CO+CuO+H2O+CO2,知道黑色固体B=CuO.1年前查看全部
- 稀盐酸与锌粒混合的现象是什么?还有稀盐酸和碳酸钠粉末混合的现象是什么?
稀盐酸与锌粒混合的现象是什么?还有稀盐酸和碳酸钠粉末混合的现象是什么?
具体点,还有稀盐酸和碳酸钠粉末混合后生成了什么,用什么检验? gongfu8081年前2
gongfu8081年前2 -
 这个不太冷 共回答了13个问题
这个不太冷 共回答了13个问题 |采纳率84.6%都是冒泡.一个是氢气,另一个是二氧化碳,可以通入氢氧化钙溶液,会有浑浊出现.1年前查看全部
大家在问
- 1怎么找圆心?方法一:把圆对折,折痕是直径,换方向再对折一次又出现一条直径,两直径
- 2京沪高速公路全长1262千米,客车从北京开出时,一辆货车同时从上海开往北京,平均每时行85km
- 3《二十四孝图》举不少两例说明作者写作的目的
- 4为什么俩个受伤的人想要在一起,却那么的难 英语翻译这句话
- 5依照下面的比喻形式,另写一组句子。要求选择新的本体和喻体,意思完整(不要求与原句字数相同)。
- 6[阅读]各边相等的三角形叫做等边三角形,等边三角形的各个内角都等于60°。[解决问题]如图,点d在等边三角形abc的边a
- 7Can you find Wuhan ___ the map of China?
- 8有6套价格相同的童装,如果每套价格下降10元后,只相当于原来3套童装的价钱,原来每套的价格是多少元?
- 9木字旁的可组成什么字?开动你们的脑筋,思考思考一下,放松一下心情,娱乐娱乐一下
- 10如图所示的电路中,闭合开关,电压表V1的示数为6V,电压表V2的示数为3.4V,那么下列说法不正确的是( ).为什么?
- 11急需一篇作文,800字左右,不限体裁,标题自拟.要求要用到以下几个词:我、春天、自豪、高三(5)班、知耻而后勇、善有善报
- 12伟大而坚强的女性 玛丽接任丈夫的工作,第一次登上讲台的时候,为什么教室外挤满了听众?2用横线画出文中描写玛丽外貌的语句,
- 13刘翔的个人最好成绩是12秒88 英语翻译
- 14英语翻译Departed From OutWard office of exchange to - HONG KONG
- 15从动物行为获得的途径上看,可以将动物的行为大致分为两大类:________行为和________行为。_________
