1.铬铁矿与纯碱的混合物在空气中燃烧,反应式?2.由二氯化钴怎样制备高氯酸钴(二价)?
 LOVE海丽2022-10-04 11:39:542条回答
LOVE海丽2022-10-04 11:39:542条回答1.差分脉冲极谱法为什么能较好地消除充电电流?
2.配位键,离子键,共价键 三者的强度顺序?
大师,帮个忙啦,要考研,急用,

已提交,审核后显示!提交回复
共2条回复
 网名是什么 共回答了18个问题
网名是什么 共回答了18个问题 |采纳率94.4%- 1、铬铁矿与纯碱在空气中不可能称为燃烧,反应倒是可以的:
4FeCr2O4 + 8Na2CO3 + 7O2 = 2Fe2O3 + 8Na2CrO4 + 8CO2
2、CoCl2 + 8H2O (电解) = 2HClO4 + Co + 3H2
Co + HClO4 = H2 + Co(ClO4)2
3、不熟悉
4、没有顺序,各有强和弱之分:最强的离子键远强于最弱的共价键和最弱的配位键;最强的配位键远强于最弱的离子键和最弱的共价键;最强的共价键远强于最弱的配位键和最弱的离子键. - 1年前
 流星若梦 共回答了3个问题
流星若梦 共回答了3个问题 |采纳率- FeCr2O4 + 8Na2CO3 + 7O2 == 8Na2CrO4 + 2Fe2O3 + 8CO2↑
+2价的Fe被氧化为+3价,生成Fe2O3。
二氯化钴制备高氯酸钴(二价)
方案1
第一步:由配制成溶液的氯化钴和碳酸钠溶液反应制备碳酸钴。
第二步:将制得的碳酸钴溶解在高氯酸中,制备高氯酸钴
最后减压过滤得高氯酸晶体。
CoCl2+Na... - 1年前
相关推荐
- 铬铁矿的主要成分可表示为FeO•Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾
铬铁矿的主要成分可表示为FeO•Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:

已知:
①4FeO•Cr2O3+8Na2CO3+7O2
8Na2CrO4+2Fe2O3+8CO2↑;750℃
②Na2CO3+Al2O3
2NaAlO2+CO2↑;750℃
③Cr2O72-+H2O⇌2CrO42-+2H+
根据题意回答下列问题:
(1)固体X中主要含有______(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用______(填写仪器或试剂名称).
(2)酸化步骤用醋酸调节溶液pH<5,其目的是______.
物质溶解度/(g/100g水)0°C40°C80°CKCl2840.151.3NaCl35.736.438K2Cr2O74.726.373Na2Cr2O7163215376
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、______、过滤、______、干燥.
(4)表格是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl→K2Cr2O7↓+2NaCl.
该反应在溶液中能发生的理由是______.
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n g样品,加入过量______(填写试剂)、溶解、过滤、再______(填写试剂)、…灼烧、冷却、称量,得干燥固体m g.计算样品中氢氧化铝的质量分数为物质 溶解度/(g/100g水) 0°C 40°C 80°C KCl 28 40.1 51.3 NaCl 35.7 36.4 38 K2Cr2O7 4.7 26.3 73 Na2Cr2O7 163 215 376 [26m/17n][26m/17n](用含m、n的代数式表示).
(6)六价铬有毒,而Cr3+相对安全.工业含铬(CrO3)废渣无害化处理的方法之一是干法解毒,用煤不完全燃烧生成的CO还原CrO3.在实验室中模拟这一过程的装置如下:
CO由甲酸脱水制得;实验结束时熄灭酒精灯的顺序是______. 毕竟我们走过那会1年前1
毕竟我们走过那会1年前1 -
 cc妮 共回答了15个问题
cc妮 共回答了15个问题 |采纳率100%解题思路:(1)依据流程图和题干反应分析判断固体X的成分;通常PH试纸只能测定溶液PH的整数,测定PH是小数的需要用精确试纸或pH计;
(2)结合流程图和反应过程中得到物质分析,酸化步骤用醋酸调节溶液pH<5为了转化CrO42-离子为Cr2O72-;
(3)溶液中得到溶质晶体的方法是蒸发浓缩,冷却结晶,过滤洗涤步骤分析回答;
(4)依据物质溶解度比较分析,反应向溶解度晓得方向进行;
(5)利用氢氧化铝是两性氢氧化物和强碱反应溶解,少量镁、铁的难溶化合物不溶解;分离提取溶液中的偏铝酸钠可以根据实验室制取氢氧化铝沉淀的方法进行,通入二氧化碳得到氢氧化铝沉淀;灼烧后得到氧化铝,依据元素守恒计算得到;
(6)依据一氧化碳气体是有毒气体需要点燃处理.(1)铬铁矿的主要成分可表示为FeO•Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,加入氧气和碳酸钠,发生反应为:
①4FeO•Cr2O3+8Na2CO3+7O2
750℃
8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3
750℃
2NaAlO2+CO2↑;
③Cr2O72-+H2O⇌2CrO42-+2H+,
操作Ⅰ是过滤得到固体X为Fe2O3、MgO;要检测酸化操作中溶液的pH是否等于4.5,普通pH试纸只能测定溶液pH到整数,是近似测定,准确测定需要用pH计或精确pH试纸,
故答案为:Fe2O3、MgO;pH计或精密pH试纸;
(2)酸化步骤用醋酸调节溶液pH<5,依据流程图中物质的转化和制备目的可知,结合反应平衡Cr2O72-+H2O⇌2CrO42-+2H+,加入酸,氢离子浓度增大,平衡左移,作用是使CrO42-转化为Cr2O72-,故答案为:使CrO42-转化为Cr2O72-;
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩,冷却结晶、过滤、洗涤、干燥得到晶体,
故答案为:冷却结晶,洗涤;
(4)依据图表物质的溶解度分析对比,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl;说明K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小),
故答案为:K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小);
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是先利用氢氧化铝的两性,用氢氧化钠溶液溶解氢氧化铝过滤得到滤液中同仁医院二氧化碳生成氢氧化铝沉淀,灼烧干燥得到氧化铝干燥固体m g,依据铝元素守恒计算,样品中氢氧化铝的质量分数=
mg
156g/mol×2×78g/mol
ng×100%=[26m/17n],
故答案为:NaOH溶液;通入过量二氧化碳;[26m/17n];
(6)CO由甲酸脱水制得,生成的一氧化碳是有毒气体,不能直接排放到空气中,最后需要点燃除去,Ⅲ装置中发生的反应是CO还原CrO3.需要冷却后再停止通一氧化碳气体,防止还原产物被氧化,所以熄灭酒精灯的顺序是先熄灭Ⅲ,在熄灭Ⅰ,最后熄灭Ⅳ,
故答案为:III、I、IV.点评:
本题考点: 制备实验方案的设计;常见金属元素的单质及其化合物的综合应用;物质的分离、提纯的基本方法选择与应用.
考点点评: 本题考查了物质制备流程和方案的分析判断,物质性质的应用,题干信息的分析理解,操作步骤的注意问题和基本操作方法是解题关键,题目难度中等.1年前查看全部
- 化工原料红矾钠(重铬酸钠:Na2Cr207-2H20)主要是以铬铁矿(主要成份为FeO-Cr2O3,还含有A1203,S
化工原料红矾钠(重铬酸钠:Na2Cr207-2H20)主要是以铬铁矿(主要成份为FeO-Cr2O3,还含有A1203,Si02等
化工原料红矾钠(重铬酸钠:Na2Cr207-2H20)主要是以铬铁矿(主要成份为FeO-Cr2O3,还含有A1203,Si02等杂质)为主要原料生产,其主要工艺流程如图1: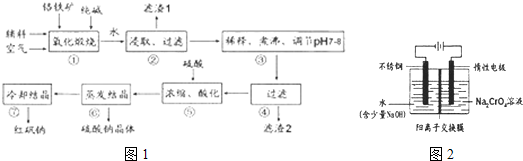
步骤①中主要反应的化学方程式为:Fe0?Cr2O3+8Na2C03+702=8Na2Cr04+2Fe2O3+8C02
(I)①中反应是在回转窑中进行,反应时需不断搅拌,其作用是______.
(2)杂质A1203,SiO2在①中转化的化学反应方程式为______
(3)用化学平衡移动原理说明③中煮沸的作用是______(用离子方程式结合文字说明),若调节pH过低产生的影响是______
(4)⑤中酸化是使Cr042一转化为Cr2072一,写出该反应的离子方程式:______
(5)工业上还可用电解法制备重铬酸钠,其装置示意图如图2:
阴极发生的电极反应式为:______
阳极发生的电极反应式为:______.
 帅气乖巧的俞小灏1年前1
帅气乖巧的俞小灏1年前1 -
 shao008 共回答了13个问题
shao008 共回答了13个问题 |采纳率76.9%(1)固体反应物在搅拌时可充分接触而反应,故答案为:增大反应物的接触面积,加快反应速率;(2)Al2O3与纯碱反应转变为可溶性盐,生成NaAlO2,反应的化学方程式为Al2O3+Na2CO3 高温 . 2NaAlO2+CO2...1年前查看全部
- (2010•烟台一模)重铬酸钾(K2Cr2O7)是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO•Cr
(2010•烟台一模)重铬酸钾(k2cr2o7)是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为feo•cr2o3)为原料生产.实验室模拟工业生产如下图:

涉及的主要反应为:6feo•cr2o3+24naoh+7kclo3
12na2cro4+3fe2o3+7kcl+12h2o△ .
在反应器中,有na2cro4生成,同时fe2o3转变为nafeo2,杂质sio2、al2o3与纯碱反应转变为可溶性盐.氧化铝与碳酸钠发生的反应为al2o3+na2co3
2naalo2+co2↑,生成的偏铝酸钠(naalo2)可与水反应naalo2+2h2o⇌naal(oh)4⇌al(oh)3+naoh.△ .
(1)写出二氧化硅与碳酸钠反应的化学方程式sio2+na2co3
na2sio3+co2高温 .sio2+na2co3.
na2sio3+co2高温 .
(2)nafeo2能强烈水解,在操作②中生成沉淀而除去,试写出该反应的化学方程式:______.
(3)操作③调节后溶液的ph比原来降低,调节的目的是(用简要的文字和必要的离子方程式说明)______.
(4)称取重铬酸钾(k2cr2o7式量为294)试样m g配成vml溶液,取出v1 ml于锥形瓶中,加入适量的稀h2so4和足量碘化钾,放于暗处5min,然后加入100ml水,同时加入3ml淀粉溶液作指示剂,用c mol•l-1na2s2o3标准溶液滴定(相关反应为:cr2o72-+6i-+14h+=2cr3++3i2+7h2o、i2+2s2o32-=2i-+s4o62- ).则:
①取v1 ml待测液应选用的仪器为______(写仪器名称).
②判断达到滴定终点的依据是______.
③设整个过程中其它杂质不参与反应.若实验***用去na2s2o3标准溶液v2ml,则计算所得产品中重铬酸钾纯度的代数式为
×100%294×c×v×v2 6×1000×v1×m (不必化简).
×100%294×c×v×v2 6×1000×v1×m  小喵子1年前1
小喵子1年前1 -
 漂流在路上 共回答了23个问题
漂流在路上 共回答了23个问题 |采纳率87%解题思路:(1)二氧化硅与碳酸钠反应生成硅酸钠和二氧化碳;
(2)NaFeO2能强烈水解,生成氢氧化铁沉淀;
(3)③调节后溶液的pH比原来降低,是因降低pH,促进水解平衡正向移动;
(4)①重铬酸钾具有强氧化性,应选酸式滴定管量取;
②达到滴定终点时颜色突变且30s不变色;
③由Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O、I2+2S2O32-=2I-+S4O62- 可知,存在Cr2O72-~6S2O32-,以此计算.(1)二氧化硅与碳酸钠反应生成硅酸钠和二氧化碳,该反应为SiO2+Na2CO3
高温
.
Na2SiO3+CO2,
故答案为:SiO2+Na2CO3
高温
.
Na2SiO3+CO2;
(2)NaFeO2能强烈水解,生成氢氧化铁沉淀,该水解反应为NaFeO2+2H2O=Fe(OH)3↓+NaOH,故答案为:NaFeO2+2H2O=Fe(OH)3↓+NaOH;
(3)③调节后溶液的pH比原来降低,是由于硅酸钠和偏铝酸钠在溶液中发生水解,SiO32-+H2O HSiO3-+OH-、HSiO3-+H2O
HSiO3-+OH-、HSiO3-+H2O H2SiO3+OH-、AlO2-+2H2O
H2SiO3+OH-、AlO2-+2H2O Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀,
Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀,
故答案为:由于硅酸钠和偏铝酸钠在溶液中发生水解,SiO32-+H2O HSiO3-+OH-、HSiO3-+H2O
HSiO3-+OH-、HSiO3-+H2O H2SiO3+OH-、AlO2-+2H2O
H2SiO3+OH-、AlO2-+2H2O Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀;
Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀;
(4)①重铬酸钾具有强氧化性,应选酸式滴定管(或移液管)量取,故答案为:酸式滴定管(或移液管);
②达到滴定终点时,当滴加最后一滴硫代硫酸钠溶液,溶液蓝色褪去且半分钟内不复现,
故答案为:当滴加最后一滴硫代硫酸钠溶液,溶液蓝色褪去且半分钟内不复现;
③由Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O、I2+2S2O32-=2I-+S4O62- 可知,
存在Cr2O72-~6S2O32-,
1 6
所得产品中重铬酸钾纯度的代数式为
294×c×V×V2
6×1000×V1×m×100%,故答案为:
294×c×V×V2
6×1000×V1×m×100%.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查混合物的分离、提纯,明确流程中操作的目的是解答的关键,注意利用关系式计算,(4)为解答的难点,题目难度中等.1年前查看全部
- (2014•青岛二模)重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO•Cr2O3,杂质为Si
(2014•青岛二模)重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO•Cr2O3,杂质为SiO2、Al2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图.涉及的主要反应是:
6FeO•Cr2O3+24NaOH+7KClO3═12Na2CrO4+3Fe2O3+7KCl+12H2O
(1)碱浸前将铬铁矿粉碎的目的是______.
(2)步骤③调节pH后过滤得渣是______.
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式______.
(4)用简要的文字说明操作⑤加入KC1的原因______
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法.该法是向废水中加入FeSO4•7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于FeⅡ[Fe
CrⅢx
]O4(铁氧磁体,罗马数字表示元素价态)的沉淀.处理1mol Cr2O72-,需加入a mol FeSO4•7H2O,下列结论正确的是______.ⅢⅢ(2−x)
A.x=0.5,a=8B.x=0.5,a=10C.x=1.5,a=8D.x=1.5,a=10. xiximao991年前1
xiximao991年前1 -
 slado 共回答了21个问题
slado 共回答了21个问题 |采纳率85.7%解题思路:工业上常用铬铁矿(主要成分为FeO•Cr2O3,杂质为SiO2、Al2O3)为原料生产重铬酸钾:在反应器①中,6FeO•Cr2O3+24NaOH+7KClO3═12Na2CrO4+3Fe2O3+7KCl+12H2O,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,NaFeO2能强烈水解,为强碱弱酸液,水解呈碱性,生成氢氧化铁沉淀,反应的离子方程式为FeO2-+2H2O=Fe(OH)3↓+OH-,由于硅酸钠和偏铝酸钠在溶液中发生水解,SiO32-+H2O⇌HSiO3-+OH-、HSiO3-+H2O⇌H2SiO3+OH-、AlO2-+2H2O⇌Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀,操作④中酸化时,CrO42-转化为Cr2O72-,常温下重铬酸钾的溶解度较小,操作⑤中利用Na2Cr2O7+2KCl═K2Cr2O7+2NaCl复分解反应,得到重铬酸钾.
(1)依据影响化学反应速率的因素分析,增大接触面积会加快反应速率;
(2)根据水解平衡移动判断产物;
(3)在酸性环境下,CrO42-转化为Cr2O72-,据此来书写方程式;
(4)操作⑤加入KCl的原因温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大;
(5)根据氧化还原反应中得失电子数相等,再结合原子守恒进行计算.工业上常用铬铁矿(主要成分为FeO•Cr2O3,杂质为SiO2、Al2O3)为原料生产重铬酸钾:在反应器①中,6FeO•Cr2O3+24NaOH+7KClO3═12Na2CrO4+3Fe2O3+7KCl+12H2O,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,NaFeO2能强烈水解,为强碱弱酸液,水解呈碱性,生成氢氧化铁沉淀,反应的离子方程式为FeO2-+2H2O=Fe(OH)3↓+OH-,由于硅酸钠和偏铝酸钠在溶液中发生水解,SiO32-+H2O⇌HSiO3-+OH-、HSiO3-+H2O⇌H2SiO3+OH-、AlO2-+2H2O⇌Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀,操作④中酸化时,CrO42-转化为Cr2O72-,常温下重铬酸钾的溶解度较小,操作⑤中利用Na2Cr2O7+2KCl═K2Cr2O7+2NaCl复分解反应,得到重铬酸钾.
(1)增大接触面积会加快反应速率,碱浸前将铭铁矿粉碎的作用是增大接触面积加快反应速率,
故答案为:增大接触面积,增大反应速率;
(2)由于硅酸钠和偏铝酸钠在溶液中发生水解,SiO32-+H2O⇌HSiO3-+OH-、HSiO3-+H2O⇌H2SiO3+OH-、AlO2-+2H2O⇌Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀,
故答案为:H2SiO3、Al(OH)3;
(3)在酸性环境下,CrO42-转化为Cr2O72-,即2CrO42-+2H+⇌Cr2O72-+H2O;
故答案为:2CrO42-+2H+⇌Cr2O72-+H2O;
(4)操作⑤加入KCl的原因是:温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大,利用Na2Cr2O7+2KCl═K2Cr2O7+2NaCl复分解反应,将溶液浓缩后,冷却,即有大量重铬酸钾结晶析出,氯化钠仍留在溶液中,可得到重铬酸钾,
故答案为:温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大,利用复分解反应,可得到重铬酸钾;
(5)处理1mol Cr2O72-,需加入a mol FeSO4•7H2O,根据铬原子守恒得,1mol Cr2O72-完全反应后生成 [2/2−x]molFeⅡ[FeⅢx•CrⅢ2-x]O4,根据铁原子守恒得amol=
2(1+x)
2−xmol①,
该反应中得失电子数相等,1mol×2×3=[2/2−x]mol×(3-2)×x,解得x=1.5,将x=1.5代入①得a=10,
故答案为:D.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查较为综合,涉及氧化还原反应、溶解平衡等问题,理解工艺流程以及根据转移电子数相等及原子守恒来分析解答是关键,需要学生具有阅读题目获取信息能力和灵活运用基础知识分析问题、解决问题能力,题目难度中等.1年前查看全部
- 铬铁矿中铁的化合价是多少呢,fecr2o4,是不是+2价?
 breaklove1年前2
breaklove1年前2 -
 yangguoqing100 共回答了23个问题
yangguoqing100 共回答了23个问题 |采纳率95.7%是的.Cr显+3价.1年前查看全部
- 重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO•Cr 2 O 3 ,杂质主要是二氧化硅和氧化
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO•Cr 2 O 3 ,杂质主要是二氧化硅和氧化铝)为原料生产,实验室模拟工业法用铬铁矿制K 2 Cr 2 O 7 的主要工艺如下,涉及的主要反应是:
6FeO•Cr 2 O 3 +24NaOH+7KClO 3
12Na 2 CrO 4 +3Fe 2 O 3 +7KCl+12H 2 O△ . 
试回答下列问题
(1)指出 24 Cr在周期表中的位置是______,
(2)NaFeO 2 能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式:______.
(3)操作③调节pH=7~8的原因是______.(用简要的文字和离子方程式说明)
下表是铬酸(H 2 CrO 4 )溶液中离子的组成与pH的关系:
(4)操作④酸化的目的是______.pH C(CrO 4 2- )mol/L C(HCrO 4 - )mol/L C(Cr 2 O 7 2- )mol/L C(H 2 CrO 4 )mol/L 4 0.0003 0.104 0.448 0 5 0.0033 0.103 0.447 0 6 0.0319 0.0999 0.437 0 7 0.2745 0.086 0.3195 0 8 0.902 0.0282 0.0347 0 9 0.996 0.0031 0.0004 0
(5)在铬酸(H 2 CrO 4 )溶液中,电离出CrO 4 2- 的电离平衡常数为K 2 ,电离出Cr 2 O 7 2- 的电离平衡常数为K 3 ,则K 2 ______K 3 (填>、﹦、<)
(6)上表中铬酸的物质的量浓度为______.(精确到小数点后2位) jingli_9201年前1
jingli_9201年前1 -
 雪窦飞雪 共回答了13个问题
雪窦飞雪 共回答了13个问题 |采纳率92.3%(1)K元素原子序数为19,处于第四周期第1列,第四周期容纳18种元素, 24 Cr的原子序数比K元素大5,所以 24 Cr处于周期表中第四周期,第6列,故 24 Cr处于周期表中第四周期第ⅥB族.
故答案为:第四周期第ⅥB.
(2)NaFeO 2 水解生成Fe(OH) 3 与NaOH,反应方程式为NaFeO 2 +2H 2 O=Fe(OH) 3 ↓+NaOH.
(3)由于溶液在硅酸钠和偏铝酸钠发生水解,SiO 3 2- +H 2 O⇌HSiO 3 - +OH - ,HSiO 3 - +H 2 O⇌H 2 SiO 3 +OH - ,AlO 2 - +H 2 O⇌Al(OH) 3 +OH - ,降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全.
故答案为:由于溶液在硅酸钠和偏铝酸钠发生水解,SiO 3 2- +H 2 O⇌HSiO 3 - +OH - ,HSiO 3 - +H 2 O⇌H 2 SiO 3 +OH - ,AlO 2 - +H 2 O⇌Al(OH) 3 +OH - ,降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全.
(4)由表中数据可知,铬酸(H 2 CrO 4 )溶液中pH越小,浓度越大Cr 2 O 7 2- ,加酸酸化使CrO 4 2- 转化为Cr 2 O 7 2- .
故答案为:酸化使CrO 4 2- 转化为Cr 2 O 7 2- .
(5)由表中数据可知,酸性条件下,铬酸(H 2 CrO 4 )溶液中Cr 2 O 7 2- 浓度远大于CrO 4 2- .所以电离出CrO 4 2- 的电离平衡常数小于电离出Cr 2 O 7 2- 的电离平衡常数,即K 2 <K 3 .
故答案为:<.
(6)选择第1组计算.根据铬元素守恒可知c(H 2 CrO 4 )=c(CrO 4 2- )mol/L+c(HCrO 4 - )mol/L+2c(Cr 2 O 7 2- )mol/L=0.0003mol/L+0.104mol/L+2×0.448mol/L=1.0003mol/L≈1.00mol/L.
故答案为:1.00mol/L.1年前查看全部
- 工业上用铬铁矿(主要成分FeO•Cr2O3,杂质为SiO2、Al2O3等)生产重铬酸钾(化学式K2Cr2O,)的流程如下
工业上用铬铁矿(主要成分FeO•Cr2O3,杂质为SiO2、Al2O3等)生产重铬酸钾(化学式K2Cr2O,)的流程如下:

(1)固体A中,除Na2CrO4、NaFeO2、NaOH外还有Na2SiO3、NaAlO2Na2SiO3、NaAlO2等;
(2)固体A水浸时,NaFeO2会发生强烈水解产生固体B,其化学反应方程式为NaFeO2+2H2O=NaOH+Fe(OH)3NaFeO2+2H2O=NaOH+Fe(OH)3;
(3)固体C中含有2种物质,要先加入下列物质中的CC,然后才能进行过滤分离.
A.氢氧化钠溶液B.稀氨水C.稀盐酸
(4)步骤④加入盐酸得到的溶液F中,除Na2Cr2O7外,还含有的溶质是NaClNaCl;
(5)在上述流程中,有氧化还原反应发生的是第①①步.
(6)已知20℃时K2Cr2O7饱和溶液浓度为0.4mol•L-1,步骤⑤中加入固体氯化钾,若使K+离子浓度达到4mol•L-1(保持温度20℃),则溶液F中Cr2O2-7离子的浓度最大为0.016mol/L0.016mol/L. win08071年前1
win08071年前1 -
 nirenfive 共回答了21个问题
nirenfive 共回答了21个问题 |采纳率95.2%(1)由题目信息可知,铬铁矿的主要成分FeO•Cr2O3,含有SiO2、Al2O3等杂质,SiO2与NaOH发生反应生成Na2SiO3,Al2O3与NaOH发生反应,生成NaAlO2,故还含有Na2SiO3、NaAlO2,
故答案为:Na2SiO3、NaAlO2;
(2)NaFeO2水解生成氢氧化钠与氢氧化铁,反应方程式为NaFeO2+2H2O═NaOH+Fe(OH)3,故答案为:NaFeO2+2H2O═NaOH+Fe(OH)3;
(3)由工艺流程可知,固体C中含有氢氧化铝与硅酸,氢氧化铝溶液强酸强碱,硅酸溶于强碱、不能与酸(HF除外)反应,故应加入盐酸,将氢氧化铝转化为偏铝酸钠,再过滤分离,
故选:C;
(4)由工艺流程可知,Na2CrO4在酸性条件下转化为Na2Cr2O7,根据元素守恒还有氯化钠生成,故答案为:NaCl;
(5)由工艺流程可知,第①步反应中,铁元素、铬元素、氧元素化合价反应变化,属于氧化还原反应,其它各步反应中元素的化合价未变化,不属于氧化还原反应,
故答案为:①;
(6)20℃时K2Cr2O7饱和溶液浓度为0.4mol•L-1,该温度下c2(K+)•c(Cr2O2-7)=0.82•0.4=0.256,所以使K+离子浓度达到4mol•L-1(保持温度20℃),溶液F中Cr2O2-7离子的浓度最大为
0.256
42mol/L=0.016mol/L,故答案为:0.016mol/L.1年前查看全部
- 工业上以铬铁矿(主要成分为FeO·Cr 2 O 3 )、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na 2 Cr 2 O 7
工业上以铬铁矿(主要成分为FeO·Cr 2 O 3 )、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na 2 Cr 2 O 7 ·2H 2 O),其主要反应如下:
①4FeO·Cr 2 O 3 +8Na 2 CO 3 +7O 2 8Na 2 CrO 4 +2Fe 2 O 3 +8CO 2
8Na 2 CrO 4 +2Fe 2 O 3 +8CO 2
②2Na 2 CrO 4 +H 2 SO 4 Na 2 SO 4 +Na 2 Cr 2 O 7 +H 2 O
下列说法正确的是( )A.反应①和②均为氧化还原反应 B.反应①的氧化剂是O 2 ,还原剂是FeO·Cr 2 O 3 C.Na 2 Cr 2 O 7 中Cr元素的化合价为+7 D.反应①中生成1 mol的Na 2 CrO 4 时共转移28 mol电子  warriorsword1年前1
warriorsword1年前1 -
 辉芳 共回答了22个问题
辉芳 共回答了22个问题 |采纳率72.7%B
反应②中元素无化合价的变化,A项错误;Na 2 Cr 2 O 7 中Cr的化合价为+6价,C项错误;从反应①看该反应转移电子数为28 mol,故生成1 mol Na 2 CrO 4 转移电子数为3.5 mol,D项错误。1年前查看全部
- 重铬酸钾(K 2 Cr 2 O 7 )是工业生产和实验室的重要氧化剂.实验室模拟工业生产重铬酸钾时用铬铁矿(主要成份为F
重铬酸钾(k 2 cr 2 o 7 )是工业生产和实验室的重要氧化剂.实验室模拟工业生产重铬酸钾时用铬铁矿(主要成份为feo•cr 2 o 3 )、纯碱、烧碱、氯酸钾等为原料先制得铬酸钠(na 2 cro 4 ),涉及的主要反应是6feo•cr 2 o 3 +24naoh+7kclo 3
12na 2 cro 4 +3fe 2 o 3 +7kcl+12h 2 o,然后将铬酸钠转化为k 2 cr 2 o 7 .其主要工艺如下:△ . 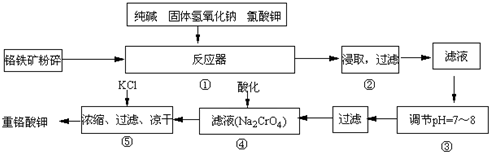
试回答下列问题:
(1)在反应器①中,有na 2 cro 4 生成,同时fe 2 o 3 转变为nafeo 2 ,杂质sio 2 、al 2 o 3 与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:______.
(2)nafeo 2 能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式:______.
(3)操作③的目的是什么,用简要的文字和化学方程式说明:______.
(4)操作④中,酸化时,cro 4 2- 转化为cr 2 o 7 2- ,写出平衡转化的离子方程式:______.
(5)称取重铬酸钾试样2.5000g配成250ml溶液,取出25.00ml于碘量瓶中,加入10ml 2mol/lh 2 so 4 溶液和足量碘化钾(铬的还原产物为cr 3+ ),放于暗处5min,然后加入100ml水,加入3ml淀粉指示剂,用0.1200mol/lna 2 s 2 o 3 标准溶液滴定i 2 +2s 2 o 3 2- =2i - +s 4 o 6 2- .
①判断达到滴定终点的依据是:______;
②若实验***用去na 2 s 2 o 3 标准溶液40.00ml,则所得产品中的重铬酸钾的纯度为:______(设k 2 cr 2 o 7 的摩尔质量为294g•mol -1 ,整个过程中其它杂质不参与反应). 朝发披香殿1年前1
朝发披香殿1年前1 -
 心迷茫路漫长 共回答了20个问题
心迷茫路漫长 共回答了20个问题 |采纳率95%(1)Al 2 O 3 与纯碱反应转变为可溶性盐,生成NaAlO 2 ,反应的化学方程式为Al 2 O 3 +Na 2 CO 3
△
.
2NaAlO 2 +CO 2 ↑,故答案为:Al 2 O 3 +Na 2 CO 3
△
.
2NaAlO 2 +CO 2 ↑;
(2)NaFeO 2 能强烈水解,为强碱弱酸液,水解呈碱性,生成氢氧化铁沉淀,反应的离子方程式为FeO 2 - +2H 2 O=Fe(OH) 3 ↓+OH - ,故答案为:FeO 2 - +2H 2 O=Fe(OH) 3 ↓+OH - ;
(3)由于硅酸钠和偏铝酸钠在溶液中发生水解,SiO 3 2- +H 2 O⇌HSiO 3 - +OH - 、HSiO 3 - +H 2 O⇌H 2 SiO 3 +OH - 、AlO 2 - +2H 2 O⇌Al(OH) 3 +OH - ,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀,
故答案为:由于硅酸钠和偏铝酸钠发生水SiO 3 2- +2H 2 O⇌H 2 SiO 3 +2OH - (或SiO 3 2- +H 2 O⇌HSiO 3 - +OH - ,HSiO 3 - +H 2 O⇌H 2 SiO 3 +OH - ,AlO 2 - +H 2 O⇌Al(OH) 3 +OH - ),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全;
(4)在酸性环境下,CrO 4 2- 转化为Cr 2 O 7 2- ,即2CrO 4 2- +2H + ⇌Cr 2 O 7 2- +H 2 O,故答案为:2CrO 4 2- +2H + ⇌Cr 2 O 7 2- +H 2 O;
(5)①根据反应:I 2 +2S 2 O 3 2- =2I - +S 4 O 6 2- ,当滴加最后一滴硫代硫酸钠溶液时,碘单质恰好完全反应,溶液蓝色褪去,达到滴定终点,
故答案为:当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不变色;
②由反应Cr 2 O 7 2- +6I - +14H + =2Cr 3+ +3I 2 +7H 2 O;I 2 +2S 2 O 3 2- =2I - +S 4 O 6 2- 可得反应的关系式为Cr 2 O 7 2- ~3I 2 ~6S 2 O 3 2- ,根据关系式计算.
Cr 2 O 7 2- ~3I 2 ~6S 2 O 3 2-
1mol 3mol 6mol
n 0.1200×40×10 -3 mol
则250ml含重铬酸钾的物质的量为n=
0.1200×40×1 0 -3 mol
6 ×10,则所得产品中重铬酸钾纯度为
0.1200×40×1 0 -3 ×10×294
6×2.5000 ×100%=94.08%,
故答案为:94.08%.1年前查看全部
- (2013•上海模拟)铬铁矿的主要成分可表示为FeO•Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,如是以铬铁
(2013•上海模拟)铬铁矿的主要成分可表示为FeO•Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,如是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:

已知:①4FeO•Cr2O3+8Na2CO3+7O2
8Na2CrO4+2Fe2O3+8CO2↑;750℃
②Na2CO3+Al2O3
2NaAlO2+CO2↑;750℃
③Cr2O72-+H2O⇌2CrO42-+2H+
根据题意回答下列问题:
(1)固体X中主要含有______(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用______(填写仪器或试剂名称).
(2)酸化步骤用醋酸调节溶液pH<5,其目的是______.
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、______、过滤、______、干燥.
(4)下表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl→K2Cr2O7↓+2NaCl.
该反应在溶液中能发生的理由是______.
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n g样品,加入过量______(填写试剂)、溶解、过滤、再______(填写试剂)、…灼烧、冷却、称量,得干燥固体m g.计算样品中氢氧化铝的质量分数为物质 溶解度/(g/100g水) 0℃ 40℃ 80℃ KCl 28 40.1 51.3 NaCl 35.7 36.4 38 K2Cr2O7 4.7 26.3 73 Na2Cr2O 163 215 376 [26m/17n][26m/17n](用含m、n的代数式表示). 一叶柳1年前1
一叶柳1年前1 -
 羽凌峰 共回答了17个问题
羽凌峰 共回答了17个问题 |采纳率100%解题思路:铬铁矿通过焙烧,生成Na2CrO4、Fe2O3、MgO和NaAlO2的混合体系,然后加水溶解得固体Fe2O3、MgO和溶液Na2CrO4、NaAlO2,再调节溶液的PH,使偏铝酸盐完全沉淀,继续调节溶液的PH使CrO42-转化为Cr2O72-,最后向所得溶液中加入氯化钾,生成溶解度极小的K2Cr2O7,
(1)依据流程图和题干反应分析判断固体X的成分;通常pH试纸只能测定溶液pH的整数,测定PH是小数的需要用精确试纸或pH计;
(2)结合流程图和反应过程中得到物质分析,酸化步骤用醋酸调节溶液pH<5为了转化CrO42-离子为Cr2O72-;
(3)溶液中得到溶质晶体的方法是蒸发浓缩,冷却结晶,过滤洗涤步骤分析回答;
(4)依据物质溶解度比较分析,反应向溶解度晓得方向进行;
(5)利用氢氧化铝是两性氢氧化物和强碱反应溶解,少量镁、铁的难溶化合物不溶解;分离提取溶液中的偏铝酸钠可以根据实验室制取氢氧化铝沉淀的方法进行,通入二氧化碳得到氢氧化铝沉淀;灼烧后得到氧化铝,依据元素守恒计算得到.(1)铬铁矿的主要成分可表示为FeO•Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,加入氧气和碳酸钠,发生反应为:
①4FeO•Cr2O3+8Na2CO3+7O2
750℃
.
8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3
750℃
.
2NaAlO2+CO2↑;
③Cr2CO72-+H2O⇌2CrO42-+2H+
操作Ⅰ是过滤得到固体X为Fe2O3、MgO;要检测酸化操作中溶液的pH是否等于4.5,普通pH试纸只能测定溶液pH到整数,是近似测定,准确测定需要用pH计或精确pH试纸,
故答案为:Fe2O3、MgO;pH计或精密pH试纸;
(2)酸化步骤用醋酸调节溶液pH<5,依据流程图中物质的转化和制备目的可知,结合反应平衡Cr2O72-+H2O⇌2CrO42-+2H+,加入酸,氢离子浓度增大,平衡左移,作用是使CrO42-转化为Cr2O72-,故答案为:使CrO42-转化为Cr2O72-;
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩,冷却结晶、过滤、洗涤、干燥得到晶体,
故答案为:冷却结晶;洗涤;
(4)依据图表物质的溶解度分析对比,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl;说明K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小),
故答案为:K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小);
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是先利用氢氧化铝的两性,用氢氧化钠溶液溶解氢氧化铝过滤得到滤液中通入二氧化碳生成氢氧化铝沉淀,灼烧干燥得到氧化铝干燥固体m g,依据铝元素守恒计算,样品中氢氧化铝的质量分数=
mg
156g/mol×2×78g/mol
ng=[26m/17n],故答案为:NaOH溶液;通入过量二氧化碳;[26m/17n].点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查了物质制备流程和方案的分析判断,物质性质的应用,题干信息的分析理解,操作步骤的注意问题和基本操作方法是解题关键,题目难度大.1年前查看全部
- (2014•资阳模拟)工业上常用铬铁矿(有效成份为FeO•Cr2O3,主要杂质为SiO2、Al2O3)为原料生产重铬酸钾
(2014•资阳模拟)工业上常用铬铁矿(有效成份为FeO•Cr2O3,主要杂质为SiO2、Al2O3)为原料生产重铬酸钾(K2Cr2O7),实验室模拟工业法用铬铁矿制重铬酸钾的主要工艺流程如图所示,涉及的主要反应是:6FeO•Cr2O3+24NaOH+7KClO3
12Na2CrO4+3Fe2O3+7KCl+12H2O,试回答下列问题:△ .
(1)⑤中溶液金属阳离子的检验方法是______.
(2)步骤③被沉淀的离子为(填离子符号)______.
(3)在反应器①中,二氧化硅与纯碱反应的化学方程式为:Na2CO3+SiO2
Na2SiO3+CO2↑高温 .Na2CO3+SiO2.
Na2SiO3+CO2↑高温 .
(4)烟道气中的CO2可与H2合成甲醇.CH3OH、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式:______.
(5)2011年云南曲靖的铬污染事件,说明含铬废渣(废水)的随意排放对人类生存环境有极大的危害.电解法是处理铬污染的一种方法,金属铁作阳极、石墨作阴极电解含Cr2O72-的酸性废水,一段时间后产生Fe(OH)3和Cr(OH)3沉淀.
①写出电解法处理废水的总反应的离子方程式______.
②已知Cr(OH)3的Ksp=6.3×10-31,若地表水铬含量最高限值是0.1mg/L,要使溶液中c(Cr3+)降到符合地表水限值,须调节溶液的c(OH-)≥6.3×10-31 1×10-4 52 mol/L(只写计算表达式).6.3×10-31 1×10-4 52  ll培养滴1年前1
ll培养滴1年前1 -
 海天蓝梦商务 共回答了19个问题
海天蓝梦商务 共回答了19个问题 |采纳率89.5%解题思路:(1)钠离子、钾离子的检验方法是焰色反应;
(2)硅酸钠和偏铝酸钠易发生水解,根据水解平衡移动原理来回答;
(3)二氧化硅与碳酸钠反应生成硅酸钠和二氧化碳;
(4)利用盖斯定律计算反应热,并书写热化学方程式;
(5)①用Fe为阳极进行电解,总反应:Fe+2H+═Fe2++H2↑;
Cr2O72-将亚铁离子氧化为铁离子反应的实质是:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,Fe3+、Cr3+结合氢氧根离子最终转化为Fe(OH)3、Cr(OH)3沉淀,把以上方程式加合可得电解法处理废水的总反应的离子方程式6Fe+Cr2O72-+2H++17H2O=6Fe(OH)3↓+2Cr(OH)3↓+6H2↑;
②根据Cr(OH)3的Ksp=6.3×10-31=c(Cr3+)×c3(OH-)计算.(1)⑤中溶液金属阳离子为钠离子、钾离子,检验方法是焰色反应,故答案为:焰色反应;
(2)由于硅酸钠和偏铝酸钠在溶液中发生水解,SiO32-+H2O⇌HSiO3-+OH-、HSiO3-+H2O⇌H2SiO3+OH-、AlO2-+2H2O⇌Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀,故答案为:SiO32-,AlO2-;
(3)二氧化硅与碳酸钠反应生成硅酸钠和二氧化碳,该反应为SiO2+Na2CO3
高温
.
Na2SiO3+CO2,故答案为:SiO2+Na2CO3
高温
.
Na2SiO3+CO2;
(4)甲醇和氢气的燃烧热书写其热化学方程式分别为:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l),△H1=-1451kJ/mol;
②2H2(g)+O2(g)═2H2O(l),△H2=-571.6KJ/mol,
根据盖斯定律,反应CO2(g)+3H2(g)═CH3OH(l)+H2O(l)
可以看成是方程式[3/2]×②-①×[1/2];所以△H=×[3/2](-571.6kJ/mol)-(-1451kJ/mol)×[1/2]=-131.9kJ/mol,
故答案为:CO2(g)+3H2(g)═CH3OH(l)+H2O(l)△H=-131.9kJ/mol;
(5)①用Fe为阳极进行电解,总反应:Fe+2H+═Fe2++H2↑;
Cr2O72-具有强氧化性,可以将亚铁离子氧化为铁离子,自身被还原为2Cr3+,反应的实质是:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,Cr2O72-与Fe2+反应的过程中,都将消耗大量的H+,使溶液pH上升,促使Fe3+、Cr3+结合氢氧根离子最终转化为Fe(OH)3、Cr(OH)3沉淀,综上可得:电解法处理废水的总反应的离子方程式6Fe+Cr2O72-+2H++17H2O=6Fe(OH)3↓+2Cr(OH)3↓+6H2↑,故答案为:6Fe+Cr2O72-+2H++17H2O=6Fe(OH)3↓+2Cr(OH)3↓+6H2↑;
②,若地表水铬含量最高限值是0.1mg/L,换算成物质的量浓度c(Cr3+)=
1×10-4
52mol/L,要使溶液中c(Cr3+)降到符合地表水限值,已知Cr(OH)3的Ksp=6.3×10-31=c(Cr3+)×c3(OH-),须调节溶液的c(OH-)≥
6.3×10-31
1×10-4
52mol/L,故答案为:
6.3×10-31
1×10-4点评:
本题考点: 制备实验方案的设计;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查较为综合,涉及氧化还原反应、电解、盖斯定律、化学计算、物质检验等,需要学生具备扎实的基础知识,平时注意培养分析和解决问题的能力,题目难度中等.1年前查看全部
- (2013•商丘三模)铬铁矿主要成分为FeO•Cr2O3,还含有杂质Al2O3.一般铬铁矿中Cr2O3质量分数约为40%
(2013•商丘三模)铬铁矿主要成分为FeO•Cr2O3,还含有杂质Al2O3.一般铬铁矿中Cr2O3质量分数约为40%.由铬铁矿制备重铬酸钾的方法如下:

已知:
①4FeO•Cr2O3+8Na2CO3+7O2
8Na2CrO4+2Fe2O3+8CO2↑;750℃ .
②Na2CO3+Al2O3
2NaAlO2+CO2↑;750℃ .
③Cr2O72-+H2O⇌2CrO42-+2H+
根据题意回答下列问题:
(1)操作I为______,固体X中主要含有______(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用______(填写仪器或试剂名称).
(2)酸化步骤用醋酸调节溶液pH<5,其目的是______.
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、______、过滤、______、干燥.
(4)固体Y中主要含有氢氧化铝,请写出调节溶液的pH=7~8时生成氢氧化铝的离子方程式______. 木头-人1年前1
木头-人1年前1 -
 fei19831103 共回答了16个问题
fei19831103 共回答了16个问题 |采纳率93.8%解题思路:铬铁矿通过焙烧,生成Na2CrO4、Fe2O3、MgO和NaAlO2的混合体系,然后加水溶解得固体Fe2O3、MgO和溶液Na2CrO4、NaAlO2,再调节溶液的PH,使偏铝酸盐完全沉淀,继续调节溶液的PH使CrO42-转化为Cr2O72-,最后向所得溶液中加入氯化钾,生成溶解度极小的K2Cr2O7,
(1)依据流程图和题干反应分析判断固体X的成分;通常PH试纸只能测定溶液PH的整数,测定PH是小数的需要用精确试纸或pH计;
(2)结合流程图和反应过程中得到物质分析,酸化步骤用醋酸调节溶液pH<5为了转化CrO42-离子为Cr2O72-;
(3)溶液中得到溶质晶体的方法是蒸发浓缩,冷却结晶,过滤洗涤步骤分析回答;
(4)调节溶液的pH=7~8时,醋酸可以和偏铝酸根离子之间反应生成氢氧化铝沉淀.(1)铬铁矿的主要成分可表示为FeO•Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,加入氧气和碳酸钠,发生反应为:
①4FeO•Cr2O3+8Na2CO3+7O2
750℃
.
8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3
750℃
.
2NaAlO2+CO2↑;
③Cr2CO72-+H2O⇌2CrO42-+2H+.
操作Ⅰ是过滤,得到固体X为Fe2O3、MgO;要检测酸化操作中溶液的pH是否等于4.5,普通pH试纸只能测定溶液pH到整数,是近似测定,准确测定需要用pH计或精确pH试纸,
故答案为:过滤;Fe2O3、MgO;pH计或精密pH试纸;
(2)酸化步骤用醋酸调节溶液pH<5,依据流程图中物质的转化和制备目的可知,结合反应平衡Cr2O72-+H2O⇌2CrO42-+2H+,加入酸,氢离子浓度增大,平衡左移,作用是使CrO42-转化为Cr2O72-,故答案为:使CrO42-转化为Cr2O72-;
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩,冷却结晶、过滤、洗涤、干燥得到晶体,
故答案为:冷却结晶,洗涤;
(4)调节溶液的pH=7~8时,醋酸可以和偏铝酸根离子之间反应生成氢氧化铝沉淀,反应为:CH3COOH+AlO2-+H2O=Al(OH)3↓+CH3COO-,故答案为:CH3COOH+AlO2-+H2O=Al(OH)3↓+CH3COO-.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;制备实验方案的设计.
考点点评: 本题考查了物质制备流程和方案的分析判断,物质性质的应用,题干信息的分析理解,操作步骤的注意问题和基本操作方法是解题关键,题目难度大.1年前查看全部
- (2009•梅州模拟)重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO•Cr2O3,杂质主要是
(2009•梅州模拟)重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO•Cr2O3,杂质主要是二氧化硅和氧化铝)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:
6FeO•Cr2O3+24NaOH+7KClO3
12Na2CrO4+3Fe2O3+7KCl+12H2O△ .
试回答下列问题
(1)指出24Cr在周期表中的位置是______,
(2)NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式:______.
(3)操作③调节pH=7~8的原因是______.(用简要的文字和离子方程式说明)
下表是铬酸(H2CrO4)溶液中离子的组成与pH的关系:
(4)操作④酸化的目的是______.pH C(CrO42-)mol/L C(HCrO4-)mol/L C(Cr2O72-)mol/L C(H2CrO4)mol/L 4 0.0003 0.104 0.448 0 5 0.0033 0.103 0.447 0 6 0.0319 0.0999 0.437 0 7 0.2745 0.086 0.3195 0 8 0.902 0.0282 0.0347 0 9 0.996 0.0031 0.0004 0
(5)在铬酸(H2CrO4)溶液中,电离出CrO42-的电离平衡常数为K2,电离出Cr2O72-的电离平衡常数为K3,则K2______K3(填>、﹦、<)
(6)上表中铬酸的物质的量浓度为______.(精确到小数点后2位) hcit146221年前1
hcit146221年前1 -
 孙培新 共回答了16个问题
孙培新 共回答了16个问题 |采纳率93.8%解题思路:(1)根据K元素确定24Cr在周期表中的位置.
(2)NaFeO2水解生成Fe(OH)3与NaOH.
(3)操作②的滤液中含有SiO32-、AlO2-等,pH调到7~8时,使SiO32-、AlO2-等水解完全除去.
(4)由表中数据可知,铬酸(H2CrO4)溶液中pH越小,浓度越大Cr2O72-,酸化使CrO42-转化为Cr2O72-.
(5)由表中数据可知,酸性条件下,铬酸(H2CrO4)溶液中Cr2O72-浓度远大于CrO42-.
(6)根据铬元素守恒可知c(H2CrO4)=c(CrO42-)mol/L+c(HCrO4-)mol/L+2c(Cr2O72-)mol/L.选择任何1组计算.(1)K元素原子序数为19,处于第四周期第1列,第四周期容纳18种元素,24Cr的原子序数比K元素大5,所以24Cr处于周期表中第四周期,第6列,故24Cr处于周期表中第四周期第ⅥB族.
故答案为:第四周期第ⅥB.
(2)NaFeO2水解生成Fe(OH)3与NaOH,反应方程式为NaFeO2+2H2O=Fe(OH)3↓+NaOH.
(3)由于溶液在硅酸钠和偏铝酸钠发生水解,SiO32-+H2O⇌HSiO3-+OH-,HSiO3-+H2O⇌H2SiO3+OH-,AlO2-+H2O⇌Al(OH)3+OH-,降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全.
故答案为:由于溶液在硅酸钠和偏铝酸钠发生水解,SiO32-+H2O⇌HSiO3-+OH-,HSiO3-+H2O⇌H2SiO3+OH-,AlO2-+H2O⇌Al(OH)3+OH-,降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全.
(4)由表中数据可知,铬酸(H2CrO4)溶液中pH越小,浓度越大Cr2O72-,加酸酸化使CrO42-转化为Cr2O72-.
故答案为:酸化使CrO42-转化为Cr2O72-.
(5)由表中数据可知,酸性条件下,铬酸(H2CrO4)溶液中Cr2O72-浓度远大于CrO42-.所以电离出CrO42-的电离平衡常数小于电离出Cr2O72-的电离平衡常数,即K2<K3.
故答案为:<.
(6)选择第1组计算.根据铬元素守恒可知c(H2CrO4)=c(CrO42-)mol/L+c(HCrO4-)mol/L+2c(Cr2O72-)mol/L=0.0003mol/L+0.104mol/L+2×0.448mol/L=1.0003mol/L≈1.00mol/L.
故答案为:1.00mol/L.点评:
本题考点: 制备实验方案的设计;盐类水解的应用.
考点点评: 考查学生对工艺流程理解、实验操作的理解、阅读题目获取信息能力、盐类水解及有关计算、电离等,难度中等,理解工艺流程是关键,需要学生具有阅读题目获取信息能力和灵活运用基础知识分析问题、解决问题能力.1年前查看全部
- (2012•韶关一模)由固体碱熔氧化法可制备重铬酸钾,已知精选后的铬铁矿主要成分是亚铬酸铁[Fe(CrO2)2或FeO•
(2012•韶关一模)由固体碱熔氧化法可制备重铬酸钾,已知精选后的铬铁矿主要成分是亚铬酸铁[Fe(CrO2)2或FeO•Cr2O3],还含有硅、铝的氧化物等杂质.

(1)若氧化焙烧在实验室进行,所用的主要仪器是______(填序号,下同);蒸发浓缩时所用的主要仪器是______.
A.蒸发皿 B.普通坩埚C.铁坩埚
(2)氧化焙烧时,发生重要反应的化学方程式有:
6FeO•Cr2O3+12Na2CO3+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12CO2↑,
Al2O3+Na2CO3
2NaAlO2+CO2↑,Fe2O3+Na2CO3△ .
2NaFeO2+CO2↑△ .
以及:SiO2+Na2CO3
Na2SiO3+CO2↑高温 .SiO2+Na2CO3.
Na2SiO3+CO2↑高温 .
(3)用水浸取熔块时,NaFeO2强烈水解,生成氢氧化铁沉淀而除去,试写出离子方程式:______.
(4)残渣2的主要成分有(填化学式)______.
(5)已知K2Cr2O7和NaCl两种物质的溶解度随温度变化变化如下:
则最后一步由混合液转变成K2Cr2O7晶体的操作是______、______、过滤、洗涤、烘干.温度 10℃ 20℃ 50℃ 80℃ 100℃ K2Cr2O7溶解度(g) 8.5 13.1 37.0 73.0 102.0 NaCl溶解度(g) 35.8 36.0 37.0 38.4 39.8  sadgkhagkjeg1年前1
sadgkhagkjeg1年前1 -
 惨吗是呀 共回答了21个问题
惨吗是呀 共回答了21个问题 |采纳率85.7%解题思路:铬铁矿通过焙烧,生成Na2CrO4、Fe2O3、MgO和NaAlO2的混合体系,然后加水溶解得固体Fe2O3、MgO和溶液Na2CrO4、NaAlO2,再调节溶液的pH,使偏铝酸盐完全沉淀,继续调节溶液的pH使CrO42-转化为Cr2O72-,最后向所得溶液中加入氯化钾,生成溶解度极小的K2Cr2O7,
(1)高温加热固体应在坩埚中进行,为防止坩埚炸裂,应用铁坩埚;蒸发浓缩时所用的主要仪器是蒸发皿;
(2)铬铁矿的主要成分可表示为FeO•Cr2O3,还含有MgO、SiO2、Al2O3、Fe2O3等杂质,都可在高温下与碳酸钠反应;
(3)NaFeO2强烈水解,生成氢氧化铁沉淀,根据质量守恒可知还应有NaOH;
(4)滤液1中含有Na2SiO3、NaAlO2,调节pH可生成Al(OH)3、H2SiO3;
(5)溶液中得到溶质晶体的方法是蒸发浓缩,冷却结晶,过滤、洗涤等步骤.铬铁矿通过焙烧,生成Na2CrO4、Fe2O3、MgO和NaAlO2的混合体系,然后加水溶解得固体Fe2O3、MgO和溶液Na2CrO4、NaAlO2,再调节溶液的pH,使偏铝酸盐完全沉淀,继续调节溶液的pH使CrO42-转化为Cr2O72-,最后向所得溶液中加入氯化钾,生成溶解度极小的K2Cr2O7,
(1)高温加热固体应在坩埚中进行,由于固体中含有碳酸钠,在高温下可与二氧化硅反应,则为防止坩埚炸裂,应用铁坩埚;蒸发浓缩时所用的主要仪器是蒸发皿,
故答案为:C; A;
(2)铬铁矿的主要成分可表示为FeO•Cr2O3,还含有MgO、SiO2、Al2O3、Fe2O3等杂质,都可在高温下与碳酸钠反应,由已知方程式可知,还应存在SiO2+Na2CO3
高温
.
Na2SiO3+CO2↑,
故答案为:SiO2+Na2CO3
高温
.
Na2SiO3+CO2↑;
(3)NaFeO2强烈水解,生成氢氧化铁沉淀,根据质量守恒可知还应有NaOH,离子方程式为FeO2-+2H2O=Fe(OH)3↓+OH-,
故答案为:FeO2-+2H2O=Fe(OH)3↓+OH-;
(4)滤液1中含有Na2SiO3、NaAlO2,调节pH可生成Al(OH)3、H2SiO3,故答案为:Al(OH)3、H2SiO3;
(5)溶液中得到溶质晶体的方法是蒸发浓缩,冷却结晶,过滤、洗涤等步骤,故答案为:蒸发浓缩;冷却结晶.点评:
本题考点: 常见金属元素的单质及其化合物的综合应用;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查了物质制备流程和方案的分析判断,为高频考点,侧重于学生的分析能力和实验能力的考查,注意物质性质的应用、题干信息的分析理解、操作步骤的注意问题和基本操作方法是解题关键,题目难度中等.1年前查看全部
- 在KOH熔体中大气中的氧气可将铬铁矿(FeCr2O4)中Fe和Cr的氧化态都转化为+6氧化态,1mol FeC
在KOH熔体中大气中的氧气可将铬铁矿(FeCr2O4)中Fe和Cr的氧化态都转化为+6氧化态,1mol FeCr2O4在理论上需要多少摩尔O2使之氧化( )
A. 2mol
B. 2.5mol
C. 3mol
D. 4mol appledoodoo1年前1
appledoodoo1年前1 -
 ainaxin 共回答了15个问题
ainaxin 共回答了15个问题 |采纳率86.7%解题思路:FeCr2O4和O2发生反应过程中,FeCr2O4失电子数和O2的得电子数是应该相等的.FeCr2O4和O2发生反应过程中,FeCr2O4失电子,Fe和Cr的氧化态都转化为+6价,失电子数目是(6-2)+2(6-3)=10,设得到这些电子需要的氧气的物质的量是n,则2n(2-0)=10,解得n=2.5mol,故选B.
点评:
本题考点: 氧化还原反应的计算.
考点点评: 注意电子守恒法在解决氧化还原反应过程中的应用是解题的关键,难度不大.1年前查看全部
- (2013•商丘三模)铬铁矿主要成分为FeO•Cr2O3,还含有杂质Al2O3.一般铬铁矿中Cr2O3质量分数约为40%
(2013•商丘三模)铬铁矿主要成分为FeO•Cr2O3,还含有杂质Al2O3.一般铬铁矿中Cr2O3质量分数约为40%.由铬铁矿制备重铬酸钾的方法如下:

已知:
①4FeO•Cr2O3+8Na2CO3+7O2
8Na2CrO4+2Fe2O3+8CO2↑;750℃ .
②Na2CO3+Al2O3
2NaAlO2+CO2↑;750℃ .
③Cr2O72-+H2O⇌2CrO42-+2H+
根据题意回答下列问题:
(1)操作I为过滤过滤,固体X中主要含有Fe2O3、MgOFe2O3、MgO(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用pH计或精密pH试纸和玻璃棒pH计或精密pH试纸和玻璃棒(填写仪器或试剂名称).
(2)酸化步骤用醋酸调节溶液pH<5,其目的是使CrO42-转化为Cr2O72-使CrO42-转化为Cr2O72-.
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、冷却结晶冷却结晶、过滤、洗涤洗涤、干燥.
(4)固体Y中主要含有氢氧化铝,请写出调节溶液的pH=7~8时生成氢氧化铝的离子方程式CH3COOH+AlO2-+H2O=Al(OH)3↓+CH3COO-CH3COOH+AlO2-+H2O=Al(OH)3↓+CH3COO-. hbs1681年前1
hbs1681年前1 -
 zzxxcc0302 共回答了14个问题
zzxxcc0302 共回答了14个问题 |采纳率92.9%(1)铬铁矿的主要成分可表示为FeO•Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,加入氧气和碳酸钠,发生反应为:
①4FeO•Cr2O3+8Na2CO3+7O2
750℃
.
8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3
750℃
.
2NaAlO2+CO2↑;
③Cr2CO72-+H2O⇌2CrO42-+2H+.
操作Ⅰ是过滤,得到固体X为Fe2O3、MgO;要检测酸化操作中溶液的pH是否等于4.5,普通pH试纸只能测定溶液pH到整数,是近似测定,准确测定需要用pH计或精确pH试纸,
故答案为:过滤;Fe2O3、MgO;pH计或精密pH试纸;
(2)酸化步骤用醋酸调节溶液pH<5,依据流程图中物质的转化和制备目的可知,结合反应平衡Cr2O72-+H2O⇌2CrO42-+2H+,加入酸,氢离子浓度增大,平衡左移,作用是使CrO42-转化为Cr2O72-,故答案为:使CrO42-转化为Cr2O72-;
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩,冷却结晶、过滤、洗涤、干燥得到晶体,
故答案为:冷却结晶,洗涤;
(4)调节溶液的pH=7~8时,醋酸可以和偏铝酸根离子之间反应生成氢氧化铝沉淀,反应为:CH3COOH+AlO2-+H2O=Al(OH)3↓+CH3COO-,故答案为:CH3COOH+AlO2-+H2O=Al(OH)3↓+CH3COO-.1年前查看全部
- 重铬酸钾(K 2 Cr 2 O 7 )为用途极广的铬化合物。铬铁矿的主要成分可表示为FeO•Cr 2 O 3 ,还含有S
重铬酸钾(K 2 Cr 2 O 7 )为用途极广的铬化合物。铬铁矿的主要成分可表示为FeO•Cr 2 O 3 ,还含有SiO 2 、Al 2 O 3 等杂质,以铬铁矿为原料制备K 2 Cr 2 O 7 晶体的过程
如下图所示:
已知:①K 2 Cr 2 O 7 有强氧化性
②NaFeO 2 遇水强烈水解
③Cr 2 O 7 2 - + H 2 O 2CrO 4 2 - + 2H +
2CrO 4 2 - + 2H +
请回答:
(1)煅烧铬铁矿生成Na 2 CrO 4 和NaFeO 2 反应的化学方程式是 。
(2)滤液1的成分除NaOH、Na 2 CrO 4 外,还含有(填化学式) ;
生成滤渣1中红褐色物质的反应离子方程式是 。
(3)由滤液2转化为Na 2 Cr 2 O 7 溶液应加入的试剂是 。
(4)向Na 2 Cr 2 O 7 溶液中加入K 2 SO 4 固体,发生复分解反应而制得K 2 Cr 2 O 7 。生成K 2 Cr 2 O 7 晶体的过程是:加热浓缩、降温结晶、过滤、洗涤、干燥。试简述此法能够制得K 2 Cr 2 O 7 晶体的原因是: ;
洗涤时应选用 (选填字母)。
(5 )工业上常用Fe 2+ 处理酸性K 2 Cr 2 O 7 废水,先将Cr 2 O 7 2— 转化为Cr 3+ ,该反应的离子方程式为 ,再调节溶液的pH使金属离子生成沉淀而除去。A.蒸馏水 B.酒精 C.稀硫酸 D.饱和K 2 SO 4 溶液  xpyz13141年前1
xpyz13141年前1 -
 dengran05 共回答了24个问题
dengran05 共回答了24个问题 |采纳率87.5%1年前查看全部
- (2013•保定一模)重铬酸钾(K2Cr2O7)是工业生产和实验室的重要氧化剂.实验室模拟工业生产重铬酸钾时用铬铁矿(主
(2013•保定一模)重铬酸钾(k2cr2o7)是工业生产和实验室的重要氧化剂.实验室模拟工业生产重铬酸钾时用铬铁矿(主要成份为feo•cr2o3)、纯碱、烧碱、氯酸钾等为原料先制得铬酸钠(na2cro4),涉及的主要反应是6feo•cr2o3+24naoh+7kclo3
12na2cro4+3fe2o3+7kcl+12h2o,然后将铬酸钠转化为k2cr2o7.其主要工艺如下:△ .
试回答下列问题:
(1)在反应器①中,有na2cro4生成,同时fe2o3转变为nafeo2,杂质sio2、al2o3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:al2o3+na2co3
2naalo2+co2↑△ .al2o3+na2co3.
2naalo2+co2↑△ .
(2)nafeo2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式:______.
(3)操作③的目的是什么,用简要的文字和化学方程式说明:______.
(4)操作④中,酸化时,cro42-转化为cr2o72-,写出平衡转化的离子方程式:______.
(5)称取重铬酸钾试样2.5000g配成250ml溶液,取出25.00ml于碘量瓶中,加入10ml 2mol/lh2so4溶液和足量碘化钾(铬的还原产物为cr3+),放于暗处5min,然后加入100ml水,加入3ml淀粉指示剂,用0.1200mol/lna2s2o3标准溶液滴定i2+2s2o32-=2i-+s4o62-.
①判断达到滴定终点的依据是:______;
②若实验***用去na2s2o3标准溶液40.00ml,则所得产品中的重铬酸钾的纯度为:______(设k2cr2o7的摩尔质量为294g•mol-1,整个过程中其它杂质不参与反应). zhangjy1年前1
zhangjy1年前1 -
 vvtvv 共回答了28个问题
vvtvv 共回答了28个问题 |采纳率92.9%解题思路:(1)Al2O3与纯碱反应转变为可溶性盐偏铝酸钠和二氧化碳;
(2)NaFeO2能强烈水解,生成氢氧化铁和氢氧化钠;
(3)硅酸钠和偏铝酸钠易发生水解,根据水解平衡移动原理来回答;
(4)在酸性环境下,CrO42-转化为Cr2O72-,据此来书写方程式;
(5)根据反应:I2+2S2O32-=2I-+S4O62-,碘单质遇到淀粉时,溶液的蓝色消失,据此来回答并计算纯度.(1)Al2O3与纯碱反应转变为可溶性盐,生成NaAlO2,反应的化学方程式为Al2O3+Na2CO3
△
.
2NaAlO2+CO2↑,故答案为:Al2O3+Na2CO3
△
.
2NaAlO2+CO2↑;
(2)NaFeO2能强烈水解,为强碱弱酸液,水解呈碱性,生成氢氧化铁沉淀,反应的离子方程式为FeO2-+2H2O=Fe(OH)3↓+OH-,故答案为:FeO2-+2H2O=Fe(OH)3↓+OH-;
(3)由于硅酸钠和偏铝酸钠在溶液中发生水解,SiO32-+H2O⇌HSiO3-+OH-、HSiO3-+H2O⇌H2SiO3+OH-、AlO2-+2H2O⇌Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀,
故答案为:由于硅酸钠和偏铝酸钠发生水SiO32-+2H2O⇌H2SiO3+2OH-(或SiO32-+H2O⇌HSiO3-+OH-,HSiO3-+H2O⇌H2SiO3+OH-,AlO2-+H2O⇌Al(OH)3+OH-),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全;
(4)在酸性环境下,CrO42-转化为Cr2O72-,即2CrO42-+2H+⇌Cr2O72-+H2O,故答案为:2CrO42-+2H+⇌Cr2O72-+H2O;
(5)①根据反应:I2+2S2O32-=2I-+S4O62-,当滴加最后一滴硫代硫酸钠溶液时,碘单质恰好完全反应,溶液蓝色褪去,达到滴定终点,
故答案为:当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不变色;
②由反应Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;I2+2S2O32-=2I-+S4O62-可得反应的关系式为Cr2O72-~3I2~6S2O32-,根据关系式计算.
Cr2O72-~3I2~6S2O32-
1mol 3mol 6mol
n 0.1200×40×10-3mol
则250ml含重铬酸钾的物质的量为n=
0.1200×40×10−3mol
6×10,则所得产品中重铬酸钾纯度为
0.1200×40×10−3×10×294
6×2.5000×100%=94.08%,
故答案为:94.08%.点评:
本题考点: 制备实验方案的设计;化学方程式的有关计算;盐类水解的应用.
考点点评: 本题考查学生有关盐的水解以及滴定实验等方面的综合知识,要求学生具有分析和解决问题的能力,难度较大.1年前查看全部
- 铬铁矿的主要成分可表示为FeO•Cr 2 O 3 ,还含有MgO、Al 2 O 3 、Fe 2 O 3 等杂质,以下是以
铬铁矿的主要成分可表示为FeO•Cr 2 O 3 ,还含有MgO、Al 2 O 3 、Fe 2 O 3 等杂质,以下是以铬铁矿为原料制备重铬酸钾(K 2 Cr 2 O 7 )的流程图: 
已知:
①4FeO•Cr 2 O 3 +8Na 2 CO 3 +7O 2
8Na 2 CrO 4 +2Fe 2 O 3 +8CO 2 ↑;750℃
②Na 2 CO 3 +Al 2 O 3
2NaAlO 2 +CO 2 ↑;750℃
③Cr 2 O 7 2- +H 2 O⇌2CrO 4 2- +2H +
根据题意回答下列问题:
(1)固体X中主要含有______(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用______(填写仪器或试剂名称).
(2)酸化步骤用醋酸调节溶液pH<5,其目的是______.
物质溶解度/(g/100g水)0°C40°C80°CKCl2840.151.3NaCl35.736.438K2Cr2O74.726.373Na2Cr2O7163215376
(3)操作Ⅲ有多步组成,获得K 2 Cr 2 O 7 晶体的操作依次是:加入KCl固体、蒸发浓缩、______、过滤、______、干燥.
(4)表格是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na 2 Cr 2 O 7 +2KCl→K 2 Cr 2 O 7 ↓+2NaCl.
该反应在溶液中能发生的理由是______.
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n g样品,加入过量______(填写试剂)、溶解、过滤、再______(填写试剂)、…灼烧、冷却、称量,得干燥固体m g.计算样品中氢氧化铝的质量分数为______(用含m、n的代数式表示).物质 溶解度/(g/100g水) 0°C 40°C 80°C KCl 28 40.1 51.3 NaCl 35.7 36.4 38 K 2 Cr 2 O 7 4.7 26.3 73 Na 2 Cr 2 O 7 163 215 376
(6)六价铬有毒,而Cr 3+ 相对安全.工业含铬(CrO 3 )废渣无害化处理的方法之一是干法解毒,用煤不完全燃烧生成的CO还原CrO 3 .在实验室中模拟这一过程的装置如下:
CO由甲酸脱水制得;实验结束时熄灭酒精灯的顺序是______. yzq75015331年前1
yzq75015331年前1 -
 bomber 共回答了18个问题
bomber 共回答了18个问题 |采纳率88.9%(1)铬铁矿的主要成分可表示为FeO•Cr 2 O 3 ,还含有MgO、Al 2 O 3 、Fe 2 O 3 等杂质,加入氧气和碳酸钠,发生反应为:
①4FeO•Cr 2 O 3 +8Na 2 CO 3 +7O 2
750℃
8Na 2 CrO 4 +2Fe 2 O 3 +8CO 2 ↑;
②Na 2 CO 3 +Al 2 O 3
750℃
2NaAlO 2 +CO 2 ↑;
③Cr 2 O 7 2- +H 2 O⇌2CrO 4 2- +2H + ,
操作Ⅰ是过滤得到固体X为Fe 2 O 3 、MgO;要检测酸化操作中溶液的pH是否等于4.5,普通pH试纸只能测定溶液pH到整数,是近似测定,准确测定需要用pH计或精确pH试纸,
故答案为:Fe 2 O 3 、MgO;pH计或精密pH试纸;
(2)酸化步骤用醋酸调节溶液pH<5,依据流程图中物质的转化和制备目的可知,结合反应平衡Cr 2 O 7 2- +H 2 O⇌2CrO 4 2- +2H + ,加入酸,氢离子浓度增大,平衡左移,作用是使CrO 4 2- 转化为Cr 2 O 7 2- ,故答案为:使CrO 4 2- 转化为Cr 2 O 7 2- ;
(3)操作Ⅲ有多步组成,获得K 2 Cr 2 O 7 晶体的操作依次是:加入KCl固体、蒸发浓缩,冷却结晶、过滤、洗涤、干燥得到晶体,
故答案为:冷却结晶,洗涤;
(4)依据图表物质的溶解度分析对比,操作Ⅲ发生反应的化学方程式是:Na 2 Cr 2 O 7 +2KCl=K 2 Cr 2 O 7 ↓+2NaCl;说明K 2 Cr 2 O 7 的溶解度比Na 2 Cr 2 O 7 小(或四种物质中K 2 Cr 2 O 7 的溶解度最小),
故答案为:K 2 Cr 2 O 7 的溶解度比Na 2 Cr 2 O 7 小(或四种物质中K 2 Cr 2 O 7 的溶解度最小);
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是先利用氢氧化铝的两性,用氢氧化钠溶液溶解氢氧化铝过滤得到滤液中同仁医院二氧化碳生成氢氧化铝沉淀,灼烧干燥得到氧化铝干燥固体m g,依据铝元素守恒计算,样品中氢氧化铝的质量分数=
mg
156g/mol ×2×78g/mol
ng ×100%=
26m
17n ,
故答案为:NaOH溶液;通入过量二氧化碳;
26m
17n ;
(6)CO由甲酸脱水制得,生成的一氧化碳是有毒气体,不能直接排放到空气中,最后需要点燃除去,Ⅲ装置中发生的反应是CO还原CrO 3 .需要冷却后再停止通一氧化碳气体,防止还原产物被氧化,所以熄灭酒精灯的顺序是先熄灭Ⅲ,在熄灭Ⅰ,最后熄灭Ⅳ,
故答案为:III、I、IV.1年前查看全部
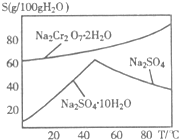
- 重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等.工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气
 重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等.工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O)的主要反应如下:
重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等.工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O)的主要反应如下:
①4FeO•Cr2O3+8Na2CO3+7O2
8Na2CrO4+2Fe2O3+8CO2高温 ..
②2Na2CrO4+H2SO4═Na2SO4+Na2Cr2O7+H2O
(1)反应①是在回转窑中进行,反应时需不断搅拌,其目的是______.
(2)右图是红矾钠(Na2Cr2O7•2H2O)和Na2SO4的溶解度曲线.从Na2Cr2O7和Na2SO4的混合溶液中提取Na2Cr2O7晶体的操作:先将混合溶液蒸发浓缩,趁热过滤.趁热过滤的目的是______;然后将滤液______,从而析出红矾钠.
(3)Na2Cr2O7与KCl或K2SO4进行复分解反应可制取K2Cr2O7,现用Na2Cr2O7与KCl来制备K2Cr2O7,简述操作步骤(有关物质的溶解度见右表):______.
(4)重铬酸钾可用于铁矿石中铁的含量测定,实验步骤如下:温度 0℃ 100℃ 溶解度 物质 K2Cr2O7 4.6g 94.1g KCl 28g 55g NaCl 35g 39g
步骤1:将mg铁矿石加浓盐酸加热溶解
步骤2:加入SnCl2溶液将Fe3+还原至黄色消失
步骤3:将所得溶液冷却,加入HgC2溶液,将过量的Sn2+氧化为Sn4+
步骤4:加入15mL硫酸和磷酸的混合酸及5滴O.2%二苯胺磺酸钠指示剂
步骤5:立即用cmol•L.重铬酸钾溶液滴定至溶液呈稳定紫色,即为终点,消耗重铬酸钾溶液VmL
①写出SnCl2还原Fe3+的离子方程式______.
②如省去步骤③,则所测定的铁的含量______(填“偏高”、“偏低”或“无影响”).
③步骤5使用的玻璃仪器有______. garmin1年前1
garmin1年前1 -
 hfhczs 共回答了19个问题
hfhczs 共回答了19个问题 |采纳率100%解题思路:(1)反应①是在回转窑中进行,反应时需不断搅拌,使反应物充分接触,加快反应速率;
(2)由图可知,温度高有利于硫酸钠结晶析出,可以防止Na2Cr2O7•2H2O结晶析出;
滤液的温度较高,从溶液中获得晶体需要冷却结晶;
(3)由溶解度可知,较高温下K2Cr2O7的溶解度大,氯化钠、氯化钾的溶解度较小,较低温度下,下K2Cr2O7的溶解度小,氯化钠、氯化钾的溶解度较大,K2Cr2O7的溶解度受温度影响大.应在较高温度下将Na2Cr2O7与KCl混合,再冷却结晶,可得K2Cr2O7;
(4)①SnCl2还原Fe3+生成亚铁离子,自身被氧化为Sn4+;
②重铬酸钾溶液能氧化Sn2+,使消耗的重铬酸钾溶液体积偏大,计算铁元素的质量偏高;
③步骤5的操作是滴定,酸性高锰酸钾具有强氧化性,应使用酸式滴定管,锥形瓶内盛放待测液.(1)反应①是在回转窑中进行,反应时需不断搅拌,使反应物充分接触,加快反应速率;
故答案为:使反应物充分接触,加快反应速率;
(2)由图可知,温度高有利于硫酸钠结晶析出,可以防止Na2Cr2O7•2H2O结晶析出;滤液的温度较高,从溶液中获得晶体需要冷却结晶,
故答案为:有利于硫酸钠结晶析出,可以防止Na2Cr2O7•2H2O结晶析出;冷却结晶;
(3)由溶解度可知,较高温下K2Cr2O7的溶解度大,氯化钠、氯化钾的溶解度较小,较低温度下,下K2Cr2O7的溶解度小,氯化钠、氯化钾的溶解度较大,K2Cr2O7的溶解度受温度影响大.应在较高温度下将Na2Cr2O7与KCl配成饱和溶液后混合,再降低温度到0℃冷却结晶,过滤洗涤,可得K2Cr2O7,
故答案为:较高温度下将Na2Cr2O7与KCl配成饱和溶液后混合,再降低温度到0℃冷却结晶,过滤洗涤,可得K2Cr2O7;
(4)①SnCl2还原Fe3+生成亚铁离子,自身被氧化为Sn4+,反应离子方程式为:2Fe3++Sn2+=Sn4++2Fe2+,
故答案为:2Fe3++Sn2+=Sn4++2Fe2+;
②重铬酸钾溶液能氧化Sn2+,使消耗的重铬酸钾溶液体积偏大,计算铁元素的质量偏高,所测定的铁的含量偏高,
故答案为:偏高;
③步骤5的操作是滴定,酸性高锰酸钾具有强氧化性,应使用酸式滴定管,锥形瓶内盛放待测液,
故答案为:酸式滴定管、锥形瓶.点评:
本题考点: 化学平衡的调控作用;探究物质的组成或测量物质的含量.
考点点评: 本题考查学生对数据及图象的分析、常用化学用语、氧化还原反应滴定等,难度中等,是对学生综合能力的考查,需要学生基本扎实的基础与运用知识分析解决问题的能力.1年前查看全部
- 一道工艺流程 调节PH问题重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO•Cr2
一道工艺流程 调节PH问题
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO•Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:6FeO•Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3 +7KCl+12H2O,
操作③的目的是
由于溶液在硅酸钠和偏铝酸钠发生水解,SiO32-+H2O HSiO3-+OH-,HSiO3-+H2O H2SiO3+OH-,AlO2-+H2O Al(OH)3+OH-,降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全.
为什么啊,调到PH为7 到8不是碱性吗 SiO32-AlO2-应该在酸性下沉淀的呀?
图片
 斑泪1年前1
斑泪1年前1 -
 yjxtd888 共回答了17个问题
yjxtd888 共回答了17个问题 |采纳率94.1%不同的东西有其不同的沉淀范围,其大小取决于Ksp(溶度积).
(Ksp)=(C(Am+) )^n ( C(Bn-))^m(这个参考百度百科)
也就是说例如Al(OH)3,或者说HALO2·H2O(氢氧化铝酸式写法)其中
c(H+)*c(AlO2-)得到的值大于溶度积就会生成沉淀
这里如果你c(AlO2-)很大的话,c(H+)小一点也无所谓.
事实上Al(OH)3沉淀的ph值一般在6~10
硅酸也是这样
平时说AlO2-等在酸性下沉淀也是定性的判断(即ph降低,c(H+)增加,离子乘积变大,容易沉淀)实际上可能并不是一定要到酸性才能沉淀
例如Fe(OH)3沉淀pH值很小就可以了(貌似是4)1年前查看全部
- 工业上以铬铁矿(主要成分为FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O),其主
工业上以铬铁矿(主要成分为FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O),其主要反应为(1)4(FeO•Cr2O3)+8Na2CO3+7O2
8Na2CrO4+2Fe2O3+8CO2(2)2Na2CrO4+H2SO4═Na2SO4+Na2Cr2O7+H2O下列说法正确的是( )高温 .
A.反应(1)和(2)均为氧化还原反应
B.反应(1)中FeO•Cr2O3既是氧化剂又是还原剂
C.高温下O2的氧化性大于Fe2O3小于Na2CrO4
D.生成1mol的Na2Cr2O7时转移7mol电子 人生坎坷生活所迫1年前1
人生坎坷生活所迫1年前1 -
 上下一致不求有功 共回答了21个问题
上下一致不求有功 共回答了21个问题 |采纳率90.5%解题思路:A.反应(2)中不存在元素的化合价变化;
B.反应(1)O2中O元素的化合价降低,Fe、Cr元素的化合价均升高;
C.根据氧化剂的氧化性大于氧化产物的氧化性判断;
D.根据反应方程式中元素化合价的变化分析.A.反应(2)中不存在元素的化合价变化,则不属于氧化还原反应,故A错误;
B.反应(1)O2中O元素的化合价降低,Fe、Cr元素的化合价均升高,所以氧化剂是O2,还原剂是FeO•Cr2O3,故B错误;
C.反应中O2作氧化剂,Fe2O3和Na2CrO4均为氧化产物,所以O2的氧化性大于Fe2O3和Na2CrO4,故C错误;
D.已知(1)4(FeO•Cr2O3 )+8Na2CO3+7O2
高温
.
8Na2CrO4+2Fe2O3+8CO2(2)2Na2CrO4+H2SO4═Na2SO4+Na2Cr2O7+H2O,则7O2~28e-~8Na2CrO4~4Na2Cr2O7,则生成1mol的Na2Cr2O7时转移7mol电子,故D正确;
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重电子的转移、氧化剂和还原剂的判断的考查,注意从化合价角度分析,难度不大.1年前查看全部
- 工业上用铬铁矿(主要成分FeO•Cr 2 O 3 ,杂质为SiO 2 、Al 2 O 3 等)生产重铬酸钾(化学式K 2
工业上用铬铁矿(主要成分FeO•Cr 2 O 3 ,杂质为SiO 2 、Al 2 O 3 等)生产重铬酸钾(化学式K 2 Cr 2 O,)的流程如下: 
(1)固体A中,除Na 2 CrO 4 、NaFeO 2 、NaOH外还有______等;
(2)固体A水浸时,NaFeO 2 会发生强烈水解产生固体B,其化学反应方程式为______;
(3)固体C中含有2种物质,要先加入下列物质中的______,然后才能进行过滤分离.
A.氢氧化钠溶液B.稀氨水C.稀盐酸
(4)步骤④加入盐酸得到的溶液F中,除Na 2 Cr 2 O 7 外,还含有的溶质是______;
(5)在上述流程中,有氧化还原反应发生的是第______步.
(6)已知20℃时K 2 Cr 2 O 7 饱和溶液浓度为0.4mol•L -1 ,步骤⑤中加入固体氯化钾,若使K + 离子浓度达到4mol•L -1 (保持温度20℃),则溶液F中Cr 2 O 2- 7 离子的浓度最大为______. 达20011年前1
达20011年前1 -
 民曰 共回答了16个问题
民曰 共回答了16个问题 |采纳率93.8%(1)由题目信息可知,铬铁矿的主要成分FeO•Cr 2 O 3 ,含有SiO 2 、Al 2 O 3 等杂质,SiO 2 与NaOH发生反应生成Na 2 SiO 3 ,Al 2 O 3 与NaOH发生反应,生成NaAlO 2 ,故还含有Na 2 SiO 3 、NaAlO 2 ,
故答案为:Na 2 SiO 3 、NaAlO 2 ;
(2)NaFeO 2 水解生成氢氧化钠与氢氧化铁,反应方程式为NaFeO 2 +2H 2 O═NaOH+Fe(OH) 3 ,故答案为:NaFeO 2 +2H 2 O═NaOH+Fe(OH) 3 ;
(3)由工艺流程可知,固体C中含有氢氧化铝与硅酸,氢氧化铝溶液强酸强碱,硅酸溶于强碱、不能与酸(HF除外)反应,故应加入盐酸,将氢氧化铝转化为偏铝酸钠,再过滤分离,
故选:C;
(4)由工艺流程可知,Na 2 CrO 4 在酸性条件下转化为Na 2 Cr 2 O 7 ,根据元素守恒还有氯化钠生成,故答案为:NaCl;
(5)由工艺流程可知,第①步反应中,铁元素、铬元素、氧元素化合价反应变化,属于氧化还原反应,其它各步反应中元素的化合价未变化,不属于氧化还原反应,
故答案为:①;
(6)20℃时K 2 Cr 2 O 7 饱和溶液浓度为0.4mol•L -1 ,该温度下c 2 (K + )•c(Cr 2 O 2- 7 )=0.8 2 •0.4=0.256,所以使K + 离子浓度达到4mol•L -1 (保持温度20℃),溶液F中Cr 2 O 2- 7 离子的浓度最大为
0.256
4 2 mol/L=0.016mol/L,故答案为:0.016mol/L.1年前查看全部
- 工业上用铬铁矿(主要成分FeO•Cr2O3,杂质为SiO2、Al2O3等)生产重铬酸钾(化学式K2Cr2O,)的流程如下
工业上用铬铁矿(主要成分FeO•Cr2O3,杂质为SiO2、Al2O3等)生产重铬酸钾(化学式K2Cr2O,)的流程如下:

(1)固体A中,除Na2CrO4、NaFeO2、NaOH外还有______等;
(2)固体A水浸时,NaFeO2会发生强烈水解产生固体B,其化学反应方程式为______;
(3)固体C中含有2种物质,要先加入下列物质中的______,然后才能进行过滤分离.
A.氢氧化钠溶液B.稀氨水C.稀盐酸
(4)步骤④加入盐酸得到的溶液F中,除Na2Cr2O7外,还含有的溶质是______;
(5)在上述流程中,有氧化还原反应发生的是第______步.
(6)已知20℃时K2Cr2O7饱和溶液浓度为0.4mol•L-1,步骤⑤中加入固体氯化钾,若使K+离子浓度达到4mol•L-1(保持温度20℃),则溶液F中Cr2O2-7离子的浓度最大为______. 你是我的左心房1年前1
你是我的左心房1年前1 -
 水沙往事 共回答了21个问题
水沙往事 共回答了21个问题 |采纳率81%解题思路:(1)由题目信息可知,铬铁矿的主要成分FeO•Cr2O3,含有SiO2、Al2O3等杂质,SiO2、Al2O3与NaOH发生反应;
(2)NaFeO2会发生强烈水解,生成固体B,可推知NaFeO2水解生成氢氧化钠与氢氧化铁;
(3)由工艺流程可知,固体C中含有氢氧化铝与硅酸,氢氧化铝溶液强酸强碱,硅酸溶于强碱、不能与酸(HF除外)反应,据此判断;
(4)由工艺流程可知,Na2CrO4在酸性条件下转化为Na2Cr2O7,根据元素守恒还有氯化钠生成;
(5)元素化合价在反应前后发生变化的反应属于氧化还原反应;
(6)一定温度下,溶液中c2(K+)•c(Cr2O2-7)为定值,根据20℃时K2Cr2O7饱和溶液浓度为0.4mol•L-1,计算c2(K+)•c(Cr2O2-7)的值,据此计算.(1)由题目信息可知,铬铁矿的主要成分FeO•Cr2O3,含有SiO2、Al2O3等杂质,SiO2与NaOH发生反应生成Na2SiO3,Al2O3与NaOH发生反应,生成NaAlO2,故还含有Na2SiO3、NaAlO2,
故答案为:Na2SiO3、NaAlO2;
(2)NaFeO2水解生成氢氧化钠与氢氧化铁,反应方程式为NaFeO2+2H2O═NaOH+Fe(OH)3,故答案为:NaFeO2+2H2O═NaOH+Fe(OH)3;
(3)由工艺流程可知,固体C中含有氢氧化铝与硅酸,氢氧化铝溶液强酸强碱,硅酸溶于强碱、不能与酸(HF除外)反应,故应加入盐酸,将氢氧化铝转化为偏铝酸钠,再过滤分离,
故选:C;
(4)由工艺流程可知,Na2CrO4在酸性条件下转化为Na2Cr2O7,根据元素守恒还有氯化钠生成,故答案为:NaCl;
(5)由工艺流程可知,第①步反应中,铁元素、铬元素、氧元素化合价反应变化,属于氧化还原反应,其它各步反应中元素的化合价未变化,不属于氧化还原反应,
故答案为:①;
(6)20℃时K2Cr2O7饱和溶液浓度为0.4mol•L-1,该温度下c2(K+)•c(Cr2O2-7)=0.82•0.4=0.256,所以使K+离子浓度达到4mol•L-1(保持温度20℃),溶液F中Cr2O2-7离子的浓度最大为
0.256
42mol/L=0.016mol/L,故答案为:0.016mol/L.点评:
本题考点: 制备实验方案的设计;常见金属元素的单质及其化合物的综合应用.
考点点评: 本题考查学生对工艺流程的理解、阅读题目获取信息能力、物质推断、化学用语、化学计算、氧化还原反应等,综合性较大,难度中等,需要学生具备扎实的基础知识与综合运用知识、信息进行解决问题的能力.1年前查看全部
- 铬铁矿的主要成分可表示为FeO·Cr 2 O 3 ,还含有MgO、Al 2 O 3 、Fe 2 O 3 等杂质,以下是以
铬铁矿的主要成分可表示为FeO·Cr 2 O 3 ,还含有MgO、Al 2 O 3 、Fe 2 O 3 等杂质,以下是以铬铁矿为原料制备重铬酸钾(K 2 Cr 2 O 7 )的流程图:

已知:①4FeO·Cr 2 O 3 + 8Na 2 CO 3 + 7O 2 8Na 2 CrO 4 + 2 Fe 2 O 3 + 8CO 2 ↑;
8Na 2 CrO 4 + 2 Fe 2 O 3 + 8CO 2 ↑;
②Na 2 CO 3 + Al 2 O 3 2NaAlO 2 + CO 2 ↑;③ Cr 2 O 7 2 - + H 2 O
2NaAlO 2 + CO 2 ↑;③ Cr 2 O 7 2 - + H 2 O 2CrO 4 2 - + 2H +
2CrO 4 2 - + 2H +
(1)固体X中主要含有_________(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用__________(填写仪器或试剂名称)。
(2)酸化步骤用醋酸调节溶液pH<5,其目的是_________________________________。物质 溶解度/(g/100g水) 0°C 40°C 80°C KCl 28 40.1 51.3 NaCl 35.7 36.4 38 K 2 Cr 2 O 7 4.7 26.3 73 Na 2 Cr 2 O 7 163 215 376
(3)操作Ⅲ有多步组成,获得K 2 Cr 2 O 7 晶体的操作依次是:加入KCl固体、蒸发浓缩、 、
过滤、_______、干燥。
(4)右表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na 2 Cr 2 O 7 +2KCl→K 2 Cr 2 O 7 ↓+2NaCl。该反应在溶液中能发生的理由是_______________。
(5)酸性溶液中过氧化氢能使Cr 2 O 7 2- 生成蓝色的过氧化铬(CrO 5 分子结构为 ), 该反应可用来检验Cr 2 O 7 2- 的存在。写出反应的离子方程式: 。
), 该反应可用来检验Cr 2 O 7 2- 的存在。写出反应的离子方程式: 。
该反应 (填“属于”或“不属于”)氧化还原反应。
(6)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL与碘量瓶中,加入10mL2mol/ L H 2 SO 4 和足量碘化钾(铬的还原产物为Cr 3+ ),放于暗处5min。然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa 2 S 2 O 3 标准溶液滴定(I 2 +2S 2 O 3 2— =2I - +S 4 O 6 2— )。
①判断达到滴定终点的依据是 &n赞
saharawind 春芽
共回答了18个问题采纳率:88.9% 举报
(16分)(1)Fe 2 O 3 、MgO(2分,有错即为0分,少一个扣1分);pH计或精密pH试纸。(1分,
答pH试纸或广泛pH试纸不给分)
(2)使C1年前
10可能相似的问题你能帮帮他们吗
Copyright © 2022 YULUCN.COM - 雨露学习互助 - 17 q. 0.062 s. - webmaster@yulucn.com 到海的那一边1年前1
到海的那一边1年前1 -
 saharawind 共回答了18个问题
saharawind 共回答了18个问题 |采纳率88.9%(16分)(1)Fe 2 O 3 、MgO(2分,有错即为0分,少一个扣1分);pH计或精密pH试纸。(1分,
答pH试纸或广泛pH试纸不给分)
(2)使C1年前查看全部
- (2014•湛江模拟)铬铁矿的主要成分可表示为FeO•Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,如图所示是
(2014•湛江模拟)铬铁矿的主要成分可表示为FeO•Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,如图所示是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺流程.

已知1:物质的溶解度(g/100g水)
已知2:
①焙烧时有Na2CrO4、Fe2O3、NaAlO2 等生成.物质 0℃ 40℃ 80℃ KCl 28.0 40.1 51.3 NaCl 35.7 36.4 38.0 K2Cr2O7 4.7 26.3 73.0 Na2Cr2O7 163.0 215.0 376.0
②Cr2O72-+H2O⇌2CrO42-+2H+;Cr2O72-具有很强的氧化性
回答问题:
(1)“浸出”步骤中,为了提高浸出率,可采取的措施有______(要求写一条).
(2)固体b中主要含有______(填写化学式).
(3)要检测酸化操作中溶液的pH是否等于4.5,应该使用______(填写仪器或用品名称).
(4)酸化步骤用醋酸调节溶液的pH<5,其目的是______;不用盐酸调节溶液pH的原因是______.
(5)操作Ⅲ发生反应的化学方程式是______,要得到K2Cr2O7 晶体的操作步骤是蒸发浓缩、冷却结晶、______、______和干燥. Ybullet1年前1
Ybullet1年前1 -
 沙舞天堂 共回答了17个问题
沙舞天堂 共回答了17个问题 |采纳率100%解题思路:(1)铬铁矿通过焙烧,生成Na2CrO4、Fe2O3、MgO和NaAlO2的混合体系,然后加水溶解得固体Fe2O3、MgO和溶液Na2CrO4、NaAlO2,再调节溶液的PH,使偏铝酸盐完全沉淀,继续调节溶液的PH使CrO42-转化为Cr2O72-,最后向所得溶液中加入氯化钾,生成溶解度极小的K2Cr2O7,
(2)依据流程图和题干反应分析判断固体a和b的成分;
(3)通常PH试纸只能测定溶液PH的整数,测定PH是小数的需要用精确试纸或pH计;
(4)结合流程图和反应过程中得到物质分析,酸化步骤用醋酸调节溶液pH<5为了转化CrO42-离子为Cr2O72-;
(5)发生反应的化学方程式是利用溶解度不同析出K2Cr2O7,溶液中得到溶质晶体的方法是蒸发浓缩,冷却结晶,过滤洗涤步骤分析回答;铬铁矿的主要成分可表示为FeO•Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,加入氧气和碳酸钠,发生反应为:
①4FeO•Cr2O3+8Na2CO3+7O2
高温
.
8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3
高温
.
2NaAlO2+CO2↑;
③Cr2CO72-+H2O⇌2CrO42-+2H+
(1)浸出”步骤中,为了提高浸出率,可采取的措施有加热,搅拌,研磨等加快反应速率;
故答案为:加热;或研磨;或搅拌;
(2)操作Ⅰ是过滤得到固体a为Fe2O3、MgO,操作Ⅱ是调节溶液的PH,使偏铝酸盐完全沉淀生成氢氧化铝,b为Al(OH)3;
故答案为:Al(OH)3;
(3)要检测酸化操作中溶液的pH是否等于4.5,普通pH试纸只能测定溶液pH到整数,是近似测定,准确测定需要用pH计或精确pH试纸,
故答案为:pH计或精密pH试纸;
(4)酸化步骤用醋酸调节溶液pH<5,依据流程图中物质的转化和制备目的可知,结合反应平衡Cr2O72-+H2O⇌2CrO42-+2H+,加入酸,氢离子浓度增大,平衡左移,作用是使CrO42-转化为Cr2O72-,不用盐酸调节溶液pH的原因是重铬酸钾具有强氧化性能氧化氯离子为氯气;
故答案为:使CrO42-转化为Cr2O72-;Cr2O72-会把盐酸(或氯离子)氧化为氯气;
(5)操作Ⅲ有多步组成,发生反应的化学方程式是Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩,冷却结晶、过滤、洗涤、干燥得到晶体;
故答案为:Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl,过滤,洗涤;点评:
本题考点: 常见金属元素的单质及其化合物的综合应用;制备实验方案的设计.
考点点评: 本题考查了物质制备流程和方案的分析判断,物质性质的应用,题干信息的分析理解,操作步骤的注意问题和基本操作方法是解题关键,题目难度中等.1年前查看全部
- (2012•资阳二模)重铬酸钾(K2Cr2O7)是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO•Cr
(2012•资阳二模)重铬酸钾(k2cr2o7)是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为feo•cr2o3)为原料生产重铬酸钾.实验室模拟工业法用铬铁矿制k2cr2o7的主要工艺如图所示.反应器中涉及的主要反应是:
6feo•cr2o3+24naoh+7kclo3
12na2cro4+3fe2o3+7kcl+12h2o△ .
试回答下列问题:
(1)在反应器①中,有na2cro4生成,同时fe2o3转变为nafeo2,杂质sio2、al2o3与纯碱反应的原理相同均转变为可溶性盐.写出氧化铝与碳酸钠反应的化学方程式:______.
(2)操作⑤中加酸酸化后cro42-转化为cr2o72-,写出转化的离子方程式:______.
(3)步骤③中测定ph值的操作为:______.
(4)某同学设计的检验上述工艺流程④的滤渣中fe、al、si元素成分的探究实验如下,请帮助完成该实验,并填写表中空格:
(5)称取重铬酸钾(其式量为294)试样2.5000g配成250ml溶液,用移液管取出25.00ml于碘量瓶中,加入10ml 2mol/l h2so4和足量碘化钾(铬的还原产物为cr3+),放置于暗处5min,然后加入100ml水,加入3ml淀粉指示剂,用0.1200mol/l na2s2o3标准溶液滴定(i2+2s2o32-=2i-+s4o62-).操作步骤 实验现象 结论 ①取滤渣样少量于试管中,加足量稀hcl,搅拌,静置. 试管中仍有固体物质 固体为______ ②操作①后,过滤;在滤液中加入过量的______. 有红褐色沉淀产生 沉淀为fe(oh)3 ③将操作②后的红褐色沉淀滤去,在滤液中通入足量co2. ______ 生成物为al(oh)3
①配制溶液时所需的玻璃仪器除烧杯、玻璃棒外,还需______和______.
②若实验***用去na2s2o3标准溶液40.00ml,则所得产品中重铬酸钾的纯度为(设整个过程中其他杂质不参与反应)______.(保留2位小数) Alex-s1年前1
Alex-s1年前1 -
 dww446 共回答了17个问题
dww446 共回答了17个问题 |采纳率88.2%解题思路:(1)依据杂质SiO2、Al2O3与纯碱反应的原理相同均转变为可溶性盐写出化学方程式;
(2)酸化后CrO42-转化为Cr2O72-,依据原子守恒和电荷守恒写出离子方程式;
(3)依据PH试纸的使用方法分析回答;
(4)过量的酸溶液中反应生成沉淀说明是硅酸沉淀;加入过量氢氧化钠溶液反应生成红褐色沉淀氢氧化铁;偏铝酸盐通入过量二氧化碳反应生成白色沉淀为氢氧化铝;
(5)①依据溶液配制的步骤分析需要的玻璃仪器;
②根据反应:I2+2S2O32-=2I-+S4O62-,碘单质遇到淀粉时,溶液的蓝色消失,据此来回答并计算纯度.依据反应过程的离子方程式的定量关系计算,注意溶液体积变化;(1)杂质SiO2、Al2O3与纯碱反应的原理相同均转变为可溶性盐,氧化硅和碳酸钠加热反应生成硅酸钠和二氧化碳,所以氧化铝和碳酸钠反应的化学方程式为:Al2O3+Na2CO3=2NaAlO2+CO2↑;
故答案为:Al2O3+Na2CO3=2NaAlO2+CO2↑;
(2)操作⑤中加酸酸化后CrO42-转化为Cr2O72-,转化的离子方程式为:2CrO42-+2H+=Cr2O72-+H2O;
故答案为:2CrO42-+2H+=Cr2O72-+H2O;
(3)PH试纸的实验方法是取一段pH试纸置于表面皿上,用玻璃棒蘸取待测液点在试纸的中部,变色后再将试纸与标准比色卡进行比较,
故答案为:取一段pH试纸置于表面皿上,用玻璃棒蘸取待测液点在试纸的中部,再将试纸与标准比色卡进行比较;
(4)检验上述工艺流程④的滤渣中Fe、Al、Si元素成分的探究实验过程是利用过量盐酸反应能生成沉淀的是硅酸根离子,生成沉淀硅酸,剩余溶液中加入过量氢氧化钠溶液出现红褐色沉淀氢氧化铁,铝离子生成偏铝酸钠,在滤液中通入过量二氧化碳反应生成白色沉淀氢氧化铝;
故答案为:
硅酸(或H2SiO3)
NaOH溶液(或其它强碱溶液)
白色胶状沉淀生成 (4)①配制溶液时,在烧杯中溶解物质后,盐玻璃棒转移溶液到250ml容量瓶中,最后用胶头滴管定容,所以所需的玻璃仪器除烧杯、玻璃棒外,还需250 mL容量瓶,胶头滴管;
故答案为:250 mL容量瓶,胶头滴管;
②根据反应:I2+2S2O32-=2I-+S4O62-,当滴加最后一滴硫代硫酸钠溶液时,碘单质恰好完全反应,溶液蓝色褪去,达到滴定终点,由反应Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;I2+2S2O32-=2I-+S4O62-可得反应的关系式为Cr2O72-~3I2~6S2O32-,根据关系式计算.
Cr2O72-~3I2~6S2O32-
1mol 6mol
n 0.1200×40×10-3mol
则250ml含重铬酸钾的物质的量为n=
0.1200×40×10−3mol
6×10,则所得产品中重铬酸钾纯度为
0.1200×40×10−3×10×294
6×2.5000×100%=94.08%;
故答案为:94.08%;点评:
本题考点: 探究物质的组成或测量物质的含量;镁、铝的重要化合物;铁的氧化物和氢氧化物.
考点点评: 本题考查物质性质和组成的实验分析应用,有关盐的水解以及滴定实验等方面的综合知识,要求学生具有分析和解决问题的能力,难度较大.1年前查看全部
- 工业上以铬铁矿(主要成分为FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O),其主
工业上以铬铁矿(主要成分为FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O),其主要反应为:
(1)4FeO•Cr2O3+8Na2CO3+7O2
8Na2CrO4+2Fe2O3+8CO2高温 .
(2)2Na2CrO4+H2SO4⇌Na2SO4+Na2Cr2O7+H2O
下列说法正确的是( )
A. 反应(1)和(2)均为氧化还原反应
B. 反应(1)的氧化剂是O2,还原剂是FeO•Cr2O3
C. Na2CrO4中Cr元素的化合价为+7
D. 反应(2)中生成1mol的Na2Cr2O7时共转移7mol电子 孤单的优秀1年前1
孤单的优秀1年前1 -
 ben3sha 共回答了19个问题
ben3sha 共回答了19个问题 |采纳率94.7%解题思路:A.反应(2)中不存在元素的化合价变化;
B.反应(1)中O元素的化合价降低,Fe、Cr元素的化合价均升高;
C.化合物中正负化合价的代数和为0;
D.反应(2)为非氧化还原反应.A.反应(2)中不存在元素的化合价变化,则不属于氧化还原反应,故A错误;B.反应(1)中O元素的化合价降低,Fe、Cr元素的化合价均升高,所以氧化剂是O2,还原剂是FeO•Cr2O3,故B正确;C.化合物中正负化合价的代数...
点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重电子的转移、氧化剂和还原剂的判断的考查,注意从化合价角度分析,难度不大.1年前查看全部
- 资源种类:(1)矿产资源:______、______、铬铁矿、______等储量和产量都居世界前列.(2)植物资源:桃花
资源种类:
(1)矿产资源:______、______、铬铁矿、______等储量和产量都居世界前列.
(2)植物资源:桃花心木、______、______都是热带雨林地区的名贵树种.
(3)动物资源:非洲大型______均居世界各洲之冠. tt3151年前1
tt3151年前1 -
 CAI涛 共回答了20个问题
CAI涛 共回答了20个问题 |采纳率90%解题思路:非洲位于东半球的西部,地跨赤道南北.它东濒印度洋,西临大西洋,北隔地中海及直布罗陀海峡与欧洲相望,东北与亚洲之间隔着狭长的红海,并以苏伊士运河为陆上分界.非洲是世界古人类和古文明的发祥地之一,拥有悠久的历史和灿烂的文化.非洲地域辽阔,物产丰富多样,被誉为“富饶大陆”.非洲矿产资源种类多,储量大.金刚石、黄金、铬铁矿、磷酸盐等的储量和产量都居世界前列.非洲的动植物资源也极为丰富,桃花心木、檀木、花梨木等都是热带雨林地区的名贵树种.非洲还是咖啡、枣椰和油棕等作物的原产地.非洲大型野生动物的种类和数量均居世界各洲之冠.
故答案为:(1)金刚石;黄金;磷酸盐;(2)檀木;花梨木;(3)野生动物.点评:
本题考点: 非洲热带草原气候和热带雨林气候的特征;非洲主要农矿产品的分布及出口.
考点点评: 考查非洲富饶的资源,要牢记.1年前查看全部
- 工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7)的主要反应为:
工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7)的主要反应为:
①4FeO•Cr2O3+8Na2CO3+7O2
8Na2CrO4+2□+8CO2高温 .
②2Na2CrO4+H2SO4=Na2SO4+Na2Cr2O7+H2O
下列说法正确的是( )
A.反应①和②均为氧化还原反应
B.反应①中的氧化剂是O2,还原剂是FeO•Cr2O3
C.□内的物质是Fe3O4
D.生成1 mol Na2Cr2O7,时共转移6 mol电子 亲爱的ミ1年前1
亲爱的ミ1年前1 -
 yyuu852 共回答了11个问题
yyuu852 共回答了11个问题 |采纳率72.7%解题思路:A.有电子转移的化学反应是氧化还原反应,其特征是有元素化合价的升降;
B.得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂;
C.根据元素守恒及原子守恒判断;
D.根据Na2Cr2O7和转移电子之间的关系式计算.A.在反应前后,②中各元素的化合价都不变化,所以不是氧化还原反应,故A错误;
B.反应①氧气得电子化合价降低,所以氧气是氧化剂,FeO•Cr2O3中铁和铬元素化合价都升高,所以FeO•Cr2O3是还原剂,故B正确;
C.根据原子守恒知,□内的物质是Fe2O3,故C错误;
D.反应②中生成1molNa2Cr2O7需要2molNa2CrO4,由反应①可知,参加反应FeO•Cr2O3为1mol,反应中Fe元素化合价由+2价升高为+3价,Cr由+3升高为+6,故生成1molNa2Cr2O7共转移电子的物质的量为1mol×[1+(6-3)]=7mol,故D错误;
故选B.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应基本概念与计算等,难度中等,注意根据化合价理解氧化还原反应.1年前查看全部
大家在问
- 1101的2次方-202乘以99+99的2次方,因式分解
- 2如图所示,是“探究发电机的工作原理”的实验装置.探究中有同学们提出了问题:“感应电流的大小会跟哪些因素有关呢?”
- 3be busy with和 work on有什么区别?用法都是什么,
- 4形容办法很多的成语
- 5一个圆形跑道的周长为1200米,甲乙两人同时从同一地点沿圆周按相反方向出发,4分钟后相遇,若两人按同一方向行走,半小时后
- 6甲乙两人分别从ab两地同时出发相向而行,若他们同时出发,则24分钟后相遇,若乙比甲提前10分钟出发,则甲出发
- 7今年上初一,挺喜欢学数学,成绩也不烂.上学期数学老师对我也还可以,昨天作业写错了,他就说我 你
- 8梯形的平行投影为什么不是梯形?.原题是:梯形的平行投影一定是梯形。(判断题)答案:错
- 9about、able、above、等什么词性
- 10What class ____ you in?A.are B.am C.is
- 11从2开始,连续的偶数相加,它们和的情况如下表:
- 12比较大小log2 5和log5 8
- 13求曲线X^3+Y^3-XY=1(X>=0,Y>=0)上点到原点的最长和最短距离
- 14七年级期末测试题,在设x的时候,需不需要加°这个单位,还有,在列式的时候,像180°或45°,需不需要加°,还是要去掉.
- 1529乘30分之7 怎么简算




