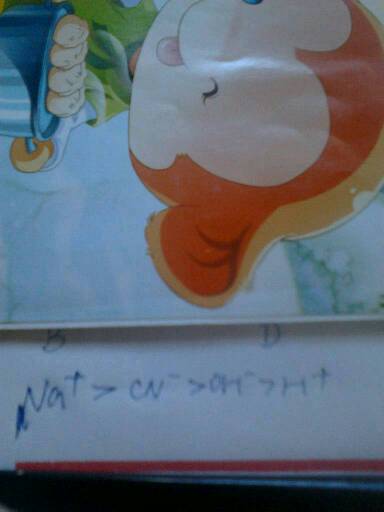浓度公式
 西门俊2022-10-04 11:39:541条回答
西门俊2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 香水有毒_1 共回答了19个问题
香水有毒_1 共回答了19个问题 |采纳率84.2%- 浓度=(溶质/溶液)*100%;溶液=溶质+溶剂,溶质就是像糖,盐之类的东西,溶剂就是水啊,酒精之类的
- 1年前
相关推荐
- 高中化学电离平衡粒子浓度大小比较问题
高中化学电离平衡粒子浓度大小比较问题
含等物质的量的碳酸钠和碳酸氢钠混合溶液中离子浓度大小顺序
求老师在给出答案之后教我一下步骤
 candyfish1年前3
candyfish1年前3 -
 盛夏骄阳 共回答了18个问题
盛夏骄阳 共回答了18个问题 |采纳率83.3%c(Na+)>c(HCO3-)>C(CO32-)>C(OH-)>C(H+)1年前查看全部
- (NH4)2CO3溶液离子浓度排序
(NH4)2CO3溶液离子浓度排序
为什么HCO3-比OH-少?
水解产生的部分OH-应该被NH4+中和了吧?那不一定OH-多吧?
那这两者怎么比较?求助= = woshicaicai1年前1
woshicaicai1年前1 -
 不系舟-岩岩 共回答了22个问题
不系舟-岩岩 共回答了22个问题 |采纳率90.9%主要逻辑,按主次排序:
主要就是(NH4)2CO3=2NH4+ + CO32-
可见,溶液中的主要离子就是NH4+ 和 CO32-,其中,NH4+浓度大于 CO32-浓度.
次要是NH4+和CO32-水解,前者产生H+,后者产生OH-,怎样判断二者的强弱呢?
其中,氨水和醋酸的电离程度是相同的,而醋酸强于碳酸,碳酸又强于碳酸氢根,故铵根的水解弱于碳酸根的水解.
注意,次要是NH4+和CO32-水解,不要考虑什么“水解产生的部分OH-应该被NH4+中和”1年前查看全部
- 酒精浓度75怎么配制
 wc5236987411年前4
wc5236987411年前4 -
 ww小鬼 共回答了20个问题
ww小鬼 共回答了20个问题 |采纳率85%设m酒精=x,m水=y,m溶液=m水+m酒精;
因为 A%=75%,且由A%=m质/m液;
所以 x/x+y=A%
x/x+y=75%
x+y/x=4/3
y/x+1=4/3
y/x=1/3;
既1份水和3份酒精;
答:——.1年前查看全部
- 单位污水排放 氨氮浓度41.45mg/L.超标16.45mg/L.如何整改?
单位污水排放 氨氮浓度41.45mg/L.超标16.45mg/L.如何整改?
单位较小 在工业开发区 没什么化学制剂,就是生活用水.但是上个月环境监测中心来提取水样 说是超标了.很困惑 我们没什么污染源 怎么氨氮就超标了?单位有个化粪池的 求教怎么来整改措施?比较简单实用的! wsyzyj1年前1
wsyzyj1年前1 -
 jayzhang800419 共回答了19个问题
jayzhang800419 共回答了19个问题 |采纳率84.2%最简单的办法 用其他的废水来稀释 尽量用其他废水 用自来水 太不节水 也不道德
产生的原因应该是化粪池做的有点小 化粪池处理不够 正确的处理方法 加大 化粪池容积 或者再建一个
我个人感觉 检测中心的也是来扯淡了 一般生活污水经化粪池处理后既可以排入到城市污水管网1年前查看全部
- 解释离子浓度
 猛弹你JJ1年前6
猛弹你JJ1年前6 -
 梦幻BB 共回答了13个问题
梦幻BB 共回答了13个问题 |采纳率100%离子是指原子由于自身或外界的作用而失去或得到一个或几个电子使其达到最外层电子数为8个或2个的稳定结构.这一过程称为电离.电离过程所需或放出的能量称为电离能.与分子、原子一样,离子也是构成物质的基本粒子.1年前查看全部
- 质量-体积浓度如何计算
 幽情王子1年前3
幽情王子1年前3 -
 网亦有道 共回答了16个问题
网亦有道 共回答了16个问题 |采纳率93.8%按字面意思啦!
质量-体积浓度=溶质质量/溶液体积1年前查看全部
- 测定K2SO4溶液浓度加入BACL2溶液
测定K2SO4溶液浓度加入BACL2溶液
反映后得到干燥BaSO4沉淀1.165g,求该溶液浓度
请给出该反应完整方程式,以及完整答案 jcy81年前1
jcy81年前1 -
 cookie600 共回答了15个问题
cookie600 共回答了15个问题 |采纳率100%没有体积或溶液的质量
K2SO4+BaCl2===BaSO4!+2KCl1年前查看全部
- 氨水当量浓度15 密度0.9 如何换算百分浓度?
 joke011年前1
joke011年前1 -
 cnhc 共回答了23个问题
cnhc 共回答了23个问题 |采纳率87%15×17÷900×100%=28.3%1年前查看全部
- 测试甲醛浓度0.33mg
 Kayvv1年前4
Kayvv1年前4 -
 jojo759100 共回答了13个问题
jojo759100 共回答了13个问题 |采纳率92.3%新居宝椰壳活性炭以高吸附性能的椰壳为载体,经特殊造孔工艺和改性处理,拥有丰富的孔隙结构和广大的比表面积,对室内空气中的甲醛、苯、TVOC等有害气体拥有较强的吸附、净化之功能,广泛用于新装修居家、宾馆、空调间、卫生间、娱乐场所、新家具、汽车等需要除臭、去毒、净化空气的任何场所.
◎主要用途
1、新居室:用于吸附新居室内空气中以及持续释放到空气中的甲醛、苯系物、氨气及氡等有毒有害气体,快速清除装修异味.
2、新家俱:用于吸附新家俱持续释放的甲醛、苯系物、及各种异味.
3、衣橱、书柜、鞋柜:祛味、解毒、除湿、防虫、除臭、杀菌、保存字画等.
4、卫 生 间:除臭杀菌、清新空气.
5、地 板:祛味、防潮、防霉、防虫蛀,保护地板不变形.
6、汽 车:吸附新车内各种有害气体及旧车内各种异味.
7、电脑、家用电器等:吸附、减少辐射气体对人的危害.
8、办公室、酒店及其他公共场所:净化空气、消除异味1年前查看全部
- 怎样降低二氧化碳浓度
 淡荷香1年前3
淡荷香1年前3 -
 梦想成真2007 共回答了14个问题
梦想成真2007 共回答了14个问题 |采纳率92.9%如果是小范围的降低浓度,可以使用碱液吸收法,如氢氧化钙,氢氧化铜等.1年前查看全部
- fluent如何定义浓度
 闽湘龙1年前1
闽湘龙1年前1 -
 想到哪儿 共回答了14个问题
想到哪儿 共回答了14个问题 |采纳率92.9%如果是作为求解的变量,那就可以用组分输运方程来求解
最后得到质量分数、mole分数等等
至于其他的情况,视具体而定1年前查看全部
- Na2SO4离子浓度大小顺序
 xiaorang121年前5
xiaorang121年前5 -
 yxgod 共回答了16个问题
yxgod 共回答了16个问题 |采纳率100%Na2SO4在水中完全电离
水溶液显中性
离子浓度大小顺序为
Na+>SO42->H+ = OH-
其中
[Na+]=2 [SO42]
多谢1年前查看全部
- na2co3水解离子浓度大小判断
na2co3水解离子浓度大小判断
碳酸根、氢氧根、和碳酸氢根 说出它们仨具体是怎么判断的就行 wangjingxp1年前3
wangjingxp1年前3 -
 leeyeeke3000 共回答了19个问题
leeyeeke3000 共回答了19个问题 |采纳率94.7%碳酸根水解成碳酸氢根和氢氧根
而水解弱
所以碳酸根溶度最大
而氢氧根还有水电离 所以其浓度一定大于碳酸氢根
所以碳酸根 大于 氢氧根 大于碳酸氢根1年前查看全部
- 利用紫外如何计算溶液浓度
 nbs2vi1年前1
nbs2vi1年前1 -
 znl004 共回答了21个问题
znl004 共回答了21个问题 |采纳率71.4%根据 Lambert-Beer 定律 A = epsilon (入) × c × l
这里的 A 是溶液的吸光度,是一个无量纲的数值;epsilon (入) 是对应的吸收波长下物质的摩尔消光系数,单位是 L / (mol cm) 是溶液的摩尔浓度,单位是 mol/L ;l 是吸收光程,单位是 cm.
一般由紫外-可见吸收光谱测得 A,由于是在 1 cm 的比色皿中测量的,所以光程为 1 cm,要求溶液的浓度,需要查该物质在对应波长下的“摩尔消光系数”,然后代入 A = epsilon (入) × c × l ,整理后得:
c = A / [ epsilon (入) × l ]
即可求出溶液的浓度.1年前查看全部
- 如何确定样本rna浓度
 tearsdrop1年前4
tearsdrop1年前4 -
 我是幽壹 共回答了18个问题
我是幽壹 共回答了18个问题 |采纳率94.4%利用实时定量pcr技术,他可以检测pcr过程中dna的浓度:
原理是:当在引物作用下dna开始复制时 就会有荧光,然后电脑就会检测到,故复制一次,荧光强度就会增加一次,进而检测到dna的浓度,1年前查看全部
- 如何判断离子浓度降低?
 KINGFUNG8881年前1
KINGFUNG8881年前1 -
 newayren 共回答了19个问题
newayren 共回答了19个问题 |采纳率94.7%c=n/v,n降低或者v增大都能导致c降低1年前查看全部
- 1mol\L NaHSO3水解物料守恒 电子守恒 离子浓度大小
 longrui10291年前1
longrui10291年前1 -
 mickey_zzz 共回答了18个问题
mickey_zzz 共回答了18个问题 |采纳率94.4%NaHS03溶液中有 NA+ HS03- H+ 0H- S032- H2S03
建立电子守恒 c(Na+)+c(H+)=c(HS03-)+2c(S032-)+c(OH-)
建立物料守恒 HS03-==H+ S032-
HS03- +H20 =H2S03+OH-
H20== H+ + OH-
c(NA+)=C(S032-)+C(HS03-)+C(H2S03)
离子浓度大小 HS03- 电离大于水解
c(NA+)>c(HS03-)>c(H+)>c(s032-)>c(oH-)1年前查看全部
- 当量浓度
 弄潮郎君1年前1
弄潮郎君1年前1 -
 riephy 共回答了20个问题
riephy 共回答了20个问题 |采纳率85%当量浓度(N) 溶液的浓度用1升溶液中所含溶质的克当量数来表示的叫当量浓度,用符号N表示.(英文:normality) 当量浓度是过去用的很多,现在基本不用了.一当量就是得失一个电子的意思.如果是盐酸,放出一个氢离子,则当量浓度和摩尔浓度是一样的.如果是硫酸,则一摩尔浓度等于二倍的当量浓度. .在一般的氧化还原反应中,就要复杂一些了,例如高锰酸钾氧化草酸钠,2摩尔高锰酸钾和5摩尔草酸钠刚好反应,则高锰酸钾的当量浓度=5倍的摩尔浓度. 当量浓度的定义是1L水溶液中溶解的溶质用氢的当量除摩尔质量,常用于表示酸溶液的质量.1年前查看全部
- 酒精浓度16%vol
 knopfler19791年前3
knopfler19791年前3 -
 荡漾de花 共回答了19个问题
荡漾de花 共回答了19个问题 |采纳率94.7%应该是酒精体积百分比浓度为16%1年前查看全部
- 关于化学KSP计算,Ksp=2.0*10^-12,请问Ag离子浓度怎么计算?
 zijiang201年前2
zijiang201年前2 -
 zxf小猪 共回答了19个问题
zxf小猪 共回答了19个问题 |采纳率100%银离子浓度的平方*铬酸根离子浓度=Ksp.那么Ksp的三次方根=铬酸根离子浓度=银离子浓度的二分之一.所以Ksp的三次方根要乘以2才是银离子浓度.1年前查看全部
- 硝酸浓度配制
 heluoqi1年前1
heluoqi1年前1 -
 ashelyyin 共回答了19个问题
ashelyyin 共回答了19个问题 |采纳率94.7%溶液不同浓度的配制都是根据溶质的物质的量不变来计算的,如浓度为ρ1的硝酸配成浓度为ρ2的硝酸溶液,则ρ1V1=ρ2V2,这样就可以算出体积比,从而配制溶液.不管是溶液稀释还是配制更浓的溶液都是一样的.1年前查看全部
- 关于高中化学离子浓度大小如何比较?
关于高中化学离子浓度大小如何比较?
这块很混乱 哎呀小腰精1年前3
哎呀小腰精1年前3 -
 bobobox 共回答了23个问题
bobobox 共回答了23个问题 |采纳率87%你产生要分清楚什么是显性粒子和隐性粒子,比如NH4Cl溶液中
显性粒子是NH4+ 、Cl-、H2O 三种
隐性粒子有:H+ (来自水的电离和NH4+的水解)、OH-(只来自水的电离)、NH3.H2O (来自水解)三种.
而这个溶液显酸性,也就是说是以水解为主的.
所以显性粒子排前面,隐性粒子排后面.
C(Cl-)》C(NH4+)》C(H+)》C(OH-)1年前查看全部
- cuso4+h2s cus h2so4 离子浓度
cuso4+h2s cus h2so4 离子浓度
理论:反应的方向是向着溶液中离子浓度减少的方向进行.
但为什么老师说反应看做CU2+SO42-生成2H+ 和SO42-
离子浓度增大 不是矛盾了么 zcl5050gyh1年前1
zcl5050gyh1年前1 -
 天边的那朵云上 共回答了16个问题
天边的那朵云上 共回答了16个问题 |采纳率93.8%楼主好!
呃……楼主是想说 CuSO4 + H2S == CuS↓ + H2SO4 吧!楼上,你的解释不准确哦,H2S在水中的确会电离出H+,但是!H2S是弱酸,它电离出的离子浓度是很小的,所以说“H+离子浓度不变”是不正确的,这个要纠正一下.
将该反应写成离子方程式:H2S + Cu2+ == CuS↓ + 2H+,在这个反应中,离子浓度的确是增大了没错,我不晓得楼主所说的“反应看做CU2+SO42-生成2H+ 和SO42-”原话是什么,但就这句话来说,肯定是错误的!因为这个反应从始至终,和硫酸根半毛钱关系都没有.
这个反应本质是复分解反应,而复分解反应指的是由两种化合物相互交换成分,生成另外两种化合物的反应.按照复分解反应的发生条件,必须有气体、沉淀、水(狭义,广义为弱电解质)三者之一生成.我们一般都认为,复分解反应的实质是化合物电离生成的离子在溶液中相互发生了反应,反应的方向是向着溶液中离子浓度减少的方向进行.这个放在绝大多数复分解反应上是没错的.但,呵呵,这是特例.
要解释这个特例,首先从我们熟悉的强酸制弱酸说起.其实,为什么我们说弱酸制强酸不行呢?就像 H2CO3 + CaCl2 = 2HCl + CaCO3.这个反应不可能就是因为生成物CaCO3能继续和HCl反映,到最后就什么也没有生成了,所以就是不能进行这个反应.而H2S+CuSO4=CuS↓+H2SO4,CuS实在太难溶于H2SO4中了(就是不反应),所以能够变成沉淀,并沉淀于H2SO4中,不像上面的CaCO3能溶于HCl.
因此,一个复分解反应其实是与其逆反应竞争的过程,比较科学的解释就是平衡常数K——复分解反应之所以能进行,就是因为在一部分离子很多的同时,另一部分离子能大量减少,拉动了平衡.而CuSO4 + H2S == CuS↓ + H2SO4 中,由于 CuS 溶解度实在太小,无法提供逆反应所需的大量 S2- ,而却能提供正反应所需的大量 Cu2+,并且在生成 CuS 的同时,满足Cu2+的大量减小,因此能够发生.至于最科学的解释涉及焓与熵,这个就不要细究了.
嗯,就这样,楼主有问题的话再问吧!1年前查看全部
- 化学离子浓度大小如何判断
 pbl6521年前1
pbl6521年前1 -
 野辣烟开滴花 共回答了21个问题
野辣烟开滴花 共回答了21个问题 |采纳率95.2%考虑粒子在溶液中是否完全电离,如果完全电离再看其粒子在溶液中的浓度大小,随后考虑其弱酸弱碱根的水解程度,判断其粒子浓度大小,最后看溶液呈酸性还是碱性判断氢离子和氢阳根的浓度大小.
最后在比较其正粒子与负离子是否近似相等.(原因是因为溶液不带电)1年前查看全部
- NH4Cl,NH4SO4,NH4HSO4,(NH4)2CO3,NH4+浓度比较
NH4Cl,NH4SO4,NH4HSO4,(NH4)2CO3,NH4+浓度比较
在相同浓度下,以上几种溶液铵根离子浓度比较. 色彩构成1年前3
色彩构成1年前3 -
 秦朝10 共回答了23个问题
秦朝10 共回答了23个问题 |采纳率95.7%(NH4)2CO3<NH4Cl<NH4HSO4<(NH4)2SO4
浓度相同即物质的量相同,(NH4)2SO4一定比NH4Cl大,
HSO4- == H+ + SO42-,NH4+ + OH- ==NH3·H2O,抑制NH4+水解
所以NH4Cl<NH4HSO4,水解毕竟是少量的,所以NH4HSO4<(NH4)2SO4
CO32- + H2O=HCO3- + OH-,NH4+ + OH- ==NH3·H2O,
双水解,互相促进,所以(NH4)2CO3中NH4+最少,
综上:(NH4)2CO3<NH4Cl<NH4HSO4<(NH4)2SO41年前查看全部
- 混合溶液离子浓度比较
混合溶液离子浓度比较

 一声裂帛长吟1年前1
一声裂帛长吟1年前1 -
 yzx7777777 共回答了17个问题
yzx7777777 共回答了17个问题 |采纳率88.2%1年前查看全部
- 高三化学PH温度影响离子浓度问题
高三化学PH温度影响离子浓度问题

这题该怎么解? familybruin1年前5
familybruin1年前5 -
 hanghangli 共回答了26个问题
hanghangli 共回答了26个问题 |采纳率84.6%看清各个点对应的情况,进行分析.
A,a点是加入10ml HCl,这时NH3·H2O一半与HCl反应生成NH4Cl,剩余一半NH3·H2O.
明显,有NH4Cl和NH3·H2O的混合溶液,呈碱性.说明NH3·H2O电离为主.
NH4Cl==NH4+ + Cl-,再加上 NH3·H2O==NH4+ + OH-
所以,NH4+ > Cl- > OH- > H+
B、b点是呈中性,所以 c(H+)=c(OH-),
而任何时刻溶液一定电荷守恒:c(Na+) + c(H+) = c(Cl-) + c(OH-)
呈中性,所以,c(Na+)=c(Cl-)
C、B答案说了,任何时刻溶液一定电荷守恒:c(Na+) + c(H+) = c(Cl-) + c(OH-)
D、NH3·H2O早电离了,这时NH3·H2O也被HCl中和的快没了.所以,温度下降与NH3·H2O电离没关系.而是因为之前溶液温度高于常温,加入新的溶液是常温的,把温度降了下来.
选D1年前查看全部
- 电子浓度等于空穴浓度
 苦乐cc1年前1
苦乐cc1年前1 -
 瘦瘦的肉肉 共回答了22个问题
瘦瘦的肉肉 共回答了22个问题 |采纳率90.9%因为空穴并不是真实存在的,只是对大量电子运动的一种等效,空穴的流动其实就是大量电子运动的等效的反运动,这从空穴的定义和特性就可以知道;
空穴的定义:
当满带顶附近产生p0个空态时,其余大量电子在外电场作用下所产生的电流,可等效为p0个具有正电荷q和正有效质量mp,速度为v(k)的准经典粒子所产生的电流.这样的准经典离子称为空穴.
空穴的特征:
1.荷电量与电子相等但符号相反,既荷+q;
2.有效质量数值等于价带顶空态所对应的电子有效质量,但符号为正,即mp=-mn;
3.速度为价带顶空带所对应的电子速度;
4.浓度等于空态密度p0;1年前查看全部
- 如何测算二氧化硫排放浓度
 楼下的回复超烂1年前1
楼下的回复超烂1年前1 -
 ffia 共回答了14个问题
ffia 共回答了14个问题 |采纳率100%单位时间内排放的二氧化硫的物质的量÷单位时间内排放的气体体积=单位时间内二氧化硫的排放浓度1年前查看全部
- 医用酒精浓度75%还是95%?
 zuankongji1年前1
zuankongji1年前1 -
 lordljy 共回答了14个问题
lordljy 共回答了14个问题 |采纳率64.3%75%的;95%的浓度太高,会在渗入细菌内部后使蛋白质立即变性,变性蛋白质在细菌细胞膜内形成一层保护膜,使酒精无法到达更深处.1年前查看全部
- Na2co3 nahco3 nahso3 nh4cl电荷守恒物料守恒质子守恒离子浓度关系
 zhaobo77881年前1
zhaobo77881年前1 -
 忽略忽略再忽略 共回答了14个问题
忽略忽略再忽略 共回答了14个问题 |采纳率100%Na2CO3
电荷守恒,cNa+ +cH+=2cCO32-+cHCO3-+cOH-
物料守恒,2cCO32-+2cHCO3-+2cH2CO3=cNa+
质子守恒,cH+ +cH2CO3=cOH-+cCO32-
NaHCO3
电荷守恒,cNa+ +cH+=2cCO32-,+cHCO3-+cOH-
物料守恒,cNa+=cHCO3-+cCO32-+cH2CO3
质子守恒,cH++cH2CO3=cCO32-+cOH-
NaHSO3与NaHCO3几乎完全一样,就不书写了
NH4Cl,电荷守恒,
cCl-+cOH-=cNH4+ +cH+
物料守恒,cNH4+ +cNH3.H2O=cCl-
质子守恒,cH+ =cNH3.H2O+cOH-
质子守恒,即电荷守恒与物料守恒式子的相减可得1年前查看全部
- 离子浓度大小如何比较
 zhengshibing1年前1
zhengshibing1年前1 -
 hujiafei2008 共回答了18个问题
hujiafei2008 共回答了18个问题 |采纳率77.8%要掌握解此类题的三个思维基点:电离、水解和守恒(电荷守恒、物料守恒及质子守恒).对有关电解质溶液中离子浓度大小比较的题,在做时首先搞清溶液状况,是单一溶液还是混合溶液,然后再根据情况分析.
1、单一溶质的溶液中离子浓度比较
① 多元弱酸溶液中,由于多元弱酸是分步电离(注意,电离都是微弱的)的,第一步的电离远远大于第二步,第二步远远大于第三步.由此可判断多元弱酸溶液中离子浓度大小顺序.例H3PO4溶液中:c(H+)>c(H2PO4-)>c(HPO42-)>c(PO43-)
② 多元弱酸的强碱正盐溶液中,要根据酸根离子的分步水解(注意,水解都是微弱的)来分析.第一步水解程度大于第二步水解程度,依次减弱.如Na2S溶液中:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
③ 多元弱酸的酸式盐溶液中:由于存在弱酸的酸式酸根离子的电离,同时还存在弱酸的酸式酸根离子的水解,因此必须搞清电离程度和水解程度的相对大小,然后判断离子浓度大小顺序.常见的NaHCO3 NaHS,Na2HPO4溶液中酸式酸根离子的水解程度大于电离程度,溶液中c(OH-)>c(H+)溶液显碱性,例NaHCO3中:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),
反例:NaHSO3,NaH2PO4溶液中弱酸根离子电离程度大于水解程度,溶液显酸性c(H+) >c(OH-).例在NaHSO3中:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-).
规律:① 第一步水解生成的粒子浓度在[OH-]和[H+]之间,第二步水解生成的粒子浓度最小 例:Na2S溶液中的各离子浓度大小的顺序:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
②不同溶液中同种离子浓度的比较:既要考虑离子在溶液中的水解因素,又要考虑其它离子的影响,是抑制还是促进,然后再判断.
例;常温下物质的量浓度相等的a.(NH4)2CO3 b.(NH4)2SO4.c.(NH4)2Fe(SO4)2三种溶液中c(NH4+)的大小;NH4+在水溶液中发生水解显酸性,CO32-离子水解显碱性,两离子水解相互促进,Fe2+水解显酸性与NH4+水解相互抑制,因此三溶液中c(NH4+):c>b>a.
2、 混合溶液中离子浓度的比较
① 强酸与弱碱溶液混合后溶液中离子浓度大小比较,首先要考虑混合后溶液的状况及溶液的酸碱性.酸过量:溶液为强酸和强酸弱碱盐的混合溶液,溶液中c(H+) >c(OH-)呈酸性
酸碱恰好完全反应:溶液为单一盐溶液,弱碱根离子水解,溶液呈酸性
碱少量过量:溶液为弱碱和强酸弱碱盐的混合溶液,溶液中c(OH-)= c(H+)呈中性
碱大量过量:溶液为大量弱碱和强酸弱碱盐的混合溶液,溶液中c(OH-)>c(H+)呈碱性.根据这几种情况可判断溶液中离子大小情况.
②强碱和弱酸溶液混合后,溶液中离子浓度的大小比较
呈碱性包括两种情况;强碱和强碱弱酸盐的混合溶液及单一强碱弱酸盐溶液.
呈中性:强碱弱酸盐和少量弱酸的混合溶液
呈酸性:强碱弱酸盐和大量弱酸的混合溶液
3理解掌握电解质溶液中的几种守恒关系;
①溶质守恒:(物料守恒)溶质在溶液中某种离子的各种存在形式总和不变.
如:在CH3COONa溶液中c(CH3COO-)+ c(CH3COOH)= c(Na+)=c( CH3COONa)
②溶剂守恒:(质子守恒)溶液中溶剂水电离的c(H+)和c(OH-)浓度相等,
如:在CH3COONa溶液中,水所电离的H+被部分CH3COO-结合生成CH3COOH,因此:c(H+)+ c(CH3COOH)= c(OH-)
③电荷守恒:任何溶液中都呈电中性,溶液中阳离子所带的正电荷总和等于阴离子所带的负电荷总和.在CH3COONa溶液中:c(CH3COO-)+ c(OH-)=c(Na+)+c(H+)
利用好守恒关系也可以达到事半功倍的效果.1年前查看全部
- 酒精浓度>5.
 菱子的鱼1年前3
菱子的鱼1年前3 -
 gstanglin 共回答了14个问题
gstanglin 共回答了14个问题 |采纳率92.9%酒精浓度(只取数字)×酒的分量(以升计)=酒精单位(约数).
例如:一听5%酒精浓度的330毫升啤酒,大约有5×0.33=1.65个酒精单位;一瓶12%酒精浓度的750毫升红酒,大概有12×0.75=9个1年前查看全部
- 如果可以,浓度~
 8u2i54381年前1
8u2i54381年前1 -
 wywapple 共回答了18个问题
wywapple 共回答了18个问题 |采纳率88.9%不可以 水合肼是强力还原剂 一般市售水合肼只有40%左右的浓度 就可以非常迅速的还原出很多金属 但是因为还原速率很高 金属单质会絮凝生成 形成的单质不会均匀附着在容器壁上 如果要做XX镜反应 需要用还原力适中 速率和缓的还原剂来做1年前查看全部
- 6千克2ppm浓度高锰酸钾溶液需多少高锰酸钾?
 fayeknight1年前1
fayeknight1年前1 -
 绛雪玄霜_ 共回答了14个问题
绛雪玄霜_ 共回答了14个问题 |采纳率85.7%0.012克1年前查看全部
- 高一化学浓度偏高偏低
 麦麦丫头1年前1
麦麦丫头1年前1 -
 maxco_mo 共回答了27个问题
maxco_mo 共回答了27个问题 |采纳率85.2%一、称量误差分析
(一)天平的砝码沾有其他物质或生锈.(mB偏大,cB偏高)
(二)调整“0”点时,游码在大于0的位置.(mB偏小,cB偏低)
(三)在敝口容器中称量NaOH、CaCl2、CuSO4粉末、MgCl2等易吸收水的物质.(mB偏小,cB偏低)
(四)称量已部分风化的Na2CO3•10H2O、CuSO4•5H2O等.(mB偏大,cB偏高)
(五)用量筒量取浓溶液时,仰视读数.(mB偏大,cB偏高)
二、配制过程误差分析
(一)称好后的药品放入烧杯时,有少量洒在烧杯外.(mB偏小,cB偏低)
(二)溶解搅拌时有部分液体溅出.(mB偏小,cB偏低)
(三)转移时有部分液体溅出.(mB偏小,cB偏低)
(四)未洗涤烧杯和玻璃棒2次~3次.(mB偏小,cB偏低)
(五)溶解时放热,且未冷却至室温(20℃)(V偏小,cB偏高);溶解时吸热,且未恢复到室温(20℃)(V偏大,cB偏低)
(六)在定容时,仰视读数(V偏大,cB偏低),俯视读数(V偏小,cB偏高)
(七)在定容时加水超过刻度线,再用胶头滴管吸出多余部分.(V偏大,cB偏低)
(八)加水至刻度线后,摇匀过程中,发现液面低于刻度线.(无影响)
(九)洗涤容量瓶后,未干燥,瓶中有少量蒸馏水.(无影响)
三、俯视、仰视的分析
仰视时,容器内液面高于刻度线;俯视时,容器内液面低于刻度线.1年前查看全部
- 增大fe(no3)3浓度抑制水解
 ev85961年前1
ev85961年前1 -
 lancona 共回答了14个问题
lancona 共回答了14个问题 |采纳率100%Fe毕竟不是活泼金属,Fe(NO3)3是强酸弱碱盐.虽然Fe3+会水解即 :Fe3+ +H2O ≒ Fe(OH)3 + H+但因为HNO3是强酸,所以会抑制水解1年前查看全部
- 提高co2浓度,反应速率加快,呼吸作用抑制?
 苹果琦1年前1
苹果琦1年前1 -
 shine1234 共回答了14个问题
shine1234 共回答了14个问题 |采纳率85.7%恩 呼吸作用 产生二氧化碳 增加产物 反应被抑制1年前查看全部
- 高锰酸钾浓度怎么测试
 龙泪儿1年前3
龙泪儿1年前3 -
 又见枫叶 共回答了28个问题
又见枫叶 共回答了28个问题 |采纳率85.7%1.KD-O02原液中H2O2含量的测定(GB6684-86)量取0.18毫升(0.2克)样品,称准至0.0002克.加25.00毫水,加10毫升4N硫酸.用0.lN高锰酸钾标准溶液滴定至溶液呈粉红色保持30秒钟.
H2O2含量%(X H2O2)按下式计算:
X H2O2=(V.C*0.01701)/M *100
式中:V-高锰酸钾标准溶液之用量,毫升;
C-高锰酸钾溶液之当量浓度,N;
m-样品重量,克;
0.01701-每毫克当量H2O2之克数.
(注:测定中所需标准溶液、制剂及制品均按GB601、GB602之规定制备)
2.稀释后的康迪消毒液中H2O2浓度的测定
试验规则:
方法所用试剂和水,在没有注明其它要求时,均按分析纯试剂和蒸馏水或相应纯度的水,试验所需标准滴定寸翻帆 带叮齐甘及制品在没有说明其它标准时,均按GB60l、GB603之规定制备.
试验方法:
(1)用500 ml或l000ml的烧杯从已配制好的消毒液申量取500-1000ml,如有杂质,须放置一段时间,让其沉淀.
(2)在3嘶创锥形瓶中预先放入40-50ml而肛的水再倒人4N的硫酸 lOml或l5M.
(3)从上述烧杯中用lOml的移液管移取lOml的消毒液于锥形瓶中.
(4)用0,1N的高锰酸钾标准液滴定至锥形瓶中溶液呈粉红色,保持30秒不褪色.
(5)H2O2含量%(X)按下式计算:
X H2O2=(V.C*0.01701)/10 *100
式中:V-高锰酸钾标准溶液用量,毫升;
C一 高锰酸钾标准溶液之当量浓度,N;
(6)消毒剂 (原液)浓度计算:
消毒剂 的浓度%(Y)按下式计算:
YKD-002= (XH2O2)/0.28
3.0.lN高锰酸钾标谁溶液的配制及标定:
(1)配制:
称取3.3克高锰酸钾,溶于1050毫升水中,缓缓煮沸15分钟,冷却后置于暗处密封保存两周.以4号玻璃过滤埚滤于干燥的棕色瓶中.
(注:过滤高锰酸钾溶液所使用的4号玻璃滤,事先应以同样的高锰酸钾溶液缓缓煮沸5分钟,收集瓶也要用此高锰酸钾溶液洗涤2-3次.)
(2)标定:
a.测定方法:称取0.2克于105-100摄适度,烘至恒重的基准草酸纳称准至0.0002克.溶于100毫升含有8毫升硫酸的水中,用0.1N高锰酸钾标准溶液滴定,近终点时加热至65QC,继续滴定至溶液呈粉红色保持30秒钟.同时作空白试验.
b.计算:
高锰酸钾标准溶液的当量浓度N按下式计算:
N= G /((V1-V2)*0.06700)
式中:G-草酸钠之重量,克
V1一 高锰酸钾溶液之用量,毫升
V2一 空白试验高锰钾溶液之用量,毫升
0.06700-每毫克当量Na2C2O2之克数1年前查看全部
- 二氧化碳浓度升高如何抑制光合作用?
 sabrina971年前1
sabrina971年前1 -
 育新生 共回答了23个问题
育新生 共回答了23个问题 |采纳率87%植物在进行光合作用时需要CO2,CO2需通过叶片表面的气孔进入植物体内,气孔的体积有限,所以当CO2浓度过高时,O2含量的比例会下降抑制呼吸作用,呼吸作用产生的ATP减少而影响光合作用细胞的能量供给(每个细胞都是在呼吸着的),所以会导致光合作用变慢,即抑制了光合作用1年前查看全部
- 排放浓度单位如何换算mg/l==>mg/Nm3
排放浓度单位如何换算mg/l==>mg/Nm3
so2,80mg/l
NOx,40mg/l
烟气浓度,30mg/Sm3
如何换算成mg/Nm3 ykdzz1年前1
ykdzz1年前1 -
 暮雲 共回答了17个问题
暮雲 共回答了17个问题 |采纳率88.2%还是自己受了的好1年前查看全部
大家在问
- 1英语翻译Precioous things are very few in this world ,that is the
- 2They ehjoyed 【they】while they were staying in Beijing.适当形式填空
- 3---Would you mind picking up the books I bought from the boo
- 4_____ at the back of the theatre, the girl couldn’t see Zhou
- 5一个平行四边形的两条临边分别为6厘米和10厘米,其中一组对边的距离是8厘米.求这个平行四边形的面积.
- 6甲、乙两车分别从A、B两地同时相对开出,经过5小时相遇,相遇后各自继续前进,又经过3小时,甲车到达B地,这时乙车距离A地
- 7省略 英语
- 8如图是反射弧的结构示意图,请据图回答问题.
- 9如图ABCD是一块边长为100米的正方形地皮,其中ATPS 是一半径为90米的扇形小山,P是弧TS上一点,其余都是平地,
- 10一叶知秋 作文
- 114x+3=2-x 中x等于多少?
- 12英语翻译Most of us,however,take life for granted.We konw that on
- 13It is reported that today ( )president will have lunch with
- 14三个数的平均数是12,前两个数的平均数是14,第三个数是?急
- 15《孟子》测试题1.朱元璋为什么要把孟子赶出孔庙?* a朱元璋提倡节约,不愿给孟子牌位提供冷猪肉 b朱元璋认为孟子没学问