某烃完全燃烧后,生成的H2O和CO2的物质的量之比为6:5.该烃的链状同分异构体的数目应是
 阿什利扬2022-10-04 11:39:543条回答
阿什利扬2022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 danielwyo 共回答了20个问题
danielwyo 共回答了20个问题 |采纳率75%- 这个烃为C5H12
同分异构体有3个
正戊烷、异戊烷、新戊烷 - 1年前
 wjm1980 共回答了4个问题
wjm1980 共回答了4个问题 |采纳率- 如题
那么H和O的比就是12比5 那就是戊烷 戊烷有三种同分异构体. - 1年前
 寒云2007 共回答了7个问题
寒云2007 共回答了7个问题 |采纳率- 该烃为C5H12,为饱和烃
所以有3个同分异构体 - 1年前
相关推荐
- 0.5mol某烃完全燃烧后得到二氧化碳和水蒸气的混合气体.若将该混合气体全部通入足
0.5mol某烃完全燃烧后得到二氧化碳和水蒸气的混合气体.若将该混合气体全部通入足
量的澄清石灰水的洗气瓶,瓶内产生白色沉淀100克;若将该混合气体全部通入盛有足量过氧化钠的干燥管,干燥管的质量增加30克。求该烃的化学式并判断该烃是否为烷烃,说明理由 cardinaul1年前1
cardinaul1年前1 -
 bleemp 共回答了14个问题
bleemp 共回答了14个问题 |采纳率64.3%根据CO2--------CaCO3
1mol 100g
2 CO2+2Na2O2=2Na2CO3+O2 质量差
2mol 56g
1mol 28g
2H2O+2Na2O2=4NaOH+O2
2mol 4g
1mol 2g
0.5molCxHy -------1molCO2.1mol H2O
烃化学式为C2H21年前查看全部
- 在25摄氏度,101千帕的条件下,将15L氧气通入10LCO和氢气的混合气体中,使其完全燃烧,干燥后,恢复到原来的温度和
在25摄氏度,101千帕的条件下,将15L氧气通入10LCO和氢气的混合气体中,使其完全燃烧,干燥后,恢复到原来的温度和压强.(1)若剩余气体的体积是15L,则原来CO和氢气的混合气体中,一氧化碳体积是多少升?,氢气的体积是多少升?
(2)若剩余气体的体积为aL,则原来的一氧化碳和氢气的混合气体中,一氧化碳和氢气的体积比是多少?
(3)若剩余气体的体积为aL,则a的取值范围是多少? dream20021年前2
dream20021年前2 -
 星那样闪 共回答了22个问题
星那样闪 共回答了22个问题 |采纳率86.4%2H2+O2==2H2O ;2CO+O2==2CO2
CO2燃烧后,生成的气体体积变为原O2的两倍,H2燃烧后,没有气体,所以气体减少的体积等于原氧气的体积
(1)一个气体体积增加一倍,一个没有气体,所以H2的体积和CO的体积相等,就能保持气体体积不变,为1:1 各5L
(2)设氢气的体积为x,CO的体积为30-x(完全燃烧),则a=x,所以一氧化碳和氢气的混合气体的体积各是(30-a)和a
(3)若混合气体全部是H2,则无气体剩余,若混合气体全部是CO,则剩余30L,由于是混合气体,而不是单一气体,所以该区间应为开区间,为0<a<301年前查看全部
- 某有机物中只含C、H、O三种元素,其蒸气的密度是同温同压下H2的23倍,2.3克该物质完全燃烧后生成0.1摩尔CO2和2
某有机物中只含C、H、O三种元素,其蒸气的密度是同温同压下H2的23倍,2.3克该物质完全燃烧后生成0.1摩尔CO2和27克H2O,求该化合物的分子式?
请按格式答题, 63819771年前6
63819771年前6 -
 消失de音符 共回答了17个问题
消失de音符 共回答了17个问题 |采纳率88.2%其蒸气的密度是同温同压下H2的23倍
所以相对分子质量为2*23=46
2.3克该物质完全燃烧后生成0.1摩尔CO2和27克H2O
所以0.05MOL该物质含有0.1MOLC和2.7、18*2=0.3MOLC
所以1MOL该物质含C 2MOL H 6MOL
其余的元素为O
所以该物质分子式C2H6O
你好像打错了 是2.7克水吧1年前查看全部
- 将0.2摩尔某烷烃完全燃烧后,生成的的气体缓慢通过盛有0.5升2摩尔的氢氧化钠溶液中,生成的碳酸钠和碳酸氢钠的物质的量之
将0.2摩尔某烷烃完全燃烧后,生成的的气体缓慢通过盛有0.5升2摩尔的氢氧化钠溶液中,生成的碳酸钠和碳酸氢钠的物质的量之比1:3,则该烷烃为什么?
 blackwhitehumor1年前2
blackwhitehumor1年前2 -
 1212121a 共回答了21个问题
1212121a 共回答了21个问题 |采纳率95.2%由于溶液中有NaHco3,所以NaoH完全反应了.
设NaHco3,Na2c03的物质的量分别为3x,x;
有钠离子物质的量守恒得:3x+x*2=0.5*2;
x=0.2;
所以碳元素的物质的量为0.2+0.6=0.8;
所以该烃为C4H10;1年前查看全部
- 乙酸完全燃烧的产物有哪些
 iloveqq1年前1
iloveqq1年前1 -
 伊人不相见 共回答了21个问题
伊人不相见 共回答了21个问题 |采纳率95.2%乙酸在空气或氧气中点燃,完全燃烧生成CO2.H2O.这是乙酸的氧化反应.在常温下,乙酸对KMnO4酸性溶液.O2等强氧化剂表现的很稳定.
CH3COOH + 2O2 == 2CO2(气) + 2H2O1年前查看全部
- 化石燃料完全燃烧和不完全燃烧后产物分别是什么
化石燃料完全燃烧和不完全燃烧后产物分别是什么
要说清楚天然气 石油 煤 XINGZENGW1年前1
XINGZENGW1年前1 -
 linyuqun1984 共回答了24个问题
linyuqun1984 共回答了24个问题 |采纳率83.3%完全燃烧就是生成CO2+H2O不完全燃烧就是CO+CO2+H2O化石燃料都含有C,H ,O元素1年前查看全部
- 若一定质量的煤中含有16g硫,计算这些煤完全燃烧时生成二氧化硫的质量.
 久瞳Ada1年前3
久瞳Ada1年前3 -
 麻广广 共回答了12个问题
麻广广 共回答了12个问题 |采纳率91.7%解题思路:由硫的质量根据硫燃烧的化学方程式可以计算出生成二氧化硫的质量.设生成二氧化硫的质量为x.
S+O2
点燃
.
SO2
32 64
16gx
[32/64]=[16g/x],x=32g
答:生成二氧化硫的质量为32g.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题主要考查有关化学方程式的计算,难度稍大.1年前查看全部
- 丁烷是液化石油气的成分之一另外完全燃烧后与甲烷完全燃烧后的产物相同写化学
 狗尾巴草的游乐场1年前1
狗尾巴草的游乐场1年前1 -
 fobqi 共回答了22个问题
fobqi 共回答了22个问题 |采纳率95.5%甲烷的化学式:CH4
点燃
CH4+2O2====CO2+2H2O
丁烷的化学式:C4H10
点燃
2C4H10+13O2====8CO2+10H2O1年前查看全部
- (2014•嘉定区三模)乙醇(C2H6O)完全燃烧时生成CO2和H2O.如果氧气不充足,乙醇燃烧可能还有CO生成.现用如
(2014•嘉定区三模)乙醇(C2H6O)完全燃烧时生成CO2和H2O.如果氧气不充足,乙醇燃烧可能还有CO生成.现用如图装置进行实验,确证乙醇燃烧产物中有CO、CO2和H2O.请回答下列问题:
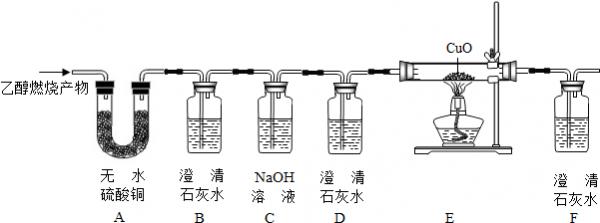
实验时可观察到:装置B、F中石灰水变浑浊,D中石灰水无变化,E中粉末变亮红色.
①能确证产物中有H2O的现象是:______;
②E中现象的解释是:CO+CuO
Cu+CO2△ .CO+CuO(用化学方程式);
Cu+CO2△ .
③B装置的作用是:______;
D装置的作用是:______;
F装置的作用是:______;
④装置A和装置B不能交换顺序的原因是:______. cjsy371年前1
cjsy371年前1 -
 jerome_1968 共回答了9个问题
jerome_1968 共回答了9个问题 |采纳率88.9%解题思路:根据各个物质的性质进行无水硫酸铜能和水反应生成蓝色的硫酸铜;澄清石灰水遇二氧化碳变浑浊;氢氧化钠能够吸收二氧化碳;一氧化碳可以还原氧化铜,使黑色的氧化铜变成红色.分析流程图中每个装置内的药品可知,A中无水硫酸铜是检验水,无水硫酸铜遇水变蓝,B中澄清石灰水是检验生成物中是否有二氧化碳,二氧化碳能使澄清石灰水变浑浊;C中氢氧化钠是吸收二氧化碳,D中澄清石灰水是检验二氧化碳是否完全吸收;E中验证一氧化碳还原氧化铜,F中澄清石灰水是检验E装置是否产生二氧化碳.
所以:①A中无水硫酸铜变蓝说明产物中有水;
②E中粉末变亮红色,说明有还原性气体一氧化碳,一氧化碳与氧化铜反应的方程式是:CO+CuO
△
.
Cu+CO2;
③澄清石灰水遇二氧化碳变浑浊,所以澄清石灰水能够检验是否有二氧化碳气体,所以B装置的作用是检验燃烧产物中是否含有CO2;
为防止原有的二氧化碳干扰试验,所以要先用氢氧化钠溶液除去二氧化碳,然后再用澄清的石灰水检验是否还有二氧化碳,所以D装置的作用是检验CO2是否被除尽;
E装置中的氧化铜变成红色,并且有二氧化碳生成,说明有一氧化碳气体存在,所以F装置的作用是检验燃烧产物中是否含有CO;
④装置A和装置B不能交换顺序的原因是:要先吸收水分,防止澄清石灰水中的水分对实验造成影响.
故答案为:①装置A中白色粉末变蓝色;
②CO+CuO
△
.
Cu+CO2;
③检验燃烧产物中是否含有CO2;检验CO2是否被除尽;检验燃烧产物中是否含有CO;
④要先吸收水分,防止澄清石灰水中的水分对实验造成影响.点评:
本题考点: 常见气体的检验与除杂方法;书写化学方程式、文字表达式、电离方程式.
考点点评: 此题的难度较大,需要同学们能够熟记一氧化碳、二氧化碳等常见气体的性质.1年前查看全部
- 在纯氧中燃烧一定量的铁粉,铁粉完全燃烧后生成固体质量增加,经测定固体增加的质量与2.4g的镁完全燃烧后增加的质量相同,则
在纯氧中燃烧一定量的铁粉,铁粉完全燃烧后生成固体质量增加,经测定固体增加的质量与2.4g的镁完全燃烧后增加的质量相同,则铁粉的质量是多少?
 bocheng0021年前1
bocheng0021年前1 -
 lilifeng98 共回答了24个问题
lilifeng98 共回答了24个问题 |采纳率75%根据反应方程式6Fe+4O2=2Fe3O4,2Mg+O2=2MgO可以看出,两个反应后固体增加的质量都为参加氧气的质量,经测定固体增加的质量与2.4g的镁完全燃烧后增加的质量相同,那么2.4克Mg消耗的氧气和铁粉完全燃烧消耗的氧气的量是一样的.然后由氧气的量可以算出铁的量!
清楚吗?你就自己去算吧,我也可以偷懒一下~1年前查看全部
- 120摄氏度,101kPa时,两种气态烃的混合物2L完全燃烧,得到相同状况下3L CO2和3L水蒸气.这两种烃可能组成是
120摄氏度,101kPa时,两种气态烃的混合物2L完全燃烧,得到相同状况下3L CO2和3L水蒸气.这两种烃可能组成是(答案CH4和C2H2)
 yizhi11年前1
yizhi11年前1 -
 amazingcong 共回答了14个问题
amazingcong 共回答了14个问题 |采纳率85.7%若这道题目是选择题,可以用代入答案拼凑出这个答案.
2L气态烃混合物燃烧得到3LCO2&3LH2O
可知气态烃与产物物质的量比为1:1.5
所以假设气态烃化学式为CxHy,有
CxHy+(x+y/4)O2=(burnning)1.5CO2+1.5H2O
根据质量守恒,可以推知方程式中x=1.5;y=3
即混合物的组成式为:C1.5H3
所以混合物的两个组分每分子碳原子数一个要大于1.5,一个要小于1.5(所以甲烷是肯定存在的);每分子氢原子数要一个大于3一个小于3.
已知有一种物质是甲烷,那么另一种烃要求碳原子数大于1.5,氢原子数小于3,所以可以得出可能是乙炔(也可以是其他满足这一要求的烃,但在结构稳定性上,乙炔是作为首选考虑的).1年前查看全部
- 一摩尔乙炔完全燃烧的化学方程式
 faster561年前4
faster561年前4 -
 kivvy 共回答了18个问题
kivvy 共回答了18个问题 |采纳率94.4%C2H2+5/2O2=(点燃)2CO2+H2O
会出现分数,放心写就好了1年前查看全部
- 某物质完全燃烧后会成成二氧化碳它含有什么元素
 飄31年前1
飄31年前1 -
 flyskyfish 共回答了24个问题
flyskyfish 共回答了24个问题 |采纳率87.5%如果只生成二氧化碳的话:一定含碳 可能含氧1年前查看全部
- 一定的甲烷完全燃烧后得到CO.CO2和水蒸气.测得此混合气体的质量59.2 g将此混合气体通过足量浓硫酸,浓硫酸增重28
一定的甲烷完全燃烧后得到CO.CO2和水蒸气.测得此混合气体的质量59.2 g将此混合气体通过足量浓硫酸,浓硫酸增重28.8 g求原混合气体中CO,CO2质量?十字交叉法使用范围有哪些?
 冷月冰星121年前3
冷月冰星121年前3 -
 陈思浓 共回答了15个问题
陈思浓 共回答了15个问题 |采纳率93.3%十字交叉法的形式就忘记了,完全燃烧后可以肯定没有甲烷,会有少量的氧气存在.题目中浓硫酸增重等于水蒸气的重量28.8克,所以燃烧生成水是1.6mol,燃烧的方程式是3CH4+5O2--->2CO +CO2+6H2O 所以一氧化碳的是x=8/15 mol 二氧化碳是y=4/15 mol,然后根据分子(原子)的相对质量计算质量就好了.或者直接根据质量来算比较简单.求得一氧化碳的质量a=11.4 二氧化碳的质量是11.8 二氧化碳的质量是9.3.其实我也不知道对不对的.
2CO CO2 6H2O 2CO CO2 6H2O
2 1 6 56 44 108
x y 1.6mol a b 22.81年前查看全部
- 3.0g某物质完全燃烧后生成4.4gCO2和1.8g水.则对该物质相关判断正确的是( )
3.0g某物质完全燃烧后生成4.4gCO2和1.8g水.则对该物质相关判断正确的是( )
A. 该物质只含碳、氢元素
B. 该物质一定含有碳、氢元素,可能含有氧元素
C. 该物质由碳、氢、氧元素组成
D. 该物质分子中碳原子和氢原子的个数比为1:1 无意相遇1年前3
无意相遇1年前3 -
 冥然 共回答了21个问题
冥然 共回答了21个问题 |采纳率90.5%解题思路:根据质量守恒定律,反应前后元素种类、质量均不变,由生成物可以初步确定该物质中含有氢元素和碳元素,由生成的二氧化碳和水中碳、氢元素的质量和与该物质的质量进行对比,从而确定该物质的组成元素.化合物原子的个数比=[元素的质量比/相对原子质量比],可以计算出该物质分子中碳原子和氢原子的个数比为.4.4gCO2中含有碳元素的质量为:4.4g×[12/44]=1.2g,1.8g水中含有氢元素的质量为:1.8g×[1×2/18]=0.2g,生成物4.4g二氧化碳和1.8g水所含碳、氢元素的质量和=1.2g+0.2g=1.4g,1.4g<3g,该物质中含氧元素的质量为:3g-1.4g=1.6g,则该物质中一定含有碳、氢、氧三种元素.
A、由上述分析可知,该物质中一定含有碳、氢、氧三种元素,故选项说法错误.
B、由上述分析可知,该物质中一定含有碳、氢、氧三种元素,故选项说法错误.
C、由上述分析可知,该物质中一定含有碳、氢、氧三种元素,故选项说法正确.
D、根据化合物原子的个数比=[元素的质量比/相对原子质量比],则该物质分子中碳原子和氢原子的个数比为[1.2g/12]:[0.2g/1]=1:2,故选项说法错误.
故选C.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题难度稍大,主要考查了质量守恒定律、化学式的计算,解题的关键是根据质量守恒定律确定物质的元素组成.1年前查看全部
- 耗氧量问题,什么决定物质完全燃烧时消耗的氧气的多少?
耗氧量问题,什么决定物质完全燃烧时消耗的氧气的多少?
什么决定物质完全燃烧时消耗的氧气的多少? marksims1年前2
marksims1年前2 -
 kgzw2007 共回答了18个问题
kgzw2007 共回答了18个问题 |采纳率105.6%如果是有机物的话 那就是碳氢原子数了 4个氢要一个氧气 1个碳要一个氧气
其他的话一般是跟他们的化合价有关系的
燃烧就是氧化反应 一般物质(不是所有)完全燃烧都是常见最高正价 所以通过化合价变化可以来计算1年前查看全部
- 100摄氏度常压 10ml某气态烃与50mlO2混合点燃并完全燃烧后恢复至原状况 剩余气体55m
100摄氏度常压 10ml某气态烃与50mlO2混合点燃并完全燃烧后恢复至原状况 剩余气体55m
100摄氏度常压 10ml某气态烃与50mlO2混合点燃并完全燃烧后恢复至原状况 剩余气体55ml 纳兰四十七若1年前0
纳兰四十七若1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 为什么烃类化合物(包括苯)燃烧时会有浓烟?为什么它们会不完全燃烧?分数全给你哦!
 billylovedog1年前1
billylovedog1年前1 -
 258402006 共回答了16个问题
258402006 共回答了16个问题 |采纳率93.8%因为C的物质的量百分含量过高,而每个原子与O结合生成稳定氧化物的几率是一样的,2个H结合1个O,一个C却要结合2个O,根据概率,可以推得部分C不能与O结合,就会发生不完全燃烧生成C单质颗粒,就变成了浓烟.1年前查看全部
- 某C,H化合物X完全燃烧后生成5.5克二氧化碳和4.5克水,则X的化学式
 xudingguo1年前2
xudingguo1年前2 -
 小蓝迷 共回答了20个问题
小蓝迷 共回答了20个问题 |采纳率95%CO2中含有C元素质量:5.5*12/44=1.5克
H2O中含有H元素质量:4.5*2*18=0.5克
C、H原子个数比为:1.5/12:0.5/1=1:4
化学式为CH4,1年前查看全部
- 将2克碳和7克一氧化碳分别完全燃烧,将产生的二氧化碳分别通入足量的石灰水中,生成沉淀的质量分别为A克和
将2克碳和7克一氧化碳分别完全燃烧,将产生的二氧化碳分别通入足量的石灰水中,生成沉淀的质量分别为A克和
则 A.A=2B B.A=B
C.A=B/3 D.A=B/2 红叶儿1年前3
红叶儿1年前3 -
 vfvf21167 共回答了17个问题
vfvf21167 共回答了17个问题 |采纳率94.1%C--CO2
12 44
2 x
x=88/12g=22/3g
CO--CO2
28 44
7 Y
Y=11g
x:y=2:3
生成的CO2的比是2:3
因为沉淀全部是CO2生成的
沉淀A和B的比就是CO2的比
即A:B=2:3
B=1.5A
没有答案1年前查看全部
- 某有机物A的蒸汽相对氢气的相对密度为49 取9.8g该有机物A完全燃烧后产生的气体通过浓硫酸增重12.6g 再通过氢氧化
某有机物A的蒸汽相对氢气的相对密度为49 取9.8g该有机物A完全燃烧后产生的气体通过浓硫酸增重12.6g 再通过氢氧化钠溶液增重30.8g 若此有机物A能使溴水褪色 在它的同分异构体中主碳链最短 只确定A的分子式.
C7H15 homerlxy1年前5
homerlxy1年前5 -
 chuang061991 共回答了14个问题
chuang061991 共回答了14个问题 |采纳率78.6%某有机物A的蒸汽相对氢气的相对密度为49 说明其分子量为49*2=98
取9.8g该有机物A完全燃烧后产生的气体通过浓硫酸增重12.6g 再通过氢氧化钠溶液增重30.8g
0.1mol该有机物A完全燃烧后产生的气体有水12.6/18=0.7mol CO2=30.8/40=0.77mol
题目 答案 有问题!1年前查看全部
- 定量气态烷烃完全燃烧后,将燃烧产物通过足量石灰水,经过滤得沉淀10g
定量气态烷烃完全燃烧后,将燃烧产物通过足量石灰水,经过滤得沉淀10g
但称量滤液时只减少2.9g,则该气态烷烃可能是
C 2H 6
为什么 selina20001年前1
selina20001年前1 -
 gzd122 共回答了22个问题
gzd122 共回答了22个问题 |采纳率90.9%根据沉淀有10g ,可以算出通入的气体中二氧化碳有4.4g 对应有0.1mol的 C
但称量滤液时只减少2.9g 这说明通入的气体一共有10-2.9=7.1g,那么通入的气体中的水的量就等于7.1-4.4=2.7g,就是0.15mol的水,对应有0.3mol的 H 所以C:H=1:3
只要符合上述比例的气态烷烃都可以,如果是一种烷烃,那就只有乙烷符合.1年前查看全部
- 将0.4mol丁烷完全燃烧后生成的气体全部缓慢通入1L 2mol/L的NaOH中,生成的Na2CO3和NaHCO3的物质
将0.4mol丁烷完全燃烧后生成的气体全部缓慢通入1L 2mol/L的NaOH中,生成的Na2CO3和NaHCO3的物质的量之比为?
 m_j_j_20051年前3
m_j_j_20051年前3 -
 心情舞墨 共回答了23个问题
心情舞墨 共回答了23个问题 |采纳率87%额 楼上失误了 过程结果自相矛盾
1:3
丁烷化学式C4H10,因此0.4mol完全燃烧生成0.4x4=1.6molCO2 跟2molNaOH,
假设生成Na2CO3 Xmol,NaHCO3 Ymol,根据Na元素守恒,我们知道2X+ Y=2
根据C元素守恒,我们知道 X + Y=1.6 所以X=0.4mol,Y=1.2mol 两者之比为1比3
还有分步反应法 因为是缓慢通过
所以可以分别写出2NaOH+CO2=Na2CO3+H2O
Na2CO3+CO2+H2O=2NaHCO3
注意比例系数 计算可得出同样答案1年前查看全部
- 物质的量相同的下列物质完全燃烧时,消耗氧气最多的是?
物质的量相同的下列物质完全燃烧时,消耗氧气最多的是?
A.乙烷 B乙烯 C乙炔D乙醇 slong8271年前1
slong8271年前1 -
 hbgwcy 共回答了15个问题
hbgwcy 共回答了15个问题 |采纳率93.3%A.乙烷
反应结束后,产物是二氧化碳和水.根据质量守恒定律,每摩尔碳原子对应一摩尔氧气,每四摩尔氢原子对应一摩尔氧气,反映物中原有的氧原子应当扣除.因此,乙烷用量最多.1年前查看全部
- 由乙醇蒸汽和乙烯的混合气体aL,当其完全燃烧时,消耗相同状况下氧气的体积为
由乙醇蒸汽和乙烯的混合气体aL,当其完全燃烧时,消耗相同状况下氧气的体积为
求详解 侠女走天下1年前7
侠女走天下1年前7 -
 震慑那 共回答了23个问题
震慑那 共回答了23个问题 |采纳率91.3%设混合气中C2H6OxL,乙烯a-xL由两者的与氧气反应的化学方程式列出关系式:
C2H60----3O2 C2H4----3O2 x 3x a-x 3(a-x)所以消耗相同状况下氧气的体积为3x+3(a-x)=3a L1年前查看全部
- 几个高一化学有机题1. 某有机物12g完全燃烧,生成7.2gH2O和8.96LCO2(标准状况下),0.5mol此有机物
几个高一化学有机题
1. 某有机物12g完全燃烧,生成7.2gH2O和8.96LCO2(标准状况下),0.5mol此有机物的质量为30g.
(1)求分子式
(2)又知此有机物具有弱酸性,能与金属钠反应,也能与碱溶液反应,试写出它可能的结构简式
(解答过程写一下,谢谢)
HOOC-CH=CHCH2OH
1.它可以在一定条件下自身发生酯化反应,写出产物的结构简式
2.他可以发生类似乙烯的加聚反应,写出产物的结构简式 zhijiazhizi1年前4
zhijiazhizi1年前4 -
 平安成都 共回答了12个问题
平安成都 共回答了12个问题 |采纳率100%1.(1)生成的H2O的量为(7.2/18=)0.4mol,
生成的CO2量为(8.96/22.4=)0.4mol,
0.5mol此有机物的质量为30g,则该有机物的分子量为30/0.5=60;
假设该有机物的分子式为CxHyOz(若为烃类则z=0)
燃烧方程式为:
CxHyOz + m O2 ----> n H2O + n CO2 (生成的水和二氧化碳的物质的量相等)
12x+y+16z n n
60 0.4
根据C元素守恒:x=n
根据H元素守恒:y=2n
所以 (12n+2n+16z)/60=n/0.4
讨论:(1) 当z=0时,n=0 不合题意;
(2) 当z=1时,n不为整数解,也不合题意;
(3) 当z=2时,n=2,该分子式为C2H4O2;
(4) 当z>2时,均不合题意
综上,该分子式为C2H4O2
(2)具有若酸性的物质可能是羧酸或者酚类化合物,含有两个C,则只能是羧酸类.所以其结构简式为CH3COOH
2.(1) 如果是双聚脱两分子水成环,则应该是10元环,不稳定.
故只能是双聚脱一分子水:HOOC-CH=CHCH2O-OC-CH=CHCH2OH
(2) COOH CH2OH
| |
-(-CH---CH-)-n1年前查看全部
- (2008•自贡)2008年奥运会火炬“祥云”采用的燃料是丙烷,丙烷完全燃烧时的化学方程式为:R+5O2 点燃
(2008•自贡)2008年奥运会火炬“祥云”采用的燃料是丙烷,丙烷完全燃烧时的化学方程式为:R+5O2
3CO2+4H2O(R代表丙烷),符合“绿色奥运”的要求.由此推断出丙烷的化学式为( )点燃 .
A.C3H4
B.C3H6
C.C3H8
D.CH4 用户姓名1年前1
用户姓名1年前1 -
 185039957 共回答了14个问题
185039957 共回答了14个问题 |采纳率85.7%解题思路:根据质量守恒定律中元素种类不变、原子个数不变的特点,可以确定丙烷的化学式.表示分子中原子个数的数字写在化学式中元素符号的右下角.由丙烷燃烧的化学方程式可以知道:方程式右边含有3个碳原子、8个氢原子、10个氧原子,方程式的左边含有10个氧原子和1个丙烷分子.根据质量守恒定律中元素种类不变、原子个数不变的规律可知:1个丙烷分子含有3个碳原...
点评:
本题考点: 化合价规律和原则;化合价的概念;质量守恒定律及其应用.
考点点评: 本题主要考查根据质量守恒定律元素种类不变和原子个数不变的规律,推断物质的化学式,难度较小.1年前查看全部
- 31克白磷完全燃烧,需要氧气多少克?生成五氧化二磷多少克?
 婧ss1年前4
婧ss1年前4 -
 baoqin 共回答了13个问题
baoqin 共回答了13个问题 |采纳率100%解题思路:根据红磷燃烧生成五氧化二磷反应的化学方程式,由参加反应红磷质量可计算反应生成五氧化二磷的质量和需要的氧气的质量.设生成五氧化二磷的质量为x,需要氧气的质量为y
4P+5O2
点燃
.
2P2O5
124 160 284
31gy x
[124/31g]=[284/x]=[160/y]
解得:x=71g y=40g
答:需要氧气40克;生成五氧化二磷71g.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 根据反应的化学方程式可以表示反应中各物质的质量关系,由反应中某一物质的质量可计算出反应中其它物质的质量.1年前查看全部
- (5分)有机物A是烃的含氧衍生物,1.38gA完全燃烧后,若将燃烧的产物通过碱石灰,碱石灰的质量会增加3.06g;若将燃
(5分)有机物A是烃的含氧衍生物,1.38gA完全燃烧后,若将燃烧的产物通过碱石灰,碱石灰的质量会增加3.06g;若将燃烧产物通过浓硫酸,浓硫酸的质量会增加1.08g;取4.6gA与足量的金属钠反应,生成的气体在标准状况下的体积为1.68L;A不与纯碱反应。该有机物的质谱图中质荷比的最大值是92。通过计算确定A的分子式和结构简式。
 叉嘴米菲兔1年前0
叉嘴米菲兔1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 在标准状态下,16g甲烷完全燃烧所消耗的氧气的分子数为2Na
在标准状态下,16g甲烷完全燃烧所消耗的氧气的分子数为2Na
另外谁能象我详细讲解Na的知识啊,这句话怎么改才对啊?
那不是钠,是阿弗加德罗常数! cycblack1年前1
cycblack1年前1 -
 kfh_07 共回答了13个问题
kfh_07 共回答了13个问题 |采纳率100%需要完全燃烧生成稳定产物,
所以16g甲烷完全燃烧生成CO2所消耗的氧气的分子数为2Na1年前查看全部
- 完全燃烧后生成二氧化碳和水的物质是什么
 huoyue1年前7
huoyue1年前7 -
 灵静flowing 共回答了19个问题
灵静flowing 共回答了19个问题 |采纳率84.2%可能是碳氢化合物,也可能是碳氢氧化合物1年前查看全部
- 1molCH3OH(g)完全燃烧后放出的热量能不能叫燃烧热?
 nicaoll1年前2
nicaoll1年前2 -
 wanzai2001 共回答了13个问题
wanzai2001 共回答了13个问题 |采纳率100%产物必需是25度下的H2O和CO21年前查看全部
- 怎样验证蜡烛不完全燃烧时产生的物质是一氧化碳
怎样验证蜡烛不完全燃烧时产生的物质是一氧化碳
实验方案 换一根较长的导管,并用湿毛巾包住导管,然后在导管另一端做点火实验 若观察到什么现象就能证明蜡烛不完全燃烧时产生一氧化碳 翻车鱼1年前3
翻车鱼1年前3 -
 ahsheng 共回答了23个问题
ahsheng 共回答了23个问题 |采纳率91.3%蓝色火焰.CO的燃烧
燃烧有蓝色火焰的还有:H2,S 不过是淡蓝.1年前查看全部
- 2.44有机物A完全燃烧后,将产物依次通入足量的浓硫酸和足量的石灰水,
2.44有机物A完全燃烧后,将产物依次通入足量的浓硫酸和足量的石灰水,
浓硫酸质量增加1.8g,石灰水质量增加7.04g.实验测得A的蒸汽对H2的相对密度为61.
(1),确定A的分子式.
(2),A有多种同分异构体,其中,能与NaOH溶液反应并且苯环上有两个取代基的同分异构体共有多少种?能与金属钠反应,且苯环上只有一个取代基的同分异构体的结构简式为?
请各位帮我看看,主要第二问,如果能写出过程最好,我对取代基以及能与NaOH溶液反应的有机物实在不知道,如果告诉我什么有机物能够与NaOH溶液反应,我万分感谢.另外,怎么看取代基个数,我看不来, 古人有云1年前3
古人有云1年前3 -
 宝贝男人 共回答了16个问题
宝贝男人 共回答了16个问题 |采纳率93.8%分子量61*2=122
C:H=7.04/44:1.8/9=4:5,H 数为双数时C8H10O,符合分子量
一个苯环,还有两个C,一个氧,
与NaOH反应,为酚,符合【能与NaOH溶液反应并且苯环上有两个取代基的同分异构体】共有3种,邻乙苯酚、间乙苯酚、对乙苯酚.
苯环上一个取代就不是酚,1-苯基乙醇,2-苯基乙醇
C6H5—CH2CH2—OH;CH3—CH(C6H5)—OH.
取代基个数:从环上伸出几根吗,简单的.1年前查看全部
- 含硫的煤不完全燃烧时,排放出污染环境的气体主要是______和______.
 whzdj1年前1
whzdj1年前1 -
 郁闷小猪二世 共回答了16个问题
郁闷小猪二世 共回答了16个问题 |采纳率100%解题思路:煤中主要含有碳元素,还含有少量的硫元素,不完全燃烧时会产生大量的一氧化碳、二氧化硫和烟尘等物质.硫和氧气反应能生成二氧化硫,碳不完全燃烧时能生成一氧化碳,二氧化硫和一氧化碳都是污染环境的物质.
故答案为:CO;SO2.点评:
本题考点: 常用燃料的使用与其对环境的影响.
考点点评: 解答本题要充分理解含硫煤在不完全燃烧的情况下的生成物以及其性质,只有这样才能对相关方面的问题做出正确的判断.1年前查看全部
- 某化合物A完全燃烧,消耗9.6gO2,生成8.8gCO2和5.4gH2o,求该化合物A中所含各元素的质量?
 charles501年前2
charles501年前2 -
 doncan90 共回答了17个问题
doncan90 共回答了17个问题 |采纳率94.1%C元素:8.8g*12/44=2.4g
H元素:5.4g*2/18=0.6g
O元素:8.8g+5.4g-9.6g-2.4g-0.6g=1.6g1年前查看全部
- 某有机物A的摩尔质量为74g.mol,取有机物A3.7g完全燃烧后,生成0.15molCO20.15molH2O.(1)
某有机物A的摩尔质量为74g.mol,取有机物A3.7g完全燃烧后,生成0.15molCO20.15molH2O.(1)计算有机物A的分子式.(2)若有机物A既可与金属钠反应,又可与氢氧化钠和碳酸钠反应,根据A的性质,写出其结构简式,并写出A与上述几种物质反应的其中一个反应方程式.(3)若有机物A为水果香味的液体,它与NaOH溶液共热后蒸馏,所得的氢气的相对密度为16求该有机物的结构简式.
 goldmoon281年前2
goldmoon281年前2 -
 天地不仁之患 共回答了19个问题
天地不仁之患 共回答了19个问题 |采纳率100%1.C3H6O2 2.类别是属于羧酸,结构式是CH3-CH2-COOH 2CH3-CH2-COOH+2Na=2CH3-CH2-COONa+H2 3.CH3-COO-CH31年前查看全部
- 1kg铀全部发生裂变释放出的能量约合2500t优质煤完全燃烧时所放出的能量.(1)这些能量约为多少焦?
1kg铀全部发生裂变释放出的能量约合2500t优质煤完全燃烧时所放出的能量.(1)这些能量约为多少焦?
1kg铀全部发生裂变释放出的能量约合2500t优质煤完全燃烧时所放出的能量.
(1)这些能量约为多少焦?
(2)这些能量最多能使多少千克的水温度升高50℃?[已知煤的热量q=3.4x10的7次方J/kg,水的比热容c=4.2x10的3次方J/(kg·℃)]
答案是(1)8.5x10的3次方J (2)4x10的8次方kg yaowuliao1年前2
yaowuliao1年前2 -
 wjj65678 共回答了20个问题
wjj65678 共回答了20个问题 |采纳率85%第一问,相当于2500t煤燃烧的能量,那就把它求出来,即Q=mq
第二问,m=Q/ct, 其中t=50摄氏度,符号我打不出来,
两问带入具体数字可求.1年前查看全部
- 完全燃烧质量为450千克的汽油,放出多少热量?
 月服王1年前2
月服王1年前2 -
 elsonoo 共回答了19个问题
elsonoo 共回答了19个问题 |采纳率84.2%汽油热值为q=44000kJ/kg,质量为m=450kg,完全燃烧后放出的热量为
Q=mq=1.98×10^7J1年前查看全部
- 求甲醇完全燃烧的热化学方程式~~~~~~~~~~~~~~~~
 Iris10181年前2
Iris10181年前2 -
 清y玉 共回答了19个问题
清y玉 共回答了19个问题 |采纳率89.5%2CH3OH(l)+3O2(g)----->2CO2(g)+4H2O(g) ΔH=-137.2KJ/mol1年前查看全部
- 有关H2密度某液态烃10.6g完全燃烧后生成17.92L(标准状况)CO2和9gH2O,该有机物蒸气密度是相同状况下H2
有关H2密度
某液态烃10.6g完全燃烧后生成17.92L(标准状况)CO2和9gH2O,该有机物蒸气密度是相同状况下H2密度的53倍,此烃分子式为____.
答案是C8H10 我写的C4H5
我知道就在蒸汽密度那出现问题
请问它给个H2蒸汽密度是什么意思?怎么进行计算? xmas661年前1
xmas661年前1 -
 qweqws 共回答了25个问题
qweqws 共回答了25个问题 |采纳率88%该有机物蒸气密度是相同状况下H2密度的53倍
即相对分子质量是氢气的53倍,即1061年前查看全部
- 某烷烃和烯烃的混合气体2.24L(标准状况),点火使其完全燃烧,将燃烧产物通过浓硫酸后,浓硫酸质量增加4.05g;再通过
某烷烃和烯烃的混合气体2.24L(标准状况),点火使其完全燃烧,将燃烧产物通过浓硫酸后,浓硫酸质量增加4.05g;再通过碱石灰,碱石灰质量增加6.60g,另取等量混合气,通入过量溴水中,溴水质量增加1.05g.
(1)通过计算分析知混合气体由______和______组成.
(2)两种烃的物质的量之比是______. 圣西罗清洁工1年前2
圣西罗清洁工1年前2 -
 leange 共回答了23个问题
leange 共回答了23个问题 |采纳率78.3%解题思路:根据有机物燃烧的特点是:有机物中的碳全部转化为二氧化碳,其质量可以根据澄清石灰水质量增加量来确定,有机物中的氢全部转化为水,其质量可以根据浓硫酸质量增加来确定,烯烃和溴单质能发生加成反应,溴水质量增加量就是烯烃的质量,根据水以及二氧化碳的量可以确定碳和氢原子的个数之比.混合气体为[2.24L/22.4L•mol−1]=0.1mol;燃烧后通过浓H2SO4,增重的质量即水的质量为4.05g,即0.225mol,再通过碱石灰,增重的质量即生成CO2的质量为6.60g,即0.15mol;取0.1mol混合物通入溴水,增重的质量即烯烃的质量为1.05g.所以设烷烃、烯烃分别为CxH2x+2、CyH2y,且两种烃的物质的量分别为a,b,则有:1.05g=14y g/mol×b;a+b=0.1mol;0.225mol=[2x+2/2]a+[2y/2]b(H守恒);ax+by=0.15mol(C守恒),解得x=1,y=3,a:b=3:1.
故答案为:(1)甲烷;丙烯;(2)3:1.点评:
本题考点: 有机物实验式和分子式的确定;有关混合物反应的计算.
考点点评: 本题考查学生燃烧法确定有机物分子组成的知识,可以根据所学知识来进行,难度不大.1年前查看全部
- 证明某有机物属于烃的含氧衍生物,应完成的实验内容是( ) A.只有验证它完全燃烧后产物只有H 2 O和CO 2
证明某有机物属于烃的含氧衍生物,应完成的实验内容是( )
A.只有验证它完全燃烧后产物只有H 2 O和CO 2 B.只有测定其燃烧产物中H 2 O和CO 2 物质的量的比值 C.测定完全燃烧时消耗有机物与生成的CO 2 、H 2 O的物质的量之比 D.测定该试样的质量及其试样完全燃烧后生成CO 2 和H 2 O的质量  天下4881年前1
天下4881年前1 -
 低烧看客 共回答了26个问题
低烧看客 共回答了26个问题 |采纳率84.6%D
1年前查看全部
- 20g红磷完全燃烧可生成多少克五氧化二磷(精确到0.1克)?同时消耗的氧气在标准状况下的体积是多少升?(标准状况下,氧气
20g红磷完全燃烧可生成多少克五氧化二磷(精确到0.1克)?同时消耗的氧气在标准状况下的体积是多少升?(标准状况下,氧气的密度是1,43g/L)(精确到0.01g/L)
 mikotutu1年前5
mikotutu1年前5 -
 浪亠 共回答了13个问题
浪亠 共回答了13个问题 |采纳率76.9%解题思路:红磷燃烧是和氧气反应生成了五氧化二磷,根据该反应的化学方程式和红磷的质量,可计算出需要氧气以及生成的五氧化二磷的质量;然后根据密度公式可计算出这些氧气在标准状况下的体积.设6.2g红磷完全燃烧需要氧气的质量为x,生成五氧化二磷的质量为y
4P+5O2
点燃
.
2P2O5
124 160 284
20g x y
[124/20g=
160
x=
284
y]
x≈25.8g
y≈39.4g
所需氧气的体积为:[25.8g/1.43g/L]≈18L
答案:20g红磷完全燃烧可生成39.4克五氧化二磷,同时消耗的氧气在标准状况下的体积是18L点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题为基础的化学方程式的计算,但由于结合了气体的密度使得本题计算难度扩大,解答时注意密度公式的变形的应用.1年前查看全部
- 1.今有氢气和一氧化碳(体积比为1:2)的混合气体VL,当其完全燃烧时.所需要氧气的体积为?
1.今有氢气和一氧化碳(体积比为1:2)的混合气体VL,当其完全燃烧时.所需要氧气的体积为?
2.如果ag某气体中所含有的分子数为b,则cg该气体在标准状况下的体积是?(用N1表示)
3.300ml某浓度的NaOH溶液中含有60g溶质,现欲配制1molLNaOH溶液,应取原溶液与蒸馏水的体积比约为? 两个天蝎1年前6
两个天蝎1年前6 -
 gkf1893 共回答了21个问题
gkf1893 共回答了21个问题 |采纳率95.2%1.
2H2 + O2==2H2O
2CO+O2==== 2CO2
从这两个反应看氢气和一氧化碳无论以什么比混合完全燃烧时消耗氧气体积比为2:1
所以氧气体积为:0.5 V L
2.
ag某气体中含有的分子数为b
则cg某气体中含有的分子数为bc/a
∴含有bc/aNA mol的分子
∴体积V=Vm*n=22.4bc/aNA
3.设取a升的原溶液,需要x升的蒸馏水
原溶液的摩尔浓度为:
[60/(23+13+1)]/0.3=1.5/0.3mol/L=5mol/L
.
[5*a]/[a+x]=1,
所以
x=4a.
即取原溶液与蒸馏水的体积比约为1:4.1年前查看全部
- 关于热机的物理选择题下面哪一个是正确的A 热值大的燃料比热值小的燃料完全燃烧时放出的热量多B 柴油机工作是,燃料燃烧没放
关于热机的物理选择题
下面哪一个是正确的
A 热值大的燃料比热值小的燃料完全燃烧时放出的热量多
B 柴油机工作是,燃料燃烧没放出1J热量,就可以得到1J的机械能
C 热机的效率越大,它的功率就越大
D 柴油机的效率一般比汽油机高,就是说完成相同的有用功,柴油机所有的燃料完全燃烧放出的能量比汽油机少
要一个个解释原因.
谢谢各位. elephantnj1年前1
elephantnj1年前1 -
 7vde 共回答了21个问题
7vde 共回答了21个问题 |采纳率81%选D
A 表面上是这样,可是你要看热值大的燃料被燃烧的程度,再来做比较
B 热机效率和机械效率是一样的,它们的值都<1
C 热机的效率是和功率无关的
D 他们所比较的,就是额外功,柴油机在做功冲程中,才运用燃料,所消耗的燃料也较少,额外功就比较少
懂了没?还可以再问我哦.1年前查看全部
- 若有16g的甲醇完全燃烧可生成二氧化碳多少克
 北海漂流瓶1年前2
北海漂流瓶1年前2 -
 玲珑蕊 共回答了14个问题
玲珑蕊 共回答了14个问题 |采纳率100%设16g甲醇完全燃烧生成二氧化碳的质量是x.
2CH3OH+3O2=点燃=2CO2+4H2O
64 88
16g x
64/16=88/x
x=22g
答:16g甲醇完全燃烧生成二氧化碳22g.1年前查看全部
- 下列物质中,属于烷烃特征的是? A完全燃烧产物只有二氧化碳和水B它们几乎不溶于水
下列物质中,属于烷烃特征的是? A完全燃烧产物只有二氧化碳和水B它们几乎不溶于水
C分子通式为CnH2n+2,与氯气发生取代反应D它们是非电解质 yeeming1年前2
yeeming1年前2 -
 树杈上的小巫婆 共回答了14个问题
树杈上的小巫婆 共回答了14个问题 |采纳率78.6%C分子通式为CnH2n+2,与氯气发生取代反应
ABD是有机物通有的性质1年前查看全部
- 1.06克某有机化合物A完全燃烧后,得到1.79LCO2气体(标况)和0.90克H2O,该有机物对空气相对密度是3.66
1.06克某有机化合物A完全燃烧后,得到1.79LCO2气体(标况)和0.90克H2O,该有机物对空气相对密度是3.66
求分子式 正米小雪1年前2
正米小雪1年前2 -
 mmenghuang2000 共回答了16个问题
mmenghuang2000 共回答了16个问题 |采纳率93.8%分子式是C8H10.
CO2的物质的量是n=V/Vm=1.79/22.4=0.08mol
H2O的物质的量是n=m/M=0.9/18=0.05mol
1个CO2含有1个C原子,所以C原子的物质的量是0.08mol,质量是0.08*12=0.96g
1个H2O含有2个H原子,所以H原子的物质的量是0.1mol,质量是0.1*1=0.1g
C和H元素的质量和是0.96+0.1=1.06g,所以该物质只含有C、H元素,没有O元素,最简式是C8H10.
相对密度比等于相对分子质量之比,空气的平均相对分子质量为29,有机物的相对分子质量为3.66*29=106,(8*12+10)x=106,x=1,所以化学式是C8H10.1年前查看全部
大家在问
- 1有没有人知道“高智商犯罪”用英语怎么说
- 2设等差数列\a\满足a2=17,a5=11,An=a1+a2.+an,An最大值,求{\a\}的前n项和
- 3一个日字旁一个斤怎么念
- 41+2+3+…+999+1000+1001的和是奇数还是偶数?请写出理由.
- 5在等差数列中,若a2+a5=17,a2a5=50,且a5>a2,求a5及an
- 6a1=1 a2=2 a3=5 a4=10 a5=17 ……求这个的规律
- 7a4=18-a5,a4+a5=18,S8=8(a1+a8)/2,问:括号外面的8是怎么得的?
- 8表白 的英语怎么说一个男生不敢像一个女生表白的表白用那个词 confess 我查了好象不对
- 9为什么大家都说吸气时肺内气压减小?
- 10周长是26厘米的长方形,长是9厘米,面积是()
- 11400加仑等于多少?我这人 脑子笨 你就告诉我多少吨 矿泉水瓶算大概多少瓶?
- 12加仑等于多少公斤
- 13"情人节快乐"用英文如何表达?
- 14情人节快乐的英文词语怎么说
- 1516,13,23的最小公倍数如题好 十六分之五 十三分之四 二十三分之六 哪个大?
