炼铁的原理是利用一氧化碳与氧化铁实验后停止加热的原因
 新燕啄泥2022-10-04 11:39:541条回答
新燕啄泥2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 玩股不累 共回答了13个问题
玩股不累 共回答了13个问题 |采纳率69.2%- 停止加热后继续通一氧化碳到试管中冷却的目的防止生成的铁被空气氧化,因为这时候铁的温度较高,与空气接触就会被氧化.
- 1年前
相关推荐
- 某炼铁厂用1000吨含氧化铁为80%的赤铁矿冶炼生铁,该厂理论上可日产纯铁的质量是多少?
 huangzn3091年前2
huangzn3091年前2 -
 鎏法世家 共回答了18个问题
鎏法世家 共回答了18个问题 |采纳率94.4%按你的意思 就是800吨Fe2O3还原成多少Fe.
800×56×2/(56×2+16×3)=560(吨)
其实高炉炼铁并非纯铁而是生铁,因此一般计算为:
800×56×2/(56×2+16×3)/0.96=583.33(吨)1年前查看全部
- 现有磁铁矿 黄铁矿 赤铁矿 .请从多种角度分析三种矿石中哪种不适合同来炼铁---,原因是?
 mixib1年前2
mixib1年前2 -
 lechang531 共回答了25个问题
lechang531 共回答了25个问题 |采纳率92%黄铁矿是铁与硫的化合物,工业上用来制取硫酸,焙烧后的炉渣含有大量的铁,在拿来炼铁,赤铁矿与磁铁矿都是工业上炼铁的主要原料,黄铁矿因为含大量的硫,在焙烧前是绝对不能炼铁的,因为黄铁矿较易燃烧,只有经过焙烧,将其中的硫取代为氧后才能用来炼铁1年前查看全部
- 高炉中炼铁主要是利用一氧化碳与赤铁矿(主要成分是Fe2O3)反应来得到铁,其...CO2+C
高炉中炼铁主要是利用一氧化碳与赤铁矿(主要成分是Fe2O3)反应来得到铁,其...CO2+C
高炉中炼铁主要是利用一氧化碳与赤铁矿(主要成分是Fe2O3)反应来得到铁,其化学方程式为3CO+Fe2O3=====2Fe+3CO2,现用足量的一氧化碳与1.25克不纯的氧化铁发生反应,将反应中生成的CO2通入澄清石灰水中,得到白色沉淀1.64千克,求氧化铁粉末的纯度 cudicini1年前1
cudicini1年前1 -
 wangxin8888 共回答了28个问题
wangxin8888 共回答了28个问题 |采纳率89.3%数据有误,核实后再问
一氧化碳与1.25克 怎么可能得到白色沉淀1.6kg?1年前查看全部
- 工业炼铁的原理是?不是化学方程式
 爱上你八是我的错1年前1
爱上你八是我的错1年前1 -
 sanrlian 共回答了18个问题
sanrlian 共回答了18个问题 |采纳率94.4%碳在高温下反应生成二氧化碳和一些一氧化碳,二氧化碳又在高温下被碳还原成一氧化碳,一氧化碳还原氧化铁,然后就是铁了1年前查看全部
- 用含杂质20%的赤铁矿2000t炼铁,在炼制过程中损失率为5%,试计算最多可以练出含杂质3%的生铁多少吨?
 stellandrea1年前1
stellandrea1年前1 -
 准备干了 共回答了17个问题
准备干了 共回答了17个问题 |采纳率82.4%含杂质20%的赤铁矿2000t含Fe2O3是2000*(1-20%)=1600t
中间损失率为5%,不损失的是1600*(1-5%)=1520t
设最多可以练出含杂质3%的生铁的质量为x.
Fe2O3+3CO=高温=2Fe+3CO2
160 112
1520t (1-3%)x
160/1520=112/97%x
x=1097t
答:最多可以练出含杂质3%的生铁1097t.1年前查看全部
- 增加炼铁高炉的高度 为什么可以降低高炉其中CO的含量?
 叉烧4包1年前2
叉烧4包1年前2 -
 memories1 共回答了23个问题
memories1 共回答了23个问题 |采纳率82.6%增加高炉的高度等于延长了可燃物一氧化碳的燃烧时间、一氧化碳含量就会减少1年前查看全部
- 某磁铁矿石样品中含Fe3O4 76%,其他不含铁的杂志24%.计算这种矿石中铁的质量分数.某炼铁厂用这种磁铁矿石冶炼生铁
某磁铁矿石样品中含Fe3O4 76%,其他不含铁的杂志24%.计算这种矿石中铁的质量分数.某炼铁厂用这种磁铁矿石冶炼生铁.该厂日消耗这种磁铁矿石100t,该厂理论上年产含铁96%的生铁的质量是多少?
 破茧A1年前1
破茧A1年前1 -
 wiib2001 共回答了20个问题
wiib2001 共回答了20个问题 |采纳率95%Fe3O4中铁的质量分数56*3/(56*3+16*4)约等于72%,所以100t矿石里面含铁元素100*76%*72%=54.72t,生产含铁96%的生铁,所以生铁质量54.72/96%=57t,所以最后答案57t1年前查看全部
- 工业上用含氧化铁480t的赤铁矿为原料炼铁,得到含杂质4%的生铁.求 氧化铁、纯铁、生铁 的质量.
工业上用含氧化铁480t的赤铁矿为原料炼铁,得到含杂质4%的生铁.求 氧化铁、纯铁、生铁 的质量.
写出完整的计算过程. hhx0011年前1
hhx0011年前1 -
 为水痴狂 共回答了16个问题
为水痴狂 共回答了16个问题 |采纳率93.8%设:纯铁Xt,生铁 yt.
如果题目没有错误的话,氧化铁的质量题目已告诉,480t
Fe2O3+3CO=2Fe+3CO2
160 56*2=112
480 x
160:112=480:x
x=336t
y=336/(1-4%)=350t
答:.
如果题目告诉赤铁矿中氧化铁得到含量,就用赤铁矿的质量乘以氧化铁的含量求出氧化铁的质量,再仿照上面计算纯铁,生铁的质量.1年前查看全部
- 某炼铁厂用含杂质20%的赤铁矿(主要成分是氧化铁)冶炼生铁.求800t这种矿石可炼出含杂质20%的生铁多少t?
 gxbwy1年前1
gxbwy1年前1 -
 安静搁浅 共回答了24个问题
安静搁浅 共回答了24个问题 |采纳率87.5%生铁含Fe=矿石含Fe
Fe2O3含铁2*56/(2*56+3*16)=70%
W铁*80%=800*80%*70%
W铁=560吨.1年前查看全部
- 某炼铁厂用赤铁矿来炼铁,赤铁矿主要成分是氧化铁.该厂每天要生产5600t铁
某炼铁厂用赤铁矿来炼铁,赤铁矿主要成分是氧化铁.该厂每天要生产5600t铁
铁元素在氧化铁中的质量分数是多少?每天要多少吨氧化铁?若赤铁砂中氧化铁质量分数为80%,那么每天要多少吨赤铁矿?如用含四氧化三铁60若磁铁矿代替赤铁矿,要磁铁矿多少吨? 有关部门来了1年前1
有关部门来了1年前1 -
 jialiyanghui 共回答了17个问题
jialiyanghui 共回答了17个问题 |采纳率94.1%需赤铁矿:160/112/0.8=1.78吨,1.78*5600=10000吨
需磁铁矿:232/168/0.6=2.30吨 ,2.3*5600=12880吨1年前查看全部
- 下列说法中正确的是( )A.用完的干电池可以随意地丢弃B.增加炼铁高炉的高度不可以降低尾气中CO的含量C.使用催化剂一
下列说法中正确的是( )
A.用完的干电池可以随意地丢弃
B.增加炼铁高炉的高度不可以降低尾气中CO的含量
C.使用催化剂一定能加快化学反应速率
D.把煤粉碎了再燃烧可以降低环境污染 Jaros_Liu1年前1
Jaros_Liu1年前1 -
 zzheron 共回答了17个问题
zzheron 共回答了17个问题 |采纳率82.4%解题思路:A.干电池会造成环境污染;
B.增加炼铁高炉的高度不能减少CO的产生;
C.催化剂是指能够改变其他物质的化学反应速率,但本身的质量和化学性质在化学反应前后保持不变的物质;
D.煤块燃烧时,将煤块粉碎成煤粉是为了使煤与空气充分接触.A.随意丢弃废旧干电池会造成环境污染,故A错误;
B.增加炼铁高炉的高度不能减少CO的产生,故B正确;
C.催化剂是改变化学反应速率,不一定是加快,故C错误;
D.把煤粉碎了再燃烧不能改变煤的成分,不改变煤的燃烧产物,不降低环境污染,故D错误.
故选B.点评:
本题考点: 燃料的充分燃烧;高炉炼铁;化学反应速率的影响因素.
考点点评: 本题考查环境污染,高炉炼铁,催化剂和燃料燃烧,注意催化剂是改变化学反应速率,不一定是加快.1年前查看全部
- 有一种铁矿石,4.5吨可以炼铁2.88吨,平均每吨可以炼铁多少吨?要炼八吨铁,需要这种矿石多少吨?
 艾雅微1年前1
艾雅微1年前1 -
 my_xqh 共回答了15个问题
my_xqh 共回答了15个问题 |采纳率86.7%平均每吨可以炼铁:2.88÷4.5=0.64吨
要炼八吨铁,需要这种矿石:0.64×8=5.12吨1年前查看全部
- 赤铁矿石是炼铁的重要原料,其主要成分为氧化铁(Fe 2 O 3 )。请计算:
赤铁矿石是炼铁的重要原料,其主要成分为氧化铁(Fe 2 O 3 )。请计算:
(1)氧化铁中铁、氧元素的质量比为______________。
(2)80g氧化铁中含有的铁元素的质量为___________g。 红花漫漫1年前1
红花漫漫1年前1 -
 碎轨 共回答了22个问题
碎轨 共回答了22个问题 |采纳率95.5%(1)7:3
(2)561年前查看全部
- MgO是否能加入炼铁中 于CO2反应在生成co 炼 铁
 羽毛_光年1年前2
羽毛_光年1年前2 -
 同肥 共回答了15个问题
同肥 共回答了15个问题 |采纳率93.3%炼铁中一般加入石灰石(CaCO3),高温下分解得到CaO:
CaCO3 = CaO + CO2
生成的CaO也不会与CO2反应,而是除掉铁中的硅:
CaO + SiO2 = CaSiO3
形成炉渣,浮在铁水表面,同时可以保护铁水的氧化烧损.1年前查看全部
- 在化学中用Fe2O3炼铁还是用Fe3O4炼铁?
在化学中用Fe2O3炼铁还是用Fe3O4炼铁?
如果都行的话,那个更好,为什么? wzzj1231年前1
wzzj1231年前1 -
 123199385 共回答了15个问题
123199385 共回答了15个问题 |采纳率100%都行,四氧化三铁会更好 因为等质量的四氧化三铁和三氧化二铁,四氧化三铁能炼出更多的铁,且排出更少二氧化碳1年前查看全部
- 回答这样几个问题 1铁具有金属通性,即___,____,_____ 2分离铁粉和硫粉的最佳方法是( ) 3铁砂石炼铁的主
回答这样几个问题 1铁具有金属通性,即___,____,_____ 2分离铁粉和硫粉的最佳方法是( ) 3铁砂石炼铁的主要原理是( ) 其主要化学方程式( ) 4钢铁电化腐蚀为( )和( ) 金属防护的措施有( ) 我在预习,所以请回答的详细点,一题题对应,另加追赏
 gcrd1年前1
gcrd1年前1 -
 xierui16800 共回答了18个问题
xierui16800 共回答了18个问题 |采纳率100%1、具有金属光泽,单质导热导电性好,在化学反应中失去电子 2、用磁铁吸引 3、C在O2不足下生成CO,CO具有还原性,能把FE从氧化态还原成单质 3CO+FE2O3===高温===2FE+3CO2 吸氧腐蚀,析氢腐蚀 这个给你解释一下. 吸氧腐蚀发生在中性和碱性条件下,发生的电极反应是Fe-2e-===Fe2+,O2+2H2O+4e-====4OH-,OH-和Fe2+和空气中的O2反应生成Fe(OH)3,这个反应是4Fe(OH)2+O2+2H2O==4Fe(OH)3,因为正极的反应吸收氧气,所以叫吸氧腐蚀. 析氢腐蚀发生在酸性环境下,其实就是铁加到酸里,Fe-2e-===Fe2+,2H+ +2e-===H2↑ 自然情况下吸氧腐蚀较普遍,析氢腐蚀只发生在空气中含大量酸性气体的化工厂周围,而考试考察的频繁的也是吸氧腐蚀,建议熟记. 4、加入其他金属组成合金 外加电流 牺牲阳极法 外表镀上其他金属或刷油漆.
求采纳1年前查看全部
- 某炼铁厂用含氧化铁80%的赤铁矿冶炼生铁.若要炼出1120t含铁95%的生铁,需要含氧化铁80%的赤铁矿多少吨?(反应方
某炼铁厂用含氧化铁80%的赤铁矿冶炼生铁.若要炼出1120t含铁95%的生铁,需要含氧化铁80%的赤铁矿多少吨?(反应方程式Fe2O3+3CO
2Fe+3CO2)高温 . 秦小绵1年前1
秦小绵1年前1 -
 wty1706 共回答了18个问题
wty1706 共回答了18个问题 |采纳率94.4%解题思路:这是一道一题多解的题目,可利用化学式计算也可利用化学方程式计算,但不管是哪种方式计算时先要把不纯的物质转化为纯净物计算,一般是混合物的质量乘以这种物质中纯净物的质量分数即为这种纯净物的质量.设需要含氧化铁80%的赤铁矿的质量为x
3CO+Fe2O3
高温
.
2Fe+3CO2
160112
x•80% 1120t•95%
x=[160•1120t•95%/112•80%]=1900t
答:需要含氧化铁80%的赤铁矿1900吨.点评:
本题考点: 含杂质物质的化学反应的有关计算.
考点点评: 此题是对含杂质物质的有关计算,问题的关键是首先解决纯净物与混合物的相互转化,利用混合物的质量乘以某种物质的质量分数即为这种纯净物质的质量,并结合化学式或化学方程式是解决这类题目的关键.1年前查看全部
- 炼铁产生的炉渣中氧化镁含量过高怎么去除?
 黄老师11年前1
黄老师11年前1 -
 rely 共回答了23个问题
rely 共回答了23个问题 |采纳率82.6%高炉炉渣氧化镁含量适当高可以增加炉渣流动性及稳定能力;一般不大于12%;若过高会造成炉渣熔化性温度过高,不利于高炉顺行及燃料比升高;方法:高炉不能去除氧化镁,氧化镁100%进入炉渣;只能通过降低烧结矿氧化镁含量和改变炉料结构来降低(实践中都不难做到)1年前查看全部
- 含杂质20%赤铁矿(成分氧化铁)炼铁.求1120t这种赤铁矿理论上可以炼的含杂质4%生铁
 锦上不添花1年前1
锦上不添花1年前1 -
 我们的烟火 共回答了14个问题
我们的烟火 共回答了14个问题 |采纳率92.9%Fe2O3+3CO=高温=2Fe+3CO2
160 112
1120t*(1-20%) x*(1-4%)
x=653.33t1年前查看全部
- 一种铁矿石,每一吨可以炼铁0.605吨,100千克这样的铁矿石可以炼铁多少千克?
 kyky991年前7
kyky991年前7 -
 happytf 共回答了28个问题
happytf 共回答了28个问题 |采纳率92.9%100千克=0.1吨
0.1×0.605=0.0605吨=60.5千克
答:可以炼铁60.5千克.1年前查看全部
- 关于金属铁、铜,下列说法中:①自然界中均有游离态单质存在②炼铁的矿石主要有赤铁矿、磁铁矿、硫铁矿
关于金属铁、铜,下列说法中:①自然界中均有游离态单质存在②炼铁的矿石主要有赤铁矿、磁铁矿、硫铁矿
③工业炼铁的主要设备是沸腾炉④炼铁中所用还原剂是CO⑤生铁、钢、黄铜都属于合金⑥铁的颜色是银白色,铜显紫红色⑦铜常温下可溶于稀硝酸,
上述说法正确的是( )
A①④⑤⑥⑦
B②④⑥
C③④⑥⑦
D全部
求详解.谢谢.
 只讲标准普通话1年前1
只讲标准普通话1年前1 -
 eeeliu 共回答了21个问题
eeeliu 共回答了21个问题 |采纳率85.7%错误.Fe、Cu都没有游离态.正确.赤铁矿Fe2O3,磁铁矿Fe3O4,硫铁矿FeS2错误.沸腾炉主要应用于接触法制硫酸,作为FeS2制SO2的发生装置正确.Fe2O3 + 3 CO ==高温== 2 Fe + 3 CO2
正确.生铁、钢、黄铜分别属于铁合金、铁合金、铜合金.错误.纯铁是银白色,铁粉是黑色.以偏概全.正确.3 Cu + 8 HNO3(稀) = 3 Cu(NO3)2 + 2 NO↑+ 4 H2O
不知道选哪个.你看着办吧1年前查看全部
- 我市某县有较丰富的煤炭和石灰岩资源,当地利用这些资源进行炼焦、炼铁。写出在炼铁过程中涉及到的以下两个反应的化学方程式。
我市某县有较丰富的煤炭和石灰岩资源,当地利用这些资源进行炼焦、炼铁。写出在炼铁过程中涉及到的以下两个反应的化学方程式。
(1)石灰石(主要成分为CaCO 3 )高温分解________;
(2)赤铁矿(主要成分为Fe 2 O 3 )在高温下与一氧化碳反应______。 难珂一梦1年前0
难珂一梦1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 高温下,炼铁高炉中存在下列平衡:FeO(s)+CO(g)⇌Fe(s)+CO2(g)△H>0
高温下,炼铁高炉中存在下列平衡:FeO(s)+CO(g)⇌Fe(s)+CO2(g)△H>0
试回答下列问题:
(1)铁在元素周期表中位于______周期______族.
(2)写出该反应的平衡常数表达式:K=c(CO2) c(CO) K=,升高温度,该反应的平衡常数K值将______(填“增大”、“减小”或“不变”,下同),平衡体系中固体的质量将______.c(CO2) c(CO)
(3)为减少高炉冶铁时,含有CO的尾气排放,下列研究方向不可取的是______.
A.其它条件不变,增加高炉的高度 B.调节还原时的炉温
C.增加原料中焦炭与赤铁矿的比例 D.将生成的铁水及时移出
(4)1100℃时,FeO(s)+CO(g)⇌Fe(s)+CO2(g),平衡常数K=0.4.今在一密闭容器中,加入7.2g的FeO,同时通入4.48L的CO气体(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为______.(精确到0.1%) mm12131年前1
mm12131年前1 -
 109753004 共回答了15个问题
109753004 共回答了15个问题 |采纳率100%解题思路:(1)根据元素周期表的编排规律以及铁元素的位置知识来回答;
(2)化学平衡常数K=[生成物平衡浓度系数次方的乘积/反应物平衡浓度系数次方的乘积],根据温度与平衡常数的关系来回答;
(3)根据化学平衡移动的影响因素知识来判断;
(4)令转化率的CO的物质的量为xmol,根据三段式用x表示出平衡时一氧化碳与二氧化碳的浓度,代入平衡常数计算x值,根据方程式可知转化的FeO的物质的量n(FeO)=n(CO),计算转化的FeO质量,最后利用转化率定义计算.(1)金属铁元素在周期表中的位置是:第四周期,第ⅤⅢ族,故答案为:四、Ⅷ;
(2)FeO(s)+CO(g)⇌Fe(s)+CO2(g)的平衡常数K=
c(CO2)
c(CO),该反应是吸热反应,升高温度,化学平衡正向移动,该反应的平衡常数K值将增大,生成的固体铁的质量会比原来氧化亚铁的质量少,故答案为:
c(CO2)
c(CO);增大;减小;
(3)为减少高炉冶铁时含有CO的尾气排放,使得化学平衡FeO(s)+CO(g)⇌Fe(s)+CO2(g)正向移动的因素均可以.
A.其它条件不变,增加高炉的高度,不会引起化学平衡的移动,不可取,故A正确;
B.升高还原时的炉温,会引起化学平衡正向移动,可取,故B错误;
C.增加原料中焦炭与赤铁矿的比例,化学平衡不会发生移动,不可取,故C正确;
D.将生成的铁水及时移出,不会引起化学平衡的移动,不可取,故D正确.
故选ACD.
(4)(5)4.48LCO(已折合为标准状况)物质的量为[4.48/22.4]=0.2mol,令转化率的CO的物质的量为xmol,则:
FeO(s)+CO(g)⇌Fe(s)+CO2(g),
开始(mol):0.2 0
变化(mol):x x
平衡(mol):0.2-x x
一氧化碳的系数等于二氧化碳的系数,故可以用物质的量代替浓度计算平衡常数,所以[x/0.2−x]=0.4,解得x=[2/35]mol,由方程式可知,转化的FeO的物质的量n(FeO)=n(CO)=[2/35]mol,所以FeO的转化率为
2
35×72
7.2×100%=57.1%,即FeO的转化率为57.1%.
故答案为:57.1%.点评:
本题考点: 化学平衡常数的含义;化学平衡的调控作用;化学平衡的计算.
考点点评: 本题涉及化学平衡常数的意义、化学平衡移动的影响因素以及化学平衡转化率的有关计算等知识,属于综合知识的考查,难度不大.1年前查看全部
- 高2化学题目在炼铁高炉中发生的主要反应如下(1)炉腹 鼓入热空气,产生还原剂CO并放出大量的热,反应的方程式______
高2化学题目
在炼铁高炉中发生的主要反应如下
(1)炉腹 鼓入热空气,产生还原剂CO并放出大量的热,反应的方程式__________________________
(2)炉身 铁被还原,并+其他物质融合为生铁,其中主要的化学方程式为____________________________
(3)炉腰 石灰石跟脉石反应生成渣,化学方程式为_________________________________ plp7s8k1年前1
plp7s8k1年前1 -
 3k1091 共回答了16个问题
3k1091 共回答了16个问题 |采纳率75%1.2C+O2=2CO
2.Fe2O3+3CO=2Fe+3CO2
3.Ca2++SiO32-=CaSiO3(沉淀)
有点忘了1年前查看全部
- 下列说法中不正确的是( )A.生铁的含碳量比钢多B.生铁和钢都是铁的合金C.球墨铸铁机械强度较差,主要用于炼钢D.炼铁
下列说法中不正确的是( )
A.生铁的含碳量比钢多
B.生铁和钢都是铁的合金
C.球墨铸铁机械强度较差,主要用于炼钢
D.炼铁的主要设备是高炉,炼钢的主要设备是转炉、电炉或平炉 摩苏明克1年前1
摩苏明克1年前1 -
 海红 共回答了19个问题
海红 共回答了19个问题 |采纳率89.5%解题思路:A、生铁的含碳量是2%--4.3%,钢的含碳量是0.03%--2%;
B、合金是指由一种金属与其它金属或非金属熔合而成的具有金属特性的物质;
C、球墨铸铁具有很高的机械强度;
D、炼铁的设备是高炉,炼钢设备有转炉、电炉和平炉.A、生铁的含碳量比钢多.正确;
B、生铁和钢的主要成分是铁,还含有碳等物质,都是铁的合金.正确;
C、球墨铸铁具有很高的机械强度.错误;
D、炼铁的主要设备是高炉,炼钢的主要设备是转炉、电炉或平炉.正确.
故选C.点评:
本题考点: 生铁和钢.
考点点评: 本题主要考查合金、钢和铁的性质、炼铁和炼钢设备等方面的知识,解答时要理解根据铁中含碳量的高低可以把铁的合金分为生铁和钢.1年前查看全部
- 工业炼铁中加石灰石将二氧化硅变成炉渣排出,为什么不能将二氧化硅还原成硅呢?
工业炼铁中加石灰石将二氧化硅变成炉渣排出,为什么不能将二氧化硅还原成硅呢?
工业炼铁中二氧化硅影响生铁的质地、添加石灰石将二氧化硅变成炉渣排放.可是炉渣并没有太大的利用价值、为什么不利用这个SiO2 + 2C ==高温== Si + 2CO↑ 将二氧化硅还原成粗硅呢?硅有很好的利用价值啊、 而且生成的一氧化碳还可以进一步炼铁阿、 这个问题硪实在想不明白、谁能帮我解决下?
…… 沉埃1年前1
沉埃1年前1 -
 kaleipzig 共回答了14个问题
kaleipzig 共回答了14个问题 |采纳率78.6%石灰石将二氧化硅变成炉渣,它的主要成分为硅酸钙,能被用于水泥业.
利用这个SiO2 + 2C ==高温== Si + 2CO↑这是你个人的想法,生成的硅会进入生成的铁中,影响铁的质量.
小朋友,不要那么大的气,你有一些很好的想法是好事,但愿你能从这个研究中解决世界冶金方向的一个问题,进而改变冶金技术,这样,你对全人类的贡献就大了.努力吧,祝你成功!1年前查看全部
- 某炼铁企业以焦炭、赤铁矿等为主要原材料炼铁,反应过程如图:
某炼铁企业以焦炭、赤铁矿等为主要原材料炼铁,反应过程如图:

(1)过程①中发生的反应属于______反应(选填“化合”“分解”“置换”“复分解”之一),过程③是利用了一氧化碳的______(选填“氧化性”“还原性”之一).
(2)列举一例防止钢铁锈蚀的具体措施:______.
(3)试用化学方程式计算:该企业用1000t含氧化铁80%的赤铁矿可炼得金属铁多少吨? 游戏中的王者1年前1
游戏中的王者1年前1 -
 天空深蓝 共回答了15个问题
天空深蓝 共回答了15个问题 |采纳率93.3%解题思路:(1)根据反应物、生成物的数量和种类来分析;根据一氧化碳的性质来分析;
(2)根据钢铁锈蚀的条件来分析;
(3)由赤铁矿石的质量、氧化铁的质量分数,根据赤铁矿炼铁的化学方程式可以列式计算出炼出铁的质量即可.(1)过程①发生的是:焦炭在高温条件下能和氧气反应生成二氧化碳,符合“多变一”的特征,属于化合反应;过程③是:氧化铁在高温条件下能够一氧化碳反应生成铁和二氧化碳,此反应中体现了一氧化碳具有还原性;
(2)铁与氧气和水接触时容易生锈.要防止钢铁生锈,就要把钢铁与空气和水隔绝,如保持钢铁的表面洁净干燥,镀一层金属,涂一层油漆等;
(3)氧化铁的质量为:1000t×80%=800t
设理论上可以炼铁的质量为x.
Fe2O3+3CO
高温
.
2Fe+3CO2
160112
800t x
[160/112=
800t
x]
x=560t
答:可炼得金属铁的质量为560t.
故答案为:(1)化合;还原性;
(2)刷油漆、镀其他金属、表面涂油等合理均可;
(3)560t.点评:
本题考点: 铁的冶炼;含杂质物质的化学反应的有关计算;金属锈蚀的条件及其防护;反应类型的判定.
考点点评: 本题难度不大,考查含杂质物质的化学方程式的计算,注意代入方程式计算的必须是纯物质的质量是正确解答此类题的关键.1年前查看全部
- 炼钢和炼铁的区别以及方程式(初中)
 向往uu1年前1
向往uu1年前1 -
 eason414 共回答了24个问题
eason414 共回答了24个问题 |采纳率83.3%炼铁是用还原剂将铁从矿石中还原出来:Fe2O3+3CO=2Fe+3CO2
炼钢是用氧化剂将生铁中多余的碳氧化掉:C+O2=CO21年前查看全部
- 古人炼铁最关键的一步反应的化学方程式是什么?(急……)
古人炼铁最关键的一步反应的化学方程式是什么?(急……)
炼钢的主要原料是生铁,在古代,人们把烧红的生铁放在铁砧上反复捶打最终使生铁转化为钢.这就是“百炼成钢”的来历.请你写出上述最关键的一步反应的花谢方程式:___________________________. realwubin1年前4
realwubin1年前4 -
 可人草香 共回答了17个问题
可人草香 共回答了17个问题 |采纳率82.4%使生铁转化为钢,就是降低含碳量.所以最关键的一步反应的方程式为
C + O2 ==△== CO21年前查看全部
- 用化学方程式表示下列原理:(1)用氢氧化钠吸收二氧化硫:______;(2)工业上用赤铁矿(主要成分Fe2O3)来炼铁:
用化学方程式表示下列原理:
(1)用氢氧化钠吸收二氧化硫:______;
(2)工业上用赤铁矿(主要成分Fe2O3)来炼铁:3CO+Fe2O3
2Fe+3CO2高温 .3CO+Fe2O3;
2Fe+3CO2高温 .
(3)含有形成化合物种类最多的一种元素组成最简单化合物燃烧的化学方程式:CH4+2O2
2H2O+CO2点燃 .CH4+2O2.
2H2O+CO2点燃 . shizxz1年前1
shizxz1年前1 -
 huidaozhan 共回答了13个问题
huidaozhan 共回答了13个问题 |采纳率76.9%解题思路:书写化学方程式的步骤一般有四步:
1.根据实验事实,在式子的左、右两边分别写出反应物和生成物的化学式,并在式子的左、右两边之间画一条短线;当反应物或生成物有多种时,中间用加号(即“+”)连接起来.
2.配平化学方程式,并检查后,将刚才画的短线改写成等号(表示式子左、右两边每一种元素原子的总数相等).
3.标明化学反应发生的条件(因为化学反应只有在一定的条件下才能发生);如点燃、加热(常用“△”号表示)、催化剂、通电等.并且,一般都写在等号的上面,若有两个条件,等号上面写一个下面写一个,等等.
4.注明生成物中气体或固体的状态符号(即“↑”、“↓”);一般标注在气体或固体生成物的化学式的右边.但是,如果反应物和生成物中都有气体或固体时,其状态符号就不用标注了.(1)二氧化硫可以和氢氧化钠反应生成亚硫酸钠和水,可以据此写出该反应的化学方程式为:SO2+2NaOH═Na2SO3+2H2O;
(2)工业上炼铁用一氧化碳作为还原剂,将铁还原出来,同时生成了二氧化碳,所以用赤铁矿炼铁的反应原理为:3CO+Fe2O3
高温
.
2Fe+3CO2;
(3)形成化合物种类最多的元素为碳元素,其组成的最简单的有机化合物为甲烷,其完全燃烧生成了二氧化碳和水,化学方程式为:CH4+2O2
点燃
.
2H2O+CO2.
故答案为:(1)SO2+2NaOH═Na2SO3+2H2O;
(2)3CO+Fe2O3
高温
.
2Fe+3CO2;
(3)CH4+2O2
点燃
.
2H2O+CO2.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 要想解答好这类题目,首先,要理解和熟记书写化学方程式、文字表达式或电离方程式,以及与之相关的知识等.然后,根据所给的问题情景或图表信息等,结合所学的相关知识和技能,细致地分析题意(或图表信息)等各种信息资源,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.1年前查看全部
- 工业炼铁,用到的原料有:铁矿石、焦炭、空气、石灰石,下列对原料在冶炼过程中的作用叙述不正确的是: [
工业炼铁,用到的原料有:铁矿石、焦炭、空气、石灰石,下列对原料在冶炼过程中的作用叙述不正确的是: [ ]
A.焦炭是铁矿石炼铁时的还原剂
B.空气在与焦炭的反应中,为炼铁提供能量
C.石灰石是助矿石中杂质形成炉渣
D.固体原料需粉碎,增大与气体的接触面 风吹的脸1年前1
风吹的脸1年前1 -
 zhangpengtao1 共回答了15个问题
zhangpengtao1 共回答了15个问题 |采纳率86.7%A1年前查看全部
- 某炼铁厂用含氧化铁80%的赤铁矿冶炼生铁.若要炼出1120t含铁95%的生铁,需要含氧化铁80%的赤铁矿多少吨?(反应方
某炼铁厂用含氧化铁80%的赤铁矿冶炼生铁.若要炼出1120t含铁95%的生铁,需要含氧化铁80%的赤铁矿多少吨?(反应方程式Fe2O3+3CO
2Fe+3CO2)高温 . loki6131年前1
loki6131年前1 -
 46hf 共回答了22个问题
46hf 共回答了22个问题 |采纳率86.4%解题思路:这是一道一题多解的题目,可利用化学式计算也可利用化学方程式计算,但不管是哪种方式计算时先要把不纯的物质转化为纯净物计算,一般是混合物的质量乘以这种物质中纯净物的质量分数即为这种纯净物的质量.设需要含氧化铁80%的赤铁矿的质量为x
3CO+Fe2O3
高温
.
2Fe+3CO2
160112
x•80% 1120t•95%
x=[160•1120t•95%/112•80%]=1900t
答:需要含氧化铁80%的赤铁矿1900吨.点评:
本题考点: 含杂质物质的化学反应的有关计算.
考点点评: 此题是对含杂质物质的有关计算,问题的关键是首先解决纯净物与混合物的相互转化,利用混合物的质量乘以某种物质的质量分数即为这种纯净物质的质量,并结合化学式或化学方程式是解决这类题目的关键.1年前查看全部
- 工业炼铁的设备原料原理和炼铁高炉中发生的三个化学方程式
 秋_风信子1年前1
秋_风信子1年前1 -
 行走渤海湾 共回答了13个问题
行走渤海湾 共回答了13个问题 |采纳率100%反应原理C+O2==CO2 (条件:高温)CO2+C=CO (条件:高温)Fe2O3+3CO=2Fe+3CO2 (条件:高温)
~如果你认可我的回答,请及时点击【采纳为满意回答】按钮~
~手机提问者在客户端右上角评价点【满意】即可.
~你的采纳是我前进的动力~~
~如还有新的问题,请不要追问的形式发送,另外发问题并向我求助或在追问处发送问题链接地址,答题不易,敬请谅解~~
O(∩_∩)O,记得好评和采纳,互相帮助
祝学习进步!1年前查看全部
- 用含Fe2o3 80%的赤铁矿石5000t炼铁,可得到多少t含杂质2%的生铁
用含Fe2o3 80%的赤铁矿石5000t炼铁,可得到多少t含杂质2%的生铁
下午3点半前! man9091年前1
man9091年前1 -
 我爱小想想 共回答了21个问题
我爱小想想 共回答了21个问题 |采纳率85.7%设可得到生铁X吨
Fe2O3+3CO=2Fe+3CO2
160 112
80%*5000 x X=2800t
2800/(1-2%)≈2857.1t
答:可得到含杂质2%的生铁约2857.1吨.1年前查看全部
- 炼铁的原理是利用一氧化碳与氧化铁反应,某同学利用该原理设计了一个实验,实验装置见图,对实验进行分析并回答:
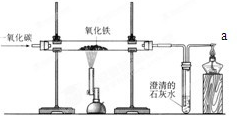 炼铁的原理是利用一氧化碳与氧化铁反应,某同学利用该原理设计了一个实验,实验装置见图,对实验进行分析并回答:
炼铁的原理是利用一氧化碳与氧化铁反应,某同学利用该原理设计了一个实验,实验装置见图,对实验进行分析并回答:
(1)实验原理用方程式表示是3CO+Fe2O3
2Fe+3CO2高温 .3CO+Fe2O3.
2Fe+3CO2高温 .
(2)给玻璃管加热的仪器叫酒精喷灯,要用其______(填“外焰”、“内焰”或“焰心”)进行加热.
(3)实验中玻璃管里氧化铁粉末的颜色变化是______,观察到澄清石灰水的现象是______.
(4)实验前“通入CO”与“开始加热”的顺序是______;
(5)实验要在装置末端a处燃着一盏酒精灯,其作用是______. tsaily1年前1
tsaily1年前1 -
 lxq830608 共回答了11个问题
lxq830608 共回答了11个问题 |采纳率72.7%解题思路:(1)一氧化碳还原氧化铁的反应原理为:3CO+Fe2O3
2Fe+3CO2;高温 .
(2)根据酒精喷灯火焰各部分的温度分析;
(3)根据反应物和生成物,分析实验中玻璃管里氧化铁粉末的颜色变化.根据二氧化碳能与氢氧化钙反应分析澄清石灰水的现象;
(4)根据玻璃管内有空气,通入一氧化碳易发生爆炸分析;
(5)根据一氧化碳是对大气有污染的气体分析.(1)一氧化碳还原氧化铁的反应原理为:3CO+Fe2O3
高温
.
2Fe+3CO2;
(2)由于酒精喷灯的外焰的温度最高,加热时要用外焰进行加热;
(3)由于在高温下,一氧化碳将氧化铁还原为铁,同时生成了二氧化碳.所以可以观察到实验中玻璃管里氧化铁粉末的颜色变化是红色粉末变黑色;二氧化碳能与氢氧化钙反应生成了碳酸钙沉淀和水.所以可以观察到澄清石灰水变浑浊;
(4)由于玻璃管内有空气,通入一氧化碳高温时易发生爆炸.所以实验前先通入CO,排净玻璃管中的空气再开始加热.
(5)为了防止一氧化碳对大气的污染,所以,实验时要在装置末端a处燃着一盏酒精灯除去反应剩余的CO.
故答案为:(1)3CO+Fe2O3
高温
.
2Fe+3CO2;
(2)外焰;
(3)红色粉末变黑色;澄清石灰水变浑浊;
(4)先通入CO,排净玻璃管中的空气再开始加热;
(5)为了防止一氧化碳对大气的污染.点评:
本题考点: 一氧化碳还原氧化铁.
考点点评: 本题主要考查一氧化碳与氧化铁反应实验装置、实验现象、一氧化碳的化学性质和污染,属基础性知识考查题.1年前查看全部
- 某炼铁厂每天消耗含Fe3O4 80%的磁铁矿石1000t,则理论上该工厂每天能生产消耗含4%杂质的生铁多少吨?
 2vcrbuuoifd45at1年前1
2vcrbuuoifd45at1年前1 -
 xinjie 共回答了18个问题
xinjie 共回答了18个问题 |采纳率88.9%设:该工厂每天能生产消耗含4%杂质的生铁x吨
4CO+Fe3O4=高温=3Fe+4CO2
232 168
1000t*80% x*(1-4%)
232/168=1000t*80%/x*(1-4%)
x=603.45t
所以某炼铁厂每天消耗含Fe3O4 80%的磁铁矿石1000t,则理论上该工厂每天能生产消耗含4%杂质的生铁603.45吨.1年前查看全部
- (2010•徐汇区一模)钢铁是重要的金属材料,在生产、生活中有广泛的用途.炼铁厂常以焦炭、赤铁矿(主要成分是Fe2O3)
(2010•徐汇区一模)钢铁是重要的金属材料,在生产、生活中有广泛的用途.炼铁厂常以焦炭、赤铁矿(主要成分是Fe2O3)、空气等为主要原料炼铁,反应过程如图:

请回答:
(1)赤铁矿主要成分Fe2O3中铁元素的化合价是______
(2)第②步的化学反应基本类型属于______;
(3)第③步反应的化学方程式:3CO+Fe2O3
3CO2+2Fe高温 .3CO+Fe2O3,其中属于还原剂的物质是______.
3CO2+2Fe高温 . cher_aquarius1年前1
cher_aquarius1年前1 -
 sichuanguangqing 共回答了26个问题
sichuanguangqing 共回答了26个问题 |采纳率88.5%解题思路:(1)化合物中各元素的化合价代数和为零,根据这一原则,可由氧化铁中氧元素的化合价计算铁元素的化合价;
(2)化合反应是指两种或两种以上物质反应生成一种物质的化学变化,该变化的特点可总结为“多变一”;
(3)还原剂是指反应中夺取其它物质中的氧元素的物质.(1)设Fe2O3中铁元素的化合价为x,则x×2+(-2)×3=0,解得x=+3
故答案为:+3;
(2)焦炭在高温条件下与二氧化碳反应生成一氧化碳,该反应符合“多变一”的化合反应的特点,该反应属于化合反应;
故答案为:化合反应;
(3)高温条件下,一氧化碳还原氧化铁生成铁和二氧化碳;该反应中一氧化碳夺取氧化铁中的氧,为该反应中的还原剂;
故答案为:3CO+Fe2O3
高温
.
3CO2+2Fe;CO.点评:
本题考点: 铁的冶炼;一氧化碳还原氧化铁;有关元素化合价的计算;反应类型的判定;还原反应;书写化学方程式、文字表达式、电离方程式.
考点点评: 化学变化的基本类型有四种:化合反应,两种或以上物质生成一种物质的反应;分解反应,一种物质生成两种或以上物质的反应;置换反应,单质与化合物生成单质与化合物的反应;复分解反应,两种化合物相互交换成分生成两种新的化合物的反应.1年前查看全部
- 某铁厂用含氧化铁【FE2O3]80%的是铁矿是炼铁,若要练出120吨的铁,需要该赤铁矿石多少吨?
 bettyzqp1年前1
bettyzqp1年前1 -
 jjlcao 共回答了17个问题
jjlcao 共回答了17个问题 |采纳率94.1%设,需要该赤铁矿石x吨
Fe2O3+3CO ===加热====2Fe+3CO2
160 112
80%x 120T
160/112=80%x/120T
x=214.3T
需要该赤铁矿石214.3吨1年前查看全部
- 炼铁料批的大小与什么有关,料批是什么概念,包括矿批和焦批吗?
 s197011年前1
s197011年前1 -
 wwe_1998 共回答了17个问题
wwe_1998 共回答了17个问题 |采纳率94.1%料批包括焦批和矿批,在实际中把一批矿石和一批焦炭叫做一批料,对于不同的高炉,料批的大小主要是由高炉的容积决定,一般高炉越大,相应的批重也会越大.还有就是高炉的运行情况了,一般高炉顺行得时候,会适当增加批重,但高炉憋风难行时,就会适当减小批重,降低高炉负荷.1年前查看全部
- 实验测得某磁铁矿石中四氧化三铁的质量分数为80%.利用该磁铁矿石5000吨.(假设杂质不含铁元素).炼铁厂理论上可以练出
实验测得某磁铁矿石中四氧化三铁的质量分数为80%.利用该磁铁矿石5000吨.(假设杂质不含铁元素).炼铁厂理论上可以练出含铁98%的生铁的质量是多少?
 tom02261年前1
tom02261年前1 -
 柯柯盐湖 共回答了21个问题
柯柯盐湖 共回答了21个问题 |采纳率95.2%设炼铁厂理论上可以练出含铁98%的生铁的质量为X
5000吨磁铁矿石含四氧化三铁的质量=5000吨*80%=4000吨.
4CO+ Fe3O4= 高温= 3Fe + 4CO2
232 168
4000吨 X*98%
232:168=4000吨:X*98%
解得:X=2955.7吨
答:炼铁厂理论上可以练出含铁98%的生铁的质量是2955.7吨1年前查看全部
- 用磁铁矿(四氧化三铁)炼铁的化学方程式
 写下来就忘却1年前6
写下来就忘却1年前6 -
 caijingjing 共回答了21个问题
caijingjing 共回答了21个问题 |采纳率95.2%Fe3O4+4CO==高温==4CO2+3Fe
告诉你个通式:
FexOy+yCO==高温==yCO2+xFe1年前查看全部
- 下列说法正确的是( )A.工业上炼铁是用电炉B.工业炼铁的原料主要是:生铁、焦炭、石灰石C.高炉炼铁时,加入石灰石的目
下列说法正确的是( )
A.工业上炼铁是用电炉
B.工业炼铁的原料主要是:生铁、焦炭、石灰石
C.高炉炼铁时,加入石灰石的目的是把矿石中的二氧化硅转变成炉渣去掉
D.高炉炼出的铁是纯铁 杨衡1年前1
杨衡1年前1 -
 lukicat 共回答了15个问题
lukicat 共回答了15个问题 |采纳率86.7%解题思路:A.根据工业炼铁的设备来分析;B.根据炼铁的原料来分析;C.根据炼铁过程中加入石灰石的作用来分析;D.根据高炉炼铁的产物来分析.A.工业炼铁用高炉,故错误;
B.工业炼铁的原料主要是铁矿石、焦炭、石灰石,故错误;
C.高炉炼铁时,加入石灰石的作用是把矿石中的二氧化硅转化为炉渣除去,故正确;
D.高炉炼出的铁中含有杂质,属于生铁,故错误.
故选C.点评:
本题考点: 铁的冶炼.
考点点评: 本题考查了高炉炼铁的知识,题目比较简单,要掌握高炉炼铁的原理、设备及原料.1年前查看全部
- 菱铁矿炼铁方程式FECO3
 WP28591年前1
WP28591年前1 -
 我要一个结果 共回答了11个问题
我要一个结果 共回答了11个问题 |采纳率81.8%FeCO3=(高温)FeO+CO2↑
FeO+CO=(高温)Fe+CO21年前查看全部
- 某校课外活动小组的同学在老师的帮助下,探究用赤铁矿(主要成分是Fe2O3)炼铁的主要反应原理.
某校课外活动小组的同学在老师的帮助下,探究用赤铁矿(主要成分是Fe2O3)炼铁的主要反应原理.
实验时,应先点燃第2个酒精灯. 为什么要先点燃第二个?
 miniliony1年前1
miniliony1年前1 -
 liuqqing 共回答了18个问题
liuqqing 共回答了18个问题 |采纳率94.4%两个酒精灯是不是火力不一样,第二个火力猛点
氧化铁还原顺序:三氧化二铁---四氧化三铁--氧化亚铁---铁;
注意,以570度为分界,小于570度就直接还原到氧化亚铁(实际上是浮氏体)1年前查看全部
- 某校课外活动小组的同学在老师的帮助下,探究用赤铁矿(主要成分Fe 2 O 3 )炼铁的主要反应原理.他们设计的实验装置,
某校课外活动小组的同学在老师的帮助下,探究用赤铁矿(主要成分Fe 2 O 3 )炼铁的主要反应原理.他们设计的实验装置,如图:
回答下列问题:
(1)写出用一氧化碳还原氧化铁的化学方程式______;
(2)实验时,在澄清的石灰水中观察到的现象是______,发生反应的化学方程式为______;
(3)图中,设计第②个酒精灯的目的是______.实验时应先点燃第______个酒精灯.
 qsn5201年前1
qsn5201年前1 -
 小妖的ss 共回答了20个问题
小妖的ss 共回答了20个问题 |采纳率85%(1)一氧化碳与氧化铁在高温条件下反应生成铁和二氧化碳,反应的化学方程式为:3CO+Fe 2 O 3
高温
.
2Fe+3CO 2 .
(2)生成的二氧化碳能与澄清石灰水反应生成碳酸钙沉淀和水,故可以观察到澄清石灰水变浑浊,反应的化学方程式为:CO 2 +Ca(OH) 2 ═CaCO 3 ↓+H 2 O.
(3)一氧化碳有毒,排放到空气中会污染空气,一氧化碳与氧气在点燃条件下反应生成二氧化碳,故设计第②个酒精灯可防止未反应的一氧化碳排放到空气中污染空气.
因为要先通一氧化碳排净玻璃管内的空气,而一氧化碳有毒不能排放到空气中去,所以要先点燃第②个酒精灯.
故答案为:(1)3CO+Fe 2 O 3
高温
.
2Fe+3CO 2 ;(2)澄清石灰水变浑浊;CO 2 +Ca(OH) 2 ═CaCO 3 ↓+H 2 O;(3)除去尾气中的CO,防止污染空气;②.1年前查看全部
- 铁在生产生活中应用十分广泛.(1)工业上常用赤铁矿(主要成分是Fe 2 O 3 )和一氧化碳在高温下炼铁,其反应的化学方
铁在生产生活中应用十分广泛.
(1)工业上常用赤铁矿(主要成分是Fe 2 O 3 )和一氧化碳在高温下炼铁,其反应的化学方程式为______.
(2)下列铁制品在使用时,主要利用金属具有良好导热性的是______ (填标号).
A.铁锤B.铁丝C.铁锅
(3)如图实验中,洁净无锈的铁钉在______ (填标号)情况下最容易生锈.写出防止铁制品生锈的l条措施:______
(4)某麦片里添加了一种极细的铁粉,食用后在胃酸(含HCl)作用下可被人体吸收.写出铁与胃酸反应的化学方程式:______.
 wyp08051年前1
wyp08051年前1 -
 cc比段nn多 共回答了14个问题
cc比段nn多 共回答了14个问题 |采纳率92.9%解;(1)工业上用一氧化碳还原氧化铁炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,反应的化学方程式为:3CO+Fe 2 O 3
高温
.
2Fe+3CO 2 ;
(2)铁锤是利用铁的硬度大的性质;铁丝是利用延展性;铁锅是利用导热性;
(3)为了防止钢铁的锈蚀,人们常采用在其表面刷油漆或镀上其他金属等覆盖保护膜的方法,这些方法都能够防止锈蚀的共同原理是隔绝氧气和水;
(4))铁与盐酸反应生成氯化亚铁和氢气,反应的化学方程式为:Fe+2HCl═FeCl 2 +H 2 ↑.
故答案为:(1)3CO+Fe 2 O 3
高温
.
2Fe+3CO 2
(2)C;(3)B涂上一层油漆(其他合理答案);(4)Fe+2HCl═FeCl 2 +H 2 ↑.1年前查看全部
- 现有200t含氧化铁80%的赤铁矿,则用这批原料进行炼铁,可以练出纯度为97%的生铁多少
 y2kksam1年前1
y2kksam1年前1 -
 aileen_cn2004 共回答了14个问题
aileen_cn2004 共回答了14个问题 |采纳率92.9%3CO+ Fe2O3 =高温= 2Fe + 3CO2
160 112
200*80% 97%x
160:112=200*80%:97%x
10:7=160:97%x
97%x=112
x=115.51年前查看全部
- 人类的生活生产离不开金属.(1)写出在高炉中用赤铁矿炼铁的化学反应方程式3CO+Fe2O3 高温 . 3CO2+2Fe3
 人类的生活生产离不开金属.
人类的生活生产离不开金属.
(1)写出在高炉中用赤铁矿炼铁的化学反应方程式3CO+Fe2O3
3CO2+2Fe高温 .3CO+Fe2O3.
3CO2+2Fe高温 .
(2)如图所示的是某“暧宝宝”外包装的图片.该“暧宝宝”中发热剂主要成分有铁粉、活性炭、氯化钠、水等.使用时,先要撕去“暧宝宝”的保护膜,其目的是______,推测发热剂成分中氯化钠的作用是______.
(3)现有一种金属R(可能是银、镁、铁中的一种).欲确定R,请你一起完成:
①请将银、镁、铁三种金属的元素符号填写在下列金属活动性顺序表中的相应位置
②取少量的金属R的粉末于试管中,逐滴加入稀硫酸,有气泡产生,则R不可能是______.
③待不再产生气泡时,再往溶液中加入洁净的锌片,锌片表面有金属析出,则R是______.写出锌片表面析出金属R的化学反应方程式______.该反应的基本类型属于______(选填“化合”、“分解”、“置换”)反应. 罗鑫1年前1
罗鑫1年前1 -
 zh1987511 共回答了20个问题
zh1987511 共回答了20个问题 |采纳率90%解题思路:(1)赤铁矿的主要成分Fe2O3;高炉炼铁的原理是用还原剂将铁从它的氧化物中还原出来;
(2)根据铁粉生锈的条件需要水和氧气分析;氯化钠可以加快铁的锈蚀;
(3)①根据金属活动性顺序:镁>铁>H>银;
②只有排在氢前面的金属才能置换出酸中的氢,产生气泡;
③只有排在前面的金属才能把后面的金属从其盐溶液中置换出来;单质和化合物反应生成新单质和新化合物的反应是置换反应.(1)高炉中用一氧化碳还原赤铁矿炼铁的化学反应方程式:3CO+Fe2O3
高温
.
3CO2+2Fe;
(2)“暧宝宝”中发热剂主要成分有铁粉,其原理就是利用铁粉生锈放出热量,而铁粉生锈的条件是在氧气和水并存时发生的缓慢氧化;所以使用时,先要撕去“暧宝宝”的保护膜的目的就是铁粉与空气接触,促使铁粉生锈,其中的氯化钠可以加快铁的生锈;故答案为:与空气接触,促使铁粉生锈 加速铁粉生锈,更快地放出热量;
(3)①在金属活动性顺序中,镁>铁>H>银;
②镁和铁的活动性位于氢的前面,能够与酸反应产生气泡,而银排在氢的后面不能与酸发生置换反应,故R不可能为银;
③镁与稀硫酸反应生成硫酸镁和氢气,铁和稀硫酸反应生成硫酸亚铁和氢气,所以溶液中的溶质有硫酸镁和硫酸亚铁,向其中加入锌:因为镁>锌>铁,排在前面的金属能把排在后面的金属从其盐溶液中置换出来,因此锌表面析出的金属是铁,故R金属是铁;锌和铁反应的方程式为:Zn+FeSO4═ZnSO4+Fe;该反应符合:单质+化合物→单质+化合物,故属于置换反应.
故答案为:①镁>铁>H>银;②银; ③铁 Zn+FeSO4═ZnSO4+Fe 置换点评:
本题考点: 铁的冶炼;金属活动性顺序及其应用;金属锈蚀的条件及其防护;反应类型的判定;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了铁的生锈条件、炼铁的原理以及铁发生的置换反应,是中考考查的重点之一,要注意顺序化学方程式时铁元素的化合价.1年前查看全部
- 分子计算题钢铁厂用含四氧化三铁50%的 磁铁矿90吨炼铁,可以得到含杂质2%的生铁多少千克
 sfiii1年前1
sfiii1年前1 -
 penglin132001088 共回答了19个问题
penglin132001088 共回答了19个问题 |采纳率78.9%90t=90000kg
90000*50%=45000kg
设:生成铁质量为x
高温
Fe3O4 +4H2====3Fe+4H2O
232 168
45000kg x
168/232=x/45000kg
x=32586kg
32586kg/(1-2%)=33251kg
所以得到生铁33251kg1年前查看全部
大家在问
- 1The Internet is widely used which speeds up the development
- 2抱歉我迟到了 I'm sorry ()() 两个括号中各填什么单词
- 3化学问题呦~~会的帮帮忙!从宏观上讲物质是由( )组成的?从微观上讲,物质是由肉眼看不见的粒子,如( )、( )等构成的
- 4英语作文should-shouldn't怎么写
- 5(2008•佛山)2008年5月12日14时28分,四川汶川发生里氏8级地震,饮用水受到严重污染.小忻同学设计了以下净水
- 6已知平面直角坐标系xOy上的区域D由不等式 给定,若M(x,y)为D上的动点,点A的坐标为(2,1),则z= ● 的最大
- 7初一,我在坚强中度过作文 《初一 ,我在坚持中度过》帮忙一下了
- 8大箱子和小箱子中间有个皮球翻译成英文
- 9补充完整含有“春”字的词语春深( )( )闹春春寒( )春山( )( )鸣春( )如春春意( )
- 10from next door副词前不是不加介词的吗?
- 11小学找规律试题 有四组数 第一组13和33.第二组16和30.第四组是25和21.求第三组的两个数是什么
- 12一道物理的概念题、、速度的方向与运动方向相反是匀加速直线运动吗?(⊙_⊙)?
- 13There were many people on the bus and there were on empty se
- 14已知直线l经过直线2x+y-5=0与x-2y=0的交点.若点A(5,0)到l的距离为3,求l的方程.
- 15几个英语问题1.I"m going to learn to play the piano after I retire-
