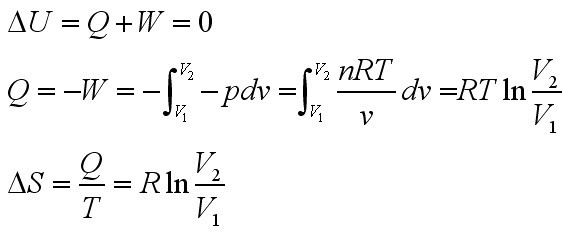4.1 mol理想气体由 0 ℃,101.3 kPa恒温不可逆膨胀到 50.6 kPa,系统作功418.4 J.
 rqs_19792022-10-04 11:39:541条回答
rqs_19792022-10-04 11:39:541条回答
4.1 mol理想气体由 0 ℃,101.3 kPa恒温不可逆膨胀到 50.6 kPa,系统作功418.4 J.
Q,ΔU,ΔH,ΔS和ΔG,并判断过程的方向;
Q,ΔU,ΔH,ΔS和ΔG,并判断过程的方向;

已提交,审核后显示!提交回复
共1条回复
 还没想好英文名 共回答了19个问题
还没想好英文名 共回答了19个问题 |采纳率94.7%- △U=0(热力学能U只是温度的函数,前后温度相同,则热力学能相同)
热力学第一定律:△U=Q+W(环境对系统做功为正,系统吸热为正),系统做功418.4J,即W=-418.4J,△U=0,所以Q=418.4J,即吸热418.4J
焓的定义H=U+PV,所以△H=U2+P2V2-(U1+P1V1),因为U1=U2,PV=nRT,n、T不变,R是常数,所以P1V1=P2V2,因此△H=0
熵变△S=Q/T=418.4/298.15=1.40J/K
△G=△H-T△S=0-298.15*1.403=-418.4J
△G<0,正向自发进行.
以上单位均是不考虑物质的量情况,如果考虑物质的量的话,都除以4.1mol即可. - 1年前
相关推荐
- 1mol理想气体其始态为27度 1013.25kpa,经恒温可逆膨胀到101.325kpa,W,△U,△H,△S!
 zxqer1年前1
zxqer1年前1 -
 weijiabin 共回答了21个问题
weijiabin 共回答了21个问题 |采纳率90.5%这个公式可供参考,孩子,我只能帮你到这了
W=-nRTln(V2/V1)
Q=-W
△U=0
△H=0
△S=Q/T1年前查看全部
- mol理想气体在气缸中进行无限缓慢的膨胀,其体积由V1变到 V2. (1) 当气缸处于绝热情况下时,求理想气体熵的增量D
mol理想气体在气缸中进行无限缓慢的膨胀,其体积由V1变到 V2. (1) 当气缸处于绝热情况下时,求理想气体熵的增量DS1;
(2) 当气缸处于等温情况下时,理想气体熵的增量DS2 饺子06251年前1
饺子06251年前1 -
 ijnh 共回答了16个问题
ijnh 共回答了16个问题 |采纳率93.8%1年前查看全部
- 1mol理想气体,已知它的状态参量同时满足p/t=a和v/t=b,则它们的温度t=
 玉福平1年前1
玉福平1年前1 -
 sdswy 共回答了20个问题
sdswy 共回答了20个问题 |采纳率95%理想状态下遵循理想气体状态方程,PV=nRT.将P=aT,V=bT,n=1mol代入,可得T=R/ab.1年前查看全部
- 1.00 mol理想气体,在298K时,经 等温可逆膨胀,体积从24.4 dm3变为244 dm3
1.00 mol理想气体,在298K时,经 等温可逆膨胀,体积从24.4 dm3变为244 dm3
求两过程的ΔS、ΔG、ΔF. XTGG6141年前1
XTGG6141年前1 -
 qthbatghq 共回答了20个问题
qthbatghq 共回答了20个问题 |采纳率90%Q=-W=pdv=nrt LN V=8.314*298*Ln10
ΔS=Q/t,ΔG=0-Q=-Q
ΔF是赫牳赫兹能吗,我们数用A表示,这个题等于W了1年前查看全部
- 1mol理想气体,在温度273.15K,由100KPa增大到200KPa,化学势的变化为多少?
 幻影之灵1年前1
幻影之灵1年前1 -
 xiandaileng 共回答了15个问题
xiandaileng 共回答了15个问题 |采纳率93.3%由热力学基本关系dG=-SdT+Vdp,对1mol理想气体pV=RT
对等温过程dT=0,所以ΔG=∫Vdp=∫(RT/p)dp=RTln(p2/p1)=RTln2代入数据即得.1年前查看全部
- 1.00 mol理想气体,在298K时,经 等温可逆膨胀,体积从24.4 dm3变为244 dm3
 洋不起来1年前1
洋不起来1年前1 -
 苑苑思无涯 共回答了22个问题
苑苑思无涯 共回答了22个问题 |采纳率86.4%不知道你要问什么
当你是问压力吧
PV=NRT
温度不变,物质的量不变,则压力是原来的1/10
难道是问做的功?1年前查看全部
大家在问
- 11条直线最多可以分成2个平面;2条直线最多可以分成4个平面;3条直线最多可以分成7个平面;4条,11个;5条,16个;6
- 2写绿色动态的成语( )、写绿色辽阔的成语( )
- 322.用重铬酸钾法测定Fe含量时,加入硫酸的目的是什么?
- 4有3个数,他们的和积相等,这3个数是( )( )( )
- 5为什么在弱电解质的电离中,增大溶液的物质的量浓度,电离平衡将向电离方向移动,那为什么电解质的
- 6填写成语:()精()神 ()阴()日
- 7怎样计算房子的面积
- 8英语课文怎样练才能提高效率?是读熟还是会背还是熟背?
- 9已知4gH2燃烧生成液态水时放出热量571.6KJ,16g甲烷完全燃烧生成CO2气体和液态水时放出890.3KJ热量,则
- 10救命氧元素2个氮原子3个钠离子原子序数为2的元素生物细胞中含量最多的金属元素液体金属元素
- 11高锰酸钾加热制取氧气要加热多久做实验时加热了很久了,还是米有气体
- 12在RT△ABC中,∠C=90°,∠A=30°,AB=6,解这个三角形
- 13过一个多边形的一个顶点做一条直线,把这个多边形截掉两个角,它的内角和为1260,求这个多边形原来的边数
- 14很简单的开方运算题,开平方,精确到0.01:0.46254,二十五分之八,2402,二十五分之三十六.开平方,精确到1:
- 15地球上的矿产资源何时会被采尽?