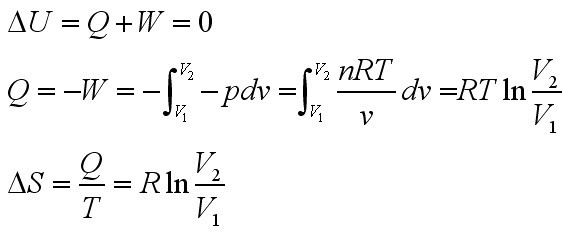1.00 mol理想气体,在298K时,经 等温可逆膨胀,体积从24.4 dm3变为244 dm3
 XTGG6142022-10-04 11:39:541条回答
XTGG6142022-10-04 11:39:541条回答
1.00 mol理想气体,在298K时,经 等温可逆膨胀,体积从24.4 dm3变为244 dm3
求两过程的ΔS、ΔG、ΔF.
求两过程的ΔS、ΔG、ΔF.

已提交,审核后显示!提交回复
共1条回复
 qthbatghq 共回答了20个问题
qthbatghq 共回答了20个问题 |采纳率90%- Q=-W=pdv=nrt LN V=8.314*298*Ln10
ΔS=Q/t,ΔG=0-Q=-Q
ΔF是赫牳赫兹能吗,我们数用A表示,这个题等于W了 - 1年前
相关推荐
- 1mol理想气体其始态为27度 1013.25kpa,经恒温可逆膨胀到101.325kpa,W,△U,△H,△S!
 zxqer1年前1
zxqer1年前1 -
 weijiabin 共回答了21个问题
weijiabin 共回答了21个问题 |采纳率90.5%这个公式可供参考,孩子,我只能帮你到这了
W=-nRTln(V2/V1)
Q=-W
△U=0
△H=0
△S=Q/T1年前查看全部
- mol理想气体在气缸中进行无限缓慢的膨胀,其体积由V1变到 V2. (1) 当气缸处于绝热情况下时,求理想气体熵的增量D
mol理想气体在气缸中进行无限缓慢的膨胀,其体积由V1变到 V2. (1) 当气缸处于绝热情况下时,求理想气体熵的增量DS1;
(2) 当气缸处于等温情况下时,理想气体熵的增量DS2 饺子06251年前1
饺子06251年前1 -
 ijnh 共回答了16个问题
ijnh 共回答了16个问题 |采纳率93.8%1年前查看全部
- 1mol理想气体,已知它的状态参量同时满足p/t=a和v/t=b,则它们的温度t=
 玉福平1年前1
玉福平1年前1 -
 sdswy 共回答了20个问题
sdswy 共回答了20个问题 |采纳率95%理想状态下遵循理想气体状态方程,PV=nRT.将P=aT,V=bT,n=1mol代入,可得T=R/ab.1年前查看全部
- 1mol理想气体,在温度273.15K,由100KPa增大到200KPa,化学势的变化为多少?
 幻影之灵1年前1
幻影之灵1年前1 -
 xiandaileng 共回答了15个问题
xiandaileng 共回答了15个问题 |采纳率93.3%由热力学基本关系dG=-SdT+Vdp,对1mol理想气体pV=RT
对等温过程dT=0,所以ΔG=∫Vdp=∫(RT/p)dp=RTln(p2/p1)=RTln2代入数据即得.1年前查看全部
- 1.00 mol理想气体,在298K时,经 等温可逆膨胀,体积从24.4 dm3变为244 dm3
 洋不起来1年前1
洋不起来1年前1 -
 苑苑思无涯 共回答了22个问题
苑苑思无涯 共回答了22个问题 |采纳率86.4%不知道你要问什么
当你是问压力吧
PV=NRT
温度不变,物质的量不变,则压力是原来的1/10
难道是问做的功?1年前查看全部
- 4.1 mol理想气体由 0 ℃,101.3 kPa恒温不可逆膨胀到 50.6 kPa,系统作功418.4 J.
4.1 mol理想气体由 0 ℃,101.3 kPa恒温不可逆膨胀到 50.6 kPa,系统作功418.4 J.
Q,ΔU,ΔH,ΔS和ΔG,并判断过程的方向; rqs_19791年前1
rqs_19791年前1 -
 还没想好英文名 共回答了19个问题
还没想好英文名 共回答了19个问题 |采纳率94.7%△U=0(热力学能U只是温度的函数,前后温度相同,则热力学能相同)
热力学第一定律:△U=Q+W(环境对系统做功为正,系统吸热为正),系统做功418.4J,即W=-418.4J,△U=0,所以Q=418.4J,即吸热418.4J
焓的定义H=U+PV,所以△H=U2+P2V2-(U1+P1V1),因为U1=U2,PV=nRT,n、T不变,R是常数,所以P1V1=P2V2,因此△H=0
熵变△S=Q/T=418.4/298.15=1.40J/K
△G=△H-T△S=0-298.15*1.403=-418.4J
△G<0,正向自发进行.
以上单位均是不考虑物质的量情况,如果考虑物质的量的话,都除以4.1mol即可.1年前查看全部
大家在问
- 1化学反应多在溶液中进行,其主要原因是( )
- 2某气体的密度小于空气且易溶于水,则用什么方法来收集该气体( )
- 3注重是不能能为人类提供能量的物质A葡萄糖 B脂肪 C蛋白质 D水
- 4鸡蛋在盐水中会浮起来,在水中会不会浮起来?
- 5(1)A、B、C三个烧杯中分别盛有相同浓度的稀硫酸.
- 6Are you in Class One .Grade Seven?(作否定回答)
- 7看电影泰坦尼克号的英文读后感
- 8一个矩形的面积为(8a^2b+4ab^2),一边长2ab,求周长
- 9长度单位在英语中有哪些用法?
- 10概率论,求X研04:设随机变量X服从正态分布N(0,1),对给定的a∈(0,1),数Ua满足P{X>Ua}=a,若P{|
- 11一个长方形的长是a厘米,宽是b厘米.
- 12my eyes is small哪里错了
- 13甲数的80%比乙数的五分之一多5,己知乙数是275,求甲数?
- 14不可数名词前能加定冠词the吗?
- 15一个梯形的上底、下底、高都是整厘米数,上底、下底与高的乘积分别为12和21,这个梯形的面积是______平方厘米.