硫酸铝铵溶液中滴入氢氧化钠 为什么是Al离子先跟氢氧化钠反应 再是NH4离子跟氢氧化钠反应
 frogart2022-10-04 11:39:541条回答
frogart2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 冰冰无礼 共回答了21个问题
冰冰无礼 共回答了21个问题 |采纳率100%- 如果先和NH4+反应,得到NH3H2O,还会与Al3+反应得到沉淀,相当于不反应
所以先和Al3+反应得到Al(OH)3
然后和NH4+反应得到NH3H2O,如果浓度大,会以NH3气体逸出
最后过量OH-溶解Al(OH)3沉淀得到AlO2- - 1年前
相关推荐
- 硫酸铝铵和氢氧化钡的反应中,为什么不同离子{(SO4)2-、Ba2+、Al3+、NH4+、OH-}的反应顺序会不一样?
硫酸铝铵和氢氧化钡的反应中,为什么不同离子{(SO4)2-、Ba2+、Al3+、NH4+、OH-}的反应顺序会不一样?
正确的反应顺序应该是怎么样的?
但是答案上说,随着氢氧化钠的不断加入,反应的方程式是这样的:
1. Ba(OH)2 + 2NH4Al(SO4)2 == BaSO4 +NH3。H2O +Al2(SO4)3
2. 3Ba(OH)2 + Al2(SO4)3 == 3BaSO4 +2Al(OH)3
3. Ba(OH)2 + 2Al(OH)3 == Ba(AlO2)2 +4H2O
这又是为什么呢?
我就是想知道多种离子在一起时,他们之间的反应顺序是怎么样的,是不是有什么原理? V桃乐妃V1年前5
V桃乐妃V1年前5 -
 5383694 共回答了17个问题
5383694 共回答了17个问题 |采纳率100%参考答案:x09祸兮福所倚,福兮祸所伏.1年前查看全部
- 在硫酸铝铵溶液中,钾可否置换铝,并把硫酸铝铵溶液变为硫酸铝钾溶液?
 yqq9201年前2
yqq9201年前2 -
 一帘风月 共回答了15个问题
一帘风月 共回答了15个问题 |采纳率86.7%NH4AL(SO4)2+K++OH-=KAL(SO4)2+NH3+H2O1年前查看全部
- 向100 mL 0.1 mol·L -1 硫酸铝铵[NH 4 Al(SO 4 ) 2 ]溶液中逐滴滴入0.1 mol·L
向100 mL 0.1 mol·L -1 硫酸铝铵[NH 4 Al(SO 4 ) 2 ]溶液中逐滴滴入0.1 mol·L -1 Ba(OH) 2 溶液。随着 Ba(OH) 2 溶液体积V的变化,沉淀总物质的量n的变化如图所示。则下列说法中正确的是( )
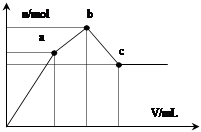
A.a点发生反应的离子方程式是:
Al 3+ +2SO 4 2- +2Ba 2+ +3OH — = Al(OH) 3 ↓+2BaSO 4 ↓B.b点消耗Ba(OH) 2 溶液体积为200mL C.从a→b 、b→c点过程中发生反应的离子方程式依次为:NH 4 + +OH - =NH 3 ·H 2 O Al(OH) 3 +OH - =AlO 2 - +2H 2 O D.沉淀的质量:a点>c点  倾尘的素衣1年前1
倾尘的素衣1年前1 -
 boyicn 共回答了19个问题
boyicn 共回答了19个问题 |采纳率89.5%B
1年前查看全部
- 向硫酸铝铵溶液中滴加几滴氢氧化钠,为什么之生成氢氧化铝,不生成一水合氨呢?
 叹息花1年前1
叹息花1年前1 -
 晴海 共回答了20个问题
晴海 共回答了20个问题 |采纳率100%氢氧根先与铝离子反应生成氢氧化铝,沉淀完全后,氢氧根与铵离子反应,生成一份氨气,铵离子全部反应后,氢氧根离子与氢氧化铝反应,生成偏铝酸根.1年前查看全部
- 奇怪:我买的食用明矾为什么是“硫酸铝铵”?不是硫酸铝钾!
奇怪:我买的食用明矾为什么是“硫酸铝铵”?不是硫酸铝钾!
奇怪:我买的食用明矾为什么是“硫酸铝铵”?
我在超市买的
袋子上写的“硫酸铝铵”
明矾不应该是硫酸铝钾KAl(SO4)2·12H2O
我配成溶液,加入过量小苏打溶液
产生大量A(OH)3沉淀和CO2气体
但有一点我注意到:
剩余溶液居然闻到氨气味道
如果加入石灰,氨气味道更明显
所以为什么我在超市买的明矾是“硫酸铝铵”?
不用硫酸铝钾? ddlg4ek1年前3
ddlg4ek1年前3 -
 轻狂如我2 共回答了18个问题
轻狂如我2 共回答了18个问题 |采纳率100%明矾是硫酸铝钾,这一点是肯定的.
楼主很细心,而且验证方法也正确,值得肯定.
就应用来说,硫酸铝铵也可起到明矾的作用,比如净化水方面.只是引入了铵根离子,而不是确定对人体无害的钾离子.1年前查看全部
- 为什麼向配制的硫酸铝铵的浓溶液加水稀释,其溶液的pH将增大?
为什麼向配制的硫酸铝铵的浓溶液加水稀释,其溶液的pH将增大?
仲有:明矾水溶液的酸碱性? sdagqerq1年前3
sdagqerq1年前3 -
 weberbobo 共回答了13个问题
weberbobo 共回答了13个问题 |采纳率100%硫酸铝铵为强酸弱碱盐,由于铵根离子和铝离子水解,溶液显酸性,加水稀释虽然会促进水解,但会导致氢离子浓度下降,酸性减弱,pH增大.
明矾水溶液由于铝离子水解显酸性.1年前查看全部
- 纳米氧化铝在陶瓷材料、电子工业、生物医药等方面有广阔的应用前景,它可通过硫酸铝铵晶体热分解得到.[已知:硫酸铝铵晶体的化
纳米氧化铝在陶瓷材料、电子工业、生物医药等方面有广阔的应用前景,它可通过硫酸铝铵晶体热分解得到.[已知:硫酸铝铵晶体的化学式为Al2(NH4)2(SO4)4•24H2O,相对分子质量为906]
(1)制备硫酸铝铵晶体的实验流程如下: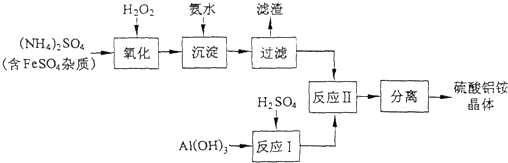
①检验上述流程中“过滤”后杂质是否除尽的实验方法是______.
②上述流程中,“分离”所包含的操作依次为:______、______、过滤、洗涤、干燥.
(2)取4.53g 硫酸铝铵晶体加热分解,最终剩余0.51g Al2O3固体.加热过程中,固体质量随温度的变化如图所示.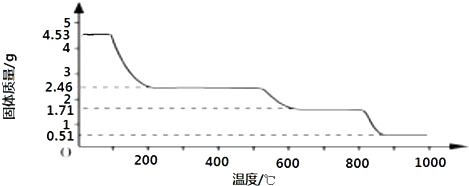
请通过计算确定400℃时剩余固体成分的化学式(写出计算过程). cyluoo1年前1
cyluoo1年前1 -
 xzlovesj 共回答了21个问题
xzlovesj 共回答了21个问题 |采纳率90.5%解题思路:由工艺流程可知,加入过氧化氢将溶液中Fe2+氧化为Fe3+,加入氨水调节溶液PH值,Fe3+使转化为Fe(OH)3,过滤后滤液主要含硫酸铵,氢氧化铝与硫酸混合反应生成硫酸铝溶液,再将硫酸铵和硫酸铝溶液混合反应,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥等最终得到硫酸铝铵晶体,
(1)①由工艺流程可知,加入过氧化氢将溶液中Fe2+氧化为Fe3+,加入氨水调节溶液PH值,Fe3+使转化为Fe(OH)3,过滤后的滤液中可能含有Fe3+,用KSCN溶液检验是否含有Fe3+;
②由工艺流程可知,流程中“分离”是从溶液中获得晶体,操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥等;
(2)计算晶体中水的质量,根据固体质量差,计算晶体中剩余结晶水的质量,进而计算剩余固体中n[(NH4)Al(SO4)2]:n(H2O),据此书写化学式.由工艺流程可知,加入过氧化氢将溶液中Fe2+氧化为Fe3+,加入氨水调节溶液PH值,Fe3+使转化为Fe(OH)3,过滤后滤液主要含硫酸铵,氢氧化铝与硫酸混合反应生成硫酸铝溶液,再将硫酸铵和硫酸铝溶液混合反应,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥等最终得到硫酸铝铵晶体;
(1)①由工艺流程可知,加入过氧化氢将溶液中Fe2+氧化为Fe3+,加入氨水调节溶液PH值,Fe3+使转化为Fe(OH)3,过滤后的滤液中可能含有Fe3+,取少许滤液于试管中,加几滴KSCN溶液,若溶液不变红色,则杂质已除尽.
故答案为:取少许滤液于试管中,加几滴KSCN溶液,若溶液不变红色,则杂质已除尽;
②由工艺流程可知,流程中“分离”是从溶液中获得晶体,操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥等,故答案为:蒸发浓缩;冷却结晶;
(2)取4.53g硫酸铝铵晶体的物质的量为[4.53g/906g/mol]=0.005mol,
4.53g硫酸铝铵晶体中水的质量为0.005mol×24×18g/mol=2.16g,
加热400℃时固体质量减少△m=4.53g-2.46g=2.07g<2.16g
剩余固体中结晶水的物质的量为[2.16g−2.07g/18g/mol]=0.005mol.
剩余固体中n[(NH4)2Al2(SO4)4]:n(H2O)=0.005mol:0.005mol=1:1,
故400℃时剩余固体成分的化学式为(NH4)2Al2(SO4)4•H2O.
答:400℃时剩余固体成分的化学式为(NH4)2Al2(SO4)4•H2O.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;制备实验方案的设计.
考点点评: 本题考查镁铝及其化合物的性质,对工艺流程理解、常用化学用语、盐类水解、物质的分离提纯与离子检验、化学计算等,综合性较大,难度较高,需要学生具备扎实的基础与运用知识分析解决问题的能力.1年前查看全部
- 向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH
向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如右图所示.则下列说法中正确的是
A.a点的溶液呈中性
B.b点发生反应的离子方程式是:
Al3 2SO42- 2Ba2 3OH— == Al(OH)3↓ 2BaSO4↓
C.c点加入Ba(OH)2溶液的体积为200 mL
D.c点溶液呈碱性
图是先上去到a,再上去(但斜率小了)到b,再下来到c随后平行线
希望说明一下每段的反应情况 zhuzi_01年前2
zhuzi_01年前2 -
 云开风散 共回答了15个问题
云开风散 共回答了15个问题 |采纳率86.7%首先要弄清楚反应顺序.
1.最先沉淀的是BASO4,然后这个东西的量就不变了.
2.接着沉淀AL(OH)3,因为一份AL(OH)3要消耗二分之三份BA(OH)2,所以斜率比较小.
3.随着反应的进行,AL(OH)3有全部转化为BA(ALO2)2,所以沉淀量下降.
再分析选项.
A错,此时NH4+刚好全部与OH-化合生成气体走掉了,且SO42-也沉淀完了,因此OH-肯定有剩下.溶液碱性.
B错,无BASO4沉淀.
C错,反应生成的氨气需消耗50mlBA(OH)2,因此是250ml.
D对.1年前查看全部
- 向硫酸铝铵溶液中逐滴加入NaOH溶液的过程中,
向硫酸铝铵溶液中逐滴加入NaOH溶液的过程中,
先生成Al(OH)3沉淀,然后是铵根离子和氢氧根离子反应生成氨气.最后是Al(OH)3变成偏铝酸根.为什么不是先生成氨气,或者是最后生成氨气. a911lee1年前1
a911lee1年前1 -
 sunnygirlgemini 共回答了19个问题
sunnygirlgemini 共回答了19个问题 |采纳率94.7%因为氨水的碱性强于氢氧化铝1年前查看全部
- 硫酸铝铵溶液加入少量氢氧化钡溶液反应过程
 ywp20031231年前3
ywp20031231年前3 -
 盛满帅哥的后宫 共回答了14个问题
盛满帅哥的后宫 共回答了14个问题 |采纳率85.7%由于 氢氧化钡溶液少量,令为1mol Ba(OH)2
而硫酸铝铵溶液过量,可令为10mol
又由于碱性:Al(OH)3 NH4+ 即溶液中的OH-先与Al3+ 反应后与NH4+反应,或Al3+有剩余时,NH4+是没有机会与OH-反应
则有:
Ba2+ + 2OH- + 10Al3+ + 10NH4+ + 20SO42-
有分数,不好确定,大家都放大3倍得:
3Ba2+ + 6OH- + 30Al3+ + 30NH4+ + 60SO42-=3BaSO4↓+ 2Al(OH)3↓ + 28Al3+ + 30NH4+ + 57SO42-
删除不参加反应的离子得:
3Ba2+ + 6OH- + 2Al3+ +3SO42-=3BaSO4↓+ 2Al(OH)3↓
综上:硫酸铝铵溶液中加少量氢氧化钡溶液的离子方程式为:
3Ba2+ + 6OH- + 2Al3+ +3SO42-=3BaSO4↓+ 2Al(OH)3↓1年前查看全部
- 无水硫酸铝铵和碳酸氢钠反应的方程式谁能写一下?多谢了!
 一亩田一家人1年前1
一亩田一家人1年前1 -
 德州扒鸡 共回答了12个问题
德州扒鸡 共回答了12个问题 |采纳率75%2NH4Al(SO4)2+6NaHCO3=3Na2SO4+(NH4)2SO4+2Al(OH)3↓+6CO2↑1年前查看全部
- 向100ml 1mol/l 的硫酸铝铵溶液中,逐滴加入1mol/l 的Ba(OH)2溶液,当加入的a(OH)2溶液的体积
向100ml 1mol/l 的硫酸铝铵溶液中,逐滴加入1mol/l 的Ba(OH)2溶液,当加入的a(OH)2溶液的体积V=______ml时 ,所得沉淀的质量最大,最大值?
 usic1年前1
usic1年前1 -
 重歼625 共回答了11个问题
重歼625 共回答了11个问题 |采纳率100%V=200mL时,沉淀量最大.
沉淀成分为0.1molAl(OH)3和0.2molBaSO4
质量54.4g1年前查看全部
- 铝及其重要化合物 硫酸铝铵与氢氧化钠反应
铝及其重要化合物 硫酸铝铵与氢氧化钠反应
向含有0.1mol NH4Al(SO4)2 溶液中逐滴加入5mol/L NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有刺激性气体的气味逸出;最后白色沉淀逐渐减少并最终消失.请画出生成沉淀的物质的量与加入NaOH溶液体积的关系 .横轴V(NaOH)为20.40.60.80.100.120ML ,纵轴 n沉淀 0.05 0.1 mol ygjsyfhqb1年前2
ygjsyfhqb1年前2 -
 许勤利 共回答了17个问题
许勤利 共回答了17个问题 |采纳率100%首先要弄清楚反应先后顺利.三份氢氧根离子先与一份铝离子反应,生成一份氢氧化铝沉淀.沉淀完全后,一份氢氧根离子与铵离子反应,生成一份氨气.铵离子全部反应后,一份氢氧根离子与一份氢氧化铝反应,生成一份偏铝酸根离子.图就没办法画了,根据反应比例画就可以了.一条上升,然后水平,最后下降.1年前查看全部
- 关于硫酸铝铵(NH4AL(SO4)2)的溶解度
关于硫酸铝铵(NH4AL(SO4)2)的溶解度
我想知道它在各温度下的溶解度,希望知道的朋友告诉我. cim20041年前2
cim20041年前2 -
 arsenalhj 共回答了21个问题
arsenalhj 共回答了21个问题 |采纳率90.5%下面是(NH4)2Al(SO4)2在不同温度下的溶解度,温度单位为K,溶解度单位为(g/100gH2O).括号里为温度.
2.10(273) 5.00(283) 7.74(293) 10.9(303) 14.9(313) 26.7(333)
文献资料就只能查到这些,应该给我最佳了吧?1年前查看全部
- (2012•顺义区二模)硫酸铝铵常用于水的净化以及工业水的处理.硫酸铝铵是白色透明结晶硬块,易溶于热水,水溶液呈酸性;随
(2012•顺义区二模)硫酸铝铵常用于水的净化以及工业水的处理.硫酸铝铵是白色透明结晶硬块,易溶于热水,水溶液呈酸性;随温度升高、脱去结晶水,产生晶变.工业用铝土矿(主要成分Al2O3、少量SiO2、Fe2O3、MgO等)为原料制取硫酸铝铵的工艺流程示意图如下:
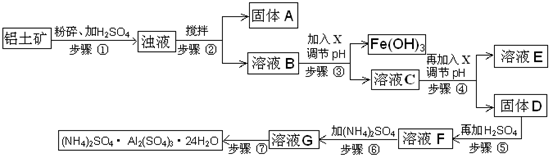
部分氢氧化物沉淀的pH如下表:
请回答下列问题:沉淀物 Al(OH)3 Fe(OH)3 Mg(OH)2 开始沉淀pH 3.8 2.7 9.4 完全沉淀pH 5.2 3.2 12.4
(1)步骤③中调节pH使Fe(OH)3沉淀完全,检验Fe3+是否沉淀完全的操作是______.
(2)若X为NaOH,步骤④中发生反应的离子方程式是______.
(3)用化学平衡移动原理解释步骤⑤中加入硫酸的作用______.
(4)硫酸铝铵水溶液呈酸性的原因是______(用离子方程式表示).浓度均为0.1mol/L硫酸铝和硫酸铝铵两种水溶液,c(Al3+) 较大的是______(填“硫酸铝铵”或“硫酸铝”)溶液.
(5)步骤⑥中,要求温度控制在90-100℃之间至硫酸铵全部溶解,其原因是______.
(6)步骤⑦的操作方法包括______. eric241年前1
eric241年前1 -
 芝麻小猪 共回答了14个问题
芝麻小猪 共回答了14个问题 |采纳率92.9%解题思路:(1)根据检验三价铁离子的检验方法完成;
(2)铝离子生成氢氧化铝沉淀的离子方程式;
(3)硫酸电离出氢离子与氢氧化铝电离出氢氧根离子反应生成水;
(4)铝离子、铵离子水解使溶液显示酸性;根据铵离子水解使溶液显示酸性,硫酸铝铵溶液中氢离子浓度大于硫酸铝溶液的,氢离子抑制了铝离子的水解;
(5)根据题中信息“易溶于热水,随温度升高、脱去结晶水,产生晶变”进行分析;
(6)从滤液G制取硫酸铝铵的操作有冷却,结晶、过滤、洗涤、干燥.(1)检验三价铁离子是否沉淀完全的方法是:取少量溶液C于试管中,加入2~3滴KSCN溶液,若溶液变成红色,说明Fe3+未沉淀完全;若溶液不变色,说明Fe3+已沉淀完全,
故答案为:取少量溶液C于试管中,加入2~3滴KSCN溶液,若溶液变成红色,说明Fe3+未沉淀完全;若溶液不变色,说明Fe3+已沉淀完全;
(2)溶液中铝离子与氢氧根离子生成氢氧化铝沉淀,反应的离子方程式为:Al3+﹢3OH-=Al(OH)3↓,
故答案为:Al3+﹢3OH-=Al(OH)3↓;
(3)因为硫酸电离出氢离子与氢氧化铝电离出氢氧根离子反应生成水,使Al(OH)3溶解平衡右移,至Al(OH)3溶解
故答案为:由于硫酸电离出氢离子与氢氧化铝电离出氢氧根离子反应生成水,使Al(OH)3溶解平衡右移,至Al(OH)3溶解;
(4)加入硫酸溶液,铝离子、铵离子水解,使溶液显示酸性,反应的离子方程式为:Al3+﹢3H2O⇌Al (OH)3﹢3H+; NH4++H2O⇌NH3•H2O+H+;根据铵离子水解使溶液显示酸性,硫酸铝铵溶液中氢离子浓度大于硫酸铝溶液的,氢离子抑制了铝离子的水解,所以硫酸铝铵溶液中铝离子浓度较大;
Al3+﹢3H2O⇌Al (OH)3﹢3H+; NH4++H2O⇌NH3•H2O+H+; 硫酸铝铵;
(5)由于硫酸铝铵“易溶于热水,随温度升高、脱去结晶水,产生晶变”,所以 温度控制在90-100℃之间,
故答案为:因为硫酸铝铵易溶于热水,有利于生成;随温度升高、脱去结晶水,产生晶变.所以 温度控制在90-100℃之间;
(6)根据题中图示,从滤液G制取硫酸铝铵,需要经过冷却,结晶、过滤、洗涤、干燥操作,
故答案为:冷却,结晶、过滤、洗涤、干燥.点评:
本题考点: 制备实验方案的设计;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查了硫酸铝铵的制取过程,注意题中信息的处理,本题难度中等.1年前查看全部
- (2014•浦东新区二模)在硫酸铝铵(NH4Al(SO4)2)溶液中滴加少量Ba(OH)2溶液并不断搅拌.用一个离子方程
(2014•浦东新区二模)在硫酸铝铵(NH4Al(SO4)2)溶液中滴加少量Ba(OH)2溶液并不断搅拌.用一个离子方程式表示最初发生的反应:______.
 撒哈拉的骄阳1年前1
撒哈拉的骄阳1年前1 -
 冷若冰-- 共回答了16个问题
冷若冰-- 共回答了16个问题 |采纳率100%解题思路:在硫酸铝铵(NH4Al(SO4)2)溶液中滴加少量Ba(OH)2溶液,由于氢氧化钡少量,氢氧根离子不足,反应按照氢氧化钡的组成进行,氨水碱性强于氢氧化铝,所以铝离子优先与氢氧根离子反应,据此写出反应的离子方程式.氢氧化钡少量,氢氧根离子和钡离子的物质的量不足,离子方程式按照氢氧化钡的组成书写,钡离子和氢氧根离子完全反应;由于氨水碱性强于氢氧化铝,故铝离子优先与氢氧根离子反应生成氢氧化铝沉淀,反应的离子方程式为3Ba2++6OH-+3SO42-+2Al3+=3BaSO4↓+2Al(OH)3↓,
故答案为:3Ba2++6OH-+3SO42-+2Al3+=3BaSO4↓+2Al(OH)3↓.点评:
本题考点: 离子方程式的书写;镁、铝的重要化合物.
考点点评: 本题考查了离子方程式的书写、反应物过量的判断,题目难度中等,注意掌握离子方程式的书写原则,正确判断反应物离子的过量情况是解答本题的关键.1年前查看全部
- (2014•闵行区二模)向硫酸铝铵溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是( )
(2014•闵行区二模)向硫酸铝铵溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是( )
A.NH4++SO42-+Ba2++OH-→BaSO4↓+NH3•H2O
B.2Al3++3SO42-+3Ba2++6OH-→3BaSO4↓+2Al(OH)3↓
C.Al3++2SO42-+2Ba2++4OH-→2BaSO4↓+AlO2-+2H2O
D.NH4++Al3++2SO42-+2Ba2++4OH-→2BaSO4↓+Al(OH)3↓+NH3•H2O nr49j61年前1
nr49j61年前1 -
 yq4588 共回答了21个问题
yq4588 共回答了21个问题 |采纳率95.2%解题思路:在NH4Al(SO4)2溶液中逐滴加入Ba(OH)2溶液,NH4Al(SO4)2和Ba(OH)2按照2:3反应,铝离子恰好沉淀,反应的离子方程式为:2Al3++3SO42-+3Ba2++6OH-→3BaSO4↓+2Al(OH)3↓;NH4Al(SO4)2和Ba(OH)2按照1:2反应,铵根离子参与反应生成一水合氨,反应的离子方程式为:NH4++Al3++2SO42-+2Ba2++4OH-→2BaSO4↓+Al(OH)3↓+NH3•H2O,如果NH4Al(SO4)2和Ba(OH)2按照2:5反应,氢氧化铝沉淀完全溶解,反应的离子方程式为:NH4++Al3++2SO42-+2Ba2++5OH-→2BaSO4↓+2H2O+AlO2-+NH3•H2O,据此进行解答.A.氨水碱性强于氢氧化铝,所以铝离子优先与氢氧根离子反应,如果铵根离子反应,铝离子一定参与反应,故A错误;
B.NH4Al(SO4)2和Ba(OH)2按照2:3反应,铝离子恰好沉淀,铵根离子没有参与反应,反应的离子方程式为:2Al3++3SO42-+3Ba2++6OH-→3BaSO4↓+2Al(OH)3↓,故B正确;
C.氢氧化铝沉淀溶解之前,铵根离子先与氢氧根离子反应生成一水合氨,铵根离子完全反应后,氢氧化铝沉淀才能够溶解,故C错误;
D.当氢氧化钡过量时,铵根离子、铝离子完全反应分别生成一水合氨、偏铝酸根离子,反应的离子方程式为:NH4++Al3++2SO42-+2Ba2++4OH-→2BaSO4↓+Al(OH)3↓+NH3•H2O,故D正确;
故选BD.点评:
本题考点: 离子方程式的书写.
考点点评: 本题考查了离子方程式的正误判断,题目难度较大,注意掌握离子方程式的书写原则,正确判断反应物的过量情况及优先与氢氧根离子反应的离子是解答本题关键.1年前查看全部
- 1mol/L的铵盐溶液中铵根离子浓度排列 :一水合氨、硫酸铵、醋酸铵、氯化铵、硫酸氢铵、硫酸铝铵、碳酸铵
1mol/L的铵盐溶液中铵根离子浓度排列 :一水合氨、硫酸铵、醋酸铵、氯化铵、硫酸氢铵、硫酸铝铵、碳酸铵
碳酸氢铵(从大到小) 雨中难人行1年前1
雨中难人行1年前1 -
 fgigigi 共回答了15个问题
fgigigi 共回答了15个问题 |采纳率93.3%一水合氨 NH3·H2O 硫酸铵(NH4)2SO4 醋酸铵 CH3COONH4 氯化铵NH4Cl
硫酸氢铵 NH4HSO4 、 硫酸铝铵NH4Al(SO4)2 、碳酸铵(NH4)2CO3
一般来说,强电解质是完全电离的,因此,产生铵根离子浓度要大些,同时注意到
(一) 1 mol (NH4)2SO4 和 (NH4)2CO3 完全电离产生的铵根近似为2 mol
因此,这二者应是里面铵根浓度较大的.
又因为,CO32- 水解呈碱性,会促进铵根的水解,使铵根离子的浓度减少得多一些,因此浓度关系为:(NH4)2SO4 > (NH4)2CO3
(二) 醋酸铵 CH3COONH4 氯化铵NH4Cl 硫酸氢铵 NH4HSO4 、 硫酸铝铵NH4Al(SO4)2
1 mol 上述物质完全电离,都近似得到 1mol 铵根,它们之间浓度比较相近些,但比(一)中两物质浓度小得多.
注意到:硫酸氢铵 NH4HSO4 中电离的H+对铵根的水解有抑作用,硫酸铝铵NH4Al(SO4)2 中的铝离子,水解呈酸性,对铵根水解也有抑制作用,因此二者都比氯化铵(NH4Cl)不水解的的氯离子中的铵根浓度大,由于Al3+水解一般比微弱,因此,抑制作用没有H+强,
而醋酸铵中CH3COO-水解呈现碱性,促进铵根水解,使其消耗更多,从而浓度下降.
所以铵根浓度关系为:
NH4HSO4 > NH4Al(SO4)2 > NH4Cl> CH3COONH4
(三)由于一水合氨是弱电解质,只能电离一部分铵根离子,因此1 mol NH3·H2O溶于水,产生铵根远小于1mol,故铵根浓度最小.
综上所述,铵根浓度大小关系为:(NH4)2SO4 > (NH4)2CO3 > NH4HSO4 > NH4Al(SO4)2 > NH4Cl> CH3COONH41年前查看全部
- 向100mL0.1mol/L硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol/L Ba(OH)2溶液.随着B
向100mL0.1mol/L硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol/L Ba(OH)2溶液.随着Ba(OH)2溶液体积V
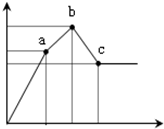 向100mL0.1mol/L硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol/L Ba(OH)2溶液.随着Ba(OH)2溶液体积V(横坐标)的变化,沉淀总物质的量n的变化如图所示,
向100mL0.1mol/L硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol/L Ba(OH)2溶液.随着Ba(OH)2溶液体积V(横坐标)的变化,沉淀总物质的量n的变化如图所示,
已知铝盐中滴加过量氨水能产生Al(OH)3沉淀,该沉淀遇强碱如NaOH溶液又可溶解NaOH+Al(OH)3=NaAlO2+2H2O,请回答下列问题
(1)写出b-c发生反应的离子方程式:______
(2)下列说法正确的是______
A.a点的溶质为(NH4)2SO4
B.b点溶液中一定存在:c(NH4+)+c(H+)=c(OH-)
C.b点沉淀为Al(OH)3和BaSO4
D.C点溶液中一定存在:c(AlO2-)>c(Ba2+)>c(NH4+)
(3)写出a-b发生反应的离子方程式:______
(4)滴加到c点共加入Ba(OH)2溶液的体积为______mL,b、a两点沉淀的质量差为______g(精确到0.001).(注:要求在答题卡最下面方框内仅列出计算比例式)
 maxxy1年前1
maxxy1年前1 -
 hbycsmile 共回答了19个问题
hbycsmile 共回答了19个问题 |采纳率94.7%100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2],NH4Al(SO4)2物质的量为0.01mol.溶液含有NH4+0.01mol,Al3+0.01mol,SO42-0.02mol.
关键弄清楚反应顺序,开始滴加同时发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,当Al3+沉淀完全时需加入0.03molOH-,即加入0.015molBa(OH)2,加入的Ba2+为0.015mol,SO42-未完全沉淀,此时溶液含有硫酸铵(开始到a);
再滴加Ba(OH)2,生成BaSO4沉淀,发生反应为SO42-+Ba2+=BaSO4↓,NH4++OH-=NH3?H2O,所以沉淀质量继续增加;当SO42-完全沉淀时,共需加入0.02molBa(OH)2,加入0.04molOH-,Al3+反应掉0.03molOH-,生成Al(OH)30.01mol,剩余0.01molOH-恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液(a到b);
继续滴加Ba(OH)2,Al(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使0.01molAl(OH)3完全溶解,需再加入0.005molBa(OH)2,此时溶液为氨水与偏铝酸钡溶液(b到c).
(1)b-c发生反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(2)A、由分析可知,从开始到a点,发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,a点的溶质为(NH4)2SO4,故A正确;
B、由分析可知,溶液中NH4+完全反应,此时溶液为氨水溶液又电荷守恒可知,b点溶液中一定存在:c(NH4+)+c(H+)=c(OH-),故B正确;
C、由分析可知,b点沉淀为Al(OH)3和BaSO4,故C正确;
D、C点为氨水与偏铝酸钡溶液,0.01molAl(OH)3完全溶解生成0.01molAlO2-,需再加入0.005molBa(OH)2,一水合氨电离很弱,则点溶液中一定存在:c(AlO2-)>c(Ba2+)>c(NH4+),故D正确,
故答案为:ABCD;
(3)由上述分析可知,a-b发生离子反应为SO42-+Ba2++NH4++OH-=BaSO4↓+NH3?H2O,
故答案为:SO42-+Ba2++NH4++OH-=BaSO4↓+NH3?H2O;
(4)当SO42-完全沉淀时,共需加入0.02molBa(OH)2,要使0.01molAl(OH)3完全溶解,需再加入0.005molBa(OH)2,则滴加到c点共加入Ba(OH)2溶液的体积为[0.025mol/0.1mol/L]=0.25L=250mL;
a点到b点,发生沉淀反应为SO42-+Ba2+=BaSO4↓,需要0.005molBa(OH)2,即b、a两点沉淀的质量差为0.005mol×233g/mol=1.165g,
故答案为:250;1.165.1年前查看全部
- 氢氧化钠加到硫酸铝铵中 氢氧根先和什么反应
 ThinkFocus1年前2
ThinkFocus1年前2 -
 抽你 共回答了20个问题
抽你 共回答了20个问题 |采纳率85%铝离子与氢氧化钠反应,用实际氢氧化物,当溶液中滴加氢氧化钠,生成白色沉淀先生(氢氧化铝)的溶液含有铝离子的溶液,然后将白色沉淀物会慢慢地溶解(即,氢氧化铝铝酸钠的氢氧化物被生成的反射),
使铝离子和氢氧化钠是由铝酸钠反应步骤的反应中产生,两者不能直接反应!1年前查看全部
- 写出在硫酸铝铵溶液中加入少量氢氧化钡溶液的离子方程式: 答案 2(Al3+)+3[(SO4)2-]+3[Ba2+]+
写出在硫酸铝铵溶液中加入少量氢氧化钡溶液的离子方程式: 答案 2(Al3+)+3[(SO4)2-]+3[Ba2+]+
写出在硫酸铝铵溶液中加入少量氢氧化钡溶液的离子方程式:
答案 2(Al3+)+3[(SO4)2-]+3[Ba2+]+6(OH-)===2Al(OH)3↓+3BaSO4↓
如果改为(Al3+)+2[(SO4)2-]+2[Ba2+]+3(OH-)===Al(OH)3↓+2BaSO4↓还对吗?为什么?两式是否与少量氢氧化钡溶液有关? ufofu_011年前2
ufofu_011年前2 -
 不怕麻烦 共回答了19个问题
不怕麻烦 共回答了19个问题 |采纳率89.5%不能,因为氢氧化钡为少量且阴阳离子均参加反应,则钡离子与氢氧根一定全反应,则两离子在方程式中比例一定要按1:2,否则如你的2:3则有一氢氧根未反应,不合实际,所以不能 .方程式两边不能随便约去,你的提问很好,观察细致,会主动思考问题,继续加油!1年前查看全部
- 能否用铵明矾制氨气硫酸铝铵+消石灰 ==加热==?
 感觉小笨猪1年前3
感觉小笨猪1年前3 -
 冰雪小思思 共回答了14个问题
冰雪小思思 共回答了14个问题 |采纳率100%你反了吧
工业上以高岭土和硫酸、氨气为原料制取铵明矾[NH4Al(SO4)2•12H2O]和硫酸铝,反应原理如下(忽略高岭土其他成分与硫酸的反应):
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O…………①
Al2(SO4)3 + H2SO4 + 2NH3 → 2NH4Al(SO4)2 …………②
实验室制取氨气:
①铵盐与碱加热制取氨气,常用NH4Cl与Ca(OH)2反应,固体与固体反应,试管要向下倾斜.
②在浓氨水中加碱或生石灰,因为氨水中存在下列平衡:
NH3+H2O NH3·H2O NH4++OH-加入碱平衡左移,同时放出大量的热促进氨水的挥发.
③加热浓氨水,加快氨水挥发.1年前查看全部
- 硫酸铝铵中三氧化二铝的含量有多高.
硫酸铝铵中三氧化二铝的含量有多高.
如上 soulinpain1年前1
soulinpain1年前1 -
 yxwangpeng 共回答了19个问题
yxwangpeng 共回答了19个问题 |采纳率89.5%把硫酸铝铵中的铝元素质量折算成多少克氧化铝中含有等量的铝元素
氧化铝式量94
硫酸铝铵式量233
1mol硫酸铝铵~0.5mol氧化铝
233~47
硫酸铝铵中氧化铝的含量为47/233=20.17%1年前查看全部
- 硫酸铝铵和少量氢氧化钠反应方程式
硫酸铝铵和少量氢氧化钠反应方程式
硫酸铝铵和少量氢氧化钠反应方程式及离子方程式..硫酸铝铵和过量氢氧化钠反应方程式及离子方程式.. 858148MOS1年前3
858148MOS1年前3 -
 tangchie 共回答了16个问题
tangchie 共回答了16个问题 |采纳率93.8%既然是少量氢氧化钠,那意思就是生成Al(OH)3就到此为止,不会进一步反应生成偏铝酸钠了.
很简单嘛~
(NH4)Al(SO4)2 + 4NaOH = NH3 + Al(OH)3 + H2O + 2Na2SO4
离子方程式去掉没有发生变化的硫酸根和钠离子
NH4(+) + Al(3+) + 4OH(-) = NH3 +Al(OH)3 +H2O
(括号中有+/-的表示电荷,这里貌似没法调成上标)1年前查看全部
- 做馒头的香甜泡打粉配料含40%的硫酸铝铵(无水物),据说含铝的食品添加剂对人体有害,这个算吗?
 tian51151年前1
tian51151年前1 -
 边城雪 共回答了16个问题
边城雪 共回答了16个问题 |采纳率87.5%算,不过只是微量1年前查看全部
- 一道离子反应题目1.向硫酸铝铵溶液中滴加氢氧化钠溶液,毫无疑问,氢氧化钠先和三价铝反应,然后问题出来了当铝离子完全转化为
一道离子反应题目
1.向硫酸铝铵溶液中滴加氢氧化钠溶液,毫无疑问,氢氧化钠先和三价铝反应,
然后问题出来了
当铝离子完全转化为氢氧化铝沉淀后,氢氧化钠先和铵根反应还是先和氢氧化铝反应呢
2.一道类似的题目,向硫酸铝溶液中通入过量的氨气,使铝离子完全转化为氢氧化铝沉淀,
在这时向其中滴加氢氧化钠溶液,氢氧化钠先和铵根反应还是先和氢氧化铝反应呢
和第一道题目还一样么 罗卜头已tt1年前2
罗卜头已tt1年前2 -
 小澄 共回答了16个问题
小澄 共回答了16个问题 |采纳率100%1. 先与NH4+反应.
Al3+在pH9的时候Al(OH)3开始溶解.
NH4+在pH>5的时候即开始与OH-结合.
2. 都一样.溶液中有氨存在的情况下,NH4+与OH-的反应会有所推迟,但没有什么本质改变1年前查看全部
- 硫酸氢铵和硫酸铝铵那个溶液中含有的铵根离子最多?急-
硫酸氢铵和硫酸铝铵那个溶液中含有的铵根离子最多?急-
答案说是硫酸氢铵啊…… 黄鹤去1年前6
黄鹤去1年前6 -
 carmie 共回答了26个问题
carmie 共回答了26个问题 |采纳率80.8%硫酸氢铵NH4HSO4
硫酸铝铵AlNH4(SO4)2
等浓度的AlNH4(SO4)2和NH4HSO4溶液
NH4+水解显酸性
但是HSO4相当于1元强酸 HSO4-=H+ +SO42-
强烈抑制NH4+的水解
而Al3+的水解能力虽然强 但是不如HSO4-电离的程度大
因此,NH4HSO4中的NH4+浓度大
祝你新年快乐1年前查看全部
- 向硫酸铝铵溶液中逐滴加入Ba(OH) 2 溶液,可能发生的反应的离子方程式是 A.NH 4 + + SO 4 2 — +
向硫酸铝铵溶液中逐滴加入Ba(OH) 2 溶液,可能发生的反应的离子方程式是
A.NH 4 + + SO 4 2 — + Ba 2+ +OH —  BaSO 4 ↓+ NH 3 ·H 2 O
BaSO 4 ↓+ NH 3 ·H 2 OB.2Al 3+ + 3SO 4 2 — +3Ba 2+ +6OH —  3BaSO 4 ↓+ 2Al(OH) 3 ↓
3BaSO 4 ↓+ 2Al(OH) 3 ↓C.Al 3+ + 2SO 4 2 — + 2Ba 2+ + 4OH —  2BaSO 4 ↓+ AlO 2 — + 2H 2 O
2BaSO 4 ↓+ AlO 2 — + 2H 2 OD.NH 4 + +Al 3+ +2SO 4 2 — +2Ba 2+ +4OH —  2BaSO 4 ↓+ Al(OH) 3 ↓+ NH 3 ·H 2 O
2BaSO 4 ↓+ Al(OH) 3 ↓+ NH 3 ·H 2 O 紫竹静心1年前1
紫竹静心1年前1 -
 玛瑙葡萄 共回答了16个问题
玛瑙葡萄 共回答了16个问题 |采纳率100%BD
1年前查看全部
- 关于硫酸铝铵的一道题向15.0mL 1.0mo1·L一的NH4A1(S04)2溶液中逐滴加人1.5mol·L-1的 Na
关于硫酸铝铵的一道题
向15.0mL 1.0mo1·L一的NH4A1(S04)2溶液中逐滴加人1.5mol·L-1的 NaOH溶液,并不断搅拌.当生成沉淀的量最大时,下列对加入NaOH溶液的体积V的判断,正确的是
A.恰好V=30.0mL B.恰好V=40.0mL
C.30.0mL≤v≤40.0mL D.以上都不正确
2楼的高手,请问为什么先跟氢氧化铝反应啊,照你的说法30毫升就够了,不是嘛?可否再详细一些 破不了尘1年前3
破不了尘1年前3 -
 qqwzh 共回答了15个问题
qqwzh 共回答了15个问题 |采纳率100%先看反应的顺序
NaOH先和Al3+离子反应,再NH4+离子反应,接着和Al(OH)3反应
原因:氨水能制取Al(OH)3,却不会产生AlO2-
所以在沉淀最大后,和NH4+离子反应时,沉淀质量不变
所以沉淀最大是在一个区域,不是一个值
用化学式计算后,
C是正确的!1年前查看全部
- 向100mL0.1mol/L硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol/L Ba(OH)2溶
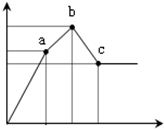 向100mL0.1mol/L硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol/L Ba(OH)2溶液.随着Ba(OH)2溶液体积V(横坐标)的变化,沉淀总物质的量n的变化如图所示,
向100mL0.1mol/L硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol/L Ba(OH)2溶液.随着Ba(OH)2溶液体积V(横坐标)的变化,沉淀总物质的量n的变化如图所示,
已知铝盐中滴加过量氨水能产生Al(OH)3沉淀,该沉淀遇强碱如NaOH溶液又可溶解NaOH+Al(OH)3=NaAlO2+2H2O,请回答下列问题
(1)写出b-c发生反应的离子方程式:______
(2)下列说法正确的是______
A.a点的溶质为(NH4)2SO4
B.b点溶液中一定存在:c(NH4+)+c(H+)=c(OH-)
C.b点沉淀为Al(OH)3和BaSO4
D.C点溶液中一定存在:c(AlO2-)>c(Ba2+)>c(NH4+)
(3)写出a-b发生反应的离子方程式:______
(4)滴加到c点共加入Ba(OH)2溶液的体积为______mL,b、a两点沉淀的质量差为______g(精确到0.001).(注:要求在答题卡最下面方框内仅列出计算比例式) 一切随凤1年前1
一切随凤1年前1 -
 sz_oct 共回答了11个问题
sz_oct 共回答了11个问题 |采纳率90.9%解题思路:100mL 0.1mol•L-1硫酸铝铵[NH4Al(SO4)2],NH4Al(SO4)2物质的量为0.01mol.溶液含有NH4+0.01mol,Al3+0.01mol,SO42-0.02mol.
关键弄清楚反应顺序,开始滴加同时发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,当Al3+沉淀完全时需加入0.03molOH-,即加入0.015molBa(OH)2,加入的Ba2+为0.015mol,SO42-未完全沉淀,此时溶液含有硫酸铵(开始到a);
再滴加Ba(OH)2,生成BaSO4沉淀,发生反应为SO42-+Ba2+=BaSO4↓,NH4++OH-=NH3・H2O,所以沉淀质量继续增加;当SO42-完全沉淀时,共需加入0.02molBa(OH)2,加入0.04molOH-,Al3+反应掉0.03molOH-,生成Al(OH)30.01mol,剩余0.01molOH-恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液(a到b);
继续滴加Ba(OH)2,Al(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使0.01molAl(OH)3完全溶解,需再加入0.005molBa(OH)2,此时溶液为氨水与偏铝酸钡溶液(b到c),以此来解答.100mL 0.1mol•L-1硫酸铝铵[NH4Al(SO4)2],NH4Al(SO4)2物质的量为0.01mol.溶液含有NH4+0.01mol,Al3+0.01mol,SO42-0.02mol.
关键弄清楚反应顺序,开始滴加同时发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,当Al3+沉淀完全时需加入0.03molOH-,即加入0.015molBa(OH)2,加入的Ba2+为0.015mol,SO42-未完全沉淀,此时溶液含有硫酸铵(开始到a);
再滴加Ba(OH)2,生成BaSO4沉淀,发生反应为SO42-+Ba2+=BaSO4↓,NH4++OH-=NH3・H2O,所以沉淀质量继续增加;当SO42-完全沉淀时,共需加入0.02molBa(OH)2,加入0.04molOH-,Al3+反应掉0.03molOH-,生成Al(OH)30.01mol,剩余0.01molOH-恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液(a到b);
继续滴加Ba(OH)2,Al(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使0.01molAl(OH)3完全溶解,需再加入0.005molBa(OH)2,此时溶液为氨水与偏铝酸钡溶液(b到c).
(1)b-c发生反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(2)A、由分析可知,从开始到a点,发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,a点的溶质为(NH4)2SO4,故A正确;
B、由分析可知,溶液中NH4+完全反应,此时溶液为氨水溶液又电荷守恒可知,b点溶液中一定存在:c(NH4+)+c(H+)=c(OH-),故B正确;
C、由分析可知,b点沉淀为Al(OH)3和BaSO4,故C正确;
D、C点为氨水与偏铝酸钡溶液,0.01molAl(OH)3完全溶解生成0.01molAlO2-,需再加入0.005molBa(OH)2,一水合氨电离很弱,则点溶液中一定存在:c(AlO2-)>c(Ba2+)>c(NH4+),故D正确,
故答案为:ABCD;
(3)由上述分析可知,a-b发生离子反应为SO42-+Ba2++NH4++OH-=BaSO4↓+NH3・H2O,
故答案为:SO42-+Ba2++NH4++OH-=BaSO4↓+NH3・H2O;
(4)当SO42-完全沉淀时,共需加入0.02molBa(OH)2,要使0.01molAl(OH)3完全溶解,需再加入0.005molBa(OH)2,则滴加到c点共加入Ba(OH)2溶液的体积为[0.025mol/0.1mol/L]=0.25L=250mL;
a点到b点,发生沉淀反应为SO42-+Ba2+=BaSO4↓,需要0.005molBa(OH)2,即b、a两点沉淀的质量差为0.005mol×233g/mol=1.165g,
故答案为:250;1.165.点评:
本题考点: 化学方程式的有关计算;离子方程式的有关计算.
考点点评: 本题考查了物质间的反应,明确物质的性质及离子反应先后顺序是解本题关键,明确各个拐点溶液中存在的溶质,注意:NH4+与Al3+同时存在,OH-首先与Al3+反应,而NH4+与Al(OH)3同时存在,OH-首先与NH4+反应,为易错点,题目难度较大.1年前查看全部
- 硫酸铝铵[NH4Al(SO4)2]溶于水能电离出NH4(+),Al(3+)和SO4(2-).往硫酸铝铵溶液中滴加过量Na
硫酸铝铵[NH4Al(SO4)2]溶于水能电离出NH4(+),Al(3+)和SO4(2-).往硫酸铝铵溶液中滴加过量NaOH溶液并加热,写出反应的离子方程式:_______________
往硫酸铝铵溶液中滴加过量的Ba(OH)2溶液并加热,写出反应的离子方程式:____________ 不玩篮球1年前1
不玩篮球1年前1 -
 造就爱的天空 共回答了18个问题
造就爱的天空 共回答了18个问题 |采纳率94.4%(1) NH4(+)+OH(-)=NH3+H2O
AL(3+)+4OH(-)=AIO2(-)+2H2O
(2)
NH4(+)+OH(-)=NH3+H2O
AL(3+)+4OH(-)=AIO2(-)+2H2O
BA(2+)+SO4(2-)=BASO41年前查看全部
- 硫酸铝铵和氢氧化钡反应求随加入Ba(OH)2的量增加,与硫酸铝铵[NH4AL(SO4)2]的反应过程请按顺序列出反应方程
硫酸铝铵和氢氧化钡反应
求随加入Ba(OH)2的量增加,与硫酸铝铵[NH4AL(SO4)2]的反应过程
请按顺序列出反应方程式 幸O福1年前3
幸O福1年前3 -
 csceclihe 共回答了15个问题
csceclihe 共回答了15个问题 |采纳率80%Ba(OH)2+2NH4Al(SO4)2===BaSO4↓+NH3·H2O+Al2(SO4)3
3Ba(OH)2+Al2(SO4)3===3BaSO4↓+2+Al(OH)3↓
Ba(OH)2+2Al(OH)3===Ba(AlO2)2+4H201年前查看全部
- 硫酸铝铵与过量氢氧化钠的3个反应方程?
 pollypl1年前1
pollypl1年前1 -
 shafa010 共回答了20个问题
shafa010 共回答了20个问题 |采纳率90%三段:第一步是生成氢氧化铝沉淀; 第二步是生成一水合氨 第三步是氢氧化铝和氢氧化钠反应生成偏铝酸钠 自己写去!1年前查看全部
- 硫酸铝铵与少量氢氧化钠反应产物?
硫酸铝铵与少量氢氧化钠反应产物?
不会生成氢氧化铝沉淀? 瞬的小小宇宙1年前3
瞬的小小宇宙1年前3 -
 光2004 共回答了12个问题
光2004 共回答了12个问题 |采纳率83.3%少量时:2NH4Al(SO4)2+2NaOH=Na2SO4+2NH3↑+Al2(SO4)3+2H2O
过量时:NH4Al(SO4)2+5NaOH=NH3↑+NaAlO2+2Na2SO4+3H2O
适量时:NH4Al(SO4)+4NaOH=NH3↑+Al(OH)3↓+H2O1年前查看全部
- 硫酸铝铵和氢氧化钡溶液反应最开始NH4+ + OH- =H2O + NH3↑Al3+ + 3OH- =Al(OH)3↓B
硫酸铝铵和氢氧化钡溶液反应
最开始NH4+ + OH- =H2O + NH3↑
Al3+ + 3OH- =Al(OH)3↓
Ba2+ + SO4 2-=BaSO4↓
之后Al(OH)3+OH-=AlO2 - +2 H2O
Ba2+ + SO4 2- = BaSO4↓
总反应2NH4 Al (SO4)2 +5Ba(OH)2 = Ba(AlO2)2 + 2NH3↑+ 4BaSO4 + 6H2O对于上述反应,优先生成氨气还是偏铝酸盐,为什么 9qrr81年前2
9qrr81年前2 -
 爱我站左边 共回答了14个问题
爱我站左边 共回答了14个问题 |采纳率92.9%在硫酸铝铵溶液中,存在NH4+、Al3+与SO42-,当加入少量氢氧化钡溶液后,Ba2+和SO42-结合生成BaSO4,OH-则既可与Al3+结合又能与NH4+结合.
由于在含有Al3+的溶液中滴入氨水,生成白色沉淀可知,Al3+结合OH-的能力大于NH4+结合OH-的能力,OH-优先与Al3+结合生成Al(OH)3.
根据铵根离子与偏铝酸根离子发生双水解反应生成氨水和氢氧化铝沉淀,得出氢氧根离子遇到铵根离子和氢氧化铝沉淀时,先与铵根离子反应
所以随着Ba(OH)2的滴加反应顺序如下:
(1)Ba2+ + SO4 2-=BaSO4↓;Al3+ + 3OH- =Al(OH)3↓
(2)NH4+ + OH- =可逆=NH3·H2O=可逆=H2O + NH3↑(NH3极易溶于水,不加热产生的氨气很少)
(3)Al(OH)3+OH-=AlO2 - +2 H2O1年前查看全部
- 硫酸铝铵主要成分硫酸铝铵是什么东西?对人体有害吗?
 独行知猪侠1年前1
独行知猪侠1年前1 -
 xiongleiqq1983 共回答了13个问题
xiongleiqq1983 共回答了13个问题 |采纳率100%铵明矾 (硫酸铝铵晶体)
分子式:ainh4(so4)2.12h2o
性状:无色玻璃状八面结晶至白色颗粒或粉末,无臭略带甜味,有强收敛性.
用途:发酵粉加工、油炸食品、海蜇淹渍、粉条加工、果蔬保鲜保脆、护色、净水环保、消毒、橡胶加工、制革、洗衣粉加工、饲料加工、铅笔制作.
特点:高白度、高细度、高含量、时间长不结块,给用户制作加工提供了方便.1年前查看全部
- 硫酸铝铵的形成原理是什么?如果以硫酸铝和氯化铵进行反应,加热后冷却结晶,其中断键,反应类型都是什么?
 馒头小妞1年前4
馒头小妞1年前4 -
 徽州骆驼 共回答了14个问题
徽州骆驼 共回答了14个问题 |采纳率92.9%不是硫酸铝和氯化铵
是硫酸铝和硫酸铵 混合结晶得到的1年前查看全部
- 硫酸铝铵加浓氢痒化钠的过程中出现的现象
硫酸铝铵加浓氢痒化钠的过程中出现的现象
要详细的一步一步 一个现象一个现象来 加分哦 黑你无敌1年前1
黑你无敌1年前1 -
 对面床的 共回答了22个问题
对面床的 共回答了22个问题 |采纳率90.9%先沉淀AL(oh)3后沉淀消失 NAAL021年前查看全部
- 硫酸铝铵溶液中滴入氢氧化钡之硫酸根沉淀刚好完全的化学方程式
硫酸铝铵溶液中滴入氢氧化钡之硫酸根沉淀刚好完全的化学方程式
硫酸铝铵是NH4AL【SO4】2 沫沫_佑1年前2
沫沫_佑1年前2 -
 淘浪子 共回答了18个问题
淘浪子 共回答了18个问题 |采纳率100%NH4AL【SO4】2+2Ba(OH)2=2BaSO4+Al(OH)3+NH3、H2O1年前查看全部
- 若将硫酸铝铵溶液加水稀释,物质的量浓度上升的离子是什么?为什么?(怎么判断的)
 wzh_20051年前1
wzh_20051年前1 -
 凉天秋 共回答了22个问题
凉天秋 共回答了22个问题 |采纳率95.5%氢氧根离子,稀释后溶液酸性减弱,氢离子浓度降低,根据水离子积常数,氢氧根离子浓度升高1年前查看全部
- 硫酸铝铵物理性质熔点 溶解度
 小小燕儿在林梢1年前2
小小燕儿在林梢1年前2 -
 maggie_wener 共回答了15个问题
maggie_wener 共回答了15个问题 |采纳率93.3%硫酸铝
无水硫酸铝Al2(SO4)3为白色粉末.从水溶液中得到的为Al2(SO4)3.18H2O,它是无色针状结晶.将纯Al(OH)3溶于热的浓H2SO4或者用H2SO4直接处理铝土矿或粘土都可以制得Al2(SO4)3.
2Al(OH)3 + 3H2SO4 Al2(SO4)3 + 6H2O
Al2O3·2SiO2·2H2O(粘土) + 3H2SO4 Al2(SO4)3 + 2H4SiO4↓+ H2O
硫酸铝易与K+、Rb+、Cs+、NH4+和Ag+等的硫酸盐结合形成矾,其通式为MAl(SO4)2·12H2O(M表示一价金属离子).在矾的分子结构中,有6个H2O分子与Al3+配位,形成Al(H2O)63+离子,余下的为晶格中的水分子,它们在Al(H2O)63+与阴离子(SO42-)之间形成氢键.硫酸铝钾KAl(SO4)2·12H2O对叫做铝钾矾,俗称明矾,它是无色晶体.Al2(SO4)3或明矾都易溶于水并且水解,它们的水解过程与AlCl3的相同,产物也是从一些碱式盐到Al(OH)3胶状沉淀.由于这些水解产物胶粒的吸附作用和Al3+的凝聚作用,Al2(SO4)3和明矾是人们早已广泛使用的净水剂(絮凝剂),但是处理水的效果不及碱式氯化铝好.铝离子能引起神经元退化,若人脑组织中铝离子浓度过大会出现早衰性痴呆症.Al2(SO4)3和明矾还用作媒染剂.织物用Al2(SO4)3的水溶液浸泡以后,再浸在Na2CO3或Ca(OH)2溶液中片刻,则所产生的胶状Al(OH)3沉积在纤维上,很容易吸附染料.此外,Al2(SO4)3还是泡沫灭火机中常用的药剂.1年前查看全部
- 硫酸铝铵对人体有害吗
 vvasq123a1年前1
vvasq123a1年前1 -
 mgliang 共回答了15个问题
mgliang 共回答了15个问题 |采纳率93.3%危害很小,不要大量接触就好了,
硫酸铝是城市生活中的必要品,是饮用水的混凝剂,有清洁之功能.
所以合理运用是不会对人体造成危害的,1年前查看全部
- 硫酸铝铵对人体的危害有哪些?作为食品添加剂,这东西能吃?还是少吃为好.
 xxzwx1181年前1
xxzwx1181年前1 -
 安娜王妃 共回答了17个问题
安娜王妃 共回答了17个问题 |采纳率88.2%含铝的东西要少吃,吃多了容易痴呆,化学老师说的1年前查看全部
- 硫酸铝铵和过量氢氧化钠反应的离子式
硫酸铝铵和过量氢氧化钠反应的离子式
硫酸铝铵和过量氢氧化钡反应的离子式 abitcool1年前1
abitcool1年前1 -
 飘渺孤鸿影 共回答了24个问题
飘渺孤鸿影 共回答了24个问题 |采纳率100%NH4 + + Al3+ + 5OH- = NH3↑ + AlO2 - + 3H2O1年前查看全部
- 硫酸铝铵水溶液中滴加石蕊溶液会产生什么现象?为什么?
硫酸铝铵水溶液中滴加石蕊溶液会产生什么现象?为什么?
为什么也要回答 刈逸易路wm1年前1
刈逸易路wm1年前1 -
 唯一蓉 共回答了22个问题
唯一蓉 共回答了22个问题 |采纳率95.5%变红 铝离子 铵根离子水解显酸性啊…结合氢氧根 剩下氢离子1年前查看全部
- 0.01mol/l硫酸铝铵与0.02mol/l氢氧化钡溶液等体积混合离子方程式
 qwpxyz1年前2
qwpxyz1年前2 -
 孙铁铺 共回答了15个问题
孙铁铺 共回答了15个问题 |采纳率93.3%Al3+ +NH4+ +2SO4 2- +2Ba2+ +4OH-=2BaSO4+H2O+NH3+Al(OH)31年前查看全部
大家在问
- 113?It was fun to play on the beach that it attracted _______
- 2英语翻译原文:体育课中,同学们都在操场上自由活动,每个人都在玩自己喜欢的体育项目,有的在打篮球,有的在打排球,有的在跳绳
- 3-1,3,-5,7,-9,11,、、、,-17,19如果选出若干个数相加,使他们的和为0,那么至少要选几个数?
- 4(2012•康县模拟)一根铁丝,第一次用去全长的[2/5],第二次又用去14米,剩下的与用去的长度比是1:3.这根铁丝原
- 5请问:什么是生物质能
- 6数学 初一 乘法公式2在公式(a+1)^2=a^2+2*a+1中,当a分别取1.2.3.……n时,可得到下列n个等式:
- 7将十进制357.96分别转换为二进制数、八进制数、十六进制数;将二进制数111010011010
- 8科技发展利大于弊的四辩辩词 还有一些辩论观点
- 9阅读诗歌《木兰花》回答问题。 木兰花
- 10试写出命题“两条直线相交,只有一个交点”的题设部分和结论部分.判断它是真命题还是假命题,并简要说明理由.
- 11上身靠在桌子上,快速地写用一个成语,什么成语
- 12y=1-|x|,y=1-1/2|x|,y=1-2|x|画出函数图像
- 13将正方形ABCD沿BD折成直二面角,M为CD中点,则角AMD的大小?答案是30度
- 14目前,直接利用的淡水资源是( ) A.冰川、地下水 B.江和湖泊水、浅层地下水 C.江河湖泊水 D.江河水,海洋水
- 15找几句有气势的句子,关于做辩论赛海报的~
