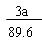氢氧化锂与盐酸、硫酸、碳酸钠反应
 peaceful7382022-10-04 11:39:541条回答
peaceful7382022-10-04 11:39:541条回答碳酸钠可以共存,应该是用各种铵态氮肥溶液

已提交,审核后显示!提交回复
共1条回复
 风起落叶飘 共回答了19个问题
风起落叶飘 共回答了19个问题 |采纳率100%- LiOH + HCl = LiCl + H2O2 LiOH + H2SO4 = Li2SO4 + 2 H2OLiOH + Na2CO3 —— 不反应
- 1年前
相关推荐
- 氢氧化锂与稀硫酸反应的化学方程式
 一个xy酒窝1年前1
一个xy酒窝1年前1 -
 flm38467 共回答了19个问题
flm38467 共回答了19个问题 |采纳率89.5%有两个反应.
当氢氧化锂1摩尔,硫酸1摩尔时:LiOH+H2SO4=LiHSO4+H2O
当氢氧化锂2摩尔,硫酸1摩尔是:2LiOH+H2SO4=Li2SO4+H201年前查看全部
- 已知氢氧化锂(LiOH)可溶于水,其化学性质与氢氧化钠相似.下列对氢氧化锂的化学性质的说法中错误的是( ) A.能与二
已知氢氧化锂(LiOH)可溶于水,其化学性质与氢氧化钠相似.下列对氢氧化锂的化学性质的说法中错误的是( ) A.能与二氧化碳反应 B.能使无色酚酞溶液变红 C.能与稀硫酸反应 D.能使紫色石蕊溶液变红  findufo1年前1
findufo1年前1 -
 0aopa 共回答了20个问题
0aopa 共回答了20个问题 |采纳率90%氢氧化锂和氢氧化钠化学性质相似,能和二氧化碳反应生成盐和水;其溶液呈碱性,使酚酞变红,使紫色石蕊试液变蓝,能和酸发生中和反应,
故选D1年前查看全部
- 在飞船中为了处理人体排出的CO2,飞船上采用了氢氧化锂(LiOH)作为吸收剂,反应生成碳酸锂和水.LiOH中锂元素的化合
在飞船中为了处理人体排出的CO2,飞船上采用了氢氧化锂(LiOH)作为吸收剂,反应生成碳酸锂和水.LiOH中锂元素的化合价是+1+1,飞船上LiOH吸收C02的化学方程式是:CO2+2LiOH=Li2CO少+H2OCO2+2LiOH=Li2CO少+H2O.
 蘩藜11年前1
蘩藜11年前1 -
 daizhi140 共回答了21个问题
daizhi140 共回答了21个问题 |采纳率90.5%LiOH中氢氧根为-1价,为保证不显电性,正负化合价s代数和为0,则Li为+1价;k氧化碳和氢氧化锂反应生成Li4CO3和H4O,根据反应物、生成物、配平可得其化学方程式是 CO4+4LiOH=Li4CO3+H4O.
故答案为:+1、CO4+4LiOH=Li4CO3+H4O1年前查看全部
- 已知氢氧化锂(LiOH)可溶于水,其化学性质与氢氧化钠相似.下列对氢氧化锂的化学性质的说法中错误的是( )
已知氢氧化锂(LiOH)可溶于水,其化学性质与氢氧化钠相似.下列对氢氧化锂的化学性质的说法中错误的是( )
A. 能与二氧化碳反应
B. 能使紫色石蕊溶液变红
C. 能与稀硫酸反应
D. 其溶液能与硫酸铜溶液反应 谗猫猫20071年前2
谗猫猫20071年前2 -
 geh_86 共回答了22个问题
geh_86 共回答了22个问题 |采纳率77.3%解题思路:A、根据二氧化碳能和碱反应生成盐和水进行分析;
B、根据碱能使紫色石蕊变蓝色,使酚酞变红色进行分析;
C、根据酸和碱反应会生成盐和水进行分析;
D、根据可溶性碱能和硫酸铜溶液反应产生蓝色沉淀和盐进行分析.A、二氧化碳和氢氧化锂反应生成碳酸锂和水,故A正确;
B、碱能使紫色石蕊变蓝色,使酚酞变红色,故B错误;
C、氢氧化锂能和稀硫酸反应生成硫酸锂和水,故C正确;
D、氢氧化锂能和硫酸铜溶液反应生成蓝色的氢氧化铜沉淀和硫酸锂,故D正确.
故选:B.点评:
本题考点: 碱的化学性质.
考点点评: 本题是信息迁移题,从氢氧化钠的化学性质入手解答,注意类似知识的应用,平时一定要熟练掌握所学物质的性质.1年前查看全部
- (2008•宣武区二模)在宇宙飞船内,宇航员所呼出的气体要通过盛有氢氧化锂的过滤网,以除去其中所含的二氧化碳,发生反应的
(2008•宣武区二模)在宇宙飞船内,宇航员所呼出的气体要通过盛有氢氧化锂的过滤网,以除去其中所含的二氧化碳,发生反应的化学方程式为
2LiOH(固)+CO2(气)═Li2CO3(固)+H2O(液).试计算1g氢氧化锂所能吸收二氧化碳的质量. 花开荼靡1年前1
花开荼靡1年前1 -
 好一句对事不对人 共回答了17个问题
好一句对事不对人 共回答了17个问题 |采纳率82.4%解题思路:根据化学方程式找出LiOH与CO2的质量比,由LiOH的质量可计算出所需CO2的质量.设1g氢氧化锂能吸收二氧化碳的质量为x.
2LiOH+CO2═Li2CO3+H2O
4844
1gx
48:1g=44:x
解得,x=0.92g
答:1g氢氧化锂所能吸收二氧化碳的质量为0.92g.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题为根据化学方程式计算的基础题型,解答时应注意步骤的规范与完整.1年前查看全部
- 宇宙飞船内,宇航员所呼出的气体要通过盛有氢氧化锂(LiOH)的过滤网,以除去CO2,发生如下化学反应:2LiOH+CO2
宇宙飞船内,宇航员所呼出的气体要通过盛有氢氧化锂(LiOH)的过滤网,以除去CO2,发生如下化学反应:2LiOH+CO2=Li2CO3+H2O.若过滤网内含有氢氧化锂48g,最多可吸收多少克二氧化碳?
 星月如水1年前1
星月如水1年前1 -
 偶尔犯贱 共回答了20个问题
偶尔犯贱 共回答了20个问题 |采纳率85%解题思路:题目中已经给出了氢氧化锂和二氧化碳反应的方程式,所以可直接根据方程式,利用氢氧化锂的质量来求出二氧化碳的质量.设吸收二氧化碳的质量为x.
2LiOH+CO2=Li2CO3+H2O
48 44
48g x
[48/44=
48g
x]
解得x=44g
答:最多可吸收44g二氧化碳.点评:
本题考点: 根据化学反应方程式的计算;气体的净化(除杂);碱的化学性质.
考点点评: 此题是根据化学方程式的计算题,而且此题所需的方程式已经给出,所以降低了难度,数据计算也不复杂,是一道比较简单的计算题.1年前查看全部
- 已知氢氧化锂(LiOH)可溶于水,其化学性质与氢氧化钠相似.下列对氢氧化锂的化学性质的说法中错误的是( )
已知氢氧化锂(LiOH)可溶于水,其化学性质与氢氧化钠相似.下列对氢氧化锂的化学性质的说法中错误的是( )
A.能与二氧化碳反应
B.能使无色酚酞溶液变红
C.能与稀硫酸反应
D.能使紫色石蕊溶液变红 大伯1年前1
大伯1年前1 -
 不知道取什么好 共回答了24个问题
不知道取什么好 共回答了24个问题 |采纳率75%解题思路:因为氢氧化锂(LiOH)可溶于水,其化学性质与氢氧化钠相似,所以氢氧化锂(LiOH)能与二氧化碳反应、能与稀硫酸反应、能使无色酚酞溶液变红、能使紫色石蕊溶液变蓝.氢氧化锂和氢氧化钠化学性质相似,能和二氧化碳反应生成盐和水;其溶液呈碱性,使酚酞变红,使紫色石蕊试液变蓝,能和酸发生中和反应,
故选D点评:
本题考点: 碱的化学性质.
考点点评: 熟记碱的化学性质,碱溶液能使指示剂变色,能和酸性氧化物反应,能和酸反应,能和盐溶液反应.1年前查看全部
- 航天工业上可采用氢氧化锂(LiOH)去除宇航服表面的二氧化碳,反应的化学方程式是2LiOH+CO2═Li2CO3+H2O
航天工业上可采用氢氧化锂(LiOH)去除宇航服表面的二氧化碳,反应的化学方程式是2LiOH+CO2═Li2CO3+H2O.试计算要除去66g 二氧化碳所需LiOH的质量.
 huli2301年前1
huli2301年前1 -
 Autumn明月 共回答了23个问题
Autumn明月 共回答了23个问题 |采纳率95.7%解题思路:已知二氧化碳的质量,根据化学方程式可以计算需要氢氧化锂的质量.设所需LiOH的质量为x,
2LiOH+CO2═Li2CO3+H2O,
4844
x 66g
[48/44]=[x/66g],
x=72g.
答:要除去66g二氧化碳所需LiOH的质量是72g.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题比较简单,主要考查根据化学方程式进行计算方面的能力.1年前查看全部
- (2008•湘潭)金属锂(元素符号Li)在通信和航天领域中有重要用途.氢氧化锂(化学式LiOH)是一种易溶于水的白色固体
(2008•湘潭)金属锂(元素符号Li)在通信和航天领域中有重要用途.氢氧化锂(化学式LiOH)是一种易溶于水的白色固体,有辣味;化学性质与NaOH相似,有强碱性和腐蚀性.
(1)“辣味”属于氢氧化锂的______性质(填“化学”或“物理”):
(2)LiOH属于______类(填“氧化物”“酸”“碱”或“盐”);
(3)LiOH利NaOH都呈碱性,是因为它们在水溶液中都能解离出______离子(填“金属”“氢”或“氢氧根”);
(4)载人航天飞船中常用LiOH代替NaOH来吸收航天员呼吸产生的CO2,则LiOH与CO2反应的化学方程式为______. 爱了散了ss1年前1
爱了散了ss1年前1 -
 weiweiwei123123 共回答了16个问题
weiweiwei123123 共回答了16个问题 |采纳率81.3%解题思路:其中辣味属于味道是物理性质,氢氧化锂(化学式LiOH)的化学性质与NaOH相似,可知它也属于碱类,具有碱的通性:①水溶液中能电离出氢氧根离子②能与酸反应③能与二氧化碳反应④能与某些盐反应.又CO2+2NaOH═Na2CO3+H2O可以推断出LiOH与CO2的反应方程式.(1)物质没有发生化学变化就表现出来到性质.通常物质的物理性质就是指色味态密熔沸以及溶解度. (2)根据氢氧化锂(化学式LiOH)的化学性质与NaOH相似,NaOH属于碱,故它也属于碱;  ...
点评:
本题考点: 碱的化学性质;常见的氧化物、酸、碱和盐的判别;化学性质与物理性质的差别及应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题以航天用的金属锂为信息,引入氢氧化锂进而来,探究这种物质的性质和用途;看似比较陌生的一种物质实质上只要掌握氢氧化钠的特性,将所学知识进行迁移即可,灵活应用.1年前查看全部
- 锂元素(元素符号为Li)及其所形成的化合物,在通讯和航空航天领域中具有极其重要的用途。它的化合物氢氧化锂(LiOH)是一
锂元素(元素符号为Li)及其所形成的化合物,在通讯和航空航天领域中具有极其重要的用途。它的化合物氢氧化锂(LiOH)是一种易溶于水的白色固体,有辣味,具有强碱性和腐蚀性。
(1)写出氢氧化锂的一条物理性质_____________________________________________。
(2)下表是部分物质的溶解性表,运用此溶解性表并结合你对复分解反应发生条件的理解,从表中选出一种盐,该盐能和LiOH发生复分解反应,请你写出该反应的化学方程式____________________________________________________________。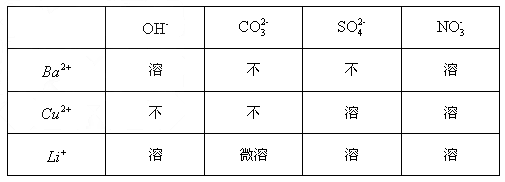
 wshhk1年前1
wshhk1年前1 -
 oboe78510 共回答了17个问题
oboe78510 共回答了17个问题 |采纳率94.1%(1)易溶于水的白色固体(合理即可)
(2)2LiOH+Cu(NO 3 ) 2 =Cu(OH) 2 ↓+2LiNO 3 (合理即可)1年前查看全部
- 锂常用于航天工业,其中氢氧化锂与二氧化碳反应,生成碳酸锂和水而用于吸收航天员呼出的二氧化碳.写出该反应的文字表达式:
 gesang8881年前1
gesang8881年前1 -
 臭法师 共回答了21个问题
臭法师 共回答了21个问题 |采纳率95.2%氢氧化锂+二氧化碳=碳酸锂+水1年前查看全部
- 氢氧化锂和盐发生复分解反应的化学方程式
 58645221年前1
58645221年前1 -
 艳子时光 共回答了17个问题
艳子时光 共回答了17个问题 |采纳率88.2%氢氧化锂作为一种较强的碱,可溶于水(常温下溶解度:12.8克),比其他第一主族强碱(NaOH,KOH)溶解度小得多.电离常数Kb=6.6*10^-1.常温下可以和几乎所有的酸反应和一些盐复分解反应,也能和两性金属作用. 1.氢氧化锂和酸反应. H2SO4+2LiOH==L2SO4+2H2O CH3COOH+LiOH==CH3COOLi+H2O 2.氢氧化锂和酸性氧化物作用(不是复分解反应) CO2+2LiOH==Li2CO3(沉淀)+H2O(碳酸锂溶解度很小,微溶) Li2CO3+CO2+H2O==2LiHCO3(碳酸氢锂可溶) 3.氢氧化锂和盐的反应. 第一类:和弱碱盐反应,生成相应弱碱和锂盐 LiOH+NH4Cl==NaCl+NH3.H2O 2LiOH+MgCl2==2LiCl+Mg(OH)2(沉淀) 2LiOH+CuCl2==Cu(OH)2(沉淀)+2LiCl 第二类:生成难溶性或微溶性锂盐. 3LiOH+Na3PO4==Li3PO4(沉淀)+3NaOH LiOH+KF==LiF(沉淀)+KOH 4.氢氧化锂和和酸式盐作用:生成锂正盐,其他正盐和水. LiOH+NaHSO3==Li2SO3+Na2SO3+H2O 5.氢氧化锂和两性金属反应(不属复分解): 2Al+2LiOH+2H2O==2LiAlO2+3H2(气体)1年前查看全部
- 锂元素(元素符号为Li)及其所形成的化合物.在通讯和航空航天领域中具有极其重要的用途.它的化合物氢氧化锂(LiOH)是一
锂元素(元素符号为Li)及其所形成的化合物.在通讯和航空航天领域中具有极其重要的用途.它的化合物氢氧化锂(LiOH)是一种易溶于水的白色固体,有辣味,具有强碱性和腐蚀性.
(1)写出氢氧化锂的一条物理性质______;
(2)下表是部分物质的溶解性表.运用此溶解性表并结合你对复分解反应发生条件的理解,
从表中选出一种盐,该盐能和LiOH发生复分解反应,请你写出该盐的化学式______.
阴离子
阳离子OH - CO 3 2- SO 4 2- NO 3 - Ba 2+ 溶 不 不 溶 Cu 2+ 不 不 溶 溶 Li + 溶 微溶 溶 溶  yanhlustc1年前1
yanhlustc1年前1 -
 ww_mm123 共回答了17个问题
ww_mm123 共回答了17个问题 |采纳率76.5%:(1)氢氧化锂LiOH的易溶于水、白色固体、有辣味是物理性质,水溶液能使无色酚酞试液变红说明溶液显碱性,有腐蚀性.碱性和腐蚀性属于化学性质;
故答案为:白色或固体或辣味或易溶于水
(2)LiOH溶液与表中离子组成的 一种盐的溶液反应,此盐与LiOH接触需要生成沉淀,此盐可为CuSO4或Cu(NO3)2,LiOH与CuSO 4 反应能生成Cu(OH) 2 沉淀和Li 2 SO 4 ;LiOH与Cu(NO 3 ) 2 反应能生成Cu(OH) 2 沉淀和LiNO 3 ;
故答案为:CuSO 4 或Cu(NO 3 ) 21年前查看全部
- 用最小公倍数配平怎么配平?就用氢氧化锂和二氧化碳反应生成碳酸锂和水 这个反应举例子吧
 blms1年前1
blms1年前1 -
 323232hhh 共回答了8个问题
323232hhh 共回答了8个问题 |采纳率87.5%看反应前后化学式中的元素种类谁多,谁最多就以谁的化学式前面的系数为一;
如有元素种类一样多的情况,就看化学式中谁的原子个数最多并以原子个数最多的化学式前面的系数为一,(如下面方反应中的 Li2CO3)定其化学式前计量数为1,然后根据关键化学式去配平其他化学式前的化学计量数.
若出现计量数为分数,再将各计量数同乘以同一整数(一般为分数分母),化分数为整数,这种先定关键化学式计量数为1的配平方法,称为归一法.
以此反应为例 LiOH + CO2 —— Li2CO3 + H2O
反应前后各化学式中元素的种类 3 2 3 2
反应前后各化学式中元素原子个数之和 3 3 6 3
显然关键是 Li2CO3的组成,因而定其计量数为1,这样可得原料中的LiOH 分子个数:2LiOH+CO2=Li2CO3+H2O1年前查看全部
- 锂元素(元素符号为Li)及其所形成的化合物,在通讯和航空航天领域中具有极其重要的用途.它的化合物氢氧化锂(LiOH)是一
锂元素(元素符号为Li)及其所形成的化合物,在通讯和航空航天领域中具有极其重要的用途.它的化合物氢氧化锂(LiOH)是一种易溶于水的白色固体,有辣味,具有强碱性和腐蚀性.写出氢氧化锂的一条物理性质______.
 我是一条大米虫11年前1
我是一条大米虫11年前1 -
 eleven815 共回答了9个问题
eleven815 共回答了9个问题 |采纳率88.9%解题思路:根据物理性质的定义进行分析,没有经过化学变化就表现出来的性质是物理性质.由题意可知:氢氧化锂的溶解性是易溶于水,色状:白色固体等都没有经过化学变化就表现出来的性质,属于物理性质;
故答为:溶解性:易溶于水.点评:
本题考点: 化学性质与物理性质的差别及应用.
考点点评: 本题比较简单,根据物理性质的概念,对给出的性质会判断是否是物理性质.1年前查看全部
- (2011•贵港)宇宙飞船内用含氢氧化锂过滤网除去宇航员呼出的二氧化碳,该反应的化学方程式为2LiOH+CO2═Li2C
(2011•贵港)宇宙飞船内用含氢氧化锂过滤网除去宇航员呼出的二氧化碳,该反应的化学方程式为2LiOH+CO2═Li2CO3+X.则X的化学式为
( )
A.H2
B.H2O2
C.H2O
D.O2 luofei3211年前1
luofei3211年前1 -
 着火的猫眼 共回答了16个问题
着火的猫眼 共回答了16个问题 |采纳率75%解题思路:在化学反应中遵循质量守恒定律,即反应前后元素的种类不变,原子的种类、个数不变.根据质量守恒定律和2LiOH+CO2═Li2CO3+X可知,每个X中含有2个氢原子和1个氧原子,是水,化学式是H2O.
故选C.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 在化学反应中遵循质量守恒定律,参加反应的物质的质量总和等于反应后生成的物质的质量总和.1年前查看全部
- (2012•永安市质检)宇宙飞船内,宇航员所呼出的气体要通过盛有氢氧化锂的过滤网,以除去所含的二氧化碳,发生如下化学反应
(2012•永安市质检)宇宙飞船内,宇航员所呼出的气体要通过盛有氢氧化锂的过滤网,以除去所含的二氧化碳,发生如下化学反应:2LiOH+CO2=Li2CO3+H2O.若过滤网内含有氢氧化锂24g,最多可吸收多少克二氧化碳?
 qertyuiop1年前1
qertyuiop1年前1 -
 mafanmafan 共回答了18个问题
mafanmafan 共回答了18个问题 |采纳率88.9%解题思路:根据反应的化学方程式,由过滤网内含有氢氧化锂的质量24g,计算24g氢氧化锂完全反应所消耗二氧化碳的质量即最多可吸收的二氧化碳.设需要二氧化碳质量为x
2LiOH+CO2=Li2CO3+H2O
48 44
24gx
[48/24g]=[44/x]
x=22g
答:需要二氧化碳质量为22g.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题为根据化学方程式计算的基础题型,解答时应注意步骤的规范与完整.1年前查看全部
- 宇宙飞船内,宇航员所呼出的气体要通过盛有氢氧化锂的过滤网,以除去所含的二氧化碳,发生如下化学反应:2LiOH+CO 2
宇宙飞船内,宇航员所呼出的气体要通过盛有氢氧化锂的过滤网,以除去所含的二氧化碳,发生如下化学反应:2LiOH+CO 2 ==Li 2 CO 3 +H 2 O。若过滤网内含有氢氧化锂24g,最多可吸收多少克二氧化碳?  AMARI1年前0
AMARI1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 宇宙飞船内,宇航员所呼出的气体要通过盛有氢氧化锂(LiOH)的过滤网,以除去所含的二氧化碳,其反应方程式为:2LiOH+
宇宙飞船内,宇航员所呼出的气体要通过盛有氢氧化锂(LiOH)的过滤网,以除去所含的二氧化碳,其反应方程式为:2LiOH+CO 2 = Li 2 CO 3 + H 2 O 。若过滤网内含有氢氧化锂72g,计算最多可吸收二氧化碳的质量
 xiaolei5101年前1
xiaolei5101年前1 -
 jmcflash 共回答了17个问题
jmcflash 共回答了17个问题 |采纳率76.5%66g
1年前查看全部
- (3分)宇宙飞船内,宇航员所呼出的气体要通过盛有氢氧化锂的过滤网,以除去所含的二氧化碳,发生如下化学反应:2LiOH+C
(3分)宇宙飞船内,宇航员所呼出的气体要通过盛有氢氧化锂的过滤网,以除去所含的二氧化碳,发生如下化学反应:2LiOH+CO 2 =Li 2 CO 3 +H 2 O。若过滤网内含有氢氧化锂24 g,最多可吸收多少克二氧化碳?
 湿湿的睫毛1年前1
湿湿的睫毛1年前1 -
 五指山梦 共回答了21个问题
五指山梦 共回答了21个问题 |采纳率85.7%22g
1年前查看全部
- 宇宙飞船内,宇航员所呼出的气体要通过盛有氢氧化锂的过滤网,以除去所含的二氧化碳,化学方程式为:2LiOH(固)+CO 2
宇宙飞船内,宇航员所呼出的气体要通过盛有氢氧化锂的过滤网,以除去所含的二氧化碳,化学方程式为:2LiOH(固)+CO 2 (气)=Li 2 CO 3 (固)+H 2 O(液)
(1)计算l g氢氧化锂所能吸收二氧化碳的质量.(计算结果精确到0.01)
(2)若用氢氧化钾代替氢氧化锂,1g氢氧化钾能吸收多少克二氧化碳?
(3)利用(1)和(2)所得结果判断用氢氧化锂还是用氢氧化钾来吸收二氧化碳更好?为什么? 林诚1年前0
林诚1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 氢氧化锂只和二氧化碳反应吗?
 一地鸡毛111年前2
一地鸡毛111年前2 -
 冬芝 共回答了15个问题
冬芝 共回答了15个问题 |采纳率80%怎么可能呢 - -!氢氧化锂具有碱的通性,可发生如下反应.1.碱性反应 可使紫色石蕊试液变蓝,使无色酚酞变红;而其浓溶液经实验验证,可以使酚酞变性,使溶液由红色变为无色(类似于浓NaOH).2.与酸中和 HCl+LiOH=Li...1年前查看全部
- 化学上利用氢化锂(LiH)和水在常温下反应制取氢气,同时生成氢氧化锂,反应的化学方程式为:LiH+H 2 O=LiOH+
化学上利用氢化锂(LiH)和水在常温下反应制取氢气,同时生成氢氧化锂,反应的化学方程式为:LiH+H 2 O=LiOH+H 2 ↑,如果用氢化锂和水反应制氢气,现要制取10g氢气,需要氢化锂多少g?生成的LiOH能和多少g质量分数为10%的稀盐酸恰好完全反应?  蘸水木棉花1年前1
蘸水木棉花1年前1 -
 zhankunming 共回答了16个问题
zhankunming 共回答了16个问题 |采纳率93.8%解;①设要制取10g氢气,需要氢化锂的质量为x,可生成LiOH的质量为y,
LiH+H 2 O=LiOH+H 2 ↑
8 24 2
x y 10g
∴
8
2 =
x
10g ,
24
2 =
y
10g ,
解之得:x=40g,y=120g;
②设生成的LiOH能和质量为z质量分数为10%的稀盐酸恰好完全反应,
LiOH+HCl=LiCl+H 2 O
24 36.5
120g,10%z
∴
24
36.5 =
120g
10%z ,
解之得;z=1825g.
答:现要制取10g氢气,需要氢化锂40g;生成的LiOH能和1825g质量分数为10%的稀盐酸恰好完全反应.1年前查看全部
- 金属锂(元素符号为Li)在通讯和航空航天领域中具有极其重要的用途.它的化合物氢氧化锂[LiOH]是一种易溶于水的白色固体
金属锂(元素符号为Li)在通讯和航空航天领域中具有极其重要的用途.它的化合物氢氧化锂[LiOH]是一种易溶于水的白色固体,有辣味,具有强碱性和腐蚀性.
(1)“辣味”属于氢氧化锂的(填“物理”或“化学”,下同) ______性质;“腐蚀性”属于氢氧化锂的 ______性质.
(2)LiOH中锂元素的化合价为 ______.
(3)载人航天飞船中通常用LiOH代替NaOH来吸收航天员呼吸产生的CO2,则LiOH与CO2反应的化学方程式 ______. 偶素ff包1年前1
偶素ff包1年前1 -
 ilvft 共回答了14个问题
ilvft 共回答了14个问题 |采纳率85.7%解题思路:(1)由题意“氢氧化锂[LiOH]是一种易溶于水的白色固体,有辣味,具有强碱性和腐蚀性”,“辣味”属于氢氧化锂的物理性质;“腐蚀性”属于氢氧化锂的化学性质;
(2)LiOH中,氢氧根的化合价为-1价,根据化合价的规律“化合物中化合价的代数和为零”,则可求锂元素的化合价;
(3)由题意,用LiOH代替NaOH来吸收航天员呼吸产生的CO2,则反应物为CO2、LiOH,生成物为Li2CO3、H2O,故根据质量守恒定律,可以书写化学方程式.(1)物质的“色、味、态”为物理性质;“腐蚀性”属于氢氧化锂的化学性质;
(2)氢氧根的化合价为-1价,根据化合价的规律“化合物中化合价的代数和为零”,则设锂元素的化合价为x,
则x+(-1)=0,故x=+1,故LiOH中锂元素的化合价为+1价;
(3)由题意,知反应物为CO2、LiOH,生成物为Li2CO3、H2O,故根据质量守恒定律,可以书写化学方程式CO2+2LiOH=Li2CO3+H2O.
故答为:(1)物理;化学;
(2)+1;
(3)CO2+2LiOH=Li2CO3+H2O点评:
本题考点: 书写化学方程式、文字表达式、电离方程式;有关元素化合价的计算;化学性质与物理性质的差别及应用.
考点点评: 由题意,找出反应物和生成物、反应条件,根据质量守恒定律,正确书写化学方程式;了解化学性质与物理性质的差别及其应用.1年前查看全部
- 宇宙飞船内,宇航员所呼出的气体要通过盛有氢氧化锂的过滤网,以除去所含的二氧化碳,化学方程式为2LiOH+CO2=Li2C
宇宙飞船内,宇航员所呼出的气体要通过盛有氢氧化锂的过滤网,以除去所含的二氧化碳,化学方程式为2LiOH+CO2=Li2CO3+H2O.
(1)试计算吸收44g二氧化碳需要氢氧化锂的质量.
(2)若用氢氧化钠代替氢氧化锂,则吸收44g二氧化碳需要氢氧化钠的质量为______g.
(3)利用(1)和(2)所得结果,试解释宇宙飞船选用氢氧化锂来吸收二氧化碳比用氢氧化钠效果更好的原因:______.
(4)若每位宇航员每天所呼出的二氧化碳平均是502L,若4位宇航员进行一项为期7天的太空任务,试写出消耗氢氧化锂质量的计算式.(在宇宙飞船内的温度和气压下,二氧化碳气体的密度为1.833g/L).[502L×1.833g/L×48×4×7/44][502L×1.833g/L×48×4×7/44].(友情提示:只须写出计算式,不必求出结果) 美错小五1年前1
美错小五1年前1 -
 lan73536 共回答了20个问题
lan73536 共回答了20个问题 |采纳率95%解题思路:(1)根据二氧化碳的质量结合化学方程式可以需要氢氧化锂的质量;
(2)根据二氧化碳的质量结合化学方程式可以求算出需要的氢氧化钠的质量;
(3)比较(1)和(2)的计算结果可以分析出原因;然后比较等质量的氢氧化锂和氢氧化钾所消耗二氧化碳的多少,就可以得到问题(3)的结论;
最后根据问题(1)的计算结果求出问题(4).(1)设吸收44g二氧化碳需要氢氧化锂的质量为x
2LiOH+CO2═Li2CO3+H2O
48 44
x 44g
[48/x=
44
44g]
解得:x=48g;
答:吸收44 g二氧化碳需要氢氧化锂的质量为48 g.
(2)设吸收44g二氧化碳需要氢氧化钠的质量为y,则:
2NaOH+CO2═Na2CO3+H2O
80 44
y 44g
[80/y=
44
44g]
解得:y=80g;
答:吸收44g二氧化碳需要氢氧化钠的质量为80g;
(3)比较(1)和(2)的计算结果可以知道:吸收等质量二氧化碳需要氢氧化锂的质量少,这样可以减小飞船的载重;
(4)根据题意可以知道,宇航员共呼出的二氧化碳的质量为:502L×1.833g/L,结合(1)的计算可以知道需要氢氧化锂的计算式为:[502L×1.833g/L×48×4×7/44]
故答案为:
(1)48g;
(2)80g;
(3)吸收等质量二氧化碳需要氢氧化锂的质量少,这样可以减小飞船的载重;
(4)[502L×1.833g/L×48×4×7/44].点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题主要考查学生运用化学方程式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.1年前查看全部
- 我国研制的航天员舱外服为航天员成功进行太空行走提供了可靠的保证.航天员舱外服内含有与氢氧化钠性质相似的氢氧化锂(LiOH
我国研制的航天员舱外服为航天员成功进行太空行走提供了可靠的保证.航天员舱外服内含有与氢氧化钠性质相似的氢氧化锂(LiOH),它不可能具有的化学性质是( )
A.与CO2反应
B.与盐酸反应
C.与Fe2O3反应
D.与CuSO4溶液反应 hewejne1年前1
hewejne1年前1 -
 我为谁活着 共回答了24个问题
我为谁活着 共回答了24个问题 |采纳率95.8%解题思路:根据信息中含有与氢氧化钠性质相似的氢氧化锂可知,它们都具备了碱的通性,利用碱的通性来分析LiOH的化学性质即可.A、因碱能与酸性氧化物反应,则LiOH能与CO2反应,故A说法正确;
B、因碱能与酸反应,则LiOH能与盐酸发生中和反应,故B说法正确;
C、因碱不能与金属氧化物反应(氧化铝例外),则LiOH不能与Fe2O3反应,故C说法错误;
D、因碱与某些盐溶液反应,要求反应物都可溶且生成沉淀,则LiOH能与CuSO4溶液反应生成氢氧化铜沉淀,故D说法正确;
故选C.点评:
本题考点: 碱的化学性质.
考点点评: 本题考查碱的通性,注意信息中氢氧化钠与氢氧化锂性质相似是解答本题的关键,然后利用学生熟悉的碱的化学性质来解答.1年前查看全部
- 从宇宙飞船的舱内除去CO2,可用氢氧化锂LiOH(似NaOH)与CO2反应:CO2+2LiOH=Li2CO3+H2O、一
从宇宙飞船的舱内除去CO2,可用氢氧化锂LiOH(似NaOH)与CO2反应:CO2+2LiOH=Li2CO3+H2O、一天内,一个人呼出1 kg CO2,为消除3名宇航员6个月的太空飞行所产生的CO2,需要LiOH的质量约是(每月按30天计) ( )
A.589kg
B.440kg
C.392kg
D.196kg uevin1年前1
uevin1年前1 -
 waaq 共回答了21个问题
waaq 共回答了21个问题 |采纳率81%解题思路:欲正确解答本题,需根据化学方程式得出各物质之间的质量比,列出比例式,通过计算得出需要LiOH的质量,然后对照选项进行选择.设需要LiOH的质量为x,
3名宇航员6个月的太空飞行所产生的CO2的质量为:1kg×3×30×6=540kg,
CO2+2LiOH=Li2CO3+H2O
44 48
540kg x
∴[44/48=
540kg
x]
解之得:x≈589.1kg,
故选A.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题主要考查学生运用化学方程式进行计算的能力.1年前查看全部
- 宇宙飞船内,宇航员所呼出的气体要通过盛有氢氧化锂的过滤网,以除去所含的二氧化碳,如下式所示:2LiOH(固)+CO2(气
宇宙飞船内,宇航员所呼出的气体要通过盛有氢氧化锂的过滤网,以除去所含的二氧化碳,如下式所示:2LiOH(固)+CO2(气)=Li2CO3(固)+H2O(液)
若每位宇航员每天所呼出的二氧化碳平均是502L,现有2位宇航员在进行一项为期7天的太空任务,试计算在宇宙飞船上应携带氢氧化锂的质量(在宇宙飞船内温度和气压下,二氧化碳气体的密度为1.833g/L). sunnieying1年前4
sunnieying1年前4 -
 bjjx2005 共回答了16个问题
bjjx2005 共回答了16个问题 |采纳率93.8%该题不难,只不过要细心算就是了.
先计算出宇航员7天所产生的CO2的质量(这里不用摩尔,初中不涉及):m(CO2)=(502*7*2)*1.833=12882.324g
依据方程式2LiOH(固)+CO2(气)=Li2CO3(固)+H2O(液) 可列出关系式:2LiOH--CO2
即应携带m(LiOH)=(12882.324*2*24)/44=14053g1年前查看全部
- 宇宙飞船内,宇航员所呼出的气体要通过盛有氢氧化锂的过滤网,以除去所含的二氧化碳,化学方程式为:2LiOH(固)+CO2(
宇宙飞船内,宇航员所呼出的气体要通过盛有氢氧化锂的过滤网,以除去所含的二氧化碳,化学方程式为:2LiOH(固)+CO2(气)═Li2CO3(固)+H2O(液)
(1)计算l g氢氧化锂所能吸收二氧化碳的质量.(计算结果精确到0.01)
(2)若用氢氧化钾代替氢氧化锂,1g氢氧化钾能吸收多少克二氧化碳?
(3)利用(1)和(2)所得结果判断用氢氧化锂还是用氢氧化钾来吸收二氧化碳更好?为什么? 法里亚长老1年前1
法里亚长老1年前1 -
 lallo20000 共回答了17个问题
lallo20000 共回答了17个问题 |采纳率100%解题思路:(1)根据氢氧化锂和二氧化碳反应的化学方程式和二氧化碳的质量,列出比例式,就可计算出1g氢氧化锂能吸收二氧化碳的质量;
(2)利用氢氧化钾与二氧化碳反应的化学方程式和二氧化碳的质量,列出比例式,就可计算出1g氢氧化钾能吸收二氧化碳的质量;
(3)把(1)和(2)的计算结果比较,即可判断用氢氧化锂还是用氢氧化钾来吸收二氧化碳更好.(1)设1g氢氧化锂能吸收二氧化碳的质量为X,
2LiOH+CO2═Li2CO3+H2O
48 44
1gX
∴[48/44=
1g
x],
解之得:X=0.92g;
(2)设1g氢氧化钾能吸收二氧化碳的质量为Y,
2KOH+CO2═K2CO3+H2O
112 44
1g Y
∴[112/44=
1g
y],
解之得:Y=0.39g;
(3)∵0.92g>0.39g,
∴用氢氧化锂吸收二氧化碳好.因为相同质量的氢氧化锂吸收的二氧化碳更多.
答:(1)l g氢氧化锂所能吸收二氧化碳的质量为0.92g;
(2)若用氢氧化钾代替氢氧化锂,1g氢氧化钾能吸收0.39g克二氧化碳;
(3)用氢氧化锂来吸收二氧化碳更好,因为相同质量的氢氧化锂吸收的二氧化碳更多.点评:
本题考点: 根据化学反应方程式的计算;化学实验方案设计与评价.
考点点评: 本题主要考查学生运用化学方程式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.1年前查看全部
- 航天员舱外服内含有与氢氧化钠性质相似的氢氧化锂(LiOH),它不可能具有的化学性质是( )
航天员舱外服内含有与氢氧化钠性质相似的氢氧化锂(LiOH),它不可能具有的化学性质是( )
A.与二氧化碳反应
B.与盐酸反应
C.与氧化铁反应
D.与氯化铜溶液反应 军蓝1年前1
军蓝1年前1 -
 wenghuochao 共回答了19个问题
wenghuochao 共回答了19个问题 |采纳率100%解题思路:由于氢氧化锂与氢氧化钠性质相似,所以能与氢氧化钠反应的物质,一般也能与氢氧化锂反应;因此氢氧化锂能和二氧化碳、盐酸、氯化铜溶液等物质反应;氢氧化锂不能和氧化铁反应.A、氢氧化锂能和二氧化碳反应生成碳酸锂和水.故选项错误;
B、氢氧化锂能和盐酸反应生成氯化锂和水.故选项错误;
C、氢氧化锂不能和氧化铁反应.故选项正确;
D、氢氧化锂能和氯化铜溶液反应生成氯化锂和氢氧化铜.故选项错误.
故选C.点评:
本题考点: 碱的化学性质.
考点点评: 解答本题要充分理解氢氧化锂的性质方面的知识,只有这样才能对相关方面的问题做出正确的判断.1年前查看全部
- 为什么潜艇用氢氧化锂吸收过量的二氧化碳?
为什么潜艇用氢氧化锂吸收过量的二氧化碳?
为什么不用别的碱,氢氧化锂有什么优点? abeany1年前3
abeany1年前3 -
 人老芯不老 共回答了18个问题
人老芯不老 共回答了18个问题 |采纳率77.8%因为氢氧化锂的分子量很小,可以用足够少的LiOH来吸收一定量的CO2.1年前查看全部
- Ca与水反应会生成氢氧化钙和氢气吗?反正Na和Li与水反应都分别会生成氢氧化钠、氢气和氢氧化锂、氢气.那钙呢?是不是也会
Ca与水反应会生成氢氧化钙和氢气吗?反正Na和Li与水反应都分别会生成氢氧化钠、氢气和氢氧化锂、氢气.那钙呢?是不是也会?什么情况下金属与水反应会生成氢氧化物和氢气?谢谢回答~~
 senen28381年前2
senen28381年前2 -
 zkvzkv 共回答了17个问题
zkvzkv 共回答了17个问题 |采纳率88.2%第一个问题:是的 第二个问题:初级化学可以这么理解.在初级化学中当金属的活泼性很大的时候都会与水反应.1年前查看全部
- 宇宙飞船用来除去二氧化碳的物质是氢氧化锂,用氢氧化锂而不用其他物质的原因是(用计算说明)
 猫猫熊1年前1
猫猫熊1年前1 -
 snoopylotus 共回答了17个问题
snoopylotus 共回答了17个问题 |采纳率88.2%2LiOH(固)+CO2(气)=Li2CO3(固)+H2O(液).1年前查看全部
- 氢氧化锂的化学性质氢氧化锂是白色固体 2.有辣味 3.
氢氧化锂的化学性质
氢氧化锂是白色固体 2.有辣味 3.强碱性 4.溶于水 5.熔点471℃ 6.沸点925℃ 7.有腐蚀性
以上关于氢氧化锂部分性质的描述中,属于化学性质的是________________ yztbjzty1年前3
yztbjzty1年前3 -
 海南第一帅 共回答了17个问题
海南第一帅 共回答了17个问题 |采纳率82.4%属于化学性质的是:
3.强碱性 7.有腐蚀性1年前查看全部
- 氢氧化锂为什么不能和二氧化碳反应
 木木e1年前1
木木e1年前1 -
 山石_008 共回答了22个问题
山石_008 共回答了22个问题 |采纳率90.9%你问错了吧,氢氧化锂,也是一种苛性碱,空气中极易吸收二氧化碳1年前查看全部
- 为什么制取氯气的时候后面连接的只能是氢氧化钠溶液,而不能是氢氧化钾或氢氧化锂的溶液呢?
 fang2391年前2
fang2391年前2 -
 坐在单车上的宝贝 共回答了18个问题
坐在单车上的宝贝 共回答了18个问题 |采纳率94.4%首先你要知道连接氢氧化钠溶液的作用是什么,就是吸收尾气(氯气,氯化氢),所以用的氢氧化钾也可以,一般是用氢氧化钠,因为其价格较氢氧化钾,氢氧化锂便宜,易得.1年前查看全部
- 氢氧化锂作吸附剂除去二氧化碳要方程式!
 vwei_12121年前1
vwei_12121年前1 -
 qhxqhx888 共回答了18个问题
qhxqhx888 共回答了18个问题 |采纳率88.9%2LiOH + CO2 = Li2CO3 + H2O1年前查看全部
- 碳酸锂怎么分离其中钴镍铜?氢氧化锂也同样?
 condraj1年前1
condraj1年前1 -
 江边鸟飞翔 共回答了15个问题
江边鸟飞翔 共回答了15个问题 |采纳率93.3%用硫酸溶解,长时间电解(惰性电极),在加碳酸钠沉淀出碳酸锂(微溶),过滤后再加熟石灰可得氢氧化锂.1年前查看全部
- 硼酸与碱反应的化学方程式在140摄氏度时。硼酸与氢氧化锂的反应的方程式
 win01041年前4
win01041年前4 -
 gzbob 共回答了14个问题
gzbob 共回答了14个问题 |采纳率78.6%硼酸的性质
2.硼酸比重1.435(15℃)、熔点185℃,露置空气中无变化,加热至
107.5℃时失水而成偏硼酸(HBO2):
H3BO3→HBO2+H2O
偏硼酸再热至150~160℃时则又失水而成焦硼酸(H2B4O 7):
4HBO2→H2B4O 7+H2O
酸性很微弱,1:50的水溶液以石蕊试纸检定,呈弱酸性反应.
那么我们就知道硼酸在140度时为偏硼酸 HBO2
注 1.偏硼酸、焦硼酸都是三价硼的含氧酸.
反应方程式为:HBO2+LiOH+H2O====LiB(OH)41年前查看全部
- 氢氧化锂和氢氧化铯谁的碱性强?根据元素周期律回答
 twtmm1年前4
twtmm1年前4 -
 爱上哭泣的沙漠 共回答了24个问题
爱上哭泣的沙漠 共回答了24个问题 |采纳率100%氢氧化铯碱性强
锂<钠<钾<铷<铯这五个还原性依次增强.氢氧化物碱性也依次增强1年前查看全部
- 氢氧化锂是不是强碱?能不能溶?
 blueflyr1年前1
blueflyr1年前1 -
 183493036 共回答了21个问题
183493036 共回答了21个问题 |采纳率85.7%氢氧化锂(LiOH)是强碱,白色晶体粉末,相对密度为1.46,熔点为470℃,942℃分解.它溶于水,20℃时,100g水中能溶解12.8g.微溶于乙醇;在空气中极易吸收水及二氧化碳.氢氧化锂有强的腐蚀性及刺激性,应密封保存.1年前查看全部
- 氢氧化锂氢氧化钠氢氧化钾氢氧化铷氢氧化铯的电离有什么不同
氢氧化锂氢氧化钠氢氧化钾氢氧化铷氢氧化铯的电离有什么不同
但我们老师说完全电离也有区别的啊 软兰儿1年前2
软兰儿1年前2 -
 清凉的秋天 共回答了22个问题
清凉的秋天 共回答了22个问题 |采纳率81.8%电离状态没什么不同,都是强电解质,完全电离
只是金属性逐渐增强
你们老师说的应该是弱电解质1年前查看全部
- 氢氧化锂的溶解度如何,微溶,可溶还是易溶?
 狼吟诗人1年前3
狼吟诗人1年前3 -
 西山晴雪_杨 共回答了17个问题
西山晴雪_杨 共回答了17个问题 |采纳率94.1%氢氧化锂难溶.1年前查看全部
- 宇宙飞船内,宇航员所呼出的气体要通过盛有氢氧化锂的过滤网,以除去所含的二氧化碳,化学方程式为:2LiOH(固)+CO2(
宇宙飞船内,宇航员所呼出的气体要通过盛有氢氧化锂的过滤网,以除去所含的二氧化碳,化学方程式为:2LiOH(固)+CO2(气)═Li2CO3(固)+H2O(液)
(1)计算l g氢氧化锂所能吸收二氧化碳的质量.(计算结果精确到0.01)
(2)若用氢氧化钾代替氢氧化锂,1g氢氧化钾能吸收多少克二氧化碳?
(3)利用(1)和(2)所得结果判断用氢氧化锂还是用氢氧化钾来吸收二氧化碳更好?为什么? 河南人好样的1年前1
河南人好样的1年前1 -
 andysjt 共回答了25个问题
andysjt 共回答了25个问题 |采纳率92%解题思路:(1)根据氢氧化锂和二氧化碳反应的化学方程式和二氧化碳的质量,列出比例式,就可计算出1g氢氧化锂能吸收二氧化碳的质量;
(2)利用氢氧化钾与二氧化碳反应的化学方程式和二氧化碳的质量,列出比例式,就可计算出1g氢氧化钾能吸收二氧化碳的质量;
(3)把(1)和(2)的计算结果比较,即可判断用氢氧化锂还是用氢氧化钾来吸收二氧化碳更好.(1)设1g氢氧化锂能吸收二氧化碳的质量为X,
2LiOH+CO2═Li2CO3+H2O
48 44
1gX
∴[48/44=
1g
x],
解之得:X=0.92g;
(2)设1g氢氧化钾能吸收二氧化碳的质量为Y,
2KOH+CO2═K2CO3+H2O
112 44
1g Y
∴[112/44=
1g
y],
解之得:Y=0.39g;
(3)∵0.92g>0.39g,
∴用氢氧化锂吸收二氧化碳好.因为相同质量的氢氧化锂吸收的二氧化碳更多.
答:(1)l g氢氧化锂所能吸收二氧化碳的质量为0.92g;
(2)若用氢氧化钾代替氢氧化锂,1g氢氧化钾能吸收0.39g克二氧化碳;
(3)用氢氧化锂来吸收二氧化碳更好,因为相同质量的氢氧化锂吸收的二氧化碳更多.点评:
本题考点: 根据化学反应方程式的计算;化学实验方案设计与评价.
考点点评: 本题主要考查学生运用化学方程式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.1年前查看全部
- 宇宙飞船内,宇航员所呼出的气体要通过盛有氢氧化锂(LiOH)的过滤网,以除去所含的二氧化碳,其反应方程式为:2LiOH+
宇宙飞船内,宇航员所呼出的气体要通过盛有氢氧化锂(LiOH)的过滤网,以除去所含的二氧化碳,其反应方程式为:2LiOH+CO 2 =Li 2 CO 3 +H 2 O.若过滤网内含有氢氧化锂72g,计算最多可吸收二氧化碳的质量.  床上的套套1年前1
床上的套套1年前1 -
 workerliubing 共回答了12个问题
workerliubing 共回答了12个问题 |采纳率100%设可吸收二氧化碳的质量为x
2LiOH+CO 2 ═Li 2 CO 3 +H 2 O
4844
72gx
48
72g =
44
x
x=66g
答:可吸收二氧化碳的质量是66g;1年前查看全部
- 有关水的组成 人类理想的能源之一是氢气.有人研究得出:将氢化锂与水反应即可放出大量氢气,同时生成氢氧化锂.一种氢能源汽车
有关水的组成
人类理想的能源之一是氢气.有人研究得出:将氢化锂与水反应即可放出大量氢气,同时生成氢氧化锂.一种氢能源汽车每天消耗密度约为0.09g/L的氢气100L,则1kg氢化锂可以维持该汽车运行约多少天? 木子百合1年前1
木子百合1年前1 -
 初雪的小径 共回答了18个问题
初雪的小径 共回答了18个问题 |采纳率88.9%LiH + H2O === LiOH + H2
8 2
1kg 1/4kg
250g/0.09(g/L)/100(L/天)=27.8天1年前查看全部
- (9分)某化学实验小组,通过Li 3 N固体水解生成氢氧化锂和氨气的反应制氨气,并进行氨气还原氧化铜的实验探究。如下图所
(9分)某化学实验小组,通过Li 3 N固体水解生成氢氧化锂和氨气的反应制氨气,并进行氨气还原氧化铜的实验探究。如下图所示,给出了本实验可供选择的装置:
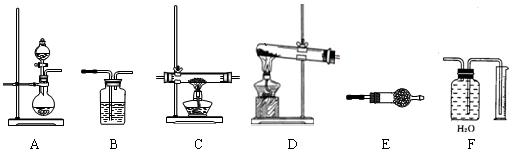
请回答下列问题:
(1)按该方法制氨气时,应选用上述装置中的 (填装置代码,下同)做氨气发生装置。
(2)为检验氨气还原氧化铜反应后生成Cu、H 2 O、N 2 ,氨气发生装置后应依次连接 → C → → →
(3)在C装置前后连接的装置中,填充的药品按前后顺序分别为 、 。
(4)有资料提出:CuO被还原时,当黑色固体完全变为红时,不一定完全转化为Cu,可能还含有Cu 2 O。已知查阅到一离子反应方程式:Cu 2 O+2H + =Cu 2+ +Cu+H 2 O。依据该信息,若证明C处的红色固体中是否含有Cu 2 O ,请设计实验: 。
(5)实验时充分加热,至C装置质量不再减轻为止。实验完毕后,若实验测得收集的N 2 体积为aL(已折算为标准状况)。则若用CH 4 还原同样多CuO,理论上最少需要CH 4 的体积为(标准状况,用含字母a的代数式表示) L。 ASHLEY111年前1
ASHLEY111年前1 -
 miaojie518 共回答了20个问题
miaojie518 共回答了20个问题 |采纳率95%1年前查看全部
- 为什么宇宙飞船选用氢氧化锂还吸收二氧化碳比用氢氧化钾好
 etghj1年前2
etghj1年前2 -
 december_miao 共回答了17个问题
december_miao 共回答了17个问题 |采纳率94.1%氢氧化锂的分子式小,同样的质量,氢氧化锂比氢氧化钾吸收的二氧化碳多.携带氢氧化锂能减轻飞船重量1年前查看全部
- 什么能使氢氧化锂发生复分解反应请问什么盐能使氢氧化锂发生复分解反应
 fanjunchao1年前2
fanjunchao1年前2 -
 轩原 共回答了11个问题
轩原 共回答了11个问题 |采纳率100%氯化铜,氯化铁、碳酸钠,碳酸钾等
2Li+ + CO32- ==Li2CO3↓
Fe3+ + 3OH- ==Fe(OH)3↓
所以只要能生成弱碱和不溶性锂盐就可以!1年前查看全部
大家在问
- 1初一数学解方程希望能写出为什么这样解答
- 2Look 等词后有时加形容词,有时加副词,那什么情况下加形容词,什么情况可加副词?
- 3Nomatter will happen,l want tell you:try to Remenber中文?
- 4一道电工题,
- 57.8*35简便方法
- 6参加环城长跑比赛的同学中,男生比女生多16人,且男生人数是女生人数的3倍,参加比赛的男女生个有几人?
- 7矩形ABCD的边AB=3,AD=2,将此矩形置入直角坐标系中,使AB在x轴上,点C在直线y=x-2上,交x轴与点p,双曲
- 8设a*b=(a+b)×(a-b)求27*9
- 9规定A▲B=(A+B)×(A-B).求27▲9.
- 10已知点(a,b)在函数y=10的x次方的图像上,(a-1,10b)在图像上吗
- 11"尝驾黄鹤返憩于此"中的"于"该怎么译?
- 12折射率为n的透镜它的入射角正弦值与其折射角正弦值的关系是怎么样的?
- 1311.下列有关脱氧核糖核酸的叙述中错误的是
- 14人为规定的地球自转方向从宇宙空间看真的是这样吗?要知道地球本身有加速度 外太空看地球是有差别的?
- 15春江水暖鸭先知的前一句