水受热以后,重量会发生变化吗
 凌晓雨2022-10-04 11:39:541条回答
凌晓雨2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 半夜笑醒 共回答了14个问题
半夜笑醒 共回答了14个问题 |采纳率92.9%- 会的,质量不变,重量减少.
- 1年前
相关推荐
- 碱式碳酸铜(Cu2(OH)2CO3)俗称铜绿,受热易分解,生成黑色固体氧化铜、水蒸汽和二氧化碳.反应的化学方程式为Cu2
碱式碳酸铜(Cu2(OH)2CO3)俗称铜绿,受热易分解,生成黑色固体氧化铜、水蒸汽和二氧化碳.反应的化学方程式为Cu2(OH)2CO3
2CuO+H2O+CO2↑.现将一定量的碱式碳酸铜和铜的粉末放在容器里,在空气中用酒精灯充分加热后冷却,称量,发现加热前后固体的质量相等.据此计算原混合粉末中Cu2(OH)2CO3的质量.△ . dolphin24281年前1
dolphin24281年前1 -
 海底琥珀 共回答了16个问题
海底琥珀 共回答了16个问题 |采纳率93.8%解题思路:根据题意,可知:铜绿受热易分解,生成黑色固体氧化铜,水蒸汽和二氧化碳,水蒸汽和二氧化碳跑到空气中了,铜粉与氧气反应生成CuO,因为加热前后固体的质量相等,所以跑掉的水蒸汽和二氧化碳的质量与铜反应的氧气的质量相等.铜绿受热易分解,生成黑色固体氧化铜,水蒸汽和二氧化碳,水蒸汽和二氧化碳跑到空气中了,铜粉与氧气反应生成CuO,因为加热前后固体的质量相等,所以跑掉的水蒸汽和二氧化碳的质量与铜反应的氧气的质量相等;
设原混合物质量为100g,其中碱式碳酸铜的质量为x,则铜的质量为100g-x,生成的水蒸汽和二氧化碳的质量为y;
则根据题意有:
①Cu2(OH)2CO3
△
.
CuO+H2O+CO2↑
222 18+44=62
xy
则[222/x=
62
y],解得y=[62x/222]
②2Cu+O2
△
.
2CuO
12832
100g-xy
[128/100g−x=
32
y],解得y=
32(100g−x)
128
所以得[62x/222]=
32(100g−x)
128,解得x≈47.2g,故
47.2g
100g×100%=47.2%
答:原混合粉末中Cu2(OH)2CO3的质量分数约为47.2%.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 此题是对利用化学方程式计算的考查题,解题的关键是对反应前后质量变化的分析,属于基础性知识考查题.1年前查看全部
- 氯酸钾化学符号表达式高锰酸钾是一种暗紫色的固体,它受热时,分解出氧气,同时还有锰酸钾和二氧化锰生成,其符号表达式是什么
 Darcy201年前6
Darcy201年前6 -
 蒙恩的zz 共回答了29个问题
蒙恩的zz 共回答了29个问题 |采纳率93.1%2KMnO4==加热==K2MnO4+MnO2+O2↑
这是高锰酸钾分解的
2KClO3==加热/催化剂==2KCl+3O2↑
这是氯酸钾分解的
有不懂的可以给我发消息.1年前查看全部
- 加热某紫黑色固体A能生成B,将受热后的残余固体与另一种白色固体混合加热也生成气体B,把B与氮气以1:4体积混合充入一集气
加热某紫黑色固体A能生成B,将受热后的残余固体与另一种白色固体混合加热也生成气体B,把B与氮气以1:4体积混合充入一集气瓶中,将一定量暗红色粉末C点燃后伸入该集气瓶,即可见大量白烟D生成,并又得到较纯净氮气,试推断:A为______B为______C为______D为______.(用化学式表示)
 aa123456a1年前1
aa123456a1年前1 -
 kqinglong 共回答了18个问题
kqinglong 共回答了18个问题 |采纳率88.9%解题思路:此题考查了常见物质的物理及化学性质,题目中“紫黑色固体A能生成气体B”,“受热后的残余固体与另一种白色固体混合加热也生成气体B”,“将一定量暗红色粉末C点燃后伸入该集气瓶,即可见大量白烟D生成”,则推测各物质为:包括了高锰酸钾、二氧化锰、氯酸钾、氧气、红磷及五氧化二磷等常见物质的基本物理及化学性质.根据题目中的信息:“紫黑色固体A能生成气体B”,“受热后的残余固体与另一种白色固体混合加热也生成气体B”,“将一定量暗红色粉末C点燃后伸入该集气瓶,即可见大量白烟D生成”,则推测A为高锰酸钾、B为氧气、C为红磷、D为五氧化二磷.
故答案为:KMnO4;O2;P;P2O5点评:
本题考点: 物质的鉴别、推断;化学式的书写及意义.
考点点评: 此题属于推断题,对常见物质的物理及化学性质要熟练掌握,对常见化学反应类型要准确掌握.1年前查看全部
- 氢氧化铝受热分解为什么生成氧化铝和水
 波米1年前1
波米1年前1 -
 一人亦精彩 共回答了19个问题
一人亦精彩 共回答了19个问题 |采纳率89.5%热力学计算得来的,2Al(OH)3=Δ=Al2O3+2H2O1年前查看全部
- 碳酸铵和碳酸氢铵受热分解的产物都一样么?为毛都是氨气、水、二氧化碳啊!
碳酸铵和碳酸氢铵受热分解的产物都一样么?为毛都是氨气、水、二氧化碳啊!
解释解释!
快啊,在线等 fei7107101年前3
fei7107101年前3 -
 美丽人生ζ 共回答了15个问题
美丽人生ζ 共回答了15个问题 |采纳率86.7%(NH4)2CO3 = 2NH3↑ + H2O + CO2↑
NH4HCO3 = NH3↑ + H2O + CO2↑
东西一样,只是生成NH3的量不同
产物一样的反应多了去了,NaOH和H2SO4反应、NaOH和NaHSO4反应,产物不也一样么?1年前查看全部
- 堆放时间较长的蔬菜会因受热而腐烂,堆积在一起的蔬菜能生热的原因是植物进行了( )
堆放时间较长的蔬菜会因受热而腐烂,堆积在一起的蔬菜能生热的原因是植物进行了( )
A. 呼吸作用
B. 光合作用
C. 吸收作用
D. 蒸腾作用 K2C-AN1年前1
K2C-AN1年前1 -
 心灵出口 共回答了12个问题
心灵出口 共回答了12个问题 |采纳率91.7%解题思路:呼吸作用的概念是细胞内有机物在氧的参与下被分解成二氧化碳和水,同时释放才能量的过程.由分析可知,呼吸作用释放出的能量,用于各项生命活动,还有一些以热的形式散失出来.所以堆放时间较长的蔬菜会因受热而腐烂,堆积在一起的蔬菜能生热的原因是植物进行了呼吸作用分解了蔬菜内的有机物导致蔬菜受热而腐烂.
故选:A.点评:
本题考点: 呼吸作用过程中有机物的分解能量的释放.
考点点评: 解答此类题目的关键是理解掌握呼吸作用的实质.1年前查看全部
- 浴室喷头长时间使用会有白色固体附着,这是因为自来水中含有较多的可溶性的钙、镁化合物,其中碳酸氢钙 Ca(HCO3)2受热
 浴室喷头长时间使用会有白色固体附着,这是因为自来水中含有较多的可溶性的钙、镁化合物,其中碳酸氢钙 ca(hco3)2受热易分解,生成难溶性的化合物、气体等物质.某小组探究碳酸氢钙受热分解后产物的成分.
浴室喷头长时间使用会有白色固体附着,这是因为自来水中含有较多的可溶性的钙、镁化合物,其中碳酸氢钙 ca(hco3)2受热易分解,生成难溶性的化合物、气体等物质.某小组探究碳酸氢钙受热分解后产物的成分.
提出猜想:从组成物质元素的角度分析:
猜想1.生成的难溶性化合物可能是______(填化学式).
猜想2.放出的气体可能是o2、h2、co2.
方案设计:请你设计实验,帮助该组同学确定难溶物的成分.
继续探讨:该组同学设计如图实验,继续探究气体的成分.实验步骤 实验现象和结论 取少量难溶物于试管中,______,然后将燃着的木条伸入试管中 若______且木条火焰熄灭,则证明猜想正确
操作1.加热a装置,一段时间后,b装置中的澄清石灰水变浑浊,c装置氢氧化钠溶液的作用是______.
操作2.在a处用燃着的木条检验,无明显现象.
实验结论:
结论:碳酸氢钙分解产生的气体一定有co2;一定没有o2和h2.
实验交流:
交流1.从安全的角度考虑,操作2中存在的实验不足是______.
交流2.小组内某同学对上述结论提出***,认为该实验没有对氧气进行验证,请说出你的观点并阐述理由:______. 尚程茶社1年前1
尚程茶社1年前1 -
 活动如果是 共回答了11个问题
活动如果是 共回答了11个问题 |采纳率81.8%解题思路:根据质量守恒定律,生成的难溶性化合物可能是碳酸钙;由题目给出的信息可知:碳酸钙可以用稀盐酸检验,碳酸钙与盐酸反应生成氯化钙和水和二氧化碳,因此有气泡冒出,并且木条熄灭.该组同学设计如图实验,继续探究气体的成分,C装置氢氧化钠溶液的作用是吸收二氧化碳;从安全的角度考虑,操作2中存在的实验不足是:氢气具有可燃性,点燃气体前没有先验纯;我认为对氧气已经进行验证了,因此不同意此观点;因为氧气具有助燃性,若有氧气产生,实验操作2中的木条燃烧得会更旺.猜想1.根据质量守恒定律,生成的难溶性化合物可能是碳酸钙;故答案为:CaCO3
【方案设计】碳酸钙可以用稀盐酸检验,碳酸钙与盐酸反应生成氯化钙和水和二氧化碳,因此有气泡冒出,并且木条熄灭;故答案为:实验步骤:加入稀盐酸;实验现象和结论:有气泡产生
【继续探究】操作1.该组同学设计如图实验,继续探究气体的成分,C装置氢氧化钠溶液的作用是吸收二氧化碳;故答案为:除去(或吸收)CO2
【实验交流】交流1.从安全的角度考虑,操作2中存在的实验不足是:氢气具有可燃性,点燃气体前没有先验纯;故答案为:点燃气体前没有先验纯
交流2.我认为对氧气已经进行验证了,因此不同意此观点;因为氧气具有助燃性,若有氧气产生,实验操作2中的木条燃烧得会更旺;故答案为:不同意此观点;因为氧气具有助燃性,若有氧气产生,实验操作2中的木条燃烧得会更旺.(答案合理均给分)点评:
本题考点: 实验探究物质的组成成分以及含量;常见气体的检验与除杂方法;质量守恒定律及其应用;氢气、一氧化碳、甲烷等可燃气体的验纯.
考点点评: 有关实验方案的设计和对实验方案的评价是中考的热点之一,设计实验方案时,要注意用最少的药品和最简单的方法;关于对实验设计方案的评价,要在两个方面考虑,一是方案是否可行,能否达到实验目的;二是设计的方法进行比较,那种方法更简便.1年前查看全部
- 如图是“大气受热过程示意图”,其中箭头①②③④表示不同的辐射.读图,完成1~2题.
 如图是“大气受热过程示意图”,其中箭头①②③④表示不同的辐射.读图,完成1~2题.
如图是“大气受热过程示意图”,其中箭头①②③④表示不同的辐射.读图,完成1~2题.
人类活动排放的二氧化碳增多,会导致( )
A.①减弱
B.②增强
C.③增强
D.④减弱 ckoaisdufoiasdu1年前1
ckoaisdufoiasdu1年前1 -
 置佳 共回答了22个问题
置佳 共回答了22个问题 |采纳率90.9%解题思路:大气对太阳辐射的削弱作用:①吸收作用:具有选择性,水汽和二氧化碳吸收红外线,臭氧吸收紫外线,对于可见光部分吸收比较少.②反射作用:无选择性,云层、尘埃越多,反射作用越强.例多云的白天温度不太高.③散射作用:具有选择性,对于波长较短的篮紫光易被散射.例晴朗的天空呈蔚蓝色等.人类活动排放的二氧化碳增多,使大气吸收地面辐射的能力增强,大气吸收更多的地面辐射,气温升高.大气吸收更多的地面辐射,地面辐射热量散失到宇宙中的就比较少,大量的热量就储存在大气层中了.大气中储存了大量的热量,在多云天气时大气逆辐射增强,还给地面的热量更多.
故选:C.点评:
本题考点: 气候与人类活动的关系.
考点点评: 考查对大气的受热过程等考点的理解,要理解记忆.1年前查看全部
- 亚硫酸钠受热分解为?(隔绝空气加热)
 elias561年前1
elias561年前1 -
 zyzhongying 共回答了16个问题
zyzhongying 共回答了16个问题 |采纳率93.8%4Na2SO3 == Na2S + 3Na2SO4; 隔绝空气加强热(600摄氏度)1年前查看全部
- 固体草酸(H2C2O4)受热分解生成碳的氧化物和水,写出该反应的化学方程式
 q7bt1年前2
q7bt1年前2 -
 晓莜 共回答了21个问题
晓莜 共回答了21个问题 |采纳率90.5%H2C2O4=加热=H2O+CO2↑+CO↑1年前查看全部
- 某盐受热分解会产生另一种盐吗
 2503333411年前2
2503333411年前2 -
 zouxiaoliang 共回答了18个问题
zouxiaoliang 共回答了18个问题 |采纳率83.3%可以;例如:2NaHCO3=加热=Na2CO3+CO2↑+H2O1年前查看全部
- 在氯酸钾受热制氧气的实验中,若没有催化剂二氧化锰,则加入少量的高锰酸钾后,反应的速度会______(填“加快”或“减慢”
在氯酸钾受热制氧气的实验中,若没有催化剂二氧化锰,则加入少量的高锰酸钾后,反应的速度会______(填“加快”或“减慢”或“不变”),产生的氧气的质量会______(填“增加”或“减少”或“不变”),高锰酸钾在反应中______催化剂(填“是”或“不是”).氯酸钾受热制氧气的化学方程式为:2KClO3
2KCl+3O2↑MnO2 .△ 2KClO3.
2KCl+3O2↑MnO2 .△  橙小丸91年前1
橙小丸91年前1 -
 shengchiyou 共回答了16个问题
shengchiyou 共回答了16个问题 |采纳率93.8%解题思路:根据高锰酸钾分解的产物(锰酸钾、二氧化锰和氧气)、催化剂的定义进行分析解答本题.高锰酸钾在加热条件下生成锰酸钾、二氧化锰和氧气,高锰酸钾分解生成的二氧化锰能对氯酸钾的分解起到催化作用,故在氯酸钾受热制氧气的实验中,若没有催化剂二氧化锰,则加入少量的高锰酸钾后,反应的速度会加快;由于高锰酸钾分解生成氧气,故产生的氧气的质量会增加;高锰酸钾在反应中不是催化剂,作催化剂的是高锰酸钾分解生成的二氧化锰.氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,反应的化学方程式为:2KClO3
MnO2
.
△2KCl+3O2↑.
故答案为:加快;增加;不是;2KClO3
MnO2
.
△2KCl+3O2↑.点评:
本题考点: 实验室制取氧气的反应原理;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,掌握实验室制取氧气的原理原理、催化剂的概念等并能灵活运用是正确解答本题的关键.1年前查看全部
- 为什么水在受热后蒸发必在常温下蒸发得快
为什么水在受热后蒸发必在常温下蒸发得快
从化学的角度说明答案不要罗嗦将清理即可要又依据不要所答非所问 且慢下手1年前1
且慢下手1年前1 -
 wxhjss 共回答了19个问题
wxhjss 共回答了19个问题 |采纳率89.5%简单的说:
温度升高,分子平均动能增大...提高蒸发速度了~
依据:高二化学教材_[化学反应速率]1年前查看全部
- 碳铵受热分解的化学方程式是什么?离子键、共价键是否被破坏?
 cthiwes1年前1
cthiwes1年前1 -
 传奇NO1 共回答了16个问题
传奇NO1 共回答了16个问题 |采纳率87.5%碳铵NH4HCO3受热分解的化学式
NH4HCO3—加热—NH3↑+H2O↑+CO2↑
碳铵受热分解,破坏离子键.
是否化学键被破坏,要看反应物是什么晶体了,分子晶体破坏的是分子间作用力,离子型晶体破坏离子键,原子晶体破坏共价键,金属晶体破坏金属键.并不是看其发生的是否是化学变化还是物理变化(比如HCl(氯化氢气体)溶于水就破坏离子键).
回答完毕!刚学的,还热乎.1年前查看全部
- 图为“地球大气受热过程示意图”,读图完成4~5题.
图为“地球大气受热过程示意图”,读图完成4~5题.

当前化石燃料的燃烧,排放大量温室气体导致( )
A.①减少
B.②增加
C.③增加
D.④减少 噶vv1年前1
噶vv1年前1 -
 小豹子超人立 共回答了22个问题
小豹子超人立 共回答了22个问题 |采纳率90.9%解题思路:人类活动排放大量温室气体如二氧化碳,二氧化碳增多,大气吸收地面长波辐射增强,从而大气逆辐射增强,即为射向地面的辐射增强.人类活动排放大量温室气体如二氧化碳,二氧化碳增多,大气吸收地面长波辐射增强,从而大气逆辐射增强,即为射向地面的辐射增强.即为②大气吸收地面辐射和④大气逆辐射增强,结合选项得知②增加.
故选:B.点评:
本题考点: 大气的受热过程.
考点点评: 理解掌握大气受热过程及保温作用原理过程即可,属于基础题.1年前查看全部
- 胆矾受热后,由蓝色晶体变为白色粉末,这种现象是不是风化?
胆矾受热后,由蓝色晶体变为白色粉末,这种现象是不是风化?
这句话是否符合实验实际? 王勇20031年前2
王勇20031年前2 -
 我才是登登 共回答了14个问题
我才是登登 共回答了14个问题 |采纳率71.4%是风化
晶体脱去结晶水就是风化1年前查看全部
- 高中化学 FE(NO3)3受热分解的化学方程式怎么写及配平方法
 七20051年前4
七20051年前4 -
 罗钦文 共回答了16个问题
罗钦文 共回答了16个问题 |采纳率81.3%先搞清楚产物,生成氧化铁,NO2,O2。
Fe(NO3)3=△=Fe2O3+NO2↑+O2↑
这个方程中,各个元素的化合价都比较容易确定,所以不需要用特殊方法配平。就用常规的得失电子守恒来配就好了。
铁元素为变价。N元素从硝酸根中+5价得1e变为NO2,O元素从硝酸根中的-2价失2e。
欲使得失电子守恒,则NO2:O2=4:1这个是配平的核心。 ...1年前查看全部
- 氧化汞受热时的变化可用如图表示(图中大圆圈表示汞原子,小圆圈表示氧原子),据图得出的下列结论中,错误的是( )
氧化汞受热时的变化可用如图表示(图中大圆圈表示汞原子,小圆圈表示氧原子),据图得出的下列结论中,错误的是( )

A.氧化汞受热时能分解成汞和氧气
B.原子是化学变化中的最小粒子
C.分子在化学变化中可以再分
D.所有的物质都是由分子构成的 leeshangyin1年前1
leeshangyin1年前1 -
 simonluo009 共回答了17个问题
simonluo009 共回答了17个问题 |采纳率88.2%解题思路:根据氧化汞受热时的变化微观示意图,分析反应物、生成物,分析在化学反应中分子、原子的变化,分析构成物质的微粒有哪些等.由氧化汞受热时的变化微观示意图可知:A、氧化汞受热能分解成汞和氧气,故A说法正确;B、原子在化学反应中不能再分,原子是化学变化中的最小粒子,故B说法正确;C、加热氧化汞时,氧化汞分子分解成氧原子和汞原子,...
点评:
本题考点: 微粒观点及模型图的应用;化学反应的实质.
考点点评: 熟悉化学变化的实质,根据变化微观示意图及粒子构成模拟图,利用分子由原子构成等特点,正确判断变化中的物质构成,是解答本题的基本方法.1年前查看全部
- 急吖一:书写下列化学方程式 1.碱式碳酸铜生成二氧化碳,水和氧化铜 2.高锰酸钾受热分解生成锰酸钾,二氧化锰和氧气 3.
急吖
一:书写下列化学方程式
1.碱式碳酸铜生成二氧化碳,水和氧化铜
2.高锰酸钾受热分解生成锰酸钾,二氧化锰和氧气
3.铁和硫酸反映成硫酸亚铁和氢气
4.铝和盐酸反应生成氯化铝和氧气
5.氢氧化钠和硫酸铜反应生成氢氧化铜沉淀和硫酸钠
6.碳酸钙呵盐酸反应生成氯化钙,二氧化碳和水
7.二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水
8.水在通电条件下生成氢气和氧气
9.二氧化碳呵硫酸反应生成硫酸铁和水 hongzhenfeng1年前1
hongzhenfeng1年前1 -
 pi1215 共回答了18个问题
pi1215 共回答了18个问题 |采纳率83.3%1.Cu2(OH)2CO3=加热=2CuO+CO2+H2O
2.2KMnO4=加热=K2MnO4+MnO2+O2
3.Fe+H2SO4=FeSO4+H2
4.2Al+6HCl=2AlCl3+3H2
5.2NaOH+CuSO4=Cu(OH)2+Na2SO4
6.CaCO3+2HCl=CaCl2+H2O+CO2
7.CO2+Ca(OH)2=CaCO3+H2O
8.2H2O=电解=2H2+O2
9.不反应1年前查看全部
- 某学生用胆矾制取氧化铜固体,并研究氧化铜能否在氯酸钾受热分解实验中起催化作用.实验步骤如下:
某学生用胆矾制取氧化铜固体,并研究氧化铜能否在氯酸钾受热分解实验中起催化作用.实验步骤如下: 
①称量ag胆矾固体放入烧杯中,加水制成溶液,向其中滴加氢氧化钠溶液至溶解完全;
②把步骤①中的溶液和沉淀转移至蒸发皿中,加热至溶液中的沉淀全部变成黑色氧化铜为止;
③过滤、洗涤、干燥,称量所得固体质量为bg;
④取一定质量的上述氧化铜固体和一定质量的氯酸钾固体,混合均匀后加热,收集反应生成的氧气,如图所示.请回答下列问题:
(1)上述各步操作中,需要用到玻璃棒的是(填写序号)______.
(2)由胆矾制备氧化铜的产率(实验产量与理论产量的百分比)为______×100%.
(3)为保证Cu 2+ 沉淀完全,步骤①中溶液的pH应大于10,简述pH试纸测定溶液pH的操作:______.
(4)为证明氧化铜在氯酸钾的分解反应中起催化作用,在上述实验①~④后还应该进行的实验操作是(按实验先后顺序填写字母序号)______.
a、过滤b、烘干c、溶解d、洗涤e、称量
(5)但有的同学认为,还必须另外再设计一个实验才能证明氧化铜在氯酸钾受热分解的实验中起催化作用.你认为还应该进行的另一个实验是______. 2006andy1年前1
2006andy1年前1 -
 fhb0991 共回答了14个问题
fhb0991 共回答了14个问题 |采纳率100%(1)胆矾固体放入烧杯中,加水制成溶液时需要用玻璃棒搅拌,加速胆矾固体溶解速度;在蒸发时用玻璃棒搅拌,是为了防止局部温度过高使液滴飞溅;过滤时用到玻璃棒的作用是引流;氧化铜固体和一定质量的氯酸钾固体,混合均匀也需要玻璃棒的搅拌,所以选择①②③④;
(2)ag胆矾中含铜元素质量为ag×
64
250 =
64
250 a ,设能制得氧化铜的质量为X由X×
64
80 ×100% ═
64
250 a 解得X=
8
25 a 所以由胆矾制备氧化铜的产率:
bg
8
25 a ×100%=
25b
8a ;
(3)pH试纸的用法:用干燥的玻璃棒蘸取少量溶液滴在pH试纸上,将呈现的颜色和标准比色卡对比,读出数值即可;
(4)由于需要证明反应前后氧化铜的质量不变,反应后先将氧化铜从混合物中分离出来:加水溶解,进行过滤,得到的氧化铜上有氯化钾溶液,进行洗涤干燥,再进行称量即可;
(5)通过对比实验才能说明氧化铜的确加快了氯酸钾的反应速度,另取相同质量的氯酸钾固体,不加氧化铜直接加热,对比放出氧气的速率快慢,现象很明显.
故答案为:(1)①②③④;(2)25b/8a;(3)用干燥的玻璃棒蘸取少量溶液滴在pH试纸上,将呈现的颜色和标准比色卡对比,读数;(4)cadbe;(5)另取相同质量的氯酸钾固体,不加氧化铜直接加热,对比放出氧气的速率快慢.1年前查看全部
- 第三问纠结变浑浊肯定是Ca(OH)2 说明有CO2能和水反应的物质目前只有 氧化钙 难道是反应受热膨胀把HCI挤到CaC

第三问
纠结
变浑浊肯定是Ca(OH)2 说明有CO2
能和水反应的物质目前只有 氧化钙
难道是反应受热膨胀把HCI挤到CaCO3里产生的二氧化碳 原因呢? 现象呢?
可是多此一举啊 cathytang811年前1
cathytang811年前1 -
 sllphyj01 共回答了14个问题
sllphyj01 共回答了14个问题 |采纳率92.9%E应该是生石灰,生石灰遇水放出大量的热,从而使锥形瓶装置的压强变大,从而使1内的压强变大,F溶液应该是稀盐酸.气压压着稀盐酸进入2中与碳酸钠反应,生成CO2,所以N溶液会变浑浊.
所以,N溶液是澄清石灰水,第二个空格填:2试管内液体流入,有气泡产生,固体消失;产生上述现象的原因是:Na2CO3+2HCl=2NaCl+H2O+CO2↑ ,二氧化碳是澄清石灰水变浑浊.1年前查看全部
- 用高锰酸钾受热分解制氧气,要得到1.6g氧气,至少需要多少克高锰酸钾?
 单纯的坦诚1年前1
单纯的坦诚1年前1 -
 啬郎 共回答了16个问题
啬郎 共回答了16个问题 |采纳率75%高锰酸钾和氧气是物质的量比是2:1,0.05mol氧气需要0.1mol的高锰酸钾,即15.8g 的高锰酸钾.1年前查看全部
- 为什么受热分解产生氨气不是铵盐的共同性质
 RaRaa1年前4
RaRaa1年前4 -
 xu_guang_fan 共回答了20个问题
xu_guang_fan 共回答了20个问题 |采纳率100%如果是强氧化性酸的铵盐,如硝酸铵,则分解的产物不是铵盐
另外,硫酸铵等受热一般情况下是不分解的1年前查看全部
- 为什么气体受热,密度会变小?
 gritty02051年前4
gritty02051年前4 -
 萧萧丫丫 共回答了16个问题
萧萧丫丫 共回答了16个问题 |采纳率93.8%一,密闭气体的密度不会随温度的升高而改变.
因为密闭气体的质量不随温度的变化而改变,且因为密闭体积不会改变,所以密闭气体的密度不会随温度的升高而改变.
二,敞开的气体(例如大气),是因为它的体积可以自由的“热胀冷缩”,由ρ=m/V知道,在质量不变时,体积越大密度就越小.1年前查看全部
- NaCl晶体受热熔化后是否存在离子键 为什么
 七七愿望多1年前1
七七愿望多1年前1 -
 cmcfy 共回答了16个问题
cmcfy 共回答了16个问题 |采纳率81.3%答:不存在.因为加热后,NaCl变成了熔融状态,离子键被破坏.阴阳离子没有了离子键的约束,可以自由移动,所以熔融状态的NaCl是导电的.反之,因为所以熔融状态的NaCl是导电的,这一实验事实,可以知道,NaCl离子键被破话.1年前查看全部
- 如下图形象地表示水在常温下的挥发和水受热加快蒸发的情况,由此分析下列说法错误的是 [
如下图形象地表示水在常温下的挥发和水受热加快蒸发的情况,由此分析下列说法错误的是  [ ]
[ ]A.分子总是在不断地运动着
B.在受热情况下,分子能量增大,运动速率加快
C.只要温度相同,任何物质分子间的间隔都是相同的
D.同一种物质在固态、液态和气态时分子间的间隔是不同的 CAR盟老七1年前1
CAR盟老七1年前1 -
 夜风雨 共回答了16个问题
夜风雨 共回答了16个问题 |采纳率87.5%C1年前查看全部
- 读图“地球表面受热过程示意图”,完成题。
读图“地球表面受热过程示意图”,完成题。

小题1:表示近地面大气主要直接热源的是
小题2:人类活动排放二氧化碳增多,会导致A.① B.② C.③ D.④ A.①减弱 B.②增强 C.③减弱 D.④增强  蝶碟恋花1年前1
蝶碟恋花1年前1 -
 lyt_nihao 共回答了13个问题
lyt_nihao 共回答了13个问题 |采纳率92.3%小题1:C
小题2:D
1年前查看全部
- 读“地球表面受热过程示意图”,完成题。
读“地球表面受热过程示意图”,完成题。
小题1:图中能对地面起到保温作用的是
小题2:白天云量增多时,会导致A.① B.② C.③ D.④ A.①减弱 B.②减弱 C.③增强 D.④不变  厌恶阿迷1年前1
厌恶阿迷1年前1 -
 ladp 共回答了23个问题
ladp 共回答了23个问题 |采纳率95.7%小题1:D
小题2:B
1年前查看全部
- 某固体物质受热后变成该物质的气态,这个变化属于?C可能是物理变化,也可能是化学变化 D既是物理变化,也是化学变化
 9月171年前1
9月171年前1 -
 黄毛丫头naddy 共回答了21个问题
黄毛丫头naddy 共回答了21个问题 |采纳率95.2%变成该物质的气态,说明不是化学变化,这个过程就是单纯的物理变化,升华,选B1年前查看全部
- 碳酸镁受热水解生成氢氧化镁为什么碳酸镁微溶于水受热就能生成更难溶于水的氢氧化镁
 机车女孩1年前2
机车女孩1年前2 -
 为什么那么爱** 共回答了18个问题
为什么那么爱** 共回答了18个问题 |采纳率88.9%碳酸镁的溶解可以看做是可逆反应,镁离子和碳酸根为生成物,碳酸根水解产生氢氧根,氢氧化镁溶度积小,生成物浓度降低平衡右移,碳酸镁不断转化为氢氧化镁1年前查看全部
- (2008•镇江)草酸晶体(H2C2O4•2H2O)熔点较低,加热会熔化、气化和分解.草酸(H2C2O4)受热会分解,它
(2008•镇江)草酸晶体(H2C2O4•2H2O)熔点较低,加热会熔化、气化和分解.草酸(H2C2O4)受热会分解,它与氢氧化钙的反应为:H2C2O4+Ca(OH)2=CaC2O4↓(白色)+2H2O.
甲、乙两同学对草酸受热分解的产物作如下探究:
(1)猜想与假设:第一种:草酸分解生成CO2和H2;第二种:草酸分解生成CO2、CO和H2O;
第三种:草酸分解:H2C2O4→CO2↑+H2O(未配平);
有同学从理论上就可判断第三种假设不成立,老师也认为这一判断是正确的,该同学判断的理论依据是______.
(2)设计与实验:
甲、乙两同学分别设计了下图所示的A、B两套实验装置(图中铁架台略去).
①甲同学按A装置实验,观察到澄清石灰水变浑浊,认为此现象是由草酸晶体受热分解产生的CO2所导致,此判断______(填“严密”或“不严密”).
②乙同学的B装置图方框内的仪器未画完整,请你帮他画完整(直接画在图上或答题卡上).
乙同学按B装置实验,看到无水硫酸铜由白变蓝,洗气瓶中溶液变浑浊.在尖嘴管口点燃剩余气体,火焰上方罩一个______烧杯,有白色固体生成,证明产物中有______;换一个干、冷烧杯罩在火焰上方,内壁无现象,证明产物中无H2.
(3)结论与思考:
①草酸受热分解的化学方程式为:H2C2O4
CO2↑+CO↑+H2O(2分);加热 ..H2C2O4.
CO2↑+CO↑+H2O(2分);加热 ..
②若省略B装置方框内的仪器,整套装置也能证明产物中有CO2(假设每步都反应完全),方法是:______. ujdf21年前1
ujdf21年前1 -
 zpp402423 共回答了12个问题
zpp402423 共回答了12个问题 |采纳率100%解题思路:猜想生成物首先考虑元素化合价反应前后肯定有升高的也又降低的,再根据图中设计的实验和二氧化碳的性质解决其它题目.(共8分)
(1)酸受热分解若只生成二氧化碳和水,氢氧元素化合价不变,而碳元素化合价升高,所以反应后应有化合价降低的元素,所以(1)答案:(1)无法进行配平、配不平或不符合质量守恒定律或只有化合价的升高,无化合价的降低(1分).
(2)烧杯敞口放置在空气中空气中也有二氧化碳,时间长了烧杯内的澄清石灰水也会变浑浊,故答案:①不严密(1分)注意洗气瓶要长进短出,进气的导管要浸没液体中,出气导管只要刚刚露出橡皮塞.故答案②如右下图(长管不伸入液面下不给分,不作美观要求)(1分)
因为无水硫酸铜由白变蓝,洗气瓶中溶液变浑浊,所以草酸受热分解肯定生成二氧化碳和水,但都被吸收.到最后点燃的是一氧化碳,燃烧生成二氧化碳.故答案:内壁附有澄清石灰水(其它合理答案均给分)(1分)CO(1分)
(3)根据实验现象和前面的分析知草酸受热分解生成二氧化碳、一氧化碳、水.故答案:①H2C2O4
△
.
CO2↑+CO↑+H2O(2分);
二氧化碳能和碱石灰中的氢氧化钠反应,虽没现象但干燥管因吸收它质量增加.故答案:②称量实验前后盛有碱石灰的干燥管的质量(意思相近的表述均给分)(1分)点评:
本题考点: 实验探究物质的性质或变化规律;化学实验方案设计与评价;化学方程式的配平;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题是实验探究题,综合考查到了质量守恒定律、物质的性质、化学用语相关知识.1年前查看全部
- 乙醇和乙酸的反应,导管不能插入碳酸钠饱和溶液是因为防倒吸.倒吸是因为受热不均.这里的受热不均是什么意思
 我爱吃鱼1年前2
我爱吃鱼1年前2 -
 mingchao919 共回答了25个问题
mingchao919 共回答了25个问题 |采纳率92%倒吸是因为内外气压不平衡,温度忽然变冷的话,压强变小,就会将外界的液体吸进来.1年前查看全部
- 石棉网的用途是什么?如何使受热体间接受热和受热均匀?
 li1397tt1年前1
li1397tt1年前1 -
 honghuo636 共回答了14个问题
honghuo636 共回答了14个问题 |采纳率71.4%火焰长时间集中在容器的某个地点,最终会使容器爆裂.
用石棉网,火焰的热量会分散到容器的每个角落,长时间烧容器也不会爆裂.
因为石棉不是可燃性物质,铁丝可将火焰的热量分散到空气里,传到容器上方,热量均匀.1年前查看全部
- 化学物质推断题.A元素氢化物的核外电子总数为10个.A的最高价氧化物B与烧碱反应生成盐C.C受热分解出新盐D和气体E.问
化学物质推断题.
A元素氢化物的核外电子总数为10个.A的最高价氧化物B与烧碱反应生成盐C.C受热分解出新盐D和气体E.问A.B.C.D.E各是什么.并给出所有反应的化学方程式和离子方程式.
我推断出A是碳..但是E跟B物质就是一样的了?是不是有问题..请高手给出推断依据.. yl761年前3
yl761年前3 -
 40009024110 共回答了29个问题
40009024110 共回答了29个问题 |采纳率86.2%A不一定是碳,氮、氧、氟均有可能(NH3、H2O、HF的核外电子总数都是10个,不信你数数),通过第二、三句话,把氧和氟排除掉.当A是氮时,B是N2O5(五氧化二氮,硝酸的酸酐),C是NaNO3,硝酸盐不稳定,受热会分
2NaNO3==2NaNO2(亚硝酸钠)+O2
则D是NaNO2,E是氧气1年前查看全部
- 右图是小华同学设计的一套验证NH4HCO3受热分解及分解产物的装置(已知NH4HCO3 △
 右图是小华同学设计的一套验证NH4HCO3受热分解及分解产物的装置(已知NH4HCO3
右图是小华同学设计的一套验证NH4HCO3受热分解及分解产物的装置(已知NH4HCO3
NH3↑+H2O+CO2↑,图中固定干燥试管的部分未画出).实验所用药品从:NH4HCO3粉末,红色石蕊试纸,澄清石灰水,水,浓硫酸等药品中选择,请按要求回答下列问题:△ .
①A烧杯中盛装的药品是______,作用是______.
②C烧杯中盛装的药品是______,实验中有何现象(用化学方程式表述)______.
③若B是红色石蕊试纸,在实验过程中发生的变化为______. 莉莉丝lavender1年前1
莉莉丝lavender1年前1 -
 wnnhy037 共回答了16个问题
wnnhy037 共回答了16个问题 |采纳率100%解题思路:由于本实验验证NH4HCO3受热分解,而没有酒精灯加热,所以要考虑物质结合放热的问题,验证二氧化碳要根据二氧化碳的特性来考虑,根据氨气水溶液显碱性来考虑红色石蕊试纸的变色情况.①在所给药品中只有浓硫酸溶于水放热,能够使NH4HCO3受热分解,所以A烧杯中盛装的药品是水和浓硫酸;
②C烧杯中盛装的药品是用来验证产物中是否含有二氧化碳的,所以盛装的是澄清石灰水,变浑浊的原因是二氧化碳与氢氧化钙反应生成碳酸钙沉淀的缘故.
③由于NH4HCO3受热分解的产物中既有氨气也有水,氨气溶于水形成的氨水是弱碱,能使红色石蕊试纸变蓝.
故答案为:①水和浓硫酸;浓硫酸溶于水放热,使NH4HCO3受热分解.
②澄清石灰水;CO2+Ca(OH)2═CaCO3↓+H2O.
③变蓝点评:
本题考点: 溶解时的吸热或放热现象;二氧化碳的检验和验满.
考点点评: 要想验证生成物,必须了解生成物的特性:二氧化碳能使石灰水变浑浊,氨气的水溶液显碱性,能使红色石蕊试纸变蓝.1年前查看全部
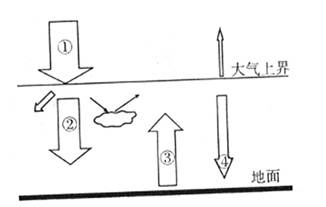
- 就整个地球大气来说,受热能量的根本来源是太阳辐射,太阳辐射能被大气接收和转化的过程十分复杂,其加热大气的过程大致可以用图
 就整个地球大气来说,受热能量的根本来源是太阳辐射,太阳辐射能被大气接收和转化的过程十分复杂,其加热大气的过程大致可以用图表示.读图完成23~25题.
就整个地球大气来说,受热能量的根本来源是太阳辐射,太阳辐射能被大气接收和转化的过程十分复杂,其加热大气的过程大致可以用图表示.读图完成23~25题.
多云的天气昼夜温差较小,主要是因为( )
A.②增强,③减弱
B.②减弱,③增强
C.③增强,④减弱
D.②减弱,④增强 龙52013141年前1
龙52013141年前1 -
 laolamiss 共回答了13个问题
laolamiss 共回答了13个问题 |采纳率84.6%解题思路:晴天云层薄大气对太阳辐射的削弱作用弱夜晚保温作用弱,故而白天温度高夜晚温度低;阴天白天由于大气辐射的削弱作用强故温度低,夜晚大气逆辐射作用强温度高.而此图为大气受热过程和保温作用原理示意图.过程为:由于大气层中的水汽、尘埃和二氧化碳对太阳的短波辐射吸收能力较弱,因此大部分太阳辐射能直接到达地表.地表在吸收了太阳短波辐射后,不断增温的同时释放长波辐射.近地面大气对地面的长波辐射具有很强的吸收能力,近地面大气增温后释放的长波辐射大部分以大气逆辐射的形式射向地面.大气逆辐射的存在使得近地面大气层始终保持有一定的温度,因而具有保温作用.故可知,①为太阳辐射,②为太阳辐射中到达地面的可见光部分,④为大气逆辐射,③为地面辐射.阴天白天由于大气辐射的削弱作用强故温度低,夜晚大气逆辐射作用强温度高,故阴天温差较小.而①为太阳辐射,②为太阳辐射中到达地面的可见光部分,④为大气逆辐射,③为地面辐射.故多云的天气昼夜温差较小,主要是因为即为②减弱,④增强.
故选:D.点评:
本题考点: 大气的受热过程.
考点点评: 掌握大气受热过程及保温作用原理即可,属于基础题.1年前查看全部
- 下列说法中描述物质的化学性质的是( ) A.水受热变成水蒸气 B.双氧水受热易分解 C.过氧化氢是一种无色液体 D.二
下列说法中描述物质的化学性质的是( ) A.水受热变成水蒸气 B.双氧水受热易分解 C.过氧化氢是一种无色液体 D.二氧化锰不溶于水  3839211年前1
3839211年前1 -
 寒水依痕的梦幻 共回答了20个问题
寒水依痕的梦幻 共回答了20个问题 |采纳率95%A、水受热变成水蒸气的过程中只是水的状态发生改变,没有新物质生成,属于物理变化,故选项错误.
B、双氧水受热易分解,需要通过化学变化才能表现出来,属于化学性质,故选项正确.
C、过氧化氢是一种无色液体,描述的是颜色、状态,不需要通过化学变化就能表现出来,属于物理性质,故选项错误.
D、二氧化锰不溶于水,描述的是溶解性,不需要通过化学变化就能表现出来,属于物理性质,故选项错误.
故选B.1年前查看全部
- 物体受热膨胀,分子势能怎么变?为什么?
 zywalterrr1年前1
zywalterrr1年前1 -
 flywinder_2 共回答了15个问题
flywinder_2 共回答了15个问题 |采纳率100%物体受热膨胀后,体积会变大,分子间的距离会增加,故分子势能变大.1年前查看全部
- 柠檬酸受热分解吗雪碧中加入紫色石蕊 然后加热 问颜色变化一直都是红的咯
 yla1231年前2
yla1231年前2 -
 千金买醉 共回答了17个问题
千金买醉 共回答了17个问题 |采纳率100%不分解.
溶液会变红.1年前查看全部
- 根据如图海水综合利用的工业流程图,判断下列说法正确的是( )已知:MgCl2•6H2O受热生成Mg(OH)Cl和HCl
根据如图海水综合利用的工业流程图,判断下列说法正确的是( )已知:MgCl2•6H2O受热生成Mg(OH)Cl和HCl气体等
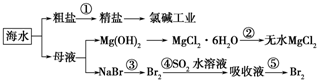
A.除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.在过程②中将MgCl2•6H2O灼烧即可制得无水MgCl2
C.从能量转换角度来看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程
D.从第③步到第⑤步的目的是为了浓缩 涂土1年前1
涂土1年前1 -
 香自苦寒来 共回答了23个问题
香自苦寒来 共回答了23个问题 |采纳率95.7%解题思路:A.过程①加入的药品顺序为BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸;
B、氯化镁易水解,为防止水解过程③中结晶出的MgCl2•6H2O要一定条件下加热脱水制得无水MgCl2;
C、电解原理分析,电解饱和食盐水是电能转化为化学能;
D、溴离子被氧化为溴单质后,被二氧化硫吸收生成溴离子,加入氧化剂氧化溴离子为溴单质,富集溴元素;A.过程①加入的药品顺序为BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸,如果再过滤沉淀前加入过量BaCl2溶液,稀盐酸不能除去氯化钡溶液,所以会产生杂质,故A错误;
B、氯化镁易水解,为防止水解,过程③中结晶出的MgCl2•6H2O要氯化氢氛围中加热脱水制得无水MgCl2,故B错误;
C、电解原理分析,电解饱和食盐水是电能转化为化学能,故C错误;
D、溴离子被氧化为溴单质后,被二氧化硫吸收生成溴离子,加入氧化剂氧化溴离子为溴单质,富集溴元素,从第③步到第⑤步的目的是为了浓缩,故D正确;
故选D.点评:
本题考点: 海水资源及其综合利用.
考点点评: 本题考查了海水资源的综合利用,明确该过程中发生的反应及反应原理是解本题关键,注意除杂剂的滴加顺序、由MgCl2•6H2O制备无水MgCl2的条件,为易错点,题目难度中等.1年前查看全部
- 碳铵受热分解的化学方程式
 tian51年前1
tian51年前1 -
 黄金二两 共回答了16个问题
黄金二两 共回答了16个问题 |采纳率93.8%NH4HCO3===NH3+CO2+H2O 再加个加热符号
满意请采纳1年前查看全部
- 用微粒的观点解释下列现象碘受热升华和凝华;打气筒里的空气加压时体积明显减小,给水加压时体积无明显变化;水电解生成氢气和氧
用微粒的观点解释下列现象
碘受热升华和凝华;打气筒里的空气加压时体积明显减小,给水加压时体积无明显变化;水电解生成氢气和氧气
化学题 fyh_10301年前1
fyh_10301年前1 -
 天tian1026 共回答了15个问题
天tian1026 共回答了15个问题 |采纳率86.7%1、碘受热升华:
碘受热,碘分子的运动更加剧烈(初一教过的吧、),于是碘分子之间的距离增大,原本的固体的密度就减小、就升华为气体.、
2、打气筒里的空气加压时体积明显减小,给水加压时体积无明显变化:
空气的分子之间的间隙比较大(就是说密度比较小、)那么它们之间的空隙就比较容易被挤压变小(体积减小);而水的分子间隙比较小不容易被压缩.
3、水电解生成氢气和氧气:
水通直流电的时候,水分子(分子式H2O、),就拆分成氢原子和氧原子(H和O),然后氢原子和氧原子又自由组合,组成氢气和氧气(H2和O2)、
就是这样~~1年前查看全部
- 物理实验碘受热升华为什么 更合理反映碘升华的是实验甲?
 hsx4561年前2
hsx4561年前2 -
 xuanzhu1 共回答了14个问题
xuanzhu1 共回答了14个问题 |采纳率71.4%因为I2分子是非极性分子,分子之间只有相对较弱的色散力存在,虽然由于I2分子量较大,色散力较前三个卤素单质较大,使I2常温下呈固体,但I2的饱和蒸气压大,所以易升华.1年前查看全部
- 氢气受热会膨胀?氢气球瘪了受热能膨胀?
 needle20081年前1
needle20081年前1 -
 KSLA 共回答了9个问题
KSLA 共回答了9个问题 |采纳率88.9%氢气受热能膨胀没有错,但是你的氢气球瘪了是氢气漏了,不能通过加热来复原,只能再去冲氢气.1年前查看全部
- 为什么在加热液体时,试管外壁有水可以忽略!而在加热固体时试管会受热不均匀而爆炸?
 ligang7803271年前1
ligang7803271年前1 -
 tianmeng1999 共回答了13个问题
tianmeng1999 共回答了13个问题 |采纳率92.3%液体导热能力高于固体,加热液体热量能更快扩散,不至于某区域温度明显高出周围,而固体导热能力相对较弱,容易受热不均匀而炸裂.1年前查看全部
- 为什么大理石和稀盐酸制取二氧化碳,碳酸氢钠受热分解产生的二氧化碳不会对自然环境造成污染
 yuanyongpeng1年前1
yuanyongpeng1年前1 -
 ohnosos 共回答了20个问题
ohnosos 共回答了20个问题 |采纳率70%毕竟是产生少量的1年前查看全部
- 有NaOH、NaHCO3和与其他物质都不反应、受热也不分解的杂志组成固体混合物17.11克
有NaOH、NaHCO3和与其他物质都不反应、受热也不分解的杂志组成固体混合物17.11克
有NaOH、NaHCO3和与其他物质都不反应、受热也不分解的杂质组成固体混合物17.11克,密闭加热至250度,充分反应
将产生气体通入过量澄清石灰水,的沉淀2.5克
冷却后全溶于水制成50毫升溶液
取出10毫升,与含HCl 1.825克的盐酸溶液25毫升 恰好中和
求原混合物中含杂质的质量分数? win2131年前1
win2131年前1 -
 ly_liuyou 共回答了14个问题
ly_liuyou 共回答了14个问题 |采纳率92.9%m(CaCO3)=2.5g
n(CaCO3)=2.5/100=0.025mol
由:Ca(OH)2+CO2=CaCO3+H2O
则:n(CO2)=0.025mol
由:2NaHCO3=Na2CO3+H2O+CO2
则:原有NaHCO3 0.05mol,为4.2g
加热后固体中含Na2CO3 0.025mol,为2.65g
m(HCl)=1.825g,n(HCl)=0.05mol
由:NaOH+HCl=NaCl+H2O;Na2CO3+2HCl=2NaCl+H2O+CO2,取出了原有的1/5,恰好中和
则:Na2CO3消耗的HCl为0.025/5*2=0.01mol,NaOH消耗的HCl为0.05-0.01=0.04mol
则:混合物中含有NaOH 0.04*5=0.2mol,为8g
所以:共有NaOH 8g,NaHCO3 4.2g 总计12.2g
含杂质:17.11-12.2=4.91g 杂质质量分数:4.91/17.11=28.697%1年前查看全部
- 氯化铵与氢氧化钠混合固体受热
 上来丢个图1年前1
上来丢个图1年前1 -
 懒人MM 共回答了30个问题
懒人MM 共回答了30个问题 |采纳率90%NH4Cl +NaOH ===加热==NaCl +H2O+NH3气体1年前查看全部
- 边长为a的混凝土正方体受热膨胀,边长增加了h,问这个正方体体积近似增加了多少
 具体起来说1年前0
具体起来说1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
大家在问
- 1Tina used to run in the morning, I used to run,too
- 2网上购物的好处和坏处.请分别用英文和中文表达出来
- 3酶工程,细胞工程,发酵工程和基因工程,它们之间的联系是怎样的?
- 450分!物理磁场题,磁场中线框受力的变化
- 5好望角与埃及北部气候类型相同,但气候特点有很大差别;原因是
- 6英语绝对渣……想提高点分数,英语厉害的给我一些万能短语吧!例如all in all这些
- 7_is the eleven month of a year中_填什么
- 8有关变阻器的!
- 91/2*2/3*3/4...*99/100*100/101=( ? ),这道题怎么做呀?哪位好心人帮帮忙.
- 10出师表中,诸葛亮提出3个建议是为了要实现哪三个政治愿望?
- 11已知函数 f(x)=log3(2x+4),g(x)=log3(5-3x),求使函数f(x)>g(x)时的X取值范围
- 12英语阅读理解,求答案~~I have been in England three months now. I hope
- 13用 一丛丛…一顶顶… 造句要两句
- 14设函数f(x)=2 x +1(x∈R)的反函数为f -1 (x),则函数y=f -1 (x)的图象是 [
- 15反义词组成词语有哪些两个字的
