计算所得税2012年8月,李某在某大学讲学,取得劳务报酬所得80000元,从中拿出20000元通过国家机关捐赠给受灾地区
 yehua2022-10-04 11:39:541条回答
yehua2022-10-04 11:39:541条回答2012年8月,李某在某大学讲学,取得劳务报酬所得80000元,从中拿出20000元通过国家机关捐赠给受灾地区.李某8月份应缴纳的个人所得税是?

已提交,审核后显示!提交回复
共1条回复
 帕特的Julee 共回答了21个问题
帕特的Julee 共回答了21个问题 |采纳率95.2%- 应纳税所得额=80000*(1-20%)=64000元
捐赠额抵扣限额64000*30%=19200元
抵扣后的应纳税所得额为64000-19200=44800元
应纳个人所得税=20000*20%+24800*30%=11440元 - 1年前
相关推荐
- 急求!(化学)实验室需要0.1mol/mL硫酸溶液100mL,现有2mol/L硫酸溶液,计算所需2mol/L硫酸溶液的体
急求!(化学)实验室需要0.1mol/mL硫酸溶液100mL,现有2mol/L硫酸溶液,计算所需2mol/L硫酸溶液的体积
 takageng1年前3
takageng1年前3 -
 xiao_se 共回答了16个问题
xiao_se 共回答了16个问题 |采纳率93.8%稀释公式:c1·V1 = c2·V2
0.1mol/L × 0.1L = 2mol/L × V
解得:V = 0.005L = 5mL1年前查看全部
- 将6.5g锌放入足量的稀硫酸中充分反应.得到80ml密度为1.25g/ml的溶液,计算所得溶液中硫酸锌的物质的量浓度和质
将6.5g锌放入足量的稀硫酸中充分反应.得到80ml密度为1.25g/ml的溶液,计算所得溶液中硫酸锌的物质的量浓度和质量分数是多少?
貌似很简单,但是脑袋缺氧不晓得怎么写了
25mol/ml 16.1%
可不可以写下详细点的过程
不用计算 就是告诉我怎么想就好 yidongzhang19741年前1
yidongzhang19741年前1 -
 弥补 共回答了18个问题
弥补 共回答了18个问题 |采纳率88.9%6.5克锌就是0.1mol锌.锌有0.1mol,那么硫酸锌也有0.1mol.溶液体积是0.08L,硫酸锌的物质的量浓度上就是0.1/0.08.锌有0.1mol,那么硫酸锌也有0.1mol.质量分数是硫酸锌的质量比溶液总质量就是125g/mol*0.1/1.25g/ml*0.08L*100%=16.1%1年前查看全部
- 已知20℃,食盐的溶解度为36g/100g水,将30g食盐放入80g水中,充分搅拌,计算所得溶液的溶质质量分数
已知20℃,食盐的溶解度为36g/100g水,将30g食盐放入80g水中,充分搅拌,计算所得溶液的溶质质量分数
要详细过程啊!
 可爱的不大小恐龙1年前1
可爱的不大小恐龙1年前1 -
 青眉书生 共回答了13个问题
青眉书生 共回答了13个问题 |采纳率84.6%设 30克食盐中有x克溶于水中
36/100=x/80
x=28.8
也就是说饱和的时候有28.8克的食盐溶于水中,此时的溶液质量m=80+28.8=108.8克
质量分数=溶质/溶液
28.8/108.8=26.48%1年前查看全部
- 实验室需要0.1摩尔每升氢氧化钠溶液100毫升,现有2mol/L氢氧化钠溶液. (1)计算所需2mol/L氢氧化钠溶液.
实验室需要0.1摩尔每升氢氧化钠溶液100毫升,现有2mol/L氢氧化钠溶液. (1)计算所需2mol/L氢氧化钠溶液...
实验室需要0.1摩尔每升氢氧化钠溶液100毫升,现有2mol/L氢氧化钠溶液. (1)计算所需2mol/L氢氧化钠溶液的体积为多少升? (2)完全中和50ml已配制溶液,需要1mol/L得盐酸多少毫升?. 写个公式然后把数字带进去就行勒.卟用计算 0082121年前3
0082121年前3 -
 Moonriver_1980 共回答了22个问题
Moonriver_1980 共回答了22个问题 |采纳率77.3%(1)稀释定律
c浓V浓=c稀V稀 2mol/L*V浓= 0.1mol/L*100mL
(2) NaOH HCl
1mol 1mol
0.1mol/L*0.05L 1mol/L*V(HCl)
0.1mol/L*0.05L = 1mol/L*V(HCl)1年前查看全部
- 将6.5g锌放入足量的稀硫酸中充分反应,得到80mL密度为1.25g/mL的溶液.试计算所得溶液中硫酸锌的物质的量浓度是
将6.5g锌放入足量的稀硫酸中充分反应,得到80mL密度为1.25g/mL的溶液.试计算所得溶液中硫酸锌的物质的量浓度是多少?
 ss网1年前2
ss网1年前2 -
 鬼才不傻 共回答了20个问题
鬼才不傻 共回答了20个问题 |采纳率85%解题思路:先根据题意判断锌完全反应,结合反应方程式求出硫酸锌的物质的量,再根据物质的量浓度公式计算硫酸锌的物质的量浓度.根据题意知,锌完全反应,稀硫酸过量,以锌为标准计算硫酸锌的物质的量,
Zn+H2SO4 =ZnSO4 +H2 ↑
1 1
[6.5g/65g/mol]=0.1mol 0.1mol
C=[n/V]=[0.1mol/0.08L]=1.25mol/L
故答案为:1.25mol/L点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查的是有关物质的量浓度的计算,排除”溶液密度“的干扰是解本题的关键.1年前查看全部
- 将一个直角三角形(直角边是3厘米和4厘米,斜边是5厘米)以斜边为轴,旋转一周,计算所得的立体图形的体积
 wyf10101年前7
wyf10101年前7 -
 海鸥随风 共回答了18个问题
海鸥随风 共回答了18个问题 |采纳率100%分析:所得的立体图形是两个底面合在一起的圆锥,底面半径可以借助三角形面积4×3÷2=5×r÷2求出,这样可以求出底面积,又因为两个圆锥的高在一条直线上,利用乘法分配律可以求出结果.
三角形面积 4×3÷2=6(平方厘米)
底面半径 6×2÷5=2.4(厘米)
底面积 3.14×2.4²=18.0864(平方厘米)
立体图形体积 1/3×18.0864×高1+1/3×18.0864×高2
=1/3×18.0864×(高1+高2)
=1/3×18.0864×5
=30.144(立方厘米)1年前查看全部
- 高数题:由y=x的3次方,x=2,y=0所围成的图形,分别绕x轴及y轴旋转,计算所得两个旋转体的体积.
 ww我1年前4
ww我1年前4 -
 正月初二 共回答了22个问题
正月初二 共回答了22个问题 |采纳率95.5%绕x轴旋转体体积V1=∫[0,2]π(x³)²dx=128π/7
绕y轴旋转体体积V2=32π-∫[0,8]π(y^1/3)²dy=64π/51年前查看全部
- 将6.5g锌放入足量的稀硫酸中充分反应,得到80mL密度为1.25g/mL的溶液.试计算所得溶液中硫酸锌的物质的量浓度是
将6.5g锌放入足量的稀硫酸中充分反应,得到80mL密度为1.25g/mL的溶液.试计算所得溶液中硫酸锌的物质的量浓度是多少?
 cq556477191年前1
cq556477191年前1 -
 开天盘古 共回答了20个问题
开天盘古 共回答了20个问题 |采纳率75%解题思路:先根据题意判断锌完全反应,结合反应方程式求出硫酸锌的物质的量,再根据物质的量浓度公式计算硫酸锌的物质的量浓度.根据题意知,锌完全反应,稀硫酸过量,以锌为标准计算硫酸锌的物质的量,
Zn+H2SO4 =ZnSO4 +H2 ↑
1 1
[6.5g/65g/mol]=0.1mol 0.1mol
C=[n/V]=[0.1mol/0.08L]=1.25mol/L
故答案为:1.25mol/L点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查的是有关物质的量浓度的计算,排除”溶液密度“的干扰是解本题的关键.1年前查看全部
- 求函数图形体积把星形线大括号x=a(cost)^3 y=a(sint)^3 所围成的图形绕x轴旋转,计算所得旋转体体积
 青茶wl1年前2
青茶wl1年前2 -
 bummer 共回答了24个问题
bummer 共回答了24个问题 |采纳率87.5%可以用参数方程 也可以用坐标方程来解 这里 我先用坐标方程解 明天补上参数方程解法 y^2/3+x^2/3=a^2/3
y^2=(a^2/3-x^2/3)^3 x属于 [-a,a]
旋转体的体积 V= 在[-a,a]上对 ∫πy^2 dx = ∫π(a^2/3-x^2/3)^3dx=32πa^3/105
今天把第二种答案附上 希望对各位有用
V= ∫πy^2 dx 积分区间 [-a,a]
= 2∫ π(a(sint)^3)^2 da(cost)^3 积分区间[0,π/2]以下都是这个积分区间
=6πa^3∫ (a(sint)^3)^2 cost^2sintdt
=6πa^3∫ sint^7(1-sint^2)dt
=6πa^3∫ sint^7-sint^9dt
=6πa^3(6*4*2/7*5*3-8*6*4*2/9*7*5*3)
288*πa^3/945=πa^3*96/315=πa^3*32/1051年前查看全部
- 实验室需要配制0.2mol/L氢氧化钠溶液100mL,现有4mol/L的浓氢氧化钠溶液,计算所需浓氢氧化钠溶液的体积(m
实验室需要配制0.2mol/L氢氧化钠溶液100mL,现有4mol/L的浓氢氧化钠溶液,计算所需浓氢氧化钠溶液的体积(mL);将足量的镁铝合金溶于该溶液中,产生H2的体积(标准状况下)是多少?
 冀之云1年前1
冀之云1年前1 -
 cc路归人 共回答了23个问题
cc路归人 共回答了23个问题 |采纳率91.3%实验室需要配制0.2mol/L氢氧化钠溶液100mL,现有4mol/L的浓氢氧化钠溶液,计算所需浓氢氧化钠溶液的体积(mL);
设体积V
0.2*0.1=4V
V=0.005L=5 mL
将足量的镁铝合金溶于该溶液中,产生H2的体积(标准状况下)是多少?
只有Al反应
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2
---------2mol-------------------------------3*22.4L
---------0.02mol-----------------------------V
V=0.672L1年前查看全部
- 定积分计算旋转体的体积由曲线 y=x^3,y=0 ,x=2 所围成的图形,分别绕x轴及 y轴旋转,计算所得两个旋转体的体
定积分计算旋转体的体积
由曲线 y=x^3,y=0 ,x=2 所围成的图形,分别绕x轴及 y轴旋转,计算所得两个旋转体的体积. guangzongzhoujin1年前1
guangzongzhoujin1年前1 -
 花哥哥 共回答了19个问题
花哥哥 共回答了19个问题 |采纳率100%1年前查看全部
- 在含1molNaOH的水溶液中通过33gCO2(假设CO2全部参与反应),计算所得溶液中含有Na2CO3和NaHCO3物
在含1molNaOH的水溶液中通过33gCO2(假设CO2全部参与反应),计算所得溶液中含有Na2CO3和NaHCO3物质的量
 wsp01171年前3
wsp01171年前3 -
 白云a随风 共回答了15个问题
白云a随风 共回答了15个问题 |采纳率93.3%33克CO的物质的量=33/44=0.75mol
2NaOH + CO2 = Na2CO3 + H2O
2 1 1
1 0.5 0.5
1mol NaOH与0.5molCO2反应,生成0.5mol的Na2CO3,还剩余0.25mol的CO2,与Na2CO3反应
Na2CO3 + CO2 + H2O = 2NaHCO3
1 1 2
0.25 0.25 0.5
所以剩余0.6-0.25=0.25mol的Na2CO3,生成0.5 mol NaHCO3
所得溶液中含有Na2CO3物质的量=0.25mol
NaHCO3物质的量=0.5 mol1年前查看全部
- 用式子表示十位上的数是a个位上的数是b的两位数再把这个两位数的十位上的数与个位上的数交换位置.计算所得与原数的和这个和能
用式子表示十位上的数是a个位上的数是b的两位数再把这个两位数的十位上的数与个位上的数交换位置.计算所得与原数的和这个和能被十一整除吗7

 小建JJ1年前1
小建JJ1年前1 -
 fine1 共回答了15个问题
fine1 共回答了15个问题 |采纳率93.3%解原数是10a+⺈b新两位数为10b+a则所得与原数的和为(10a+b)+(10b十a)=11a+11b=11(a+b)又因为ab均不等于0且大于9的正整数所以a+b是不等于0的正整数所以11(a+b能被整除所以这两个数的和能被整除1年前查看全部
- 24g木炭在与标准状况下33.6L氧气反应,计算反应后所得气体在标准状况下的体积?计算所得气体中CO2的体积分
 蒲公英兰1年前1
蒲公英兰1年前1 -
 ang_wy 共回答了16个问题
ang_wy 共回答了16个问题 |采纳率81.3%设二氧化碳和一氧化碳的物质的量分别为X、Y
X+Y=2
X+0.5y=1.5
X/Y=1/1
所得气体中CO2的体积分数为1/2=50%1年前查看全部
- 下列调查活动或实验中,计算所得数值与实际数值相比,可能偏大的是( )
下列调查活动或实验中,计算所得数值与实际数值相比,可能偏大的是( )
A. 标志重捕法调查灰喜鹊种群密度时标志物脱落
B. 用血细胞计数板计数酵母菌数量时只统计方格内细胞
C. 样方法调查蒲公英种群密度时在分布较稀疏的地区取样
D. 探究土壤中小动物类群丰富度时仅用肉眼对小动物进行观察和分类 娃哈哈hm3621年前1
娃哈哈hm3621年前1 -
 坏叶子 共回答了19个问题
坏叶子 共回答了19个问题 |采纳率100%解题思路:标志重捕法的计算公式:种群中个体数(N)/标记总数=重捕总数/重捕中被标志的个体数;用血细胞计数板计数酵母菌数量时要统计方格内的菌体,边线上的菌体要计算两条相邻的两边;采用样方法调查蒲公英种群密度时,应随机取样;.明确知识点,梳理相关知识,根据选项描述结合基础知识做出判断.
土壤小动物具有趋湿、趋黑、避高温的特性,所以可以用诱虫器采集小动物,并且打开电灯;采用样方法调查草地中的蒲公英时,对于边界线上的个体,要计相邻两条边及夹角中的数目;若调查的是遗传病的发病率,则应在群体中抽样调查.A、根据标志重捕法的计算公式:种群中个体数(N)/标记总数=重捕总数/重捕中被标志的个体数可知,若部分野兔身上的标志物脱落,则会导致重捕中被标志的个体数偏小,最终导致实验所得到数值比实际数值大,A正确;
B、正常统计时,血球计数板的框格边上的菌体要计算两条相邻的两边,所以只统计计数室方格内的菌体,则实验所得到数值比实际数值偏小,B错误;
C、样方法调查蒲公英种群密度时,应随机取样,而不能在分布较稀疏的地区取样,这样会使计算所得数值偏小,C错误;
D、探究土壤中小动物类群丰富度时仅用肉眼对小动物进行观察和分类,会导致所得数值偏小,D错误.
故选:A.点评:
本题考点: 估算种群密度的方法;探究培养液中酵母种群数量的动态变化;土壤中动物类群丰富度的研究.
考点点评: 本题综合考查种群密度调查、探究酵母菌数量和探究土壤中小动物类群丰富度的相关知识,意在考查学生能独立完成“生物知识内容表”所列的生物实验,包括理解实验目的、原理、方法和操作步骤,掌握相关的操作技能,并能将这些实验涉及的方法和技能进行综合运用.1年前查看全部
- 1,将23.4克NaCl溶解在水中,配成250mL溶液,计算所得溶液中溶质的物质的量浓度.
 沉默中的爆发1年前1
沉默中的爆发1年前1 -
 粽王之粽 共回答了18个问题
粽王之粽 共回答了18个问题 |采纳率83.3%n(NaCl)=23.4/58.5=0.4mol
c(NaCl)=0.4/0.250=1.6mol/L1年前查看全部
- 用18mol/L浓硫酸配制100ml 3.0mol/L稀硫酸.计算所用硫酸的体积?
 sisyphus1011年前1
sisyphus1011年前1 -
 薛平贵 共回答了18个问题
薛平贵 共回答了18个问题 |采纳率77.8%100mL 3.0mol/L的物质的量为0.1*3=0.3mol 所以要浓硫酸的体积为0.3mol/18=0.0167L 即16.7ML1年前查看全部
- 将5克的钠铝合金投入到200mL的水中,固体完全溶解,产生4.48L标准情况下的气体,溶液只有一种.计算所得溶液的物质的
将5克的钠铝合金投入到200mL的水中,固体完全溶解,产生4.48L标准情况下的气体,溶液只有一种.计算所得溶液的物质的量浓度
 风吹海上1年前1
风吹海上1年前1 -
 米润 共回答了17个问题
米润 共回答了17个问题 |采纳率94.1%溶质是NaAlO2
所以n(Na) = n(Al)
4.48L 气体是H2即0.2mol H2
所以反应共转移电子数 = 0.2*2 = 0.4mol
所以n(Na) + 3n(Al) = 0.4mol
23n(Na) + 27n(Al) = 5g
得n(Na) = n(Al) = 0.1mol
所以c = 0.1/0.2 = 0.5mol/L1年前查看全部
- 某同学用质量分数为98%、密度为1.84g/cm的浓硫酸,配制500ml、0.2mol/LH2SO4溶液,计算所需浓硫酸
某同学用质量分数为98%、密度为1.84g/cm的浓硫酸,配制500ml、0.2mol/LH2SO4溶液,计算所需浓硫酸的体积
 爱琴海之旅1年前1
爱琴海之旅1年前1 -
 tqsz2007 共回答了24个问题
tqsz2007 共回答了24个问题 |采纳率87.5%根据稀释前后溶液的浓度不变进行计算.1年前查看全部
- 帮忙解决个初中化学问题某同学用51g过氧化氢溶液和二氧化锰来制取氧气,最后得到氧气2.4g,请计算所用过氧化氢溶液的溶质
帮忙解决个初中化学问题
某同学用51g过氧化氢溶液和二氧化锰来制取氧气,最后得到氧气2.4g,请计算所用过氧化氢溶液的溶质质量分数.
要有解析,全面些
 叶子若为1年前1
叶子若为1年前1 -
 张小林 共回答了17个问题
张小林 共回答了17个问题 |采纳率94.1%设过氧化氢质量为x g
2(H2O2)=2(H2O)+O2
68 32
x g 2.4g
68/x=32/2.4
x=5.1 g
所以 H2O2%=5.1/51=10%1年前查看全部
- 在1L1mol/LNaOH溶液中通入16.8L标准状况下的CO2,计算所得溶液中含有的NaHCO3和Na2CO3的物质的
在1L1mol/LNaOH溶液中通入16.8L标准状况下的CO2,计算所得溶液中含有的NaHCO3和Na2CO3的物质的量
 月点点1年前2
月点点1年前2 -
 默默136 共回答了15个问题
默默136 共回答了15个问题 |采纳率86.7%由CO2的体积计算得CO2的物质的量为0.75mol
2NaOH +CO2=Na2CO3+H2O
2 1 1
1 0.5 0.5
Na2CO3+H2O+CO2=2NaHCO3
1 1 2
0.25 0.25 0.51年前查看全部
- 初一数学.这是三题 指出错在哪里.1.用数值代替代数式里的字母,计算所得的结果叫做代数式的值.2.代数式中的字母可取一切
初一数学.
这是三题 指出错在哪里.
1.用数值代替代数式里的字母,计算所得的结果叫做代数式的值.
2.代数式中的字母可取一切有理数.
3.代数式中的字母可取一切自然数.
额。说的清楚点,什么叫不一定是具体的数值。 qinsiliu1年前2
qinsiliu1年前2 -
 首问责任制 共回答了21个问题
首问责任制 共回答了21个问题 |采纳率90.5%1.代数式的值不一定是一个自然数!
也就是代数式的值不一定是具体的数值.
2.代数式的字母也可以选无理数
应该是可取一切实数!
3.跟2一样1年前查看全部
- 提问,紧急!1、任意写出一个四位数(四个位上的数完全不同),用四个数及它的符号分别组成最大的数和最小的数,计算所组成的最
提问,紧急!
1、任意写出一个四位数(四个位上的数完全不同),用四个数及它的符号分别组成最大的数和最小的数,计算所组成的最大数和最小数得差 { 例如:-1023,用1、0、2、3及符号组成最大的数为-123(即“-0123”),最小为-3210.作差,得-123-(-3210)=3087 } .再对所得差重复上述操作,结果如何?考虑.
2、eat的正在进行时
3、library的复数
4、he sends an e-mail to me every day.的同义句
he____ ____every day.
5、这家店从早上8点营业到晚上6点.
the shop is _____ _____ 8a.m_____6p.m .
6、我们总是坐在树下聊天.(翻译)
7、她对他的同学很好.(翻译) 我也来披个qq1年前1
我也来披个qq1年前1 -
 zz虚拟人t 共回答了17个问题
zz虚拟人t 共回答了17个问题 |采纳率82.4%2.eatting
3.libraries
5.open,from,to
6.We always chatting under the tree.1年前查看全部
- 急 化学浓度的计算题 用600kg质量分数为98%的硫酸和500kgCso3为20%的发烟硫酸混合,试计算所得硫酸的浓度
急 化学浓度的计算题
用600kg质量分数为98%的硫酸和500kgCso3为20%的发烟硫酸混合,试计算所得硫酸的浓度?以Cso3表示
要求: 游拟kk1年前1
游拟kk1年前1 -
 laurelover20_ 共回答了16个问题
laurelover20_ 共回答了16个问题 |采纳率87.5%(1).600kg浓硫酸含水分:
600*(100%-98%)=12kg ;
(2).500kg发烟硫酸含二氧化硫:
500kg*20%=100kg ;
(3).水与与二氧化硫反应得硫酸:
SO3 + H2O = H2SO4
质量比:80……18……98
得到量:……12……?
生成硫酸质量:12*98/18=65.3kg ;
需要三氧化硫量:12*80/18=53.3kg ;
剩余三氧化硫量:100-53.3=46.7kg ;
(4).两种硫酸混合后,混合液的浓度[C(H2SO4中的SO3)%]:
[(600*98%+65.3+500*80%)*80/98]/[600*98%+65.3+500*80%+46.7]
[(588+65.3+400)*80/98]/588+65.3+400+46.7]
859.8/1100=78.2% .1年前查看全部
- 用式子表示百位上的数是a,十位上的数字是b ,个位上的数字是C,再把这个三位数的百位与个位数字对调 ,计算所得的数与原来
用式子表示百位上的数是a,十位上的数字是b ,个位上的数字是C,再把这个三位数的百位与个位数字对调 ,计算所得的数与原来的数的差 ,这个数能被九整除吗?说明理由 .
 accidy1年前2
accidy1年前2 -
 四ff丝 共回答了14个问题
四ff丝 共回答了14个问题 |采纳率92.9%100a+10B+C
100C+10B+a1年前查看全部
- 波粒二象性的一道题金属锂的功函数为2.13eV.(1)用波长为410nm的光照射锂,计算所发出光电子的最大初动能.这个的
波粒二象性的一道题
金属锂的功函数为2.13eV.
(1)用波长为410nm的光照射锂,计算所发出光电子的最大初动能.
这个的答案是0.9eV
(2)用什么波长的光照射可以使从锂发出的光电子具有0.
想问问为什么Ek=mc^2-m0c^2?这一步没看懂
那个式子为什么等于1/4*m0c^2啊? 94支持阿佘1年前2
94支持阿佘1年前2 -
 67533839 共回答了20个问题
67533839 共回答了20个问题 |采纳率100%Ek=mc^2-m0^2
=(m-m0)c^2
=m减少*c^2
根据爱因斯坦的质量和能量转换公式的来的:
E=(一个像三角形的图标,)mc^21年前查看全部
- 将6.5g锌放入足量的稀硫酸中充分反应,得到80mL密度为1.25g/mL的溶液.试计算所得溶液中硫酸锌的物质的量浓度是
将6.5g锌放入足量的稀硫酸中充分反应,得到80mL密度为1.25g/mL的溶液.试计算所得溶液中硫酸锌的物质的量浓度是多少?
 润起来1年前1
润起来1年前1 -
 long_for_love 共回答了17个问题
long_for_love 共回答了17个问题 |采纳率94.1%解题思路:先根据题意判断锌完全反应,结合反应方程式求出硫酸锌的物质的量,再根据物质的量浓度公式计算硫酸锌的物质的量浓度.根据题意知,锌完全反应,稀硫酸过量,以锌为标准计算硫酸锌的物质的量,
Zn+H2SO4 =ZnSO4 +H2 ↑
1 1
[6.5g/65g/mol]=0.1mol 0.1mol
C=[n/V]=[0.1mol/0.08L]=1.25mol/L
故答案为:1.25mol/L点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查的是有关物质的量浓度的计算,排除”溶液密度“的干扰是解本题的关键.1年前查看全部
- 46.8gNacl溶解于水中,形成250ml溶液,计算所得溶液中溶质的物质的量的浓度.
 opqist88981年前3
opqist88981年前3 -
 不吃嫩草的牛 共回答了19个问题
不吃嫩草的牛 共回答了19个问题 |采纳率89.5%n=m/M =46.8/58.5 mol=0.8mol
C=n/V=0.8/0.25 mol/L=3.2mol/L1年前查看全部
- 定义一种对于三位数abc(a、b、c不完全相同)的“F运算”:重排abc的三个数位上的数字,计算所得最大三位数和最小三位
定义一种对于三位数abc(a、b、c不完全相同)的“F运算”:重排abc的三个数位上的数字,计算所得最大三位数和最小三位数的差(允许百位数字为零).例如abc=213时,则
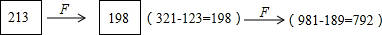
(1)求579经过三次“F运算”的结果(要求写出三次“F运算”的过程);
(2)假设abc中a>b>c,则abc经过一次“F运算”得______(用代数式表示);
(3)若任意一个三位数经过若干次“F运算”都会得到一个固定不变的值,那么任意一个四位数也经过若干次这样的“F运算”是否会得到一个定值?若存在,请直接写出这个定值;若不存在,请说明理由. Slinaaa1年前1
Slinaaa1年前1 -
 asdfjiqwgqwge 共回答了10个问题
asdfjiqwgqwge 共回答了10个问题 |采纳率100%解题思路:(1)根据“F运算”的定义得到579经过三次“F运算”的结果即可;
(2)用100a+10b+c减去100c+10b+a即可;
(3)把1234根据“F运算”的定义进行计算可得到定值.(1)579
F
396(975-579)
F
594(963-369)
F
495(954-459);
(2)100a+10b+c
F
99(a-c);
故答案为99(a-c);
(3)存在,这个定值为6174.点评:
本题考点: 规律型:数字的变化类.
考点点评: 本题考查了规律型:数字的变化类:认真观察、仔细思考,善用联想是解决这类问题的方法.1年前查看全部
- 80gNaOH固体溶解于水中,调配成500ml的溶液,试计算所得溶液的溶质的物质的量的浓度是多少 要具体步骤,
 nnLOVEBBT1年前2
nnLOVEBBT1年前2 -
 60997748 共回答了21个问题
60997748 共回答了21个问题 |采纳率85.7%NaOH的相对分子质量为40,那么它物质的量为2mol,水的体积为0.5L,2/0.5=4mol/L1年前查看全部
- 用质量分数为百分之98,密度是1.84g/ml的浓硫酸,配制0.2mol/L的硫酸溶液500ml,计算所需要的浓硫酸体积
用质量分数为百分之98,密度是1.84g/ml的浓硫酸,配制0.2mol/L的硫酸溶液500ml,计算所需要的浓硫酸体积
可以附上解析过程么?谢谢 大锈豺1年前1
大锈豺1年前1 -
 男人不能这么萎 共回答了22个问题
男人不能这么萎 共回答了22个问题 |采纳率86.4%配制的溶液中含有的n(H2SO4)=0.2mol/L*0.5L=0.1mol
Vml浓硫酸中的n(H2SO4)=Vml*1.84g/ml*98%÷98g/mol
两者相等
可求V=5.43ml1年前查看全部
- 用18mol/L 浓硫酸配制100ml 3.0mol/L 稀硫酸的实验步骤如下:①计算所用
用18mol/L 浓硫酸配制100ml 3.0mol/L 稀硫酸的实验步骤如下:①计算所用浓硫酸的体积,②量取一定体积的浓硫酸,③溶解,④检漏、转移、洗涤,⑤定容、摇匀.回答下列问题:
(1)所需浓硫酸的体积是______(保留到小数点后一位),量取浓硫酸所用的量筒的规格是______(从下列中选用:A.10mlB.25mlC.50mlD.100ml)
(2)在上述实验步骤中,需要用到玻璃棒的有______(填序号).
(3)第⑤步实验的操作是:继续向容量瓶注入蒸馏水至离刻度线1-2cm处,改用胶头滴管向容量瓶滴加至______为止.塞紧瓶塞,倒转摇匀.
(4)下列情况对所配制的稀硫酸浓度有何影响?(填“偏大”、“偏小”或“无影响”)
A.所用的浓硫酸长时间放置在密封不好的容器中______
B.容量瓶用蒸馏水洗涤后残留有少量的水______
C.所用过的烧杯、玻璃棒未洗涤______
D.定容时俯视溶液的凹液面______. miracleforever1年前1
miracleforever1年前1 -
 zyboy7 共回答了23个问题
zyboy7 共回答了23个问题 |采纳率100%解题思路:(1)根据稀释过程中溶质的物质的量不变计算出需要浓硫酸的体积;根据计算出的浓硫酸的体积选择量筒的规格;
(2)配制过程中,浓硫酸的稀释和转移溶液都会用到玻璃棒;
(3)根据配制一定物质的量浓度的溶液时正确的定容操作进行解答;
(4)根据c=[n/V]可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大.(1)配制100ml 3.0mol/L 稀硫酸,需要18mol/L 浓硫酸的体积为:[3.0mol/L×0.1L/18mol/L]≈0.0167L=16.7mL,
故答案为:16.7mL;B;
(2)配制100ml 3.0mol/L 稀硫酸中,稀释浓硫酸和转移稀释的硫酸溶液会用到玻璃棒,即需要用到玻璃棒的有:③④,
故答案为:③④;
(3)定容操作为:继续向容量瓶注入蒸馏水至离刻度线1-2cm处,改用胶头滴管向容量瓶滴加至凹液面与刻度线相切,
故答案为:凹液面与刻度线相切;
(4)A.所用的浓硫酸长时间放置在密封不好的容器中,由于浓硫酸会吸水,导致浓硫酸的浓度偏小,
故答案为:偏小;
B.容量瓶用蒸馏水洗涤后残留有少量的水,由于定容时还需要加入蒸馏水,所以不影响配制结果,
故答案为:无影响
C.所用过的烧杯、玻璃棒未洗涤,导致配制的溶液中溶质的物质的量偏小,根据c=[n/V]可得,配制的溶液浓度偏小,
故答案为:偏小;
D.定容时俯视溶液的凹液面,会导致加入的蒸馏水体积偏小,根据c=[n/V]可得,配制的溶液浓度偏大,
故答案为:偏大.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了配制一定物质的量浓度的溶液的方法,该题是中等难度的试题,试题基础性强,该题难易适中,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力;该题的难点在于误差分析,注意明确误差分析的方法.1年前查看全部
- 电水壶的实际加热时间大于计算所得加热时间,可能的原因有哪些
 鹤舞狂天1年前2
鹤舞狂天1年前2 -
 popou 共回答了22个问题
popou 共回答了22个问题 |采纳率95.5%可能当时是用电高峰期,这样加热时间会变长.还有就是在电路运输过程中,导线也会有一些电阻,而家庭电路中电阻越并越多,那么总电阻变小,根据u=IR可知电压变小,再根据P=U*U/R可得p变小,这样加热时间会变长.还有就是水壶上标的额定功率不正确,不过这种可能性极小,如果你是要做题目的话,我不推荐你写上去.
不知道对你有没有用!1年前查看全部
- 将23.4gNAcl溶于水中,配方250ML溶液,计算所得溶液的物质的量浓度
 89hgfdsaxzx1年前1
89hgfdsaxzx1年前1 -
 一粒尘埃终落定 共回答了21个问题
一粒尘埃终落定 共回答了21个问题 |采纳率85.7%n(NaCl)=23.4/58.5=0.4mol
c=n/v=0.4/0.25=1.6mol/L1年前查看全部
- 是实验室需要0.1mol每升的氢氧化钠溶液100mL,现有2MOL每升氢氧化钠溶液. 计算所需2M
是实验室需要0.1mol每升的氢氧化钠溶液100mL,现有2MOL每升氢氧化钠溶液. 计算所需2M
是实验室需要0.1mol每升的氢氧化钠溶液100mL,现有2MOL每升氢氧化钠溶液.
计算所需2MOL每升氢氧化钠的体积.(2)完全中和5MOL每升的硫酸体积是多少?
求解啊 sophia9421年前2
sophia9421年前2 -
 ADFGUJAETKJRSTG 共回答了18个问题
ADFGUJAETKJRSTG 共回答了18个问题 |采纳率88.9%根据物质的量相等有n=cv=0.1mol/Lx0.1L=2mol/Lxv,v=0.005L=5ml,第二问n=cv=0.1mol/Lx0.1L=5mol/LxV,V=2ml1年前查看全部
- 将23.4g NaCl溶于水中,配成250mL溶液,计算所得溶液中溶质的物质的量浓度?
 yumenl1年前1
yumenl1年前1 -
 kissleaf810 共回答了21个问题
kissleaf810 共回答了21个问题 |采纳率90.5%23.4g的NaCl的物质的量为0.4mol 那么溶质的物质量浓度为0.4/0.25=1.6mol/L1年前查看全部
- 将30g碳酸钠溶液与48.2g氯化钡溶液混合后恰好完全反应.过滤,得19.7g白色沉淀和滤液,试计算所得滤液中溶质的质量
将30g碳酸钠溶液与48.2g氯化钡溶液混合后恰好完全反应.过滤,得19.7g白色沉淀和滤液,试计算所得滤液中溶质的质量分数.
 yuer44331年前1
yuer44331年前1 -
 bio1234cffbio 共回答了17个问题
bio1234cffbio 共回答了17个问题 |采纳率88.2%Na2CO3 + BaCl2 = BaCO3 + 2NaCl
197 117
白色沉淀为碳酸钡,可算出反应产生的氯化钠为11.7克,氯化钠即为溶质.
溶液的质量为30+48.2-19.7=58.5克.
溶质的质量分数为11.7/58.5*100%=20%1年前查看全部
- 【急问,在线等】为何用pH=pKa-lg(C酸/C碱)计算所得的缓冲溶液的pH值是个近似值?
【急问,在线等】为何用pH=pKa-lg(C酸/C碱)计算所得的缓冲溶液的pH值是个近似值?
为何用pH=pKa-lg(C酸/C碱)计算所得的缓冲溶液的pH值是个近似值?(pKa中a为脚标,Ka为共轭酸电离常数) 我要考律1年前1
我要考律1年前1 -
 蝶恋花_ll 共回答了19个问题
蝶恋花_ll 共回答了19个问题 |采纳率84.2%因为当酸碱共存时,在应用Henderson–Hasselbalch方程式时没有考虑酸,或碱的解离转换(尽管这种解离转换程度极小)1年前查看全部
- 将13.0g锌放入足量的稀盐酸中充分反应,得到200ml密度为1.1g/ml的溶液.试计算所得溶液中硫酸锌的物质的量浓度
将13.0g锌放入足量的稀盐酸中充分反应,得到200ml密度为1.1g/ml的溶液.试计算所得溶液中硫酸锌的物质的量浓度和质量各是多少?
 颜白子1年前1
颜白子1年前1 -
 活得简单化 共回答了16个问题
活得简单化 共回答了16个问题 |采纳率87.5%ZN+ 2HCL= ZNCL2+H2
65 136
13g x=27.2g 27.2/136=0.2mol 0.2mol/0.2l=1mol/l所得溶液中氯化锌的物质的量浓度1摩尔每升和质量各是27.2克1年前查看全部
- 在1.00L1.00mol/LNaOH溶液中通入16.8L标准状况下的二氧化碳,计算所得溶液中含有的NaHCO3和Na2
在1.00L1.00mol/LNaOH溶液中通入16.8L标准状况下的二氧化碳,计算所得溶液中含有的NaHCO3和Na2CO3的物质的量.
 mammonhand1年前1
mammonhand1年前1 -
 红呤 共回答了24个问题
红呤 共回答了24个问题 |采纳率91.7%16.8L二氧化碳,就是0.75mol 由2NaOH+CO2=Na2CO3+H2O可知,1molNaOH只能和0.5molCO2反应,生成0.5mol碳酸钠,故还剩余0.25mol二氧化碳 Na2CO3+CO2+H2O=2NaHCO3,可知此时剩余的0.25mol二氧化碳继续和碳酸钠反应,生成了0.5mol的碳酸氢钠,消耗了0.25mol碳酸钠 故最后剩余0.5mol碳酸氢钠,0.25mol碳酸钠1年前查看全部
- 将6.5g锌放入足量的稀硫酸中充分反应,得到80mL密度为1.25g/mL的溶液.试计算所得溶液中硫酸锌的物质的量浓度是
将6.5g锌放入足量的稀硫酸中充分反应,得到80mL密度为1.25g/mL的溶液.试计算所得溶液中硫酸锌的物质的量浓度是多少?
 yuccawy1年前1
yuccawy1年前1 -
 carme 共回答了16个问题
carme 共回答了16个问题 |采纳率87.5%解题思路:先根据题意判断锌完全反应,结合反应方程式求出硫酸锌的物质的量,再根据物质的量浓度公式计算硫酸锌的物质的量浓度.根据题意知,锌完全反应,稀硫酸过量,以锌为标准计算硫酸锌的物质的量,
Zn+H2SO4 =ZnSO4 +H2 ↑
1 1
[6.5g/65g/mol]=0.1mol 0.1mol
C=[n/V]=[0.1mol/0.08L]=1.25mol/L
故答案为:1.25mol/L点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查的是有关物质的量浓度的计算,排除”溶液密度“的干扰是解本题的关键.1年前查看全部
- 用60%和20%的两种氢氧化钠溶液来配置30%的氢氧化钠溶液160g.计算所需60%氢氧化钠和20%氢氧化钠质量各多少
 一日看尽天牙花1年前2
一日看尽天牙花1年前2 -
 前锋阿福 共回答了16个问题
前锋阿福 共回答了16个问题 |采纳率93.8%设加入20%的两种氢氧化钠溶液X克
则加入60%的两种氢氧化钠溶液160-X克
X*20%+(160-X)*60%=160*30%
X=120克
所需60%氢氧化钠和20%氢氧化钠质量分别是160-120=40克和120克1年前查看全部
- 将6.5g锌放入足量的稀硫酸中充分反应,得到80mL密度为1.25g/mL的溶液.试计算所得溶液中硫酸锌的物质的量浓度是
将6.5g锌放入足量的稀硫酸中充分反应,得到80mL密度为1.25g/mL的溶液.试计算所得溶液中硫酸锌的物质的量浓度是多少?
 水土121年前1
水土121年前1 -
 z5l5a5 共回答了29个问题
z5l5a5 共回答了29个问题 |采纳率89.7%解题思路:先根据题意判断锌完全反应,结合反应方程式求出硫酸锌的物质的量,再根据物质的量浓度公式计算硫酸锌的物质的量浓度.根据题意知,锌完全反应,稀硫酸过量,以锌为标准计算硫酸锌的物质的量, Zn+H2SO4 =ZnSO4 +H2 ↑ 1 ...
点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查的是有关物质的量浓度的计算,排除”溶液密度“的干扰是解本题的关键.1年前查看全部
- 往5g盐酸中加入8g15%的氢氧化钠溶液,溶液呈碱性;再加入5g9.8%的稀硫酸,恰好把过量的碱完全中和,计算所用盐酸的
往5g盐酸中加入8g15%的氢氧化钠溶液,溶液呈碱性;再加入5g9.8%的稀硫酸,恰好把过量的碱完全中和,计算所用盐酸的溶质质量分数.
 沈阳小米锅巴1年前1
沈阳小米锅巴1年前1 -
 偶nn的怕谁 共回答了18个问题
偶nn的怕谁 共回答了18个问题 |采纳率94.4%解题思路:①根据氢氧化钠与硫酸反应的化学方程式和已知的硫酸的质量,即可计算出和H2SO4反应的NaOH的质量;然后根据“NaOH的总质量-和H2SO4反应的NaOH的质量”计算出与盐酸反应的NaOH的质量;②根据氢氧化钠与盐酸反应的化学方程式和与盐酸反应的NaOH的质量,即可计算出参与反应的HCl的质量(即所用盐酸的溶质质量),然后根据溶质质量分数公式计算即可.①设和H2SO4反应的NaOH的质量为x,
H2SO4+2NaOH=Na2SO4+2H2O
98 80
5g×9.8% x
∴[98/80=
5g×9.8%
x]
解之得:x=0.4g,
则与盐酸反应的NaOH的质量为:8g×15%-0.4g=0.8g;
②设参与反应的HCl的质量为y,
NaOH+HCl=NaCl+H2O
40 36.5
0.8g y
∴[40/36.5=
0.8g
y]
解之得:y=0.73g,
所用盐酸的溶质质量分数为:
0.73g
5g×100%=14.6%.
答:所用盐酸的溶质质量分数为14.6%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 本题主要考查学生运用化学方程式和溶质的质量分数公式进行计算的能力.1年前查看全部
- 是实验室需要0.1mol每升的氢氧化钠溶液100mL,现有2MOL每升氢氧化钠溶液. 计算所需2M
是实验室需要0.1mol每升的氢氧化钠溶液100mL,现有2MOL每升氢氧化钠溶液. 计算所需2M
是实验室需要0.1mol每升的氢氧化钠溶液100mL,现有2MOL每升氢氧化钠溶液.
计算所需2MOL每升氢氧化钠的体积.(2)完全中和5MOL每升的硫酸体积是多少?
 yeting6001年前1
yeting6001年前1 -
 眉清目扬 共回答了14个问题
眉清目扬 共回答了14个问题 |采纳率85.7%(1)0.1molL*0.1L=0.01mol
0.01mol除以2mol/L=0.005L=5ml
(2)1mol硫酸需要2molNaOH
可以中和硫酸物质的量0.01mol除以2=0.005mol
0.005mol除以5mol/L=0.001L=1ml1年前查看全部
- 用60%和20%的两种氢氧化钠溶液来配置35%的氢氧化钠溶液160g计算所需60%氢氧化钠溶液和20%氢氧化钠溶液质量
用60%和20%的两种氢氧化钠溶液来配置35%的氢氧化钠溶液160g计算所需60%氢氧化钠溶液和20%氢氧化钠溶液质量
各多少g liu787781年前1
liu787781年前1 -
 LucDo 共回答了23个问题
LucDo 共回答了23个问题 |采纳率91.3%60.15
.35
20.25
3:5
60g60%
100g20%1年前查看全部
- 用式子表示十位上的数是a,个位上的数是b的两位数,再把这两位数的位置调换,计算所得数与原数的和.这个数能被11整除吗?
 princeton1年前1
princeton1年前1 -
 wdowdow 共回答了15个问题
wdowdow 共回答了15个问题 |采纳率100%ab +ba
=a*10 +b+b*10+a
=a*10+a+b*10+b
=a(10+1)+b(10+1)
=11*a+11*b
=11*(a+b)
因为有公因式11
所以能被11整除1年前查看全部
- 如果一种物质的杂质是可溶性的,杂质不反应,那么在计算所得溶液溶质的质量分数为?如果杂质不溶的公式
 心灵与心灵1年前1
心灵与心灵1年前1 -
 comawhite129 共回答了20个问题
comawhite129 共回答了20个问题 |采纳率95%如果你没有办法把杂质排除,那么计算时就会把它视为所求的溶质,换句话说,你在计算式把溶质算多一些,质量分数当然会偏高.1年前查看全部
- 标况下,将22.4L氯化氢气体溶于635.5ml的水中,所得盐酸的密度为1.12g/cm3,计算所得盐酸的溶物质的量浓度
 lodosswar1年前2
lodosswar1年前2 -
 nonfish 共回答了19个问题
nonfish 共回答了19个问题 |采纳率94.7%22.4L氯化氢气体 的物质的量 为 22.4L / (22.4L/mol)=1mol
22.4L氯化氢气体 的质量 为 1mol x 36.5 g/mol =36.5g
溶解后的溶液总质量为 :36.5+ 635.5 =672 g
其体积为 672g / (1.12g/cm3)= 600 cm3 =600 ml
则所得盐酸的溶物质的量浓度c= 1mol/ 600ml =1.67mol/L1年前查看全部
大家在问
- 1模仿纪伯伦的【浪之歌】或【雨之歌】400字,用第一人称
- 2that is ,the continuing existence of those animals and plant
- 3把体积1立方分米的正方体木块切割成体积是1立方厘米的小正方体,六个面都没有涂色
- 4我从哪边可以乘电梯下楼,用英语怎么说?
- 5小亮要去离家3.5km的公园晨练,他以4km/h的速度步行,后来又以9km/h的速度跑步走,结果用了40min到达公园,
- 6把高是45cm的圆柱按照3:2的比例截成两个小圆柱,截取后表面积比原来增加了32平方厘米,
- 7老师上课知识点很多,很难记下,课后复习有时看不懂自己写什么
- 8102795元的英文拼写
- 9用"一、二、三、四、五"这五个数字造个句子
- 10我县正在举办首届乡村旅游文化节请仿照示例为此活动写一则宣传标语示例相约秀美乡村体验农家风情
- 11男生比女生多27人,是女生的4倍.男生和女生各有多少人?
- 12如图,cb⊥ab , ∠CBA:∠CBD=5:1 则∠CBD=
- 13请问下大家知道关于春天的古诗有谁了解的告诉下哟,谢谢了{随机数q
- 14有这样的两位数,交换该数数码所得到的两个位数与原数的和是一个完全平方数.例如,29就是这样的两位数,因为29+92=12
- 15计算个人所得税王某当月取得工资收入9000元,当月个人承担住房公积金、基本养老保险金、医疗保险金、失业保险金共计1000

