钠和钾的合金在常温下是什么状态
 红尘02022-10-04 11:39:541条回答
红尘02022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 atrainof-angles 共回答了19个问题
atrainof-angles 共回答了19个问题 |采纳率100%- 化学结构是:4K-Na ;在常温状态下是液态(由于钠本身的熔点就比较低,在者合金的熔点比二者中最低的还要低,所以是液态);常用作核反应堆的导热剂注:熔点大概是0度以下
- 1年前
相关推荐
- 合金的结晶温度和纯金属的结晶温度?
 hisashiyoyo1年前1
hisashiyoyo1年前1 -
 qiwuliutqin 共回答了21个问题
qiwuliutqin 共回答了21个问题 |采纳率81%合金的熔点低于组成它的主体金属的熔点.
如铝硅合金(含硅质量分数为13.5%)的熔点为564℃,比纯铝或硅的熔点都低.(硅的熔点:1410℃,铝的熔点:660℃)1年前查看全部
- 焊条药皮中各合金元素的主要作用是什么
焊条药皮中各合金元素的主要作用是什么
主要有
Ti Ca Mg Mo Cr……
常见合金化元素
请高手指点下
是每样元素具体的作用 过客来哥1年前1
过客来哥1年前1 -
 娃哈哈pusm 共回答了21个问题
娃哈哈pusm 共回答了21个问题 |采纳率95.2%钛是以氧化钛或钛铁的形式加入,主要起造渣,脱氧,稳定电弧的作用.
钙以氟化钙或碳酸钙的成分加入,稳定电弧,气体保护,造渣.
铬的作用;渗合金,脱氧.
镍粉;渗合金,
硅铁锰铁;主要是渗合金和脱氧,其次是造 渣 .1年前查看全部
- 黄铜矿主要成分CuFeS2是合金还是盐
 STENT1年前1
STENT1年前1 -
 huangxiong635188 共回答了18个问题
huangxiong635188 共回答了18个问题 |采纳率77.8%CuFeS2是盐 ,是化合物,不是混合物.1年前查看全部
- 某学生用实验来研究导体的电阻跟导体的长度、横截面积和材料的关系.具体方法是把两根不同的合金丝A和B分别接到电压相同的电路
某学生用实验来研究导体的电阻跟导体的长度、横截面积和材料的关系.具体方法是把两根不同的合金丝A和B分别接到电压相同的电路中,并观察通过它们的电流强度IA和IB的大小.下列四个现象,能直接说明导体的电阻跟导体的长度有关的是( )
A. 当A和B分别为粗细相同的镍铬合金丝和锰铜丝,且A比B长时,IA<IB
B. 当A和B分别为长度相同的镍铬合金丝,且A比B粗时,IA>IB
C. 当A和B分别为粗细相同的镍铬合金丝,且A比B长时,IA<IB
D. 当A和B分别为粗细和长度都相同的镍铬合金丝和锰铜丝时,IA<IB cslzqqq1年前1
cslzqqq1年前1 -
 suqian555 共回答了27个问题
suqian555 共回答了27个问题 |采纳率96.3%解题思路:(1)导体的电阻的大小与导体的材料、导体的长度、导体的横截面积和导体的温度有关,故在研究其中任何一个影响因素时,应用控制变量的思维来考虑.
(2)电阻是导体对电流的一种阻碍作用,故在电压一定时,导体的电阻越大,通过其的电流会越小.A、当A和B分别为粗细相同的镍铬合金丝和锰铜丝,且A比B长,即此时所选择的材料不同,长度不同,故无法比较其电阻大小与导体长度的关系,故不符合题意;
B、当A和B分别为长度相同的镍铬合金丝,且A比B粗时,IA>IB;即说明此时导体的电阻与导体的横截面积有关,故不符合题意;
C、当A和B分别为粗细相同的镍铬合金丝,且A比B长时,IA<IB;即说明在材料和横截面积一定时,导体越长,其阻值越大,故通过其中的电流就越小,故正确;
D、当A和B分别为粗细和长度都相同的镍铬合金丝和锰铜丝时,IA<IB;即说明导体的电阻与导体的材料有关,故不符合题意.
故选C.点评:
本题考点: 影响电阻大小的因素.
考点点评: 知道影响电阻大小的因素,并能用控制变量的思维去分析和考虑实验时器材的选取是解决该题的关键.1年前查看全部
- 九年级物理-电热器的发热体所用的合金丝为什么应该是电阻大的?
九年级物理-电热器的发热体所用的合金丝为什么应该是电阻大的?
合金丝的电压为220V不变,根据Q=I^2Rt=U^2t/R,电压一定的情况下,要使电热器的热量越多,应该让电阻小,似乎与先前结论相矛盾.为什么? p661841年前5
p661841年前5 -
 空灵的生活 共回答了19个问题
空灵的生活 共回答了19个问题 |采纳率94.7%题目中的所提电阻是相对导线的电阻和电源内阻,根据Q=I^2Rt.发热体电阻小,则导线、电源内部的发热量相对增加.
Q=U^2t/R中的u是发热器上的电压,在电压不变的情况下,电阻小发热多.
一般实际应用中,电源、导线都有电阻,电压降等于电流乘以各自的电阻.负载电压等于电源的电动势-电源的内阻上的电压降-导线的电压降.
如果负载电阻小,电流大,实际电器的电压会降低.
电器上电阻为无穷大时发热功为0,电阻逐渐减少发热量在增加,当电器电阻增加到电源内阻+导线内阻时,电器的发热功最大,但效率最低,只有50%,另外50的功耗是导线和电源内阻消耗的.1年前查看全部
- 金属与非金属组成的具有金属特性的物质是合金吗?请举例。
 单翼天使-1年前2
单翼天使-1年前2 -
 新hh 共回答了77个问题
新hh 共回答了77个问题 |采纳率15.6%是1年前查看全部
- 我国第四套人民币硬币从1999年开始发行,一元币为钢芯镀镍(Ni),伍角币为钢芯镀铜合金,一角币为铝合金或不锈钢.
我国第四套人民币硬币从1999年开始发行,一元币为钢芯镀镍(Ni),伍角币为钢芯镀铜合金,一角币为铝合金或不锈钢.
(1)铸造以上硬币用到的材料都是______(填“非金属材料”或“金属材料”).
(2)以上硬币中涉及到Fe、Cu、Al、Ni(镍),已知镍能够发生如下反应:Ni+H2SO4═NiSO4+H2↑Fe+NiCl2═Ni+FeCl2,四种金属的活动性有强到弱的顺序为______(用元素符号表示).
(3)铁制品易生锈,写出一种防止其生锈的方法:______. qq英语241年前1
qq英语241年前1 -
 lxslfree 共回答了21个问题
lxslfree 共回答了21个问题 |采纳率90.5%解题思路:根据已有的知识进行分析,硬币是金属材料制成的,在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,防锈就是破坏铁生锈的条件.(1)钢芯镀镍、钢芯镀铜、铝合金或不锈钢都是属于金属材料,故填:金属材料;
(2)已知在金属活动性顺序中Al>Fe>H>Cu,根据Ni+H2SO4═NiSO4+H2↑可知,Ni>H,根据Fe+NiCl2═Ni+FeCl2可知,Fe>Ni,故这四种金属的活动性顺序为Al>Fe>Ni>Cu,故填:
Al、Fe、Ni、Cu;
(3)铁在有水喝氧气并存时易生锈,防锈就是使铁与水货氧气隔绝,可以在铁制品表面喷漆,以防止生锈,故填:在铁制品表面喷漆.点评:
本题考点: 金属材料及其应用;金属活动性顺序及其应用;金属锈蚀的条件及其防护.
考点点评: 本题考查了金属的有关知识,完成此题,可以依据已有的金属的性质以及金属活动性顺序及其意义进行.1年前查看全部
- 下列关于合金的叙述,正确的是() A.非金属和金属之间也可以形成合金 B.合金的硬度可以比原金属更高,化
下列关于合金的叙述,正确的是() A.非金属和金属之间也可以形成合金 B.合金的硬度可以比原金属更高,化
下列关于合金的叙述,正确的是()
A.非金属和金属之间也可以形成合金
B.合金的硬度可以比原金属更高,化学性质也可能和原成分
C.合金的熔沸点一般比组成他们的各成分金属要高
D.合金的用途比纯金属的用途更广
下列关于合金的叙述,正确的是()
A.非金属和金属之间也可以形成合金
B.合金的硬度可以比原金属更高,化学性质也可能和原成分金属不同
C.合金的熔沸点一般比组成他们的各成分金属要高
D.合金的用途比纯金属的用途更广
本题为多选题 xx江1年前4
xx江1年前4 -
 aiyefh899 共回答了21个问题
aiyefh899 共回答了21个问题 |采纳率95.2%A对,比如说钢
D也对,因为合金在工业上的用途 比纯金属更广、更重要
B应该对,这个没找到解释1年前查看全部
- 将一定质量的镁、铝合金,投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加5mol/L NaOH溶
将一定质量的镁、铝合金,投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加5mol/L NaOH溶液,生成的沉淀质量与加入NaOH溶液体积如图所示,由图中数据分析计算:

①原合金中镁的质量为______g
②铝的质量为______g
③盐酸的物质的量浓度为______mol/L. webgame171731年前1
webgame171731年前1 -
 永茂皮草 共回答了19个问题
永茂皮草 共回答了19个问题 |采纳率89.5%解题思路:由图可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后盐酸有剩余,此时发生的反应为:HCl+NaOH=NaCl+H2O.
继续滴加NaOH溶液,到氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液.再继续滴加NaOH溶液,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,发生反应Al(OH)3+NaOH=NaAlO2+2H2O.
①由图可知,从加入20m氢氧化钠溶液L开始产生沉淀,加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,该阶段消耗氢氧化钠140mL,由氢氧根守恒可知3n[Al(OH)3]+2n[Mg(OH)2]=n(NaOH)=(0.16L-0.02L)×5mol/L=0.7mol.从加入氢氧化钠溶液160mL~180mL溶解氢氧化铝,该阶段发生反应Al(OH)3+NaOH=NaAlO2+2H2O,所以n[Al(OH)3]=(0.18L-0.16L)×5mol/L=0.1mol,代入上式计算n[Mg(OH)2],由元素守恒可知n(Mg)=n[Mg(OH)2],再利用m=nM计算Mg的质量;
②根据Al原子守恒有n(Al)=n[Al(OH)3],m=nM计算Al的质量;
③加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液,根据钠元素守恒此时溶液中n(NaCl)=n(NaOH),据此计算出n(HCl),再利用c=[n/V]计算盐酸的物质的量浓度.①由图可知,从加入20m氢氧化钠溶液L开始产生沉淀,加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,该阶段消耗氢氧化钠140mL,由氢氧根守恒可知3n[Al(OH)3]+2n[Mg(OH)2]=n(NaOH)=(0.16L-0.02L)×5mol/L=0.7mol.从加入氢氧化钠溶液160mL~180mL溶解氢氧化铝,该阶段发生反应Al(OH)3+NaOH=NaAlO2+2H2O,所以n[Al(OH)3]=(0.18L-0.16L)×5mol/L=0.1mol,故3×0.1mol+2n[Mg(OH)2]=0.7mol,解得n[Mg(OH)2]=0.2mol,由元素守恒可知n(Mg)=n[Mg(OH)2]=0.2mol,所以Mg的质量为0.2mol×24g/mol=4.8g,
故答案为:4.8g;
②由①计算可知,n(Al)=n[Al(OH)3]=(0.18L-0.16L)×5mol/L=0.1mol,故m(Al)=0.1mol×27g/mol=2.7g,
故答案为:2.7;
③加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液,根据钠元素守恒此时溶液中n(NaCl)=n(NaOH)=0.16L×5mol/L=0.8mol,根据氯元素守恒n(HCl)=0.8mol,故盐酸的物质的量浓度为[0.8mol/0.1L]=8mol/L,
故答案为:8.点评:
本题考点: 镁、铝的重要化合物;有关混合物反应的计算.
考点点评: 考查镁铝化合物性质、混合物的计算,以图象题的形式考查,题目难度中等,分析图象各阶段的发生的反应是解题关键,再利用守恒计算.1年前查看全部
- 姐姐,为什么合金的密度在两种物质的密度之间呢?
姐姐,为什么合金的密度在两种物质的密度之间呢?
还是我现在只用知道这一点就行了呢 花生苏1年前7
花生苏1年前7 -
 天仙真是你你你 共回答了12个问题
天仙真是你你你 共回答了12个问题 |采纳率100%你现在只要知道“合金的密度在两种物质的密度之间”就可以了.但你也可以了解以下知识.这些计算公式是可以利用密度公式推导出来的.
1、若甲、乙两种通过热熔混合均匀的固体(固体+固体)或两种液体简单地混合(不发生化学反应),且混合后的体积若可以看成是两体积之和,因此,混合物密度(平均密度)为:
(1) 混合物密度=(甲所占的体积分数×甲的密度)+(乙所占的体积分数×乙的密度)
ρ=[V1/(V1+V2)]×ρ1+[V2/(V1+V2)]×ρ2
(2) 混合物密度的倒数=(甲所占的质量分数×甲的密度的倒数)+(乙所占的质量分数×乙的密度的倒数)
1/ρ=[m1/(m1+m2)]×(1/ρ1)+[m2/(m1+m2)]×(1/ρ2)
2、合金的密度,一般可以采用方法(2)来求解.1年前查看全部
- 家用的不锈钢(铁的合金)汤勺,常在手柄上端加一木柄或塑料柄.说明铁具有的物理性质是( ) A.铁是电的良导体 B.铁是
家用的不锈钢(铁的合金)汤勺,常在手柄上端加一木柄或塑料柄.说明铁具有的物理性质是( ) A.铁是电的良导体 B.铁是热的良导体 C.铁在空气中容易生锈 D.铁的密度大  _h_vec4f5fw0d0c1年前1
_h_vec4f5fw0d0c1年前1 -
 vash1076 共回答了22个问题
vash1076 共回答了22个问题 |采纳率95.5%家用的不锈钢(铁的合金)汤勺,常在手柄上端加一木柄或塑料柄.说明铁是热的良导体,这是铁的物理性质.
故选B.1年前查看全部
- 我国第四套人民币硬币从1999年开始发行,一元币为钢芯镀镍(Ni),伍角币为钢芯镀铜合金,一角币为铝合金或不锈钢.
我国第四套人民币硬币从1999年开始发行,一元币为钢芯镀镍(Ni),伍角币为钢芯镀铜合金,一角币为铝合金或不锈钢.
(1)铸造以上硬币用到的材料都是______(填“合成材料”或“金属材料”)
(2)以上硬币中涉及Fe,Cu,Al,Ni(镍),已知Ni能够发生如下反应:
Ni+H2SO4═H2↑+NiSO4Fe+NiCl2═Ni+FeCl2
这两个反应的基本类型都是______.四种金属的活动性由强到弱的顺序为______(用元素符号表示). 左手1231年前1
左手1231年前1 -
 娃哈哈br2 共回答了19个问题
娃哈哈br2 共回答了19个问题 |采纳率89.5%解题思路:(1)依据硬币的组成成分分析材料的种类;
(2)根据金属活动性顺序的具体应用对金属的活动性进行分析,依据反应的反应物生成物种类判断反应的类型.(1)根据题干所知硬币的组成成分都是金属的合金,所以铸造以上硬币用到的材料都是金属材料;故填:金属材料;
(2)由金属活动性顺序的具体应用可知:活动性在氢前的金属可以与稀酸反应生成氢气,金属活动性强的金属可以把金属活动性比它弱的金属从其盐溶液中置换出来,所以据Ni+H2SO4═H2↑+NiSO4,Fe+NiCl2═Ni+FeCl2可知:Ni活动性在氢前且比铁弱,结合金属活动性顺序表可知四种金属的活动性顺序是:Al>Fe>Ni>Cu,从反应类型上看Ni+H2SO4═H2↑+NiSO4 ,Fe+NiCl2═Ni+FeCl2都是一种单质与一种化合物反应生成另一种单质与另一种化合物,故都是置换反应.
故答案为:置换反应;Al>Fe>Ni>Cu.点评:
本题考点: 金属材料及其应用;金属活动性顺序及其应用;反应类型的判定.
考点点评: 此题是一道与金属相关的考查题,解题的关键是充分理解和掌握金属活动性顺序表的意义以及其它相关的知识.1年前查看全部
- 向16g黄铜(由锌、铜形成的合金)样品中加入稀硫酸充分反应,所加稀硫酸与生成气体的质量关系如图所示,求:
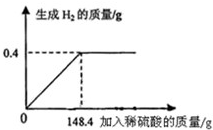 向16g黄铜(由锌、铜形成的合金)样品中加入稀硫酸充分反应,所加稀硫酸与生成气体的质量关系如图所示,求:
向16g黄铜(由锌、铜形成的合金)样品中加入稀硫酸充分反应,所加稀硫酸与生成气体的质量关系如图所示,求:
(1)样品中锌的质量分数.(保留一位小数)
(2)所用的稀硫酸中溶质的质量.
(3)恰好完全反应时,所得反应后溶液中溶质的质量分数. t3wbc1年前1
t3wbc1年前1 -
 **盼望 共回答了14个问题
**盼望 共回答了14个问题 |采纳率78.6%解题思路:本题涉及的反应Zn+H2SO4═ZnSO4+H2↑,图象为充分反应所生成氢气的质量随加入稀硫酸质量的变化情况.根据曲线可确定加入148.4g稀硫酸时与锌恰好完全反应放出0.4g氢气,运用化学方程式可求反应的硫酸的质量,由氢气质量计算参加反应锌的质量及生成硫酸锌的质量,最后由质量守恒定律计算反应后所得溶液质量,完成所得溶液中溶质的质量分数的计算.设样品中锌的质量为x,生成硫酸锌的质量为y.反应的硫酸的质量是z,由图分析可知产生氢气0.4g.
Zn+H2SO4═ZnSO4+H2↑
6598161 2
xzy 0.4g
[65/x=
98
z=
161
y=
2
0.4g]
x=13g y=32.2g z=19.6g
(1)样品中锌的质量分数为[13g/16g]×100%=81.25%
(2)所用的稀硫酸中溶质的质量为19.6g;
(3)恰好完全反应时,所得溶液中溶质的质量分数=[32.2g/13g+148.4g-0.4g]×100%=20%
答:(1)样品中锌的质量分数为81.25%;(2)所用的稀硫酸中溶质的质量为19.6g;(3)所得硫酸锌溶液中溶质的质量分数为20%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 解答此类问题的根本点在于对反应图象的曲线进行分析,曲线的折点表示此时恰好完全反应.1年前查看全部
- 某化学兴趣小组的同学为了测定某黄铜(Cu与Zn的合金)的组成,取10g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分
某化学兴趣小组的同学为了测定某黄铜(Cu与Zn的合金)的组成,取10g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应.每次所用稀硫酸的质量及剩余固体的质量记录于下表:
试回答下列问题:加入稀硫酸的质量(g) 充分反应后剩余固体的质量(g) 第1次 10 8.7 第2次 10 7.4 第3次 10 6.1 第4次 10 5.6 第5次 10 5.6
(1)黄铜样品中锌的质量分数为______.
(2)计算所用稀硫酸中硫酸的质量分数是多少? 征婚女一号1年前1
征婚女一号1年前1 -
 woceci 共回答了25个问题
woceci 共回答了25个问题 |采纳率80%解题思路:(1)根据第四次和第五次剩余固体质量相等可知,剩余的5.6g固体即为样品中铜的质量,故第4次实验结束时样品中的锌就已完全反应进行解答.
(2)根据金属活动性可知,铜排在氢后,不能与稀硫酸发生反应,故发生反应的是锌,减少的固体的质量就是参加反应的锌的质量,由题目可知:第1次反应消耗锌的质量=10g-8.7g=1.3g,根据反应的化学方程式,可计算出所加10g稀盐酸中溶质的质量,由溶质的质量分数公式,求出所用稀盐酸中溶质的质量分数;(1)根据第4次和第5次剩余固体质量相等可知,剩余的5.6g固体即为样品中铜的质量,所以样品中锌的质量为10g-5.6g=4.4g,故黄铜样品中锌的质量分数为[4.4g/10g]×100%=44%;
(2)根据金属活动性可知,铜排在氢后,不能与稀硫酸发生反应,故发生反应的是锌,减少的固体的质量就是参加反应的锌的质量,由题目可知:第1次反应消耗锌的质量=10g-8.7g=1.3g;
设参加反应的H2SO4质量为x
Zn+H2SO4=ZnSO4+H2↑
65 98
1.3g x
[65/1.3g=
98
x]
x=1.96g
则所用稀硫酸的溶质质量分数=[1.96g/10g]×100%=19.6%
故答案为:(1)44%;(2)答:反应后所得溶液中溶质的质量分数为19.6%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 计算所用稀硫酸的溶质质量分数时,一定要确保稀硫酸完全反应,此时计算出的硫酸的质量才是稀硫酸溶液中所含溶质的质量.1年前查看全部
- 有黄金cu-zn合金,和cu-Ag合金,取合金粉末是20克放烧杯中,架50克稀硫酸恰好完全反应,测烧杯中剩余物的质量为6
有黄金cu-zn合金,和cu-Ag合金,取合金粉末是20克放烧杯中,架50克稀硫酸恰好完全反应,测烧杯中剩余物的质量为69.8g 1、求产生氢气的质量 2、求该合金中铜的质量分数3、稀硫酸中、溶质的质量分数
 jokey_adam1年前1
jokey_adam1年前1 -
 一人听风 共回答了18个问题
一人听风 共回答了18个问题 |采纳率83.3%首先,质量守恒,氢气质量=20g+50g-69.8g-0.2g
Zn + H2SO4 = ZnSO4 + H2
65 98 2
x y 0.2g
65/x=98/y=2/0.2g
x=6.5g
y=9.8g
所以 1.氢气的质量0.2g
2.求该合金中铜的质量分数67.5%
3.稀硫酸中溶质的质量分数19.6%1年前查看全部
- 大多数的金属材料实际上是合金,请举出几个生活中的例子
大多数的金属材料实际上是合金,请举出几个生活中的例子
请问怎么进行判断呢? 人来_人往1年前3
人来_人往1年前3 -
 程为民 共回答了13个问题
程为民 共回答了13个问题 |采纳率84.6%比如最常用的不锈钢1Cr18Ni9Ti
青铜器是普通青铜,即铜锡合金
黄铜是铜锌合金
现在门窗是铝合金的1年前查看全部
- 1.将20克铁合金样品置于氧气流中灼烧,得到0.4g二氧化碳.求此合金样品中碳的质量分数.
1.将20克铁合金样品置于氧气流中灼烧,得到0.4g二氧化碳.求此合金样品中碳的质量分数.
2.若赤铁矿中氧化铁的质量分数为80%,600t这样的赤铁矿可以冶炼出含碳等其他质量分数为7%生铁多少吨?
3.有一生锈的铁钉(铁锈主要成分为氧化铁)质量为16g,加入足量盐酸充分反应后生成氢气0.4g.求未生锈前铁片的质量为多少? 钱包漏了1年前1
钱包漏了1年前1 -
 蔚蓝静海 共回答了18个问题
蔚蓝静海 共回答了18个问题 |采纳率94.4%碳的质量=0.4*12/44=0.11g
此合金样品中碳的质量分数=0.5%
(600*80%*112/160)/0.93%=361t
Fe + 2HCl = FeCl2 + H2
56 2
X 0.4
X=11.2g
氧化铁的质量=20-11.2=8.8克
未被氧化前的质量=8.8*112/160=6.16g
未生锈前铁片的质量=11.2+6.16=17.36g1年前查看全部
- (2014•孝感一模)黄铜是铜和锌的合金.向一定质量的黄铜样品中加入50g稀硫酸,恰好完全反应,产生0.2g氢气.
(2014•孝感一模)黄铜是铜和锌的合金.向一定质量的黄铜样品中加入50g稀硫酸,恰好完全反应,产生0.2g氢气.
(1)计算所用稀硫酸的溶质质量分数;
(2)除了可求出稀硫酸的溶质质量分数外,下列化学量中,你还能求出的化学量有______(填序号).
①合金中锌的质量②合金中铜的质量分数③合金中锌的质量分数
④生成硫酸锌的质量⑤硫酸溶液的体积⑥反应后溶液中溶质的质量分数. 小妖怪是我1年前1
小妖怪是我1年前1 -
 小酒窝waiting 共回答了14个问题
小酒窝waiting 共回答了14个问题 |采纳率85.7%解题思路:根据金属活动性强弱关系锌>氢>铜可知,把黄铜放入稀硫酸时,锌可与硫酸反应生成硫酸锌同时放出氢气;利用反应的化学方程式,由反应生成氢气的质量可计算消耗锌的质量、消耗硫酸的质量及生成硫酸锌的质量,然后利用硫酸质量与稀硫酸质量比还可计算出稀硫酸中硫酸的溶质质量分数;根据质量守恒定律,还可计算出反应后所得溶液的质量,因此还可计算反应后硫酸锌溶液的溶质质量分数.(1)设参加反应的硫酸的质量为x,
Zn+H2SO4=ZnSO4+H2↑
982
x 0.2g
[98/x=
2
0.2g]
x=9.8g
稀硫酸的质量分数为
9.8g
50g×100%=19.6%;
答:所用稀硫酸的溶质质量分数为19.6%;
(2)根据反应的化学方程式,还可以计算出锌的质量、硫酸锌的质量;但由于不知道黄铜的质量,因此不能计算出黄铜中铜的质量分数、锌的质量分数;由于不知道硫酸溶液的密度,因此也不能把硫酸溶液的质量转变为体积;根据质量守恒定律,反应后溶液质量可由参加反应锌的质量+所加稀硫酸的质量-放出氢气的质量而计算出来,因此,还可以计算出所加稀硫酸的溶质质量分数;
故答案为:①④⑥.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 反应的化学方程式可以表现出反应中各物质的质量关系,因此,利用反应的化学方程式可由反应中任一物质质量计算出反应中其它物质的质量.1年前查看全部
- 某化学兴趣小组为了测定镁铜合金中镁的质量分数,取出3g合金样品,将60g稀硫酸分6次加入样品中,充分反应后过滤、洗涤、干
某化学兴趣小组为了测定镁铜合金中镁的质量分数,取出3g合金样品,将60g稀硫酸分6次加入样品中,充分反应后过滤、洗涤、干燥、称重,得到的实验数据如下:
(1)测定过程中发生反应的化学方程式为______;稀硫酸用量 剩余固体质量 第一次加入10g mg 第二次加入10g 2.0g 第三次加入10g 1.5g 第四次加入10g 1.0g 第五次加入10g 0.6g 第六次加入10g 0.6g
(2)从以上数据可知,最后剩余的0.6g固体的成分是______;这六次实验中,第______次加入稀硫酸时样品中的镁已经完全反应;表格中,m=______.
(3)计算合金样品中镁的质量分数.
(4)计算所用稀硫酸中H2SO4的质量分数. 燕山落雪1年前1
燕山落雪1年前1 -
 冰雨虫 共回答了21个问题
冰雨虫 共回答了21个问题 |采纳率81%解题思路:在金属活动顺序表中镁排在氢前面,而铜排在氢后面,所以将合金放入硫酸中,镁与硫酸反应,而铜与硫酸不反应.由表格中所给数据可得第五次反应后,镁全部反应完,剩余的全部是铜,从而可以得出合金样品中镁的质量分数;根据前四次中任意一次消耗金属的质量计算稀硫酸中溶质的质量,然后根据公式求出溶质质量分数.镁能与硫酸反应,而铜与硫酸不反应,所以我们可以得到当把合金放入硫酸中镁反应质量减少,减少的部分为反应的镁的质量.由表格中所给的数据可知每加入10g硫酸,合金减少0.5g,而在第五次时只减少了0.4g,所以在第五次时镁完全反应,剩余的0.6g为铜的质量.所以3g合金中镁的质量为2.4g.根据表格信息可以看出每消耗10克稀硫酸,就有0.5克金属镁参加反应,进而可以根据镁的质量求出稀硫酸中所含溶质的质量.
故答案为:(1)Mg+H2SO4=MgSO4+H2↑;
(2)铜、五、2.5;
(3)由表格数据分析可知,0.6g为铜的质量,所以3g合金中镁的质量为2.4g;
合金样品中镁的质量分数为:[2.4g/3g]×100%=80%.
(4)设10克稀硫酸中所含H2SO4的质量为x.
Mg+H2SO4=MgSO4+H2↑
24 98
0.5g x
[24/0.5g=
98
x]
x=2.04g
稀硫酸的溶质质量分数=
2.04g
10g×100%=20.4%.点评:
本题考点: 金属的化学性质;实验数据处理或者误差分析的探究;金属活动性顺序及其应用.
考点点评: 表格题关键是能够通过图中所给的数据,分析出完全反应的点,同时由表格中的数据得到想要的信息,学会分析表格是关键.1年前查看全部
- 有一种“马踏飞燕”工艺制作品采用 密度为8.0×10³kg/m³的合金材料铸造而成,测出该工艺品的体
有一种“马踏飞燕”工艺制作品采用 密度为8.0×10³kg/m³的合金材料铸造而成,测出该工艺品的体积
如题, donghang1年前1
donghang1年前1 -
 443988535 共回答了17个问题
443988535 共回答了17个问题 |采纳率100%如果该工艺品为实心的话,可以测出它的质量m,然后用质量除以密度就可以得出它的体积.1年前查看全部
- 下列说法正确的是( ) A.日常使用的金属材料大多数是合金 B.温度越高物质的溶解度越大 C.有水生成的反应就是中和反
下列说法正确的是( ) A.日常使用的金属材料大多数是合金 B.温度越高物质的溶解度越大 C.有水生成的反应就是中和反应 D.催化剂在化学反应中质量和性质不变  娃哈哈vpbu1年前1
娃哈哈vpbu1年前1 -
 askzr 共回答了19个问题
askzr 共回答了19个问题 |采纳率94.7%A、大多数纯金属性质活泼且性能单一,故日常使用的金属材料大多数是合金,故正确;
B、绝大多数固体物质的溶解度随温度的升高而升高,而气体和氢氧化钙的溶解度随温度的升高而降低,故错误;
C、酸与碱反应生成盐和水的反应是中和反应,故错误;
D、催化剂在化学反应中质量和化学性质不变,故错误;
故选A.1年前查看全部
- 一些金属或合金当达到某一温度时,电阻会变为零,这种现象称为“超导”,能够发生超导现象的物质叫超导体,请你想想下列哪个事例
一些金属或合金当达到某一温度时,电阻会变为零,这种现象称为“超导”,能够发生超导现象的物质叫超导体,请你想想下列哪个事例不是利用超导体的( ) A.可用于输电线路降低输电损耗 B.研制成磁悬浮列车 C.装配成功率大、高效率的发电设备和电动机 D.制成大功率的电炉  峰雨楼刺猬1年前1
峰雨楼刺猬1年前1 -
 kdjexpma 共回答了15个问题
kdjexpma 共回答了15个问题 |采纳率86.7%超导体电阻为零,可减少电能损耗,不产生热量,因此凡是利用热量的地方是不能用超导体的,电炉是利用电产生热量的电器,故不能用超导体.故选D.1年前查看全部
- 物理 密度推导题有甲乙两种密度分别为P1,P2的两种金属合成一块密度为P,边长为a的正方体 求合金中两金属的质量要过程
 左新文1年前1
左新文1年前1 -
 laoyangming 共回答了24个问题
laoyangming 共回答了24个问题 |采纳率91.7%首先合金密度P=M/V
设金属1体积V1则金属2体积V-V1
金属1质量P1V1金属2质量P2(V-V1)
则P1V1+P2(V-V1)=M解得V1=(M-P2V)/(P1-P2)金属2体积=V-V1=(P1V-M)/(P1-P2)
质量比=P1V1:P2*(P1V-M)/(P1-P2)=P1(M-P2V):P2(P1V-M)
【中学物理导航】团队您解答1年前查看全部
- 在一块含有铅97千克,铁152千克的合金中,增加多少千克的铅,可使铁与铅的比为4:3?
 se_ami_sai1年前4
se_ami_sai1年前4 -
 锦江上空的鹰 共回答了21个问题
锦江上空的鹰 共回答了21个问题 |采纳率95.2%解题思路:此题可以用比例的方法解答.设增加x千克的铅,可使铁与铅的比为4:3,由题意列出比例为:152:(97+x)=4:3,解这个比例即可.增加x千克的铅,由题意得:
152:(97+x)=4:3,
4×(97+x)=152×3,
388+4x=456,
4x=68,
x=17.
答:增加17千克的铅,可使铁与铅的比为4:3.点评:
本题考点: 比的应用.
考点点评: 此题考查了学生列比例解比例的能力.1年前查看全部
- 奥氏体区扩大合金元素有哪些?扩扩大奥氏体区的原理是什么,是不是强碳化物形成元素如Cr w v就可以扩大奥
奥氏体区扩大合金元素有哪些?扩扩大奥氏体区的原理是什么,是不是强碳化物形成元素如Cr w v就可以扩大奥
碳化物形成元素扩大奥氏体区还是非碳化物形成元素扩大奥区,扩到奥区的机理是什么,强碳化物形成元素是不是增大奥氏体的稳定性而扩大奥区 真正的十三贝勒1年前1
真正的十三贝勒1年前1 -
 shuang117 共回答了14个问题
shuang117 共回答了14个问题 |采纳率92.9%Ni、Mn、Co、C、N、Cu都是奥氏体区扩大元素,具体原理每种合金元素都不一样,最好查固态相变手册,或合金钢手册之类的工具书.1年前查看全部
- 小学数学网-一种铜铝合金重 75克 ,其中铜与铝的重量之比为8:7,这种合金中铝有(
 新兴购物商城1年前4
新兴购物商城1年前4 -
 accountin35 共回答了12个问题
accountin35 共回答了12个问题 |采纳率91.7%铜40克,铝35克.
铜的重量=75×8/15
铝的重量=75×7/151年前查看全部
- 向16g黄铜(由锌、铜形成的合金)样品中加入稀硫酸充分反应,所加稀硫酸与生成气体的质量关系如图所示,求:
向16g黄铜(由锌、铜形成的合金)样品中加入稀硫酸充分反应,所加稀硫酸与生成气体的质量关系如图所示,求:

(1)样品中锌的质量分数.(保留一位小数)
(2)所用的稀硫酸中溶质的质量.
(3)恰好完全反应时,所得反应后溶液中溶质的质量分数. 1jxw1年前1
1jxw1年前1 -
 xysth 共回答了23个问题
xysth 共回答了23个问题 |采纳率87%解题思路:本题涉及的反应Zn+H2SO4═ZnSO4+H2↑,图象为充分反应所生成氢气的质量随加入稀硫酸质量的变化情况.根据曲线可确定加入148.4g稀硫酸时与锌恰好完全反应放出0.4g氢气,运用化学方程式可求反应的硫酸的质量,由氢气质量计算参加反应锌的质量及生成硫酸锌的质量,最后由质量守恒定律计算反应后所得溶液质量,完成所得溶液中溶质的质量分数的计算.设样品中锌的质量为x,生成硫酸锌的质量为y.反应的硫酸的质量是z,由图分析可知产生氢气0.4g.
Zn+H2SO4═ZnSO4+H2↑
6598161 2
xzy 0.4g
[65/x=
98
z=
161
y=
2
0.4g]
x=13g y=32.2g z=19.6g
(1)样品中锌的质量分数为[13g/16g]×100%=81.25%
(2)所用的稀硫酸中溶质的质量为19.6g;
(3)恰好完全反应时,所得溶液中溶质的质量分数=[32.2g/13g+148.4g-0.4g]×100%=20%
答:(1)样品中锌的质量分数为81.25%;(2)所用的稀硫酸中溶质的质量为19.6g;(3)所得硫酸锌溶液中溶质的质量分数为20%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 解答此类问题的根本点在于对反应图象的曲线进行分析,曲线的折点表示此时恰好完全反应.1年前查看全部
- 为什么合金与纯金属的性能有很大的差异
 歌特o1年前1
歌特o1年前1 -
 最爱吃粉 共回答了10个问题
最爱吃粉 共回答了10个问题 |采纳率90%在纯金属内,原子的排列十分规整,而合金内由于加入了其他元素的原子,使得原子层之间的相对滑动变得困难,因而性能发生了改变.1年前查看全部
- 有两块锌铜合金的质量分别为10千克、15千克,这两块合金的含铜的质量分数不同,现分别从这两块合金中各切下一块质量相同的合
有两块锌铜合金的质量分别为10千克、15千克,这两块合金的含铜的质量分数不同,现分别从这两块合金中各切下一块质量相同的合金,交换后分别与另一块合在一起熔化,冷却后测得这两块合金含铜的质量分数相同,求切下的一块合金的质量.
 twp19811年前1
twp19811年前1 -
 瑞津zzww 共回答了14个问题
瑞津zzww 共回答了14个问题 |采纳率92.9%解题思路:设切下的一块重量是x千克,设10千克和15千克的合金的含铜的质量分数为a,b,则交换后第一块合金含铜的质量为(10-x)a+xb,第二块合金含铜量为(15-x)b+xa,根据交换后两块合金含铜的质量分数相同,可得出方程,解出即可.设切下的一块重量是x千克,设10千克和15千克的合金的含铜的百分比为a,b,
则交换后第一块合金含铜的质量为(10-x)a+xb,第二块合金含铜量为(15-x)b+xa,
由题意得:
(10−x)a+xb
10=
(15−x)b+xa
15,
整理得:(b-a)x=6(b-a),
解得:x=6.
答:切下的一块合金的质量为6千克.点评:
本题考点: 一元一次方程的应用.
考点点评: 此题主要考查了用一元一次方程解决实际问题,根据熔炼后两者含铜的百分比恰好相等得到相应的等量关系是解决本题的关键,注意一些必须的量没有时,应设其未知数,在解答过程中消去无关未知数.1年前查看全部
- 光谱分析法如何检测合金中某金属成分?
光谱分析法如何检测合金中某金属成分?
光谱分析法如何检测合金中某金属成分,例如Cr、Ni?
希望能写明具体原理.
ps.能说一下电镜扫描的方法么? firefox3151年前3
firefox3151年前3 -
 有事也逛逛 共回答了14个问题
有事也逛逛 共回答了14个问题 |采纳率85.7%应当是查PDF卡片,就能发现相应金属的衍射峰的波长来判断金属成分.现在都软件化了,你在用仪器测试过程电脑就能帮你分析出元素.
光谱分析,是X射线照射金属原子,激发出二次X射线,不同元素激发的射线波长不一样,从而分析元素存在.
你用Jade5.0,分析就可以了
电镜是利用电子来对材料进行形貌和相的鉴定.扫描电镜是利用反射和衍射电子,而透射电镜是利用透射电子.1年前查看全部
- 金属材料包括纯金属以及它们的合金,在生产、生活和社会发展中起着非常重要的作用.
金属材料包括纯金属以及它们的合金,在生产、生活和社会发展中起着非常重要的作用.
(1)某校同学以“比较锰、铁、铜3种金属的活动性”为课题进行探究.
提供的药品:铁片、铜片、锰片、稀盐酸、硫酸亚铁溶液、硫酸铜溶液、硫酸锰溶液.
【作出猜想】他们考虑到铁的活动性比铜强,对3种金属的活动性顺序作出如下猜想.
猜想一:______;
猜想二:铁>铜>锰;
猜想三:铁>锰>铜.
【设计实验】为了验证猜想成立,同学们分成三组,分别针对一种猜想设计实验方案:
①第一组验证猜想一.实验方案是将锰片、铁片分别放入稀盐酸中,观察现象;
②第二组验证猜想二.实验方案是将锰片放入______中,观察现象;
③第三组验证猜想三.实验方案是(只用两个实验):______.
【实验及结论】各组通过实验和交流,确认猜想一是正确的.第一组同学的实验现象是:______.
(2)铜与锌的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.某化学兴趣小组的同学为了测定某种黄铜的组成,取20g该黄铜样品于烧杯中,向其中分5次加入同一种稀硫酸,并将每次加入稀硫酸的质量和充分反应后剩余固体的质量记录于下表:
①表格中m=______;加入稀硫酸的质量(g) 充分反应后剩余固体的质量(g) 第1次 20 17.4 第2次 20 14.8 第3次 20 12.2 第4次 20 12.0 第5次 20 m
②黄铜样品中锌的质量分数为______. 水沐霂1年前1
水沐霂1年前1 -
 lgsghd 共回答了21个问题
lgsghd 共回答了21个问题 |采纳率95.2%解题思路:本题考查金属的活动性顺序,要证明一种金属比另一种金属活泼,只要把一种金属放入另一种金属的盐溶液中,观察现象即可.对于实验设计方案的评价,要看能不能达到实验目的;可以根据化学方程式的计算求黄铜样品中锌的质量分数.(1)【作出猜想】比较锰、铁、铜3种金属的活动性,猜想二和三都是铁在锰的前面,因此猜想一是:锰>铁>铜,故答案为:锰>铁>铜(写“Mn>Fe>Cu”亦可)
【设计实验】验证锰和铜的活动性顺序,只要把锰片放入硫酸铜溶液中即可,故答案为:②硫酸铜溶液(写“CuSO4溶液”亦可)
③要验证铁>锰>铜,只要把锰片分别放入硫酸亚铁溶液和硫酸铜溶液中即可,本题开放性比较强,答案不唯一.故答案为:将两片锰分别放入硫酸亚铁溶液和硫酸铜溶液中,观察现象(或将铁片和铜片分别放入硫酸锰溶液中,观察现象;或将铁片放入硫酸锰溶液中、锰片放入硫酸铜溶液中,观察现象;或将锰片放入硫酸亚铁溶液中、铜片放入硫酸锰溶液中,观察现象)
【实验及结论】第一组同学的实验方案是将锰片、铁片分别放入稀盐酸中,实验现象是:都有气泡产生,锰片的反应比铁片的反应剧烈.故答案为:都有气泡产生,锰片的反应比铁片的反应剧烈
(2)根据题目信息和表格给出的数据分析,第4次加入硫酸时,锌已经充分反应,因此m=12g.故答案为:①12.0(写“12”亦可)
②根据表格数据可知:铜的质量是12g,锌的质量=20g-12g=8g,[8g/20g]×100%=40%
故答案为:40%点评:
本题考点: 金属活动性的探究;根据化学反应方程式的计算.
考点点评: 有关实验方案的设计和对实验方案的评价是中考的热点之一,设计实验方案时,要注意用最少的药品和最简单的方法;关于对实验设计方案的评价,要在两个方面考虑,一是方案是否可行,能否达到实验目的;二是设计的方法进行比较,那种方法更简便.1年前查看全部
- 比理解应用题有一块铜锌合金,其中铜与锌的比是2:3,现在加入锌6克,共得到新合金36克,求在新合金中铜与锌的比.
 tyjyag1年前2
tyjyag1年前2 -
 freetsinghua 共回答了23个问题
freetsinghua 共回答了23个问题 |采纳率87%2:3,现在加入锌6克,共得到新合金36克,
求在新合金中铜与锌的比.
[(36-6)*2/5]:[(36-6)*3/5+6]=1:2
在新合金中铜与锌的比1:2.1年前查看全部
- 现有铁,碳两种元素组成的合金.现有铁、碳两种元素组成的合金,某实验小组为了 研究该合金的性质并测定该合金中碳的质量分数,
现有铁,碳两种元素组成的合金.
现有铁、碳两种元素组成的合金,某实验小组为了 研究该合金的性质并测定该合金中碳的质量分数,设计了如下实验方案和实验装置:
I.探究该合金的某些性质:,并加入足量浓H2SO4,A 、 B中均无明显现象,原因是________________________________
(2) 点燃酒精灯一段时间后,A中剧烈反应,请写出A中反应的化学方程式________________________________________
(3) 反应一段时间后,B中的现象为________________________________
II.测定样品中碳的质量分数.C的作用________________;装置D的作用________________
(5) 反应结束后,若U型管E增重mg,则合金中碳的质量分数为________ ________ (用含m和的式子表示). kermit11211年前1
kermit11211年前1 -
 不小心走火 共回答了18个问题
不小心走火 共回答了18个问题 |采纳率88.9%1.碳不与浓硫酸反应,铁在浓硫酸中的时候会在表面生成氧化膜阻止反应进行,也就是说铁会钝化
2.2Fe+3H2SO4(浓)=Fe2(SO4)3+3H2 有加热符号,氢气那有气体符号.
3.B中午现象,其余的无图无真相……1年前查看全部
- 有三种合金,按重量计算,甲种合金含金5份、银2份.铝1份,乙种合金含金2份、银5份、铝1份,
有三种合金,按重量计算,甲种合金含金5份、银2份.铝1份,乙种合金含金2份、银5份、铝1份,
丙种合金含金3份、银1份、铝4份.现在要用以上这三种合金熔炼成一种新的合金,使其中含金/银/铝的重量相等,如果熔炼这种新合金540克,那么需要甲乙丙三种合金各多少克? costore1年前1
costore1年前1 -
 天山游牧 共回答了15个问题
天山游牧 共回答了15个问题 |采纳率93.3%三种加起来的比为,甲:乙:丙=10:8:6,所以甲乙丙分别得:225g,180g,135g
希望对你能有所帮助.1年前查看全部
- 有比铜导电性好的合金吗?俺说的是合金!
 文己齐舞1年前1
文己齐舞1年前1 -
 dudugraphy 共回答了25个问题
dudugraphy 共回答了25个问题 |采纳率92%银比铜好,金也是,加点元素就叫合金.
少加点对导电率影响又不大
铝合金这个肯定是比铜差的,这个不用多说1年前查看全部
- 有一个质量为232g的铜铝合金球,其中含铝54g,求合金的密度为多少?(已知铜的密度为ρ铜=8.9g/cm3,铝的密度为
有一个质量为232g的铜铝合金球,其中含铝54g,求合金的密度为多少?(已知铜的密度为ρ铜=8.9g/cm3,铝的密度为ρ铝=2.7g/cm3)
 人生DIY1年前1
人生DIY1年前1 -
 yuelanfeng1981 共回答了8个问题
yuelanfeng1981 共回答了8个问题 |采纳率75%解题思路:已知合金球和铝的质量,可求铜的质量,根据密度公式可求铜和铝的体积,再求出总体积,总质量除以总体积就是合金球的密度.铜的质量m铜=m总-m铝=232g-54g=178g,
∵ρ=[m/V],
∴铜的体积为V铜=
m铜
ρ铜=[178g
8.9g/cm3=20cm3,
铝的体积为V铝=
m铝
ρ铝=
54g
2.7g/cm3=20cm3,
所以铜铝合金球的体积为V=V铝+V铜=20cm3+20cm3=40cm3,
合金球的密度ρ=
m总/V]=
232g
40cm3=5.8g/cm3.
答:合金球的密度为5.8g/cm3.点评:
本题考点: 密度的计算.
考点点评: 本题考查质量、体积、密度的计算,关键是公式及其变形的灵活运用,重点是求铜和铝的体积.1年前查看全部
- 关于合金性质的说法中,错误的是( )
关于合金性质的说法中,错误的是( )
A. 多数合金的硬度一般比其各成分金属的硬度高
B. 多数合金的熔点一般比其各成分金属的熔点低
C. 合金的物理性质一般与其各成分金属的物理性质不同
D. 合金的化学性质一般与其各成分金属的化学性质不同 yefeng5271年前3
yefeng5271年前3 -
 天门一啸 共回答了21个问题
天门一啸 共回答了21个问题 |采纳率90.5%解题思路:A.合金的硬度比组成它的各成分的硬度都大;
B.合金的熔点比组成它的各成分的熔点都低;
C.合金与各成分金属相比硬度大熔点低;
D.合金的化学性质一般与各成分金属的相同.A.合金的硬度一般比其各成分金属的硬度高,故A错误;
B.合金的熔点一般比其各成分金属的熔点低,故B错误;
C.合金的物理性质一般与其各成分金属的物理性质不同,如合金与各成分金属相比硬度大熔点低,故C错误;
D.合金的化学性质一般与各成分金属的化学性质相同,故D正确.
故选D.点评:
本题考点: 金属与合金在性能上的主要差异.
考点点评: 本题考查合金的性质,难度不大,掌握合金的化学性质一般与各成分金属的化学性质相同是解题的关键.1年前查看全部
- 一块合金含铜与锌的比是3:4,用此合金造成铜与锌之比为1:2的新合金378克,需要加()()克
 zhixin_0071年前1
zhixin_0071年前1 -
 llz_蓝天 共回答了24个问题
llz_蓝天 共回答了24个问题 |采纳率79.2%378÷(2+1)=126(克) 126×2=252(克) 126÷3×4=168(克) 需要加锌:252-168=84(克)1年前查看全部
- 如图所示,P为一块均匀的半圆形合金薄片电阻,先将它按图甲的方式接在电极A,B之间,测得它的电阻为R,
如图所示,P为一块均匀的半圆形合金薄片电阻,先将它按图甲的方式接在电极A,B之间,测得它的电阻为R,
然后将他按图乙的方式接在电极C,D之间,则此时P的电阻(C,D)间的电阻为
4R,为什么,快

 砂石山1年前3
砂石山1年前3 -
 peter0203115 共回答了14个问题
peter0203115 共回答了14个问题 |采纳率100%电阻和长度成正比,横截面积成反比,看图,长度变成两倍了,横截面积变成二分之一了,所以电阻就四倍了1年前查看全部
- 用质量为m1,密度为p1的金属甲和质量为m2,密度为p2的金属乙制成质量为(m1+m2)的合金球,则合金球中甲,乙两种金
用质量为m1,密度为p1的金属甲和质量为m2,密度为p2的金属乙制成质量为(m1+m2)的合金球,则合金球中甲,乙两种金属各占的体积之比为多少?
 wkxfm1年前1
wkxfm1年前1 -
 xinbenhao 共回答了16个问题
xinbenhao 共回答了16个问题 |采纳率93.8%金属甲的体积V1=m1/ρ1,金属乙的体积V2=m2/ρ2
合金球中甲、乙两种金属各占的体积之比=V1:V2=m1/ρ1:m2/ρ2=m1ρ2/m2ρ1
答:合金球中甲、乙两种金属各占的体积之比为m1ρ2/m2ρ1.1年前查看全部
- 甲乙两块合金的质量比是:8:7,甲合金中铜与锌的质量比是5:3,乙合金中铜与锌的质量比是9:5现将两块合金熔成一块,新合
甲乙两块合金的质量比是:8:7,甲合金中铜与锌的质量比是5:3,乙合金中铜与锌的质量比是9:5现将两块合金熔成一块,新合金中铜与锌的比是______.
 蓝梦冰橙1年前2
蓝梦冰橙1年前2 -
 kittyxin1130 共回答了23个问题
kittyxin1130 共回答了23个问题 |采纳率87%解题思路:把甲的质量看作单位“1”,则乙的质量为甲的[7/8],那么在甲中,铜就是[5/8],锌就是[3/8];再把乙的质量看作单位“1”,那么在乙中,铜就是甲的质量的[7/8]×[9/14],锌就是甲的质量的[7/8]×[5/14];两块合在一起之后,每块合金中铜与锌的质量是不会变的,那么铜的质量就是两块中铜的质量相加得到的:([5/8]+[7/8]×[9/14]),锌是([3/8]+[7/8]×[5/14]),从而可以求新合金中铜和锌的比.5+3=8,9+5=14,
([5/8]+[7/8]×[9/14]):([3/8]+[7/8]×[5/14]),
=[19/16]:[11/16],
=19:11;
答:新合金中铜与锌的比是19:11.
故答案为:19:11.点评:
本题考点: 比的应用.
考点点评: 解答此题的关键是设出不同的单位“1”,将每块合金中的铜和锌的含量用甲的质量表示出来,从而问题得解.1年前查看全部
- 铁的合金60g在氧气中充分燃烧产生8.8g二氧化碳,通过计算确定该合金是生铁还是钢?,
 wh0071年前2
wh0071年前2 -
 gaotian007 共回答了15个问题
gaotian007 共回答了15个问题 |采纳率93.3%只有碳才能够氧化成为二氧化碳,根据题意:
C+O2=CO2
可知:8.8/44=0.2mol,由于化学反应C与CO2mol 比是1:1,所以消耗的也是0.2mol的碳.
0.2mol的碳为:0.2X12=2.4g碳,该60g的铁的合金含有2.4g碳,故含碳量为:
2.4/60=0.04=4%,由于铁碳合金中,含碳量0.0218~2.11%的为钢,含碳量2.11~6.69%为生铁,而本铁的合金含碳量为4%,含碳量>2.11…%,故为生铁.1年前查看全部
- 有一含锡量约为45%的合金(其他是铅,铁等等),用最简单的方法准确测定里面的含锡量
有一含锡量约为45%的合金(其他是铅,铁等等),用最简单的方法准确测定里面的含锡量
用化学或物理的方法都可以 如何测定 ljf6661年前1
ljf6661年前1 -
 mengyansheng 共回答了19个问题
mengyansheng 共回答了19个问题 |采纳率100%可以用直读火花光谱仪!1年前查看全部
- 取50毫升稀硫酸与一定质量的镁铝合金反应,合金全部溶解,向所得溶液中滴加5mol/L的氢氧化钠溶液至过量,
取50毫升稀硫酸与一定质量的镁铝合金反应,合金全部溶解,向所得溶液中滴加5mol/L的氢氧化钠溶液至过量,
生成沉淀质量与加入氢氧化钠溶液体积关系如图,则原合金中镁的质量为?(沉淀最大值19.4克,沉淀最大值对应氢氧化钠的量为160毫升,最后沉淀为11.6克,对应氢氧化钠的量为180毫升.) 爱情三分球1年前1
爱情三分球1年前1 -
 习他们的 共回答了13个问题
习他们的 共回答了13个问题 |采纳率92.3%最后的沉淀为氢氧化镁,可以算出氢氧化镁物质的量为 11.6/58=0.2mol 所以Mg为0.2mol,为4.8g 沉淀最大时,应该是氢氧化铝和氢氧化镁共存,所以氢氧化铝质量为19.4-11.6=7.8g 其物质的量为 7.8/78=0.1mol 所以铝为2.7g1年前查看全部
- 甲乙两种金属密度分别为ρ1和ρ2,组成合金密度为ρ1ρ2/2,
甲乙两种金属密度分别为ρ1和ρ2,组成合金密度为ρ1ρ2/2,
若制作前后体积不变,那么两种物的质量比试多少? 紫韵撩香1年前1
紫韵撩香1年前1 -
 xuchang92 共回答了23个问题
xuchang92 共回答了23个问题 |采纳率82.6%ρ1=m1/V1,ρ2=m2/V2,m1+m2=(V1+V2)ρ1ρ2/2,然后解该方程即可.为(ρ1-2)/(2-ρ2)1年前查看全部
- 〔急〕市售 黄金粉 是由Zn和Cu组成的合金粉,将此粉20g与93.7g稀硫酸充分反应,可得氢气0.2g.将反应后的混合
〔急〕
市售 黄金粉 是由Zn和Cu组成的合金粉,将此粉20g与93.7g稀硫酸充分反应,可得氢气0.2g.将反应后的混合物过虑,所虑出固体中只含Cu
1.求黄金粉中Zn的质量分数 amyloveamyhoho1年前1
amyloveamyhoho1年前1 -
 48480501 共回答了20个问题
48480501 共回答了20个问题 |采纳率100%Zn+H2SO4=ZnSO4+ H2↑
65 2
x 0.2
65/x=2/0.2,解得x=6.5
故黄金粉中含有6.5gZn,且质量分数为6.5/20*100%=32.5%1年前查看全部
- 一种合金由铜、铁和铝合成,其中铜占25%,铁占35%,一块这种合金重8千克,其中铝有多少千克?
 Fenber1年前3
Fenber1年前3 -
 wenqls 共回答了22个问题
wenqls 共回答了22个问题 |采纳率86.4%铝有多少千克?
m=8*(1-25%-35%)=8*40%=3.21年前查看全部
- 什么是合金的蒸汽压?
 腰刀19421年前1
腰刀19421年前1 -
 flydog1997 共回答了10个问题
flydog1997 共回答了10个问题 |采纳率80%在一定外界条件下,液体(或者固体)的合金表面上,组成合金的液(固)态分子(原子)会溢出表面而成为蒸气,这些蒸气对合金表面产生的压强就是该合金的蒸气压.1年前查看全部
- 关于铝及铝合金说法错误的是A氧化铝是一种高硬度高熔沸点化合物B铝是活泼金属,其合金抗腐蚀能力差C铝合金具有密度小,高强度
关于铝及铝合金说法错误的是
A氧化铝是一种高硬度高熔沸点化合物
B铝是活泼金属,其合金抗腐蚀能力差
C铝合金具有密度小,高强度及较好的可塑性
D铝合金可用于制飞机骨架等 kkbad1年前2
kkbad1年前2 -
 10指紧扣的爱 共回答了23个问题
10指紧扣的爱 共回答了23个问题 |采纳率91.3%B错误 Al常温下在空气中形成保护膜 抗腐蚀能力强1年前查看全部
大家在问
- 1听录音,看图选择。 ( ) 1. A. juice ( ) 2. B. bread ( ) 3.
- 2下列说法中,正确的是( ) A.近似数117.08精确到十分位 B.按科学记数法表示的数 ,其原数是50400 C.
- 3如图所示,灯泡L标有“6V 3W”字样,滑动变阻器的最大阻值为12Ω,当开关S1S2闭合,滑动变阻器滑片P滑到最右端时,
- 4Livingroom怎么读什么意思?
- 5Whether he work hard or plays,I don't think he will pass the
- 6六年级有102名同学,选出男同学的1/3和3名……
- 7英语翻译1、我们到达电影院时,那部受年轻人喜欢的电影已经开始10分钟了.(popular)2、你认为将来电脑制作的连环漫
- 8小船在400米宽的河水中行驶,船在静水中速度4米/秒,水流速度为2米/秒,求:
- 9连词成句 1.when,your,lost,find,and,did,where,you,car(?) 2.was,bo
- 10在100ml水中放入一小块金属钠,当完全反应后,收集到112ml氢气(标况),假设反应后溶液的体积仍为100ml 求反应
- 11食堂有3200千克大米,第一个月用了8分之3,第二个月再用多少千克才能是剩下的大米正好是原有大米的5分之2
- 12北纬44.66° 西经111.11°是哪里
- 13有两袋大米,甲袋的重量是乙袋的1.2倍.如果再往乙袋装5千克大米,两袋就一样重了.原来两袋大米各有多少千克?(列方程解答
- 14π-arctan(3/2)-arctan(2/3)=?
- 15罗比塔法则 lim(2/3.14*arctanX)的x次方,x趋向于无穷,答案是多少
