硫酸亚铁和正三价铁的区别
 雨夜在独醉中逃逸2022-10-04 11:39:541条回答
雨夜在独醉中逃逸2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 wangjin_207 共回答了22个问题
wangjin_207 共回答了22个问题 |采纳率95.5%- 三价铁的化合价为+3价,硫酸亚铁的化合价为+2价.
可溶性三价铁的溶液是黄色的,硫酸亚铁溶液是浅绿色的.
三价铁只有氧化性,硫酸亚铁既有氧化性又有还原性.
三价铁较稳定,硫酸亚铁不稳定. - 1年前
相关推荐
- 铁与硫酸生成硫酸亚铁.铁与氧气生成四氧化三铁.那我怎么才能知道铁在化学变化中变成铁还是亚铁呢?
 懒人-20031年前4
懒人-20031年前4 -
 豆儿1985 共回答了20个问题
豆儿1985 共回答了20个问题 |采纳率90%一看你就知道是初中困苦的娃.
在初中范围内,置换反应中,铁一律为正2价.如:铁与硫酸生成硫亚铁.
, 其他反应中,铁为正3价,如:铁+氧气=4氧化3铁
ps:置换反应是“单质+化合物=另一种单质+另一种化合物'的反应1年前查看全部
- 怎么样除去硫酸镁中硫酸亚铁?
 密码很简单1年前1
密码很简单1年前1 -
 aidemengai 共回答了14个问题
aidemengai 共回答了14个问题 |采纳率100%溶于水,加入过量镁粉,由于Mg比Fe活泼
Mg+FeSO4=MgSO4+Fe
过量的Mg和生成的Fe过滤除去,滤液蒸发结晶得到纯净的MgSO4.1年前查看全部
- 醋酸-硫酸亚铁溶液与亚硝酸钠反应方程式
 zoeyzhan1年前2
zoeyzhan1年前2 -
 kinki51 共回答了19个问题
kinki51 共回答了19个问题 |采纳率84.2%酸性条件下分解
2H+ + 2NO2- = H2O + NO + NO2
这里是应该写成2HAc+2NO2-=H2O+NO+NO2+2Ac-
3Fe2+ + NO + 2 SO42- = [Fe (NO)]SO4
生成棕色的硫酸亚硝酰铁1年前查看全部
- 氯化钙氯化锌氯化钡氯化铝氯化钾氯化银氯化铁氯化亚铁氯化铜氯化亚铜硫酸钠硫酸铜硫酸锌硫酸镁硫酸钡硫酸钙硫酸铝硫酸铁硫酸亚铁
氯化钙
氯化锌
氯化钡
氯化铝
氯化钾
氯化银
氯化铁
氯化亚铁
氯化铜
氯化亚铜
硫酸钠
硫酸铜
硫酸锌
硫酸镁
硫酸钡
硫酸钙
硫酸铝
硫酸铁
硫酸亚铁
硫酸铵
硫酸钾
碳酸钙
碳酸钾
碳酸钠
碳酸银
碳酸钡
碳酸镁
碳酸锌
碳酸铵
硝酸钾
硝酸钠
硝酸银
硝酸钙
硝酸镁
硝酸钡
硝酸锌
硝酸铜
硝酸铁
硝酸亚铁
硝酸铵
硝酸汞 海岸之珠1年前2
海岸之珠1年前2 -
 charmcao 共回答了20个问题
charmcao 共回答了20个问题 |采纳率100%氯化钙CaCl2
氯化锌ZnCl2
氯化钡BaCL2
氯化铝AlCl3
氯化钾KCl
氯化银AgCl
氯化铁FeCl3
氯化亚铁FeCl2
氯化铜CuCl2
氯化亚铜CuCl
硫酸钠Na2SO4
硫酸铜CuSO4
硫酸锌ZnSO4
硫酸镁MgSO4
硫酸钡BaSO4
硫酸钙CaSO4
硫酸铝Al2(SO4)3
硫酸铁Fe2(SO4)3
硫酸亚铁FeSO4
硫酸铵(NH4)2SO4
硫酸钾K2SO4
碳酸钙CaCO3
碳酸钾K2CO3
碳酸钠Na2CO3
碳酸银Ag2CO3
碳酸钡BaCO3
碳酸镁MgCO3
碳酸锌ZnCO3
碳酸铵(NH4)2CO3
硝酸钾KNO3
硝酸钠NaNO3
硝酸银AgNO3
硝酸钙Ca(NO3)2
硝酸镁Mg(NO3)2
硝酸钡Ba(NO3)2
硝酸锌Zn(NO3)2
硝酸铜Cu(NO3)2
硝酸铁Fe(NO3)3
硝酸亚铁Fe(NO3)2
硝酸铵NH4NO3
硝酸汞Hg(NO3)21年前查看全部
- 将10克铁粉加入到50毫升2摩尔每升的稀硫酸中,充分反应后生成硫酸亚铁的物质的量为多少?
 v3火箭1年前2
v3火箭1年前2 -
 azsd988 共回答了17个问题
azsd988 共回答了17个问题 |采纳率94.1%Fe+H2SO4=Feso4+H2
50毫升的稀硫酸完全反应可以反应掉50*2再除以1000=0.1mol 而铁的物质的量为10除以56明显不止0.1 所以铁粉有剩余 有方程式可知最终生成的硫酸亚铁物质的量为0.1mol 谢谢 希望对你有所帮助1年前查看全部
- 工厂利用废铁屑与废硫酸反应制取硫酸亚铁.假设1t废铁屑能与9.8t废硫酸反映得到10.78t固液废硫酸质量分数
 Rewinke1年前1
Rewinke1年前1 -
 DDAAVV 共回答了18个问题
DDAAVV 共回答了18个问题 |采纳率94.4%FE+ H2SO4= FESO4 +H21年前查看全部
- 工厂利用废铁屑与废硫酸起反应来制取硫酸亚铁.现有废硫酸19.6t(硫酸的质量分数为20%)
工厂利用废铁屑与废硫酸起反应来制取硫酸亚铁.现有废硫酸19.6t(硫酸的质量分数为20%)
工厂利用回收废铁屑与废硫酸来制取硫酸亚铁.现有废硫酸19.6t(硫酸的质量分数为20%)与足量的废铁屑起反应,求生产含杂量5%的硫酸亚铁的质量.
 imoda1年前1
imoda1年前1 -
 cengduan 共回答了16个问题
cengduan 共回答了16个问题 |采纳率93.8%硫酸与硫酸亚铁是1:1的关系,质量比是98:152.
那么硫酸亚铁的量应该是19.6×20%÷98×152=6.08吨
因为含5%杂质,所以最终产量是6.08÷95%=6.4吨1年前查看全部
- PH值偏高,硫酸亚铁溶液为什么显黄色
 曰久生情1年前1
曰久生情1年前1 -
 将臣8 共回答了17个问题
将臣8 共回答了17个问题 |采纳率94.1%因为pH值高,则溶液中oH相对较多,加上部分+2Fe被氧化为+3Fe,结合oH生成氢氧化铁,溶解于溶液中,整个溶液就显黄色.这里讨论的都是少量的1年前查看全部
- 除杂质!(急!)要出去硫酸亚铁中混有少量的硫酸铜杂质,可以在溶液中加入______,再用______方法出去杂质,有关化
除杂质!(急!)
要出去硫酸亚铁中混有少量的硫酸铜杂质,可以在溶液中加入______,再用______方法出去杂质,有关化学方程式______________________. dreaming8601年前1
dreaming8601年前1 -
 5393070123 共回答了13个问题
5393070123 共回答了13个问题 |采纳率84.6%加入__铁粉,再用___过滤
fe + cuso4=cu +feso41年前查看全部
- 硫酸亚铁溶液中加入过量铁粉生成的红色物质是什么
硫酸亚铁溶液中加入过量铁粉生成的红色物质是什么
铁粉其实就是铁钉,硫酸亚铁溶液是我自己用硫酸铜合铁钉配的.铁钉放置在溶液一段时间后有一大块红色物质生成并附着在铁钉表面 家住秦都1年前1
家住秦都1年前1 -
 hongli0424 共回答了8个问题
hongli0424 共回答了8个问题 |采纳率62.5%将铁钉加入到硫酸铜溶液中过后,是否过滤除去的生成的铜?铁能将硫酸铜中的铜置换出来,生成铜单质附着在铁钉表面,看上去是红色的.
如果是过滤过的,并且铜离子也是反应完全了的……
硫酸亚铁溶液水解显酸性(生成了微量的硫酸和氢氧化亚铁),放置在硫酸亚铁溶液中的铁钉会不断消耗水解生成的硫酸,使溶液pH增大,而促进硫酸亚铁的水解,产生大量的Fe(OH)2.
Fe(OH)2被空气中的氧气氧化,生成了红色的水合氧化铁Fe2O3·xH2O,也写成Fe(OH)3.
此外,硫酸亚铁溶液为电解质溶液,铁钉置于电解质溶液中时,铁钉与其中微量的惰性杂质构成原电池,造成铁被空气中的氧气迅速氧化,最终产物也是红色的水合氧化铁.1年前查看全部
- .用等体积等物质的量浓度的氯化钡溶液可使相同体积的硫酸铁、硫酸亚铁、硫酸钾三种溶液中的硫酸根离子完全转化为沉淀。则三种溶
.用等体积等物质的量浓度的氯化钡溶液可使相同体积的硫酸铁、硫酸亚铁、硫酸钾三种溶液中的硫酸根离子完全转化为沉淀。则三种溶液的物质的量浓度之比为( )
A.1∶1∶1 B.1∶2∶3 C.3∶1∶1 D.1∶3∶3
答案是D
方法讲下。。
 飞一般享受1年前1
飞一般享受1年前1 -
 sexbaby 共回答了20个问题
sexbaby 共回答了20个问题 |采纳率95%n(Ba2+)=n(SO4 2-)
所以假设这些溶液中每份都含有 3 mol SO42- ,体积为 10L 那么
FeSO4 物质的量为 3 mol,物质的量浓度为 0.3mol/L
Fe2(SO4)3 物质的量为 1 mol,物质的量浓度为 0.1mol/L
K2SO4 物质的量为 3mol,物质的量浓度为 0.3mol/L
所以选 D1年前查看全部
- 化学方程式,教写下!碳酸铵硫酸硫酸铜盐酸氢氧化钡硝酸铵碳酸氢钠熟石灰石灰石硫酸钾硫酸镁硫酸亚铁硝酸镁硝酸钾硝酸钡硝酸铵碳
化学方程式,教写下!
碳酸铵
硫酸
硫酸铜
盐酸
氢氧化钡
硝酸铵
碳酸氢钠
熟石灰
石灰石
硫酸钾
硫酸镁
硫酸亚铁
硝酸镁
硝酸钾
硝酸钡
硝酸铵
碳酸镁
磷酸钾
磷酸钙
磷酸铁
磷酸钾
硫酸钙
磷酸铁
氢氧化铁
生石灰
会的帮我下, 樊景杨秋1年前4
樊景杨秋1年前4 -
 kerubim 共回答了15个问题
kerubim 共回答了15个问题 |采纳率73.3%碳酸铵(NH4)2CO3
硫酸H2SO4
硫酸铜CuSO4
盐酸HCl
氢氧化钡Ba(OH)2
硝酸铵NH4NO3
碳酸氢钠NaHCO3
熟石灰Ca(OH)2
石灰石CaCO3
硫酸钾K2SO4
硫酸镁MgSO4
硫酸亚铁FeSO4
硝酸镁Mg(NO3)2
硝酸钾KNO3
硝酸钡Ba(NO3)2
硝酸铵NH4NO3
碳酸镁MgCO3
磷酸钾K3PO4
磷酸钙Ca2(PO4)3
磷酸铁FePO4
磷酸钾K3PO4
硫酸钙CaSO4
磷酸铁FePO4
氢氧化铁Fe(OH)3
生石灰CaO
新春快乐!1年前查看全部
- 某种含硫酸亚铁的药物可以用于治疗缺铁性贫血.某贫血患者每天需服用这种含铁原素10%的药物112mg,则每天他服用这种药物
某种含硫酸亚铁的药物可以用于治疗缺铁性贫血.某贫血患者每天需服用这种含铁原素10%的药物112mg,则每天他服用这种药物中含硫酸亚铁(FeSo4)的质量是:(该物质其他成分不含铁元素)
拜托解题的时候把解题过程和思路写下来,这种题目我一向不怎么会解答.
答案也一并写出来. 白桦林江枫1年前1
白桦林江枫1年前1 -
 csxu2005 共回答了21个问题
csxu2005 共回答了21个问题 |采纳率85.7%Fe的质量为112*10%=11.2mg
FeSO4的原子相对质量为152 ,Fe的相对原子质量为56
FeSO4:Fe=152:56
因为Fe=11.2mg
解得FeSO4=30.4mg1年前查看全部
- 硫酸亚铁和氯水反应方程式?
 wade3181年前2
wade3181年前2 -
 zwz1982 共回答了13个问题
zwz1982 共回答了13个问题 |采纳率92.3%6 FeSO4+3 Cl2=2 Fe2(SO4)3+2 FeCl31年前查看全部
- 硫酸亚铁溶液被氧气氧化成硫酸铁溶液还是碱式硫酸铁?
 snr192567241年前2
snr192567241年前2 -
 liumangdp111 共回答了11个问题
liumangdp111 共回答了11个问题 |采纳率90.9%硫酸铁溶液 12FeSO4+3O2+6H2O=4Fe2(SO4)3+4Fe(OH)31年前查看全部
- 向过量稀硫酸种加入除去油污的废铁屑,是否是制备硫酸亚铁的可行方案?
向过量稀硫酸种加入除去油污的废铁屑,是否是制备硫酸亚铁的可行方案?
RT,为什么? sskkxx1年前1
sskkxx1年前1 -
 kim_1214 共回答了22个问题
kim_1214 共回答了22个问题 |采纳率90.9%稀硫酸过量,加入废铁屑后生成硫酸亚铁是不假,但是里面还有稀硫酸呢?怎么分离出稀硫酸来?如果废铁屑过量,那这就是一个制备硫酸亚铁的好方法了.1年前查看全部
- 硝酸 硫酸钡 硫酸镁 硫酸铜 硫酸亚铁 硫酸铁 硫酸铵
硝酸 硫酸钡 硫酸镁 硫酸铜 硫酸亚铁 硫酸铁 硫酸铵
还有碳酸钠 碳酸钾 碳酸钡 碳酸钙 碳酸铵 氢氧化钠 氢氧化钙 氢氧化铁 氢氧化铜 氢氧化铝 氢氧化铵 硝酸钾 硝酸钠 硝酸银 硝酸铜 硝酸铵
有点多啊,我给多点分啊 tgren1年前5
tgren1年前5 -
 小雪是星星 共回答了19个问题
小雪是星星 共回答了19个问题 |采纳率94.7%硝酸 HNO3
硫酸钡 BaSO4
硫酸镁 MgSO4
硫酸铜 CuSO4
硫酸亚铁 FeSO4
硫酸铁 Fe2(SO4)3
硫酸铵 (NH4)2SO4
碳酸钠 Na2CO3
碳酸钾 K2CO3
碳酸钡 BaCO3
碳酸钙 CaCO3
碳酸铵 (NH4)2CO3
氢氧化钠 NaOH
氢氧化钙 Ca(OH)2
氢氧化铁 Fe(OH)3
氢氧化铜 CU(OH)2
氢氧化铝 Al(OH)3
氢氧化铵 NH3.H2O
硝酸钾 KNO3
硝酸钠 NaNO3
硝酸银 AgNO3
硝酸铜 Cu(NO3)2
硝酸铵NH4NO31年前查看全部
- 刚买养花用的硫酸亚铁为淡绿色为什么溶与水之后为黄色多加点会更深呢? 有混浊
 我爱单车1年前2
我爱单车1年前2 -
 相见总在伤感时 共回答了14个问题
相见总在伤感时 共回答了14个问题 |采纳率78.6%被水中溶解的氧气氧化了,生成Fe(OH)3沉淀1年前查看全部
- 铁到硫酸亚铁的化学式(坐等)RT尽量多给几种不同的
 小米5321年前4
小米5321年前4 -
 紧紧依偎 共回答了21个问题
紧紧依偎 共回答了21个问题 |采纳率85.7%Fe +H2SO4 ==FeSO4 +H2↑
Fe +CuSO4 =FeSO4 +Cu1年前查看全部
- 有一种工业废水,其中含有大量的硫酸亚铁、少量的银离子以及污泥.某同学设计了一个既经济又合理的方法回
有一种工业废水,其中含有大量的硫酸亚铁、少量的银离子以及污泥.某同学设计了一个既经济又合理的方法回
⑴步骤②中:需加入的物质是(铁粉),分离所得混合物的方法是(过滤)
⑵步骤③中,需加入的物质是(硫酸),发生反应的化学方程式是(Fe+H2SO4=FeSO4+H2↑)
⑶某同学认为经过步骤②后所得固体就是纯净的银,不需要进行步骤③,你认为是否合理(不合理),理由是(铁粉过量,和银混在一起)
⑷步骤④的溶液2和溶液3为什么要混合(更充分回收硫酸亚铁晶体)
答案我都知道,但能给我解释一下(1)中为什么要加铁粉?发生了什么反应?
讲详细点,谢谢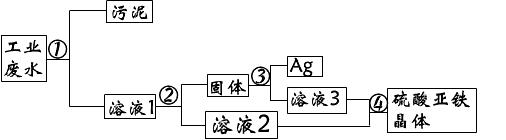
 迫于果腹撒1年前1
迫于果腹撒1年前1 -
 羽丕花圣 共回答了20个问题
羽丕花圣 共回答了20个问题 |采纳率100%加入过量的铁粉目的是把溶液的的Ag+全部置换出来生成单质的银.
反应的化学方程式为:Fe+Ag2SO4=FeSO4+2Ag1年前查看全部
- 锌片放入硫酸亚铁溶液中一段时间后,发现锌片表面有气泡产生为什么?
 wj338491年前2
wj338491年前2 -
 辰以 共回答了20个问题
辰以 共回答了20个问题 |采纳率85%硫酸亚铁溶液中含有一定量的硫酸,锌把铁换完了就跟硫酸反应了.1年前查看全部
- 在实际生活中,化学物质有重要的用途.请用下列物质的化学式选择填写:生石灰、氮气、氧气、硫酸亚铁、消石灰、干冰.
在实际生活中,化学物质有重要的用途.请用下列物质的化学式选择填写:生石灰、氮气、氧气、硫酸亚铁、消石灰、干冰.
(1)可治疗贫血的药物是______;
(2)充入包装袋中作食品保护气的是______;
(3)可用于人工降雨的是______;
(4)为了防止食品受潮,在其包装袋中放入一小袋干燥剂,这种干燥剂是______. 雪天的竹扉1年前1
雪天的竹扉1年前1 -
 pz_8848 共回答了18个问题
pz_8848 共回答了18个问题 |采纳率88.9%解题思路:首先根据题意确定物质的化学名称,然后根据书写化学式的方法和步骤写出物质的化学式即可.(1)硫酸亚铁中含有铁元素,能治疗贫血,其化学式为:FeSO4.
(2)氮气化学性质不活泼,可作食品保护气,其化学式为:N2.
(3)干冰(固体的二氧化碳)升华时吸收大量的热,可用于人工降雨,其化学式为:CO2.
(4)氧化钙和水反应从而吸收水,可做干燥剂,其化学式为:CaO.
故答案为:(1)FeSO4;(2)N2;(3)CO2;(4)CaO.点评:
本题考点: 化学式的书写及意义.
考点点评: 本题难度不大,熟练掌握常见物质的性质、用途、组成及化学式的书写是正确解答此类题的关键所在.1年前查看全部
- 硫酸亚铁未溶解时为淡绿色,用水溶解后水溶液变了黄色,什么原因?
 1841703291年前3
1841703291年前3 -
 cumulus 共回答了14个问题
cumulus 共回答了14个问题 |采纳率78.6%硫酸亚铁为粉末状时亚铁离子不是自由移动的离子 因此难与氧气反应 用水溶解后亚铁离子电离出来成为自由移动的离子 又因为亚铁离子不稳定极易被氧化成三价铁离子 而三价铁离子的水溶呈棕黄色 故将硫酸亚铁溶于水后 亚铁离子被溶于水的氧气氧化成三价铁离子 因此溶液变成了黄色1年前查看全部
- 铁与硫酸生成硫酸亚铁和氢气 求解这反应物中没氢元素啊 配平
 雨桐12191年前5
雨桐12191年前5 -
 庶吉士 共回答了17个问题
庶吉士 共回答了17个问题 |采纳率94.1%Fe+H2SO4=FeSO4+H2
氢气来源于硫酸中的氢离子1年前查看全部
- 硫酸亚铁和稀硫酸反应,化学方程式、
 mz20071年前4
mz20071年前4 -
 小玩家xxn 共回答了17个问题
小玩家xxn 共回答了17个问题 |采纳率82.4%不能反应的.看化合价.硫酸亚铁中硫的化合价和硫酸中的是一样的不能反应的1年前查看全部
- 高锰酸钾溶液在酸性条件下可以与硫酸亚铁反应,化学方程式如下(未配平): KMnO 4 + FeSO 4 + H
高锰酸钾溶液在酸性条件下可以与硫酸亚铁反应,化学方程式如下(未配平): KMnO 4 + FeSO 4 + H高锰酸钾溶液在酸性条件下可以与硫酸亚铁反应,化学方程式如下(未配平):
KMnO 4 + FeSO 4 + H 2 SO 4 = K 2 SO 4 + MnSO 4 + Fe 2 (SO 4 ) 3 + H 2 O
下列说法正确的是A.MnO 4 - 是氧化剂,Fe 3+ 是还原产物 B.Fe 2+ 的还原性强于Mn 2+ C.取反应后的溶液加KSCN溶液,可观察到有血红色沉淀生成 D.生成1mol水时,转移2.5mol电子
 网名太长不好记11年前1
网名太长不好记11年前1 -
 deicai 共回答了16个问题
deicai 共回答了16个问题 |采纳率87.5%B
试题分析:A、MnO 4 - 是氧化剂,Fe 3+ 是氧化产物,错误;B、还原剂还原性强于还原产物,正确;C、KSCN溶液与Fe 3+ 反应生成配离子溶液,不是沉淀,错误;
D、 2 KMnO 4 + 10 FeSO 4 + 8 H 2 SO 4 = 1 K 2 SO 4 + 2 MnSO 4 + 5 Fe 2 (SO 4 ) 3 + 8 H 2 O(反应有10个电子转移)计算生成1mol水时,转移10÷8=1.25mol电子,错误。1年前查看全部
- 硫酸亚铁与硫酸反应生成什么
 轻虹紫云1年前1
轻虹紫云1年前1 -
 2chw 共回答了18个问题
2chw 共回答了18个问题 |采纳率88.9%稀硫酸不反应
浓硫酸:2FeSO4+2H2SO4(浓)=△=Fe2(SO4)3+SO2↑+2H2O1年前查看全部
- 硫酸亚铁与氢氧化钠反应,刚开始有白色絮状沉淀物什么物质,有人说是氢氧化亚铁,氢氧化亚铁不是绿色的吗,搞不懂
 liaoya12061年前1
liaoya12061年前1 -
 f4ak 共回答了10个问题
f4ak 共回答了10个问题 |采纳率90%二价铁离子是绿的,氢氧化铁的铁解离不成离子1年前查看全部
- 在硫酸亚铁与氢氧化钠反应制备氢氧化亚铁的实验中,生成的白色絮状氢氧化亚铁沉淀迅速变成灰绿色的沉淀,这种灰绿色的沉淀是什么
在硫酸亚铁与氢氧化钠反应制备氢氧化亚铁的实验中,生成的白色絮状氢氧化亚铁沉淀迅速变成灰绿色的沉淀,这种灰绿色的沉淀是什么?
 qionghai661年前2
qionghai661年前2 -
 lixinghua 共回答了25个问题
lixinghua 共回答了25个问题 |采纳率88%氢氧化三铁和氢氧化二铁的水合混合物发生一定的颜色变化1年前查看全部
- 硫酸亚铁可用于治疗缺铁性贫血.某贫血患者每天需补充1.12g铁元素,则他服用的药物中含硫酸亚铁的质量至少为( )
硫酸亚铁可用于治疗缺铁性贫血.某贫血患者每天需补充1.12g铁元素,则他服用的药物中含硫酸亚铁的质量至少为( )
A. 3.80g
B. 6.95g
C. 10g
D. 3.04g 士多啤犁1年前4
士多啤犁1年前4 -
 zongdiaodu77 共回答了23个问题
zongdiaodu77 共回答了23个问题 |采纳率95.7%解题思路:此题需要先计算硫酸亚铁的含铁质量分数,然后利用铁的质量除以铁的质量分数即可求出硫酸亚铁的质量.先计算硫酸亚铁中铁的质量分数,然后用铁的质量除以其质量分数即可.
硫酸亚铁中铁的质量分数是:[56/56+32+16×4]×100%=36.8%
需硫酸亚铁的质量是 1.12g÷36.8%=3.04g
故选D点评:
本题考点: 化合物中某元素的质量计算.
考点点评: 此题是对化学式计算的考查,主要利用了元素的质量等于物质的质量乘以元素的质量分数的计算方法,属基础性化学计算题.1年前查看全部
- 写出除去下列物质中的少量杂质所用试剂的名称或化学式:铜粉中混有氧化铜______;氢气中混有氯化氢______;硫酸亚铁
写出除去下列物质中的少量杂质所用试剂的名称或化学式:铜粉中混有氧化铜______;氢气中混有氯化氢______;硫酸亚铁溶液中混有硫酸铜______.
 黑人的房间1年前4
黑人的房间1年前4 -
 微微的辣 共回答了21个问题
微微的辣 共回答了21个问题 |采纳率85.7%解题思路:本题属于除杂质题,除杂质题最少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应②反应时不能加入新的杂质.铜粉中混有氧化铜,氧化铜用稀酸可以除去;氢气中混有氯化氢,可以用碱溶液把氯化氢气体除去;硫酸亚铁溶液中混有硫酸铜,可以用铁粉除去.因为铜排在氢的后面,因此铜与酸不反应,氧化铜用稀盐酸或稀硫酸可以除去;氢气与碱不反应,可以用氢氧化钠溶液把氯化氢气体除去;铁排在铜的前面,因此硫酸铜可以用铁粉除去.故答案为:稀HCl或稀H2SO4;氢氧化钠溶液;铁粉
点评:
本题考点: 物质除杂或净化的探究.
考点点评: 本考点属于物质的分离和提纯,是中考的重点也是一个难点,同学们要认真分析,记住常见离子的溶解性和除去方法,根据两个必要条件综合把握.本考点经常出现在选择题、填空题和实验题中.1年前查看全部
- 硫酸亚铁和硫化氢反应吗?为什么
 掬一片心情品味1年前3
掬一片心情品味1年前3 -
 asl521 共回答了30个问题
asl521 共回答了30个问题 |采纳率80%假如反应,生成的是硫化亚铁和稀硫酸,但硫化亚铁是溶于稀酸的,所以不反应.1年前查看全部
- 初中化学生成硫酸亚铁方程式请问,生成硫酸亚铁的方程式,
 祥云之上1年前1
祥云之上1年前1 -
 布啾布秋 共回答了21个问题
布啾布秋 共回答了21个问题 |采纳率90.5%H2SO4+Fe==FeSO4+H2↑(置换反应) 、Fe + CuSO4 =FeSO4 + Cu (置换反应)、Fe(OH)2+H2SO4=FeSO4+2H2O(酸碱中和反应)、FeO+H2SO4=FeSO4+H2O(这个是金属氧化物和酸反应).FeCO3+H2SO4=FeSO4+H2O+CO2↑.就差不多是这些了.学学举一反三吧!只要是有硫酸根离子的可溶性物质,都能和含有铁离子的反应,生成对应的盐和水.1年前查看全部
- 几个化学反应方程式怎么写1、向氯化铝溶液中滴加少量氢氧化钠2、向氯化铝溶液中滴加过量氢氧化钠3、用硫酸亚铁和氨水制备氢氧
几个化学反应方程式怎么写
1、向氯化铝溶液中滴加少量氢氧化钠
2、向氯化铝溶液中滴加过量氢氧化钠
3、用硫酸亚铁和氨水制备氢氧化亚铁
4、将氯化铁溶液滴到淀粉KI试纸上
5、碳酸钠溶液中滴加少量澄清石灰水
6、碳酸钠溶液中滴加过量澄清石灰水 czzx20041年前3
czzx20041年前3 -
 3WARNING 共回答了20个问题
3WARNING 共回答了20个问题 |采纳率95%1.向氯化铝溶液中滴加少量氢氧化钠::由于所氢氧化钠少量,氯化铝就过多,会和生成的氯化铝反应最终生成偏铝酸钠.AlCl3+4NaOH=NaAlO2+2H2O+3NaCl ,二楼同志答反了
2:向氯化铝溶液中滴加过量氢氧化钠:由于氢氧化钠过量,最终只有氢氧化铝沉淀产生
AlCl3+3NaOH=3NaCl+Al(OH)3↓
3,用硫酸亚铁和氨水制备氢氧化亚铁:FeSO4+2NH3~H2O=(NH4)2SO4+Fe(OH)2↓
4;、将氯化铁溶液滴到淀粉KI试纸上;2FeCl3+2KI=2FeCl2+2KCl+I2 由于三价铁离子会和碘离子反应,所以一楼同志生成的FeI3是不存在的,碘离子会被还原成碘单质
5,碳酸钠溶液中滴加少量澄清石灰水:
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
6,碳酸钠溶液中滴加过量澄清石灰水:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,5和6的反应是一样的,生成的物质都不会和溶液中的物质反应1年前查看全部
- (2009•大连二模)某次实验结束时,各实验小组将含有硫酸铜、硫酸锌、硫酸亚铁的废液倒在废液缸里,考虑到废液直接排放会造
(2009•大连二模)某次实验结束时,各实验小组将含有硫酸铜、硫酸锌、硫酸亚铁的废液倒在废液缸里,考虑到废液直接排放会造成水污染,某化学活动小组利用课余时间处理废液,回收工业重要原料硫酸锌和有关金属.实验过程如下:

(1)固体A的成分是铜铁锌铜铁锌.
(2)步骤③从固体A中分离出固体B的实验操作是用磁铁吸引用磁铁吸引.
(3)步骤④中发生反应的化学方程式是:Zn+H2SO4=ZnSO4+H2↑.Zn+H2SO4=ZnSO4+H2↑..
(4)若忽略实验过程中的物质损失,利用以上实验能否测定该废水中硫酸锌的质量分数?若认为能,写出最少需要称量哪些物质的质量;若不能,说明理由. 相逢是首歌20051年前1
相逢是首歌20051年前1 -
 chunxiang033 共回答了15个问题
chunxiang033 共回答了15个问题 |采纳率93.3%解题思路:(1)根据金属活动性顺序表的应用分析固体A的成分.
(2)根据B的特性分析从固体A中分离出固体B的实验操作;
(3)根据反应写出反应的方程式;
(4)根据要计算该废液中硫酸锌的质量分数,必须知道废液的质量及废液中所含硫酸锌的质量,废液的质量可以直接进行称量,废液中硫酸锌的质量可通过称量所得硫酸锌固体质量减去回收过程中所加入锌粉反应生成硫酸锌的质量,因此还必须称量得到硫酸锌固体与所加锌粉的质量.(1)由于金属的活动性大小是:锌>铁>铜,所以,过量的锌加入到含有硫酸铜、硫酸锌、硫酸亚铁的废液中,能把铜、铁全部置换出来.所以,固体A的成分是铜铁锌;
(2)由于滤液A、B蒸发至干得硫酸锌,可得知两滤液中的硫酸锌皆为硫酸锌;固体C加入过量的稀硫酸得到滤液B和铜.由上述分析可知,固体A的成分是铜铁锌.说明固体C是铜和锌的混合物,则B是铁,由于铁能磁铁吸引.所以,步骤③从固体A中分离出固体B的实验操作是用磁铁吸引;
(3)由流程图可知,步骤④是锌与稀硫酸反应,反应的方程式是:Zn+H2SO4=ZnSO4+H2↑;
(4)根据溶液中溶质质量分数计算公式,要计算该废液中硫酸锌的质量分数,必须知道废液的质量及废液中所含硫酸锌的质量,在称量废液质量后,还必须称量得到硫酸锌固体与所加锌粉的质量,利用锌粉质量计算出所得到的硫酸锌中由锌粉反应生成硫酸锌的质量,所得硫酸锌固体质量与锌粉反应生成硫酸锌的质量差即为原废液中所含硫酸锌的质量.
故答为:(1)铜铁锌;(2)用磁铁吸引;(3)Zn+H2SO4=ZnSO4+H2↑;(4)能测定,需要称量废液的质量、硫酸锌的质量、锌粉的质量.点评:
本题考点: 物质的相互转化和制备.
考点点评: 根据金属的活动性,排在氢前面的金属都可把酸中的氢置换出来而得到氢气;活动性强的金属可把活动性弱的金属从其盐溶液中置换出来1年前查看全部
- Fe与硫酸反应生成硫酸亚铁和氢气,当56gFe与过量的硫酸反应时,试求生成FeSo4的质量和所产生H2在标准状况下的体积
Fe与硫酸反应生成硫酸亚铁和氢气,当56gFe与过量的硫酸反应时,试求生成FeSo4的质量和所产生H2在标准状况下的体积 最好有详细的步骤与说明
 shanbyao1年前4
shanbyao1年前4 -
 九天涅磐 共回答了12个问题
九天涅磐 共回答了12个问题 |采纳率83.3%设硫酸亚铁质量为m(FeSO4) 氢气在标准状况下的体积为V(H2)
Fe + H2SO4 = FeSO4 + H2↑
56g/moL 152g/moL 22.4L/moL
56g m(FeSO4) V(H2)
56 / 56 = 152/ m(FeSO4) = 22.4/ V(H2)
m(FeSO4)=152g V(H2)=22.4L1年前查看全部
- 除了硫酸亚铁外 还有什么可以改变土壤的酸性,食醋可以吗
除了硫酸亚铁外 还有什么可以改变土壤的酸性,食醋可以吗
用醋 浇花 可以吗 比如我想把花的土壤的ph值降低一些
可以吗 为什么?
硫酸亚铁外 还有什么可以 暖暖761年前1
暖暖761年前1 -
 飘飘的小鱼 共回答了25个问题
飘飘的小鱼 共回答了25个问题 |采纳率92%使用硫酸铵,硫酸钾等都可以.用醋浇不好,浇少了没用,浇多了肯定死.如果是种花,还不如去买现成的草炭土或腐殖质土,看你提问题的 水平,也不像能把土壤pH值调准的样子.1年前查看全部
- 硫酸亚铁溶液和氢氧化钠溶液反应求化学方程式和具体反应现象,
 w522w1年前1
w522w1年前1 -
 windabc123 共回答了23个问题
windabc123 共回答了23个问题 |采纳率95.7%FeSO4+2NaOH==Fe(OH)2↓+Na2SO4
4Fe(OH)2+O2+2H2O==4Fe(OH)3
生成白色沉淀,迅速变为灰绿色,最终变为红褐色1年前查看全部
- 请问硫酸亚铁和石灰放在一个里面会反应吗?怎么才能保证不变质?
 放逐1234561年前1
放逐1234561年前1 -
 君临天下2006 共回答了13个问题
君临天下2006 共回答了13个问题 |采纳率84.6%氧化钙在空气中容易吸水生成氢氧化钙,氢氧化钙可以和硫酸亚铁反应
FeSO4+Ca(OH)2==Fe(OH)2+CaSO4
4Fe(OH)2+O2+2H2O==4Fe(OH)3
如果是硫酸亚铁固体,应该密封隔绝氧气或空气保存.如果是溶液,可以滴加少量稀硫酸抑制水解,同时加少量铁粉,防止被氧化.这样才可以保证不变质1年前查看全部
- (2013•昆都仑区一模)向含有硫酸镁、硫酸亚铁、硫酸铜的混合溶液中加入一些锌粉,完全反应后过滤,滤渣为A,滤液为B.将
(2013•昆都仑区一模)向含有硫酸镁、硫酸亚铁、硫酸铜的混合溶液中加入一些锌粉,完全反应后过滤,滤渣为A,滤液为B.将A放入稀硫酸中没有气泡冒出.则下列说法不正确的是( )
A.A中一定有铜、可能有铁
B.A中只有铜
C.B中一定有硫酸镁、硫酸锌、硫酸亚铁
D.B中可能有硫酸铜 绝望的重生1年前1
绝望的重生1年前1 -
 鼠你唯一 共回答了16个问题
鼠你唯一 共回答了16个问题 |采纳率93.8%解题思路:根据金属活动性顺序.在金属活动性顺序中,排在氢前面的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来;据此结合题意进行分析判断.根据金属活动顺序表可知,锌比铁活泼,铁比铜活泼,锌的活动性比镁弱,所以加入一定量的锌粉,锌不能与硫酸镁溶液反应;首先锌粉和硫酸铜溶液反应,置换出单质铜,如果锌粉足量可以继续与硫酸亚铁反应置换出铁.由题意可知,向滤出的固体A中滴加稀硫酸,没有气泡产生,说明固体中不含和稀硫酸反应的金属,金属不可能是铁和锌;
A、向滤出的固体A中滴加稀硫酸,没有气泡产生,说明固体中不含和稀硫酸反应的金属,金属A不可能是铁和锌,A中一定有铜,故选项说法错误;
B、向滤出的固体A中滴加稀硫酸,没有气泡产生,说明固体中不含和稀硫酸反应的金属,A中一定有铜,金属A不可能是铁和锌,故选项说法正确;
C、滤液B中一定有硫酸镁、生成的硫酸锌、硫酸亚铁,故选项说法正确;
D、由于滤渣A中只含有金属铜,当加入的锌量极少时,硫酸铜可能有剩余,B中可能有硫酸铜,故选项说法正确.
故选:A.点评:
本题考点: 金属的化学性质.
考点点评: 本题有一定难度,主要考查了学生对金属活动顺序表的运用,在解题时要注意对定量(如一定量、过量、少量等)概念的理解和掌握.1年前查看全部
- 置换反应 硫酸亚铁溶液(硫酸铜)CUSO4+MG==MGSO4+CU吖 括号内是要被去除的 这样可以吗
 moviefan1年前4
moviefan1年前4 -
 namexp 共回答了26个问题
namexp 共回答了26个问题 |采纳率92.3%当然不行,你用镁置换铜之后,你又引入了新的杂质硫酸镁啊...如果镁的用量多又置换铁了.你应该用铁除杂1年前查看全部
- (2004•广州)下面各组金属用硫酸亚铁溶液,就能比较它们的活动性强弱的是( )
(2004•广州)下面各组金属用硫酸亚铁溶液,就能比较它们的活动性强弱的是( )
A.铜和银
B.铜和锌
C.汞和铜
D.铅和汞 大连男人0081年前1
大连男人0081年前1 -
 xjlcp 共回答了16个问题
xjlcp 共回答了16个问题 |采纳率93.8%解题思路:根据活动性强的金属能将活动性弱的金属从其盐溶液中置换出来,分析各组金属与硫酸亚铁溶液发生反应的情况,判断各组金属的活动性强弱关系.A、铜、银都不能与硫酸亚铁发生反应,用硫酸亚铁溶液,不能比较铜、银两种金属的活动性强弱;故A不正确;
B、铜不能与硫酸亚铁反应,而锌能置换硫酸亚铁中的铁,用硫酸亚铁溶液,能比较铜、锌两种金属的活动性强弱;故B正确;
C、汞、铜都不能与硫酸亚铁发生反应,用硫酸亚铁溶液,不能比较铜、汞两种金属的活动性强弱;故C不正确;
D、汞、铅都不能与硫酸亚铁发生反应,用硫酸亚铁溶液,不能比较铜、铅两种金属的活动性强弱;故D不正确;
故选B.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 利用活动性强的金属能将活动性弱的金属从其盐溶液中置换出来的反应特点,可用来检验金属的活动性.1年前查看全部
- 往硫酸,硫酸铜,硫酸亚铁的混合溶液中加入过量的氢氧化钠
往硫酸,硫酸铜,硫酸亚铁的混合溶液中加入过量的氢氧化钠
会出现什么现象
生成物中有氢氧化亚铁吧,氢氧化亚铁会变成氢氧化铁吗,再说了,是先出现氢氧化铜沉淀还是先出现氢氧化亚铁沉淀还是同时出现 nwhong1年前3
nwhong1年前3 -
 天才地煞 共回答了19个问题
天才地煞 共回答了19个问题 |采纳率94.7%放出大量热,有白色和蓝色沉淀生成,白色沉淀
变成灰绿色,最终变为红褐色 故最终看到蓝色和红褐色
沉淀,蓝色沉淀中可能有黑色固体(CuO)1年前查看全部
- 硫酸亚铁溶液加铁钉防止溶液里的亚铁离子被氧化
硫酸亚铁溶液加铁钉防止溶液里的亚铁离子被氧化
通常用氯化铁溶液腐蚀铜箔制造印刷线路板,在硫酸亚铁溶液里加铁定或铁粉来防止溶液离得亚铁离子被氧化,说出其中的道理,分析发生的化学反应. rt19821年前2
rt19821年前2 -
 可怜水 共回答了24个问题
可怜水 共回答了24个问题 |采纳率95.8%因为如果亚铁离子被氧化会生产铁离子,铁和铁离子反应生产亚铁离子.方程式:Fe+2Fe3+ = 3Fe2+1年前查看全部
- 在允许加热的条件下,只用一种试剂就可以鉴别硫酸铁,硫酸亚铁,硫酸钠,氯化铝,氯化铵五种溶液,这种试剂是?
在允许加热的条件下,只用一种试剂就可以鉴别硫酸铁,硫酸亚铁,硫酸钠,氯化铝,氯化铵五种溶液,这种试剂是?
A 硝酸银溶液 B 氯化钡溶液 C氨水 D氢氧化钠溶液
我想问为什么B不可以,硫酸铁和硫酸亚铁可以直接看出,氯化铵加热就可以看出,硫酸钠和氯化铝不可以用B直接鉴别嘛 啸弘1年前3
啸弘1年前3 -
 yo727yo 共回答了15个问题
yo727yo 共回答了15个问题 |采纳率80%氯化铵是不会受热分解的,需要加入氢氧化钠1年前查看全部
- 要检验硫酸亚铁试剂有没有被氧化 可用__试剂,反应离子方程式_____,检验氯化铁溶液中是否
要检验硫酸亚铁试剂有没有被氧化 可用__试剂,反应离子方程式_____,检验氯化铁溶液中是否
混有氯化亚铁,往试样中滴入几滴___________,反应的离子方程式为______________.欲除去氯化亚铁溶液中混有的氯化铁可加入_________充分反应后再______,欲除去混在氯化铁中的氯化亚铁可加入_______试剂,再对溶液作___处理. yinboen1年前1
yinboen1年前1 -
 江南好风景旧曾谙 共回答了20个问题
江南好风景旧曾谙 共回答了20个问题 |采纳率95%检验硫酸亚铁有没有被氧化.
即检验三价铁离子,可用硫氰化钾溶液检验,Fe3+ + 3SCN- = Fe(SCN)3.发生络合反应,溶液变(血)红色.
检验氯化铁中的氯化亚铁.
即检验二价铁离子,可用酸性高锰酸钾溶液检验,5Fe2+ + MnO4- + 8H+ = 5Fe3+ + Mn2+ + 4H2O.发生氧化还原反应,高锰酸钾被二价铁还原,紫色褪去.
除去氯化亚铁中的三氯化铁.
可加入铁粉,充分反应后再过滤掉多余的铁粉.Fe + 2Fe3+ = 3Fe2+,发生氧化还原反应.
除去氯化铁中的氯化亚铁.
可通入氯气,再加热.Cl2 + 2Fe2+ = 2Fe3+ + 2Cl-,发生氧化还原反应.也可加入酸化的双氧水,也是将二价铁氧化为三价.1年前查看全部
- 帮我写几个离子方程式,硫酸亚铁中加入经硫酸酸化的双氧水小苏打溶液与烧碱溶液反应氯气通入水中三氯化铁与氢碘酸反应氢氧化钡溶
帮我写几个离子方程式,
硫酸亚铁中加入经硫酸酸化的双氧水
小苏打溶液与烧碱溶液反应
氯气通入水中
三氯化铁与氢碘酸反应
氢氧化钡溶液与稀硫酸的反应
用氨水吸收过量二氧化碳
向漂白粉中通入二氧化碳气体
碳酸氢钠中加入少量氢氧化钡溶液
氨水与硝酸作用
硫化亚铁与稀硝酸作用
氯化铁制备氢氧化铁胶体 Jiang_linyan1年前1
Jiang_linyan1年前1 -
 zhanglia 共回答了23个问题
zhanglia 共回答了23个问题 |采纳率82.6%2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O
HCO3- + OH- = CO32- + H2O
Cl2 + H2O = Cl- + HClO + H+
2Fe3+ + 2I- = 2Fe2+ +I2↓
OH- + H+ =H2O
CO2 + NH3·H2O = NH4+ + HCO3-
Ca2+ + 2ClO- +H2O + CO2 = CaCO3↓+2HClO
或ClO- + H2O + CO2 = HCO3- + HClO
HCO3- + Ba2+ + OH- = BaCO3↓+H2O
NH3·H2O +H+ =NH4+ + H2O
FeS + 6H+ + 3NO3-=Fe3+ + S + 3NO2↑ + 3H2O
Fe3+ + 3OH- = Fe(OH)31年前查看全部
- 硫酸铁和硫酸亚铁混合物,其中铁元素质量分数a%,硫元素质量分数为
 花开物语1年前1
花开物语1年前1 -
 我凤我凰 共回答了15个问题
我凤我凰 共回答了15个问题 |采纳率93.3%剩下的都是硫酸根百分数等于1-a%
硫酸根中硫百分数等于1/3
所以硫百分数等于1/3乘以(1-a%)1年前查看全部
- 写出制取硫酸亚铁的4种方法(原理不能重复)
 cwka1年前1
cwka1年前1 -
 袁小痴 共回答了23个问题
袁小痴 共回答了23个问题 |采纳率91.3%1.直接反应:
Fe+H2SO4=FeSO4+H2↑
2.铜和氧气反应再硫酸反应,铁置换
2Cu+O2=加热=2CuO
CuO+H2SO4=CuSO4+H2O
Fe+CuSO4=FeSO4+Cu
3.铁和氧气反应,再和硫酸反应,用铜还原
3Fe+2O2=点燃=Fe3O4
Fe3O4+4H2SO4=FeSO4+Fe2(SO4)3+4H2O
Cu+Fe2(SO4)3=2FeSO4+CuSO4
4.铜和硫酸反应,铁置换
Cu+2H2SO4(浓)=加热=CuSO4+SO2↑+2H2O
Fe+CuSO4=FeSO4+Cu1年前查看全部
大家在问
- 1y=根号下(x2+2)的值域
- 2y=根号下:—x2+x+2的值域
- 3_清 郑燮的新竹诗,谁能告诉我全拼音的
- 4高一函数简答题1.证明函数y=-x^2+1在区间[0,+∞]上是减函数.2.根据函数f(x)=|1-x|的图像,写出f(
- 5初2滴一次函数题,(急!谁帮我解)一个三角形的底边长5CM,高H可以任意伸缩(1)写出面积S随H变化关系式(2)指出其中
- 6将规格分别为12v 6w和6v 6w的甲乙两灯串联在15v的电源上,求通过两灯的电流
- 7两只灯泡的规格分别是“6V 6W ”“6V 12W".将它们串联,电源电压多大?两只消灯泡消耗的总功率多大?
- 8全球变暖,2010气候的反常,是大自然对人类的惩罚么?
- 9描写人跑不动了的语段,写出动作神态,
- 10氮气是一种什么样的气体
- 11如何除去硫酸亚铁氨中三价铁离子
- 12苯酚是有机物 为什么是弱电解质
- 13从静止开始下落的物体都必做自由落体运动 这句话对吗?
- 14酉字右边上面一个雨下面三个口是什么字
- 15f(x)在x0可导是|f(x)|在x0可导的什么条件
