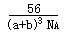单晶硅是信息产业中重要的基础材料,通常用炭在高温下还原二氧化硅制得粗硅(含铁,铝,硼,磷等杂质)
 bocaibb0122022-10-04 11:39:541条回答
bocaibb0122022-10-04 11:39:541条回答,粗硅与氯气反应生成四氯化硅(反应温度450-500℃),四氯化硅经提纯后用氢气还原可得高纯硅,以下是实验室制备四氯化硅的装置示意图.

相关信息如下:
①四氯化硅遇水极易水解;
②硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
③有关物质的物理常数见下表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 162 |
(1)写出装置A中发生反应的离子方程式
| ||
| ||
(2)装置A中g管的作用是______,装置B中的试剂是______,装置C中的试剂是______,装置E中h瓶需要冷却的理由是______.
(3)干燥管F的作用______.

已提交,审核后显示!提交回复
共1条回复
 asdkfhergh 共回答了14个问题
asdkfhergh 共回答了14个问题 |采纳率85.7%- 解题思路:由制备四氯化硅的实验流程可知,A中发生二氧化锰与浓盐酸的反应生成氯气,B中饱和实验水除去HCl,C装置中浓硫酸干燥氯气,D中发生Si与氯气的反应生成四氯化硅,由信息可知,四氯化硅的沸点低,则E装置冷却可收集四氯化硅,F可防止空气中的水进入,最后处理含氯气的尾气,以此来解答.
由制备四氯化硅的实验流程可知,A中发生二氧化锰与浓盐酸的反应生成氯气,B中饱和实验水除去HCl,C装置中浓硫酸干燥氯气,D中发生Si与氯气的反应生成四氯化硅,由信息可知,四氯化硅的沸点低,则E装置冷却可收集四氯...
点评:
本题考点: 制备实验方案的设计;物质的分离、提纯的基本方法选择与应用.
考点点评: 本题考查制备实验方案的设计,为高频考点,把握制备原理及实验流程中的反应、物质的性质等为解答的关键,侧重分析与实验、计算能力的综合考查,题目难度不大. - 1年前
相关推荐
- 问几个化学方程式1、石英和焦炭制备半导体单晶硅2、二氧化硫通入溴水中(离)
 hp79881年前1
hp79881年前1 -
 sonya-faye 共回答了16个问题
sonya-faye 共回答了16个问题 |采纳率100%SiO2 + 2C==高温==Si + 2CO
SO2 + Br2 + 2H2O==4H+ + SO42- + 2Br-1年前查看全部
- 单晶硅是信息产业中的重要基础材料,下列硅及其化合物的说法正确的是( )
单晶硅是信息产业中的重要基础材料,下列硅及其化合物的说法正确的是( )
①硅是构成一些岩石和矿物的基本元素②水泥、玻璃、水晶饰物都是硅酸盐制品
③陶瓷是人类应用很早的硅酸盐材料④单晶硅常用于制造光导纤维
⑤二氧化硅是沙子、石英的主要成分A.①③⑤ B.①②④ C.③④⑤ D.①④⑤  zhdt3161年前1
zhdt3161年前1 -
 hxcy1316 共回答了16个问题
hxcy1316 共回答了16个问题 |采纳率87.5%A
1年前查看全部
- (它223•重庆)电脑CPU蕊片由一种叫“单晶硅”的材料制成,未切割前的单晶硅材料是一种薄型圆片,叫“晶圆片”.现为了生
 (它223•重庆)电脑CPU蕊片由一种叫“单晶硅”的材料制成,未切割前的单晶硅材料是一种薄型圆片,叫“晶圆片”.现为了生产某种CPU蕊片,需要长、宽都是1cm的正方形小硅片若干.如果晶圆片的直径为12.25cm.问一张这种晶圆片能否切割出所需尺寸的小硅片66张?请说明g的方法和理由.(不计切割损耗)
(它223•重庆)电脑CPU蕊片由一种叫“单晶硅”的材料制成,未切割前的单晶硅材料是一种薄型圆片,叫“晶圆片”.现为了生产某种CPU蕊片,需要长、宽都是1cm的正方形小硅片若干.如果晶圆片的直径为12.25cm.问一张这种晶圆片能否切割出所需尺寸的小硅片66张?请说明g的方法和理由.(不计切割损耗)  fangqi1111年前1
fangqi1111年前1 -
 kimxie 共回答了11个问题
kimxie 共回答了11个问题 |采纳率90.9%解题思路:可以按9个正方形排成一排,叠4层,先放入圆内,然后(1)上下再加一层,每层8个,现在共有6层.
(2)在前面的基础上,上下各加6个,现在共有8层.
(3)最后上下还可加一层,但每层只能是一个,共10层,这样各个层的正方形的个数就可以得到.答:可以切割出iic小正方形.(1分)
方法下:
(1)我们把10c小正方形排成下排,看成下c长条形h矩形,这c矩形刚好能放入直径为10.0scmh圆内,如图中矩形ABCD.
∵BC=10AB=10.
∴对角线AC2=100+1=101<10.0s2.(0分)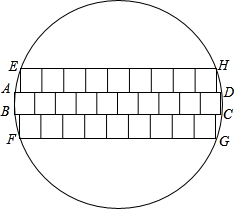
(2)我们在矩形ABCDh上方和下方可以分别放入9c小正方形.
∵新加入h两排小正方形连同ABCDh下部分可看成矩形手FGH,矩形手FGHh长为9,高为0,对角线手G2=92+02=81+9=90<10.0s2.但是新加入h这两排小正方形不能是每排10c,因为:
102+02=100+9=109>10.0s2.(i分)
(0)同理:82+s2=i4+2s=89<10.0s2,
92+s2=81+2s=10i>10.0s2,
∴可以在矩形手FGHh上面和下面分别再排下8c小正方形,那么现在小正方形已有了s层.(8分)
(4)再在原来h基础上,上下再加下层,共7层,新矩形h高可以看成是7,那么新加入h这两排,每排都可以是7c但不能是8c.
∵72+72=49+49=98<10.0s2,
82+72=i4+49=110>10.0s2.(9分)
(s)在7层h基础上,上下再加入下层,新矩形h高可以看成是9,这两层,每排可以是4c但不能是sc.
∵42+92=1i+81=97<10.0s2,
s2+92=2s+81=10i>10.0s2,
现在总共排了9层,高度达到了9,上下各剩下约0.scmh空间,因为矩形ABCDh位置不能调整,
故再也放不下下c小正方形了.
∴10+2×9+2×8+2×7+2×4=ii(c).(10分)
方法二:
学生也可能按下面h方法排列,只要说理清楚,评分标准参考方法下.
可以按9c正方形排成下排,叠4层,先放入圆内,
然后:(1)上下再加下层,每层8c,现在共有i层;
(2)在前面h基础上,上下各加ic,现在共有8层;
(0)最后上下还可加下层,但每层只能是下c,共10层.
这样共有:4×9+2×8+2×i+2×1=ii(c).点评:
本题考点: 正多边形和圆.
考点点评: 本题是圆与正方形相结合的问题,正确理解题意是解决本题的关键.1年前查看全部
- "单晶硅并不是直接半导体"什么意思?那他属于什么类型的半导体呢?
 送423支野百合1年前1
送423支野百合1年前1 -
 yan88888 共回答了16个问题
yan88888 共回答了16个问题 |采纳率93.8%单晶硅是制造半导体的重要材料,需要在单晶硅中掺入微量的第ЩA族元素,才能形成P型半导体,掺入微量的第VA族元素,形成N型半导体.1年前查看全部
- Ⅰ.第ⅢA、VA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型第三代半导体材料,其晶体结构与单晶硅
Ⅰ.第Ⅲa、va元素组成的化合物gan、gap、gaas等是人工合成的新型第三代半导体材料,其晶体结构与单晶硅Ⅰ.第Ⅲa、va元素组成的化合物gan、gap、gaas等是人工合成的新型第三代半导体材料,其晶体结构与单晶硅相似。试回答:
(1)ga的基态原子的价电子的轨道排布式为 。
(2)下列说法正确的是 (选填序号)。
a.***和镓都属于p区元素 b.gan、gap、gaas均为分子晶体
c.电负性:as>ga d.第一电离能ga>as
(3)gaas是由(ch 3 ) 3 ga和ash 3 在一定条件下制得,同时得到另一物质,该物质分子是 (填“极性分子”或“非极性分子”)。(ch 3 ) 3 ga中镓原子的杂化方式为 。
Ⅱ.氧化钙晶体的晶胞如图所示,试回答: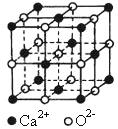
(1)晶体中ca 2+ 的配位数为 。
(2)已知ca 2+ 的半径为a cm,o 2- 的半径为b cm,n a 代表阿伏加德罗常数,
该晶体的密度为 g/cm 3 。(用含a、b、n a 的代数式表示)
 山城闲云野鹤1年前1
山城闲云野鹤1年前1 -
 比没锅好五倍 共回答了20个问题
比没锅好五倍 共回答了20个问题 |采纳率90%1年前查看全部
- 单晶硅是重要的半导体材料,初三化学题,急!!!
单晶硅是重要的半导体材料,初三化学题,急!!!
单晶硅是重要的半导体材料,但在生产单晶硅的过程中,排放的废水中含有HCl会造成水体的严重污染。经测定,某工厂产生的废水中,HCl的质量分数为0.73%,为保证该厂每天产生的100吨废水无害排放,必须进行中和处理。Ca(OH)2粉末的市场价为400元/吨,10%的NaOH溶液的市场价为300元/吨。若仅从成本考虑,选用何种原料更加经济?通过计算说明。
详细过程,正确的。
 文十一1年前4
文十一1年前4 -
 马拉之星 共回答了16个问题
马拉之星 共回答了16个问题 |采纳率75%氯化氢的质量为:100*1000*1000*0。73%=730000克
Ca(OH)2+2HCl=CaC12+2H2O
74 73
X 730000 X=740000 0。74*400=296元
NaOH + HCl=NaCl+H2O
40 36。5
Y*10% 730000 Y=8000000 8*300=2400元
所以氢氧化钙粉末更经济1年前查看全部
- (12分)⑴第ⅢA、ⅤA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。G
(12分)⑴第ⅢA、ⅤA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。Ga原子的电子排布式为 ▲ 。在GaN晶体中,与同一个Ga原子相连的N原子构成的空间构型为 ▲ 。在四大晶体类型中,GaN属于 ▲ 晶体。
⑵ K^S*5U.C#O% 铜、铁元素能形成多种配合物。微粒间形成配位键的条件是:一方是能够提供孤电子对的原子或离子,另一方是具有 ▲ 的原子或离子
⑶CuCl 2 溶液与乙二胺(H 2 N-CH 2 -CH 2 -NH 2 )可形成配离子:请回答下列问题: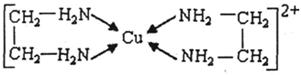
① H、N、O三种元素的电负性由大到小的顺序是 ▲ 。
②SO 2 分子的空间构型为 ▲ 。与SnCl 4 互为等电子体的一种离子的化学式为 ▲
③乙二胺分子中氮原子轨道的杂化类型为 ▲ 。乙二胺和三甲胺[N(CH 3 ) 3 ]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是 ▲ 。
④⑶中所形成的配离子中含有的化学键类型有 ▲ 。
a.配位键 b.极性键 c.离子键 d.非极性键
⑤CuCl的晶胞结构如上图所示,其中Cl原子的配位数为 ▲ 。 时尚叮当1年前1
时尚叮当1年前1 -
 luckgc9 共回答了21个问题
luckgc9 共回答了21个问题 |采纳率100%(12分)
⑴1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 1 (或[Ar]3d 10 4s 2 4p 1 )(1分)
正四面体(1分)原子晶体(1分) K^S*5U.C#O%
⑵能够接受孤电子对的空轨道(1分)
⑶① O >N >H(1分)
②V形(1分) SO 4 2- 、SiO 4 4- 等(1分)
③sp 3 杂化(1分) 乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键(1分)
④abd (2分)⑤4(1分)
略1年前查看全部
- (2005•南京)单晶硅是制作电子集成电路的基础材料.工业上通过以下反应将自然界的二氧化硅(SiO2)转化为硅:SiO2
(2005•南京)单晶硅是制作电子集成电路的基础材料.工业上通过以下反应将自然界的二氧化硅(SiO2)转化为硅:SiO2+2C═Si+2CO↑,下列分析正确的是( )
A.二氧化硅发生了氧化反应
B.碳发生了还原反应
C.该反应属于复分解反应
D.该反应属于置换反应 张扬灵魂1年前1
张扬灵魂1年前1 -
 younger711 共回答了16个问题
younger711 共回答了16个问题 |采纳率87.5%解题思路:本题应根据物质的种类和数目判断反应的类型,从得氧失氧的角度来认识氧化和还原反应,SiO2和CO都是化合物,也是氧化物,C和Si是单质.A、二氧化硅在反应中失去氧元素,被还原,是氧化剂,所以二氧化硅发生了还原反应,故A错误;
B、碳在反应中得到氧元素,被氧化,是还原剂,发生了氧化反应,故B错误;
C、复分解反应是两种化合物相互交换成分,该反应不属于分解反应,故C错误;
D、置换反应是单质和化合物反应生成单质和化合物,故D正确.
故选D.点评:
本题考点: 氧化反应;置换反应及其应用;复分解反应及其应用;还原反应.
考点点评: 本题应注意从不同的角度来认识和分析化学反应,注重反应前后的变化,能从细微之处去分析反应,解答本题要掌握判断反应类型的方法,只有这样才能对各种反应类型做出正确的判断.1年前查看全部
- 自然界中存在的元素大多以化合态存在,而我们在生产和生活中需要许多单质,如金属铁、单晶硅等.试想,如果把某元素由化合态变为
自然界中存在的元素大多以化合态存在,而我们在生产和生活中需要许多单质,如金属铁、单晶硅等.试想,如果把某元素由化合态变为游离态,则该元素( )
A. 被氧化
B. 有可能被氧化,也有可能被还原
C. 被还原
D. 该元素既不被氧化也不被还原 ehn11年前1
ehn11年前1 -
 舞衣清月 共回答了19个问题
舞衣清月 共回答了19个问题 |采纳率100%解题思路:某元素在化学反应中由游离态变为化合态,元素的化合价肯能升高,也可能降低.A.可能被还原,如Fe+Cu2+=Fe2++Cu,故A错误;
B.某元素在化学反应中由游离态变为化合态,如发生Fe+Cu2+=Fe2++Cu,则被还原,如发生Cl2+S2-=2Cl-+S,则被氧化,故B正确;
C.可能被氧化,如Cl2+S2-=2Cl-+S,故C错误;
D.元素在化学反应中由游离态变为化合态,化合价一定发生变化,则元素一定被氧化或被还原,故D错误;
故选B.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,侧重化合价升高或降低的分析,注意利用实例解答,题目难度不大.1年前查看全部
- (2012•平谷区二模)高纯的单晶硅是重要的半导体材料.制备高纯硅的化学方程式为:SiCl4+2H2 高温
(2012•平谷区二模)高纯的单晶硅是重要的半导体材料.制备高纯硅的化学方程式为:SiCl4+2H2
Si+4HCl.请计算要获得56g硅(Si),至少需要氢气多少克?高温 .  youngshop0071年前1
youngshop0071年前1 -
 tanwenhua123 共回答了22个问题
tanwenhua123 共回答了22个问题 |采纳率100%设至少需要氢气的质量为x.
SiCl4+2H2=Si+4HCl
4 28
x56g
4
28=
x
56g x=8g
答:至少需要8g氢气.1年前查看全部
- 电脑CPU芯片有一种叫“单晶硅”的材料制成,未切割前的单晶硅材料是一种薄型圆片,叫“晶圆片”.现为了生产某种CPU芯片,
电脑CPU芯片有一种叫“单晶硅”的材料制成,未切割前的单晶硅材料是一种薄型圆片,叫“晶圆片”.现为了生产某种CPU芯片,需要边长为1cm的正方形小硅片若干.如果晶圆片的直径为10.05cm,问一张这种晶圆片能否切割出所需尺寸的小硅片66张?请说明你的方法和理由.(不计切割损耗)
 花221年前1
花221年前1 -
 lingshaoliang 共回答了16个问题
lingshaoliang 共回答了16个问题 |采纳率100%不计切割损耗.
也就是只需要计算面积就可以了
小正方形的总面积是 66平方厘米
晶圆面积是 pi * (10.05/2)^2=79.3平方厘米
答:可以切割出所需尺寸的小硅片66张1年前查看全部
- 非晶硅,单晶硅,多晶硅英文怎么说?
 LIURONG02091年前2
LIURONG02091年前2 -
 leejia2006 共回答了13个问题
leejia2006 共回答了13个问题 |采纳率76.9%amorphous silicon
Monocrystalline silicon
polycrystalline silicon1年前查看全部
- 单晶硅是信息产业中重要的基础材料。通常用焦炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四
单晶硅是信息产业中重要的基础材料。通常用焦炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
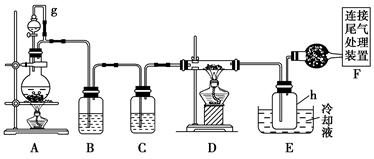
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:物 质 sicl 4 bcl 3 alcl 3 fecl 3 pcl 5 沸点/℃ 57.7 12.8 - 315 - 熔点/℃ -70.0 -107.2 - - - 升华温度/℃ - - 180 300 162
请回答下列问题:
(1)写出装置a中发生反应的离子方程式 ____________________________。
(2)装置a中g管的作用是________;装置c中的试剂是________;装置e中的h瓶需要冷却的理由是________________________________________。
(3)装置e中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到***四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是________(填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成fe 2 + ,再用kmno 4 标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5fe 2 + +mno 4 - +8h + =5fe 3 + +mn 2 + +4h 2 o
滴定前是否要滴加指示剂?________(填“是”或“否”),请说明理由______________________。
②某同学称取5.000 g残留物,经预处理后在容量瓶中配制成100 ml溶液,移取25.00 ml试样溶液,用1.000×10 - 2 mol·l - 1 kmno 4 标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 ml,则残留物中铁元素的质量分数是________。 ky681年前1
ky681年前1 -
 gupiaopiao 共回答了16个问题
gupiaopiao 共回答了16个问题 |采纳率93.8%1年前查看全部
- 关于硅太阳能电池的特性问题1、单晶硅、多晶硅、非晶硅的暗伏安特性说明了什么性质,与二极管有什么关系?2、单晶硅、多晶硅、
关于硅太阳能电池的特性问题
1、单晶硅、多晶硅、非晶硅的暗伏安特性说明了什么性质,与二极管有什么关系?
2、单晶硅、多晶硅、非晶硅光照时的开路电压、短路电流与光强的关系?
3、单晶硅、多晶硅、非晶硅光照时的输出特性?
4、单晶硅、多晶硅、非晶硅光强特性?
5、单晶硅、多晶硅、非晶硅的光谱灵敏度性质?
6、单晶硅、多晶硅、非晶硅光照时的温度特性? 辉Sir1年前1
辉Sir1年前1 -
 hanfengze 共回答了20个问题
hanfengze 共回答了20个问题 |采纳率90%单晶硅转化率高,单成本是三者之中最大的
多晶硅性价比是最高的
非晶硅吸收弱光性好,但转化率是最低的,成本也低,制备能耗少.1年前查看全部
- (1)第ⅢA、ⅤA族元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似.Ga原
(1)第ⅢA、ⅤA族元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似.Ga原子的电子排布式为______.在GaN晶体中,每个Ga原子与______个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为______.在四大晶体类型中,GaN属于______晶体.N元素原子的价层电子的轨道表示式为______.
(2)人工模拟酶是当前研究的热点.有研究表明,化合物X可用于研究模拟酶,当其结合 或C
或C
(Ⅰ)如下图(Ⅰ表示化合价为+1)时,分别形成a和b:
①a中连接相邻含N杂环的碳碳键可以旋转,说明该碳碳键具有______键的特性.
②C、N、H、O四种元素的电负性由小到大的顺序为______.C与O构成的常见的CO2的电子式为______.写出N与O形成和CO2的等电子体物质的化学式为______.
③微粒间的相互作用包括化学键和分子间相互作用,比较a和b中微粒间相互作用力的差异______.
(③a中微粒间相互作用为分子间氢键和范德华力,b中是配位键) kevin11221年前1
kevin11221年前1 -
 hl_917 共回答了16个问题
hl_917 共回答了16个问题 |采纳率87.5%解题思路:(1)Ga是31号元素,其基态原子核外有31个电子,根据构造原理书写其原子核外电子排布式;
单晶硅是Si正四面体向空间延伸的立体网状结构,为原子晶体,GaN晶体结构与单晶硅相似,GaN属于原子晶体,与同一个Ga原子相连的N原子构成的空间构型为与但晶硅中Si的结构相似;
根据GaN的构成微粒确定晶体类型;
氮原子核外有7个电子,最外层有5个电子,最外层电子就是N元素价电子;
(2)①σ键可以旋转,π键不能旋转;
②元素的非金属性越强,其电负性越强,同一周期中,元素的电负性随着原子序数的增大而增大;二氧化碳分子中每个氧原子和碳原子形成共价双键;
原子个数相等价电子数相等的微粒为等电子体;
③a中含有含有氢键,b中含有配位键.(1)Ga原子是31号元素,Ga原子的电子排布式为1s22s22p63s23p63d104s24p1;GaN晶体结构与单晶硅相似,GaN属于原子晶体,每个Ga原子与4个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为正四面体,氮原子核外有7个电子,最外层有5个电子,最外层电子就是N元素价电子,其价电子轨道表示式为,
 ,
,
故答案为:1s22s22p63s23p63d104s24p1;4;正四面体;原子; ;
;
(2)①σ键可以旋转,π键不能旋转,所以具有σ键的特点,故答案为:σ;
②元素的非金属性越强,其电负性越强,同一周期中,元素的电负性随着原子序数的增大而增大,所以C、N、H、O四种元素的电负性由小到大的顺序为H<C<N<O;二氧化碳分子中每个氧原子和碳原子形成共价双键,所以二氧化碳的电子式为 ,原子个数相等价电子数相等的微粒为等电子体,所以N与O形成和CO2的等电子体物质的化学式为N2O,
,原子个数相等价电子数相等的微粒为等电子体,所以N与O形成和CO2的等电子体物质的化学式为N2O,
故答案为:H<C<N<O; ;N2O;
;N2O;
③根据图片知,a中含有含有氢键,b中含有配位键,故答案为:a中含有含有氢键,b中含有配位键.点评:
本题考点: 原子核外电子排布;判断简单分子或离子的构型;晶胞的计算;原子轨道杂化方式及杂化类型判断.
考点点评: 本题考查了物质结构和性质,明确物质结构是解本题关键,结构决定性质,知道电负性大小的判断方法、电子式的书写规则,难度不大.1年前查看全部
- 1 对单晶硅Si来说,在B,Al,P,As等元素中,哪些属于N 型杂质,哪些属于P型杂质?
 Aaron1361年前1
Aaron1361年前1 -
 5575786 共回答了19个问题
5575786 共回答了19个问题 |采纳率89.5%B、Al外层是三个价电子比Si或Ge少一个,形成空穴导电,是P型半导体;P、As外层是5个价电子比Si或Ge多一个,形成电子导电,是N型半导体.
价带:与价电子能级相对应的能带称为价带.
导带:价带以上能量最低的允许带称为导带.
导带与价带之间的不存在薛定谔方程本征解的能量区间称为禁带.
具体的可以看任何一本《固体物理》的能带论那一章,推荐基泰尔的《固体物理》.1年前查看全部
- (2013•西城区二模)单晶硅是制作电子集成电路的基础材料.工业上通过以下反应将自然界的二氧化硅(SiO2)转化为硅:S
(2013•西城区二模)单晶硅是制作电子集成电路的基础材料.工业上通过以下反应将自然界的二氧化硅(SiO2)转化为硅:SiO2+2C
Si+2CO↑,该反应属于( )高温
A.化合反应
B.分解反应
C.复分解反应
D.置换反应 i恋上单眼皮的猪1年前1
i恋上单眼皮的猪1年前1 -
 yxh180302 共回答了13个问题
yxh180302 共回答了13个问题 |采纳率92.3%解题思路:化学反应的类型有四个:化合反应、分解反应、置换反应和复分解反应.化合反应是有两种或两种以上的物质生成一种物质的化学反应,特征是:多变一.分解反应是一变多;置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的化学反应;复分解反应是两种化合物互相交换成分生成另外两种化合物的反应.SiO2+2C
Si+2CO↑,属于置换反应.高温 A、化合反应是有两种或两种以上的物质生成一种物质的化学反应,特征是:多变一;故选项错误;
B、分解反应是一变多,故选项错误;
C、复分解反应是两种化合物互相交换成分生成另外两种化合物的反应,复故选项错误;
D、置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的化学反应,SiO2+2C
高温
Si+2CO↑,属于置换反应.;故选项正确故选D点评:
本题考点: 反应类型的判定.
考点点评: 本考点考查了基本反应类型的判断,要牢记四个基本反应类型的概念,并会理解应用.本考点基础性比较强,主要出现在选择题和填空题中.1年前查看全部
- 从自然界中的石英砂制取单晶硅的有关方程式
 麻木行走1年前2
麻木行走1年前2 -
 全球最佳坤宠 共回答了22个问题
全球最佳坤宠 共回答了22个问题 |采纳率86.4%SiO2 + 2C = Si +2CO↑(条件为高温) 这里得到的是粗硅,需要进一步提纯
C +2Cl2 = CCl4
Si + 2Cl2 = SiCl4
SiCl4 + 2H2 = Si + 4HCl
(条件同上)1年前查看全部
- 多晶硅制成单晶硅的能耗指标是多少?
多晶硅制成单晶硅的能耗指标是多少?
如果一吨多晶硅制成单晶硅,能形成多少兆瓦的硅片,这个环节的耗能多少? 2haoha1年前1
2haoha1年前1 -
 e芒果雪芭e 共回答了24个问题
e芒果雪芭e 共回答了24个问题 |采纳率79.2%按20寸热场拉6寸硅片计算.
1吨多晶=950KG单晶方棒(按头尾料、边皮料、锅底料重复使用计算,大概有5%的原料损耗)
950KG单晶方棒=72200片(按每公斤出8英寸硅片78片)
每张6寸硅片按发电2.5W计算,能发电72200*2.5=180500W=0.1805兆瓦
能耗就得算成本了,不过估算需要反复拉晶18炉左右.按每炉运行50小时,60KW计算,拉晶需要电费54000千瓦时的电,另外人工、辅料、开方、切片的都还没算.1年前查看全部
- 电脑CPU芯片由一种叫“单晶硅”的材料制成,未切割前的单晶硅材料是一种薄圆形片,叫“晶圆片”.现在为了生产某种CPU芯片
电脑CPU芯片由一种叫“单晶硅”的材料制成,未切割前的单晶硅材料是一种薄圆形片,叫“晶圆片”.现在为了生产某种CPU芯片,需要长、宽都是1cm的正方形小硅片若干,如果晶圆片的直径为10.05cm,问一张这种晶圆片能否切割出所需尺寸的小硅片66张?请说明你的方法和理由.(不计切割损耗)
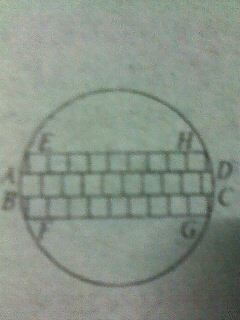
 lov靓颖4ev1年前1
lov靓颖4ev1年前1 -
 falyrabbit 共回答了21个问题
falyrabbit 共回答了21个问题 |采纳率95.2%帮你搜了个答案答:可以切割出66个小正方形.(1分)方法一:(1)我们把10个小正方形排成一排,看成一个长条形的矩形,这个矩形刚好能放入直径为10.05cm的圆内,如图中矩形ABCD.∵AB=10BC=10.∴对角线AC平方=100+1=101<10.05平方.(3分)(2)我们在矩形ABCD的上方和下方可以分别放入9个小正方形.∵新加入的两排小正方形连同ABCD的一部分可看成矩形EFGH,矩形EFGH的长为9,高为3,对角线EG^2=9^2+3^2=81+9=90<10.05^2.但是新加入的这两排小正方形不能是每排10个,因为:10^22+3^2=100+9=109>10.052.(6分)(3)同理:8^2+5^2=64+25=89<10.05^2,9^2+5^2=81+25=106>10.05^2,∴可以在矩形EFGH的上面和下面分别再排下8个小正方形,那么现在小正方形已有了5层.(8分)(4)再在原来的基础上,上下再加一层,共7层,新矩形的高可以看成是7,那么新加入的这两排,每排都可以是7个但不能是8个.∵7^2+7^2=49+49=98<10.05^2,8^2+7^2=64+49=113>10.05^2.(9分)(5)在7层的基础上,上下再加入一层,新矩形的高可以看成是9,这两层,每排可以是4个但不能是5个.∵4^2+9^2=16+81=97<10.05^2,5^2+9^2=25+81=106>10.05^2,现在总共排了9层,高度达到了9,上下各剩下约0.5cm的空间,因为矩形ABCD的位置不能调整,故再也放不下一个小正方形了.∴10+2×9+2×8+2×7+2×4=66(个).(10分)方法二:学生也可能按下面的方法排列,只要说理清楚,评分标准参考方法一.可以按9个正方形排成一排,叠4层,先放入圆内,然后:(1)上下再加一层,每层8个,现在共有6层;(2)在前面的基础上,上下各加6个,现在共有8层;(3)最后上下还可加一层,但每层只能是一个,共10层.这样共有:4×9+2×8+2×6+2×1=66(个).
 1年前查看全部
1年前查看全部
- (2011•龙岩模拟)制作半导体时,需向单晶硅或其他晶体中掺入杂质.单晶硅内的原子是规则排列的,在两层电子间的间隙会形成
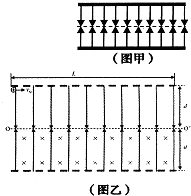 (2011•龙岩模拟)制作半导体时,需向单晶硅或其他晶体中掺入杂质.单晶硅内的原子是规则排列的,在两层电子间的间隙会形成如图甲所示的上下对称的匀强电场,设某空间存在上下对称的匀强电场,并在该电场中的下半区域加一方向垂直纸面向里的匀强磁场,如图乙所示.电量为+q、质量为m的带电小球从上边界以初速度v0垂直电场入射.已知上下场区的宽均为d,长为L,电场强度E=
(2011•龙岩模拟)制作半导体时,需向单晶硅或其他晶体中掺入杂质.单晶硅内的原子是规则排列的,在两层电子间的间隙会形成如图甲所示的上下对称的匀强电场,设某空间存在上下对称的匀强电场,并在该电场中的下半区域加一方向垂直纸面向里的匀强磁场,如图乙所示.电量为+q、质量为m的带电小球从上边界以初速度v0垂直电场入射.已知上下场区的宽均为d,长为L,电场强度E=
,初速度v0=mg q 3 2
,sin37°=gd
,cos37°=3 5
.4 5
求:
(1)小球第一次经过对称轴OO′时的速度;
(2)要使小球不越过下边界,所加磁场的磁感应强度B的最小值;
(3)若所加磁场的磁感应强度B′=2m qd
,且L=20d,求小球在场区运动的总时间.gd  不吃葡萄不吐皮1年前1
不吃葡萄不吐皮1年前1 -
 夜百合0 共回答了16个问题
夜百合0 共回答了16个问题 |采纳率100%解题思路:(1)对小球受力分析,得知重力和电场力方向相同,由此可知小球在上半区的加速度,小球在上半区做类平抛运动,由牛顿运动定律和运动学公式几何速度的合成与分解可求出小球刚要离开上半区是的速度大小和方向.
(2)小球进入下边界,受到的电场力和重力平衡,小球在洛伦兹力的作用下做匀速圆周运动,画出运动轨迹图,由几何关系求出运动半径,在由牛顿运动定律可求出磁场的强度.
(3)首先可根据第二问的结果判知在此磁场中运动的半径(为第二问求得半径的一半),分析得出小球在做周期性的运动(在上半区做斜上抛运动,在下半区做匀速圆周运动),由几何知识求出一个周期内小球在水平方向上的位移,判断能运动几个周期;再分段求出一个周期所用的时间,便可求出总时间.(1)小球进入电场后做类平抛运动,在竖直方向上有:
加速度:a=
mg+qE
m=2g
竖直方向的位移:d=
1
2at2
得:t=
d
g
所以和速度大小为:v=
v20
+v2y=
5
2
gd
与竖直方向的夹角θ:tan=
v0
vy=
3
2
gd
2
gd=
3
4
可得:θ=37°
(2)小球进入下半区域时,因重力和电场力平衡,小球在洛伦兹力的作用下做匀速匀速圆周运动,设小球恰好不越过下边界,则小球在到下边界时速度的方向应与边界平行,设圆周半径为R.如图所示:
由几何关系得:
R−d
R=sin37°
得:R=
5
2d
由牛顿第二定律得:qvB=m点评:
本题考点: 带电粒子在混合场中的运动;牛顿第二定律;向心力;带电粒子在匀强电场中的运动.
考点点评: 正确分析带电粒子的受力及运动特征是解决问题的前提,灵活选用力学规律是解决问题的关键.
1、明确研究对象,对研究对象进行受力分析.
2、依据力与运动的关系,明确运动性质及运动过程作出运动轨迹建立合理的运动模型.
3、根据不同的运动模型,选择合适的定律、定理列方程组求解.
当带电粒子在复合场中做匀速直线运动时,应根据平衡条件列方程求解.
当带电粒子在复合场中做匀速圆周运动时,应运用向心力公式和平衡条件联立方程求解.
当带电粒子在复合场中做非匀变速曲线运动时,应选用动能定理或能量守恒定律列方程求解.(或把该运动分解为匀速圆周运动和匀速直线运动的叠加)1年前查看全部
- 下列说法正确的是( ) A.石英玻璃和普通玻璃成分相同 B.工艺师可用盐酸刻蚀玻璃制作工艺品 C.由石英沙制备单晶硅不
下列说法正确的是( ) A.石英玻璃和普通玻璃成分相同 B.工艺师可用盐酸刻蚀玻璃制作工艺品 C.由石英沙制备单晶硅不涉及氧化还原反应 D.Si可用于信息存储,SiO 2 可用于光纤通讯  shanshan0401年前1
shanshan0401年前1 -
 朋友在ww 共回答了19个问题
朋友在ww 共回答了19个问题 |采纳率89.5%A.普通玻璃的主要成分是:二氧化硅、硅酸钠和硅酸钙,石英玻璃的成分主要为二氧化硅(SiO 2 ),所以二者成分不同,故A错误;
B.玻璃中含有二氧化硅,二氧化硅能和氢氟酸反应生成四氟化硅,和盐酸不反应,所以工艺师用氢氟酸刻蚀玻璃制作工艺品,故B错误;
C.由石英沙制备单晶硅过程中,硅元素的化合价由+4价变为0价,所以一定涉及氧化还原反应,故C错误;
D.硅是半导体材料,可用于信息存储,能用于制作硅芯片,二氧化硅能用于制造光导纤维,故D正确;
故选D.1年前查看全部
- (2012•昌平区二模)高纯的单晶硅是重要的半导体材料.制备高纯硅的化学方程式为:SiCl4+2H2 高温
(2012•昌平区二模)高纯的单晶硅是重要的半导体材料.制备高纯硅的化学方程式为:SiCl4+2H2
Si+4HCl.请计算要获得14g硅(Si),至少需要氢气多少克?高温 .  qqpasser1年前1
qqpasser1年前1 -
 飚滴 共回答了24个问题
飚滴 共回答了24个问题 |采纳率91.7%解题思路:利用化学方程式和要获得14g硅,列出比例式,就可计算出至少需要氢气的质量.设至少需要氢气的质量为x,
SiCl4+2H2
高温
.
Si+4HCl
428
x 14g
∴
4
28=
x
14g
∴x=
14g×4
28=2g.
答:至少需要氢气的质量为2g.点评:
本题考点: 根据化学反应方程式的计算.1年前查看全部
- 二氧化硅、氮化硅、单晶硅薄膜对近红外光的反射率
二氧化硅、氮化硅、单晶硅薄膜对近红外光的反射率
我最近在做薄膜对近红外光的反射实验,但是具体的数值我不确定,所以请问大家:
0.5μm厚度的氮化硅薄膜对808nm近红外光的反射率?
1μm厚度的二氧化硅薄膜对808nm近红外光的反射率?
380μm厚度的单晶硅薄膜对808nm近红外光的反射率? 爱恨交加时1年前1
爱恨交加时1年前1 -
 霍启刚 共回答了22个问题
霍启刚 共回答了22个问题 |采纳率95.5%这个有难度,薄膜的反射率取决于很多因素,而不仅仅是材料本身.建议查相关资料的基础上,根据表面形状(包括薄膜形成方式)估计反射率,并以实测数据相互印证.1年前查看全部
- 硅稳定吗我们刚学到硅.我们老师刚上课时说硅极易与氧结合,所以没有单质硅,后来讲到课本后面那个单晶硅,还有个插图,说硅放在
硅稳定吗
我们刚学到硅.我们老师刚上课时说硅极易与氧结合,所以没有单质硅,后来讲到课本后面那个单晶硅,还有个插图,说硅放在那里很稳定,我都晕了,怎么回事啊
 天天337081年前1
天天337081年前1 -
 jdzdavidking 共回答了12个问题
jdzdavidking 共回答了12个问题 |采纳率83.3%结晶型的硅,化学性质非常稳定.在常温下,除氟化氢以外,很难与其他物质发生反应. 你们老师说的是在自然界中没有单质硅,但是硅在上万年里很多自然条件特殊的情况下是会与氧发生反应的.举个通俗的例子,碳的化学性质很稳定吧,但在高温的条件下还不是会与氧发生反应?所以说不一定化学性质稳定的物质就不发生化学反应,反应条件也很重要,所以他们并不矛盾.1年前查看全部
- 下列说法中,正确的是( )A.粗硅制备单晶硅不涉及氧化还原反应B.工艺师利用盐酸刻蚀石英制作艺术品C.水晶项链和餐桌上
下列说法中,正确的是( )
A.粗硅制备单晶硅不涉及氧化还原反应
B.工艺师利用盐酸刻蚀石英制作艺术品
C.水晶项链和餐桌上的瓷盘都是硅酸盐制品
D.硅是目前人类将太阳能转变为电能的重要材料 hamleit1年前1
hamleit1年前1 -
 田方之里 共回答了11个问题
田方之里 共回答了11个问题 |采纳率100%解题思路:A.粗硅制备单晶硅时涉及氧化还原反应;
B.氢氟酸能腐蚀石英;
C.水晶的主要成分是二氧化硅;
D.硅是重要的半导体材料.A.粗硅制备单晶硅的反应是,Si+2Cl2
△
.
SiCl4,SiCl4+2H2
△
.
Si+4HCl,过程中涉及氧化还原反应,故A错误;
B.石英的主要成分是二氧化硅,二氧化硅能和氢氟酸反应而和盐酸不反应,所以工艺师利用HF刻蚀石英制作艺术品,故B错误;
C.水晶的主要成分是二氧化硅,不属于硅酸盐产品,故C错误;
D.硅位于金属和非金属分界线附近,具有金属性和非金属性,是重要的半导体材料,能制造硅太阳能电池,所以硅是目前人类将太阳能转变为电能的重要材料,故D正确;
故选D.点评:
本题考点: 硅和二氧化硅.
考点点评: 本题考查了硅、二氧化硅的性质,知道粗硅的制备原理、二氧化硅及硅的用途,为常考查点,但一般题目都较容易.1年前查看全部
- )单晶硅是信息产业中重要的基础材料.通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四
)单晶硅是信息产业中重要的基础材料.通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度 450~500 ℃),四氯化硅经提纯后用氢气还原可得高纯硅.以下是实验室制备四氯化硅的装置示意图.相关信息如下:a.四氯化硅遇水极易水解; b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物; c.有关物质的物理常数见下表:物质 sicl 4 bcl 3 alcl 3 fecl 3 pcl 5 沸点/℃ 57.7 12.8 — 315 — 熔点/℃ -70.0 -107.2 — — — 升华温度/℃ — — 180 300 162 请回答下列问题:(1)写出装置a 中发生反应的离子方程式 ________________________________________________________________________.(2)装置a 中g 管的作用是________;装置c 中的试剂是________;装置e 中的h 瓶需要冷却的理由是 ________________________________________________________________________ ________________________________________________________________________.(3)装置e 中h 瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到***四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是________(填写元素符号).(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成 fe 2+,再用 kmno 4 标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5fe 2++mno - 4 +8h + ===5fe 3++mn 2++4h 2 o ①滴定前是否要滴加指示剂?________( 填“是”或“否”) ,请说明理由 ________________________________________________________________________.②某同学称取5.000 g 残留物,经预处理后在容量瓶中配制成100 ml 溶液,移取25.00 ml 试样溶液,用1.000×10 -2 mol·l -1 kmno 4 标准溶液滴定.达到滴定终点时,消耗标准溶液20.00 ml,则残留物中铁元素的质量分数是________.
第四问的第二小题的答案是4.480%
为什么要加个0,化学计算时要算几位数要以什么为准 iammonica1年前1
iammonica1年前1 -
 aa以时间计时 共回答了17个问题
aa以时间计时 共回答了17个问题 |采纳率88.2%要保留4个有效数字.因为原题中是保留的4个.如25.00 mL,1.000×10 -2,20.00 mL
再题目没有说明保留有效数字的情况下,以原题目的数据为准1年前查看全部
- (1)第ⅢA、ⅤA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似.Ga原子
(1)第ⅢA、ⅤA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似.Ga原子的电子排布式为______.在GaN晶体中,与同一个Ga原子相连的N原子构成的空间构型为______.在四大晶体类型中,GaN属于______晶体.
(2)铜、铁元素能形成多种配合物.微粒间形成配位键的条件是:一方是能够提供孤电子对的原子或离子,另一方是具有______的原子或离子
(3)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:请回答下列问题: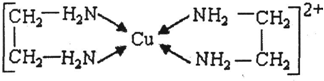
①H、N、O三种元素的电负性由大到小的顺序是______.
②SO2分子的空间构型为______.与SnCl4互为等电子体的一种离子的化学式为______
③乙二胺分子中氮原子轨道的杂化类型为______.乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是______.
④(3)中所形成的配离子中含有的化学键类型有______.
a.配位键b.极性键c.离子键d.非极性键
⑤CuCl的晶胞结构如图所示,其中Cl原子的配位数为______. stefinia18261年前1
stefinia18261年前1 -
 住天才呀 共回答了23个问题
住天才呀 共回答了23个问题 |采纳率91.3%解题思路:(1)Ga原子是31号元素,根据核外电子排布规律书写原子的电子排布式;单晶硅是Si正四面体向空间延伸的立体网状结构,为原子晶体,GaN晶体结构与单晶硅相似,GaN属于原子晶体,与同一个Ga原子相连的N原子构成的空间构型为与但晶硅中Si的结构相似;
(2)微粒间形成配位键的条件是:一方是能够提供孤电子对的原子或离子,另一方是具有能够接受孤电子对的空轨道的原子或离子;
(3)①根据电负性的变化规律比较电负性大小;
②根据判断SO2分子含有的δ键以及孤电子对数判断空间构型,根据SnCl4含有的最外层电子数为50,以及含有5个原子判断等电子体;
③根据价层电子对数判断乙二胺分子中氮原子的杂化类型,根据是否含有氢键分析二者熔沸点高低不同的原因;
④根据成键原子的特点判断化学键类型;
⑤根据晶体结构特点分析Cl原子的配位数.(1)Ga原子是31号元素,Ga原子的电子排布式为1s22s22p63s23p63d104s24p1;GaN晶体结构与单晶硅相似,GaN属于原子晶体,与同一个Ga原子相连的N原子构成的空间构型为正四面体,
故答案为:1s22s22p63s23p63d104s24p1;正四面体;原子;
(2)微粒间形成配位键的条件是:一方是能够提供孤电子对的原子或离子,另一方是具有能够接受孤电子对的空轨道的原子或离子,
故答案为:能够接受孤电子对的空轨道;
(3)①在元素周期表中同一周期从左到右元素的电负性逐渐增强,同一主族从上到下元素的电负性逐渐减弱,可知电负性强弱顺序为O>N>H,
故答案是:O>N>H;
②SO2分子中含有2个δ键,孤电子对数=[6−2×2/2]=1,所以分子为V形,SnCl4含有的价层电子数为50,并含有5个原子,与之为电子体的离子有SO42-、SiO44-等,
故答案为:V形; SO42-、SiO44-等;
③乙二胺分子中氮原子形成4个δ键,价层电子对数为4,氮原子为sp3杂化,乙二胺分子间可以形成氢键,物质的熔沸点较高,而三甲胺分子间不能形成氢键,熔沸点较低,
故答案为:sp3杂化;乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键;
④)②中所形成的配离子中含有的化学键中N与Cu之间为配位键,C-C键为非极性键,C-N、N-H、C-H键为极性键,不含离子键,
故答案为:abd;
⑤从CuCl的晶胞可以判断,每个铜原子与4个Cl距离最近且相等,即Cu的配位数为4,根据化学式可知Cl的配位数也为4,
故答案为:4.点评:
本题考点: 原子核外电子排布;元素电离能、电负性的含义及应用;配合物的成键情况;晶胞的计算;原子轨道杂化方式及杂化类型判断.
考点点评: 本题考查较为综合,涉及电子排布式、分子的立体构型、杂化轨道类型、氢键、化学键类型以及晶体结构分析等知识,题目具有一定难度,本题注意晶胞配位数的判断方法,可根据CuCl的化学式进行比较.1年前查看全部
- 单晶硅是属于什么类型的晶体?例如离子晶体,分子晶体,原子晶体
 rr0861年前1
rr0861年前1 -
 lucas_yao 共回答了23个问题
lucas_yao 共回答了23个问题 |采纳率100%原子晶体 ,没错.高中阶段原子晶体很少,只有金刚石,Si,SiO2等1年前查看全部
- 单晶硅与二氧化硅反应的化学反应方程式
 lmxx2691年前1
lmxx2691年前1 -
 妖精368 共回答了23个问题
妖精368 共回答了23个问题 |采纳率87%si+si02=2si0
高温下,真空下,会反应.
这个可以有1年前查看全部
- 为什么太阳能电池的单晶硅的发电量为25%,而多晶硅的发电量为20.4%.是不是以平方为单位而产出的电量.
 52lena1年前1
52lena1年前1 -
 yinghanwen123 共回答了24个问题
yinghanwen123 共回答了24个问题 |采纳率100%与面积无关,不是以平方为单位产出的电量.是太阳光能转化成电能的比例,面积大小比例是不变的,也叫发电效率.单晶和多晶因为晶体结构不同,发电效率也不同.你说的是实验室的发电效率,实际应用中还达不到上述指标.1年前查看全部
- 工业制单晶硅反应的方程式
 springsummertea1年前1
springsummertea1年前1 -
 星晴dreamer 共回答了17个问题
星晴dreamer 共回答了17个问题 |采纳率100%一般来说,工业上制造单晶硅的反应方程式:
1、首先由石英砂和焦炭在电弧炉中制取纯度较低的粗硅
SiO2+2C=Si+2CO↑ ( 反应条件加热3273K)
2、然后将粗硅转化为有挥发性并易提纯的四氯化硅或三氯氢硅
Si+2Cl2=SiCl4 ( 反应条件加热723K~773K)
Si+3HCl=SiHCl3+H2↑ (反应条件加热523K~573K)
3、再用精馏法提纯SiCl4和SiHCl3,在电炉中用氢气还原,得到纯度较高的硅
SiCl4+2H2=Si+4HCl (反应条件加热)
4、最后用熔融法进一步提纯并制成高纯单晶硅
希望能帮上你.1年前查看全部
- 单晶硅能否作干燥剂和催化剂的载体
 咖啡_咖啡1年前1
咖啡_咖啡1年前1 -
 疯子_ 共回答了12个问题
疯子_ 共回答了12个问题 |采纳率83.3%硅能吸收各种气体,因此常用来作吸附剂、干燥剂和部分催化剂的载体.1年前查看全部
- 计算机工业所用的单晶硅要求达到99,99%以上的纯度在制造过程中利用四氯化硅和和氢气在高温下反应制取高纯硅,同时生成氯化
计算机工业所用的单晶硅要求达到99,99%以上的纯度在制造过程中利用四氯化硅和和氢气在高温下反应制取高纯硅,同时生成氯化氢 写出其化学方程式
 寒风扫落叶1年前1
寒风扫落叶1年前1 -
 jiangxu1986 共回答了15个问题
jiangxu1986 共回答了15个问题 |采纳率86.7%Si(粗硅)十2Cl2=加热=SiCl4
SiCl4十2H2=加热=Si(纯硅)十4HCl1年前查看全部
- 单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯
单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450 一500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。 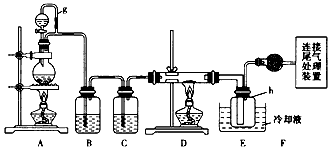
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
请回答下列问题:
(1)写出装置a中发生反应的离子方程式____。
(2)装置a中g管的作用是____;装置c中的试剂是____;装置e中的h瓶需要冷却的理由是______ 。
(3)装置e中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到***四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是_____(填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成fe 2+ , 再用kmno 4 标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5fe 2+ +mno 4 - +8h + = 5fe 3+ +mn 2+ +4h 2 o
①滴定前是否要滴加指示剂?_____________(填“是”或“否”),请说明理由____
②某同学称取5.000 g残留物,经预处理后在容量瓶中配制成100 ml溶液,移取25.00 ml试样溶液,用1.000×10 -2 moi/lkmno 4 标准溶液滴定。达到滴定终点时,消耗标准溶液20. 00 ml,则残留物中铁元素的质量分数是_______。 zyfsina1年前1
zyfsina1年前1 -
 糊糊抱个熊熊 共回答了20个问题
糊糊抱个熊熊 共回答了20个问题 |采纳率85%1年前查看全部
- 单晶硅起源或发现过程,分子结构,在在生产生活中有什么作用,以及未来的发展和用途
 ku8cn1年前1
ku8cn1年前1 -
 clppcb 共回答了22个问题
clppcb 共回答了22个问题 |采纳率95.5%单晶硅建设项目具有巨大的市场和广阔的发展空间.在地壳中含量达25.8%的硅元素,为单晶硅的生产提供了取之不尽的源泉. 近年来,各种晶体材料,特别是以单晶硅为代表的高科技附加值材料及其相关高技术产业的发展,成为当代信息技术产业的支柱,并使信息产业成为全球经济发展中增长最快的先导产业.单晶硅作为一种极具潜能,亟待开发利用的高科技资源,正引起越来越多的关注和重视. 与此同时,鉴于常规能源供给的有限性和环保压力的增加,世界上许多国家正掀起开发利用太阳能的热潮并成为各国制定可持续发展战略斩重要内容. 在跨入21世纪门槛后,世界大多数国家踊跃参与以至在全球范围掀起了太阳能开发利用的“绿色能源热”,一个广泛的大规模的利用太阳能的时代正在来临,太阳能级单晶硅产品也将因此炙手可热. 此外,包括我国在内的各国政府也出台了一系列“阳光产业”的优惠政策,给予相关行业重点扶持,单晶硅产业呈现出美好的发展前景. 单晶硅性质;单晶硅具有金刚石晶格.晶体硬而脆具有金属光泽.能导电.但导电率不及金属.局随温度升高而增加.具有半导体性质.单晶硅石重要的半导体材料,在单晶硅中掺入微量的IIIA族元素.形成p型半导体.掺入微量的第vA族元素.形成N型和P型导体结合在一起.就可以做成太阳能电池.将辐射能转变为电能.在开发电能方面是一种很有前途的材料.
熔融的单质硅在凝固时硅原子以金刚石晶格排列成许多晶核,如果这些晶核长成晶面取向相同的晶粒,则这些晶粒平行结合起来便结晶成单晶硅.单晶硅具有准金属的物理性质,有较弱的导电性,其电导率随温度的升高而增加,有显著的半导电性.超纯的单晶硅是本征半导体.在超纯单晶硅中掺入微量的ⅢA族元素,如硼可提高其导电的程度,而形成p型硅半导体;如掺入微量的ⅤA族元素,如磷或砷也可提高导电程度,形成n型硅半导体.单晶硅的制法通常是先制得多晶硅或无定形硅,然后用直拉法或悬浮区熔法从熔体中生长出棒状单晶硅.
发展趋势:
日本、美国和德国是主要的硅材料生产国.中国硅材料工业与日本同时起步,但总体而言,生产技术水平仍然相对较低,而且大部分为2.5、3、4、5英寸硅锭和小直径硅片.中国消耗的大部分集成电路及其硅片仍然依赖进口.但我国科技人员正迎头赶上,于1998年成功地制造出了12英寸单晶硅,标志着我国单晶硅生产进入了新的发展时期.目前,全世界单晶硅的产能为1万吨/年,年消耗量约为6000吨~7000吨.未来几年中,世界单晶硅材料发展将呈现以下发展趋势:
1、微型化
随着半导体材料技术的发展,对硅片的规格和质量也提出更高的要求,适合微细加工的大直径硅片在市场中的需求比例将日益加大.目前,硅片主流产品是200mm,逐渐向300mm过渡,研制水平达到400mm~450mm.据统计,200mm硅片的全球用量占60%左右,150mm占20%左右,其余占20%左右.Gartner发布的对硅片需求的5年预测表明,全球300mm硅片将从2000年的1.3%增加到2006年的21.1%.日、美、韩等国家都已经在1999年开始逐步扩大300mm硅片产量.据不完全统计,全球目前已建、在建和计划建的300mm硅器件生产线约有40余条,主要分布在美国和我国台湾等,仅我国台湾就有20多条生产线,其次是日、韩、新及欧洲.%P 世界半导体设备及材料协会(SEMI)的调查显示,2004年和2005年,在所有的硅片生产设备中,投资在300mm生产线上的比例将分别为55%和62%,投资额也分别达到130.3亿美元和184.1亿美元,发展十分迅猛.而在1996年时,这一比重还仅仅是零.
2、国际化,集团化,集中化
研发及建厂成本的日渐增高,加上现有行销与品牌的优势,使得硅材料产业形成“大者恒大”的局面,少数集约化的大型集团公司垄断材料市场.上世纪90年代末,日本、德国和韩国(主要是日、德两国)资本控制的8大硅片公司的销量占世界硅片销量的90%以上.根据SEMI提供的2002年世界硅材料生产商的市场份额显示,Shinetsu、SUMCO、Wacker、MEMC、Komatsu等5家公司占市场总额的比重达到89%,垄断地位已经形成.
3、硅基材料
随着光电子和通信产业的发展,硅基材料成为硅材料工业发展的重要方向.硅基材料是在常规硅材料上制作的,是常规硅材料的发展和延续,其器件工艺与硅工艺相容.主要的硅基材料包括SOI(绝缘体上硅)、GeSi和应力硅.目前SOI技术已开始在世界上被广泛使用,SOI材料约占整个半导体材料市场的30%左右,预计到2010年将占到50%左右的市场.Soitec公司(世界最大的SOI生产商)的2000年~2010年SOI市场预测以及2005年各尺寸SOI硅片比重预测了产业的发展前景.
4、硅片制造技术进一步升级
半导体,芯片,集成电路,设计,版图,芯片,制造,工艺目前世界普遍采用先进的切、磨、抛和洁净封装工艺,使制片技术取得明显进展.在日本,Φ200mm硅片已有50%采用线切割机进行切片,不但能提高硅片质量,而且可使切割损失减少10%.日本大型半导体厂家已经向300mm硅片转型,并向0.13μm以下的微细化发展.另外,最新尖端技术的导入,SOI等高功能晶片的试制开发也进入批量生产阶段.对此,硅片生产厂家也增加了对300mm硅片的设备投资,针对设计规则的进一步微细化,还开发了高平坦度硅片和无缺陷硅片等,并对设备进行了改进. 硅是地壳中赋存最高的固态元素,其含量为地壳的四分之一,但在自然界不存在单体硅,多呈氧化物或硅酸盐状态.硅的原子价主要为4价,其次为2价;在常温下它的化学性质稳定,不溶于单一的强酸,易溶于碱;在高温下化学性质活泼,能与许多元素化合. 硅材料资源丰富,又是无毒的单质半导体材料,较易制作大直径无位错低微缺陷单晶.晶体力学性能优越,易于实现产业化,仍将成为半导体的主体材料. 多晶硅材料是以工业硅为原料经一系列的物理化学反应提纯后达到一定纯度的电子材料,是硅产品产业链中的一个极为重要的中间产品,是制造硅抛光片、太阳能电池及高纯硅制品的主要原料,是信息产业和新能源产业最基础的原材料.
硅材料市场前景广阔,中国硅单晶的产量、销售收入近几年递增较快,以中小尺寸为主的硅片生产已成为国际公认的事实,为世界和中国集成电路、半导体分立器件和光伏太阳能电池产业的发展做出了较大的贡献.[1年前查看全部
- 太阳能路灯照亮的时间太短现在遇到一个问题:前段时间装了盏太阳能路灯,配置:180W单晶硅组件2块串联(串联电压35V左右
太阳能路灯照亮的时间太短
现在遇到一个问题:
前段时间装了盏太阳能路灯,配置:180W单晶硅组件2块串联(串联电压35V左右),12V/75AH铅酸电池两只(串联电压24V),10A控制器24v,负载是42W的LED路灯.
现在测电池电压一只12.2V,另一只只有10.7V,电池电压怎么相差这么大,是不是蓄电池有问题.还是充电没有充满的问题?
刚装好一个月不到,现在不亮咯?求大家分析下原因.
有个问题更正下:是80W单晶硅组件两块串联(串联电压35V~38V),经过昨天亲自到现场看后发现蓄电池是没有问题.
现场的问题是:在控制器上测得光伏输入端的电压是25V,然后断开光伏端的电压是40V,这两个数据相差也太大了.现在我怀疑是太阳能电池功率不够,两组串联的电压是38~40v(正常值),连接上控制器后怎么就变成25V了.
还有一个数据就是:充电电流在2.3A左右,这电流也太小了.这更加让我怀疑是太阳能电池功率的问题.
有些叙述不清,还求师兄们指点. 荒漠劲草1年前1
荒漠劲草1年前1 -
 figohill 共回答了11个问题
figohill 共回答了11个问题 |采纳率90.9%都把问题复杂化了,
1,80的板子够了.80W的组件就算功率不足,也不能低于70W吧?否则那也太坏良心了,
2、控制器是主要问题,换个控制器吧,
我也要说说1263:像这样的配置完全没有问题,除非你是图价格,什么都要便宜的,如果是这样出问题也是正常.
太阳能组件生产:譬如:60W的组件生产出来,功率都是参差不齐的,最高的上下能差到5W左右(当然是个别的).至于更深的就别说了,总而言之就是:价格合理才行.1年前查看全部
- 化学与生产、生活密切相关,下列叙述错误的是 A.从海带中提取碘单质的过程涉及氧化还原反应 B.单晶硅常用于制造光导纤维
化学与生产、生活密切相关,下列叙述错误的是
A.从海带中提取碘单质的过程涉及氧化还原反应 B.单晶硅常用于制造光导纤维 C.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 D.制作“毒豆芽”所用的亚硝酸钠,猪肉变“牛肉”掺入的硼砂(Na 2 B 4 O 7 ·10H 2 O)都属于钠盐  xxx-xx1年前1
xxx-xx1年前1 -
 ywxyh 共回答了24个问题
ywxyh 共回答了24个问题 |采纳率79.2%B
1年前查看全部
- 粗硅制单晶硅是否涉及氧化还原反应
 suiysh1年前1
suiysh1年前1 -
 尼莫茨菇 共回答了15个问题
尼莫茨菇 共回答了15个问题 |采纳率86.7%Si+2Cl2=SiCl4
SiCl4+2H2=Si+4HCl
都是氧化还原反应1年前查看全部
大家在问
- 1空间四边形ABCD的每条边和对角线长的是a,点E,F分别是BC,AD的中点,则AE向量乘以AF向量的值为多少
- 2cad中怎样在一个圆内画一条长度一定的直线与圆上的弧相交切不超出圆弧
- 3用英语写五条短语保持身体健康的方法,并以上五条短语及自己的做法写一篇80词左右的英语作文.
- 4准备上高中提前预习,1、已知2FeCl2+Cl2=2FeCl3,2NaBr+Cl2=2NaCl+Br2,6FeCl2+3
- 50.8平方米等于( )平方分米2.85元等于( )分( )千克等于0.07吨0.5米等于( )分米600平方厘米等于平方
- 6在做“平面镜成像特点”的实验时,将一块透明玻璃板放在水平桌面上,再取两段相同的蜡烛A和B,一前一后竖直放置在桌面上,点燃
- 7这就一年四季不感到寂寞.你怎样理解这里的寂寞
- 8关于反函数的问题~y=-x的图像与他的反函数图像重合,能不能在写出一个非一次函数,也使其反函数与原函数的图像重合.- -
- 9天然气是纯净物还是混合物...我有急用...谢咯..
- 10初一英语作文30—40个词,
- 11一辆汽车停在水平地面上,一个人用力水平推车,但车仍然静止,表明( )
- 12(2014•通辽)如图是三种微粒的结构示意图,有关它们的说法正确的是( )
- 13句型转换句型转换1.This is her ruler.(改为否定句和一般疑问句)______ ______ _____
- 14英语看图说话,请帮我分析点可以用的句子出来,比如“The boy has a
- 15按要求填写下列实验报告: 实验内容 主要实验操作 主要结论 ① 除去FeSO4溶液中的少量Fe2(SO4)3, ____